引用本文: 段娟, 李可, 何睿, 胡雯. 負載姜黃素-維生素 E 復合物的溫敏水凝膠對放射性口腔黏膜炎小鼠的治療效果分析. 華西醫學, 2025, 40(1): 60-67. doi: 10.7507/1002-0179.202409089 復制
版權信息: ?四川大學華西醫院華西期刊社《華西醫學》版權所有,未經授權不得轉載、改編
放射性口腔黏膜炎(radiation-induced oral mucositis, RIOM)是指電離輻射引起的口腔黏膜損傷,臨床上多見于頭頸部惡性腫瘤患者放化療過程中[1],可致患者口腔疼痛、吞咽困難、營養供給不足等問題[2]。RIOM 的發生致使頭頸癌患者放化療延遲、停止或劑量下調,嚴重影響患者癌癥治療效果、預后及生存質量[3]。盡管目前臨床上已有多種治療 RIOM 的方法,如抗炎藥物、天然藥物、生長因子、抗菌劑和麻醉鎮痛劑等,但療效均有限,且可能伴隨副作用[4-5],因此,深入研究并開發出有效安全的 RIOM 預防和治療新策略,對改善患者臨床癥狀、提高預后及生存質量以及優化癌癥綜合治療效果具有重要意義。姜黃素是從姜黃、莪術、郁金等天然植物中提取的多酚類化合物[6],具有良好的抑菌[7]、抗氧化[8]、抗炎效果[9-10],目前許多研究發現姜黃素及其衍生物對 RIOM 的發病進程有較好的抑制作用,可作為治療 RIOM 的有效手段[11-14]。然而,單獨的姜黃素因水溶性低、穩定性差、生物利用率低等特性,在臨床中實際應用的可能性受到極大限制[15]。Huang 等[16]發現,姜黃素可與維生素 E(vitamin E, VE)發生酯化反應形成具有自組裝性能的姜黃素-VE 衍生物,極大地改善了姜黃素的水溶性和穩定性。此外,VE 作為一種天然抗氧化劑,可保護細胞免受氧化損傷[17],也可增加膠原蛋白、纖維蛋白等合成,保護細胞膜結構,促進細胞再生與黏膜上皮化,有利于口腔黏膜損傷后的修復[18]。但目前對姜黃素-VE 復合物防治 RIOM 的效果尚未有驗證。因此,本研究以泊洛沙姆溫敏水凝膠為載體[19],負載姜黃素-VE 復合物,制作成載有姜黃素-VE 復合物的溫敏水凝膠(以下簡稱“姜黃素-VE 凝膠”),實現姜黃素-VE 復合物的口腔黏膜給藥,并從姜黃素-VE 凝膠對小鼠舌組織炎癥水平、氧化應激水平及 DNA 損傷修復幾個方向觀察其對 RIOM 的治療效果,為 RIOM 的臨床治療提供新的可能。
1 材料與方法
1.1 試劑與儀器
1.1.1 藥物與試劑
姜黃素(北京索萊寶科技有限公司);D-α-生育酚琥珀酸酯、泊洛沙姆 F127、泊洛沙姆 F68(上海源葉生物科技有限公司);二環己基二亞胺、4-二甲氨基吡啶(上海阿拉丁生化科技股份有限公司);殼聚糖(上海麥克林生化科技股份有限公司);4% 多聚甲醛固定液(合肥白鯊生物科技公司);超氧化物歧化酶(superoxide dismutase, SOD)、過氧化氫酶(catalase, CAT)、谷胱甘肽過氧化物酶(glutathione peroxidase, GSH-Px)、丙二醛檢測試劑盒(南京建成生物公司);BCA 蛋白濃度測定試劑盒(上海碧云天生物技術有限公司);腫瘤壞死因子 α(tumor necrosis factor α, TNF-α)、白細胞介素(interleukin, IL)-1β 及 IL-6 酶聯免疫吸附法(enzyme linked immunosorbent assay, ELISA)測定試劑盒(武漢伊萊瑞特生物科技股份有限公司);磷酸化組蛋白 H2AX(phosphorylated histone H2AX, γ-H2AX)單克隆抗體(成都正能生物公司)、核轉錄因子紅系 2 相關因子 2(nuclear factor-erythroid 2-related factor 2, Nrf2)單克隆抗體(武漢三鷹生物技術有限公司);辣根過氧化物酶標記山羊抗兔免疫球蛋白 G、乙二胺四乙酸抗原修復液、檸檬酸鹽緩沖液、蘇木素(武漢塞維爾生物科技有限公司);伊紅(合肥博美生物公司);二氨基聯苯胺顯色試劑盒(北京中杉金橋生物有限公司)。
1.1.2 儀器
旋轉蒸發儀(上海亞榮生化儀器公司);恒溫磁力攪拌器(上海滬西分析儀器有限公司);Nicolet Nexus670 紅外光譜儀(美國 Thermo Nicolet 儀器公司);NETZSCH 旋轉流變儀 Kinexus Lab+(德國耐馳儀器公司);Prisma E 掃描電鏡、Scientific Sorvall ST16R 臺式離心機、Multiskan FC1510 酶標儀(美國 Thermo Fisher 儀器公司);FreeZone 真空冷凍干燥機(美國 Labconco 公司);X-RAY 小動物精準輻照儀(美國 Radsource 科技公司);RM2016 轉輪式切片機(德國 Leica 公司);自動脫水機(武漢俊杰電子科技公司);組織包埋機、病理組織漂烘儀(常州中威電子儀器廠);DP27 熒光倒置顯微鏡(日本 Olympus 株式會社);zwickLine Z2.5 TN﹢ 電子萬能試驗機(德國 ZWICK/Roell 公司)。
1.2 姜黃素-VE 凝膠的合成與性能測定
1.2.1 姜黃素-VE 復合物的合成及表征
姜黃素-VE 復合物的合成參照 Huang 等[16]和 Zhang 等[20]的方法:稱取 D-α-生育酚琥珀酸酯
1.2.2 姜黃素-VE 凝膠的合成及表征
吸取 100 μL Tween80 超聲分散于 5 mL 去離子水中,稱取 20 mg 姜黃素-VE 復合物溶于 1 mL 二甲基亞砜,吸取 250 μL 緩慢滴加于上述去離子水,制備姜黃素-VE 復合物制劑。滴加 28.6 μL 冰醋酸于姜黃素-VE 復合制劑中,定容至 5 mL,使得冰醋酸濃度為 0.1 mol/L。稱取一定質量的殼聚糖溶解于上述制劑,室溫下磁力攪拌 1 h,可得到質量分數為 0.5% 的殼聚糖溶液。分別稱取質量比為 20∶5 的泊洛沙姆 F127 和 F68 溶于殼聚糖溶液,4℃下放置 24 h 充分溶脹,得到澄清黏稠的姜黃素-VE 凝膠。通過流變儀進行流變學分析以評估凝膠的凝膠化溫度。將制備好的姜黃素-VE 凝膠置于液氮中速凍后真空冷凍干燥得到凍干樣品,噴金后掃描電鏡觀察其內部結構及微觀形態。
1.2.3 姜黃素-VE 凝膠性能測定
① 溶脹性:準確稱取 100 mg(W0)冷凍干燥后的空白凝膠、姜黃素-VE 凝膠,置于 20 mL 磷酸鹽緩沖液(phosphate buffered saline, PBS)(pH=7.4)中,于 37℃下浸泡,不同時間點下用濾紙吸干凝膠表面水分并稱重(WS),直到凝膠樣品達到溶脹平衡,質量不再變化。溶脹率計算公式:溶脹率=(WS–W0)/W0。
② 降解性:準確稱取 100 mg(W0)冷凍干燥后的空白凝膠、姜黃素-VE 凝膠,置于 20 mL PBS(pH=7.4)中,放入恒溫搖床(37℃,100 r/min)中孵育,每 12 小時取出水凝膠,真空冷凍干燥后稱重,記錄重量(WS)。降解率計算公式:降解率=(W0–WS)/W0。
③ 黏附性:模擬口腔濕潤環境,采用搭接剪切實驗測定空白凝膠及姜黃素-VE 凝膠的黏附性。新鮮豬皮嚴格去除表面毛發及油脂,并切割為 60 mm×15 mm 大小,浸泡于人工唾液 1 h 備用。分別將 100 μL 空白凝膠、姜黃素-VE 凝膠均勻涂抹于兩塊豬皮表面,涂抹區域面積為 15 mm×15 mm,37℃下穩定 1 h 后,通過萬能試驗機測定黏附性能。拉伸速度 5 mm/min,黏附強度由最大拉伸力(單位 N)除以兩塊豬皮搭接區域面積(單位 m2)表示。
1.3 動物實驗
1.3.1 實驗動物及分組
30 只體重在 21~23 g 的 8 周齡無特定病原體級雄性 BALB/C 小鼠,購于四川維通利華實驗動物技術有限公司,許可證號:SCXK(川)2023-0040。采用隨機數字表將小鼠分為空白組、模型組(輻射組)、輻射+凝膠組,每組各 10 只。小鼠全程飼養于四川大學華西基礎與法醫學院動物實驗中心,環境溫度 20~26℃,相對濕度 40%~70%,適應性喂養 7 d,期間小鼠自由飲水、進食。動物實驗經四川大學華西醫院實驗動物倫理委員會批準,倫理備案號:20240618001。
1.3.2 RIOM 動物模型建立
RIOM 模型建立采用單次大劑量輻射。小鼠稱重后,腹腔注射 0.3% 戊巴比妥鈉(3.5 mL/kg)麻醉小鼠,仰臥位固定于鉛盒中,露出頭頸部,其余部分采用厚度為 5 mm 的鉛板覆蓋以隔絕電離輻射,置于 X-RAY 小動物精準輻照儀內進行頭頸部局部放療,放射條件:電壓 160 kV,電流 20 mA,總放射劑量 25 Gy,劑量率 1.903 Gy/min;空白組只麻醉不進行輻射。
1.3.3 給藥方法
輻射當天記為第 0 天,于輻射后第 1 天進行治療干預,連續 7 d。空白組、輻射組給予常規飼料及飲水,此外不作任何處理;輻射+凝膠組除常規飼料及飲水外,每日上午 10:00、下午 18:00 各給予凝膠干預 1 次。凝膠干預方式為:定量吸取 100 μL 姜黃素-VE 凝膠,采用無菌棉簽充分涂抹于小鼠口腔,禁食禁水 1 h 后自由飲水、進食。第 8 天腹腔注射麻醉頸椎脫臼處死小鼠,收集指標。
1.3.4 檢測指標
① 小鼠一般狀態及體重:輻射當天及輻射后每日同一時間觀察小鼠一般情況,記錄小鼠體重。
② 小鼠潰瘍面積的測量:小鼠頸椎脫臼處死后立即取小鼠舌組織,用棉簽蘸取 1% 乙酸溶液清洗舌組織表面,均勻涂抹 1% 甲苯胺藍染液后靜置 5 min,1% 乙酸溶液充分清洗多余染液,拍照后 Image-J 分析潰瘍面積、黏膜炎面積與舌組織全面積比例。
③ 組織病理觀察:甲苯胺藍染色后的舌組織 PBS 清洗 2 次后置于 4% 多聚甲醛中固定 24~48 h,沿矢狀面將舌組織一分為二,經脫水、石蠟包埋、切片、蘇木精-伊紅染色后脫水封片,顯微鏡下觀察并拍照。
④ 小鼠舌組織炎癥因子水平的測定:采用 ELISA 測定小鼠舌組織 TNF-α、IL-1β、IL-6 的水平。剪碎的組織與預冷的 PBS 按 1∶9 的重量體積比混合,在組織勻漿機中充分勻漿,4℃,500×g 離心 10 min,得到 10% 勻漿上清液,取上清液按照 ELISA 檢測步驟測定各炎癥因子的水平。
⑤ 小鼠舌組織抗氧化水平的測定:測定小鼠舌組織中 SOD、CAT、GSH-Px 的活性及丙二醛的含量。剪碎的組織按重量體積比 1∶9 的比例加入生理鹽水,在組織勻漿機中充分勻漿,400×g,離心 10 min,取上清液,嚴格遵循說明書中的操作步驟進行測定。
⑥ 小鼠舌組織 γ-H2AX、Nrf2 分布表達:小鼠舌組織固定、取材、脫水、包埋、切片、脫蠟、抗原修復后進行內源性過氧化物酶阻斷,滴加牛血清白蛋白室溫封閉 20 min,對應一抗稀釋后(Nrf2 1∶200;γ-H2AX 1∶200)孵育,4℃過夜。取出過夜孵育組織復溫后 PBS 洗滌,滴加二抗 37℃孵育 30 min,PBS 洗滌后二氨基聯苯胺顯色,使用蘇木素復染細胞核,脫水封片后顯微鏡下觀察,每個切片隨機選取 3 個視野拍照,Image-J 分析陽性細胞數。
1.4 統計學方法
采用 SPSS Statistics 26.0 軟件進行統計學分析。計量資料符合正態分布,采用均數±標準差表示。方差齊的計量資料組間進行 t 檢驗或單因素方差分析,使用 LSD 法進行多重比較;不符合方差齊性的計量資料采用 Welch 檢驗,使用 Games-Howell 法進行多重比較。重復測量的資料采用重復測量方差分析。雙側檢驗水準 α=0.05。
2 結果
2.1 姜黃素-VE 凝膠的合成及性能測定結果
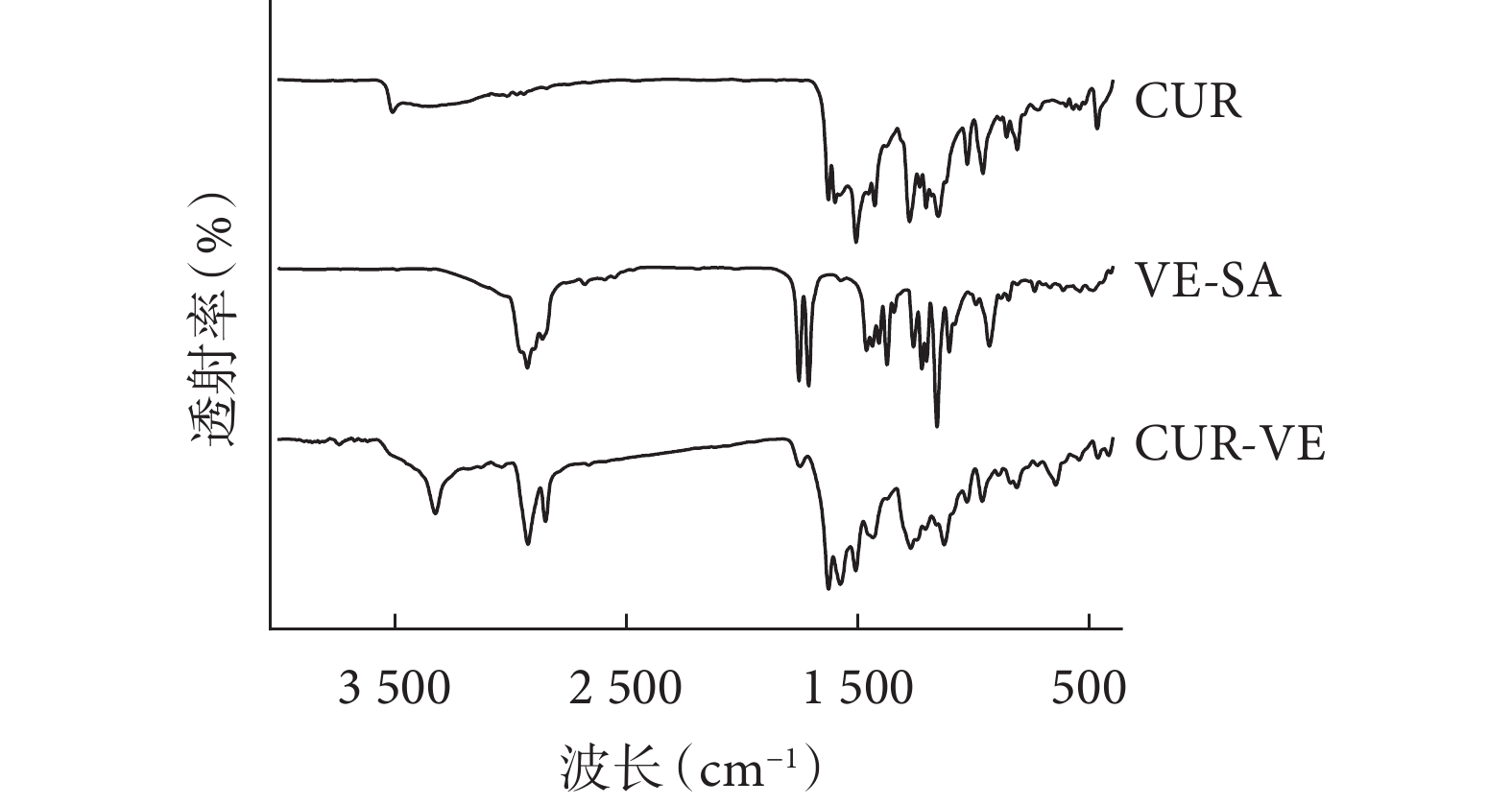
2.1.1 姜黃素-VE 復合物傅里葉紅外光譜分析
如圖1 所示,姜黃素的主要特征峰出現在
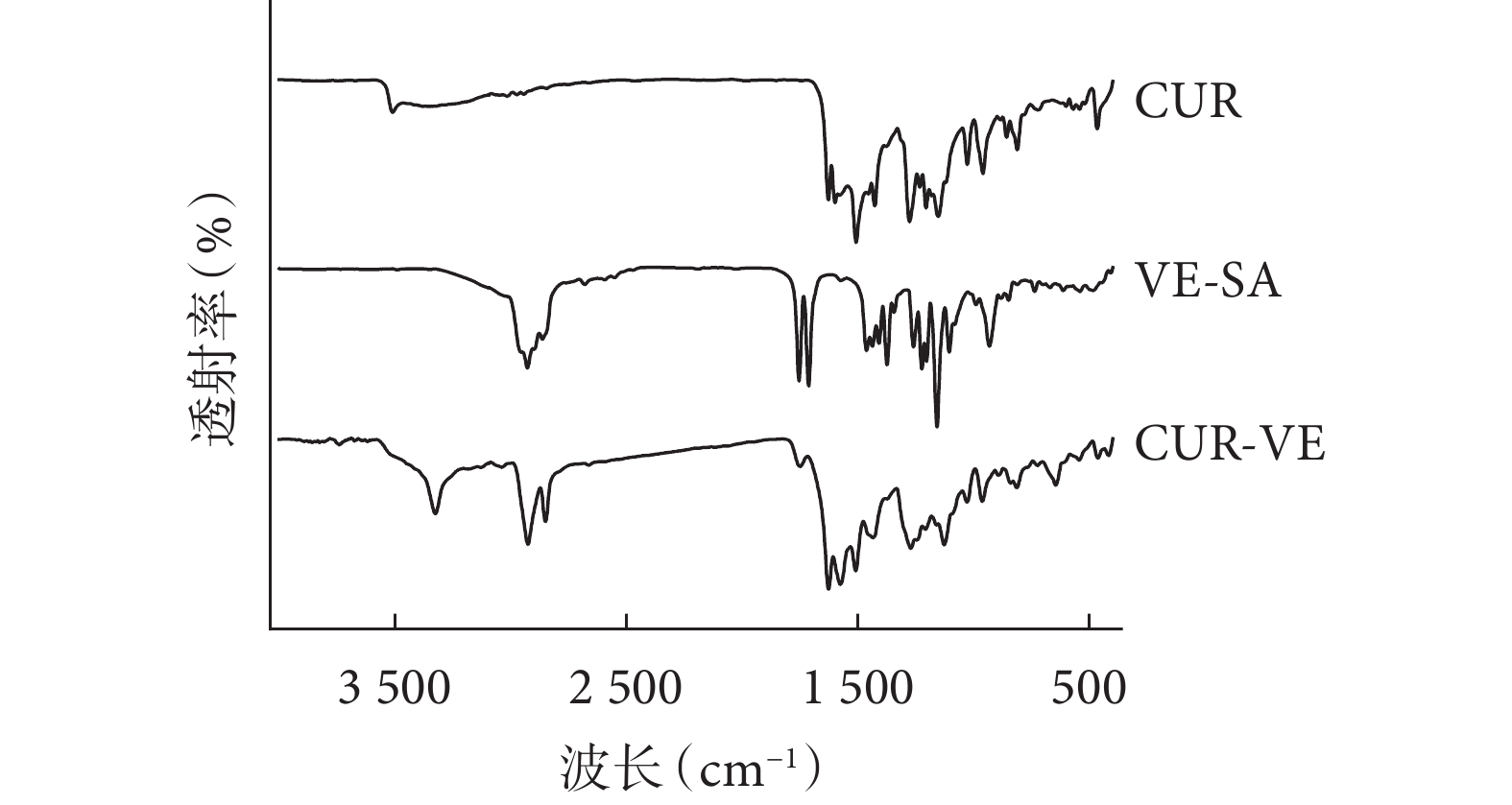 圖1
姜黃素-VE 復合物傅里葉紅外光譜結果圖
圖1
姜黃素-VE 復合物傅里葉紅外光譜結果圖
VE:維生素 E;CUR:姜黃素;VE-SA:D-α-生育酚琥珀酸酯
2.1.2 姜黃素-VE 凝膠的表征
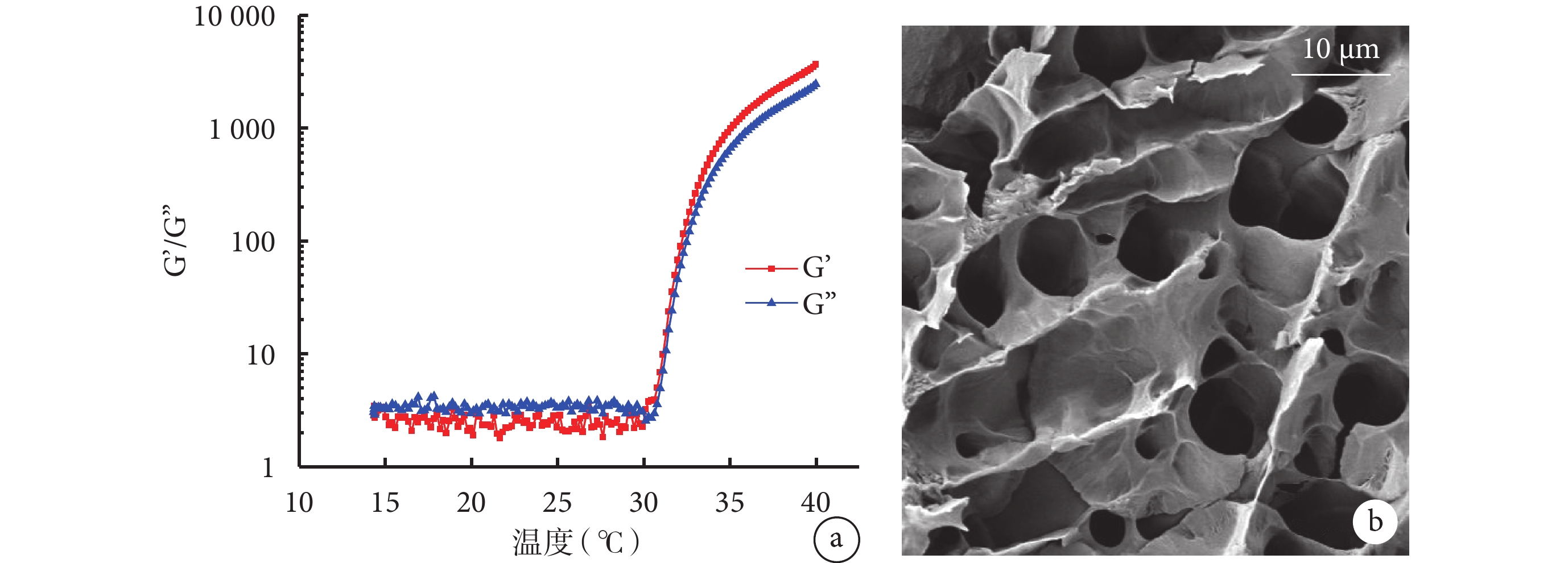
如圖2a 所示,當溫度低于 30℃時,姜黃素-VE 凝膠的 G’(儲存模量)低于 G’’(損失模量),而隨著溫度的升高,在一定的頻率和應變值下,G’與 G’’均隨著溫度升高而升高,但當溫度到達 30℃后,G’開始高于 G’’,此時凝膠發生溶膠-凝膠反應,由液態的溶膠變為固態的凝膠,表明姜黃素-VE 凝膠具有溫敏性,當溫度升高到 30℃時可成凝膠,即在口腔溫度條件下,姜黃素-VE 凝膠可以固態凝膠的狀態黏附在口腔黏膜上。
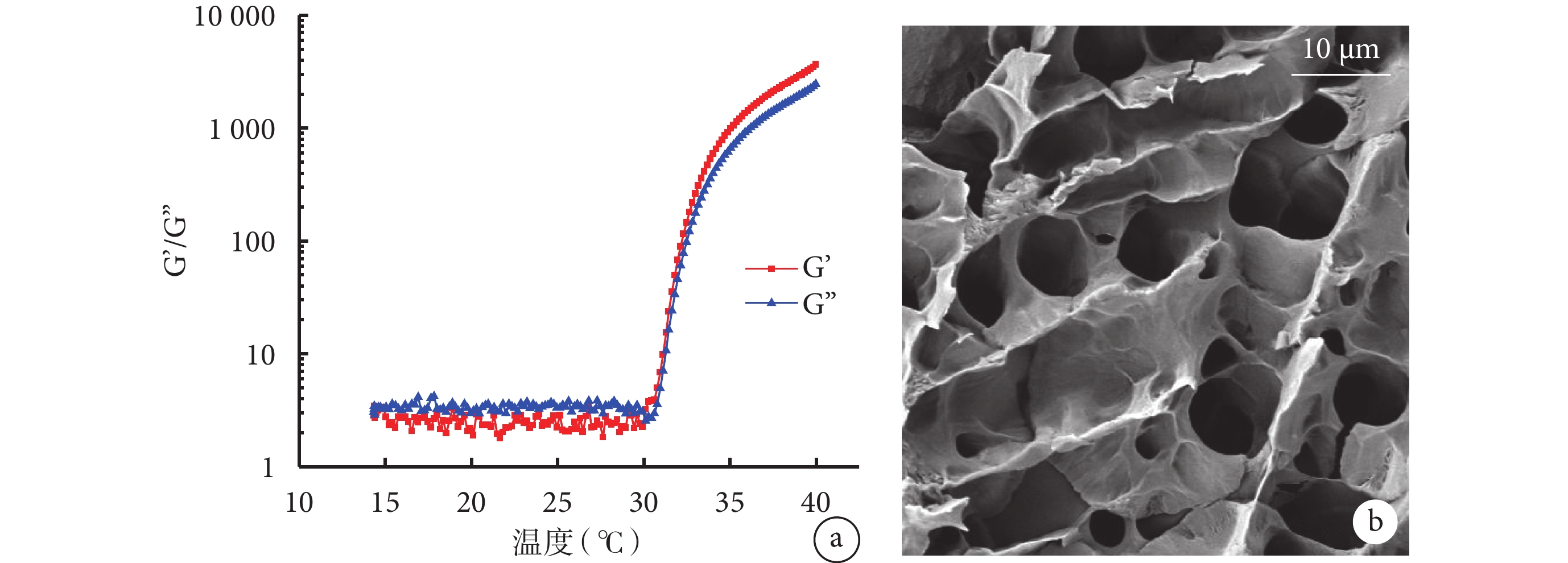 圖2
姜黃素-VE 凝膠溫度-G’/G’’變化曲線及凍干姜黃素-VE 凝膠掃描電鏡圖
圖2
姜黃素-VE 凝膠溫度-G’/G’’變化曲線及凍干姜黃素-VE 凝膠掃描電鏡圖
a. 溫度-G’/G’’變化曲線;b. 凍干姜黃素-VE 凝膠掃描電鏡圖。VE:維生素 E;G’:儲存模量;G’’:損失模量
掃描電鏡下姜黃素-VE 凝膠結構如圖2b 所示,觀察可見姜黃素-VE 凝膠凍干后內部微觀結構呈現出多孔網狀結構,孔徑分布主要在 5~20 μm,該結構有利于小分子藥物、水及營養物質等進出,具有藥物緩釋作用,有利于傷口愈合。
2.1.3 凝膠性能
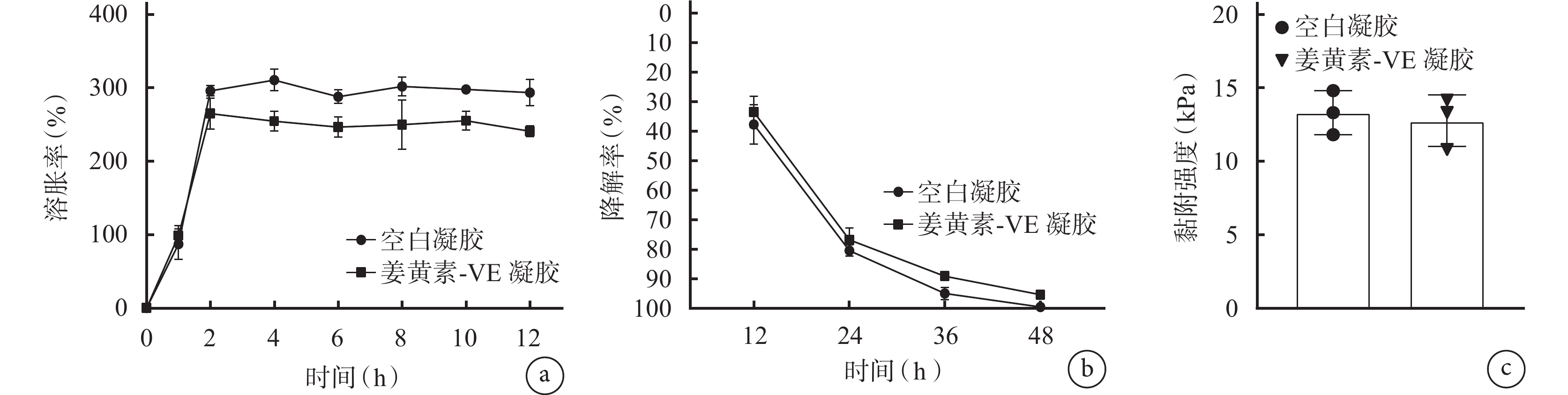
① 溶脹性:如圖3a 所示,空白凝膠在 4 h 內快速吸水,溶脹率超過 300%,而后達到溶脹平衡,表明空白凝膠有較好的溶脹性能,可以適當吸收并儲存水分,而負載姜黃素-VE 復合物對凝膠溶脹性能無顯著影響(P>0.05)。
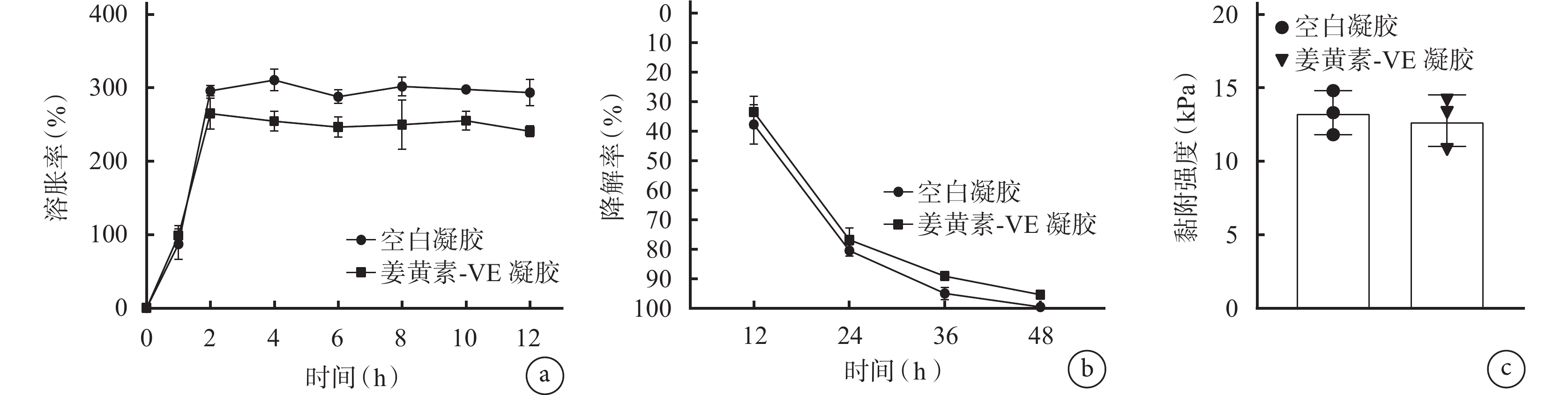 圖3
凝膠性能測定結果
圖3
凝膠性能測定結果
a. 凝膠溶脹率(
② 降解性:如圖3b 所示,24 h 內空白凝膠、姜黃素-VE 凝膠降解率分別為 80.506%、76.912%,而 48 h 后兩種凝膠降解率均超過 95%,表明姜黃素-VE 復合物的加入對凝膠降解速率無顯著影響(P>0.05)。
③ 黏附性:如圖3c 所示,在模擬口腔濕潤環境下,空白凝膠黏附強度為 13.300 kPa,姜黃素-VE 凝膠為 12.748 kPa,差異無統計學意義(P>0.05),且兩種凝膠的黏附強度均高于常見敷料(0~5 kPa),表明凝膠可穩定黏附在口腔環境內,延長藥物與創口作用時間。
2.2 動物實驗結果
2.2.1 小鼠體重變化
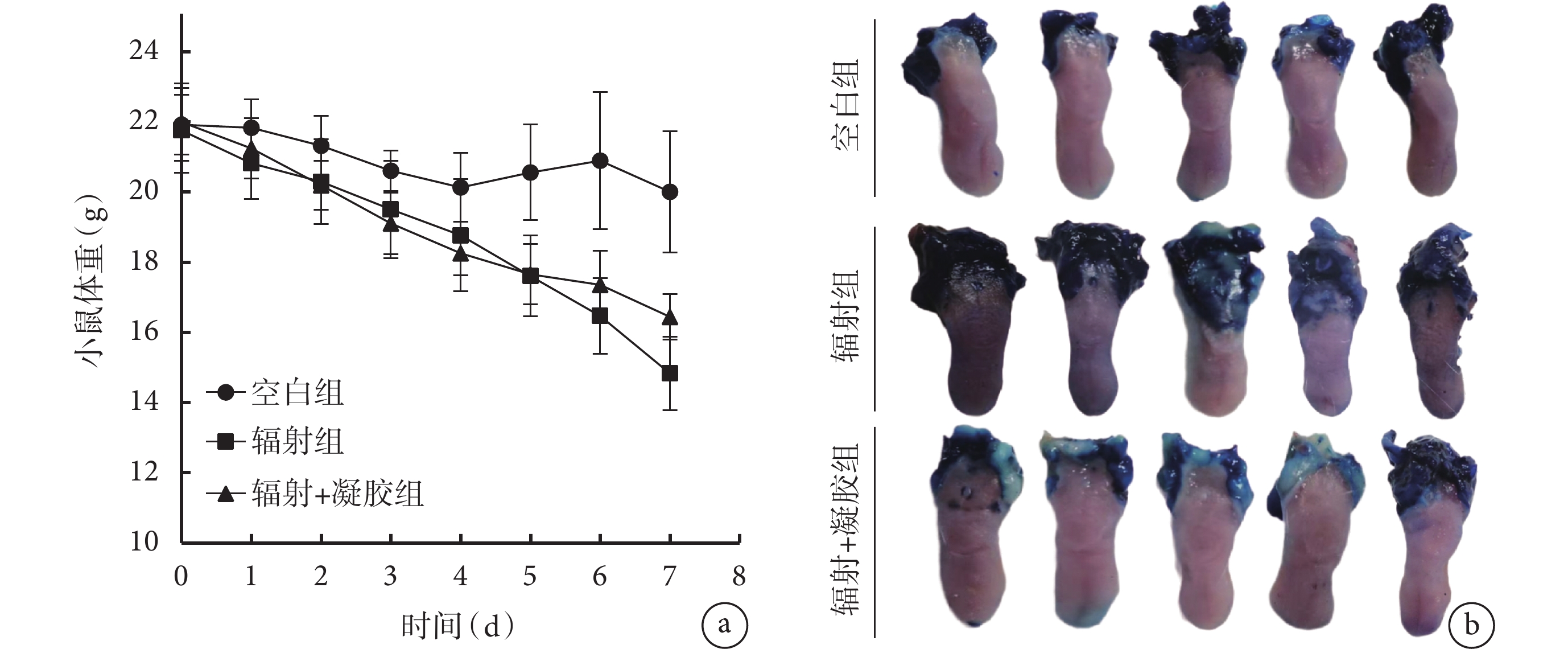
如圖4a 所示,輻射前各組小鼠體重差異無統計學意義(P>0.05)。空白組輻射前與輻射后第 7 天小鼠體重差異無統計學意義(P>0.05);輻射組、輻射+凝膠組小鼠輻射后第 7 天較輻射前體重顯著下降(P<0.05),但輻射+凝膠組小鼠體重從第 5 天開始高于輻射組,在第 7 天時兩組小鼠體重差異具有統計學意義(P<0.05)。
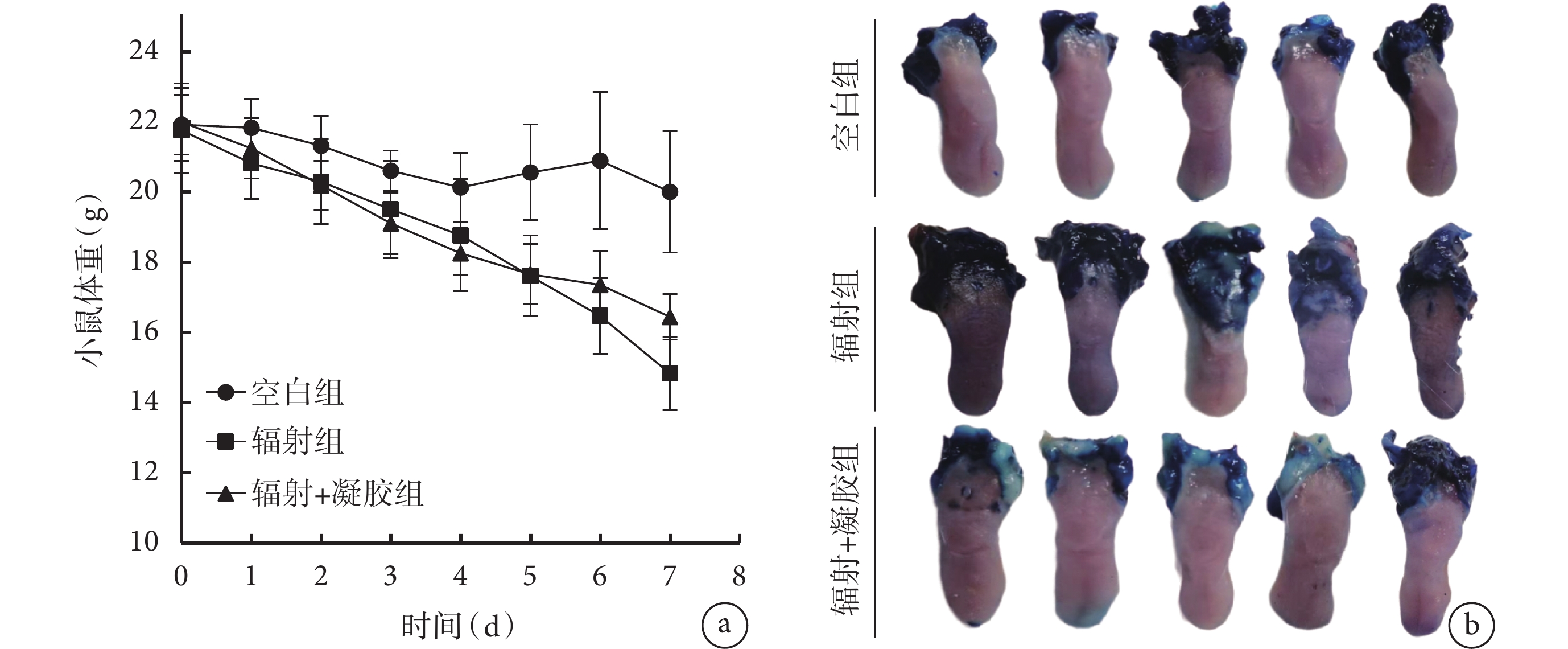 圖4
小鼠體重變化和舌組織甲苯胺藍染色彩色像
圖4
小鼠體重變化和舌組織甲苯胺藍染色彩色像
a. 各組小鼠體重變化; b. 小鼠舌組織甲苯胺藍染色彩色像
2.2.2 小鼠潰瘍面積比較
如圖4b、表1 所示,正常小鼠舌組織呈粉紅色,質地柔軟濕潤,僅見 1 處甲苯胺藍點狀陽性著色;輻射組小鼠舌組織出現黏膜炎甚至潰瘍,甲苯胺藍染色后舌體顏色變深,潰瘍區域出現明顯藍色陽性著色,潰瘍主要出現在舌根處;輻射+凝膠組較輻射組潰瘍面積顯著減少,可見散在點狀陽性著色。輻射組潰瘍面積占比(潰瘍面積/舌組織全面積)27.21%,黏膜炎面積占比(黏膜炎面積/舌組織全面積)59.77%,姜黃素-VE 凝膠干預后潰瘍面積、黏膜炎面積占比下降至 1.74%、19.10%,差異有統計學意義(P<0.05)。
2.2.3 組織病理觀察
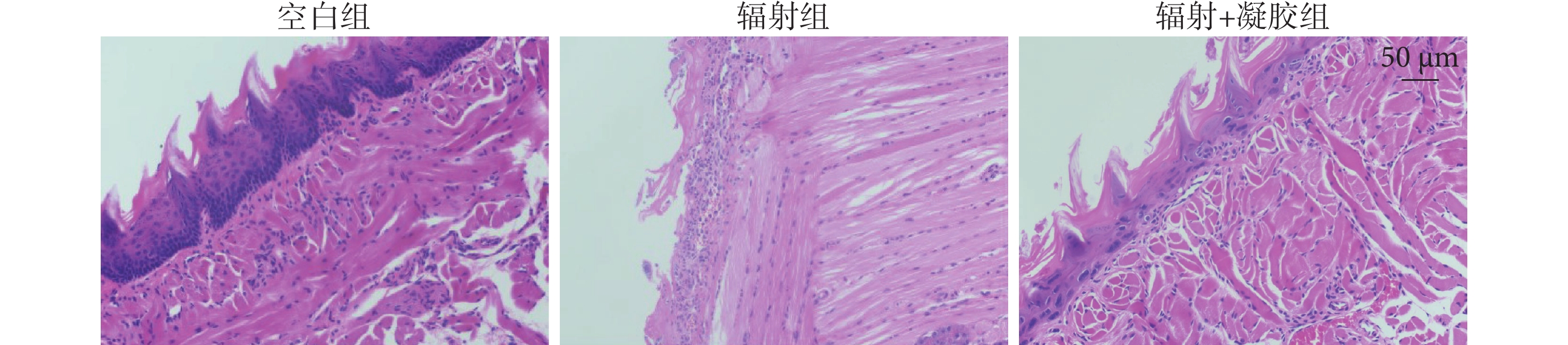
如圖5 所示,空白組小鼠舌組織上皮結構完整,細胞排列整齊,上皮及固有層未有炎癥細胞浸潤;輻射組上皮結構完整性消失,大部分上皮脫落,固有層可見大量炎性細胞浸潤;輻射+凝膠組小鼠舌組織上皮層結構分層略有紊亂,上皮細胞數量減少,細胞排列紊亂,基底層消失,上皮厚度較正常組織略有降低,但未見鱗狀上皮脫落,上皮結構基本完整,僅在固有層有少量炎性細胞浸潤。
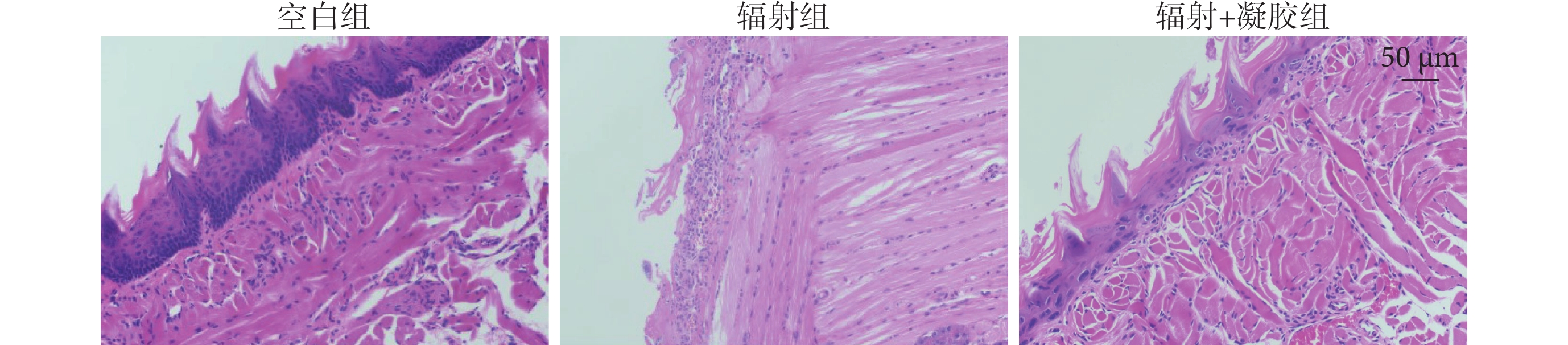 圖5
各組小鼠舌組織蘇木精-伊紅染色圖(×200)
圖5
各組小鼠舌組織蘇木精-伊紅染色圖(×200)
2.2.4 小鼠舌組織炎癥因子水平比較
如表2 所示,與空白組相比,輻射組 TNF-α、IL-1β 及 IL-6 含量均升高,且差異有統計學意義(P<0.05);在給予姜黃素-VE 凝膠干預后,小鼠舌組織 TNF-α、IL-1β 及 IL-6 含量較輻射組均出現顯著下降(P<0.05)。
2.2.5 各組小鼠舌組織抗氧化水平比較
如表3 所示,與空白組相比,輻射組小鼠舌組織 SOD、CAT 活性下降,丙二醛水平升高,差異均有統計學意義(P<0.05);而與輻射組相比,輻射+凝膠組小鼠舌組織 CAT 活性增加,差異有統計學意義(P<0.05)。
2.2.6 小鼠舌組織 Nrf2、γ-H2AX 的分布表達
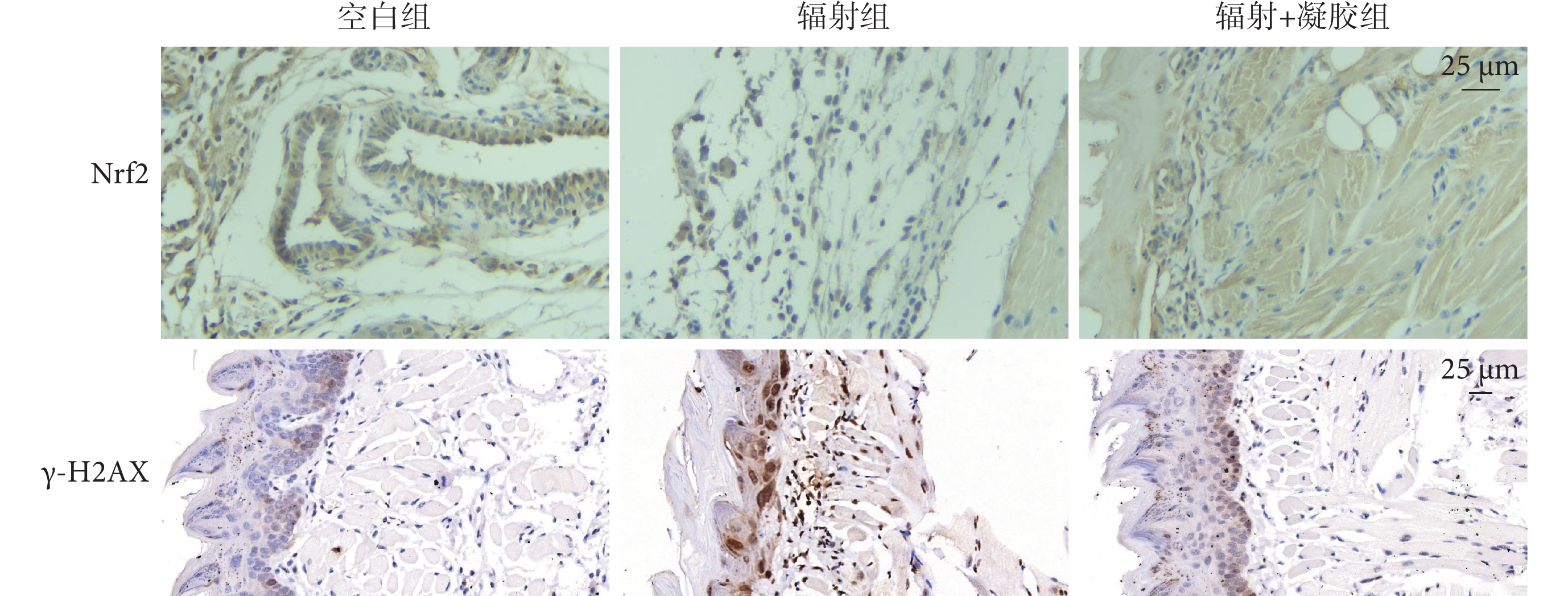
如圖6、表4 所示,與空白組相比,輻射組 Nrf2 表達下調,但差異無統計學意義(P>0.05);γ-H2AX 表達量增加,差異有統計學意義(P<0.05)。姜黃素-VE 凝膠干預后,Nrf2 表達較輻射組上調,但差異無統計學意義(P>0.05);γ-H2AX 表達量下降,差異有統計學意義(P<0.05)。
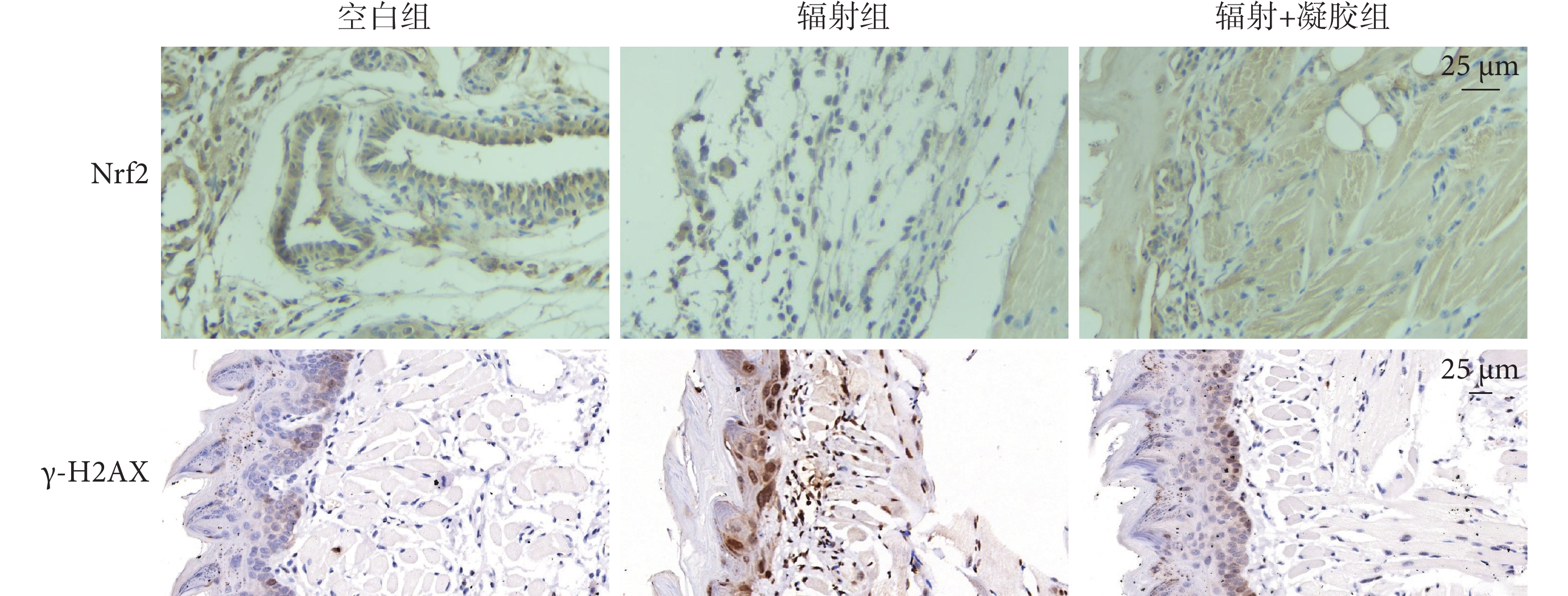 圖6
各組舌組織 Nrf2 和 γ-H2AX 免疫組織化學染色像(×400)
圖6
各組舌組織 Nrf2 和 γ-H2AX 免疫組織化學染色像(×400)
Nrf2:核轉錄因子紅系 2 相關因子 2;γ-H2AX:磷酸化組蛋白 H2AX
3 討論
RIOM 以口腔潰瘍為主,患者可出現口腔紅腫、糜爛,進一步引起口腔劇烈的疼痛,從而減少患者攝食量,影響患者預后及生活質量[21]。本研究深入探討了姜黃素-VE 凝膠在治療 RIOM 中的效果。在輻射誘導的口腔潰瘍模型中,我們發現輻射組小鼠出現了多處口腔潰瘍,體重也呈現下降趨勢,特別是在急性潰瘍期,體重下降更為顯著。然而,姜黃素-VE 凝膠的應用顯著減少了輻射引起的口腔潰瘍,改善了小鼠的進食量,并緩解了體重減輕的現象。
根據 Sonis[22]于 2004 年提出的 RIOM 五階段理論,放療過程中,電離輻射直接損傷細胞 DNA,導致細胞程序性死亡。γ-H2AX 作為 DNA 雙鏈斷裂的生物標志物,當 DNA 損傷,雙鏈斷裂時,組蛋白 H2A 的 139 位絲氨酸迅速磷酸化,生成 γ-H2AX[23]。Zhang 等[24]通過制備四面體框架核酸藥物遞送系統負載姜黃素用以治療 RIOM 的研究發現,相較于輻射組和單獨的四面體框架核酸材料,負載姜黃素的四面體核酸材料可以顯著減少輻射后細胞核內 γ-H2AX 的表達。本研究中,在輻射后小鼠舌組織中 γ-H2AX 的表達顯著升高,而姜黃素-VE 凝膠的應用顯著降低了 γ-H2AX 的表達,提示姜黃素-VE 凝膠對輻射引起的 DNA 損傷具有保護作用。
在輻射后的生物效應研究中,我們觀察到 SOD、CAT 等抗氧化酶活性的下降和丙二醛含量的升高,這些變化反映了輻射引起的氧化應激。然而,輻射+凝膠治療組的小鼠顯示出 CAT 活性的增加,這表明姜黃素-VE 凝膠能夠抑制輻射引起的氧化應激。此外,多項研究指出,姜黃素可能通過依賴性上調 Nrf2 的表達或促使其核易位,促進 SOD、CAT、GSH-Px 等抗氧化酶的活性,進而清除活性氧[25-27]。而在本研究中,姜黃素-VE 凝膠上調了受輻射抑制的 Nrf2 的表達,但差異無統計學意義,因此姜黃素-VE 抑制輻射后氧化應激的機制仍需進一步探究。
進入炎癥反應階段后,大量包括 TNF-α、IL-1β、IL-6 在內的炎癥因子釋放,招募額外的單核細胞和中性粒細胞,增加血管內皮對炎癥細胞的通透性從而導致組織損傷、上皮細胞變薄、口腔黏膜損傷,若炎癥反應持續進行,將致使潰瘍形成、細菌定植[22]。本研究發現,姜黃素-VE 凝膠可有效降低在輻射后增加的 TNF-α、IL-1β、IL-6 等炎癥因子的水平,有效抑制組織炎癥反應。
綜上所述,姜黃素-VE 凝膠可通過減少輻射引起的 DNA 損傷,改善輻射后氧化應激以及有效降低炎癥因子水平來延緩或減弱 RIOM 的進程,對 RIOM 的治療具有潛在療效。這些發現為 RIOM 的臨床治療提供了新的策略,并為進一步的研究和藥物開發奠定了基礎。
利益沖突:所有作者聲明不存在利益沖突。
放射性口腔黏膜炎(radiation-induced oral mucositis, RIOM)是指電離輻射引起的口腔黏膜損傷,臨床上多見于頭頸部惡性腫瘤患者放化療過程中[1],可致患者口腔疼痛、吞咽困難、營養供給不足等問題[2]。RIOM 的發生致使頭頸癌患者放化療延遲、停止或劑量下調,嚴重影響患者癌癥治療效果、預后及生存質量[3]。盡管目前臨床上已有多種治療 RIOM 的方法,如抗炎藥物、天然藥物、生長因子、抗菌劑和麻醉鎮痛劑等,但療效均有限,且可能伴隨副作用[4-5],因此,深入研究并開發出有效安全的 RIOM 預防和治療新策略,對改善患者臨床癥狀、提高預后及生存質量以及優化癌癥綜合治療效果具有重要意義。姜黃素是從姜黃、莪術、郁金等天然植物中提取的多酚類化合物[6],具有良好的抑菌[7]、抗氧化[8]、抗炎效果[9-10],目前許多研究發現姜黃素及其衍生物對 RIOM 的發病進程有較好的抑制作用,可作為治療 RIOM 的有效手段[11-14]。然而,單獨的姜黃素因水溶性低、穩定性差、生物利用率低等特性,在臨床中實際應用的可能性受到極大限制[15]。Huang 等[16]發現,姜黃素可與維生素 E(vitamin E, VE)發生酯化反應形成具有自組裝性能的姜黃素-VE 衍生物,極大地改善了姜黃素的水溶性和穩定性。此外,VE 作為一種天然抗氧化劑,可保護細胞免受氧化損傷[17],也可增加膠原蛋白、纖維蛋白等合成,保護細胞膜結構,促進細胞再生與黏膜上皮化,有利于口腔黏膜損傷后的修復[18]。但目前對姜黃素-VE 復合物防治 RIOM 的效果尚未有驗證。因此,本研究以泊洛沙姆溫敏水凝膠為載體[19],負載姜黃素-VE 復合物,制作成載有姜黃素-VE 復合物的溫敏水凝膠(以下簡稱“姜黃素-VE 凝膠”),實現姜黃素-VE 復合物的口腔黏膜給藥,并從姜黃素-VE 凝膠對小鼠舌組織炎癥水平、氧化應激水平及 DNA 損傷修復幾個方向觀察其對 RIOM 的治療效果,為 RIOM 的臨床治療提供新的可能。
1 材料與方法
1.1 試劑與儀器
1.1.1 藥物與試劑
姜黃素(北京索萊寶科技有限公司);D-α-生育酚琥珀酸酯、泊洛沙姆 F127、泊洛沙姆 F68(上海源葉生物科技有限公司);二環己基二亞胺、4-二甲氨基吡啶(上海阿拉丁生化科技股份有限公司);殼聚糖(上海麥克林生化科技股份有限公司);4% 多聚甲醛固定液(合肥白鯊生物科技公司);超氧化物歧化酶(superoxide dismutase, SOD)、過氧化氫酶(catalase, CAT)、谷胱甘肽過氧化物酶(glutathione peroxidase, GSH-Px)、丙二醛檢測試劑盒(南京建成生物公司);BCA 蛋白濃度測定試劑盒(上海碧云天生物技術有限公司);腫瘤壞死因子 α(tumor necrosis factor α, TNF-α)、白細胞介素(interleukin, IL)-1β 及 IL-6 酶聯免疫吸附法(enzyme linked immunosorbent assay, ELISA)測定試劑盒(武漢伊萊瑞特生物科技股份有限公司);磷酸化組蛋白 H2AX(phosphorylated histone H2AX, γ-H2AX)單克隆抗體(成都正能生物公司)、核轉錄因子紅系 2 相關因子 2(nuclear factor-erythroid 2-related factor 2, Nrf2)單克隆抗體(武漢三鷹生物技術有限公司);辣根過氧化物酶標記山羊抗兔免疫球蛋白 G、乙二胺四乙酸抗原修復液、檸檬酸鹽緩沖液、蘇木素(武漢塞維爾生物科技有限公司);伊紅(合肥博美生物公司);二氨基聯苯胺顯色試劑盒(北京中杉金橋生物有限公司)。
1.1.2 儀器
旋轉蒸發儀(上海亞榮生化儀器公司);恒溫磁力攪拌器(上海滬西分析儀器有限公司);Nicolet Nexus670 紅外光譜儀(美國 Thermo Nicolet 儀器公司);NETZSCH 旋轉流變儀 Kinexus Lab+(德國耐馳儀器公司);Prisma E 掃描電鏡、Scientific Sorvall ST16R 臺式離心機、Multiskan FC1510 酶標儀(美國 Thermo Fisher 儀器公司);FreeZone 真空冷凍干燥機(美國 Labconco 公司);X-RAY 小動物精準輻照儀(美國 Radsource 科技公司);RM2016 轉輪式切片機(德國 Leica 公司);自動脫水機(武漢俊杰電子科技公司);組織包埋機、病理組織漂烘儀(常州中威電子儀器廠);DP27 熒光倒置顯微鏡(日本 Olympus 株式會社);zwickLine Z2.5 TN﹢ 電子萬能試驗機(德國 ZWICK/Roell 公司)。
1.2 姜黃素-VE 凝膠的合成與性能測定
1.2.1 姜黃素-VE 復合物的合成及表征
姜黃素-VE 復合物的合成參照 Huang 等[16]和 Zhang 等[20]的方法:稱取 D-α-生育酚琥珀酸酯
1.2.2 姜黃素-VE 凝膠的合成及表征
吸取 100 μL Tween80 超聲分散于 5 mL 去離子水中,稱取 20 mg 姜黃素-VE 復合物溶于 1 mL 二甲基亞砜,吸取 250 μL 緩慢滴加于上述去離子水,制備姜黃素-VE 復合物制劑。滴加 28.6 μL 冰醋酸于姜黃素-VE 復合制劑中,定容至 5 mL,使得冰醋酸濃度為 0.1 mol/L。稱取一定質量的殼聚糖溶解于上述制劑,室溫下磁力攪拌 1 h,可得到質量分數為 0.5% 的殼聚糖溶液。分別稱取質量比為 20∶5 的泊洛沙姆 F127 和 F68 溶于殼聚糖溶液,4℃下放置 24 h 充分溶脹,得到澄清黏稠的姜黃素-VE 凝膠。通過流變儀進行流變學分析以評估凝膠的凝膠化溫度。將制備好的姜黃素-VE 凝膠置于液氮中速凍后真空冷凍干燥得到凍干樣品,噴金后掃描電鏡觀察其內部結構及微觀形態。
1.2.3 姜黃素-VE 凝膠性能測定
① 溶脹性:準確稱取 100 mg(W0)冷凍干燥后的空白凝膠、姜黃素-VE 凝膠,置于 20 mL 磷酸鹽緩沖液(phosphate buffered saline, PBS)(pH=7.4)中,于 37℃下浸泡,不同時間點下用濾紙吸干凝膠表面水分并稱重(WS),直到凝膠樣品達到溶脹平衡,質量不再變化。溶脹率計算公式:溶脹率=(WS–W0)/W0。
② 降解性:準確稱取 100 mg(W0)冷凍干燥后的空白凝膠、姜黃素-VE 凝膠,置于 20 mL PBS(pH=7.4)中,放入恒溫搖床(37℃,100 r/min)中孵育,每 12 小時取出水凝膠,真空冷凍干燥后稱重,記錄重量(WS)。降解率計算公式:降解率=(W0–WS)/W0。
③ 黏附性:模擬口腔濕潤環境,采用搭接剪切實驗測定空白凝膠及姜黃素-VE 凝膠的黏附性。新鮮豬皮嚴格去除表面毛發及油脂,并切割為 60 mm×15 mm 大小,浸泡于人工唾液 1 h 備用。分別將 100 μL 空白凝膠、姜黃素-VE 凝膠均勻涂抹于兩塊豬皮表面,涂抹區域面積為 15 mm×15 mm,37℃下穩定 1 h 后,通過萬能試驗機測定黏附性能。拉伸速度 5 mm/min,黏附強度由最大拉伸力(單位 N)除以兩塊豬皮搭接區域面積(單位 m2)表示。
1.3 動物實驗
1.3.1 實驗動物及分組
30 只體重在 21~23 g 的 8 周齡無特定病原體級雄性 BALB/C 小鼠,購于四川維通利華實驗動物技術有限公司,許可證號:SCXK(川)2023-0040。采用隨機數字表將小鼠分為空白組、模型組(輻射組)、輻射+凝膠組,每組各 10 只。小鼠全程飼養于四川大學華西基礎與法醫學院動物實驗中心,環境溫度 20~26℃,相對濕度 40%~70%,適應性喂養 7 d,期間小鼠自由飲水、進食。動物實驗經四川大學華西醫院實驗動物倫理委員會批準,倫理備案號:20240618001。
1.3.2 RIOM 動物模型建立
RIOM 模型建立采用單次大劑量輻射。小鼠稱重后,腹腔注射 0.3% 戊巴比妥鈉(3.5 mL/kg)麻醉小鼠,仰臥位固定于鉛盒中,露出頭頸部,其余部分采用厚度為 5 mm 的鉛板覆蓋以隔絕電離輻射,置于 X-RAY 小動物精準輻照儀內進行頭頸部局部放療,放射條件:電壓 160 kV,電流 20 mA,總放射劑量 25 Gy,劑量率 1.903 Gy/min;空白組只麻醉不進行輻射。
1.3.3 給藥方法
輻射當天記為第 0 天,于輻射后第 1 天進行治療干預,連續 7 d。空白組、輻射組給予常規飼料及飲水,此外不作任何處理;輻射+凝膠組除常規飼料及飲水外,每日上午 10:00、下午 18:00 各給予凝膠干預 1 次。凝膠干預方式為:定量吸取 100 μL 姜黃素-VE 凝膠,采用無菌棉簽充分涂抹于小鼠口腔,禁食禁水 1 h 后自由飲水、進食。第 8 天腹腔注射麻醉頸椎脫臼處死小鼠,收集指標。
1.3.4 檢測指標
① 小鼠一般狀態及體重:輻射當天及輻射后每日同一時間觀察小鼠一般情況,記錄小鼠體重。
② 小鼠潰瘍面積的測量:小鼠頸椎脫臼處死后立即取小鼠舌組織,用棉簽蘸取 1% 乙酸溶液清洗舌組織表面,均勻涂抹 1% 甲苯胺藍染液后靜置 5 min,1% 乙酸溶液充分清洗多余染液,拍照后 Image-J 分析潰瘍面積、黏膜炎面積與舌組織全面積比例。
③ 組織病理觀察:甲苯胺藍染色后的舌組織 PBS 清洗 2 次后置于 4% 多聚甲醛中固定 24~48 h,沿矢狀面將舌組織一分為二,經脫水、石蠟包埋、切片、蘇木精-伊紅染色后脫水封片,顯微鏡下觀察并拍照。
④ 小鼠舌組織炎癥因子水平的測定:采用 ELISA 測定小鼠舌組織 TNF-α、IL-1β、IL-6 的水平。剪碎的組織與預冷的 PBS 按 1∶9 的重量體積比混合,在組織勻漿機中充分勻漿,4℃,500×g 離心 10 min,得到 10% 勻漿上清液,取上清液按照 ELISA 檢測步驟測定各炎癥因子的水平。
⑤ 小鼠舌組織抗氧化水平的測定:測定小鼠舌組織中 SOD、CAT、GSH-Px 的活性及丙二醛的含量。剪碎的組織按重量體積比 1∶9 的比例加入生理鹽水,在組織勻漿機中充分勻漿,400×g,離心 10 min,取上清液,嚴格遵循說明書中的操作步驟進行測定。
⑥ 小鼠舌組織 γ-H2AX、Nrf2 分布表達:小鼠舌組織固定、取材、脫水、包埋、切片、脫蠟、抗原修復后進行內源性過氧化物酶阻斷,滴加牛血清白蛋白室溫封閉 20 min,對應一抗稀釋后(Nrf2 1∶200;γ-H2AX 1∶200)孵育,4℃過夜。取出過夜孵育組織復溫后 PBS 洗滌,滴加二抗 37℃孵育 30 min,PBS 洗滌后二氨基聯苯胺顯色,使用蘇木素復染細胞核,脫水封片后顯微鏡下觀察,每個切片隨機選取 3 個視野拍照,Image-J 分析陽性細胞數。
1.4 統計學方法
采用 SPSS Statistics 26.0 軟件進行統計學分析。計量資料符合正態分布,采用均數±標準差表示。方差齊的計量資料組間進行 t 檢驗或單因素方差分析,使用 LSD 法進行多重比較;不符合方差齊性的計量資料采用 Welch 檢驗,使用 Games-Howell 法進行多重比較。重復測量的資料采用重復測量方差分析。雙側檢驗水準 α=0.05。
2 結果
2.1 姜黃素-VE 凝膠的合成及性能測定結果
2.1.1 姜黃素-VE 復合物傅里葉紅外光譜分析
如圖1 所示,姜黃素的主要特征峰出現在
 圖1
姜黃素-VE 復合物傅里葉紅外光譜結果圖
圖1
姜黃素-VE 復合物傅里葉紅外光譜結果圖
VE:維生素 E;CUR:姜黃素;VE-SA:D-α-生育酚琥珀酸酯
2.1.2 姜黃素-VE 凝膠的表征
如圖2a 所示,當溫度低于 30℃時,姜黃素-VE 凝膠的 G’(儲存模量)低于 G’’(損失模量),而隨著溫度的升高,在一定的頻率和應變值下,G’與 G’’均隨著溫度升高而升高,但當溫度到達 30℃后,G’開始高于 G’’,此時凝膠發生溶膠-凝膠反應,由液態的溶膠變為固態的凝膠,表明姜黃素-VE 凝膠具有溫敏性,當溫度升高到 30℃時可成凝膠,即在口腔溫度條件下,姜黃素-VE 凝膠可以固態凝膠的狀態黏附在口腔黏膜上。
 圖2
姜黃素-VE 凝膠溫度-G’/G’’變化曲線及凍干姜黃素-VE 凝膠掃描電鏡圖
圖2
姜黃素-VE 凝膠溫度-G’/G’’變化曲線及凍干姜黃素-VE 凝膠掃描電鏡圖
a. 溫度-G’/G’’變化曲線;b. 凍干姜黃素-VE 凝膠掃描電鏡圖。VE:維生素 E;G’:儲存模量;G’’:損失模量
掃描電鏡下姜黃素-VE 凝膠結構如圖2b 所示,觀察可見姜黃素-VE 凝膠凍干后內部微觀結構呈現出多孔網狀結構,孔徑分布主要在 5~20 μm,該結構有利于小分子藥物、水及營養物質等進出,具有藥物緩釋作用,有利于傷口愈合。
2.1.3 凝膠性能
① 溶脹性:如圖3a 所示,空白凝膠在 4 h 內快速吸水,溶脹率超過 300%,而后達到溶脹平衡,表明空白凝膠有較好的溶脹性能,可以適當吸收并儲存水分,而負載姜黃素-VE 復合物對凝膠溶脹性能無顯著影響(P>0.05)。
 圖3
凝膠性能測定結果
圖3
凝膠性能測定結果
a. 凝膠溶脹率(
② 降解性:如圖3b 所示,24 h 內空白凝膠、姜黃素-VE 凝膠降解率分別為 80.506%、76.912%,而 48 h 后兩種凝膠降解率均超過 95%,表明姜黃素-VE 復合物的加入對凝膠降解速率無顯著影響(P>0.05)。
③ 黏附性:如圖3c 所示,在模擬口腔濕潤環境下,空白凝膠黏附強度為 13.300 kPa,姜黃素-VE 凝膠為 12.748 kPa,差異無統計學意義(P>0.05),且兩種凝膠的黏附強度均高于常見敷料(0~5 kPa),表明凝膠可穩定黏附在口腔環境內,延長藥物與創口作用時間。
2.2 動物實驗結果
2.2.1 小鼠體重變化
如圖4a 所示,輻射前各組小鼠體重差異無統計學意義(P>0.05)。空白組輻射前與輻射后第 7 天小鼠體重差異無統計學意義(P>0.05);輻射組、輻射+凝膠組小鼠輻射后第 7 天較輻射前體重顯著下降(P<0.05),但輻射+凝膠組小鼠體重從第 5 天開始高于輻射組,在第 7 天時兩組小鼠體重差異具有統計學意義(P<0.05)。
 圖4
小鼠體重變化和舌組織甲苯胺藍染色彩色像
圖4
小鼠體重變化和舌組織甲苯胺藍染色彩色像
a. 各組小鼠體重變化; b. 小鼠舌組織甲苯胺藍染色彩色像
2.2.2 小鼠潰瘍面積比較
如圖4b、表1 所示,正常小鼠舌組織呈粉紅色,質地柔軟濕潤,僅見 1 處甲苯胺藍點狀陽性著色;輻射組小鼠舌組織出現黏膜炎甚至潰瘍,甲苯胺藍染色后舌體顏色變深,潰瘍區域出現明顯藍色陽性著色,潰瘍主要出現在舌根處;輻射+凝膠組較輻射組潰瘍面積顯著減少,可見散在點狀陽性著色。輻射組潰瘍面積占比(潰瘍面積/舌組織全面積)27.21%,黏膜炎面積占比(黏膜炎面積/舌組織全面積)59.77%,姜黃素-VE 凝膠干預后潰瘍面積、黏膜炎面積占比下降至 1.74%、19.10%,差異有統計學意義(P<0.05)。
2.2.3 組織病理觀察
如圖5 所示,空白組小鼠舌組織上皮結構完整,細胞排列整齊,上皮及固有層未有炎癥細胞浸潤;輻射組上皮結構完整性消失,大部分上皮脫落,固有層可見大量炎性細胞浸潤;輻射+凝膠組小鼠舌組織上皮層結構分層略有紊亂,上皮細胞數量減少,細胞排列紊亂,基底層消失,上皮厚度較正常組織略有降低,但未見鱗狀上皮脫落,上皮結構基本完整,僅在固有層有少量炎性細胞浸潤。
 圖5
各組小鼠舌組織蘇木精-伊紅染色圖(×200)
圖5
各組小鼠舌組織蘇木精-伊紅染色圖(×200)
2.2.4 小鼠舌組織炎癥因子水平比較
如表2 所示,與空白組相比,輻射組 TNF-α、IL-1β 及 IL-6 含量均升高,且差異有統計學意義(P<0.05);在給予姜黃素-VE 凝膠干預后,小鼠舌組織 TNF-α、IL-1β 及 IL-6 含量較輻射組均出現顯著下降(P<0.05)。
2.2.5 各組小鼠舌組織抗氧化水平比較
如表3 所示,與空白組相比,輻射組小鼠舌組織 SOD、CAT 活性下降,丙二醛水平升高,差異均有統計學意義(P<0.05);而與輻射組相比,輻射+凝膠組小鼠舌組織 CAT 活性增加,差異有統計學意義(P<0.05)。
2.2.6 小鼠舌組織 Nrf2、γ-H2AX 的分布表達
如圖6、表4 所示,與空白組相比,輻射組 Nrf2 表達下調,但差異無統計學意義(P>0.05);γ-H2AX 表達量增加,差異有統計學意義(P<0.05)。姜黃素-VE 凝膠干預后,Nrf2 表達較輻射組上調,但差異無統計學意義(P>0.05);γ-H2AX 表達量下降,差異有統計學意義(P<0.05)。
 圖6
各組舌組織 Nrf2 和 γ-H2AX 免疫組織化學染色像(×400)
圖6
各組舌組織 Nrf2 和 γ-H2AX 免疫組織化學染色像(×400)
Nrf2:核轉錄因子紅系 2 相關因子 2;γ-H2AX:磷酸化組蛋白 H2AX
3 討論
RIOM 以口腔潰瘍為主,患者可出現口腔紅腫、糜爛,進一步引起口腔劇烈的疼痛,從而減少患者攝食量,影響患者預后及生活質量[21]。本研究深入探討了姜黃素-VE 凝膠在治療 RIOM 中的效果。在輻射誘導的口腔潰瘍模型中,我們發現輻射組小鼠出現了多處口腔潰瘍,體重也呈現下降趨勢,特別是在急性潰瘍期,體重下降更為顯著。然而,姜黃素-VE 凝膠的應用顯著減少了輻射引起的口腔潰瘍,改善了小鼠的進食量,并緩解了體重減輕的現象。
根據 Sonis[22]于 2004 年提出的 RIOM 五階段理論,放療過程中,電離輻射直接損傷細胞 DNA,導致細胞程序性死亡。γ-H2AX 作為 DNA 雙鏈斷裂的生物標志物,當 DNA 損傷,雙鏈斷裂時,組蛋白 H2A 的 139 位絲氨酸迅速磷酸化,生成 γ-H2AX[23]。Zhang 等[24]通過制備四面體框架核酸藥物遞送系統負載姜黃素用以治療 RIOM 的研究發現,相較于輻射組和單獨的四面體框架核酸材料,負載姜黃素的四面體核酸材料可以顯著減少輻射后細胞核內 γ-H2AX 的表達。本研究中,在輻射后小鼠舌組織中 γ-H2AX 的表達顯著升高,而姜黃素-VE 凝膠的應用顯著降低了 γ-H2AX 的表達,提示姜黃素-VE 凝膠對輻射引起的 DNA 損傷具有保護作用。
在輻射后的生物效應研究中,我們觀察到 SOD、CAT 等抗氧化酶活性的下降和丙二醛含量的升高,這些變化反映了輻射引起的氧化應激。然而,輻射+凝膠治療組的小鼠顯示出 CAT 活性的增加,這表明姜黃素-VE 凝膠能夠抑制輻射引起的氧化應激。此外,多項研究指出,姜黃素可能通過依賴性上調 Nrf2 的表達或促使其核易位,促進 SOD、CAT、GSH-Px 等抗氧化酶的活性,進而清除活性氧[25-27]。而在本研究中,姜黃素-VE 凝膠上調了受輻射抑制的 Nrf2 的表達,但差異無統計學意義,因此姜黃素-VE 抑制輻射后氧化應激的機制仍需進一步探究。
進入炎癥反應階段后,大量包括 TNF-α、IL-1β、IL-6 在內的炎癥因子釋放,招募額外的單核細胞和中性粒細胞,增加血管內皮對炎癥細胞的通透性從而導致組織損傷、上皮細胞變薄、口腔黏膜損傷,若炎癥反應持續進行,將致使潰瘍形成、細菌定植[22]。本研究發現,姜黃素-VE 凝膠可有效降低在輻射后增加的 TNF-α、IL-1β、IL-6 等炎癥因子的水平,有效抑制組織炎癥反應。
綜上所述,姜黃素-VE 凝膠可通過減少輻射引起的 DNA 損傷,改善輻射后氧化應激以及有效降低炎癥因子水平來延緩或減弱 RIOM 的進程,對 RIOM 的治療具有潛在療效。這些發現為 RIOM 的臨床治療提供了新的策略,并為進一步的研究和藥物開發奠定了基礎。
利益沖突:所有作者聲明不存在利益沖突。