引用本文: 王宸宸, 李天博, 郭瑞敏, 季慶輝, 王江寧, 曹毓琳. 可吸收支架負載外泌體方法研究. 中國修復重建外科雜志, 2024, 38(2): 206-210. doi: 10.7507/1002-1892.202310068 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
介入手術是治療動脈閉塞性疾病的有效方法之一[1] 。糖尿病患者因外周動脈閉塞疾病導致缺血,引發糖尿病足潰瘍并抑制創面愈合,重建閉塞動脈是促進創面愈合的主要治療方法 [2-7]。當術中重建閉塞動脈后,管腔殘余狹窄和限流性夾層的出現是植入動脈支架的常見指征[8]。既往臨床主要采用裸金屬支架,但是存在支架內再狹窄等問題,近年來逐漸被藥物涂層支架替代[9]。但是,藥物涂層支架的金屬部分長期殘留在血管內,會引發慢性持續性異物炎癥反應[10],同時殘存的支架給二次手術帶來很大困難,為此學者們提出了可吸收支架[11-12]。
外泌體是含有多種生物活性的細胞外囊泡,研究發現MSCs來源外泌體包含多種生物活性物質,對組織有修復作用[13-15]。Hu等[16]的研究顯示外泌體可以負載于金屬支架表面。考慮到金屬支架長期殘留問題,我們在上述研究基礎上,探討一種將外泌體負載于可吸收支架的方法,制備外泌體洗脫可吸收支架,并對其進行相關檢測。
1 材料與方法
1.1 主要試劑與儀器
人臍帶MSCs來源外泌體(北京唐頤生物醫學技術研究院有限公司),粒徑90~220 nm、濃度1.0×1011粒子/mL,蛋白濃度8~20 μg/μL,保存于生理鹽水中。聚乳酸可吸收支架,外徑為(5.0±0.5)mm(北京阿邁特醫療器械有限公司)。無水乙醇、王水、氨丙基三乙氧基硅烷 [(3-aminopropyl)triethoxysilane,APTES]、N-羥基琥珀酰亞胺(N-hydroxysuccinimide,NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽 [N-(3-dimethylamin opropyl)-N-ethylcarbodiimide hydrochloride,EDC·HCL]、二硬脂酰磷脂酰乙酰胺-聚乙二醇5000 {1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)5000],DSPE-PEG5000}、NaOH(北京伊諾凱科技有限公司);PBS(北京普利智誠生物技術有限公司)。
超聲波清洗機(深圳市潔盟清洗設備有限公司);集熱式恒溫磁力攪拌浴(鄭州長城科工貿有限公司);掃描電鏡(Zeiss公司,德國);原子力顯微鏡(Bruker公司,德國);飛行時間二次離子質譜儀(Ulvac-Phi公司,日本);體視顯微鏡(廈門麥克奧迪實業集團有限公司);徑向力測試儀(Blockwise公司,美國)。
1.2 外泌體洗脫可吸收支架構建方法
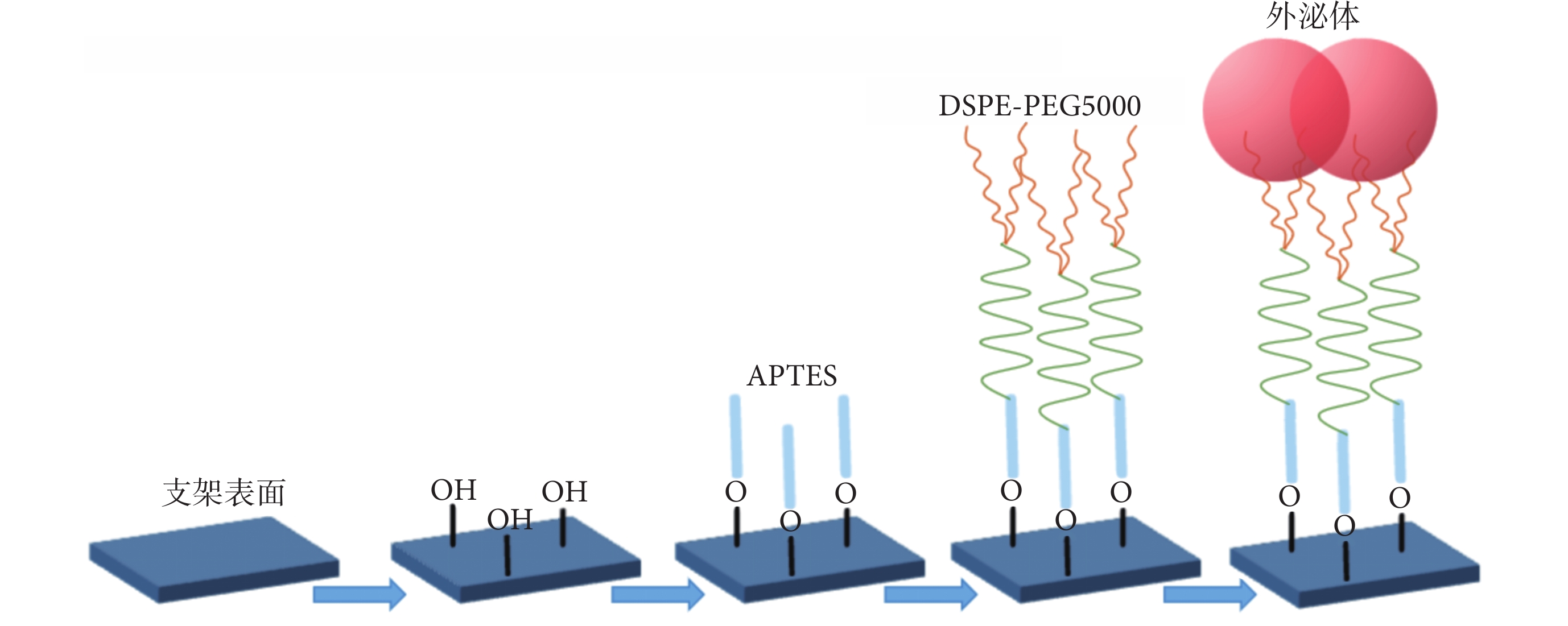
可吸收支架負載外泌體操作參考文獻 [16] 制備流程。具體流程如下:取聚乳酸可吸收支架片段,以無水乙醇和去離子水清洗后,于20℃條件下用王水活化支架表面5 min,去離子水沖洗3次并晾干;置于1 mol/L NaOH 于30℃水浴10 min后,去離子水沖洗3次并晾干;置于5%APTES乙醇溶液中,在搖床20℃條件下浸泡5 h,去離子水沖洗,儲存于純水中過夜;取出支架置于1 mol/L NHS,在搖床20℃條件下孵育10~20 min,進一步加入等量1 mol/L EDC·HCL,繼續孵育10~20 min;取出支架,用去離子水沖洗后,與DSPE-PEG5000溶液在搖床20℃條件下反應8~10 h,使DSPE-PEG5000與支架上的APTES結合;取出支架用去離子水沖洗后,保存于去離子水過夜;最后將結合DSPE-PEG5000的支架浸泡在常溫解凍后的外泌體溶液中,在搖床20℃條件下結合8~10 h,PBS沖洗后獲得外泌體洗脫可吸收支架,于4℃條件下PBS保存。見圖1。
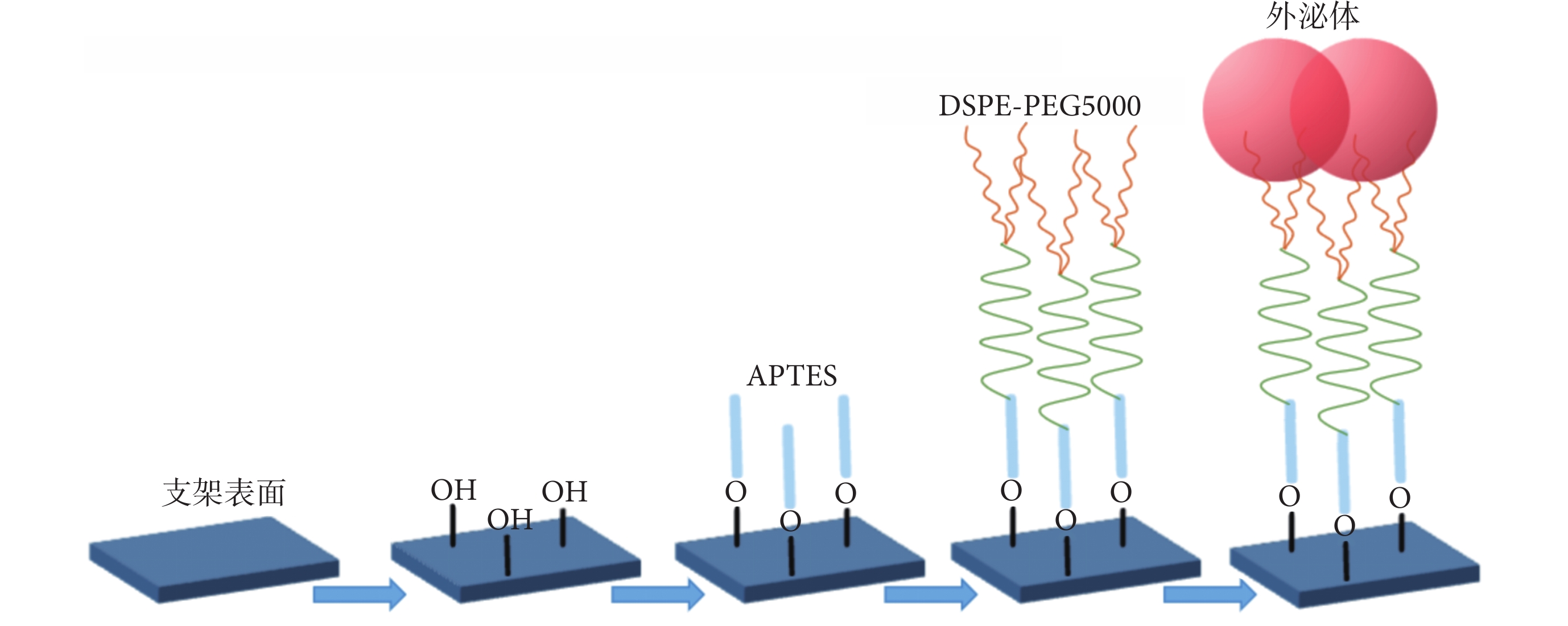 圖1
可吸收支架負載外泌體流程示意圖
Figure1.
Schematic diagram of the process for loading exosomes onto absorbable stents
圖1
可吸收支架負載外泌體流程示意圖
Figure1.
Schematic diagram of the process for loading exosomes onto absorbable stents
1.3 觀測指標
1.3.1 掃描電鏡觀察
剪取適當大小外泌體洗脫可吸收支架樣品,經干燥噴金處理后,掃描電鏡下觀察支架表面情況及外泌體吸附情況。以單純可吸收支架作為對照。
1.3.2 原子力顯微鏡觀測
剪取適當大小外泌體洗脫可吸收支架樣品,干燥后固定于樣品臺上,應用輕敲模式設定5 μm2取樣范圍,檢測支架表面粗糙程度。以單純可吸收支架作為對照。實驗重復3次。
1.3.3 飛行時間質譜檢測
剪取適當大小外泌體洗脫可吸收支架樣品,干燥后固定于飛行時間二次離子質譜儀樣品板上,對支架表面物質進行鑒定。另取單純可吸收支架、外泌體行相同檢測,作為對照。
1.3.4 體視顯微鏡觀察
將外泌體洗脫可吸收支架干燥后,體視顯微鏡下旋轉1周觀察支架外觀,可接受標準為支架表面光潔,無裂痕、毛刺、凹陷。然后選取1點為0° 測外徑,將選取點旋轉90° 后再次測量外徑,實驗重復3次。測量結果與原可吸收支架外徑范圍(5.0±0.5)mm進行比較。
1.3.5 徑向強度檢測
將徑向力測試儀預熱至37℃后,將外泌體洗脫可吸收支架樣品置入其中,以0.5 mm/s速度壓縮支架至支架初始直徑60%,取支架直徑變化15%范圍內出現塑性形變的最大壓強值。可接受標準為徑向強度≥200 mm Hg(1 mm Hg=0.133 kPa)。實驗重復3次。
2 結果
2.1 掃描電鏡觀察
掃描電鏡觀察示,與可吸收支架相比,外泌體洗脫可吸收支架表面可見大量顆粒狀物體,粒徑為90~220 nm,與外泌體粒徑一致,表面還分布有細小不規則裂紋(圖2)。
 圖2
掃描電鏡觀察
圖2
掃描電鏡觀察
從左至右分別為放大500、1 000、10 000倍 a. 可吸收支架;b. 外泌體洗脫可吸收支架
Figure2. Scanning electron microscopy observationFrom left to right for magnified by 500, 1 000, and 10 000 times a. Absorbable stents; b. Exosome-eluting absorbable stents
2.2 原子力顯微鏡觀測
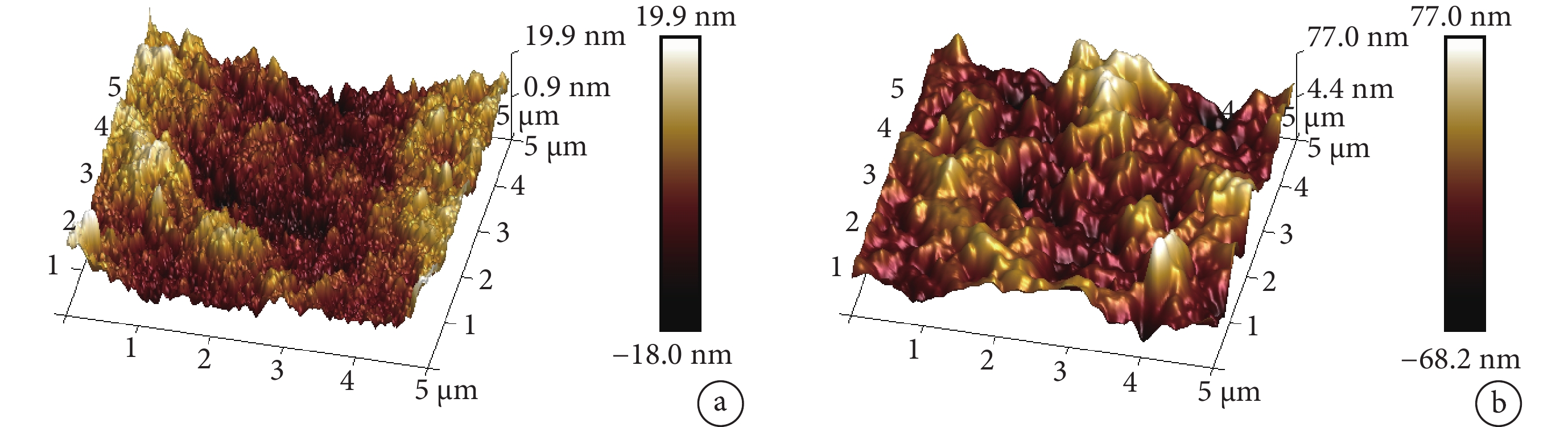
在5 μm2取樣范圍,可吸收支架表面粗糙程度為 ±20 nm,外泌體洗脫可吸收支架為 ±70 nm(圖3)。
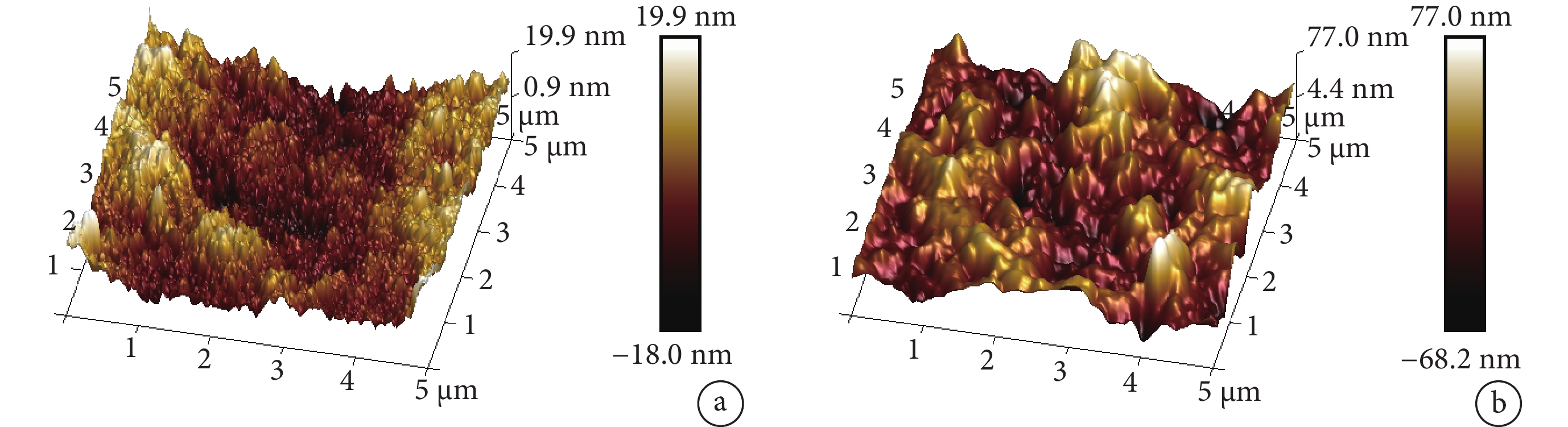 圖3
原子力顯微鏡觀察
圖3
原子力顯微鏡觀察
a. 可吸收支架;b. 外泌體洗脫可吸收支架
Figure3. Atomic force microscope observationa. Absorbable stents; b. Exosome-eluting absorbable stents
2.3 飛行時間質譜檢測
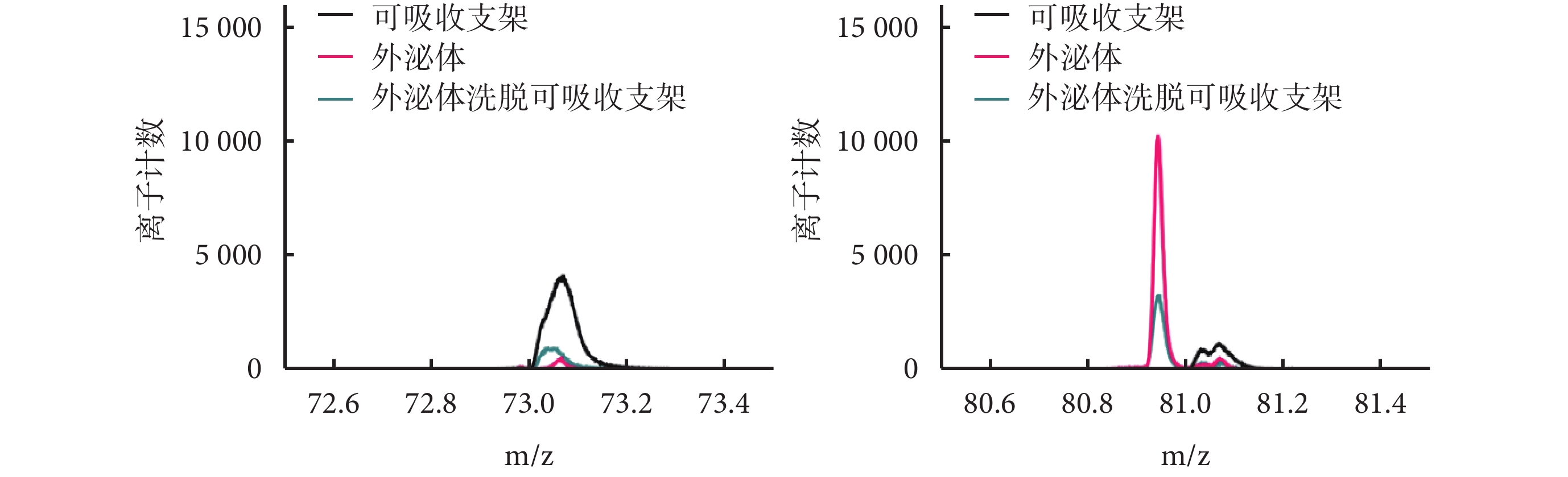
可吸收支架在正離子結果中有C3H5O2+(m/z 73)的峰值,外泌體有C6H9+(m/z 81)的峰值,外泌體洗脫可吸收支架m/z 81處有峰值、m/z 73處峰值相對可吸收支架降低。3種材料離子計數組間比較見圖4。
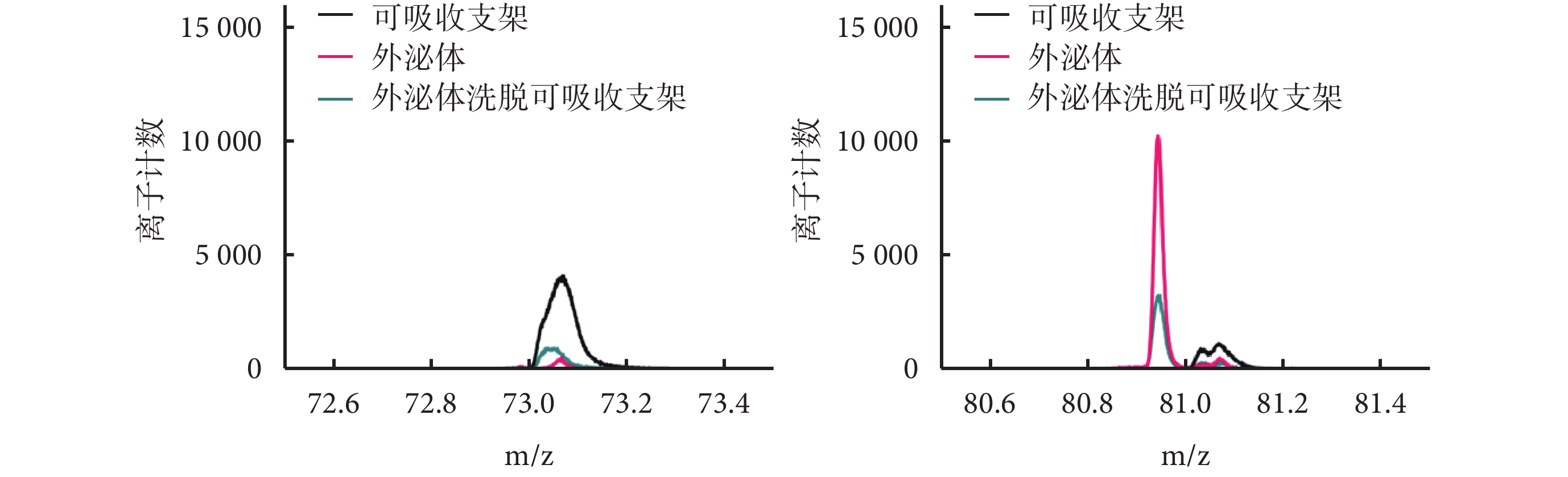 圖4
m/z 73及m/z 81處3種材料離子計數比較結果
Figure4.
Comparison of ions counts for three materials at m/z 73 and m/z 81, respectively
圖4
m/z 73及m/z 81處3種材料離子計數比較結果
Figure4.
Comparison of ions counts for three materials at m/z 73 and m/z 81, respectively
2.4 體視顯微鏡觀察
體視顯微鏡下觀察外泌體洗脫可吸收支架表面光潔,無裂痕、毛刺、凹陷,支架外徑在原可吸收支架合格范圍內。見圖5。
 圖5
體視顯微鏡觀察支架外觀及直徑(×30)
Figure5.
Appearance and diameter of the stents observed by stereomicroscope (×30)
圖5
體視顯微鏡觀察支架外觀及直徑(×30)
Figure5.
Appearance and diameter of the stents observed by stereomicroscope (×30)
2.5 徑向強度檢測
外泌體洗脫可吸收支架符合原可吸收支架徑向強度≥200 mm Hg的檢測標準。
3 討論
本研究成功構建外泌體洗脫可吸收支架,掃描電鏡示支架表面較平整,制作流程未過度損傷支架表面,同時表面有符合外泌體大小的顆粒。飛行時間質譜檢測結果顯示,外泌體和外泌體洗脫可吸收支架的正離子結果中均出現C6H9+(m/z 81)的峰值,在可吸收支架中并未出現。C6H9+(m/z 81)是脂質特征離子[17],而外泌體是細胞產生的囊泡,囊泡由細胞膜包裹,脂質雙分子層是細胞膜的主要結構。這表明外泌體洗脫可吸收支架表面結合的是外泌體,而非其他物質。外泌體洗脫可吸收支架在m/z 73處峰值相對可吸收支架明顯降低,分析為外泌體在支架表面形成遮蓋導致。掃描電鏡下可見支架表面存在細小裂紋,為此我們進一步對支架表面行原子力顯微鏡檢測,結果表明在5 μm2取樣范圍下,表面粗糙程度從可吸收支架的 ±20 nm增加至 ±70 nm,粗糙程度仍在納米級別。由此可見即使在支架表面負載外泌體后,對支架直徑的改變仍非常微小,不會過度改變支架形態,從而避免因過度改變支架內局部血流動力學導致支架內血栓形成[18-19]。徑向強度是提供支架支撐能力的重要指標[20],我們參照行業標準[21]檢測了外泌體洗脫可吸收支架徑向強度,結果顯示其仍≥200 mm Hg,表示該支架仍可提供足夠支撐能力,符合可吸收支架合格標準。
為解決金屬支架植入后長期血管內殘留導致慢性炎癥及限制再手術等問題,本研究首次提出用可吸收支架代替金屬支架與外泌體結合,初步探索出一個外泌體洗脫可吸收支架的制備流程,并進行相關表征檢測,驗證了外泌體與可吸收支架結合的可行性,為下一步檢測外泌體洗脫可吸收支架的生物活性及治療效果奠定基礎。后續將開展藥物濃度、時間、溫度等處理條件的對比實驗,探索最佳制備流程。此外,外泌體較紫杉醇等藥物涂層有促進內皮細胞修復的優勢,而可吸收支架能解決金屬支架遠期體內殘留的問題,理論上兩者結合在促進內皮修復同時也避免了支架殘留問題,后續將進行外泌體洗脫可吸收支架細胞實驗及動物實驗,明確其應用可行性及有效性。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
作者貢獻聲明 王宸宸:研究實施、文章撰寫;李天博:參與支架相關檢測及評價;郭瑞敏、曹毓琳:參與外泌體相關檢測及使用指導;季慶輝、王江寧:參與研究設計、組織及指導
介入手術是治療動脈閉塞性疾病的有效方法之一[1] 。糖尿病患者因外周動脈閉塞疾病導致缺血,引發糖尿病足潰瘍并抑制創面愈合,重建閉塞動脈是促進創面愈合的主要治療方法 [2-7]。當術中重建閉塞動脈后,管腔殘余狹窄和限流性夾層的出現是植入動脈支架的常見指征[8]。既往臨床主要采用裸金屬支架,但是存在支架內再狹窄等問題,近年來逐漸被藥物涂層支架替代[9]。但是,藥物涂層支架的金屬部分長期殘留在血管內,會引發慢性持續性異物炎癥反應[10],同時殘存的支架給二次手術帶來很大困難,為此學者們提出了可吸收支架[11-12]。
外泌體是含有多種生物活性的細胞外囊泡,研究發現MSCs來源外泌體包含多種生物活性物質,對組織有修復作用[13-15]。Hu等[16]的研究顯示外泌體可以負載于金屬支架表面。考慮到金屬支架長期殘留問題,我們在上述研究基礎上,探討一種將外泌體負載于可吸收支架的方法,制備外泌體洗脫可吸收支架,并對其進行相關檢測。
1 材料與方法
1.1 主要試劑與儀器
人臍帶MSCs來源外泌體(北京唐頤生物醫學技術研究院有限公司),粒徑90~220 nm、濃度1.0×1011粒子/mL,蛋白濃度8~20 μg/μL,保存于生理鹽水中。聚乳酸可吸收支架,外徑為(5.0±0.5)mm(北京阿邁特醫療器械有限公司)。無水乙醇、王水、氨丙基三乙氧基硅烷 [(3-aminopropyl)triethoxysilane,APTES]、N-羥基琥珀酰亞胺(N-hydroxysuccinimide,NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽 [N-(3-dimethylamin opropyl)-N-ethylcarbodiimide hydrochloride,EDC·HCL]、二硬脂酰磷脂酰乙酰胺-聚乙二醇5000 {1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)5000],DSPE-PEG5000}、NaOH(北京伊諾凱科技有限公司);PBS(北京普利智誠生物技術有限公司)。
超聲波清洗機(深圳市潔盟清洗設備有限公司);集熱式恒溫磁力攪拌浴(鄭州長城科工貿有限公司);掃描電鏡(Zeiss公司,德國);原子力顯微鏡(Bruker公司,德國);飛行時間二次離子質譜儀(Ulvac-Phi公司,日本);體視顯微鏡(廈門麥克奧迪實業集團有限公司);徑向力測試儀(Blockwise公司,美國)。
1.2 外泌體洗脫可吸收支架構建方法
可吸收支架負載外泌體操作參考文獻 [16] 制備流程。具體流程如下:取聚乳酸可吸收支架片段,以無水乙醇和去離子水清洗后,于20℃條件下用王水活化支架表面5 min,去離子水沖洗3次并晾干;置于1 mol/L NaOH 于30℃水浴10 min后,去離子水沖洗3次并晾干;置于5%APTES乙醇溶液中,在搖床20℃條件下浸泡5 h,去離子水沖洗,儲存于純水中過夜;取出支架置于1 mol/L NHS,在搖床20℃條件下孵育10~20 min,進一步加入等量1 mol/L EDC·HCL,繼續孵育10~20 min;取出支架,用去離子水沖洗后,與DSPE-PEG5000溶液在搖床20℃條件下反應8~10 h,使DSPE-PEG5000與支架上的APTES結合;取出支架用去離子水沖洗后,保存于去離子水過夜;最后將結合DSPE-PEG5000的支架浸泡在常溫解凍后的外泌體溶液中,在搖床20℃條件下結合8~10 h,PBS沖洗后獲得外泌體洗脫可吸收支架,于4℃條件下PBS保存。見圖1。
 圖1
可吸收支架負載外泌體流程示意圖
Figure1.
Schematic diagram of the process for loading exosomes onto absorbable stents
圖1
可吸收支架負載外泌體流程示意圖
Figure1.
Schematic diagram of the process for loading exosomes onto absorbable stents
1.3 觀測指標
1.3.1 掃描電鏡觀察
剪取適當大小外泌體洗脫可吸收支架樣品,經干燥噴金處理后,掃描電鏡下觀察支架表面情況及外泌體吸附情況。以單純可吸收支架作為對照。
1.3.2 原子力顯微鏡觀測
剪取適當大小外泌體洗脫可吸收支架樣品,干燥后固定于樣品臺上,應用輕敲模式設定5 μm2取樣范圍,檢測支架表面粗糙程度。以單純可吸收支架作為對照。實驗重復3次。
1.3.3 飛行時間質譜檢測
剪取適當大小外泌體洗脫可吸收支架樣品,干燥后固定于飛行時間二次離子質譜儀樣品板上,對支架表面物質進行鑒定。另取單純可吸收支架、外泌體行相同檢測,作為對照。
1.3.4 體視顯微鏡觀察
將外泌體洗脫可吸收支架干燥后,體視顯微鏡下旋轉1周觀察支架外觀,可接受標準為支架表面光潔,無裂痕、毛刺、凹陷。然后選取1點為0° 測外徑,將選取點旋轉90° 后再次測量外徑,實驗重復3次。測量結果與原可吸收支架外徑范圍(5.0±0.5)mm進行比較。
1.3.5 徑向強度檢測
將徑向力測試儀預熱至37℃后,將外泌體洗脫可吸收支架樣品置入其中,以0.5 mm/s速度壓縮支架至支架初始直徑60%,取支架直徑變化15%范圍內出現塑性形變的最大壓強值。可接受標準為徑向強度≥200 mm Hg(1 mm Hg=0.133 kPa)。實驗重復3次。
2 結果
2.1 掃描電鏡觀察
掃描電鏡觀察示,與可吸收支架相比,外泌體洗脫可吸收支架表面可見大量顆粒狀物體,粒徑為90~220 nm,與外泌體粒徑一致,表面還分布有細小不規則裂紋(圖2)。
 圖2
掃描電鏡觀察
圖2
掃描電鏡觀察
從左至右分別為放大500、1 000、10 000倍 a. 可吸收支架;b. 外泌體洗脫可吸收支架
Figure2. Scanning electron microscopy observationFrom left to right for magnified by 500, 1 000, and 10 000 times a. Absorbable stents; b. Exosome-eluting absorbable stents
2.2 原子力顯微鏡觀測
在5 μm2取樣范圍,可吸收支架表面粗糙程度為 ±20 nm,外泌體洗脫可吸收支架為 ±70 nm(圖3)。
 圖3
原子力顯微鏡觀察
圖3
原子力顯微鏡觀察
a. 可吸收支架;b. 外泌體洗脫可吸收支架
Figure3. Atomic force microscope observationa. Absorbable stents; b. Exosome-eluting absorbable stents
2.3 飛行時間質譜檢測
可吸收支架在正離子結果中有C3H5O2+(m/z 73)的峰值,外泌體有C6H9+(m/z 81)的峰值,外泌體洗脫可吸收支架m/z 81處有峰值、m/z 73處峰值相對可吸收支架降低。3種材料離子計數組間比較見圖4。
 圖4
m/z 73及m/z 81處3種材料離子計數比較結果
Figure4.
Comparison of ions counts for three materials at m/z 73 and m/z 81, respectively
圖4
m/z 73及m/z 81處3種材料離子計數比較結果
Figure4.
Comparison of ions counts for three materials at m/z 73 and m/z 81, respectively
2.4 體視顯微鏡觀察
體視顯微鏡下觀察外泌體洗脫可吸收支架表面光潔,無裂痕、毛刺、凹陷,支架外徑在原可吸收支架合格范圍內。見圖5。
 圖5
體視顯微鏡觀察支架外觀及直徑(×30)
Figure5.
Appearance and diameter of the stents observed by stereomicroscope (×30)
圖5
體視顯微鏡觀察支架外觀及直徑(×30)
Figure5.
Appearance and diameter of the stents observed by stereomicroscope (×30)
2.5 徑向強度檢測
外泌體洗脫可吸收支架符合原可吸收支架徑向強度≥200 mm Hg的檢測標準。
3 討論
本研究成功構建外泌體洗脫可吸收支架,掃描電鏡示支架表面較平整,制作流程未過度損傷支架表面,同時表面有符合外泌體大小的顆粒。飛行時間質譜檢測結果顯示,外泌體和外泌體洗脫可吸收支架的正離子結果中均出現C6H9+(m/z 81)的峰值,在可吸收支架中并未出現。C6H9+(m/z 81)是脂質特征離子[17],而外泌體是細胞產生的囊泡,囊泡由細胞膜包裹,脂質雙分子層是細胞膜的主要結構。這表明外泌體洗脫可吸收支架表面結合的是外泌體,而非其他物質。外泌體洗脫可吸收支架在m/z 73處峰值相對可吸收支架明顯降低,分析為外泌體在支架表面形成遮蓋導致。掃描電鏡下可見支架表面存在細小裂紋,為此我們進一步對支架表面行原子力顯微鏡檢測,結果表明在5 μm2取樣范圍下,表面粗糙程度從可吸收支架的 ±20 nm增加至 ±70 nm,粗糙程度仍在納米級別。由此可見即使在支架表面負載外泌體后,對支架直徑的改變仍非常微小,不會過度改變支架形態,從而避免因過度改變支架內局部血流動力學導致支架內血栓形成[18-19]。徑向強度是提供支架支撐能力的重要指標[20],我們參照行業標準[21]檢測了外泌體洗脫可吸收支架徑向強度,結果顯示其仍≥200 mm Hg,表示該支架仍可提供足夠支撐能力,符合可吸收支架合格標準。
為解決金屬支架植入后長期血管內殘留導致慢性炎癥及限制再手術等問題,本研究首次提出用可吸收支架代替金屬支架與外泌體結合,初步探索出一個外泌體洗脫可吸收支架的制備流程,并進行相關表征檢測,驗證了外泌體與可吸收支架結合的可行性,為下一步檢測外泌體洗脫可吸收支架的生物活性及治療效果奠定基礎。后續將開展藥物濃度、時間、溫度等處理條件的對比實驗,探索最佳制備流程。此外,外泌體較紫杉醇等藥物涂層有促進內皮細胞修復的優勢,而可吸收支架能解決金屬支架遠期體內殘留的問題,理論上兩者結合在促進內皮修復同時也避免了支架殘留問題,后續將進行外泌體洗脫可吸收支架細胞實驗及動物實驗,明確其應用可行性及有效性。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
作者貢獻聲明 王宸宸:研究實施、文章撰寫;李天博:參與支架相關檢測及評價;郭瑞敏、曹毓琳:參與外泌體相關檢測及使用指導;季慶輝、王江寧:參與研究設計、組織及指導