引用本文: 張靜, 張瀟月, 江琪, 曲迪, 胡羽生, 戚超, 付海濤. M2型小膠質細胞移植促進小鼠脊髓損傷修復的實驗研究. 中國修復重建外科雜志, 2024, 38(2): 198-205. doi: 10.7507/1002-1892.202311093 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
脊髓損傷(spinal cord injury,SCI)是嚴重中樞神經系統損傷疾病,主要包括血管破裂、血脊髓屏障在內的原發性損傷和一系列細胞及分子反應引起的繼發性損傷[1]。由于SCI進展復雜及神經通路自我修復能力有限,目前尚無理想治療方法。細胞移植是近年用于SCI治療的新方法,移植后的細胞可通過自我分化以及免疫調節功能改善損傷區域微環境,修復/替代受損神經組織或分化為具有活力的神經元以重建神經網絡[2],進而改善多因素導致的SCI后興奮毒性、神經元損傷以及膠質瘢痕組織形成等問題[3]。此外,移植細胞來源神經元衍生的軸突可以橋接脊髓斷端[4],重新構建神經元回路并恢復運動和感覺功能。目前,用于SCI治療的細胞分離方案較多,常用細胞類型有MSCs[5-6]、膠質細胞[7]、嗅鞘細胞[8]、雪旺細胞[9-10],植入體內后發揮調節局部微環境、營養支持、恢復受損細胞穩態、神經保護以及將神經炎癥水平調節至更有益狀態等作用。
小膠質細胞(microglia,MG)是中樞神經系統中的先天免疫細胞[11],再生能力強,即使在無炎癥的中樞神經系統中也能迅速增殖,并在7 d內恢復至正常密度[12]。如果MG可以移植至SCI損傷部位并發揮神經保護作用,那么中樞神經系統將獲得充足的“治療來源”。研究顯示MG在內源性或病理信號影響下,可以轉化分裂成眾多亞型,包括經典活化的促炎表型(M1)、交替活化的抗炎表型(M2a和M2b)和獲得性失活表型(M2c)[13]。MG在SCI后迅速活化,其中M1-MG表達IL-1β、IL-6、IL-12、TNF-α等細胞因子,招募炎癥細胞導致原發性機械損傷后的進一步損傷[14]。相反,M2-MG可分泌IL-4、IL-10、IGF-1和TGF-β等抗炎細胞因子或趨化因子抑制過度炎癥反應,促進傷口愈合[15]。IL-4 是巨噬細胞M2亞型增殖信號,已有研究證明在成年小鼠腦內注射重組IL-4可明顯增強M2-MG基因表達[16]。將通過這種方法誘導獲得的M2-MG移植到SCI小鼠體內,可以有效促進小鼠運動功能恢復[17]。
SCI后損傷區域星形膠質細胞顯著增生并形成膠質瘢痕,阻礙軸突再生。研究表明損傷區附近的星形膠質細胞具有A1、 A2 型,分別發揮促炎效應和神經保護功能[18-20]。因此,從理論上分析抑制星形膠質細胞向A1型轉化對改善SCI后的功能恢復具有重要價值。本研究旨在利用IL-4體外誘導MG分化為M2亞型,并用于小鼠SCI損傷區域,評估其對神經元軸突再生和神經功能恢復的影響及其作用機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
6周齡雌性C57BL/6小鼠42只,體質量15~18 g,由濟南杰瑞康生物科技有限公司提供。新生2~3 d C57BL/6乳鼠15只,雌雄不限,體質量1.5~2.0 g;新生1周C57BL/6乳鼠5只,雌雄不限,體質量5.5~6.0 g;均由本課題組自行繁育。動物實驗操作按照青島大學附屬醫院實驗動物護理使用指南進行,實驗前小鼠在控制條件下正常喂養7 d以適應環境。
偶聯 Alexa Fluor 山羊抗兔二抗、偶聯 Alexa Fluor 山羊抗鼠二抗、山羊抗鼠Iba1抗體以及山羊抗兔抗精氨酸酶 1(Arginase 1,Arg-1)、膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)、神經元核抗原(neuronal nuclei antigen,NeuN)、C3抗體(Abcam公司,美國);多聚賴氨酸、重組小鼠IL-4(Sigma公司,美國);FBS(GIBCO公司,美國);DMEM/F12培養基、 DMEM 培養基(HyClone 公司,美國)。
相差顯微鏡(上海巴拓儀器有限公司);熒光顯微鏡(Leica 公司,德國);體視顯微鏡、腦立體定位儀、Nanoject Ⅲ微量注射泵、小動物麻醉機(深圳市瑞沃德生命科技有限公司);Transwell培養板(Corning公司,美國);超速離心管、超速離心機(Beckman 公司,美國);脊髓夾傷鑷(Fine Science Tools公司,英國)。
1.2 細胞培養及鑒定
1.2.1 MG提取及鑒定
取15只新生2~3 d C57BL/6乳鼠置于75%乙醇浸泡15 min后,使用眼科剪剪下乳鼠頭部獲取腦組織,體視顯微鏡下用鑷子取大腦皮質,置于0.25%胰蛋白酶消化10 min,以含15%FBS的DMEM/F12培養基重懸,將單細胞懸液通過100 μm細胞篩網,以離心半徑10 cm,1 000 r/min離心5 min。置于37℃、5%CO2培養箱中培養14 d,于搖床以200 r/min震蕩2 h,收集脫落的MG置于25 cm2細胞培養瓶,相差顯微鏡下觀察細胞形態,繼續培養待細胞生長至80%~90%密度時,進行Iba1免疫熒光染色鑒定其純度。熒光顯微鏡下Iba1呈綠色熒光,DAPI呈藍色熒光,兩者重合部分為陽性細胞,當細胞純度達80%時提示培養細胞為MG。
1.2.2 M2-MG誘導培養及鑒定
取生長狀態穩定的MG接種于6孔板,每孔6×105個細胞,隨機分為兩組,每組3個復孔。實驗組、對照組分別以含20 ng/mL IL-4的DMEM培養基、單純DMEM培養基于37℃、5%CO2培養箱中培養。培養48 h后于相差顯微鏡下觀察細胞形態變化及生長情況,并行Arg-1、Iba1免疫熒光染色。首先4%多聚甲醛固定細胞30 min;室溫封閉30 min,與Arg-1、Iba1一抗4℃孵育過夜,復溫后與偶聯 Alexa Fluor 山羊抗兔二抗、偶聯 Alexa Fluor 山羊抗鼠二抗共孵育1 h,PBS洗滌后加入 DAPI 復染。熒光顯微鏡下觀察,細胞誘導為M2型后Arg-1染色呈強綠色熒光,使用Image J軟件半定量分析Arg-1、Iba1熒光強度。
1.3 背根神經節(dorsal root ganglion,DRG)培養及與M2-MG共培養觀測
將5只新生1周C57BL/6乳鼠置于75%乙醇浸泡15 min,然后沿背部中線縱行切開脊柱,取長約1 cm的胸腰段脊柱。于體視顯微鏡下摘取兩側DRG,置于含10%FBS的DMEM培養基中,用顯微鑷完整剝除其外膜后,接種于Transwell培養板下層。用含10%FBS的DMEM培養基重懸1.2.2中獲得的M2-MG后,接種于培養板上層與DRG共培養作為實驗組(M2-MG+DRG組);以上層未添加M2-MG培養的DRG作為對照組(DRG組)。DRG及M2-MG接種密度均為3×104個/cm2。置于37℃、5%CO2培養箱中培養5 d后,相差顯微鏡下觀察DRG軸突生長情況,隨機取3個DRG采用Image J軟件分別測量對應4個象限中3根最長軸突的長度,取均值。
1.4 動物實驗
1.4.1 實驗分組及方法
取42只6周齡C57BL/6小鼠隨機分為假手術組(n=6)、SCI組(n=18)及SCI+M2-MG組(n=18)。所有小鼠腹腔注射5%水合氯醛(1 mL/200 g)麻醉后,作背部正中縱形切口暴露T10節段脊柱,假手術組僅切除椎板,SCI組及SCI+M2-MG組行SCI造模,采用脊髓夾傷鑷鉗夾T10節段脊髓3 s,確保夾傷時脊髓被全部覆蓋。以夾傷過程中小鼠后肢明顯抽搐,蘇醒后雙下肢完全癱瘓且無踝關節活動,作為判斷造模成功標準。SCI+M2-MG組在造模成功后立即行M2-MG移植,具體方法:連接微量注射泵的玻璃微電極與腦立體定位儀,生理鹽水沖洗SCI部位以獲得清晰視野,玻璃微電極吸取2 μL M2-MG細胞懸液(約1×105個細胞)后插入損傷區域,以3 nL/s速度注射15 min。術后各組每天人工按摩小鼠膀胱2次,促進排尿、排便,直至重新建立自主排尿功能。
1.4.2 觀測指標
① 行為學檢測:術后觀測各組小鼠存活以及后肢功能恢復情況。 術后當天(0)、3、7、14、21、28 d,各組取3只小鼠采用 BMS(Basso Mouse Scale)評分評價運動功能恢復情況,總分為9分,評分從高到低表示由完全正常逐漸向完全癱瘓過渡。術后28 d行足跡實驗評價小鼠步態,如足跡間隔均勻、足跡軌跡連續和穩定提示步態協調。
② 免疫熒光染色觀察:術后7、14、28 d,SCI組、SCI+M2-MG組各取3只小鼠進行觀測。各組同上法麻醉后,通過心臟持續灌注10倍濃度冷PBS,待肝臟從紅色變為灰白色后,改為注入4%多聚甲醛,待小鼠抽搐停止后迅速分離脊柱,取出T7~9節段脊柱置于4% 多聚甲醛、4℃固定過夜。體視顯微鏡下剝離脊髓后置于30%蔗糖溶液中,于4℃脫水24 h;冠狀位切片,片厚25 μm;采用封閉液在常溫下封閉2 h,PBS洗滌后與GFAP、C3和NeuN一抗在4℃下孵育過夜,復溫后與對應二抗孵育2 h并進行DAPI核染色,熒光顯微鏡下觀察。取7、14、28 d GFAP染色(綠色熒光)切片觀察SCI損傷區域,28 d NeuN染色(綠色熒光)切片觀察神經元存活情況,7、14 d GFAP/C3雙重染色(綠色/紅色熒光)切片觀察A1星形膠質細胞變化。各組隨機選擇3個視野,使用 Image J圖像分析軟件對存活神經元數量和A1星形膠質細胞(C3+/GFAP+細胞)進行計數,計算C3+/GFAP+細胞百分比,并測量SCI損傷區域面積,取均值。
1.5 統計學方法
采用 SPSS22.0統計軟件進行分析。計量資料行Shapiro-Wilk正態性檢驗,均符合正態分布,以均數±標準差表示。體外實驗中Iba1、Arg-1熒光強度及軸突長度比較采用獨立樣本t檢驗。動物實驗中BMS評分采用重復測量方差分析,若不滿足球形檢驗,采用Greenhouse-Geisser 進行校正,同一組別不同時間點間比較采用 Bonferroni 法,同一時間點不同組別間比較采用多因素方差分析;熒光染色測量結果組間比較采用單因素方差分析或獨立樣本t檢驗,兩兩比較采用SNK檢驗。檢驗水準 α=0.05。
2 結果
2.1 細胞培養及鑒定
2.1.1 MG鑒定
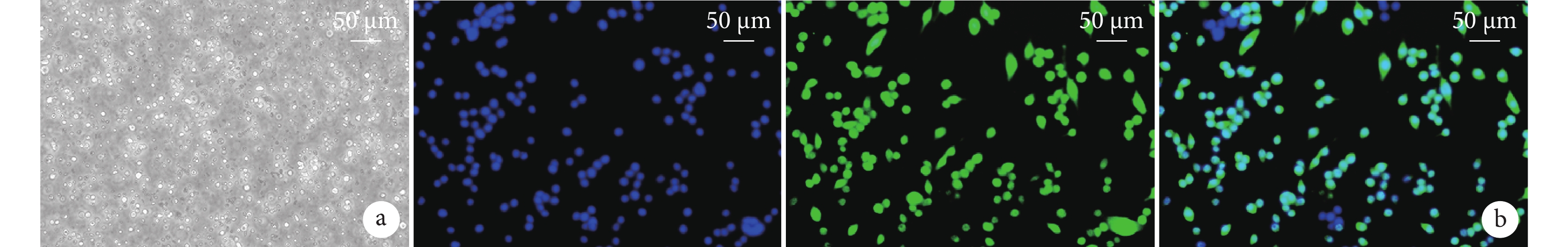
MG體外培養14 d后,相差顯微鏡下見上層透亮,細胞呈圓形;熒光顯微鏡下Iba1陽性細胞呈綠色熒光,陽性率約為90%。上述結果提示培養細胞為MG。見圖1。
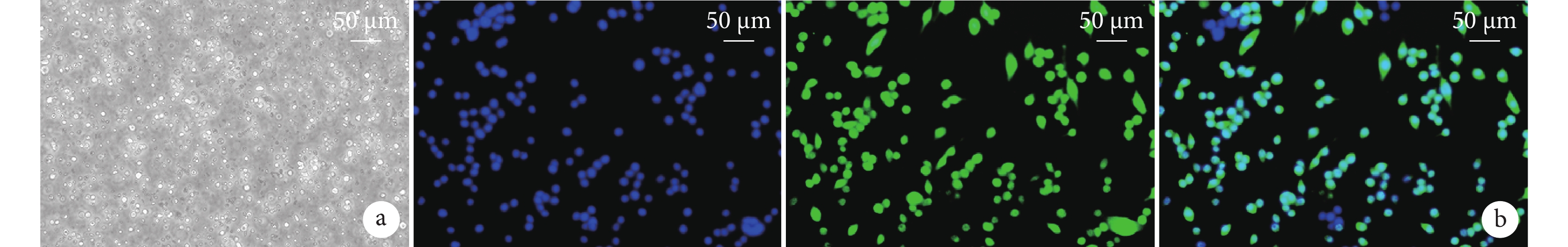 圖1
MG形態觀察及鑒定
圖1
MG形態觀察及鑒定
a. 培養14 d相差顯微鏡觀察細胞形態(×200);b. 免疫熒光染色觀察(熒光顯微鏡×200) 從左至右分別為DAPI染色、Iba1染色、重疊圖像
Figure1. Morphological observation and identification of MGa. Morphological observation after 14 days of culture under contrast microscope (×200); b. Immunofluorescence staining (Fluorescence microscope×200) From left to right for DAPI staining, Iba1 staining, and overlapping images, respectively
2.1.2 M2-MG鑒定
誘導培養48 h后,實驗組細胞形態以圓形為主,有少量形態不規則細胞,并出現一些偽足;對照組細胞也以圓形為主,但未見明顯不規則變化和偽足生成。免疫熒光染色觀察,兩組細胞Iba1、Arg-1均呈陽性染色,但染色強度存在差異。對照組及實驗組Iba1熒光強度分別為205.23±3.46、148.00±2.02,Arg-1熒光強度分別為105.54±1.71、179.42±2.18,差異均有統計學意義(t=8.252,P=0.001;t=15.400,P<0.001)。見圖2。鏡下細胞形態及免疫熒光染色結果表明實驗組細胞極化誘導為M2亞型。
 圖2
M2-MG形態觀察及鑒定
圖2
M2-MG形態觀察及鑒定
a. 實驗組(左)及對照組(右)細胞形態(相差顯微鏡×200);b. 實驗組(上)及對照組(下)免疫熒光染色觀察(熒光顯微鏡×200) 從左至右分別為Iba1染色、DAPI染色、Arg-1染色、重疊圖像
Figure2. Morphological observation and identification of M2-MGa. Cell morphology of experimental group (left) and control group (right) (Contrast microscope×200); b. Immunofluorescence staining of experimental group (top) and control group (bottom) (Fluorescence microscope×200) From left to right for Iba1 staining, DAPI staining, Arg-1 staining, and overlapping images, respectively
2.2 DRG與M2-MG共培養觀測
培養5 d后相差顯微鏡下見,兩組DRG細胞核周圍均有軸突伸出。M2-MG+DRG組軸突長度為(630.77±43.80)μm,明顯長于DRG組(318.14±20.63)μm,差異有統計學意義(t=21.700,P<0.001),見圖3。
 圖3
相差顯微鏡觀察DRG軸突(×50)
圖3
相差顯微鏡觀察DRG軸突(×50)
a. M2-MG+DRG組;b. DRG組
Figure3. DRG axons observation under contrast micorscope (×50)a. M2-MG+DRG group; b. DRG group
2.3 動物實驗
2.3.1 行為學檢測
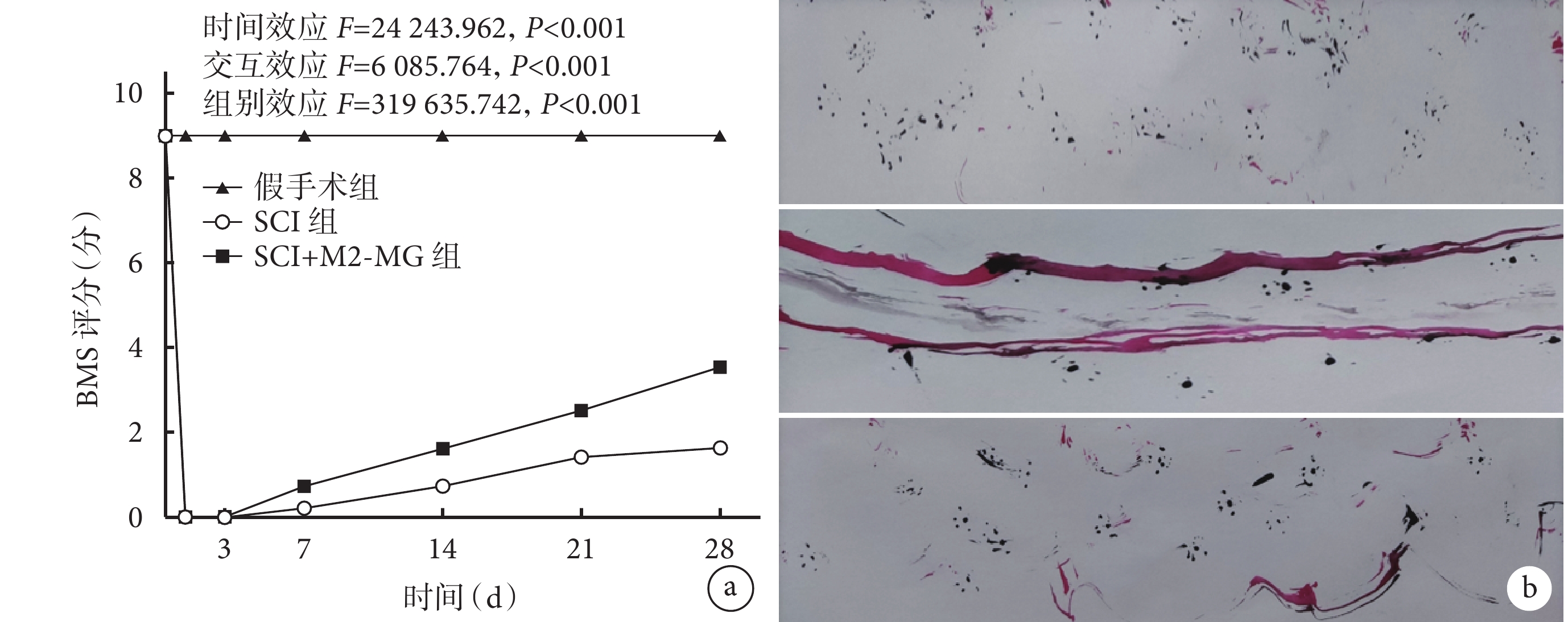
術后各組小鼠均存活至實驗完成,手術部位未發生感染等癥狀。假手術組小鼠術后后肢功能無異常;SCI組及SCI+M2-MG組小鼠術后早期后肢運動功能差,隨時間延長逐漸恢復。與SCI組相比,SCI+M2-MG組術后0、3、7、14 d BMS評分差異無統計學意義(P>0.05),但術后21、28 d評分升高且差異有統計學意義(P<0.05)。
足跡實驗示,術后28 d SCI+M2-MG組小鼠有拖拽步態,相較假手術組運動功能差;但拖曳步態較SCI組明顯減輕,且出現足跡間隔,提示運動功能得到改善。見圖4。
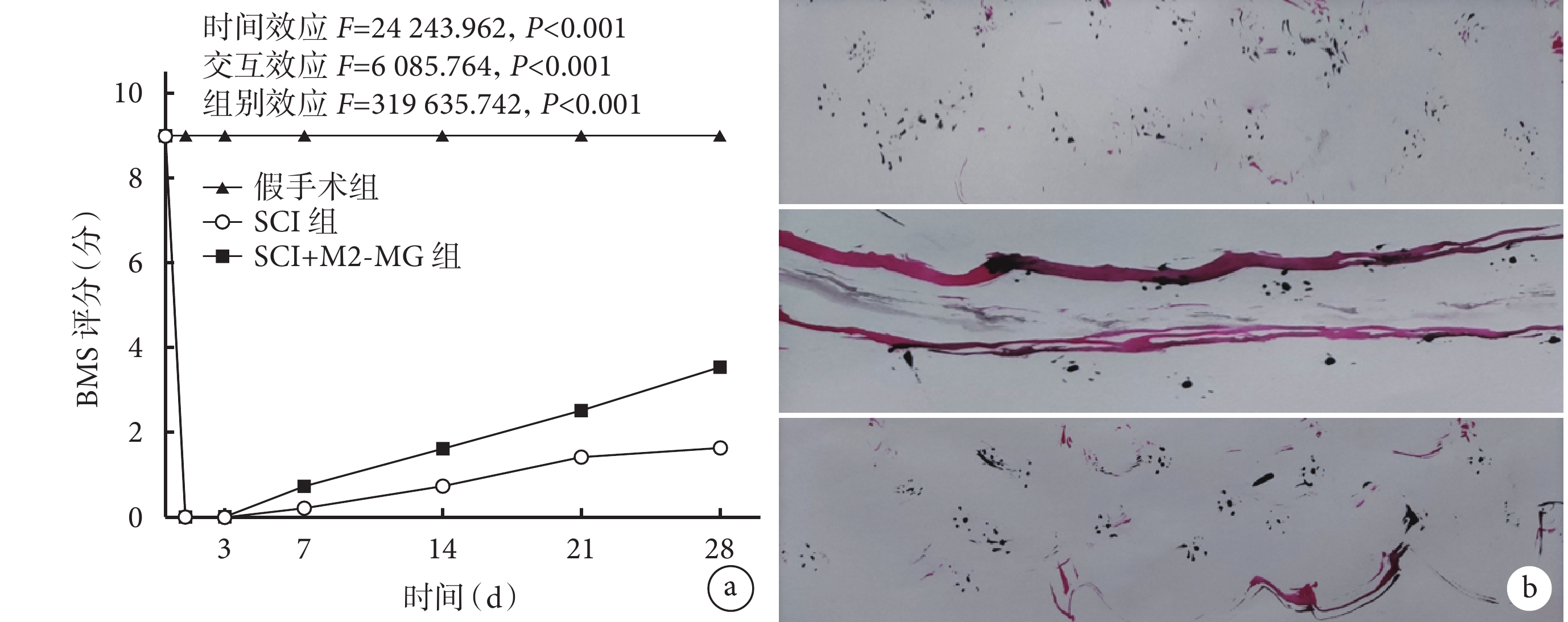 圖4
3組小鼠行為學檢測
圖4
3組小鼠行為學檢測
a. BMS評分變化趨勢;b. 術后28 d足跡實驗 從上至下分別為假手術組、SCI組、SCI+M2-MG組
Figure4. Behavioral tests of mice in 3 groupsa. Change trends of BMS scores after operation; b. The footprint experiment at 28 days after operation From top to bottom for sham group, SCI group, and SCI+M2-MG group, respectively
2.3.2 免疫熒光染色觀察
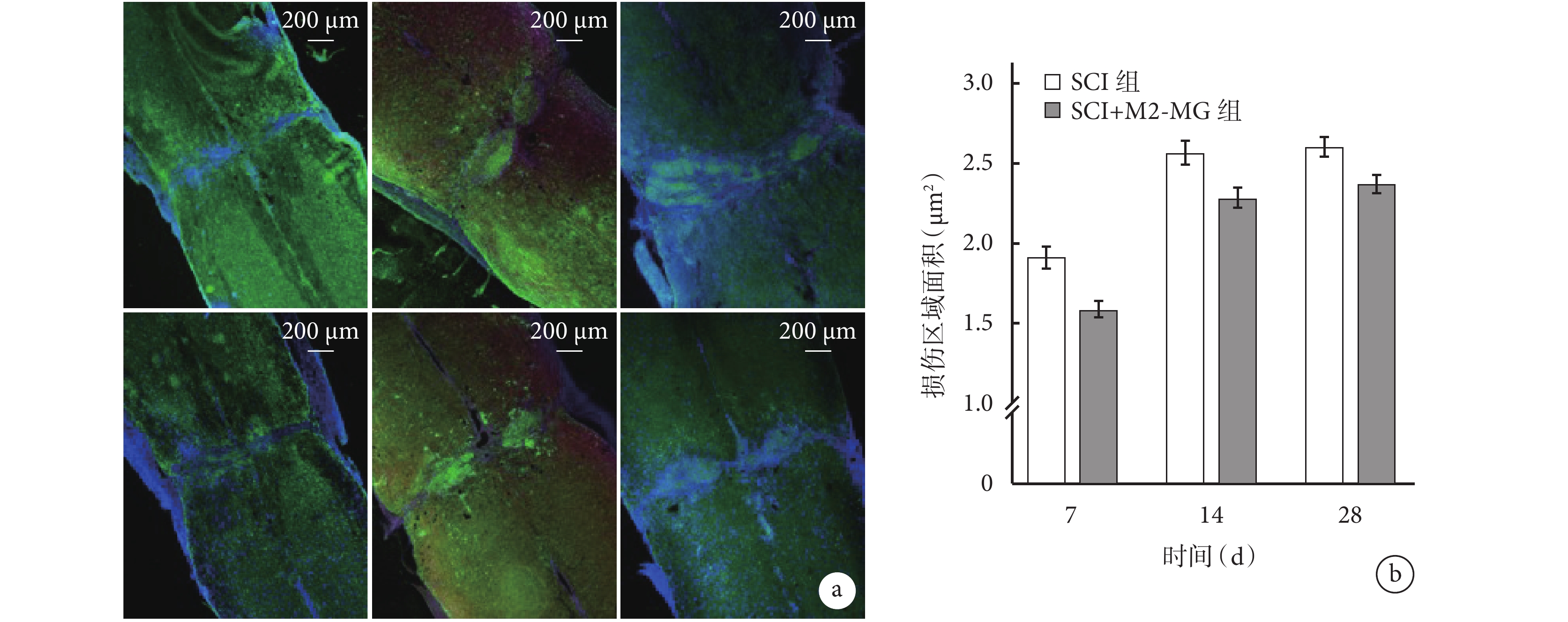
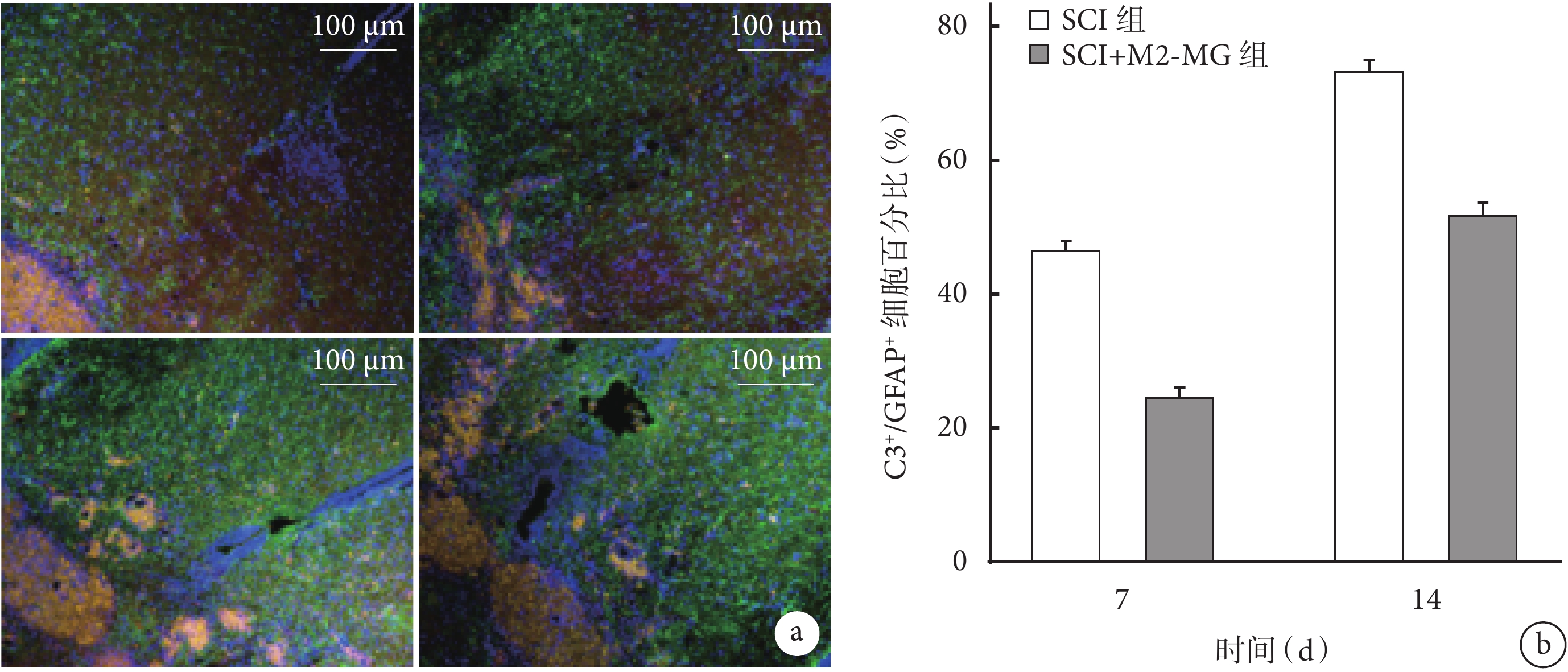
① GFAP染色:術后SCI組、SCI+M2-MG組損傷部位出現明顯膠質瘢痕邊界,且病變范圍隨時間延長逐漸擴大。圖像分析示,術后7、14、28 d SCI+M2-MG 組損傷區域面積均低于SCI組,差異有統計學意義(P<0.05)。見圖5。
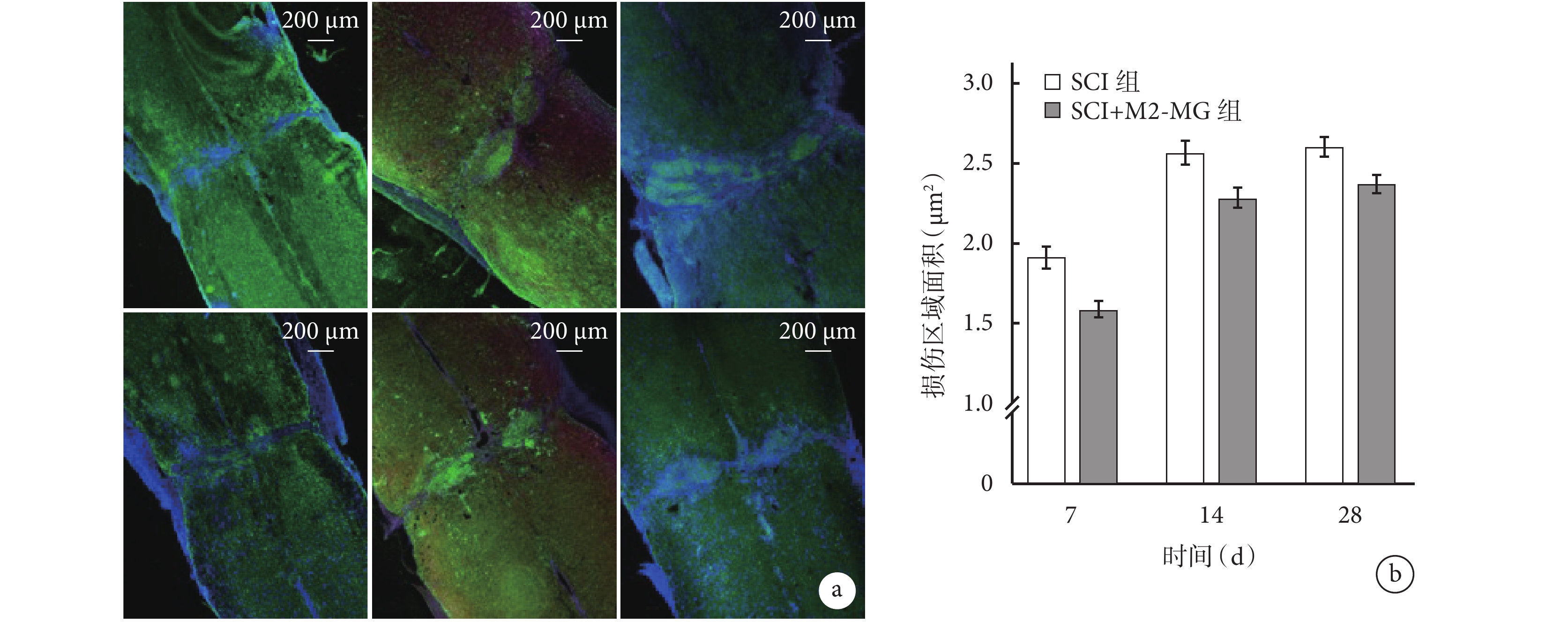 圖5
各組GFAP免疫熒光染色觀測
圖5
各組GFAP免疫熒光染色觀測
a. SCI組(上)、SCI+M2-MG組(下)熒光顯微鏡下觀察(×50) 從左至右分別為術后7、14、28 d;b. 各組術后7、14、28 d損傷區域面積
Figure5. GFAP immunofluorescence staining of each groupa. Fluorescence microscope observation (×50) of SCI group (top) and SCI+M2-MG group (bottom) From left to right for 7, 14, and 28 days, respectively; b. The size of injury area in each group at 7, 14, and 28 days, respectively
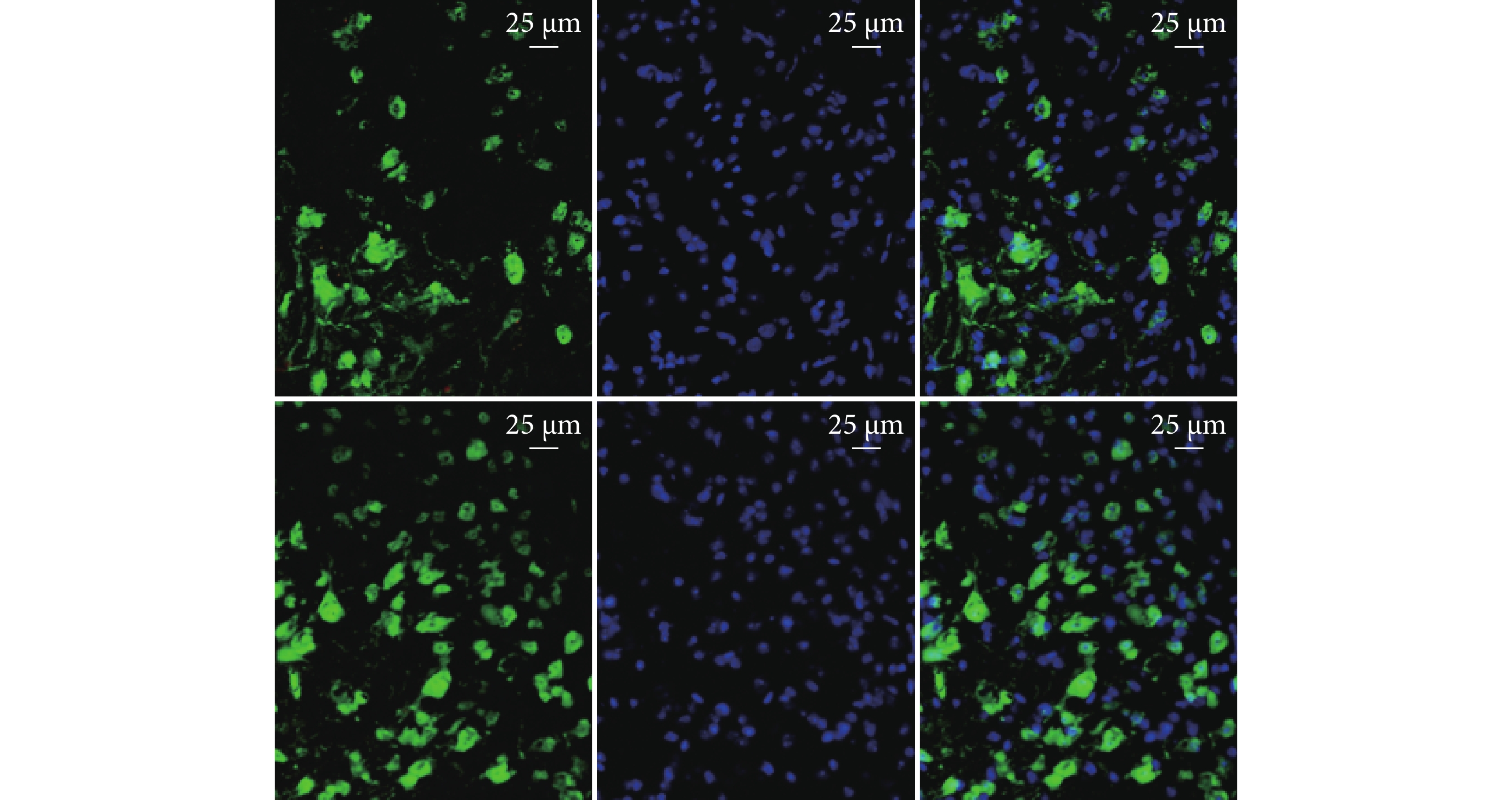
② NeuN染色:術后28 d, SCI+M2-MG 組神經元存活數量為(2 029±147)個/mm2,較SCI組(1 058±147)個/mm2明顯增多,差異有統計學意義(t=5.280,P=0.006)。 見圖6 。
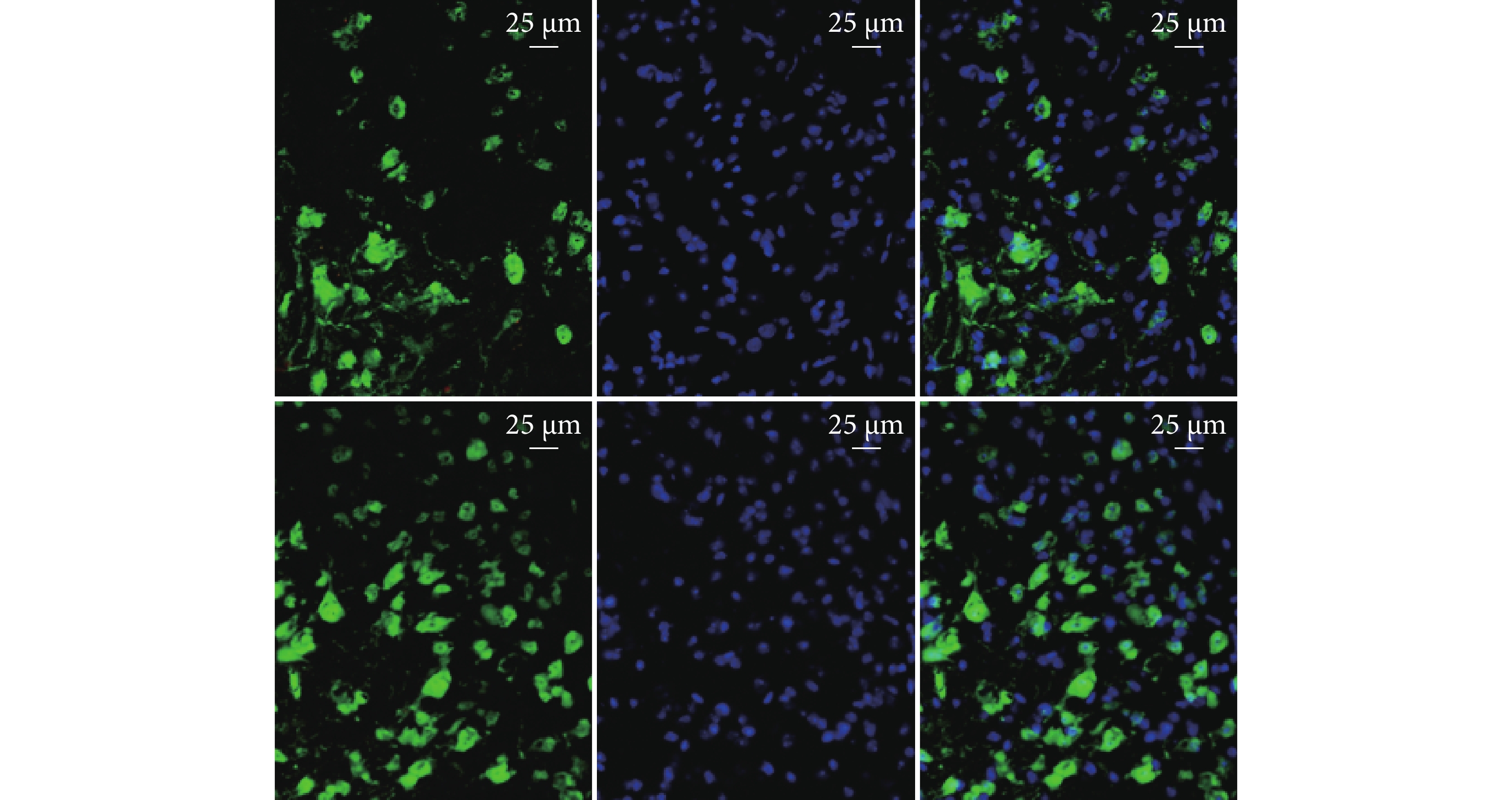 圖6
SCI組(上)、SCI+M2-MG組(下)NeuN免疫熒光染色觀測(熒光顯微鏡×400)
圖6
SCI組(上)、SCI+M2-MG組(下)NeuN免疫熒光染色觀測(熒光顯微鏡×400)
從左至右分別為NeuN染色、DAPI染色、重疊圖像
Figure6. NeuN immunofluorescence staining of SCI group (top) and SCI+M2-MG group (bottom) (Fluorescence microscope×400)From left to right for NeuN staining, DAPI staining, and overlapping images, respectively
③ GFAP/C3雙重染色:術后兩組均可見GFAP綠色熒光及C3紅色熒光表達,其中C3紅色熒光隨時間延長表達逐漸增強。但與SCI組相比,SCI+M2-MG組在術后7、14 d 時A1星形膠質細胞的特異性蛋白C3表達強度降低,C3+/GFAP+ 細胞百分比降低,差異有統計學意義(P<0.05)。見圖7。
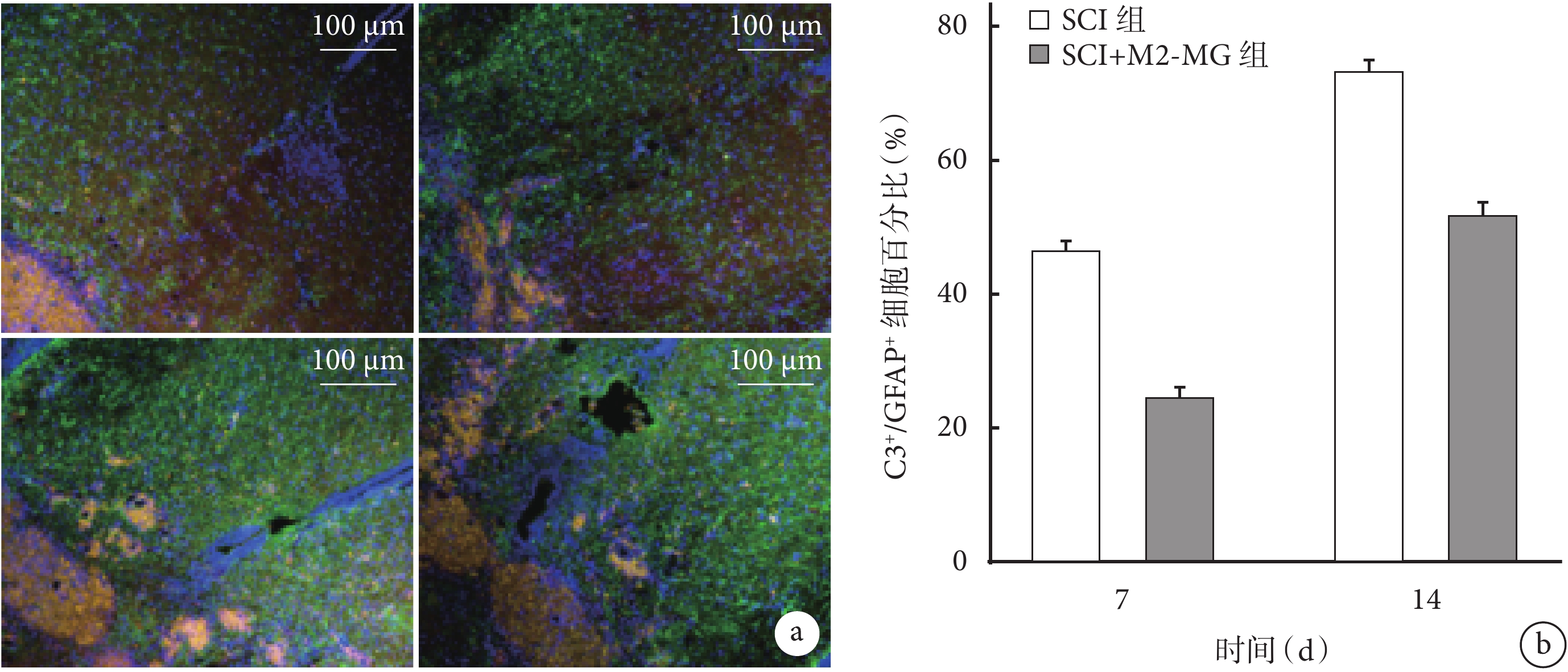 圖7
各組GFAP/C3雙重免疫熒光染色觀測
圖7
各組GFAP/C3雙重免疫熒光染色觀測
a. SCI組(上)、SCI+M2-MG組(下)熒光顯微鏡下觀察(×100) 從左至右分別為7、14 d;b. 各組C3+/GFAP+細胞百分比
Figure7. GFAP/C3 double immunofluorescence staining in each groupa. Fluorescence microscope observation (×100) of SCI group (top) and SCI+M2-MG group (bottom) From left to right for 7 and 14 days, respectively; b. Percentage of C3+/GFAP+ cells in each group
3 討論
MG起源于胚胎卵黃囊,相較于其他神經細胞具有強大再生能力,是其優于其他細胞的特性之一。此外,MG發生活化閾值很低[21],可以在SCI損傷后30 min內迅速激活,與神經元、其他膠質細胞及進入中樞神經系統的外周免疫細胞相互影響。MG通過合成趨化因子和細胞因子對周圍其他神經細胞進行調節,使其成為同類保護性/破壞性分子,進而減小或加重SCI因膠質瘢痕形成、神經元死亡以及免疫浸潤導致軸突再生的難度[21-22]。在SCI損傷后早期,MG通過增強吞噬活性,加速清除刺激物和細胞碎片發揮抗炎作用[23];同時刺激周圍其他神經細胞響應,為損傷區提供一種細胞保護和修復反應[24],而這種神經修復的積極作用和M2亞型出現有關。在受到持續刺激后,隨著M2亞型消散以及M1亞型的持續活化,MG分泌的炎癥因子擴散并激活下游免疫反應[25],表現促炎效應。Kigerl等[26] 的研究證明體外培養獲得的M2-MG條件培養基可以促進受傷小鼠脊髓神經再生。因此,有效獲取M2-MG并將其移植至SCI損傷部位,可能是研究SCI治療方法的重要方向之一。
本研究以小鼠作為SCI動物模型,采用損傷部位原位注射方法移植細胞。選擇該移植方法主要基于以下原因:首先,全身靜脈或尾靜脈注射移植時,移植細胞需要通過血腦屏障才能到達SCI損傷部位,導致移植細胞損失;其次,靜脈注射可能對其他組織器官產生副作用;最后,有研究顯示原位注射移植對脊髓造成的損傷可能比靜脈給藥更大[17],如需注射細胞較多時,往往需要多次注射,造成較大損傷。考慮本研究所需細胞較少,對注射部位造成的損傷小,所以相較靜脈注射效果更好。
本研究結果顯示M2-MG移植治療后,SCI小鼠后肢活動度、步態協調性均改善,術后 SCI+M2-MG組損傷區域面積較SCI組顯著減小,免疫熒光染色顯示類似神經保護結果,存活的神經元數量增多。此外,我們通過在體外培養DRG驗證了M2-MG具有促軸突生長作用,這可能與其分泌的促生長因子有關。C3蛋白是A1星形膠質細胞標志物,該細胞失去了正常星形膠質細胞的形態和功能,是SCI后膠質瘢痕的重要組成成分,具有一定神經毒性并引發神經元死亡[27]。為了進一步驗證M2-MG是否通過調節星形膠質細胞活化發揮神經保護作用,我們進行了GFAP/C3雙重染色。結果顯示SCI+M2-MG組小鼠 A1星形膠質細胞標志物C3蛋白表達降低,提示M2-MG抑制SCI后A1星形膠質細胞活化。
綜上述,M2-MG移植對小鼠SCI損傷區域神經組織產生了積極影響,該促進作用可能與A1星形膠質細胞活化被抑制相關。但本研究仍存在一定不足,如MG表型在M1促炎損傷與M2抗炎修復之間轉換,但移植后細胞是否一直保持移植時表型還是部分發生了表型改變,還需要通過更嚴謹的細胞測序手段驗證。此外,M2-MG移植有可能改變了損傷區域的整體炎癥狀態,從而提供了一個促進脊髓愈合的環境,但有待進一步研究明確。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經青島大學附屬醫院醫學倫理委員會批準(QYFY WZLL 2812);實驗動物使用許可證號:SYXK(魯)20200009
作者貢獻聲明 張靜、江琪、曲迪:研究實施、數據分析;張瀟月、胡羽生:數據收集及整理、圖片繪制;戚超、付海濤:研究設計及對文章知識性內容作批評性審閱
脊髓損傷(spinal cord injury,SCI)是嚴重中樞神經系統損傷疾病,主要包括血管破裂、血脊髓屏障在內的原發性損傷和一系列細胞及分子反應引起的繼發性損傷[1]。由于SCI進展復雜及神經通路自我修復能力有限,目前尚無理想治療方法。細胞移植是近年用于SCI治療的新方法,移植后的細胞可通過自我分化以及免疫調節功能改善損傷區域微環境,修復/替代受損神經組織或分化為具有活力的神經元以重建神經網絡[2],進而改善多因素導致的SCI后興奮毒性、神經元損傷以及膠質瘢痕組織形成等問題[3]。此外,移植細胞來源神經元衍生的軸突可以橋接脊髓斷端[4],重新構建神經元回路并恢復運動和感覺功能。目前,用于SCI治療的細胞分離方案較多,常用細胞類型有MSCs[5-6]、膠質細胞[7]、嗅鞘細胞[8]、雪旺細胞[9-10],植入體內后發揮調節局部微環境、營養支持、恢復受損細胞穩態、神經保護以及將神經炎癥水平調節至更有益狀態等作用。
小膠質細胞(microglia,MG)是中樞神經系統中的先天免疫細胞[11],再生能力強,即使在無炎癥的中樞神經系統中也能迅速增殖,并在7 d內恢復至正常密度[12]。如果MG可以移植至SCI損傷部位并發揮神經保護作用,那么中樞神經系統將獲得充足的“治療來源”。研究顯示MG在內源性或病理信號影響下,可以轉化分裂成眾多亞型,包括經典活化的促炎表型(M1)、交替活化的抗炎表型(M2a和M2b)和獲得性失活表型(M2c)[13]。MG在SCI后迅速活化,其中M1-MG表達IL-1β、IL-6、IL-12、TNF-α等細胞因子,招募炎癥細胞導致原發性機械損傷后的進一步損傷[14]。相反,M2-MG可分泌IL-4、IL-10、IGF-1和TGF-β等抗炎細胞因子或趨化因子抑制過度炎癥反應,促進傷口愈合[15]。IL-4 是巨噬細胞M2亞型增殖信號,已有研究證明在成年小鼠腦內注射重組IL-4可明顯增強M2-MG基因表達[16]。將通過這種方法誘導獲得的M2-MG移植到SCI小鼠體內,可以有效促進小鼠運動功能恢復[17]。
SCI后損傷區域星形膠質細胞顯著增生并形成膠質瘢痕,阻礙軸突再生。研究表明損傷區附近的星形膠質細胞具有A1、 A2 型,分別發揮促炎效應和神經保護功能[18-20]。因此,從理論上分析抑制星形膠質細胞向A1型轉化對改善SCI后的功能恢復具有重要價值。本研究旨在利用IL-4體外誘導MG分化為M2亞型,并用于小鼠SCI損傷區域,評估其對神經元軸突再生和神經功能恢復的影響及其作用機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
6周齡雌性C57BL/6小鼠42只,體質量15~18 g,由濟南杰瑞康生物科技有限公司提供。新生2~3 d C57BL/6乳鼠15只,雌雄不限,體質量1.5~2.0 g;新生1周C57BL/6乳鼠5只,雌雄不限,體質量5.5~6.0 g;均由本課題組自行繁育。動物實驗操作按照青島大學附屬醫院實驗動物護理使用指南進行,實驗前小鼠在控制條件下正常喂養7 d以適應環境。
偶聯 Alexa Fluor 山羊抗兔二抗、偶聯 Alexa Fluor 山羊抗鼠二抗、山羊抗鼠Iba1抗體以及山羊抗兔抗精氨酸酶 1(Arginase 1,Arg-1)、膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)、神經元核抗原(neuronal nuclei antigen,NeuN)、C3抗體(Abcam公司,美國);多聚賴氨酸、重組小鼠IL-4(Sigma公司,美國);FBS(GIBCO公司,美國);DMEM/F12培養基、 DMEM 培養基(HyClone 公司,美國)。
相差顯微鏡(上海巴拓儀器有限公司);熒光顯微鏡(Leica 公司,德國);體視顯微鏡、腦立體定位儀、Nanoject Ⅲ微量注射泵、小動物麻醉機(深圳市瑞沃德生命科技有限公司);Transwell培養板(Corning公司,美國);超速離心管、超速離心機(Beckman 公司,美國);脊髓夾傷鑷(Fine Science Tools公司,英國)。
1.2 細胞培養及鑒定
1.2.1 MG提取及鑒定
取15只新生2~3 d C57BL/6乳鼠置于75%乙醇浸泡15 min后,使用眼科剪剪下乳鼠頭部獲取腦組織,體視顯微鏡下用鑷子取大腦皮質,置于0.25%胰蛋白酶消化10 min,以含15%FBS的DMEM/F12培養基重懸,將單細胞懸液通過100 μm細胞篩網,以離心半徑10 cm,1 000 r/min離心5 min。置于37℃、5%CO2培養箱中培養14 d,于搖床以200 r/min震蕩2 h,收集脫落的MG置于25 cm2細胞培養瓶,相差顯微鏡下觀察細胞形態,繼續培養待細胞生長至80%~90%密度時,進行Iba1免疫熒光染色鑒定其純度。熒光顯微鏡下Iba1呈綠色熒光,DAPI呈藍色熒光,兩者重合部分為陽性細胞,當細胞純度達80%時提示培養細胞為MG。
1.2.2 M2-MG誘導培養及鑒定
取生長狀態穩定的MG接種于6孔板,每孔6×105個細胞,隨機分為兩組,每組3個復孔。實驗組、對照組分別以含20 ng/mL IL-4的DMEM培養基、單純DMEM培養基于37℃、5%CO2培養箱中培養。培養48 h后于相差顯微鏡下觀察細胞形態變化及生長情況,并行Arg-1、Iba1免疫熒光染色。首先4%多聚甲醛固定細胞30 min;室溫封閉30 min,與Arg-1、Iba1一抗4℃孵育過夜,復溫后與偶聯 Alexa Fluor 山羊抗兔二抗、偶聯 Alexa Fluor 山羊抗鼠二抗共孵育1 h,PBS洗滌后加入 DAPI 復染。熒光顯微鏡下觀察,細胞誘導為M2型后Arg-1染色呈強綠色熒光,使用Image J軟件半定量分析Arg-1、Iba1熒光強度。
1.3 背根神經節(dorsal root ganglion,DRG)培養及與M2-MG共培養觀測
將5只新生1周C57BL/6乳鼠置于75%乙醇浸泡15 min,然后沿背部中線縱行切開脊柱,取長約1 cm的胸腰段脊柱。于體視顯微鏡下摘取兩側DRG,置于含10%FBS的DMEM培養基中,用顯微鑷完整剝除其外膜后,接種于Transwell培養板下層。用含10%FBS的DMEM培養基重懸1.2.2中獲得的M2-MG后,接種于培養板上層與DRG共培養作為實驗組(M2-MG+DRG組);以上層未添加M2-MG培養的DRG作為對照組(DRG組)。DRG及M2-MG接種密度均為3×104個/cm2。置于37℃、5%CO2培養箱中培養5 d后,相差顯微鏡下觀察DRG軸突生長情況,隨機取3個DRG采用Image J軟件分別測量對應4個象限中3根最長軸突的長度,取均值。
1.4 動物實驗
1.4.1 實驗分組及方法
取42只6周齡C57BL/6小鼠隨機分為假手術組(n=6)、SCI組(n=18)及SCI+M2-MG組(n=18)。所有小鼠腹腔注射5%水合氯醛(1 mL/200 g)麻醉后,作背部正中縱形切口暴露T10節段脊柱,假手術組僅切除椎板,SCI組及SCI+M2-MG組行SCI造模,采用脊髓夾傷鑷鉗夾T10節段脊髓3 s,確保夾傷時脊髓被全部覆蓋。以夾傷過程中小鼠后肢明顯抽搐,蘇醒后雙下肢完全癱瘓且無踝關節活動,作為判斷造模成功標準。SCI+M2-MG組在造模成功后立即行M2-MG移植,具體方法:連接微量注射泵的玻璃微電極與腦立體定位儀,生理鹽水沖洗SCI部位以獲得清晰視野,玻璃微電極吸取2 μL M2-MG細胞懸液(約1×105個細胞)后插入損傷區域,以3 nL/s速度注射15 min。術后各組每天人工按摩小鼠膀胱2次,促進排尿、排便,直至重新建立自主排尿功能。
1.4.2 觀測指標
① 行為學檢測:術后觀測各組小鼠存活以及后肢功能恢復情況。 術后當天(0)、3、7、14、21、28 d,各組取3只小鼠采用 BMS(Basso Mouse Scale)評分評價運動功能恢復情況,總分為9分,評分從高到低表示由完全正常逐漸向完全癱瘓過渡。術后28 d行足跡實驗評價小鼠步態,如足跡間隔均勻、足跡軌跡連續和穩定提示步態協調。
② 免疫熒光染色觀察:術后7、14、28 d,SCI組、SCI+M2-MG組各取3只小鼠進行觀測。各組同上法麻醉后,通過心臟持續灌注10倍濃度冷PBS,待肝臟從紅色變為灰白色后,改為注入4%多聚甲醛,待小鼠抽搐停止后迅速分離脊柱,取出T7~9節段脊柱置于4% 多聚甲醛、4℃固定過夜。體視顯微鏡下剝離脊髓后置于30%蔗糖溶液中,于4℃脫水24 h;冠狀位切片,片厚25 μm;采用封閉液在常溫下封閉2 h,PBS洗滌后與GFAP、C3和NeuN一抗在4℃下孵育過夜,復溫后與對應二抗孵育2 h并進行DAPI核染色,熒光顯微鏡下觀察。取7、14、28 d GFAP染色(綠色熒光)切片觀察SCI損傷區域,28 d NeuN染色(綠色熒光)切片觀察神經元存活情況,7、14 d GFAP/C3雙重染色(綠色/紅色熒光)切片觀察A1星形膠質細胞變化。各組隨機選擇3個視野,使用 Image J圖像分析軟件對存活神經元數量和A1星形膠質細胞(C3+/GFAP+細胞)進行計數,計算C3+/GFAP+細胞百分比,并測量SCI損傷區域面積,取均值。
1.5 統計學方法
采用 SPSS22.0統計軟件進行分析。計量資料行Shapiro-Wilk正態性檢驗,均符合正態分布,以均數±標準差表示。體外實驗中Iba1、Arg-1熒光強度及軸突長度比較采用獨立樣本t檢驗。動物實驗中BMS評分采用重復測量方差分析,若不滿足球形檢驗,采用Greenhouse-Geisser 進行校正,同一組別不同時間點間比較采用 Bonferroni 法,同一時間點不同組別間比較采用多因素方差分析;熒光染色測量結果組間比較采用單因素方差分析或獨立樣本t檢驗,兩兩比較采用SNK檢驗。檢驗水準 α=0.05。
2 結果
2.1 細胞培養及鑒定
2.1.1 MG鑒定
MG體外培養14 d后,相差顯微鏡下見上層透亮,細胞呈圓形;熒光顯微鏡下Iba1陽性細胞呈綠色熒光,陽性率約為90%。上述結果提示培養細胞為MG。見圖1。
 圖1
MG形態觀察及鑒定
圖1
MG形態觀察及鑒定
a. 培養14 d相差顯微鏡觀察細胞形態(×200);b. 免疫熒光染色觀察(熒光顯微鏡×200) 從左至右分別為DAPI染色、Iba1染色、重疊圖像
Figure1. Morphological observation and identification of MGa. Morphological observation after 14 days of culture under contrast microscope (×200); b. Immunofluorescence staining (Fluorescence microscope×200) From left to right for DAPI staining, Iba1 staining, and overlapping images, respectively
2.1.2 M2-MG鑒定
誘導培養48 h后,實驗組細胞形態以圓形為主,有少量形態不規則細胞,并出現一些偽足;對照組細胞也以圓形為主,但未見明顯不規則變化和偽足生成。免疫熒光染色觀察,兩組細胞Iba1、Arg-1均呈陽性染色,但染色強度存在差異。對照組及實驗組Iba1熒光強度分別為205.23±3.46、148.00±2.02,Arg-1熒光強度分別為105.54±1.71、179.42±2.18,差異均有統計學意義(t=8.252,P=0.001;t=15.400,P<0.001)。見圖2。鏡下細胞形態及免疫熒光染色結果表明實驗組細胞極化誘導為M2亞型。
 圖2
M2-MG形態觀察及鑒定
圖2
M2-MG形態觀察及鑒定
a. 實驗組(左)及對照組(右)細胞形態(相差顯微鏡×200);b. 實驗組(上)及對照組(下)免疫熒光染色觀察(熒光顯微鏡×200) 從左至右分別為Iba1染色、DAPI染色、Arg-1染色、重疊圖像
Figure2. Morphological observation and identification of M2-MGa. Cell morphology of experimental group (left) and control group (right) (Contrast microscope×200); b. Immunofluorescence staining of experimental group (top) and control group (bottom) (Fluorescence microscope×200) From left to right for Iba1 staining, DAPI staining, Arg-1 staining, and overlapping images, respectively
2.2 DRG與M2-MG共培養觀測
培養5 d后相差顯微鏡下見,兩組DRG細胞核周圍均有軸突伸出。M2-MG+DRG組軸突長度為(630.77±43.80)μm,明顯長于DRG組(318.14±20.63)μm,差異有統計學意義(t=21.700,P<0.001),見圖3。
 圖3
相差顯微鏡觀察DRG軸突(×50)
圖3
相差顯微鏡觀察DRG軸突(×50)
a. M2-MG+DRG組;b. DRG組
Figure3. DRG axons observation under contrast micorscope (×50)a. M2-MG+DRG group; b. DRG group
2.3 動物實驗
2.3.1 行為學檢測
術后各組小鼠均存活至實驗完成,手術部位未發生感染等癥狀。假手術組小鼠術后后肢功能無異常;SCI組及SCI+M2-MG組小鼠術后早期后肢運動功能差,隨時間延長逐漸恢復。與SCI組相比,SCI+M2-MG組術后0、3、7、14 d BMS評分差異無統計學意義(P>0.05),但術后21、28 d評分升高且差異有統計學意義(P<0.05)。
足跡實驗示,術后28 d SCI+M2-MG組小鼠有拖拽步態,相較假手術組運動功能差;但拖曳步態較SCI組明顯減輕,且出現足跡間隔,提示運動功能得到改善。見圖4。
 圖4
3組小鼠行為學檢測
圖4
3組小鼠行為學檢測
a. BMS評分變化趨勢;b. 術后28 d足跡實驗 從上至下分別為假手術組、SCI組、SCI+M2-MG組
Figure4. Behavioral tests of mice in 3 groupsa. Change trends of BMS scores after operation; b. The footprint experiment at 28 days after operation From top to bottom for sham group, SCI group, and SCI+M2-MG group, respectively
2.3.2 免疫熒光染色觀察
① GFAP染色:術后SCI組、SCI+M2-MG組損傷部位出現明顯膠質瘢痕邊界,且病變范圍隨時間延長逐漸擴大。圖像分析示,術后7、14、28 d SCI+M2-MG 組損傷區域面積均低于SCI組,差異有統計學意義(P<0.05)。見圖5。
 圖5
各組GFAP免疫熒光染色觀測
圖5
各組GFAP免疫熒光染色觀測
a. SCI組(上)、SCI+M2-MG組(下)熒光顯微鏡下觀察(×50) 從左至右分別為術后7、14、28 d;b. 各組術后7、14、28 d損傷區域面積
Figure5. GFAP immunofluorescence staining of each groupa. Fluorescence microscope observation (×50) of SCI group (top) and SCI+M2-MG group (bottom) From left to right for 7, 14, and 28 days, respectively; b. The size of injury area in each group at 7, 14, and 28 days, respectively
② NeuN染色:術后28 d, SCI+M2-MG 組神經元存活數量為(2 029±147)個/mm2,較SCI組(1 058±147)個/mm2明顯增多,差異有統計學意義(t=5.280,P=0.006)。 見圖6 。
 圖6
SCI組(上)、SCI+M2-MG組(下)NeuN免疫熒光染色觀測(熒光顯微鏡×400)
圖6
SCI組(上)、SCI+M2-MG組(下)NeuN免疫熒光染色觀測(熒光顯微鏡×400)
從左至右分別為NeuN染色、DAPI染色、重疊圖像
Figure6. NeuN immunofluorescence staining of SCI group (top) and SCI+M2-MG group (bottom) (Fluorescence microscope×400)From left to right for NeuN staining, DAPI staining, and overlapping images, respectively
③ GFAP/C3雙重染色:術后兩組均可見GFAP綠色熒光及C3紅色熒光表達,其中C3紅色熒光隨時間延長表達逐漸增強。但與SCI組相比,SCI+M2-MG組在術后7、14 d 時A1星形膠質細胞的特異性蛋白C3表達強度降低,C3+/GFAP+ 細胞百分比降低,差異有統計學意義(P<0.05)。見圖7。
 圖7
各組GFAP/C3雙重免疫熒光染色觀測
圖7
各組GFAP/C3雙重免疫熒光染色觀測
a. SCI組(上)、SCI+M2-MG組(下)熒光顯微鏡下觀察(×100) 從左至右分別為7、14 d;b. 各組C3+/GFAP+細胞百分比
Figure7. GFAP/C3 double immunofluorescence staining in each groupa. Fluorescence microscope observation (×100) of SCI group (top) and SCI+M2-MG group (bottom) From left to right for 7 and 14 days, respectively; b. Percentage of C3+/GFAP+ cells in each group
3 討論
MG起源于胚胎卵黃囊,相較于其他神經細胞具有強大再生能力,是其優于其他細胞的特性之一。此外,MG發生活化閾值很低[21],可以在SCI損傷后30 min內迅速激活,與神經元、其他膠質細胞及進入中樞神經系統的外周免疫細胞相互影響。MG通過合成趨化因子和細胞因子對周圍其他神經細胞進行調節,使其成為同類保護性/破壞性分子,進而減小或加重SCI因膠質瘢痕形成、神經元死亡以及免疫浸潤導致軸突再生的難度[21-22]。在SCI損傷后早期,MG通過增強吞噬活性,加速清除刺激物和細胞碎片發揮抗炎作用[23];同時刺激周圍其他神經細胞響應,為損傷區提供一種細胞保護和修復反應[24],而這種神經修復的積極作用和M2亞型出現有關。在受到持續刺激后,隨著M2亞型消散以及M1亞型的持續活化,MG分泌的炎癥因子擴散并激活下游免疫反應[25],表現促炎效應。Kigerl等[26] 的研究證明體外培養獲得的M2-MG條件培養基可以促進受傷小鼠脊髓神經再生。因此,有效獲取M2-MG并將其移植至SCI損傷部位,可能是研究SCI治療方法的重要方向之一。
本研究以小鼠作為SCI動物模型,采用損傷部位原位注射方法移植細胞。選擇該移植方法主要基于以下原因:首先,全身靜脈或尾靜脈注射移植時,移植細胞需要通過血腦屏障才能到達SCI損傷部位,導致移植細胞損失;其次,靜脈注射可能對其他組織器官產生副作用;最后,有研究顯示原位注射移植對脊髓造成的損傷可能比靜脈給藥更大[17],如需注射細胞較多時,往往需要多次注射,造成較大損傷。考慮本研究所需細胞較少,對注射部位造成的損傷小,所以相較靜脈注射效果更好。
本研究結果顯示M2-MG移植治療后,SCI小鼠后肢活動度、步態協調性均改善,術后 SCI+M2-MG組損傷區域面積較SCI組顯著減小,免疫熒光染色顯示類似神經保護結果,存活的神經元數量增多。此外,我們通過在體外培養DRG驗證了M2-MG具有促軸突生長作用,這可能與其分泌的促生長因子有關。C3蛋白是A1星形膠質細胞標志物,該細胞失去了正常星形膠質細胞的形態和功能,是SCI后膠質瘢痕的重要組成成分,具有一定神經毒性并引發神經元死亡[27]。為了進一步驗證M2-MG是否通過調節星形膠質細胞活化發揮神經保護作用,我們進行了GFAP/C3雙重染色。結果顯示SCI+M2-MG組小鼠 A1星形膠質細胞標志物C3蛋白表達降低,提示M2-MG抑制SCI后A1星形膠質細胞活化。
綜上述,M2-MG移植對小鼠SCI損傷區域神經組織產生了積極影響,該促進作用可能與A1星形膠質細胞活化被抑制相關。但本研究仍存在一定不足,如MG表型在M1促炎損傷與M2抗炎修復之間轉換,但移植后細胞是否一直保持移植時表型還是部分發生了表型改變,還需要通過更嚴謹的細胞測序手段驗證。此外,M2-MG移植有可能改變了損傷區域的整體炎癥狀態,從而提供了一個促進脊髓愈合的環境,但有待進一步研究明確。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經青島大學附屬醫院醫學倫理委員會批準(QYFY WZLL 2812);實驗動物使用許可證號:SYXK(魯)20200009
作者貢獻聲明 張靜、江琪、曲迪:研究實施、數據分析;張瀟月、胡羽生:數據收集及整理、圖片繪制;戚超、付海濤:研究設計及對文章知識性內容作批評性審閱