引用本文: 鄧博文, 蔣昇源, 劉港, 李筱葉, 白惠中, 霍路遙, 徐杰, 徐林, 穆曉紅. 攜川芎嗪導電水凝膠促進脊髓損傷后血管新生和神經保護的實驗研究. 中國修復重建外科雜志, 2024, 38(2): 189-197. doi: 10.7507/1002-1892.202311009 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
脊髓損傷(spinal cord injury,SCI)病理機制復雜,尤以繼發性損傷為甚,如細胞程序性死亡、軸突脫髓鞘、炎癥級聯反應等。其中,微血管再生不足是限制神經組織再生和運動功能恢復不良的主要病理因素[1-2]。研究證實,SCI損傷后急性期,鄰近區域灰質內內皮細胞特異性抗體標記的微血管密度持續性下降,損傷區域幾乎無微血管存在,并伴有大量神經細胞死亡,其損傷程度與SCI嚴重程度密切相關[3-5]。損傷后慢性期,內源性微血管再生不足,形成無完整血管結構和功能的網絡,具有高通透性及灌流不足等特征,加劇繼發性損傷[5-6]。相關研究表明,損傷區域血管密度與神經功能的改善程度有密切關系,通過改善毛細血管血流量和促進血管新生可增強SCI后功能恢復[7-8]。同時,血管可能作為“支架”誘導受傷后軸突再生[9]。因此,增強微血管再生及重塑血管網絡對于神經修復具有重要意義。
我們前期研究發現川芎嗪(tetramethylpyrazine,TMP)具有促血管新生和神經保護等多種藥理作用[10-12],然而受限于給藥途徑和較低的生物利用率問題,導致其療效不顯著[12-13]。基于生物材料為載體的組合式手段可能是提高藥物生物利用度,協同促進損傷區域再血管化,從而增強SCI修復效果的有效方式[14]。研究表明,以甲基丙烯酰化明膠(gelatin methacryloyl,GelMA)-聚吡咯(polypyrrole,Ppy)顆粒材料構建的導電水凝膠(簡稱“GTP”)通過仿細胞外基質結構,不僅具備與脊髓組織相匹配的力學特性,能較好地填充神經損傷后的空洞缺損,而且具有優良的導電性能,可誘導細胞黏附及遷移,為神經血管再生提供了良好微環境[15-16];還具有獨特的三維網狀結構可攜載藥物或種子細胞,局部緩釋,調控繼發性損傷。據此,我們將其作為載體,制備了攜TMP的導電水凝膠(簡稱“TGTP”),初步研究證實其能實現藥物局部富集與緩釋,促進SCI大鼠運動功能恢復,但具體機制有待深入研究[17]。本研究擬以此為切入點,在前期研究基礎上進一步深入探索TGTP修復SCI的作用機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
8周齡雌性SD大鼠72只,體質量220~240 g,由中國中醫科學院骨傷研究所提供,造模前在標準屏障實驗室(22℃,40%~50%濕度,12 h光/暗循環)適應性喂養1周,4只/籠,自由飲食,不限制活動。
吡咯單體、甲基丙烯酸酐、光引發劑Irgacure2959(Sigma公司,美國);明膠、六水合氯化鐵(上海阿拉丁生化科技股份有限公司);鹽酸TMP注射液(哈爾濱三聯藥業股份有限公司);PDGF-B抗體、CD31抗體、VEGF-A抗體(Abcam公司,美國);PDGF受體β(PDGF receptor β,PDGFR-β)抗體(Santa Cruz公司,美國);Tie-2(一種具有免疫球蛋白和EGF同源結構域的酪氨酸激酶受體)抗體、VEGF受體2(VEGF receptor 2,VEGFR-2)抗體、血管生成素1(angiopoietin 1,Ang-1)抗體(武漢三鷹生物技術有限公司);神經絲蛋白200(neurofilament 200,NF200;CST公司,美國)。激光共聚焦顯微鏡、倒置相差顯微鏡(Leica公司,德國)。
1.2 GTP和TGTP制備
TGTP構建方法與前期文獻報道一致[17]。將適量光引發劑Irgacure2959和500 μg/mL鹽酸TMP注射液在避光條件下共混,60℃水浴加熱后,添加適量GelMA、Ppy等化合物;震蕩混勻后再次水浴加熱至完全溶解。避光條件下使用移液槍將混合液注入自制模具中,通過紫外線(6.9 mW/cm2,360~480 nm)光聚合制備TGTP;并將其浸泡于4℃ 75%乙醇溶液中消除凝膠內雜質,備用。GTP的制備除未添加鹽酸TMP注射液外,其余步驟與TGTP一致。
1.3 動物分組及造模方法
將72只SD大鼠通過隨機數字表法分為假手術組(A組)、SCI模型組(B組)、SCI+GTP組(C組)和SCI+TGTP(D組),每組18只。術前所有大鼠均禁食、水8 h,造模方式與前期文獻報道一致[17-18]。主要步驟:大鼠稱重,以0.3%戊巴比妥(30 mg/kg)腹腔注射麻醉后,備皮消毒,俯臥位固定于手術臺。以T9和T10的棘突為中心,依次分離皮膚、筋膜、肌肉層,暴露對應節段椎板和關節突關節,使用椎板鉗沿上、下椎體間隙咬除T9、T10椎板,暴露脊髓。A組僅切除T9、T10椎板,其余3組使用自制顯微雙刃剪切除2 mm長脊髓,其中C、D組在損傷部位植入對應的水凝膠。分層縫合,閉合切口。術后每日3次進行膀胱按摩,幫助大鼠排尿、排便。
1.4 觀測指標
1.4.1 行為學評分
采用BBB評分法和改良Rivlin-Tator斜板實驗[19]評估大鼠術前及術后1、3、7、14、28 d后肢運動功能恢復情況。評估時間點固定于19∶00,大鼠自由活動;采用雙人雙盲法,觀察大鼠5 min內的運動情況,評估3次,取均值。
1.4.2 組織學染色觀察
術后28 d每組取6只大鼠,同上法麻醉后,經4%多聚甲醛心臟灌注后,以損傷區域為中心取1.0 cm長脊髓組織,標注頭、尾端。以4%多聚甲醛浸泡過夜,修塊、脫水、石蠟包埋,制備5 μm厚切片,常規行組織學染色觀察。① Masson染色觀察損傷區域瘢痕增生情況,并行膠原容積分數半定量分析;② Nissl染色觀察神經元存活情況,并行尼氏體數量半定量分析;③ LFB染色觀察髓鞘分布和再生情況,并行髓鞘陽性表達面積半定量分析。
1.4.3 免疫熒光染色觀察
術后7 d同上法取材,制備脊髓切片,并取上述術后28 d部分切片脫蠟、乙醇梯度脫水后,EDTA修復液抗原修復。0.2%Triton X-100溶液避光條件下透膜10 min,10%FBS室溫封閉1 h。去除封閉液后,滴加CD31(1∶2 000)、NF200(1∶200)一抗,4℃過夜。PBS漂洗3次,滴加對應二抗(Alexa Fluor? 594標記山羊抗兔IgG,Alexa Fluor? 488標記山羊抗小鼠IgG),4℃濕盒內孵育1 h。PBS漂洗后滴入含有DAPI的防淬滅封片劑,封片,激光共聚焦顯微鏡下觀察內皮細胞標記分布,并通過Image J軟件半定量分析CD31陽性表達熒光強度。
1.4.4 Western blot檢測
術后7 d和28 d每組取3只大鼠同上法麻醉后,低溫取材、組織研磨裂解,經BCA法評估濃度,并上樣、轉膜及封閉。分別在術后7 d切片滴加一抗[Ang-1(1∶2 000)、Tie-2(1∶2 000)];術后28 d切片滴加一抗 [Ang-1(1∶2 000)、PDGF-B (1∶1 000)、Tie-2(1∶2 000)、VEGF-A(1∶1 000)、VEGFR2(1∶500)、PDGFR-β(1∶500)、NF200 (1∶1 000)],所有切片低溫過夜,二抗室溫孵育。經ECL法曝光及定影。Image Pro Plus軟件對掃描膠片圖像進行處理,分析目的條帶灰度,獲得目的蛋白相對表達量(目的蛋白和GAPDH的比值)。
1.5 統計學方法
采用SPSS25.0統計軟件進行分析。計量資料經Shapiro-Wilk正態性檢驗,符合正態分布的數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;不符合正態分布的數據以M(Q1,Q3)表示,組間比較采用Kruskal-Wallis H檢驗。檢驗水準α=0.05。
2 結果
2.1 行為學評分
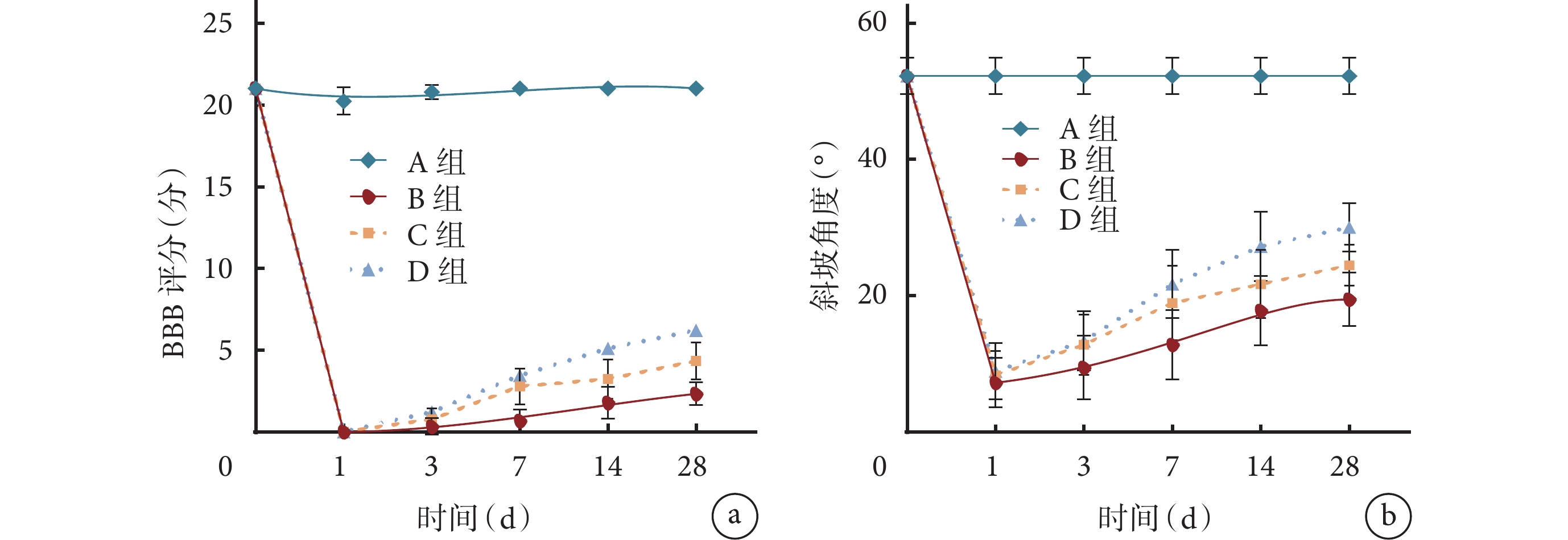
BBB評分和改良Rivlin-Tator斜板實驗結果示,術前所有大鼠后肢功能均正常;術后1 d各組大鼠后肢完全癱瘓,并在3 d后逐漸恢復后肢運動功能。術后各時間點B~D組BBB評分和斜坡角度均顯著低于A組,C組術后7~28 d及D組術后3~28 d各指標顯著高于B組,D組術后14、28 d顯著高于C組,差異均有統計學意義(P<0.05)。見圖1。
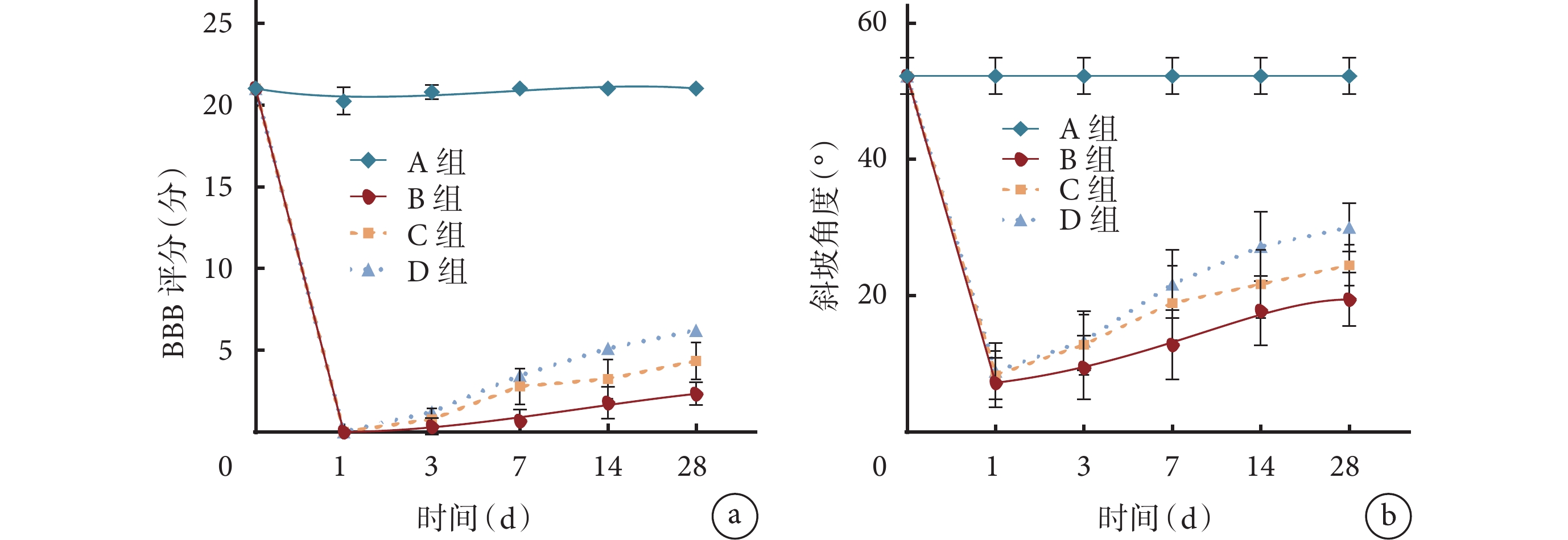 圖1
各組各時間點后肢運動功能檢測
圖1
各組各時間點后肢運動功能檢測
a. BBB評分;b. 改良Rivlin-Tator斜板實驗斜坡角度
Figure1. Variations of hind limb motor function at different time points in each groupa. BBB score; b. Climbing angle of modified Rivlin-Tator inclined plate test
2.2 組織學染色觀察
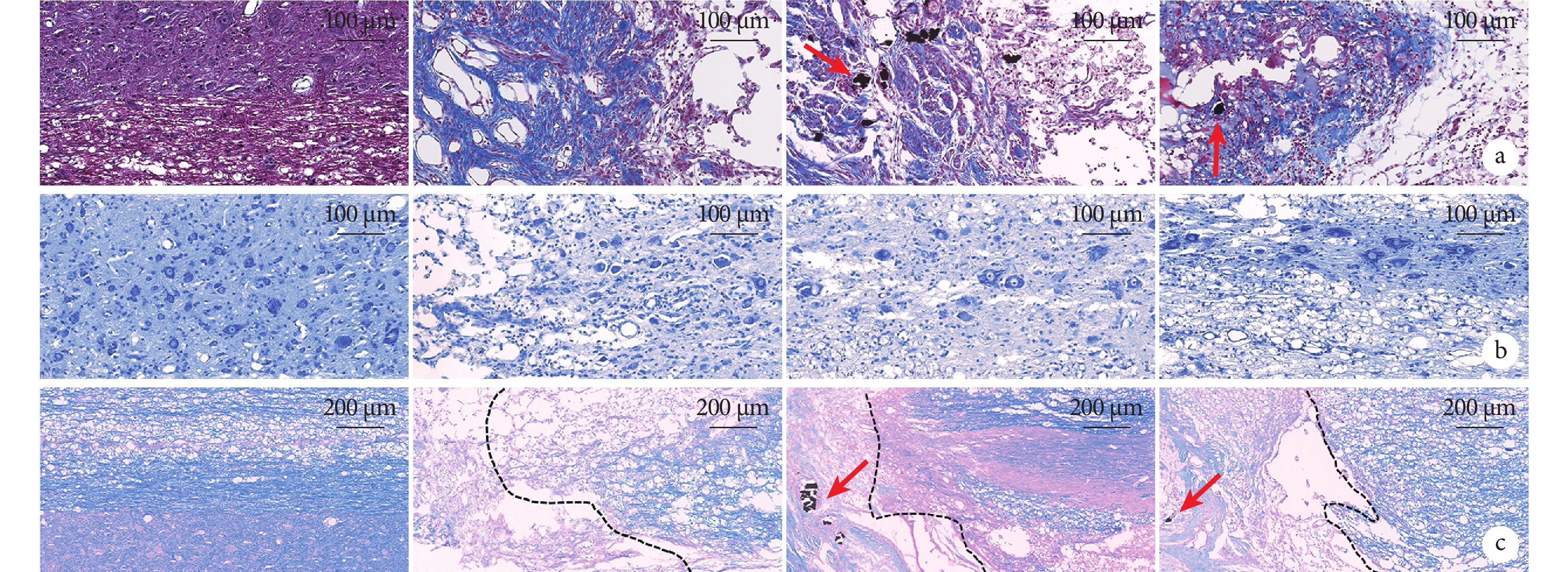
Masson染色示,A組灰質和白質組織結構排列緊密,未見藍染膠原纖維;B組斷端兩側組織結構與細胞排列雜亂,斷端兩側組織溶解形成空洞囊腔,斷端處嚴重纖維化,呈亮藍色;C組斷端處可見纖維瘢痕組織包裹的黑色導電顆粒,周圍炎癥細胞浸潤,并存在少量空洞囊腔;D組斷端可見少量散在黑色導電顆粒,周圍膠原纖維成分相對較少。B~D組膠原容積分數顯著高于A組,差異有統計學意義(P<0.05);D組低于B、C組,但僅與B組比較差異有統計學意義(P<0.05);B組高于C組,差異有統計學意義(P<0.05)。
Nissl染色示,A組灰、白質結構完整,灰質內神經元形態規整,尼氏體呈虎斑狀;B組神經元變性嚴重,表現為尼氏體溶解、數量明顯減少,形態異常;C組僅于損傷鄰近部位觀察到少數殘存神經元,尼氏體形態欠規整;D組損傷鄰近區域灰質內可見部分未凋亡的神經元,尼氏體固縮。B~D組損傷鄰近區域尼氏體數量顯著低于A組,差異有統計學意義(P<0.05);D組高于B、C組,但僅與B組比較差異有統計學意義(P<0.05);B、C組間差異無統計學意義(P>0.05)。
LFB染色示,A組脊髓組織髓鞘呈連續藍色結構,排列致密有序,結構完整;B組損傷周邊組織結構稀疏,白質出現溶解,神經纖維缺損;C、D組髓鞘結構損傷相對較輕,D組脊髓組織鄰近區域可見相對完整、連續的藍染髓鞘結構,髓鞘面積占比明顯高于B、C組。同時,C、D組損傷中心可見散在分布的導電顆粒,其周圍髓鞘密度高于B組。B~D組髓鞘陽性表達面積顯著低于A組,差異有統計學意義(P<0.05);D組低于B、C組,但僅與B組比較差異有統計學意義(P<0.05);B、C組間差異無統計學意義(P>0.05)。見圖2、表1。
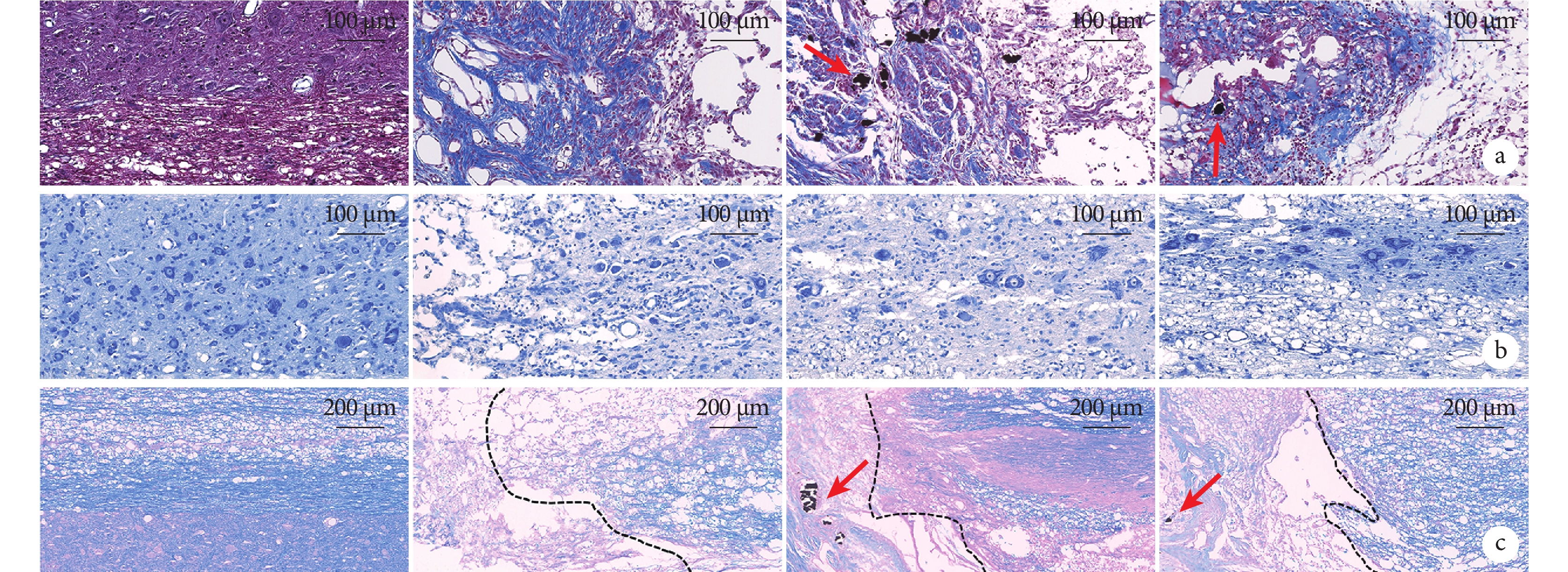 圖2
術后28 d各組組織學染色觀察(×20)
圖2
術后28 d各組組織學染色觀察(×20)
箭頭示導電顆粒,從左至右依次為A、B、C、D組 a. Masson染色;b. Nissl染色;c. LFB染色(黑色虛線示損傷區域和鄰近正常脊髓組織界線)
Figure2. Histological staining of spinal cord in each group at 28 days postoperatively (×20)Arrow showed conductive particles; from left to right for groups A, B, C, and D, respectively a. Masson staining; b. Nissl staining; c. LFB staining (Black dotted line showed the boundary between the area of injury and the adjacent normal spinal cord tissue)
 )
Table1.
Comparison of each indicator between groups after operation (n=6,
)
Table1.
Comparison of each indicator between groups after operation (n=6,  )
)
2.3 免疫熒光染色觀察
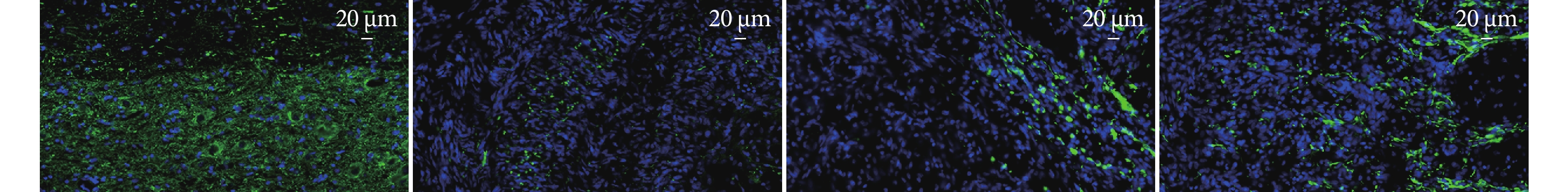
NF200免疫熒光染色示,A組脊髓組織結構完整,神經元形態規整,排列致密;B組NF200陽性神經絲呈點狀分布,鄰近區域幾乎未見完整神經元;C組損傷部位可見少量神經纖維生長;D組損傷部位NF200陽性纖維密度優于B、C組。見圖3。
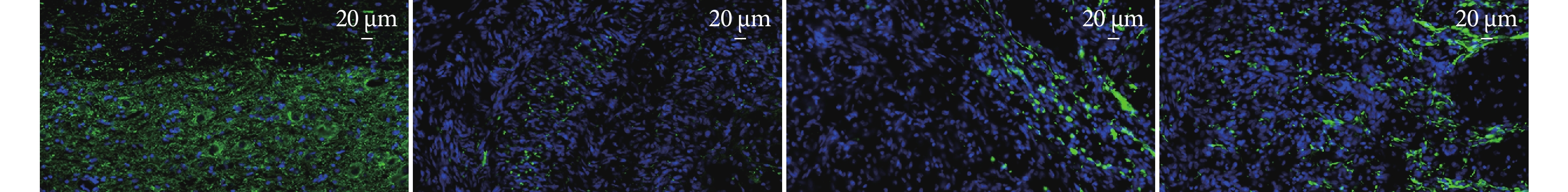 圖3
術后28 d各組NF200免疫熒光染色觀察(×40)
圖3
術后28 d各組NF200免疫熒光染色觀察(×40)
從左至右依次為A、B、C、D組
Figure3. Immunofluorescence staining for NF200 in each group at 28 days postoperatively (×40)From left to right for groups A, B, C, and D, respectively
CD31免疫熒光染色示,A組術后7、28 d均可見紅色熒光標記的內皮細胞,呈連續“線性”或類圓形形態;B、C組術后7 d損傷區域可見零星點狀分布的內皮細胞,未見明顯新生血管,術后28 d可見少量新生血管;D組術后7 d損傷區域周圍可見少量新生血管影,術后28 d可見管狀新生血管影。術后7 d各組間損傷區域CD31陽性表達熒光強度差異均無統計學意義(P>0.05);28 d,B~D組損傷區域CD31陽性表達熒光強度均顯著低于A組,差異有統計學意義(P<0.05);D組顯著高于B、C組,但僅與28 d的C組差異有統計學意義(P<0.05);B、C組間差異均無統計學意義(P>0.05)。見圖4、表1。
 圖4
術后7、28 d各組CD31免疫熒光染色觀察(激光共聚焦顯微鏡×60)
圖4
術后7、28 d各組CD31免疫熒光染色觀察(激光共聚焦顯微鏡×60)
箭頭示新生血管,從左至右依次為A、B、C、D組 a. 術后7 d;b. 術后28 d
Figure4. Immunofluorescence staining for CD31 in each group at 7 and 28 days postoperatively (Laser confocal microscope×60)Arrow showed angiogenesis; from left to right for groups A, B, C, and D, respectively a. At 7 days postoperatively; b. At 28 days postoperatively
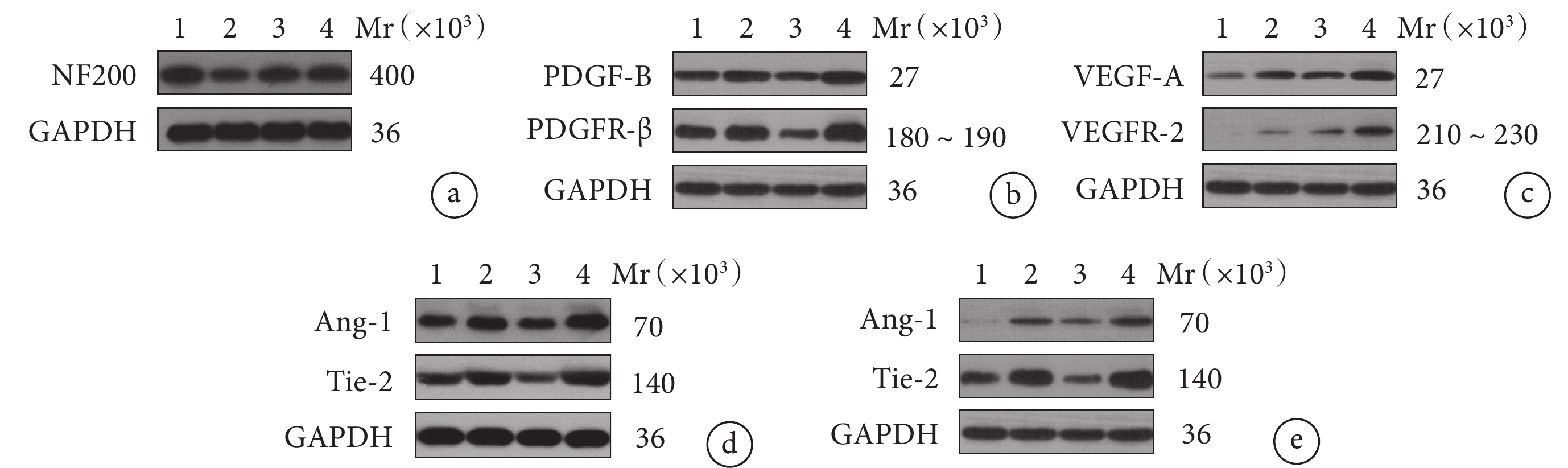
2.4 Western blot檢測
Western blot檢測示術后28 d B~D組NF200蛋白相對表達量顯著低于A組,D組顯著高于B、C組,差異均有統計學意義(P<0.05);B、C組間差異無統計學意義(P>0.05)。
術后7、28 d B~D組Ang-1、Tie-2蛋白相對表達量高于A組,D組高于B、C組,差異有統計學意義(P<0.05);B、C組間差異無統計學意義(P>0.05)。術后28 d D組PDGF-B、PDGFR-β蛋白相對表達量顯著高于B、C組,B組顯著高于C組,差異有統計學意義(P<0.05)。術后28 d B~D組VEGF-A、VEGFR-2蛋白相對表達量高于A組,差異均有統計學意義(P<0.05);D組高于B、C組,D組與B組比較差異有統計學意義(P<0.05),與C組比較僅VEGF-A蛋白差異有統計學意義(P<0.05);B、C組間比較僅VEGFR-2蛋白差異有統計學意義(P<0.05)。見圖5、表1。
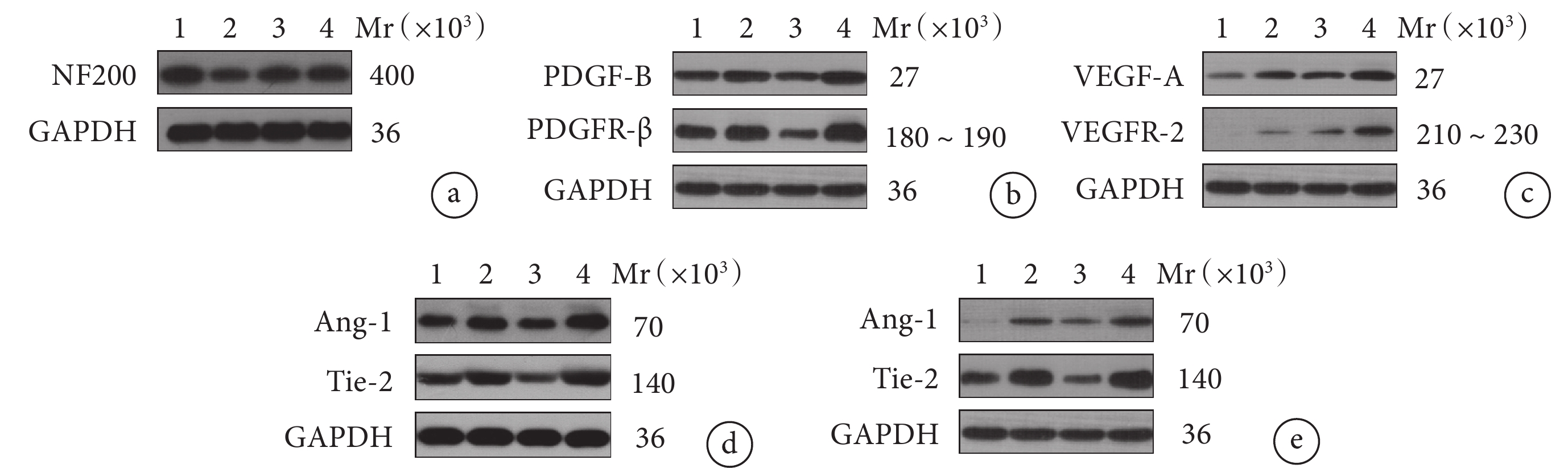 圖5
Western blot檢測各組術后各時間點各蛋白表達凝膠電泳圖
圖5
Western blot檢測各組術后各時間點各蛋白表達凝膠電泳圖
Mr:相對分子質量 1:A組 2:B組 3:C組 4:D組 a. NF200;b. PDGF-B和PDGFR-β;c. VEGF-A和VEGFR-2;d. 術后7 d Ang-1和Tie-2;e. 術后28 d Ang-1和Tie-2
Figure5. The gel electrophoresis of different protein expressions in each group detected by Western blot assay at different postoperative timeMr: Relative molecular mass 1: Group A 2: Group B 3: Group C 4: Group D a. NF200; b. PDGF-B and PDGFR-β; c. VEGF-A and VEGFR-2; d. Ang-1 and Tie-2 at 7 days postoperatively; e. Ang-1 and Tie-2 at 28 days postoperatively
3 討論
近年來,通過多學科交叉協作,構建以水凝膠為基礎的組合式神經修復策略,在促進SCI后再神經化和血管化方面取得重要進展[20]。GelMA水凝膠是一種典型的光固化水凝膠,在光引發劑作用下迅速成膠,并具備細胞生長與分化的三維空間[21]。GelMA水凝膠中甲基丙烯酸酯基團與lysine基團的結合,使其具有相對良好的機械強度與溶脹率,同時能為細胞黏附提供合適位點[21]。通過化學交聯高導電性Ppy有機聚合物制備的新型高電活性水凝膠,不僅能有效加強細胞間生物電信號傳遞,誘導內源性神經元向水凝膠中遷移、存活,而且能夠較好地填充神經損傷后的空洞缺損,抑制瘢痕增生[15-16]。據此,我們以GelMA/Ppy為“骨架”,通過TMP中的共軛雙鍵與Ppy中的共軛雙鍵產生π-π堆積效應,攜載TMP,制備了攜載TMP藥物的導電水凝膠,初步表明其能有效緩釋TMP,調節炎癥反應,從而促進SCI后運動功能恢復[17],但其具體調控機制尚不明確。
本研究在此基礎上,進一步探索了TGTP修復SCI的有效性及作用機制。行為學評估顯示,D組相較于B、C組在改善SCI大鼠運動方面療效顯著。但D組尚未觀察到大鼠后足掌面著地的現象(BBB評分>8分),這可能與脊髓全橫斷模型創傷過大及觀察時間較短有關。我們進一步對損傷區域行組織學染色分析,以揭示D組運動功能恢復最佳的機制。纖維瘢痕大量增生是神經功能恢復受限的重要因素,不同于星形膠質細胞所產生的膠質瘢痕,局部上調的炎癥反應會誘導并加速纖維瘢痕的發生[22-23]。前期研究中,我們證實了TGTP植入或TMP腹腔注射均能有效抑制TNF-α等炎癥因子表達[11,17]。本研究中,我們通過Masson染色發現TGTP植入能夠有效降低損傷區域膠原容積分數,抑制纖維結締組織增生,從而減少纖維瘢痕形成,這可能與局部緩釋的TMP抑制炎癥反應密切相關。此外,尼氏體作為中樞神經元的特征性結構,其形態結構及數量的改變可評估神經元的功能狀態[24]。本研究中D組脊髓斷端周圍尼氏體數量明顯優于B、C組,尼氏體結構趨于正常,表明TGTP具有一定神經細胞保護作用。LFB染色結果也發現D組神經纖維排列相對有序,髓鞘密集緊致,髓鞘陽性表達面積優于B、C組。這與我們前期研究結果一致[15-17],即導電聚合物可能恢復局部電信號傳導,誘導軸突再生。同時,NF200陽性纖維相對表達量與分布情況進一步提示了TGTP促進神經修復的有效性。NF200作為神經絲的成分參與了軸突構成,能有效反映神經元結構完整性和再生情況。本研究結果也發現D組損傷區域NF200表達量優于B、C組。上述結果提示TGTP不僅能發揮鄰近組織的神經保護作用,在促進神經再生方面也有一定療效。
早期重建損傷區域血運與加速血管化進程,對于神經元存活至關重要。損傷區域微血管密度與損傷后運動功能恢復程度密切相關[7-8]。本研究發現,D組在損傷后7 d和28 d,血管內皮細胞特異性標記物CD31表達強度呈上升趨勢,并優于B、C組。同時,我們發現局部微血管密度動態變化過程和運動功能改善時間窗密切重合,即D組大鼠在損傷后3 d開始出現部分運動功能恢復,7 d時出現顯著運動功能改善,28 d時達到相對穩定狀態,與CD31陽性表達變化過程相似,與既往研究結果一致[6,25-26]。這進一步提示TGTP可能通過促進血管新生和重塑,改善局部血流量,從而促進神經功能的恢復。損傷部位再血管化受局部微環境影響,鄰近細胞或組織通過直接作用或旁分泌多種相關信號因子調控微血管新生進程[27]。其中,促血管生成因子、血管生成素及PDGF等分子與SCI后血管新生密切相關。VEGF-A作為神經血管構建的主要初始驅動因子,在脈管系統形成和功能維持中起著關鍵作用[28]。VEGF-A可誘導尖端細胞遷移方向與莖細胞增殖,促進血管新生;與下游VEGFR-2結合,介導血管內皮細胞增殖與肌動蛋白重組,維持微管穩定及加速血管管腔形成等多種生物學進程[29-31]。本研究結果顯示D組VEGF-A和VEGFR-2表達同步上調,并優于B、C組,提示TGTP可能通過調控此信號軸促進血管新生。VEGF-A/VEGFR-2軸可串擾內皮細胞中αvβ3整合素表達,調控血管新生,并受PDGFR-β蛋白負向調控[32]。本研究也發現C、D組PDGFR-β蛋白表達趨勢與VEGFR-2相反,與既往研究結果一致。此外,PDGF-B為PDGF家族成員,是一種多功能的調節性多肽,主要來源于血小板、損傷內皮細胞及巨噬細胞;其與周細胞表面受體PDGFR-β相結合二聚化,募集下游信號,促進周細胞遷移、纖維轉化和內皮小管成熟,在中樞系統微血管成熟和穩定中起重要作用[33]。Duan等[30]發現通過上調PDGF-B/PDFGR-β軸表達,能有效提升損傷區域新生血管周細胞覆蓋率,促進功能化血管形成,從而增強SCI后修復療效。Menezes等[34]發現上調PDGFR-β蛋白表達,可募集損傷鄰近區域周細胞向新生血管遷移,促進血管成熟。本研究中,C組PDGF-B、PDFGR-β蛋白表達明顯低于B組,而D組相關蛋白表達水平明顯上調,顯著優于B、C組。提示TMP藥物和導電水凝膠協同應用優于單一手段的治療模式,能有效正向調控PDGF-B/PDFGR-β信號通路,從而促進血管化。血管成熟和重塑過程中,血管生成素也起著關鍵作用。Ang-1是血管生成素家族中典型代表,主要由血管壁細胞表達,正常組織內表達含量較低,與酪氨酸受體Tie-2結合,通過調控內皮細胞間、內皮細胞與基質之間的緊密連接蛋白表達,減弱VEGF-A誘導的血管通透性改變以及募集內皮細胞遷移和管狀結構形成,促進血管成熟[35-36]。Herrera等[37]發現在損傷急性期Ang-1蛋白靶向遞送能增強內源性VEGF-A蛋白表達,促進損傷區域血管新生。疾病慢性期,注射Ang-1因子可有效促進內源性Ang-1/Tie-2蛋白過表達,增強血管重塑,同時抑制炎癥因子表達,減輕其對血管通透性的影響。因此,增強Ang-1的內源性表達,可能是加速血管重塑的關鍵蛋白。本研究中,損傷后7 d和28 d C組Ang-1和Tie-2蛋白相對表達量均低于B組,與熒光染色結果較一致,提示GTP可能抑制血管新生進程。既往研究發現水凝膠中導電顆粒成分,即Ppy可能誘導炎癥反應[16,38],本研究也發現導電顆粒周圍存在炎癥細胞浸潤。研究證實炎癥反應程度與血管網絡重塑過程密切相關[39-40],我們前期研究發現與GTP相比,TGTP能有效抑制炎癥反應,促進神經功能恢復[17]。本研究中D組血管新生相關蛋白表達顯著上調,且CD31熒光強度也明顯優于C組,提示TGTP可能抑制了Ppy誘導的炎癥反應,增強了水凝膠對血管新生相關蛋白的調控作用,促進血管新生和重塑過程,從而加速SCI修復。
綜上述,TGTP可能通過促進SCI后血管新生,同時保護神經元,從而改善損傷后神經功能的恢復。本研究也存在一定局限性,VEGF-A/VEGFR-2等相關蛋白可能與多條生物學過程相互串擾,其與血管生成的因果關系尚不明確。而本研究未進行細胞層面的探索,僅從動物及組織層面初步分析了水凝膠修復SCI的潛在機制,后續將進一步深入研究,明確其確切調控作用。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突
倫理聲明 研究方案經北京中醫藥大學實驗動物倫理委員會批準(BUCM-4-2021040802-2021);實驗動物生產許可證號:SCXK(京)2017-0005,實驗動物使用許可證號:SYXK(京)2020-0013
作者貢獻聲明 鄧博文、徐林、穆曉紅:研究設計及協助研究開展;蔣昇源、劉港、霍路遙、白惠中:研究實施及文章撰寫;李筱葉、徐杰:數據收集整理及統計分析
脊髓損傷(spinal cord injury,SCI)病理機制復雜,尤以繼發性損傷為甚,如細胞程序性死亡、軸突脫髓鞘、炎癥級聯反應等。其中,微血管再生不足是限制神經組織再生和運動功能恢復不良的主要病理因素[1-2]。研究證實,SCI損傷后急性期,鄰近區域灰質內內皮細胞特異性抗體標記的微血管密度持續性下降,損傷區域幾乎無微血管存在,并伴有大量神經細胞死亡,其損傷程度與SCI嚴重程度密切相關[3-5]。損傷后慢性期,內源性微血管再生不足,形成無完整血管結構和功能的網絡,具有高通透性及灌流不足等特征,加劇繼發性損傷[5-6]。相關研究表明,損傷區域血管密度與神經功能的改善程度有密切關系,通過改善毛細血管血流量和促進血管新生可增強SCI后功能恢復[7-8]。同時,血管可能作為“支架”誘導受傷后軸突再生[9]。因此,增強微血管再生及重塑血管網絡對于神經修復具有重要意義。
我們前期研究發現川芎嗪(tetramethylpyrazine,TMP)具有促血管新生和神經保護等多種藥理作用[10-12],然而受限于給藥途徑和較低的生物利用率問題,導致其療效不顯著[12-13]。基于生物材料為載體的組合式手段可能是提高藥物生物利用度,協同促進損傷區域再血管化,從而增強SCI修復效果的有效方式[14]。研究表明,以甲基丙烯酰化明膠(gelatin methacryloyl,GelMA)-聚吡咯(polypyrrole,Ppy)顆粒材料構建的導電水凝膠(簡稱“GTP”)通過仿細胞外基質結構,不僅具備與脊髓組織相匹配的力學特性,能較好地填充神經損傷后的空洞缺損,而且具有優良的導電性能,可誘導細胞黏附及遷移,為神經血管再生提供了良好微環境[15-16];還具有獨特的三維網狀結構可攜載藥物或種子細胞,局部緩釋,調控繼發性損傷。據此,我們將其作為載體,制備了攜TMP的導電水凝膠(簡稱“TGTP”),初步研究證實其能實現藥物局部富集與緩釋,促進SCI大鼠運動功能恢復,但具體機制有待深入研究[17]。本研究擬以此為切入點,在前期研究基礎上進一步深入探索TGTP修復SCI的作用機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
8周齡雌性SD大鼠72只,體質量220~240 g,由中國中醫科學院骨傷研究所提供,造模前在標準屏障實驗室(22℃,40%~50%濕度,12 h光/暗循環)適應性喂養1周,4只/籠,自由飲食,不限制活動。
吡咯單體、甲基丙烯酸酐、光引發劑Irgacure2959(Sigma公司,美國);明膠、六水合氯化鐵(上海阿拉丁生化科技股份有限公司);鹽酸TMP注射液(哈爾濱三聯藥業股份有限公司);PDGF-B抗體、CD31抗體、VEGF-A抗體(Abcam公司,美國);PDGF受體β(PDGF receptor β,PDGFR-β)抗體(Santa Cruz公司,美國);Tie-2(一種具有免疫球蛋白和EGF同源結構域的酪氨酸激酶受體)抗體、VEGF受體2(VEGF receptor 2,VEGFR-2)抗體、血管生成素1(angiopoietin 1,Ang-1)抗體(武漢三鷹生物技術有限公司);神經絲蛋白200(neurofilament 200,NF200;CST公司,美國)。激光共聚焦顯微鏡、倒置相差顯微鏡(Leica公司,德國)。
1.2 GTP和TGTP制備
TGTP構建方法與前期文獻報道一致[17]。將適量光引發劑Irgacure2959和500 μg/mL鹽酸TMP注射液在避光條件下共混,60℃水浴加熱后,添加適量GelMA、Ppy等化合物;震蕩混勻后再次水浴加熱至完全溶解。避光條件下使用移液槍將混合液注入自制模具中,通過紫外線(6.9 mW/cm2,360~480 nm)光聚合制備TGTP;并將其浸泡于4℃ 75%乙醇溶液中消除凝膠內雜質,備用。GTP的制備除未添加鹽酸TMP注射液外,其余步驟與TGTP一致。
1.3 動物分組及造模方法
將72只SD大鼠通過隨機數字表法分為假手術組(A組)、SCI模型組(B組)、SCI+GTP組(C組)和SCI+TGTP(D組),每組18只。術前所有大鼠均禁食、水8 h,造模方式與前期文獻報道一致[17-18]。主要步驟:大鼠稱重,以0.3%戊巴比妥(30 mg/kg)腹腔注射麻醉后,備皮消毒,俯臥位固定于手術臺。以T9和T10的棘突為中心,依次分離皮膚、筋膜、肌肉層,暴露對應節段椎板和關節突關節,使用椎板鉗沿上、下椎體間隙咬除T9、T10椎板,暴露脊髓。A組僅切除T9、T10椎板,其余3組使用自制顯微雙刃剪切除2 mm長脊髓,其中C、D組在損傷部位植入對應的水凝膠。分層縫合,閉合切口。術后每日3次進行膀胱按摩,幫助大鼠排尿、排便。
1.4 觀測指標
1.4.1 行為學評分
采用BBB評分法和改良Rivlin-Tator斜板實驗[19]評估大鼠術前及術后1、3、7、14、28 d后肢運動功能恢復情況。評估時間點固定于19∶00,大鼠自由活動;采用雙人雙盲法,觀察大鼠5 min內的運動情況,評估3次,取均值。
1.4.2 組織學染色觀察
術后28 d每組取6只大鼠,同上法麻醉后,經4%多聚甲醛心臟灌注后,以損傷區域為中心取1.0 cm長脊髓組織,標注頭、尾端。以4%多聚甲醛浸泡過夜,修塊、脫水、石蠟包埋,制備5 μm厚切片,常規行組織學染色觀察。① Masson染色觀察損傷區域瘢痕增生情況,并行膠原容積分數半定量分析;② Nissl染色觀察神經元存活情況,并行尼氏體數量半定量分析;③ LFB染色觀察髓鞘分布和再生情況,并行髓鞘陽性表達面積半定量分析。
1.4.3 免疫熒光染色觀察
術后7 d同上法取材,制備脊髓切片,并取上述術后28 d部分切片脫蠟、乙醇梯度脫水后,EDTA修復液抗原修復。0.2%Triton X-100溶液避光條件下透膜10 min,10%FBS室溫封閉1 h。去除封閉液后,滴加CD31(1∶2 000)、NF200(1∶200)一抗,4℃過夜。PBS漂洗3次,滴加對應二抗(Alexa Fluor? 594標記山羊抗兔IgG,Alexa Fluor? 488標記山羊抗小鼠IgG),4℃濕盒內孵育1 h。PBS漂洗后滴入含有DAPI的防淬滅封片劑,封片,激光共聚焦顯微鏡下觀察內皮細胞標記分布,并通過Image J軟件半定量分析CD31陽性表達熒光強度。
1.4.4 Western blot檢測
術后7 d和28 d每組取3只大鼠同上法麻醉后,低溫取材、組織研磨裂解,經BCA法評估濃度,并上樣、轉膜及封閉。分別在術后7 d切片滴加一抗[Ang-1(1∶2 000)、Tie-2(1∶2 000)];術后28 d切片滴加一抗 [Ang-1(1∶2 000)、PDGF-B (1∶1 000)、Tie-2(1∶2 000)、VEGF-A(1∶1 000)、VEGFR2(1∶500)、PDGFR-β(1∶500)、NF200 (1∶1 000)],所有切片低溫過夜,二抗室溫孵育。經ECL法曝光及定影。Image Pro Plus軟件對掃描膠片圖像進行處理,分析目的條帶灰度,獲得目的蛋白相對表達量(目的蛋白和GAPDH的比值)。
1.5 統計學方法
采用SPSS25.0統計軟件進行分析。計量資料經Shapiro-Wilk正態性檢驗,符合正態分布的數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;不符合正態分布的數據以M(Q1,Q3)表示,組間比較采用Kruskal-Wallis H檢驗。檢驗水準α=0.05。
2 結果
2.1 行為學評分
BBB評分和改良Rivlin-Tator斜板實驗結果示,術前所有大鼠后肢功能均正常;術后1 d各組大鼠后肢完全癱瘓,并在3 d后逐漸恢復后肢運動功能。術后各時間點B~D組BBB評分和斜坡角度均顯著低于A組,C組術后7~28 d及D組術后3~28 d各指標顯著高于B組,D組術后14、28 d顯著高于C組,差異均有統計學意義(P<0.05)。見圖1。
 圖1
各組各時間點后肢運動功能檢測
圖1
各組各時間點后肢運動功能檢測
a. BBB評分;b. 改良Rivlin-Tator斜板實驗斜坡角度
Figure1. Variations of hind limb motor function at different time points in each groupa. BBB score; b. Climbing angle of modified Rivlin-Tator inclined plate test
2.2 組織學染色觀察
Masson染色示,A組灰質和白質組織結構排列緊密,未見藍染膠原纖維;B組斷端兩側組織結構與細胞排列雜亂,斷端兩側組織溶解形成空洞囊腔,斷端處嚴重纖維化,呈亮藍色;C組斷端處可見纖維瘢痕組織包裹的黑色導電顆粒,周圍炎癥細胞浸潤,并存在少量空洞囊腔;D組斷端可見少量散在黑色導電顆粒,周圍膠原纖維成分相對較少。B~D組膠原容積分數顯著高于A組,差異有統計學意義(P<0.05);D組低于B、C組,但僅與B組比較差異有統計學意義(P<0.05);B組高于C組,差異有統計學意義(P<0.05)。
Nissl染色示,A組灰、白質結構完整,灰質內神經元形態規整,尼氏體呈虎斑狀;B組神經元變性嚴重,表現為尼氏體溶解、數量明顯減少,形態異常;C組僅于損傷鄰近部位觀察到少數殘存神經元,尼氏體形態欠規整;D組損傷鄰近區域灰質內可見部分未凋亡的神經元,尼氏體固縮。B~D組損傷鄰近區域尼氏體數量顯著低于A組,差異有統計學意義(P<0.05);D組高于B、C組,但僅與B組比較差異有統計學意義(P<0.05);B、C組間差異無統計學意義(P>0.05)。
LFB染色示,A組脊髓組織髓鞘呈連續藍色結構,排列致密有序,結構完整;B組損傷周邊組織結構稀疏,白質出現溶解,神經纖維缺損;C、D組髓鞘結構損傷相對較輕,D組脊髓組織鄰近區域可見相對完整、連續的藍染髓鞘結構,髓鞘面積占比明顯高于B、C組。同時,C、D組損傷中心可見散在分布的導電顆粒,其周圍髓鞘密度高于B組。B~D組髓鞘陽性表達面積顯著低于A組,差異有統計學意義(P<0.05);D組低于B、C組,但僅與B組比較差異有統計學意義(P<0.05);B、C組間差異無統計學意義(P>0.05)。見圖2、表1。
 圖2
術后28 d各組組織學染色觀察(×20)
圖2
術后28 d各組組織學染色觀察(×20)
箭頭示導電顆粒,從左至右依次為A、B、C、D組 a. Masson染色;b. Nissl染色;c. LFB染色(黑色虛線示損傷區域和鄰近正常脊髓組織界線)
Figure2. Histological staining of spinal cord in each group at 28 days postoperatively (×20)Arrow showed conductive particles; from left to right for groups A, B, C, and D, respectively a. Masson staining; b. Nissl staining; c. LFB staining (Black dotted line showed the boundary between the area of injury and the adjacent normal spinal cord tissue)
 )
Table1.
Comparison of each indicator between groups after operation (n=6,
)
Table1.
Comparison of each indicator between groups after operation (n=6,  )
)
2.3 免疫熒光染色觀察
NF200免疫熒光染色示,A組脊髓組織結構完整,神經元形態規整,排列致密;B組NF200陽性神經絲呈點狀分布,鄰近區域幾乎未見完整神經元;C組損傷部位可見少量神經纖維生長;D組損傷部位NF200陽性纖維密度優于B、C組。見圖3。
 圖3
術后28 d各組NF200免疫熒光染色觀察(×40)
圖3
術后28 d各組NF200免疫熒光染色觀察(×40)
從左至右依次為A、B、C、D組
Figure3. Immunofluorescence staining for NF200 in each group at 28 days postoperatively (×40)From left to right for groups A, B, C, and D, respectively
CD31免疫熒光染色示,A組術后7、28 d均可見紅色熒光標記的內皮細胞,呈連續“線性”或類圓形形態;B、C組術后7 d損傷區域可見零星點狀分布的內皮細胞,未見明顯新生血管,術后28 d可見少量新生血管;D組術后7 d損傷區域周圍可見少量新生血管影,術后28 d可見管狀新生血管影。術后7 d各組間損傷區域CD31陽性表達熒光強度差異均無統計學意義(P>0.05);28 d,B~D組損傷區域CD31陽性表達熒光強度均顯著低于A組,差異有統計學意義(P<0.05);D組顯著高于B、C組,但僅與28 d的C組差異有統計學意義(P<0.05);B、C組間差異均無統計學意義(P>0.05)。見圖4、表1。
 圖4
術后7、28 d各組CD31免疫熒光染色觀察(激光共聚焦顯微鏡×60)
圖4
術后7、28 d各組CD31免疫熒光染色觀察(激光共聚焦顯微鏡×60)
箭頭示新生血管,從左至右依次為A、B、C、D組 a. 術后7 d;b. 術后28 d
Figure4. Immunofluorescence staining for CD31 in each group at 7 and 28 days postoperatively (Laser confocal microscope×60)Arrow showed angiogenesis; from left to right for groups A, B, C, and D, respectively a. At 7 days postoperatively; b. At 28 days postoperatively
2.4 Western blot檢測
Western blot檢測示術后28 d B~D組NF200蛋白相對表達量顯著低于A組,D組顯著高于B、C組,差異均有統計學意義(P<0.05);B、C組間差異無統計學意義(P>0.05)。
術后7、28 d B~D組Ang-1、Tie-2蛋白相對表達量高于A組,D組高于B、C組,差異有統計學意義(P<0.05);B、C組間差異無統計學意義(P>0.05)。術后28 d D組PDGF-B、PDGFR-β蛋白相對表達量顯著高于B、C組,B組顯著高于C組,差異有統計學意義(P<0.05)。術后28 d B~D組VEGF-A、VEGFR-2蛋白相對表達量高于A組,差異均有統計學意義(P<0.05);D組高于B、C組,D組與B組比較差異有統計學意義(P<0.05),與C組比較僅VEGF-A蛋白差異有統計學意義(P<0.05);B、C組間比較僅VEGFR-2蛋白差異有統計學意義(P<0.05)。見圖5、表1。
 圖5
Western blot檢測各組術后各時間點各蛋白表達凝膠電泳圖
圖5
Western blot檢測各組術后各時間點各蛋白表達凝膠電泳圖
Mr:相對分子質量 1:A組 2:B組 3:C組 4:D組 a. NF200;b. PDGF-B和PDGFR-β;c. VEGF-A和VEGFR-2;d. 術后7 d Ang-1和Tie-2;e. 術后28 d Ang-1和Tie-2
Figure5. The gel electrophoresis of different protein expressions in each group detected by Western blot assay at different postoperative timeMr: Relative molecular mass 1: Group A 2: Group B 3: Group C 4: Group D a. NF200; b. PDGF-B and PDGFR-β; c. VEGF-A and VEGFR-2; d. Ang-1 and Tie-2 at 7 days postoperatively; e. Ang-1 and Tie-2 at 28 days postoperatively
3 討論
近年來,通過多學科交叉協作,構建以水凝膠為基礎的組合式神經修復策略,在促進SCI后再神經化和血管化方面取得重要進展[20]。GelMA水凝膠是一種典型的光固化水凝膠,在光引發劑作用下迅速成膠,并具備細胞生長與分化的三維空間[21]。GelMA水凝膠中甲基丙烯酸酯基團與lysine基團的結合,使其具有相對良好的機械強度與溶脹率,同時能為細胞黏附提供合適位點[21]。通過化學交聯高導電性Ppy有機聚合物制備的新型高電活性水凝膠,不僅能有效加強細胞間生物電信號傳遞,誘導內源性神經元向水凝膠中遷移、存活,而且能夠較好地填充神經損傷后的空洞缺損,抑制瘢痕增生[15-16]。據此,我們以GelMA/Ppy為“骨架”,通過TMP中的共軛雙鍵與Ppy中的共軛雙鍵產生π-π堆積效應,攜載TMP,制備了攜載TMP藥物的導電水凝膠,初步表明其能有效緩釋TMP,調節炎癥反應,從而促進SCI后運動功能恢復[17],但其具體調控機制尚不明確。
本研究在此基礎上,進一步探索了TGTP修復SCI的有效性及作用機制。行為學評估顯示,D組相較于B、C組在改善SCI大鼠運動方面療效顯著。但D組尚未觀察到大鼠后足掌面著地的現象(BBB評分>8分),這可能與脊髓全橫斷模型創傷過大及觀察時間較短有關。我們進一步對損傷區域行組織學染色分析,以揭示D組運動功能恢復最佳的機制。纖維瘢痕大量增生是神經功能恢復受限的重要因素,不同于星形膠質細胞所產生的膠質瘢痕,局部上調的炎癥反應會誘導并加速纖維瘢痕的發生[22-23]。前期研究中,我們證實了TGTP植入或TMP腹腔注射均能有效抑制TNF-α等炎癥因子表達[11,17]。本研究中,我們通過Masson染色發現TGTP植入能夠有效降低損傷區域膠原容積分數,抑制纖維結締組織增生,從而減少纖維瘢痕形成,這可能與局部緩釋的TMP抑制炎癥反應密切相關。此外,尼氏體作為中樞神經元的特征性結構,其形態結構及數量的改變可評估神經元的功能狀態[24]。本研究中D組脊髓斷端周圍尼氏體數量明顯優于B、C組,尼氏體結構趨于正常,表明TGTP具有一定神經細胞保護作用。LFB染色結果也發現D組神經纖維排列相對有序,髓鞘密集緊致,髓鞘陽性表達面積優于B、C組。這與我們前期研究結果一致[15-17],即導電聚合物可能恢復局部電信號傳導,誘導軸突再生。同時,NF200陽性纖維相對表達量與分布情況進一步提示了TGTP促進神經修復的有效性。NF200作為神經絲的成分參與了軸突構成,能有效反映神經元結構完整性和再生情況。本研究結果也發現D組損傷區域NF200表達量優于B、C組。上述結果提示TGTP不僅能發揮鄰近組織的神經保護作用,在促進神經再生方面也有一定療效。
早期重建損傷區域血運與加速血管化進程,對于神經元存活至關重要。損傷區域微血管密度與損傷后運動功能恢復程度密切相關[7-8]。本研究發現,D組在損傷后7 d和28 d,血管內皮細胞特異性標記物CD31表達強度呈上升趨勢,并優于B、C組。同時,我們發現局部微血管密度動態變化過程和運動功能改善時間窗密切重合,即D組大鼠在損傷后3 d開始出現部分運動功能恢復,7 d時出現顯著運動功能改善,28 d時達到相對穩定狀態,與CD31陽性表達變化過程相似,與既往研究結果一致[6,25-26]。這進一步提示TGTP可能通過促進血管新生和重塑,改善局部血流量,從而促進神經功能的恢復。損傷部位再血管化受局部微環境影響,鄰近細胞或組織通過直接作用或旁分泌多種相關信號因子調控微血管新生進程[27]。其中,促血管生成因子、血管生成素及PDGF等分子與SCI后血管新生密切相關。VEGF-A作為神經血管構建的主要初始驅動因子,在脈管系統形成和功能維持中起著關鍵作用[28]。VEGF-A可誘導尖端細胞遷移方向與莖細胞增殖,促進血管新生;與下游VEGFR-2結合,介導血管內皮細胞增殖與肌動蛋白重組,維持微管穩定及加速血管管腔形成等多種生物學進程[29-31]。本研究結果顯示D組VEGF-A和VEGFR-2表達同步上調,并優于B、C組,提示TGTP可能通過調控此信號軸促進血管新生。VEGF-A/VEGFR-2軸可串擾內皮細胞中αvβ3整合素表達,調控血管新生,并受PDGFR-β蛋白負向調控[32]。本研究也發現C、D組PDGFR-β蛋白表達趨勢與VEGFR-2相反,與既往研究結果一致。此外,PDGF-B為PDGF家族成員,是一種多功能的調節性多肽,主要來源于血小板、損傷內皮細胞及巨噬細胞;其與周細胞表面受體PDGFR-β相結合二聚化,募集下游信號,促進周細胞遷移、纖維轉化和內皮小管成熟,在中樞系統微血管成熟和穩定中起重要作用[33]。Duan等[30]發現通過上調PDGF-B/PDFGR-β軸表達,能有效提升損傷區域新生血管周細胞覆蓋率,促進功能化血管形成,從而增強SCI后修復療效。Menezes等[34]發現上調PDGFR-β蛋白表達,可募集損傷鄰近區域周細胞向新生血管遷移,促進血管成熟。本研究中,C組PDGF-B、PDFGR-β蛋白表達明顯低于B組,而D組相關蛋白表達水平明顯上調,顯著優于B、C組。提示TMP藥物和導電水凝膠協同應用優于單一手段的治療模式,能有效正向調控PDGF-B/PDFGR-β信號通路,從而促進血管化。血管成熟和重塑過程中,血管生成素也起著關鍵作用。Ang-1是血管生成素家族中典型代表,主要由血管壁細胞表達,正常組織內表達含量較低,與酪氨酸受體Tie-2結合,通過調控內皮細胞間、內皮細胞與基質之間的緊密連接蛋白表達,減弱VEGF-A誘導的血管通透性改變以及募集內皮細胞遷移和管狀結構形成,促進血管成熟[35-36]。Herrera等[37]發現在損傷急性期Ang-1蛋白靶向遞送能增強內源性VEGF-A蛋白表達,促進損傷區域血管新生。疾病慢性期,注射Ang-1因子可有效促進內源性Ang-1/Tie-2蛋白過表達,增強血管重塑,同時抑制炎癥因子表達,減輕其對血管通透性的影響。因此,增強Ang-1的內源性表達,可能是加速血管重塑的關鍵蛋白。本研究中,損傷后7 d和28 d C組Ang-1和Tie-2蛋白相對表達量均低于B組,與熒光染色結果較一致,提示GTP可能抑制血管新生進程。既往研究發現水凝膠中導電顆粒成分,即Ppy可能誘導炎癥反應[16,38],本研究也發現導電顆粒周圍存在炎癥細胞浸潤。研究證實炎癥反應程度與血管網絡重塑過程密切相關[39-40],我們前期研究發現與GTP相比,TGTP能有效抑制炎癥反應,促進神經功能恢復[17]。本研究中D組血管新生相關蛋白表達顯著上調,且CD31熒光強度也明顯優于C組,提示TGTP可能抑制了Ppy誘導的炎癥反應,增強了水凝膠對血管新生相關蛋白的調控作用,促進血管新生和重塑過程,從而加速SCI修復。
綜上述,TGTP可能通過促進SCI后血管新生,同時保護神經元,從而改善損傷后神經功能的恢復。本研究也存在一定局限性,VEGF-A/VEGFR-2等相關蛋白可能與多條生物學過程相互串擾,其與血管生成的因果關系尚不明確。而本研究未進行細胞層面的探索,僅從動物及組織層面初步分析了水凝膠修復SCI的潛在機制,后續將進一步深入研究,明確其確切調控作用。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突
倫理聲明 研究方案經北京中醫藥大學實驗動物倫理委員會批準(BUCM-4-2021040802-2021);實驗動物生產許可證號:SCXK(京)2017-0005,實驗動物使用許可證號:SYXK(京)2020-0013
作者貢獻聲明 鄧博文、徐林、穆曉紅:研究設計及協助研究開展;蔣昇源、劉港、霍路遙、白惠中:研究實施及文章撰寫;李筱葉、徐杰:數據收集整理及統計分析