引用本文: 張克凡, 張晨晨, 任強, 王德寧, 孫力, 王鑫, 王耀敏, 石輝. 一次離心法制備兔貧白細胞富血小板血漿的離心條件研究. 中國修復重建外科雜志, 2024, 38(2): 183-188. doi: 10.7507/1002-1892.202311075 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
富血小板血漿(platelet-rich plasma,PRP)是通過分離自體全血制備的含有高濃度血小板的血漿[1],最初用于治療和預防出血。近20年來,PRP的應用已從口腔醫學拓展至各個醫學領域,特別是運動醫學和骨科等[2-3]。PRP根據不同分離制備方式分為多種類型,包括貧白細胞PRP(leucocyte-poor PRP,LP-PRP)、富白細胞PRP(leucocyte-rich PRP,LR-PRP)和富血小板纖維蛋白(platelet-rich fibrin,PRF)等[3],在臨床疾病治療中具有不同作用。
既往研究中將白細胞濃度低于全血基線的PRP定義為LP-PRP[4]。Lana等[5]設計的MARSPILL分類按照PRP成分差異進行區分,相較于其他類型,LP-PRP中白細胞濃度更低,并且存在更多抗炎作用因子和細胞合成代謝因子[6-7]。LP-PRP能夠釋放大量細胞因子和生長因子,如PDGF、TGF-β1、IGF、FGF-2和VEGF等,這些生物活性分子在損傷部位募集干細胞,促進生長因子和抗炎因子分泌,從而增強膠原蛋白和基質合成,起到組織修復作用[7],因此臨床常用于皮膚、軟骨、肩袖和肌腱修復等。
LP-PRP通常采用密度梯度離心法制備,Anitua等[8]的一次離心法、Petrungaro[9]和Aghaloo等[10]的兩次離心法均可制備。但這些離心方式存在血小板濃度偏低、活性降低和操作復雜等問題[11]。近年來,新型PRP制備裝置不斷涌現[12],如Arthrex ACP系統、Emcyte Genesis CS系統、Arteriocyte Magellan PRP系統、Harvest SmartPrep APC系統和Biomet GPS Ⅲ系統等,這些裝置具備更佳的無菌條件,同時能夠高效制備PRP。但在PRP基礎研究中多使用新西蘭兔作為實驗動物,其血液成分與人體存在較大差異[13],商業系統提供的PRP離心制備條件并不適用于兔模型實驗研究。
一次離心法制備LP-PRP操作簡單并且具有較高容錯率,是臨床中常用的制備方式,但一次離心法的離心條件尚無統一標準。同時目前的實驗研究[14]大多局限于LP-PRP作用效果的比較,缺乏LP-PRP制備離心條件的標準化研究。為此,本研究旨在探索一次離心法制備兔LP-PRP的最佳離心條件。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
3~4月齡健康雄性新西蘭兔16只,體質量1.9~2.4 kg,購自金豐實驗動物有限公司。實驗動物飼養于濱州醫學院附屬醫院動物實驗中心,實驗期間分籠獨立飼養,室內維持清潔、安靜、通風、干燥,室溫20~25℃,相對濕度30%~50%,人工光照12 h/d,動物可自由進食、飲水,適應性飼養1周后進行實驗。實驗過程中對動物的飼養、操作方法均符合《關于善待實驗動物的指導下意見》相關規定。
水合氯醛注射液、EDTA溶液(福州飛凈生物科技有限公司)。Arthrex ACP雙注射器系統(Arthrex公司,美國);HORIZON 24 FLEX-AH離心機(HORIZON公司,美國);Mindray BC-7500全自動血細胞分析儀(深圳邁瑞生物醫療電子股份有限公司)。
1.2 LP-PRP制備方法
使用Arthrex ACP雙注射器系統[12]的制備方式,即一次離心后取無白細胞上層血漿制備LP-PRP。采血管實驗前使用EDTA溶液潤管防止血液凝固,取16只新西蘭兔以10%水合氯醛靜脈注射麻醉后,于兔耳背中央動脈采集15 mL抗凝血,另外采集0.5 mL抗凝血測定血小板濃度作為對照;分別于1、2個月后重復取血步驟。將采集的48份血液標本隨機分為16組,每組3個標本。將血液標本置于離心半徑16.7 cm離心機中,在離心轉速1 200、1 300、1 400、1 500 r/min(對應離心力分別為269×g、315×g、365×g、420×g)和離心時間2、3、4、5 min下進行16種不同條件的離心處理。
1.3 觀測指標
根據Arthrex ACP雙注射器系統設備說明,各組離心后采集分離平面1.5 mL以上的血漿(即為LP-PRP),混勻后進行血常規檢驗。計算并比較各組以下指標:① LP-PRP體積:測量采集血漿的體積;② LP-PRP血小板富集系數:計算公式為PRP中血小板濃度/全血中血小板濃度;③ LP-PRP血小板回收率:計算公式為(LP-PRP體積×LP-PRP中血小板濃度)/(全血體積×全血中血小板濃度)×100%。
1.4 統計學方法
采用SPSS21.0統計軟件進行分析。計量資料行Shapiro-Wilk正態性檢驗和Levene同質性檢驗,符合正態分布的數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗。檢驗水準α=0.05。
2 結果
2.1 LP-PRP體積
所有離心條件下獲得的LP-PRP體積范圍為1.8~7.6 mL。相同離心轉速時,隨離心時間延長,LP-PRP體積顯著增大,各離心時間組間兩兩比較差異均有統計學意義(P<0.05)。離心2 min時,1 200、1 300 r/min轉速下LP-PRP體積<2.0 mL,兩組間差異無統計學意義(P>0.05),其余條件下獲得的LP-PRP體積均≥2.0 mL;離心4、5 min時,各轉速下獲得的LP-PRP體積均≥4.0 mL。見圖1a。
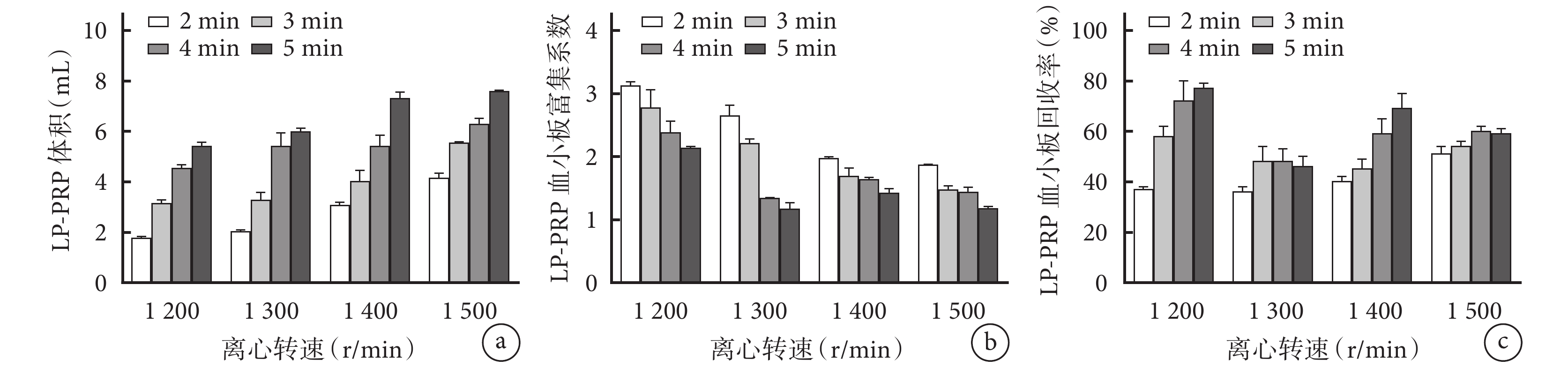 圖1
不同離心轉速及離心時間下各指標比較
圖1
不同離心轉速及離心時間下各指標比較
a. LP-PRP體積;b. LP-PRP血小板富集系數;c. LP-PRP血小板回收率
Figure1. Comparison of each index under different centrifugal speed and centrifugal timea. LP-PRP volume; b. Platelet enrichment coefficient of LP-PRP; c. Platelet recovery rate of LP-PRP
2.2 LP-PRP血小板富集系數
相同離心轉速時,隨離心時間延長,LP-PRP血小板富集系數呈降低趨勢。1 200 r/min轉速下各離心時間組和1 300 r/min轉速下離心2、3 min組LP-PRP血小板富集系數均>2.0,其余條件下獲得的LP-PRP血小板富集系數均<2.0。1 200 r/min轉速下離心2 min能夠獲得最高的LP-PRP血小板富集系數,與相同轉速下其余時間組比較差異均有統計學意義(P<0.05);1 200 r/min轉速下離心3 min與1 300 r/min轉速下離心2 min組LP-PRP血小板富集系數均>2.5,但兩組間比較差異無統計學意義(P>0.05)。見圖1b。
2.3 LP-PRP血小板回收率
1 200 r/min轉速下離心4、5 min與1 400 r/min轉速下離心5 min所得LP-PRP血小板回收率均>60%,其余條件下獲得的LP-PRP血小板回收率均<60%;1 200 r/min轉速下離心4、5 min組間比較差異無統計學意義(P>0.05);1 400 r/min轉速下離心5 min組LP-PRP血小板回收率小于1 200 r/min轉速下離心5 min組,差異有統計學意義(P<0.05)。見圖1c。
3 討論
LP-PRP是全血離心制得的含有高濃度血小板及較少白細胞的血漿,含有豐富的生長因子和細胞因子,對于促進組織修復和生物學再生具有獨特優勢。LP-PRP在組織工程、再生醫學以及臨床治療方面展現出巨大潛力,同時在骨科、運動醫學和整形外科等領域的應用日益廣泛。然而目前制備LP-PRP的離心條件尚無統一標準,鑒于此,我們分析了一次離心法制備兔LP-PRP時離心轉速和離心時間對LP-PRP性質的影響,并探究了最佳制備離心條件。
3.1 LP-PRP體積的選擇
LP-PRP常用于兔骨關節炎模型、肌腱病模型和皮膚創面模型的研究,各疾病模型所需PRP體積和兔采血量要求不同。在骨關節炎治療中,關節腔大小決定了所需PRP體積,Huang等[15]的兔骨關節炎模型軟骨研究中采集了0.6 mL PRP進行膝關節腔注射,鐘陽[16]的兔顳下頜關節骨關節炎研究中使用了0.2 mL PRP進行注射治療。對于運動系統疾病模型,Zhou等[17]對兔髕腱的研究和Kurnaz等[18]對兔半月板撕裂模型的研究均采集了約4 mL PRP,Jiang等[19]對兔跟腱模型的研究中則使用了更少量(200 μL)PRP。本研究結果發現,我們采集的15 mL血液在各離心條件下均能制備1 mL以上LP-PRP,在各轉速下離心4、5 min能夠制得4 mL以上LP-PRP,以供多次治療使用。因此本實驗中采用的離心條件更適用于兔膝關節、髕腱和跟腱等部位的研究,以及需要進行多次PRP治療的實驗研究。
兔模型研究中的采血量需要根據具體實驗要求進行選擇,Kurnaz等[18]、Jiang等[19]、Gelalis等[20]和Xue等[21]的研究中采血量均<15 mL;Zhou等[17]的實驗中采集單只兔全血27 mL,但其輸注了等量生理鹽水以恢復血容量。而本研究中一次采血15 mL,并以1個月為時間間隔進行多次采血,滿足了大多數實驗的要求,且并未出現兔死亡情況。
3.2 LP-PRP血小板富集系數
Anitua等[8]發現,血小板濃度與釋放的生長因子之間存在直接相關性。因此PRP的血小板富集系數是評估PRP性質和組織修復能力的重要指標[22-23]。Graziani等[24]比較了不同血小板富集系數(2.5、3.5、4.2和5.5)的PRP對成骨細胞培養的影響,結果表明血小板富集系數為2.5時PRP能產生最大作用,而過高的血小板富集系數則帶來抑制作用。一項兔模型的骨再生研究[25]表明,血小板富集系數為2~6時能夠產生積極生物學效應。Anitua等[26]使用不同血小板濃度的PRP培養成纖維細胞發現,PRP血小板富集系數為2~4時可獲得最大細胞增殖率。本實驗中1 200 r/min轉速下各離心時間及1 300 r/min轉速下離心2、3 min均可達到LP-PRP血小板富集系數>2.0;同時,LP-PRP血小板富集系數峰值出現在1 200 r/min轉速下離心2 min時,而此時LP-PRP體積最小。通過分析我們認為,當繼續降低轉速或縮減離心時間能夠出現更高血小板富集系數的LP-PRP,但會出現離心不充分情況,導致紅細胞未能沉積于最下層,白細胞未能沉積于白膜層,從而使上層血漿的成分混雜。
一次離心法制備LP-PRP的原理是利用血液成分的密度差異,低離心力作用使血小板懸浮于血漿層,白細胞和紅細胞分別趨向于白膜層和填充層[27-28]。張昭遠等[29]認為,當紅細胞濃度達到最大時,血小板與白細胞因空間被擠壓而離開填充層,形成白膜層。本研究中我們發現,超過1 500 r/min轉速時,1 min以上離心時間易造成血小板過多沉積于白膜層而使制備失敗。同時有文獻[30]報道,過高離心力或過長離心時間會影響血小板活性。結合實驗結果我們認為,一次離心法制備LP-PRP需要采取低轉速、短時間離心,使白細胞沉積而血小板處于懸浮狀態,因此在能滿足血小板富集系數>2.0的條件下,宜選擇1 200 r/min轉速離心。
3.3 LP-PRP血小板回收率
血小板回收率是指在離心過程中從全血中回收的血小板數量與原始全血中血小板數量之比,反映了離心過程中血小板的損失程度,血小板回收率越高,血小板損失程度越低。與以往研究中追求高血小板濃度的觀點不同,Boswell等[31]認為是PRP中血小板數量而非血小板濃度影響了PRP的最大生物學效益,原因是組織中的細胞因子靶點有限,血小板濃度的進一步增加不會導致合成代謝進一步上調。
Harrison等[32]比較了離心轉速和離心時間不同的一次離心法制備PRP技術,結果顯示PRP血小板回收率范圍為50%~72%。Su等[33]和金哲等[34]的研究同樣報道了60%~80%的血小板回收率,并證明了該血小板回收率范圍內PRP具有生物反應性。本研究中,1 200 r/min轉速下離心4、5 min能夠達到LP-PRP血小板回收率>60%,且兩組間差異無統計學意義(P>0.05);同時,在1 400 r/min轉速下離心5 min也能達到LP-PRP血小板回收率>60%,但在此離心條件下血小板富集系數<2.0。因此1 200 r/min轉速下離心4 min能夠在最短時間達到最高的PRP血小板回收率。
既往研究中未提及血小板富集系數與血小板回收率的聯系,本研究結果發現,1 200 r/min轉速下隨著離心時間延長,LP-PRP血小板富集系數和血小板回收率出現了此消彼長的趨勢,但在更高轉速時這種趨勢并不明顯。結合實驗結果和既往研究分析發現,一次離心法制備PRP時很少出現血小板回收率>80%的報道,我們認為一次離心法需要舍棄通過紅細胞擠壓聚集的血小板,因此制得LP-PRP的血小板回收率難以達到80%以上。
3.4 實驗局限性和展望
本研究提示了一次離心法制備兔LP-PRP過程中離心轉速和離心時間對LP-PRP性質的影響,展現了LP-PRP的體積、血小板富集系數和血小板回收率在不同離心條件下的變化。雖然篩選出了最佳離心條件,但在該離心條件下制得的LP-PRP能否發揮應有的組織修復作用,血小板能否釋放足夠的有效作用因子還需要進一步實驗驗證。同時,Ozer等[27]和Piao等[35]發現平均血小板體積可被視為PRP生物反應性的潛在標志物。我們下一步將進行更大樣本量和更多評估指標的實驗研究,逐步解決LP-PRP制備中一些有爭議的問題。
在將來LP-PRP有望成為定制治療方案的一部分,即根據患者的個體特征和疾病需要調整LP-PRP的制備條件,實現更精準、有效的治療。因此需要針對不同疾病開展長期研究和臨床推廣,為其在醫學實踐中的廣泛應用提供更充足的證據支持。
綜上述,采用一次離心法制備兔LP-PRP時,采集15 mL血液以離心半徑16.7 cm、1 200 r/min轉速下離心4 min即可制備體積>2.0 mL、血小板富集系數>2.0且血小板回收率>60%的LP-PRP,在最短時間達到LP-PRP的最佳作用參數。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經濱州醫學院附屬醫院實驗動物倫理委員會批準(20221014-36);實驗動物使用許可證號:SYXK(魯)20180006
作者貢獻聲明 張克凡:參與實驗設計與實施、數據收集整理及統計分析、文章撰寫;張晨晨:對實驗操作過程進行指導與實施;石輝、任強:對實驗方案和文章的知識性內容作批評性審閱;王德寧、王鑫:參與實驗設計與實施;孫力、王耀敏:參與實驗實施與數據統計分析
富血小板血漿(platelet-rich plasma,PRP)是通過分離自體全血制備的含有高濃度血小板的血漿[1],最初用于治療和預防出血。近20年來,PRP的應用已從口腔醫學拓展至各個醫學領域,特別是運動醫學和骨科等[2-3]。PRP根據不同分離制備方式分為多種類型,包括貧白細胞PRP(leucocyte-poor PRP,LP-PRP)、富白細胞PRP(leucocyte-rich PRP,LR-PRP)和富血小板纖維蛋白(platelet-rich fibrin,PRF)等[3],在臨床疾病治療中具有不同作用。
既往研究中將白細胞濃度低于全血基線的PRP定義為LP-PRP[4]。Lana等[5]設計的MARSPILL分類按照PRP成分差異進行區分,相較于其他類型,LP-PRP中白細胞濃度更低,并且存在更多抗炎作用因子和細胞合成代謝因子[6-7]。LP-PRP能夠釋放大量細胞因子和生長因子,如PDGF、TGF-β1、IGF、FGF-2和VEGF等,這些生物活性分子在損傷部位募集干細胞,促進生長因子和抗炎因子分泌,從而增強膠原蛋白和基質合成,起到組織修復作用[7],因此臨床常用于皮膚、軟骨、肩袖和肌腱修復等。
LP-PRP通常采用密度梯度離心法制備,Anitua等[8]的一次離心法、Petrungaro[9]和Aghaloo等[10]的兩次離心法均可制備。但這些離心方式存在血小板濃度偏低、活性降低和操作復雜等問題[11]。近年來,新型PRP制備裝置不斷涌現[12],如Arthrex ACP系統、Emcyte Genesis CS系統、Arteriocyte Magellan PRP系統、Harvest SmartPrep APC系統和Biomet GPS Ⅲ系統等,這些裝置具備更佳的無菌條件,同時能夠高效制備PRP。但在PRP基礎研究中多使用新西蘭兔作為實驗動物,其血液成分與人體存在較大差異[13],商業系統提供的PRP離心制備條件并不適用于兔模型實驗研究。
一次離心法制備LP-PRP操作簡單并且具有較高容錯率,是臨床中常用的制備方式,但一次離心法的離心條件尚無統一標準。同時目前的實驗研究[14]大多局限于LP-PRP作用效果的比較,缺乏LP-PRP制備離心條件的標準化研究。為此,本研究旨在探索一次離心法制備兔LP-PRP的最佳離心條件。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
3~4月齡健康雄性新西蘭兔16只,體質量1.9~2.4 kg,購自金豐實驗動物有限公司。實驗動物飼養于濱州醫學院附屬醫院動物實驗中心,實驗期間分籠獨立飼養,室內維持清潔、安靜、通風、干燥,室溫20~25℃,相對濕度30%~50%,人工光照12 h/d,動物可自由進食、飲水,適應性飼養1周后進行實驗。實驗過程中對動物的飼養、操作方法均符合《關于善待實驗動物的指導下意見》相關規定。
水合氯醛注射液、EDTA溶液(福州飛凈生物科技有限公司)。Arthrex ACP雙注射器系統(Arthrex公司,美國);HORIZON 24 FLEX-AH離心機(HORIZON公司,美國);Mindray BC-7500全自動血細胞分析儀(深圳邁瑞生物醫療電子股份有限公司)。
1.2 LP-PRP制備方法
使用Arthrex ACP雙注射器系統[12]的制備方式,即一次離心后取無白細胞上層血漿制備LP-PRP。采血管實驗前使用EDTA溶液潤管防止血液凝固,取16只新西蘭兔以10%水合氯醛靜脈注射麻醉后,于兔耳背中央動脈采集15 mL抗凝血,另外采集0.5 mL抗凝血測定血小板濃度作為對照;分別于1、2個月后重復取血步驟。將采集的48份血液標本隨機分為16組,每組3個標本。將血液標本置于離心半徑16.7 cm離心機中,在離心轉速1 200、1 300、1 400、1 500 r/min(對應離心力分別為269×g、315×g、365×g、420×g)和離心時間2、3、4、5 min下進行16種不同條件的離心處理。
1.3 觀測指標
根據Arthrex ACP雙注射器系統設備說明,各組離心后采集分離平面1.5 mL以上的血漿(即為LP-PRP),混勻后進行血常規檢驗。計算并比較各組以下指標:① LP-PRP體積:測量采集血漿的體積;② LP-PRP血小板富集系數:計算公式為PRP中血小板濃度/全血中血小板濃度;③ LP-PRP血小板回收率:計算公式為(LP-PRP體積×LP-PRP中血小板濃度)/(全血體積×全血中血小板濃度)×100%。
1.4 統計學方法
采用SPSS21.0統計軟件進行分析。計量資料行Shapiro-Wilk正態性檢驗和Levene同質性檢驗,符合正態分布的數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗。檢驗水準α=0.05。
2 結果
2.1 LP-PRP體積
所有離心條件下獲得的LP-PRP體積范圍為1.8~7.6 mL。相同離心轉速時,隨離心時間延長,LP-PRP體積顯著增大,各離心時間組間兩兩比較差異均有統計學意義(P<0.05)。離心2 min時,1 200、1 300 r/min轉速下LP-PRP體積<2.0 mL,兩組間差異無統計學意義(P>0.05),其余條件下獲得的LP-PRP體積均≥2.0 mL;離心4、5 min時,各轉速下獲得的LP-PRP體積均≥4.0 mL。見圖1a。
 圖1
不同離心轉速及離心時間下各指標比較
圖1
不同離心轉速及離心時間下各指標比較
a. LP-PRP體積;b. LP-PRP血小板富集系數;c. LP-PRP血小板回收率
Figure1. Comparison of each index under different centrifugal speed and centrifugal timea. LP-PRP volume; b. Platelet enrichment coefficient of LP-PRP; c. Platelet recovery rate of LP-PRP
2.2 LP-PRP血小板富集系數
相同離心轉速時,隨離心時間延長,LP-PRP血小板富集系數呈降低趨勢。1 200 r/min轉速下各離心時間組和1 300 r/min轉速下離心2、3 min組LP-PRP血小板富集系數均>2.0,其余條件下獲得的LP-PRP血小板富集系數均<2.0。1 200 r/min轉速下離心2 min能夠獲得最高的LP-PRP血小板富集系數,與相同轉速下其余時間組比較差異均有統計學意義(P<0.05);1 200 r/min轉速下離心3 min與1 300 r/min轉速下離心2 min組LP-PRP血小板富集系數均>2.5,但兩組間比較差異無統計學意義(P>0.05)。見圖1b。
2.3 LP-PRP血小板回收率
1 200 r/min轉速下離心4、5 min與1 400 r/min轉速下離心5 min所得LP-PRP血小板回收率均>60%,其余條件下獲得的LP-PRP血小板回收率均<60%;1 200 r/min轉速下離心4、5 min組間比較差異無統計學意義(P>0.05);1 400 r/min轉速下離心5 min組LP-PRP血小板回收率小于1 200 r/min轉速下離心5 min組,差異有統計學意義(P<0.05)。見圖1c。
3 討論
LP-PRP是全血離心制得的含有高濃度血小板及較少白細胞的血漿,含有豐富的生長因子和細胞因子,對于促進組織修復和生物學再生具有獨特優勢。LP-PRP在組織工程、再生醫學以及臨床治療方面展現出巨大潛力,同時在骨科、運動醫學和整形外科等領域的應用日益廣泛。然而目前制備LP-PRP的離心條件尚無統一標準,鑒于此,我們分析了一次離心法制備兔LP-PRP時離心轉速和離心時間對LP-PRP性質的影響,并探究了最佳制備離心條件。
3.1 LP-PRP體積的選擇
LP-PRP常用于兔骨關節炎模型、肌腱病模型和皮膚創面模型的研究,各疾病模型所需PRP體積和兔采血量要求不同。在骨關節炎治療中,關節腔大小決定了所需PRP體積,Huang等[15]的兔骨關節炎模型軟骨研究中采集了0.6 mL PRP進行膝關節腔注射,鐘陽[16]的兔顳下頜關節骨關節炎研究中使用了0.2 mL PRP進行注射治療。對于運動系統疾病模型,Zhou等[17]對兔髕腱的研究和Kurnaz等[18]對兔半月板撕裂模型的研究均采集了約4 mL PRP,Jiang等[19]對兔跟腱模型的研究中則使用了更少量(200 μL)PRP。本研究結果發現,我們采集的15 mL血液在各離心條件下均能制備1 mL以上LP-PRP,在各轉速下離心4、5 min能夠制得4 mL以上LP-PRP,以供多次治療使用。因此本實驗中采用的離心條件更適用于兔膝關節、髕腱和跟腱等部位的研究,以及需要進行多次PRP治療的實驗研究。
兔模型研究中的采血量需要根據具體實驗要求進行選擇,Kurnaz等[18]、Jiang等[19]、Gelalis等[20]和Xue等[21]的研究中采血量均<15 mL;Zhou等[17]的實驗中采集單只兔全血27 mL,但其輸注了等量生理鹽水以恢復血容量。而本研究中一次采血15 mL,并以1個月為時間間隔進行多次采血,滿足了大多數實驗的要求,且并未出現兔死亡情況。
3.2 LP-PRP血小板富集系數
Anitua等[8]發現,血小板濃度與釋放的生長因子之間存在直接相關性。因此PRP的血小板富集系數是評估PRP性質和組織修復能力的重要指標[22-23]。Graziani等[24]比較了不同血小板富集系數(2.5、3.5、4.2和5.5)的PRP對成骨細胞培養的影響,結果表明血小板富集系數為2.5時PRP能產生最大作用,而過高的血小板富集系數則帶來抑制作用。一項兔模型的骨再生研究[25]表明,血小板富集系數為2~6時能夠產生積極生物學效應。Anitua等[26]使用不同血小板濃度的PRP培養成纖維細胞發現,PRP血小板富集系數為2~4時可獲得最大細胞增殖率。本實驗中1 200 r/min轉速下各離心時間及1 300 r/min轉速下離心2、3 min均可達到LP-PRP血小板富集系數>2.0;同時,LP-PRP血小板富集系數峰值出現在1 200 r/min轉速下離心2 min時,而此時LP-PRP體積最小。通過分析我們認為,當繼續降低轉速或縮減離心時間能夠出現更高血小板富集系數的LP-PRP,但會出現離心不充分情況,導致紅細胞未能沉積于最下層,白細胞未能沉積于白膜層,從而使上層血漿的成分混雜。
一次離心法制備LP-PRP的原理是利用血液成分的密度差異,低離心力作用使血小板懸浮于血漿層,白細胞和紅細胞分別趨向于白膜層和填充層[27-28]。張昭遠等[29]認為,當紅細胞濃度達到最大時,血小板與白細胞因空間被擠壓而離開填充層,形成白膜層。本研究中我們發現,超過1 500 r/min轉速時,1 min以上離心時間易造成血小板過多沉積于白膜層而使制備失敗。同時有文獻[30]報道,過高離心力或過長離心時間會影響血小板活性。結合實驗結果我們認為,一次離心法制備LP-PRP需要采取低轉速、短時間離心,使白細胞沉積而血小板處于懸浮狀態,因此在能滿足血小板富集系數>2.0的條件下,宜選擇1 200 r/min轉速離心。
3.3 LP-PRP血小板回收率
血小板回收率是指在離心過程中從全血中回收的血小板數量與原始全血中血小板數量之比,反映了離心過程中血小板的損失程度,血小板回收率越高,血小板損失程度越低。與以往研究中追求高血小板濃度的觀點不同,Boswell等[31]認為是PRP中血小板數量而非血小板濃度影響了PRP的最大生物學效益,原因是組織中的細胞因子靶點有限,血小板濃度的進一步增加不會導致合成代謝進一步上調。
Harrison等[32]比較了離心轉速和離心時間不同的一次離心法制備PRP技術,結果顯示PRP血小板回收率范圍為50%~72%。Su等[33]和金哲等[34]的研究同樣報道了60%~80%的血小板回收率,并證明了該血小板回收率范圍內PRP具有生物反應性。本研究中,1 200 r/min轉速下離心4、5 min能夠達到LP-PRP血小板回收率>60%,且兩組間差異無統計學意義(P>0.05);同時,在1 400 r/min轉速下離心5 min也能達到LP-PRP血小板回收率>60%,但在此離心條件下血小板富集系數<2.0。因此1 200 r/min轉速下離心4 min能夠在最短時間達到最高的PRP血小板回收率。
既往研究中未提及血小板富集系數與血小板回收率的聯系,本研究結果發現,1 200 r/min轉速下隨著離心時間延長,LP-PRP血小板富集系數和血小板回收率出現了此消彼長的趨勢,但在更高轉速時這種趨勢并不明顯。結合實驗結果和既往研究分析發現,一次離心法制備PRP時很少出現血小板回收率>80%的報道,我們認為一次離心法需要舍棄通過紅細胞擠壓聚集的血小板,因此制得LP-PRP的血小板回收率難以達到80%以上。
3.4 實驗局限性和展望
本研究提示了一次離心法制備兔LP-PRP過程中離心轉速和離心時間對LP-PRP性質的影響,展現了LP-PRP的體積、血小板富集系數和血小板回收率在不同離心條件下的變化。雖然篩選出了最佳離心條件,但在該離心條件下制得的LP-PRP能否發揮應有的組織修復作用,血小板能否釋放足夠的有效作用因子還需要進一步實驗驗證。同時,Ozer等[27]和Piao等[35]發現平均血小板體積可被視為PRP生物反應性的潛在標志物。我們下一步將進行更大樣本量和更多評估指標的實驗研究,逐步解決LP-PRP制備中一些有爭議的問題。
在將來LP-PRP有望成為定制治療方案的一部分,即根據患者的個體特征和疾病需要調整LP-PRP的制備條件,實現更精準、有效的治療。因此需要針對不同疾病開展長期研究和臨床推廣,為其在醫學實踐中的廣泛應用提供更充足的證據支持。
綜上述,采用一次離心法制備兔LP-PRP時,采集15 mL血液以離心半徑16.7 cm、1 200 r/min轉速下離心4 min即可制備體積>2.0 mL、血小板富集系數>2.0且血小板回收率>60%的LP-PRP,在最短時間達到LP-PRP的最佳作用參數。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;課題經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經濱州醫學院附屬醫院實驗動物倫理委員會批準(20221014-36);實驗動物使用許可證號:SYXK(魯)20180006
作者貢獻聲明 張克凡:參與實驗設計與實施、數據收集整理及統計分析、文章撰寫;張晨晨:對實驗操作過程進行指導與實施;石輝、任強:對實驗方案和文章的知識性內容作批評性審閱;王德寧、王鑫:參與實驗設計與實施;孫力、王耀敏:參與實驗實施與數據統計分析