引用本文: 曹春風, 邵高海, 張銘華, 李波, 徐海濤, 張紅軍, 屈一鳴. 基于Notch/STAT3信號通路探討bFGF對大鼠脊髓損傷的治療機制. 中國修復重建外科雜志, 2024, 38(4): 480-486. doi: 10.7507/1002-1892.202312066 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
脊髓損傷(spinal cord injury,SCI)是臨床常見神經系統疾病,可引起神經元損傷,并伴隨星形膠質細胞活化及炎癥反應[1-2]。SCI具有較高致死率和致殘率,目前尚無有效治療手段,探索安全有效治療方法一直是臨床研究熱點[3]。星形膠質細胞活化及隨之形成的膠質瘢痕是阻礙脊髓再生修復的主要原因[4]。研究表明,Notch基因在細胞分化、增殖和凋亡過程中起著重要作用,可調控神經元生長、分化及SCI后星形膠質細胞活化過程,與STAT3相互作用,在神經毒性A1星形膠質細胞分化過程中發揮重要作用,因此阻斷Notch信號通路可抑制SCI后神經毒性A1星形膠質細胞的激活,是治療SCI的重要靶點[5]。STAT3是神經元分化、調控和功能恢復的重要轉錄因子,研究顯示抑制STAT3有利于大鼠SCI后的功能恢復,促進組織修復,改善損傷部位神經元分化[6]。另有研究證實,抑制Notch/STAT3信號通路可調控膠質母細胞增殖、凋亡及神經元生長、分化過程,并參與SCI后星形膠質細胞活化、神經元分化及軸突再生過程[7]。故探究Notch/STAT3信號通路在SCI中的調控作用,對闡明SCI神經再生修復機制具有一定意義。
bFGF是一種多功能細胞生長因子,廣泛存在于神經元中,可促進神經元分化和成熟,誘導突觸向神經纖維生長,維持神經元正常功能 [8-10]。近來研究發現bFGF可減少SCI神經元損傷并改善神經功能恢復,但具體分子生物學機制尚未明確[11]。我們分析bFGF可能通過調控Notch/STAT3信號通路促進脊髓再生修復,本研究通過建立大鼠SCI模型對此進行驗證,以期闡明其分子生物學機制,為臨床治療SCI提供參考。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
10周齡清潔級雄性SD大鼠56只,體質量358~379 g,購自重慶騰鑫生物公司,于重慶醫科大學實驗動物中心常規飼養。
bFGF凍干粉(北京博爾西科技有限公司),實驗前以生理鹽水溶解制備成濃度為10 μg/mL的bFGF溶液;HE染色試劑盒、Nissl染色試劑盒、碘化丙啶(propidium iodide,PI)染色試劑盒、膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)單克隆抗體、羊抗兔二抗、IL-1β、TNF-α、干擾素γ(interferon γ,IFN-γ)ELISA試劑盒、蛋白抽提試劑(重慶葉脈生物技術有限責任公司);Notch、STAT3、磷酸化-STAT3(phosphoryl-STAT3,p-STAT3)、BMP-2、β-肌動蛋白(β-actin)單克隆抗體(蘇州天隆生物科技有限公司)。
顯微鏡、酶標儀(福州康泰生物科技有限公司);蛋白成像儀(湛江安度斯生物有限公司);Image J 軟件(美國國立衛生研究院);Image Pro Plus 5.0 圖像分析系統(Media Cybernetics公司,美國)。
1.2 實驗方法
1.2.1 大鼠SCI模型建立及分組方法
實驗分為模型組、bFGF組、假手術組。首先,參照文獻 [12] 方法構建SCI大鼠模型。取40只大鼠俯臥位固定于手術臺,腹腔注射30 mg/kg戊巴比妥鈉麻醉后,作背部正中切口,鈍性分離皮下和肌肉組織,暴露T10棘突、椎板及其對應的硬脊膜及脊髓,將25 g擊打棍從35 cm高度自由落體撞擊T10棘突及對應脊髓。以鼠尾痙攣卷曲、雙后肢回縮且呈痙攣性擺動、撞擊部位脊髓水腫出血呈紫紅色、硬脊膜完整作為判斷SCI造模成功標準[12]。其中32只大鼠SCI造模成功,隨機分為模型組和bFGF組,每組16只。另取16只健康大鼠,參照上述方式麻醉后,作切口僅暴露T10棘突、硬脊膜和脊髓,作為假手術組。
造模后bFGF組大鼠按照100 μg/kg劑量腹腔注射bFGF[13],模型組和假手術組腹腔注射生理鹽水(100 μg/kg);每天注射1次,連續給藥28 d。術后3 d內,每天肌肉注射1次頭孢噻肟鈉注射劑(0.2 g/kg)預防感染。
1.2.2 觀測指標
① 運動功能評估:造模后觀察各組大鼠存活以及雙后肢功能恢復情況。于造模前及造模后即刻(0 d)及14 、28 d,對各組大鼠行BBB評分[14],由2名實驗觀察者進行盲檢并評分。
② 組織學觀察:造模后28 d BBB評分后,采用注射過量麻醉藥物處死各組大鼠,經原切口入路暴露T10脊髓。每組取其中8只大鼠損傷部位脊髓組織置于?70℃冰箱保存;余8只大鼠脊髓組織置于4%多聚甲醛固定,石蠟包埋,冠狀切片,片厚5 μm。取部分切片行HE、Nissl和PI染色,3種染色每只大鼠均使用3張連續切片,顯微鏡下觀察損傷部位脊髓組織病理學變化、神經元存活和凋亡情況,隨機取6個視野計數尼氏體和PI紅染細胞,取均值。
③ 免疫組織化學染色觀察: 取剩余切片(每只大鼠取3張連續冠狀切片),脫蠟、水化、抗原修復,添加GFAP一抗(1∶830)孵育10 h,繼續添加羊抗兔二抗(1∶2 460)孵育2.5 h,DAB顯色,蘇木精復染、透明、封片。光鏡下觀察呈棕色染色表示GFAP陽性表達,即活化星形膠質細胞。隨機取5個視野,用Image Pro Plus 5.0圖像分析系統對GFAP表達進行半定量分析,取均值。
④ ELISA檢測:取–70℃保存脊髓組織,室溫下解凍勻漿。取部分脊髓組織以3000×g離心10 min,取上清液,參照ELISA試劑盒說明書檢測脊髓組織炎癥因子IL-1β、TNF-α、IFN-γ水平。
⑤ Western blot檢測:取部分脊髓組織勻漿液,蛋白抽提試劑提取并測定蛋白濃度后,進行電泳、轉膜和封閉操作,加入一抗 [Notch(1∶1 380)、STAT3(1∶1 070)、p-STAT3(1∶1 070)、BMP-2(1∶1 450)、β-actin(1∶1 950)] 孵育12 h,繼續添加二抗(1∶2 530)孵育2.5 h,化學發光法顯色并拍照,Image J軟件分析各目的蛋白相對表達量,以與內參β-actin比值分別定量Notch和BMP-2相對表達,以p-STAT3/STAT3定量STAT3的磷酸化表達。
1.3 統計學方法
采用SPSS26.0統計軟件進行分析。計量資料采用Kolmogorov-Smirnov檢驗行正態性檢驗,均符合正態分布,以均數±標準差表示。BBB評分組間比較采用重復測量方差分析,若不滿足球形檢驗,采用Greenhouse-Geisser法進行校正,同一組別不同時間點間比較采用 Bonferroni 法,同一時間點不同組別間比較采用多因素方差分析。其余指標組間比較采用單因素方差分析,兩兩比較采用SNK檢驗。檢驗水準α=0.05。
2 結果
2.1 運動功能評估
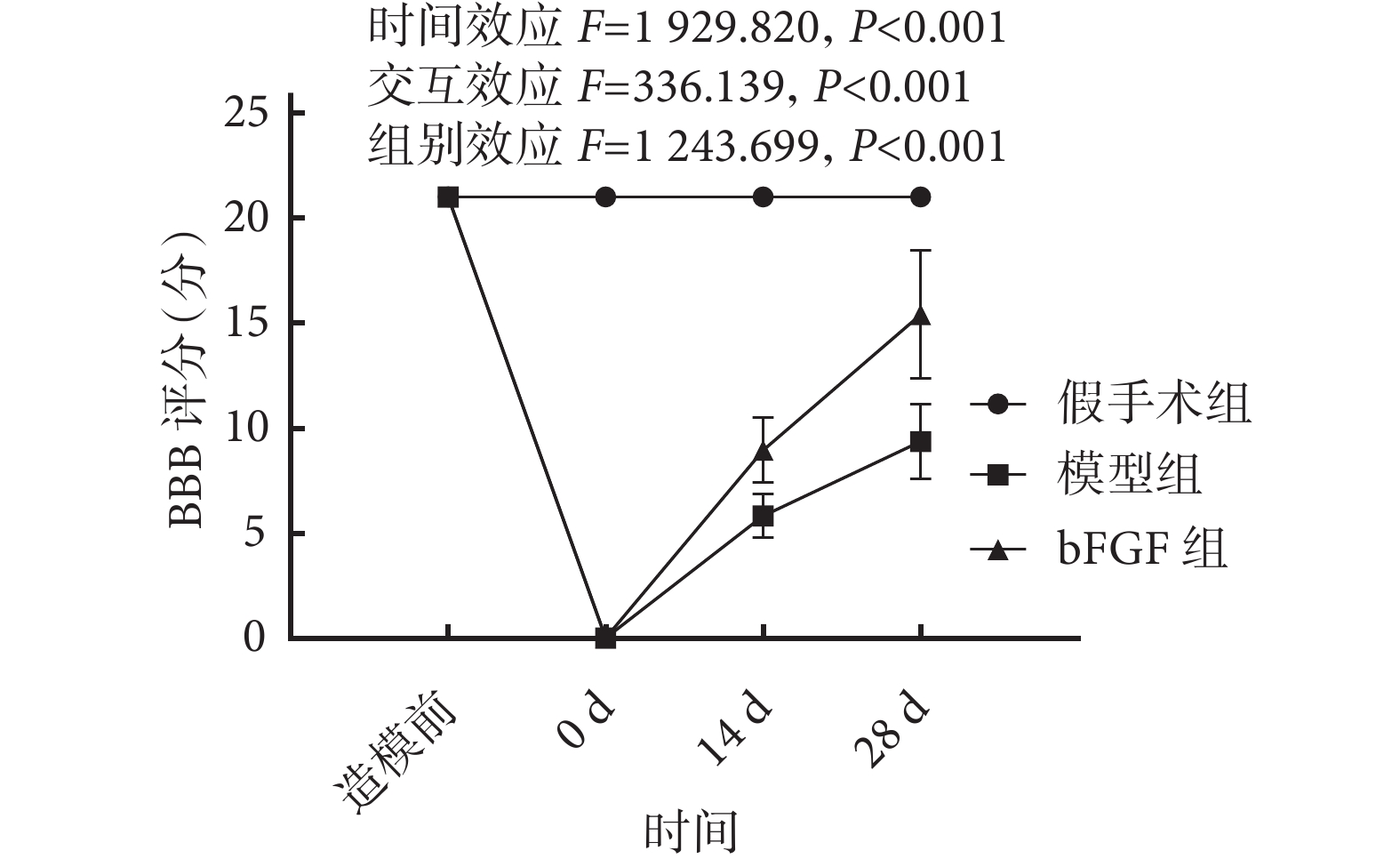
各組大鼠均存活至實驗完成。組間比較:造模前,3組BBB評分差異均無統計學意義(P>0.05)。造模后即刻,模型組及bFGF組BBB評分均較假手術組降低,差異有統計學意義(P<0.05)。造模后14、28 d,模型組BBB評分較假手術組降低,bFGF組較模型組升高,差異均有統計學意義(P<0.05)。組內比較:假手術組各時間點間差異均無統計學意義(P>0.05)。模型組、bFGF組與造模前比較,造模后即刻BBB評分降低,14、28 d評分逐漸升高,各時間點間差異均有統計學意義(P<0.05)。見圖1。
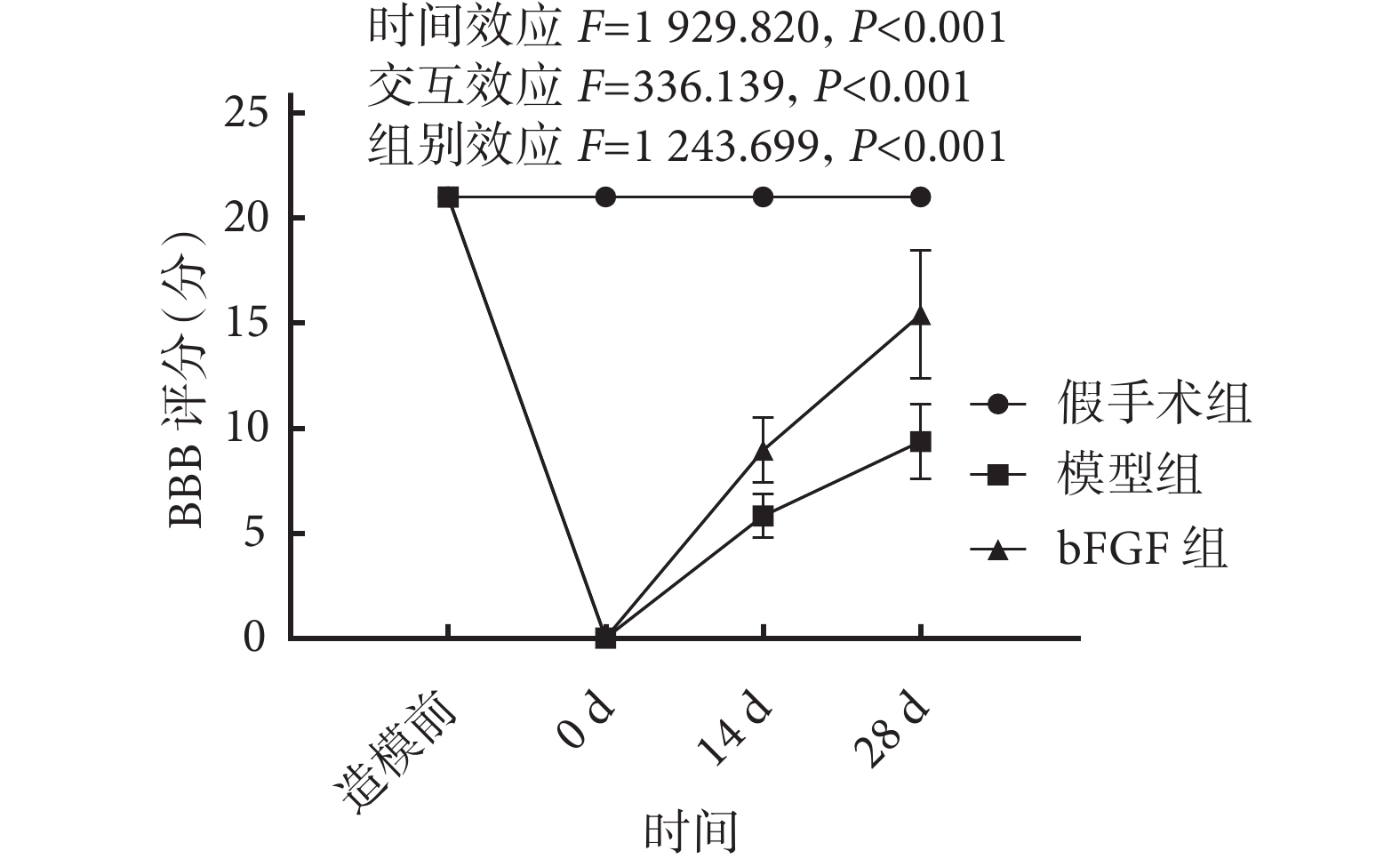 圖1
各組BBB評分變化趨勢
Figure1.
Change trend of BBB score in each group
圖1
各組BBB評分變化趨勢
Figure1.
Change trend of BBB score in each group
2.2 組織學觀察
2.2.1 HE染色
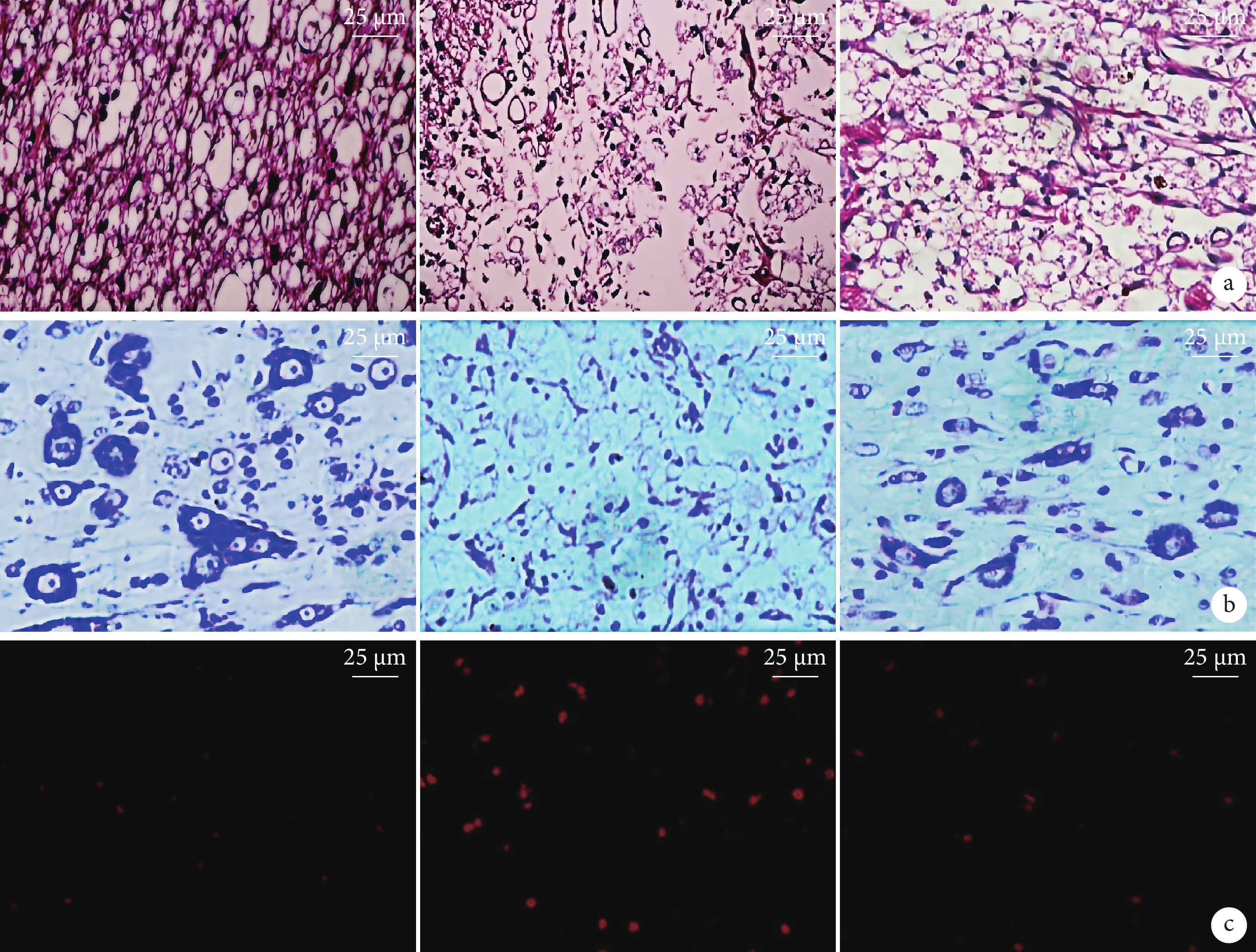
假手術組脊髓組織結構正常;模型組脊髓組織出現較多壞死灶,囊腔樣變化,可見較多膠質瘢痕及空洞;bFGF組可見脊髓組織壞死灶、膠質瘢痕及空洞較模型組明顯減少。見圖2a。
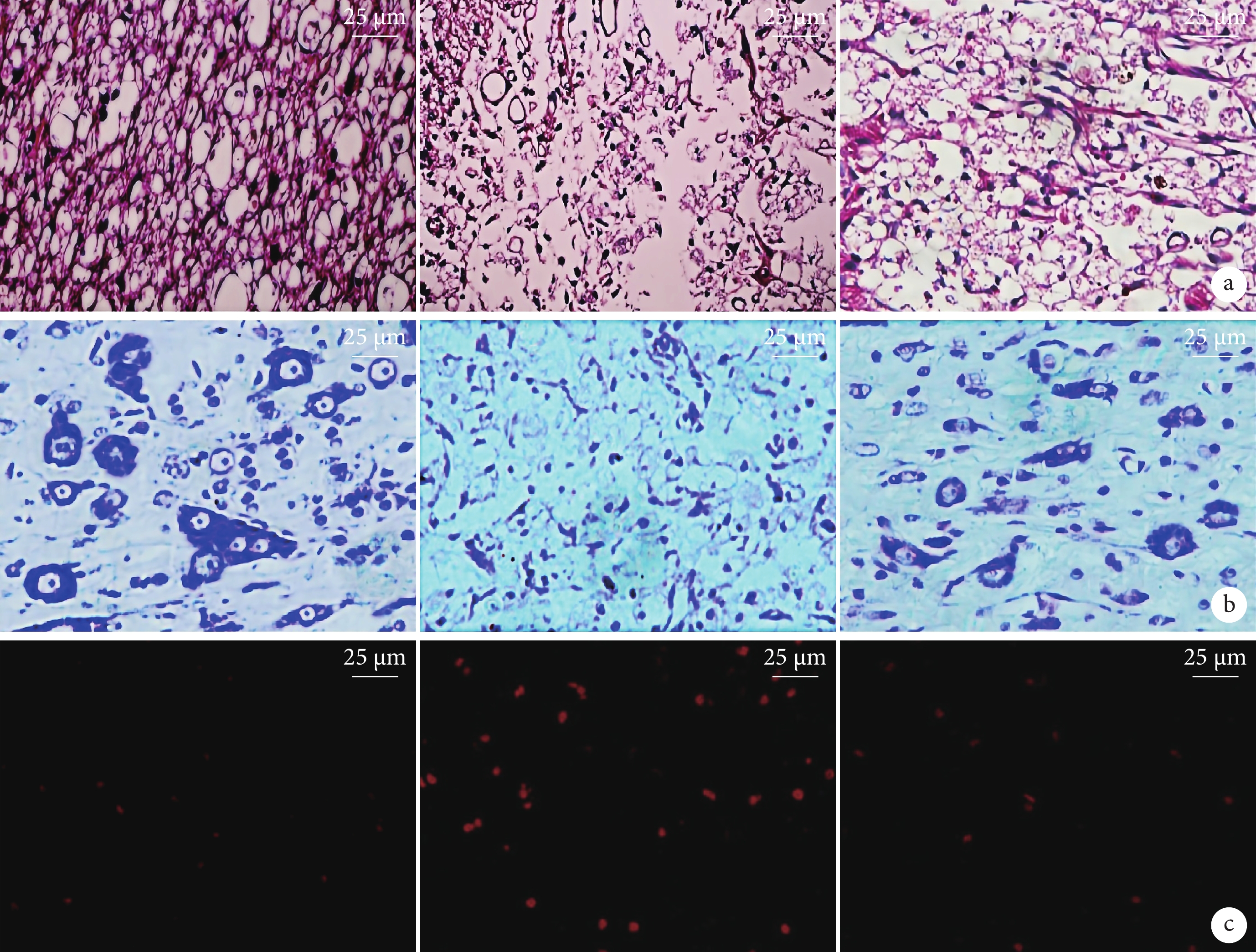 圖2
各組脊髓組織組織學觀察(×400)
圖2
各組脊髓組織組織學觀察(×400)
從左至右分別為假手術組、模型組、bFGF組 a. HE染色;b. Nissl染色;c. PI染色
Figure2. Histological observation of spinal cord tissue in each group (×400)From left to right for the sham-operation group, model group, and bFGF group, respectively a. HE staining; b. Nissl staining; c. PI staining
2.2.2 Nissl染色
假手術組脊髓組織尼氏體較多且結構清晰;模型組脊髓組織尼氏體呈細小顆粒狀,結構正常尼氏體較少;bFGF組脊髓組織尼氏體呈粗顆粒狀,可見部分結構正常尼氏體。見圖2b。模型組脊髓組織尼氏體數量較假手術組減少,bFGF組較模型組增加,差異均有統計學意義(P<0.05)。見表1、2。
 )
Table1.
Comparison of indicators in the three groups (n=8,
)
Table1.
Comparison of indicators in the three groups (n=8,  )
)
2.2.3 PI染色
3組均可見PI紅染細胞(圖2c)。模型組脊髓組織PI紅染細胞數量較假手術組增加,bFGF組較模型組減少,差異均有統計學意義(P<0.05)。見表1、2。
2.3 免疫組織化學染色觀察
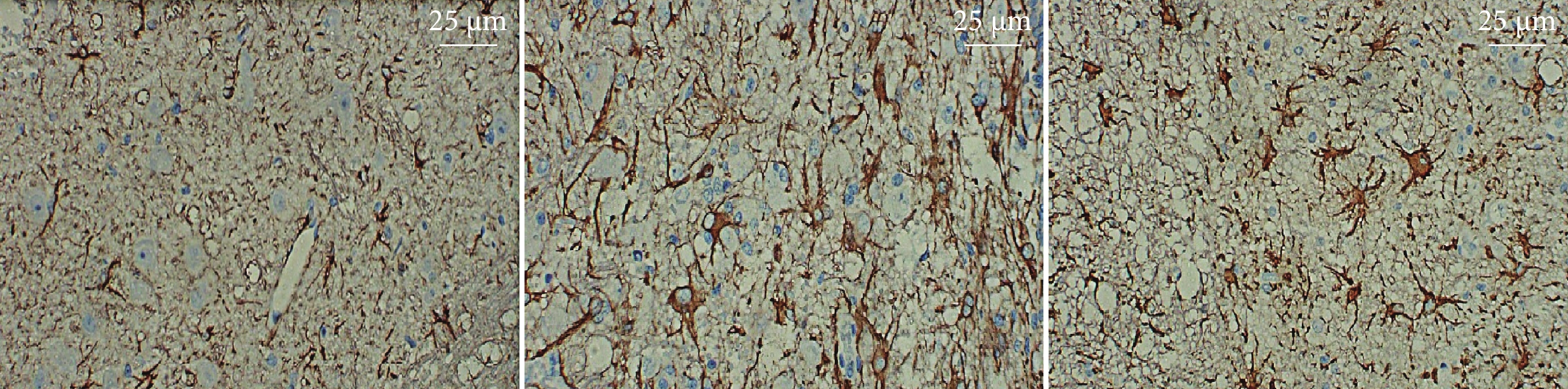
鏡下3組均可見活化星形膠質細胞(圖3)。模型組脊髓組織GFAP表達水平較假手術組升高,bFGF組較模型組降低,差異均有統計學意義(P<0.05)。見表1、2。
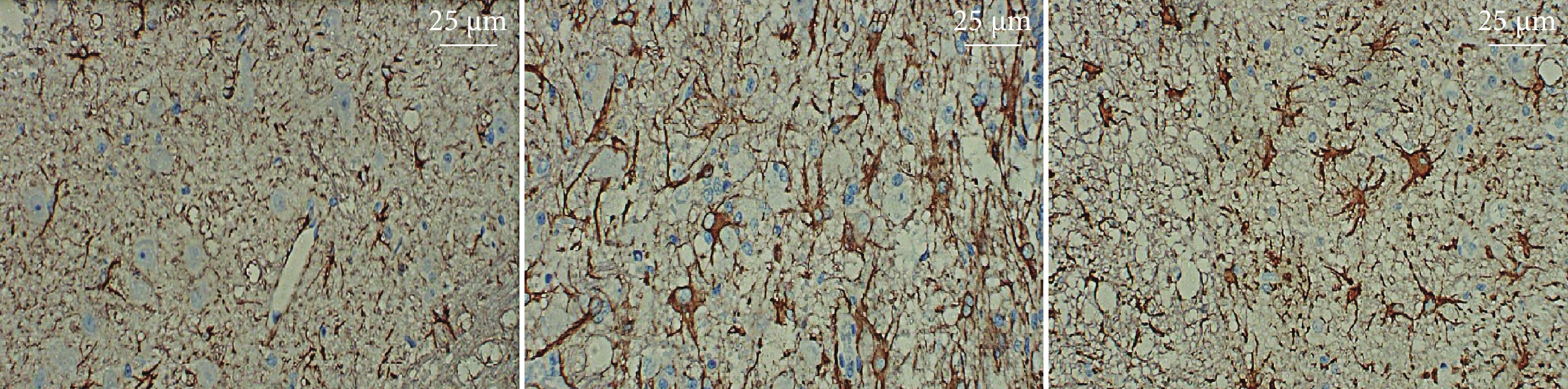 圖3
各組脊髓組織GFAP免疫組織化學染色觀察(×400)
圖3
各組脊髓組織GFAP免疫組織化學染色觀察(×400)
從左至右分別為假手術組、模型組、bFGF組
Figure3. GFAP immunohistochemical staining of spinal cord tissue in each group (×400)From left to right for the sham-operation group, model group, and bFGF group, respectively
2.4 ELISA檢測
模型組脊髓組織IL-1β、TNF-α、IFN-γ水平均較假手術組升高,bFGF組上述指標均較模型組降低,差異均有統計學意義(P<0.05)。見表1、2。
2.5 Western blot檢測
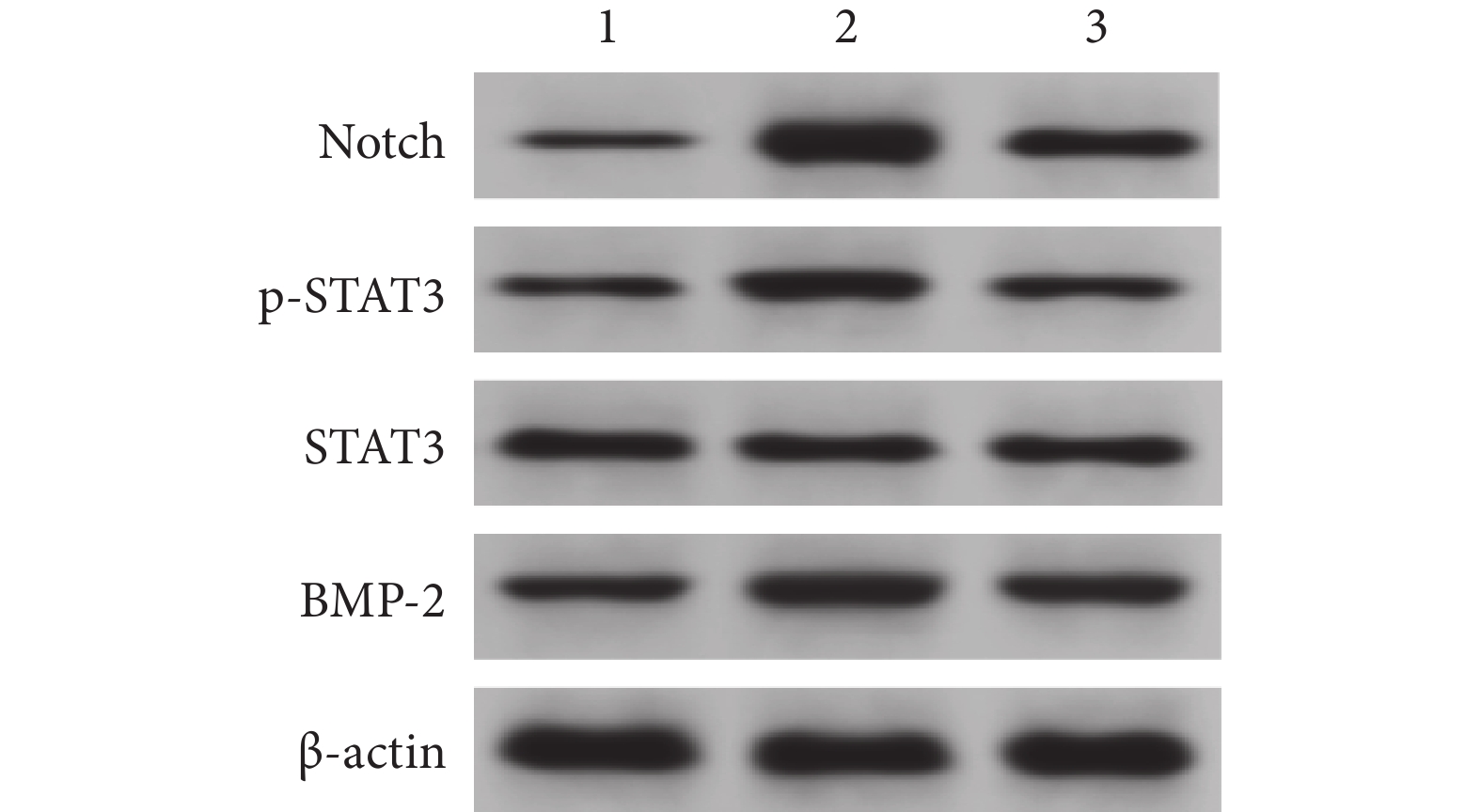
模型組脊髓組織p-STAT3/STAT3及Notch、BMP-2蛋白相對表達量較假手術組升高,bFGF組上述指標均較模型組降低,差異均有統計學意義(P<0.05)。見表1、2及圖4。
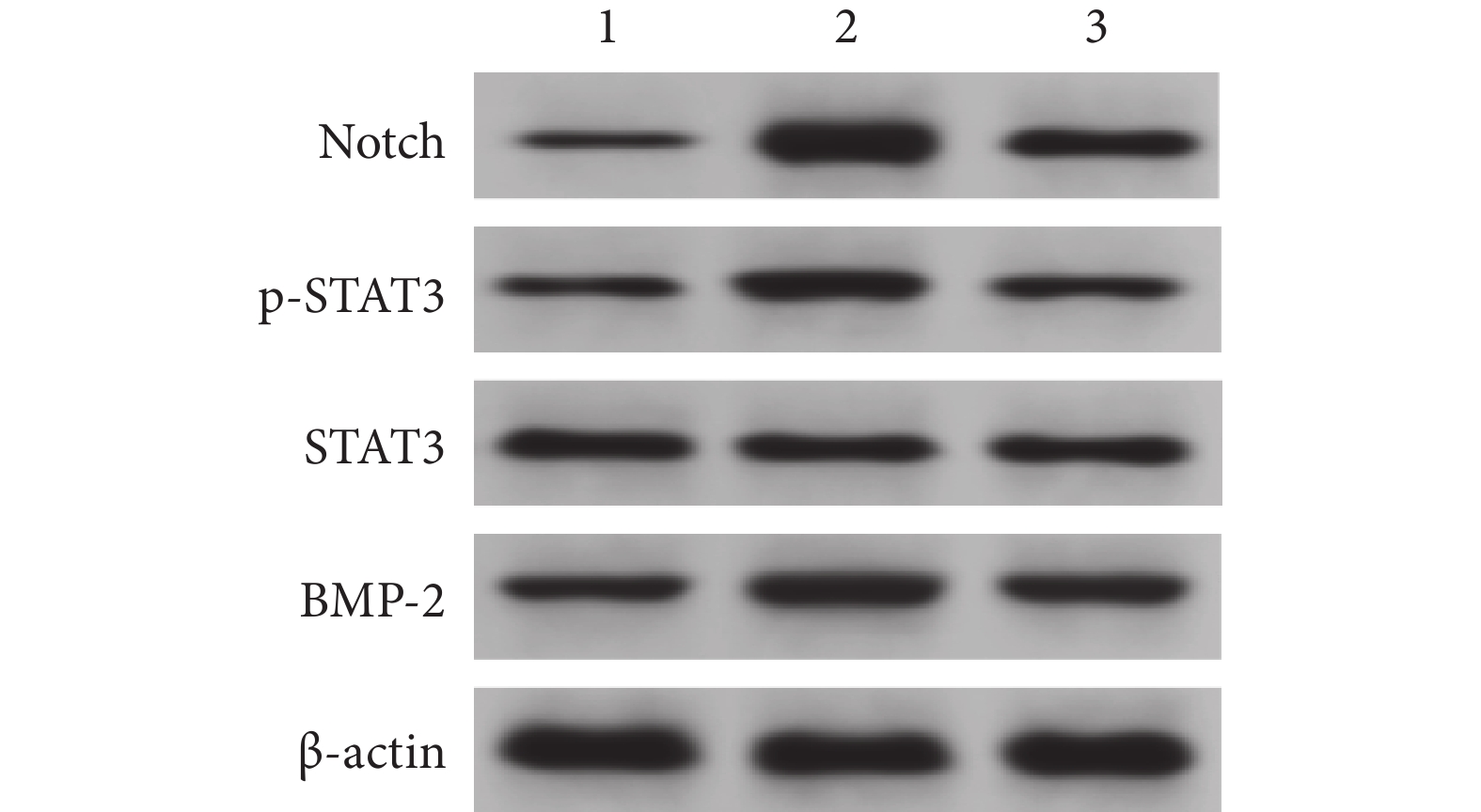 圖4
Western blot檢測脊髓組織Notch、p-STAT3、STAT3、BMP-2蛋白表達
圖4
Western blot檢測脊髓組織Notch、p-STAT3、STAT3、BMP-2蛋白表達
1:假手術組 2:模型組 3:bFGF組
Figure4. Notch, p-STAT3, STAT3, and BMP-2 protein expressions in spinal cord tissue detected by Western blot1: Sham-operation group 2: Model group 3: bFGF group
3 討論
SCI是一種致殘率高、恢復欠佳的中樞神經系統疾病,可造成不同程度四肢癱瘓或截癱[15-16]。研究證實SCI受損部位的星形膠質細胞胞體肥大、突起增多增大,活化星形膠質細胞增加并分泌神經抑制因子、胞外基質分子等,導致神經元凋亡和軸突再生障礙[17]。本研究發現,模型組大鼠脊髓組織出現較多壞死灶,結構正常尼氏體較少,運動功能BBB評分、脊髓組織尼氏體數量降低,脊髓組織PI紅染細胞數、GFAP表達及炎癥因子水平升高;表明SCI大鼠運動功能存在障礙,SCI處星形膠質細胞過度活化且伴隨炎癥反應,脊髓組織病理損傷嚴重,神經元存活狀況較差且凋亡嚴重。
bFGF可促進神經元分化和成熟,保護神經元并維持其正常功能[18]。Wu等[19]研究發現bFGF可促進SCI大鼠臍靜脈內皮細胞形成和血管新生,改善SCI部位炎癥微環境,抑制神經元凋亡和軸突萎縮。Huang等[20]報道過表達bFGF可減少SCI小鼠脊髓膠質瘢痕形成,使得神經再生和內源性神經干細胞增殖能力增強,恢復SCI小鼠運動功能。本研究采用腹腔注射bFGF,bFGF進入動物體內后會隨著血液循環被運輸到各個組織和器官,包括脊髓,并在脊髓中發揮作用[21]。研究結果顯示,在給予SCI大鼠bFGF干預后,脊髓組織壞死灶、膠質瘢痕及空洞較模型組明顯減少,尼氏體呈粗顆粒狀,可見部分結構正常尼氏體,BBB評分、脊髓組織尼氏體數量升高,PI紅染細胞數量、GFAP表達水平及炎癥因子水平降低,與Wu等[19]和Huang等[20]研究結果一致。提示bFGF可抑制神經元凋亡、星形膠質細胞活化、膠質瘢痕生成及炎癥反應,改善SCI大鼠脊髓組織病理損傷、神經元存活及運動功能,然而其作用機制并不明確。
Notch/STAT3信號通路參與SCI進程,SCI后會導致Notch信號被激活,進而促進下游因子STAT3通過活化p-STAT3使神經干細胞向星形膠質細胞分化,阻滯神經干細胞向神經元分化及神經再生[5, 22]。BMP-2是STAT3下游靶分子之一,SCI后活化的星形膠質細胞分泌BMP-2,促進脊髓膠質瘢痕形成[23]。研究表明,抑制Notch/STAT3信號通路可促進SCI大鼠脊髓神經元存活,增強神經元抗凋亡能力,抑制星形膠質細胞活性,從而發揮SCI治療作用[24]。本研究發現,模型組脊髓組織Notch、p-STAT3/STAT3、BMP-2蛋白表達水平較假手術組升高,表明SCI大鼠脊髓組織中Notch/STAT3信號通路被激活,這可能是SCI大鼠脊髓組織中活化星形膠質細胞及膠質瘢痕較多而神經元減少的原因。在給予SCI大鼠bFGF干預后,脊髓組織Notch、p-STAT3/STAT3、BMP-2蛋白表達水平降低,提示bFGF可抑制Notch/STAT3信號通路活性及下游因子BMP-2蛋白表達。結合Shen等[24]的研究結果,我們分析bFGF降低Notch/STAT3信號通路活性可能是其治療SCI大鼠的分子機制。
綜上述,bFGF能改善SCI大鼠運動功能和脊髓組織病理損傷,提高神經元存活率,抑制脊髓組織星形膠質細胞過度活化及炎癥反應,其分子機制可能與抑制Notch/STAT3信號通路的活性相關。本研究尚存在以下不足,一是未設置多個劑量的bFGF對SCI大鼠進行干預,以探究不同劑量bFGF的作用效果;二是未設置Notch/STAT3信號通路激活劑進行回復實驗;以上均需在后續研究中進一步改善。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經重慶醫科大學附屬永川醫院倫理委員會批準(基礎LS-2023-01-04);實驗動物使用許可證號:SYXK(渝)2022-0016
作者貢獻聲明 曹春風、邵高海:實驗設計、實施及文章撰寫;張銘華、李波、徐海濤、張紅軍:部分實驗數據收集及整理;屈一鳴:提供實驗思路、文章審閱
脊髓損傷(spinal cord injury,SCI)是臨床常見神經系統疾病,可引起神經元損傷,并伴隨星形膠質細胞活化及炎癥反應[1-2]。SCI具有較高致死率和致殘率,目前尚無有效治療手段,探索安全有效治療方法一直是臨床研究熱點[3]。星形膠質細胞活化及隨之形成的膠質瘢痕是阻礙脊髓再生修復的主要原因[4]。研究表明,Notch基因在細胞分化、增殖和凋亡過程中起著重要作用,可調控神經元生長、分化及SCI后星形膠質細胞活化過程,與STAT3相互作用,在神經毒性A1星形膠質細胞分化過程中發揮重要作用,因此阻斷Notch信號通路可抑制SCI后神經毒性A1星形膠質細胞的激活,是治療SCI的重要靶點[5]。STAT3是神經元分化、調控和功能恢復的重要轉錄因子,研究顯示抑制STAT3有利于大鼠SCI后的功能恢復,促進組織修復,改善損傷部位神經元分化[6]。另有研究證實,抑制Notch/STAT3信號通路可調控膠質母細胞增殖、凋亡及神經元生長、分化過程,并參與SCI后星形膠質細胞活化、神經元分化及軸突再生過程[7]。故探究Notch/STAT3信號通路在SCI中的調控作用,對闡明SCI神經再生修復機制具有一定意義。
bFGF是一種多功能細胞生長因子,廣泛存在于神經元中,可促進神經元分化和成熟,誘導突觸向神經纖維生長,維持神經元正常功能 [8-10]。近來研究發現bFGF可減少SCI神經元損傷并改善神經功能恢復,但具體分子生物學機制尚未明確[11]。我們分析bFGF可能通過調控Notch/STAT3信號通路促進脊髓再生修復,本研究通過建立大鼠SCI模型對此進行驗證,以期闡明其分子生物學機制,為臨床治療SCI提供參考。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
10周齡清潔級雄性SD大鼠56只,體質量358~379 g,購自重慶騰鑫生物公司,于重慶醫科大學實驗動物中心常規飼養。
bFGF凍干粉(北京博爾西科技有限公司),實驗前以生理鹽水溶解制備成濃度為10 μg/mL的bFGF溶液;HE染色試劑盒、Nissl染色試劑盒、碘化丙啶(propidium iodide,PI)染色試劑盒、膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)單克隆抗體、羊抗兔二抗、IL-1β、TNF-α、干擾素γ(interferon γ,IFN-γ)ELISA試劑盒、蛋白抽提試劑(重慶葉脈生物技術有限責任公司);Notch、STAT3、磷酸化-STAT3(phosphoryl-STAT3,p-STAT3)、BMP-2、β-肌動蛋白(β-actin)單克隆抗體(蘇州天隆生物科技有限公司)。
顯微鏡、酶標儀(福州康泰生物科技有限公司);蛋白成像儀(湛江安度斯生物有限公司);Image J 軟件(美國國立衛生研究院);Image Pro Plus 5.0 圖像分析系統(Media Cybernetics公司,美國)。
1.2 實驗方法
1.2.1 大鼠SCI模型建立及分組方法
實驗分為模型組、bFGF組、假手術組。首先,參照文獻 [12] 方法構建SCI大鼠模型。取40只大鼠俯臥位固定于手術臺,腹腔注射30 mg/kg戊巴比妥鈉麻醉后,作背部正中切口,鈍性分離皮下和肌肉組織,暴露T10棘突、椎板及其對應的硬脊膜及脊髓,將25 g擊打棍從35 cm高度自由落體撞擊T10棘突及對應脊髓。以鼠尾痙攣卷曲、雙后肢回縮且呈痙攣性擺動、撞擊部位脊髓水腫出血呈紫紅色、硬脊膜完整作為判斷SCI造模成功標準[12]。其中32只大鼠SCI造模成功,隨機分為模型組和bFGF組,每組16只。另取16只健康大鼠,參照上述方式麻醉后,作切口僅暴露T10棘突、硬脊膜和脊髓,作為假手術組。
造模后bFGF組大鼠按照100 μg/kg劑量腹腔注射bFGF[13],模型組和假手術組腹腔注射生理鹽水(100 μg/kg);每天注射1次,連續給藥28 d。術后3 d內,每天肌肉注射1次頭孢噻肟鈉注射劑(0.2 g/kg)預防感染。
1.2.2 觀測指標
① 運動功能評估:造模后觀察各組大鼠存活以及雙后肢功能恢復情況。于造模前及造模后即刻(0 d)及14 、28 d,對各組大鼠行BBB評分[14],由2名實驗觀察者進行盲檢并評分。
② 組織學觀察:造模后28 d BBB評分后,采用注射過量麻醉藥物處死各組大鼠,經原切口入路暴露T10脊髓。每組取其中8只大鼠損傷部位脊髓組織置于?70℃冰箱保存;余8只大鼠脊髓組織置于4%多聚甲醛固定,石蠟包埋,冠狀切片,片厚5 μm。取部分切片行HE、Nissl和PI染色,3種染色每只大鼠均使用3張連續切片,顯微鏡下觀察損傷部位脊髓組織病理學變化、神經元存活和凋亡情況,隨機取6個視野計數尼氏體和PI紅染細胞,取均值。
③ 免疫組織化學染色觀察: 取剩余切片(每只大鼠取3張連續冠狀切片),脫蠟、水化、抗原修復,添加GFAP一抗(1∶830)孵育10 h,繼續添加羊抗兔二抗(1∶2 460)孵育2.5 h,DAB顯色,蘇木精復染、透明、封片。光鏡下觀察呈棕色染色表示GFAP陽性表達,即活化星形膠質細胞。隨機取5個視野,用Image Pro Plus 5.0圖像分析系統對GFAP表達進行半定量分析,取均值。
④ ELISA檢測:取–70℃保存脊髓組織,室溫下解凍勻漿。取部分脊髓組織以3000×g離心10 min,取上清液,參照ELISA試劑盒說明書檢測脊髓組織炎癥因子IL-1β、TNF-α、IFN-γ水平。
⑤ Western blot檢測:取部分脊髓組織勻漿液,蛋白抽提試劑提取并測定蛋白濃度后,進行電泳、轉膜和封閉操作,加入一抗 [Notch(1∶1 380)、STAT3(1∶1 070)、p-STAT3(1∶1 070)、BMP-2(1∶1 450)、β-actin(1∶1 950)] 孵育12 h,繼續添加二抗(1∶2 530)孵育2.5 h,化學發光法顯色并拍照,Image J軟件分析各目的蛋白相對表達量,以與內參β-actin比值分別定量Notch和BMP-2相對表達,以p-STAT3/STAT3定量STAT3的磷酸化表達。
1.3 統計學方法
采用SPSS26.0統計軟件進行分析。計量資料采用Kolmogorov-Smirnov檢驗行正態性檢驗,均符合正態分布,以均數±標準差表示。BBB評分組間比較采用重復測量方差分析,若不滿足球形檢驗,采用Greenhouse-Geisser法進行校正,同一組別不同時間點間比較采用 Bonferroni 法,同一時間點不同組別間比較采用多因素方差分析。其余指標組間比較采用單因素方差分析,兩兩比較采用SNK檢驗。檢驗水準α=0.05。
2 結果
2.1 運動功能評估
各組大鼠均存活至實驗完成。組間比較:造模前,3組BBB評分差異均無統計學意義(P>0.05)。造模后即刻,模型組及bFGF組BBB評分均較假手術組降低,差異有統計學意義(P<0.05)。造模后14、28 d,模型組BBB評分較假手術組降低,bFGF組較模型組升高,差異均有統計學意義(P<0.05)。組內比較:假手術組各時間點間差異均無統計學意義(P>0.05)。模型組、bFGF組與造模前比較,造模后即刻BBB評分降低,14、28 d評分逐漸升高,各時間點間差異均有統計學意義(P<0.05)。見圖1。
 圖1
各組BBB評分變化趨勢
Figure1.
Change trend of BBB score in each group
圖1
各組BBB評分變化趨勢
Figure1.
Change trend of BBB score in each group
2.2 組織學觀察
2.2.1 HE染色
假手術組脊髓組織結構正常;模型組脊髓組織出現較多壞死灶,囊腔樣變化,可見較多膠質瘢痕及空洞;bFGF組可見脊髓組織壞死灶、膠質瘢痕及空洞較模型組明顯減少。見圖2a。
 圖2
各組脊髓組織組織學觀察(×400)
圖2
各組脊髓組織組織學觀察(×400)
從左至右分別為假手術組、模型組、bFGF組 a. HE染色;b. Nissl染色;c. PI染色
Figure2. Histological observation of spinal cord tissue in each group (×400)From left to right for the sham-operation group, model group, and bFGF group, respectively a. HE staining; b. Nissl staining; c. PI staining
2.2.2 Nissl染色
假手術組脊髓組織尼氏體較多且結構清晰;模型組脊髓組織尼氏體呈細小顆粒狀,結構正常尼氏體較少;bFGF組脊髓組織尼氏體呈粗顆粒狀,可見部分結構正常尼氏體。見圖2b。模型組脊髓組織尼氏體數量較假手術組減少,bFGF組較模型組增加,差異均有統計學意義(P<0.05)。見表1、2。
 )
Table1.
Comparison of indicators in the three groups (n=8,
)
Table1.
Comparison of indicators in the three groups (n=8,  )
)
2.2.3 PI染色
3組均可見PI紅染細胞(圖2c)。模型組脊髓組織PI紅染細胞數量較假手術組增加,bFGF組較模型組減少,差異均有統計學意義(P<0.05)。見表1、2。
2.3 免疫組織化學染色觀察
鏡下3組均可見活化星形膠質細胞(圖3)。模型組脊髓組織GFAP表達水平較假手術組升高,bFGF組較模型組降低,差異均有統計學意義(P<0.05)。見表1、2。
 圖3
各組脊髓組織GFAP免疫組織化學染色觀察(×400)
圖3
各組脊髓組織GFAP免疫組織化學染色觀察(×400)
從左至右分別為假手術組、模型組、bFGF組
Figure3. GFAP immunohistochemical staining of spinal cord tissue in each group (×400)From left to right for the sham-operation group, model group, and bFGF group, respectively
2.4 ELISA檢測
模型組脊髓組織IL-1β、TNF-α、IFN-γ水平均較假手術組升高,bFGF組上述指標均較模型組降低,差異均有統計學意義(P<0.05)。見表1、2。
2.5 Western blot檢測
模型組脊髓組織p-STAT3/STAT3及Notch、BMP-2蛋白相對表達量較假手術組升高,bFGF組上述指標均較模型組降低,差異均有統計學意義(P<0.05)。見表1、2及圖4。
 圖4
Western blot檢測脊髓組織Notch、p-STAT3、STAT3、BMP-2蛋白表達
圖4
Western blot檢測脊髓組織Notch、p-STAT3、STAT3、BMP-2蛋白表達
1:假手術組 2:模型組 3:bFGF組
Figure4. Notch, p-STAT3, STAT3, and BMP-2 protein expressions in spinal cord tissue detected by Western blot1: Sham-operation group 2: Model group 3: bFGF group
3 討論
SCI是一種致殘率高、恢復欠佳的中樞神經系統疾病,可造成不同程度四肢癱瘓或截癱[15-16]。研究證實SCI受損部位的星形膠質細胞胞體肥大、突起增多增大,活化星形膠質細胞增加并分泌神經抑制因子、胞外基質分子等,導致神經元凋亡和軸突再生障礙[17]。本研究發現,模型組大鼠脊髓組織出現較多壞死灶,結構正常尼氏體較少,運動功能BBB評分、脊髓組織尼氏體數量降低,脊髓組織PI紅染細胞數、GFAP表達及炎癥因子水平升高;表明SCI大鼠運動功能存在障礙,SCI處星形膠質細胞過度活化且伴隨炎癥反應,脊髓組織病理損傷嚴重,神經元存活狀況較差且凋亡嚴重。
bFGF可促進神經元分化和成熟,保護神經元并維持其正常功能[18]。Wu等[19]研究發現bFGF可促進SCI大鼠臍靜脈內皮細胞形成和血管新生,改善SCI部位炎癥微環境,抑制神經元凋亡和軸突萎縮。Huang等[20]報道過表達bFGF可減少SCI小鼠脊髓膠質瘢痕形成,使得神經再生和內源性神經干細胞增殖能力增強,恢復SCI小鼠運動功能。本研究采用腹腔注射bFGF,bFGF進入動物體內后會隨著血液循環被運輸到各個組織和器官,包括脊髓,并在脊髓中發揮作用[21]。研究結果顯示,在給予SCI大鼠bFGF干預后,脊髓組織壞死灶、膠質瘢痕及空洞較模型組明顯減少,尼氏體呈粗顆粒狀,可見部分結構正常尼氏體,BBB評分、脊髓組織尼氏體數量升高,PI紅染細胞數量、GFAP表達水平及炎癥因子水平降低,與Wu等[19]和Huang等[20]研究結果一致。提示bFGF可抑制神經元凋亡、星形膠質細胞活化、膠質瘢痕生成及炎癥反應,改善SCI大鼠脊髓組織病理損傷、神經元存活及運動功能,然而其作用機制并不明確。
Notch/STAT3信號通路參與SCI進程,SCI后會導致Notch信號被激活,進而促進下游因子STAT3通過活化p-STAT3使神經干細胞向星形膠質細胞分化,阻滯神經干細胞向神經元分化及神經再生[5, 22]。BMP-2是STAT3下游靶分子之一,SCI后活化的星形膠質細胞分泌BMP-2,促進脊髓膠質瘢痕形成[23]。研究表明,抑制Notch/STAT3信號通路可促進SCI大鼠脊髓神經元存活,增強神經元抗凋亡能力,抑制星形膠質細胞活性,從而發揮SCI治療作用[24]。本研究發現,模型組脊髓組織Notch、p-STAT3/STAT3、BMP-2蛋白表達水平較假手術組升高,表明SCI大鼠脊髓組織中Notch/STAT3信號通路被激活,這可能是SCI大鼠脊髓組織中活化星形膠質細胞及膠質瘢痕較多而神經元減少的原因。在給予SCI大鼠bFGF干預后,脊髓組織Notch、p-STAT3/STAT3、BMP-2蛋白表達水平降低,提示bFGF可抑制Notch/STAT3信號通路活性及下游因子BMP-2蛋白表達。結合Shen等[24]的研究結果,我們分析bFGF降低Notch/STAT3信號通路活性可能是其治療SCI大鼠的分子機制。
綜上述,bFGF能改善SCI大鼠運動功能和脊髓組織病理損傷,提高神經元存活率,抑制脊髓組織星形膠質細胞過度活化及炎癥反應,其分子機制可能與抑制Notch/STAT3信號通路的活性相關。本研究尚存在以下不足,一是未設置多個劑量的bFGF對SCI大鼠進行干預,以探究不同劑量bFGF的作用效果;二是未設置Notch/STAT3信號通路激活劑進行回復實驗;以上均需在后續研究中進一步改善。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經重慶醫科大學附屬永川醫院倫理委員會批準(基礎LS-2023-01-04);實驗動物使用許可證號:SYXK(渝)2022-0016
作者貢獻聲明 曹春風、邵高海:實驗設計、實施及文章撰寫;張銘華、李波、徐海濤、張紅軍:部分實驗數據收集及整理;屈一鳴:提供實驗思路、文章審閱