引用本文: 蔡東峰, 楊子肖, 鐘超, 張靖, 洪嵩. miR-515-5p靶向Toll樣受體4調控髓樣分化因子88/NF-κB通路抑制骨關節炎軟骨細胞凋亡及炎癥反應的分子機制研究. 中國修復重建外科雜志, 2024, 38(3): 315-323. doi: 10.7507/1002-1892.202312091 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
骨關節炎(osteoarthritis,OA)是一種退行性關節疾病,主要表現為關節軟骨的漸進性損傷、軟骨細胞凋亡以及關節炎癥,導致患者身體殘疾,嚴重影響生活質量[1-2]。研究表明,軟骨細胞凋亡以及促炎因子的產生與OA進展密切相關[3-4]。因此,抑制軟骨細胞凋亡和緩解炎癥反應是治療OA的有效措施。然而,OA的具體發病機制尚不明確。
miRNA是一類非編碼小RNA,其可通過靶向結合mRNA的特定互補序列,從而負調控基因表達[5],且與OA等多種疾病的發展緊密相關[6-7]。研究表明,在OA發生過程中,miR-515-5p可能作為內源性競爭RNA的中間因子,其表達緩解了IL-1β誘導的軟骨細胞凋亡、炎癥反應和細胞外基質降解[8]。Toll樣受體4(Toll-like receptor 4,TLR4)是Toll樣受體家族成員之一且與多種炎癥性疾病密切相關,因其能夠識別OA中微生物或宿主衍生配體而被廣泛關注[9-11]。研究表明,TLR4在OA軟骨和活化的滑膜細胞中表達[12],抑制TLR4的表達能夠減少促炎因子產生,從而減輕OA[13]。TLR4通過激活髓樣分化因子88(myeloid differentiation primary response gene 88,MyD88)/NF-κB信號通路釋放促炎因子,從而促進炎癥反應[14];而抑制MyD88/NF-κB信號通路能夠有效緩解OA進展[15],提示TLR4/MyD88/NF-κB信號通路可能在OA進展中發揮重要作用。但目前關于miRNA與TLR4/MyD88/NF-κB信號通路在OA中作用機制的研究較少。本研究擬對此進行探究,為OA防治提供有效治療策略。
1 材料與方法
1.1 主要試劑及儀器
人軟骨細胞C28/I2、HEK293T細胞(上海雅吉生物科技有限公司)。mimics陰性對照(negative control,NC)和mimics miR(MedChemExpress公司,美國);pcDNA-TLR4和pcDNA3.1質粒(上海吉瑪制藥技術有限公司);pGL3-TLR4-MUT、pGL3-TLR4-WT和pGL3質粒(湖南豐暉生物科技有限公司);LipofectamineTM2000(Thermo Fisher公司,美國);細胞計數試劑盒8(cell counting kit 8,CCK-8;Dojindo Molecular Technologies公司,日本);Annexin Ⅴ-FITC/碘化丙啶(propidium iodide,PI)細胞凋亡檢測試劑盒(武漢伊萊瑞特生物科技股份有限公司);SYBR? Premix Ex TaqTM Ⅱ(Takara公司,日本);總蛋白提取試劑盒(沈陽萬類生物科技有限公司);人TNF-α ELISA試劑盒、人IL-6 ELISA試劑盒、抗Ⅱ型膠原抗體、抗B淋巴細胞瘤2蛋白(B-cell lymphoma 2 protein,Bcl-2)抗體、抗Bcl-2相關X蛋白(Bcl-2-associated X protein,Bax)抗體、抗裂解的半胱天冬酶3(cleaved-Caspase-3)抗體、抗TLR4蛋白抗體、抗MyD88蛋白抗體、抗p65蛋白抗體、抗磷酸化p65(phosphorylated p65,p-p65)蛋白抗體、GAPDH、辣根過氧化物酶標記的山羊抗兔IgG、前列腺素E2(prostaglandin E2,PGE2)ELISA試劑盒、EdU增殖試劑盒(Abcam公司,美國);TRIzol試劑盒、PrimeScript RT試劑盒(Invitrogen公司,美國)。
Bio-Rad 680酶標儀(Bio-Rad公司,美國);流式細胞儀(Aceabio公司,美國);Image J軟件(National Institutes of Health,美國);ABI 7900HT快速PCR實時系統(Applied Biosystems公司,美國);GraphPad Prism 8.01軟件(GraphPad Software公司,美國);熒光顯微鏡(Leica公司,德國)。
1.2 細胞培養及分組
取人軟骨細胞C28/I2接種于含10%FBS的DMEM培養基中,于37℃、5%CO2、95%濕度培養箱中培養[16],待細胞附著90%后行傳代培養,取第3代以后的對數期細胞經免疫熒光染色鑒定[17]后進行后續實驗。
取上述C28/I2細胞進行以下分組及處理:對照組(A組,細胞在上述培養條件下培養不作任何處理),OA組(B組,細胞采用10 ng/mL IL-1β處理24 h)[18],OA+mimics NC組(C組,mimics NC轉染細胞24 h后,10 ng/mL IL-1β處理細胞24 h),OA+mimics miR組(D組,mimics miR轉染細胞24 h后,10 ng/mL IL-1β處理細胞24 h),OA+mimics miR+過表達(over expression,oe)-NC組(E組,mimics miR與oe-NC共轉染細胞24 h后,10 ng/mL IL-1β處理細胞24 h),OA+mimics miR+oe-TLR4組(F組,mimics miR與oe-TLR4共轉染細胞24 h后,10 ng/mL IL-1β處理細胞24 h)。轉染方法:采用LipofectamineTM2000試劑將oe-TLR4和oe-NC、mimics NC和mimics miR轉染C28/I2細胞,轉染終濃度為50 nmol/L。
1.3 miR-515-5p抑制OA軟骨細胞凋亡
1.3.1 免疫熒光染色觀察
將培養的C28/I2細胞用4%多聚甲醛固定20 min,PBS洗3次,免疫染色通透液處理5 min,1%牛血清白蛋白封閉1 h;加入抗Ⅱ型膠原抗體4℃下孵育過夜;PBS洗3次,加入二抗孵育30 min;PBS洗3次,DAPI染色,熒光顯微鏡觀察。采用Image J軟件分析細胞內Ⅱ型膠原陽性率,鑒定細胞純度[17]。
1.3.2 CCK-8檢測細胞增殖
取A~D組細胞于37℃、5%CO2、95%濕度條件下分別培養0、24、48、72 h,加入25 μL CCK-8試劑孵育2 h,用酶標儀測定450 nm波長處吸光度(A)值;實驗重復3次[8]。
1.3.3 EdU檢測細胞增殖
取A~D組細胞,按照EdU增殖試劑盒說明書方法檢測細胞增殖,熒光顯微鏡下觀察EdU染色細胞并計數,以相對熒光表達量表示各組熒光素酶活性并反映細胞增殖活力[19]。
1.3.4 流式細胞術檢測細胞凋亡
取A~D組細胞,以0.25%胰蛋白酶消化離心后,PBS洗3次,結合緩沖液重懸細胞;根據Annexin Ⅴ-FITC/PI細胞凋亡檢測試劑盒說明書方法,將Annexin Ⅴ-FITC和PI于室溫避光條件下孵育細胞15~20 min,1 h內用流式細胞儀檢測細胞凋亡情況[20]。
1.3.5 Western blot檢測
取A~D組細胞,采用總蛋白提取試劑盒提取細胞總蛋白,BCA蛋白檢測試劑盒檢測蛋白濃度;行電泳、轉膜、封閉處理后,加入一抗(Bcl2、Bax、cleaved-Caspase-3)于4℃孵育過夜;洗膜,加入二抗37℃孵育1 h。采用化學發光試劑盒檢測蛋白條帶,使用Image J軟件進行灰度分析。
1.3.6 ELISA檢測
取A~D組細胞,采用ELISA試劑盒檢測細胞上清液中促炎因子(PGE2、TNF-α、IL-6)的表達水平。
1.3.7 實時熒光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)檢測
取A~D組細胞,使用TRIzol regent提取樣本總RNA,以PrimeScript RT試劑盒轉錄成cDNA;然后于ABI 7900HT快速PCR實時系統上使用SYBR? Premix Ex TaqTM Ⅱ進行qPCR。以U6為內參,采用2?ΔΔCt法計算miR-515-5p mRNA相對表達量。引物序列見表1。
1.4 miR-515-5p促進OA軟骨細胞周期
為研究miR-515-5p對IL-1β誘導的OA軟骨細胞周期的調控作用,采用流式細胞術檢測OA軟骨細胞的細胞周期情況。取A~D組細胞,使用無水乙醇4℃固定過夜,加入PI染色液孵育30 min,通過流式細胞儀檢測染色后的細胞并記錄不同細胞周期的細胞比例。
1.5 miR-515-5p靶向調控TLR4
為研究miR-515-5p與TLR4之間的靶向關系,采用BiBiServ2數據庫(https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid/RNAhybrid)預測miR-515-5p和TLR4之間的潛在結合位點,并采用雙熒光素酶報告實驗驗證miR-515-5p和TLR4的靶向關系。將miR-515-5p與TLR4的互補結合序列及其突變序列進行擴增,克隆至pGL3載體上,構建野生型質粒TLR4-WT和對應的突變型質粒TLR4-MUT。使用Lipofectamine 2000轉染試劑將TLR4-MUT+mimics NC、TLR4-MUT+mimics miR、TLR4-WT+mimics NC和TLR4-WT+mimics miR共轉染HEK293T細胞,雙熒光素酶報告實驗檢測熒光素酶活性。
然后,同1.3.5和1.3.7方法分別采用Western blot和RT-qPCR檢測各組TLR4蛋白和mRNA相對表達量,以GAPDH為內參,引物序列見表1。
1.6 TLR4逆轉miR-515-5p對OA軟骨細胞凋亡抑制及炎癥改善作用
取D~F組細胞,同1.3.2和1.3.3方法采用CCK-8法和EdU檢測細胞增殖能力,同1.3.4方法采用流式細胞術檢測細胞凋亡情況及細胞周期,ELISA法檢測細胞促炎因子(PGE2、TNF-α和IL-6)表達水平,同1.3.5方法采用Western blot檢測TLR4蛋白及凋亡相關蛋白(Bcl-2、Bax和cleaved-Caspase-3)相對表達量。
1.7 miR-515-5p靶向TLR4阻斷MyD88/NF-κB信號通路激活
為進一步研究miR-515-5p靶向負調控TLR4對MyD88/NF-κB信號通路的調控作用,同1.3.5方法采用Western blot檢測A~F組細胞中MyD88、p-p65、p65蛋白相對表達量。
1.8 統計學方法
采用GraphPad Prism 8.01統計軟件進行分析。計量資料經Shapiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,CCK-8檢測結果多組間比較采用雙因素方差分析,其余指標多組間比較采用單因素方差分析,兩兩比較采用Tukey多重比較檢驗;檢驗水準取雙側α=0.05。
2 結果
2.1 miR-515-5p抑制OA軟骨細胞凋亡
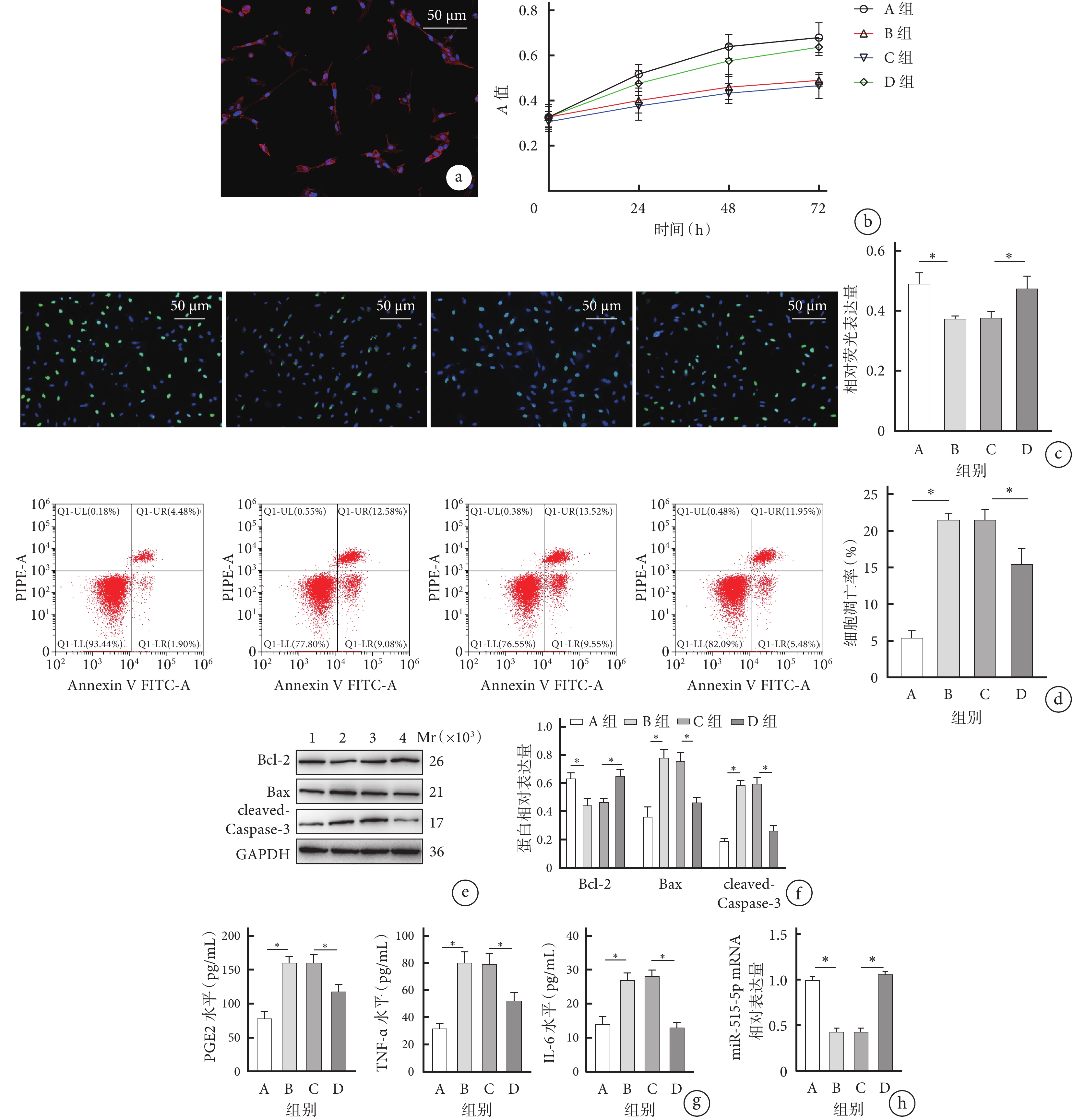
免疫熒光染色檢測示,C28/I2細胞的純度高于90%。見圖1a。
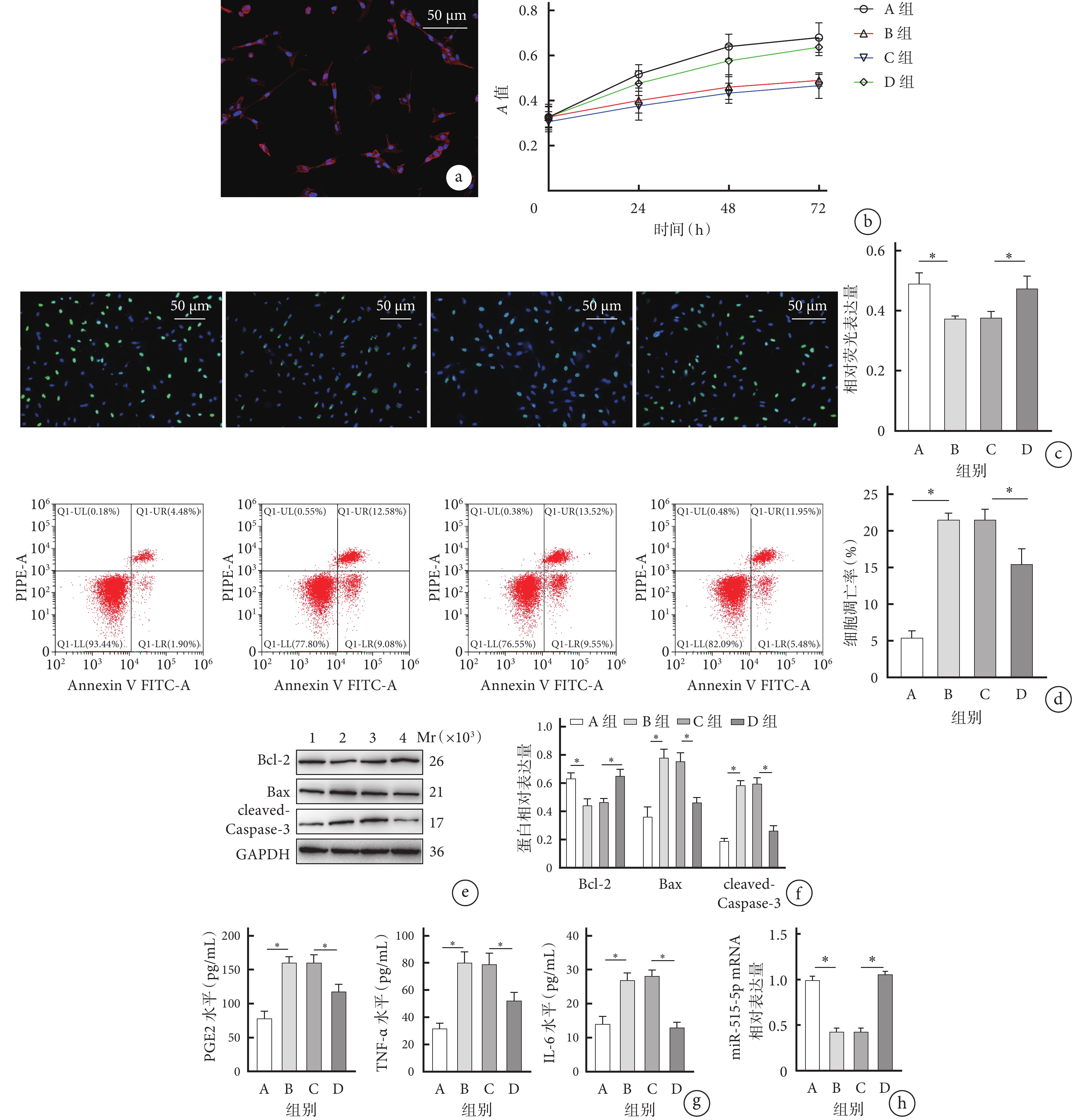 圖1
過表達miR-515-5p對IL-1β誘導的OA軟骨細胞凋亡的抑制作用
圖1
過表達miR-515-5p對IL-1β誘導的OA軟骨細胞凋亡的抑制作用
*
*
CCK-8和EdU檢測示,B組細胞增殖能力顯著低于A組,D組顯著高于C組,培養24、48、72 h A值及EdU相對熒光表達量組間比較差異均有統計學意義(P<0.05)。見圖1b、c。
流式細胞術檢測示,B組細胞凋亡率顯著高于A組,D組顯著低于C組,差異均有統計學意義(P<0.05)。見圖1d。
Western blot檢測示,B組Bcl-2蛋白相對表達量顯著低于A組,D組顯著高于C組;B組Bax和cleaved-Caspase-3蛋白相對表達量顯著高于A組,D組顯著低于C組;差異均有統計學意義(P<0.05)。見圖1e、f。
ELISA檢測示,B組PGE2、TNF-α、IL-6表達水平顯著高于A組,D組顯著低于C組,差異均有統計學意義(P<0.05)。見圖1g。
RT-qPCR檢測示,B組miR-515-5p mRNA相對表達量顯著低于A組,D組顯著高于C組,差異均有統計學意義(P<0.05)。見圖1h。
2.2 miR-515-5p促進OA軟骨細胞周期
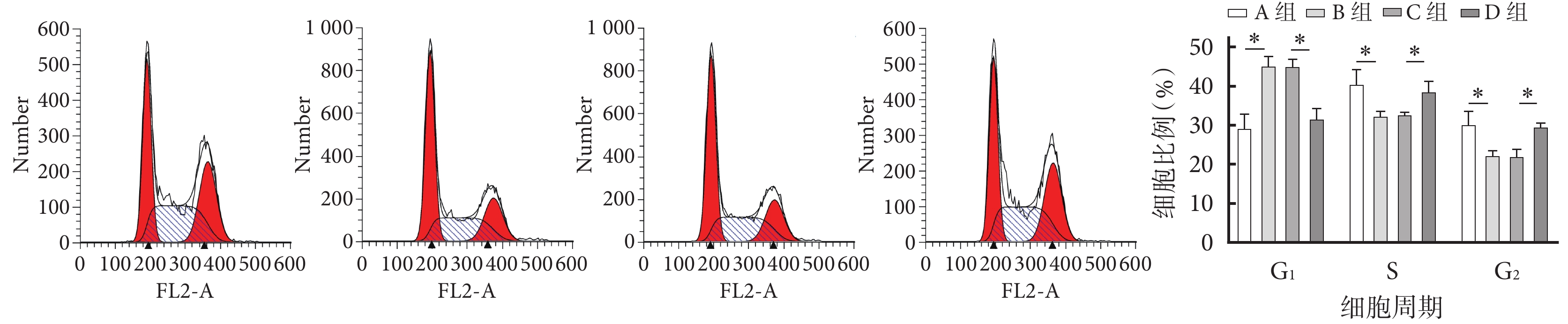
流式細胞術檢測示,與A組相比,B組G1期細胞比例顯著增加,而S期和G2期顯著減小;與C組相比,D組G1期細胞比例顯著減小,S期和G2期顯著增加;差異均有統計學意義(P<0.05)。見圖2。
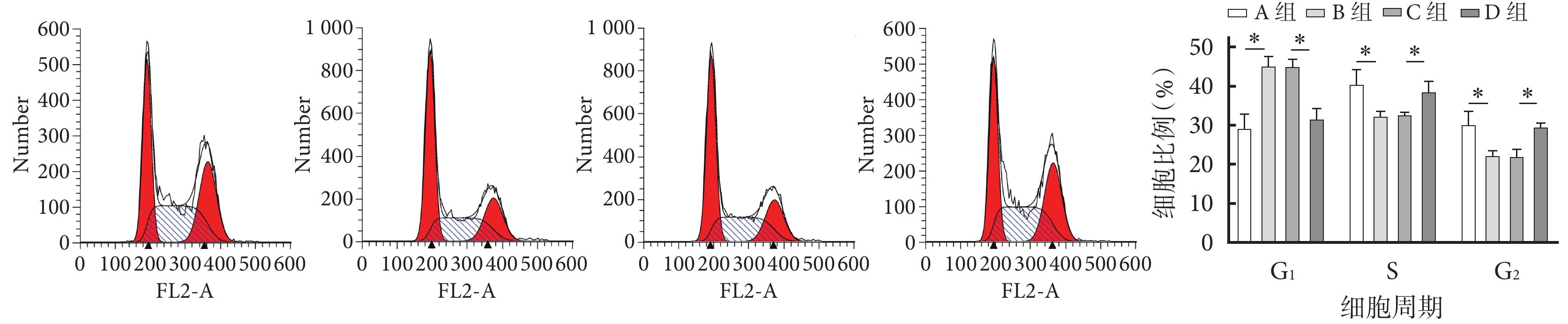 圖2
流式細胞術檢測過表達miR-515-5p對IL-1β誘導的OA軟骨細胞周期的促進作用
圖2
流式細胞術檢測過表達miR-515-5p對IL-1β誘導的OA軟骨細胞周期的促進作用
*
*
2.3 miR-515-5p靶向調控TLR4
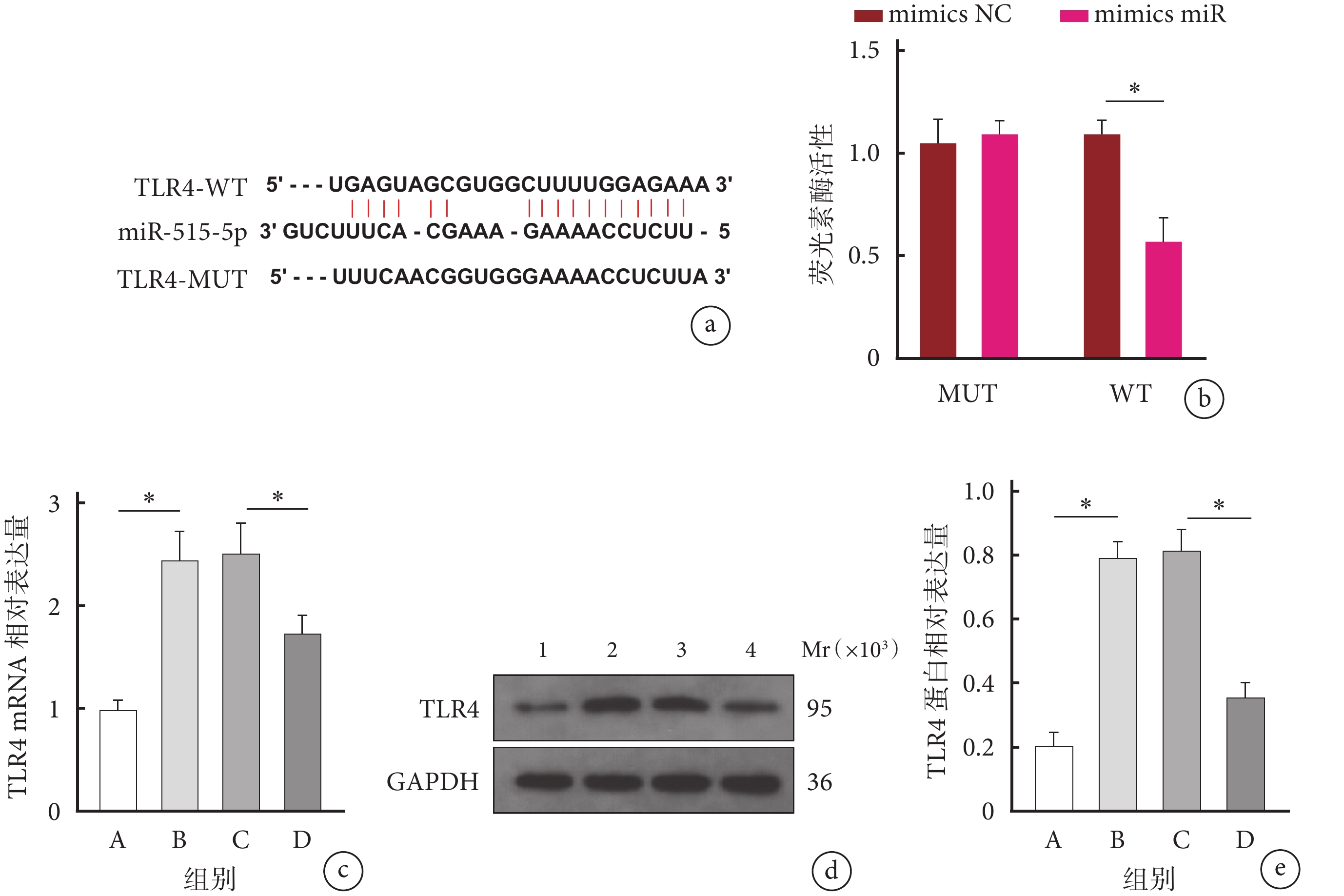
BiBiServ2數據庫預測示,miR-515-5p與TLR4之間存在結合位點。雙熒光素酶報告實驗驗證示,在突變后的MUT組中,轉染mimics NC或mimics miR兩者之間的熒光素酶活性差異無統計學意義(P>0.05);但在野生型的WT組中,轉染mimics miR后其熒光素酶活性顯著降低(P<0.05),表明miR-515-5p能夠與TLR4靶向結合。RT-qPCR和Western blot檢測示,B組TLR4 mRNA和蛋白相對表達量顯著高于A組,D組均顯著低于C組,差異均有統計學意義(P<0.05)。見圖3。
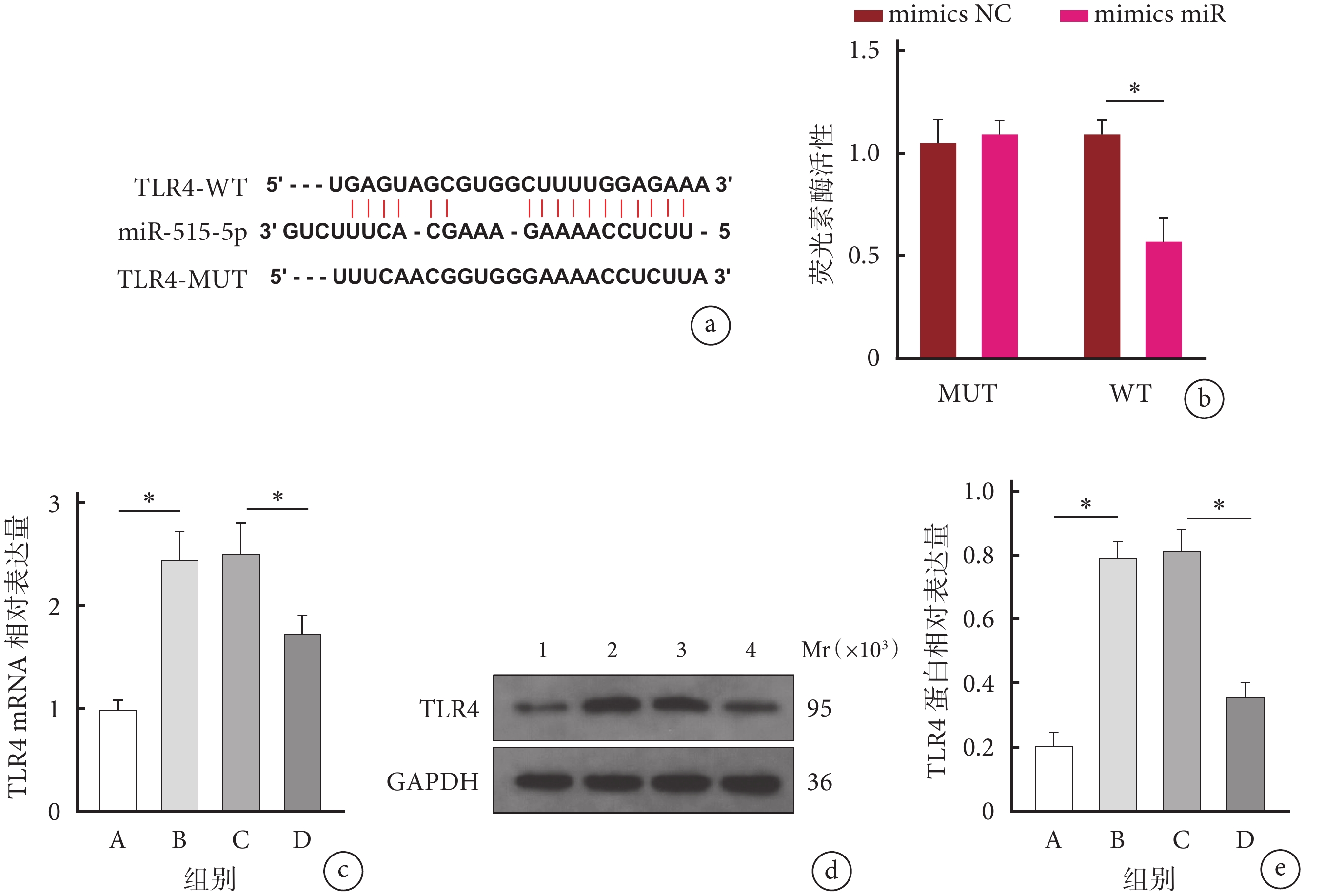 圖3
miR-515-5p靶向負調控TLR4相關檢測
圖3
miR-515-5p靶向負調控TLR4相關檢測
*
*
2.4 上調TLR4部分逆轉過表達miR-515-5p對IL-1β誘導的OA軟骨細胞凋亡的抑制作用及炎癥改善作用
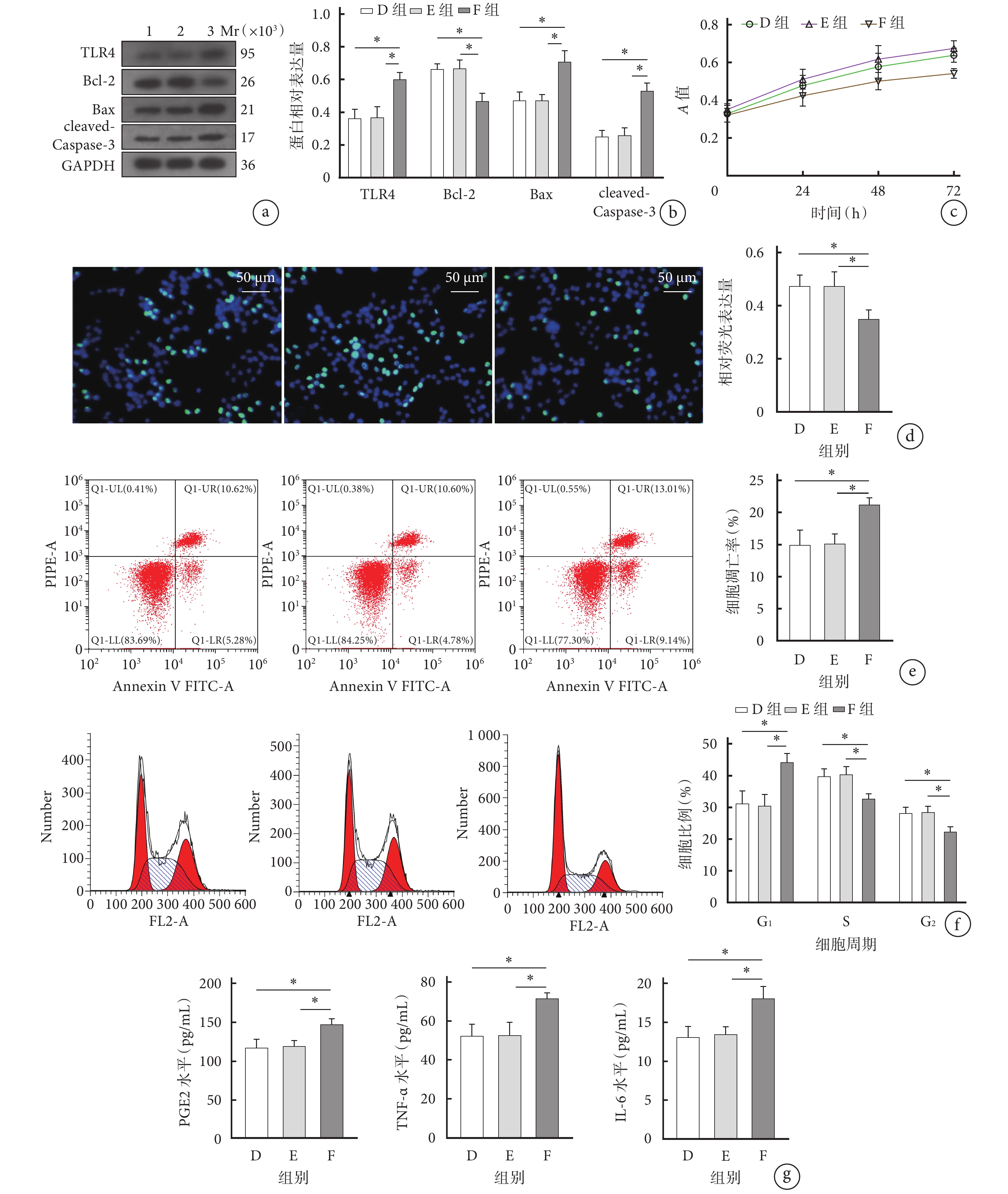
與D、E組相比,F組細胞的增殖能力明顯降低,培養24、48、72 h A值及EdU相對熒光表達量比較差異均有統計學意義(P<0.05);細胞凋亡率顯著增加,G1期細胞比例顯著增加,S期和G2期細胞比例顯著減少;細胞上清液中促炎因子PGE2、TNF-α、IL-6表達水平均顯著升高;TLR4、Bax和cleaved-Caspase-3蛋白相對表達量顯著升高,Bcl-2蛋白相對表達量顯著降低;差異均有統計學意義(P<0.05)。以上指標D、E組間差異均無統計學意義(P>0.05)。見圖4。
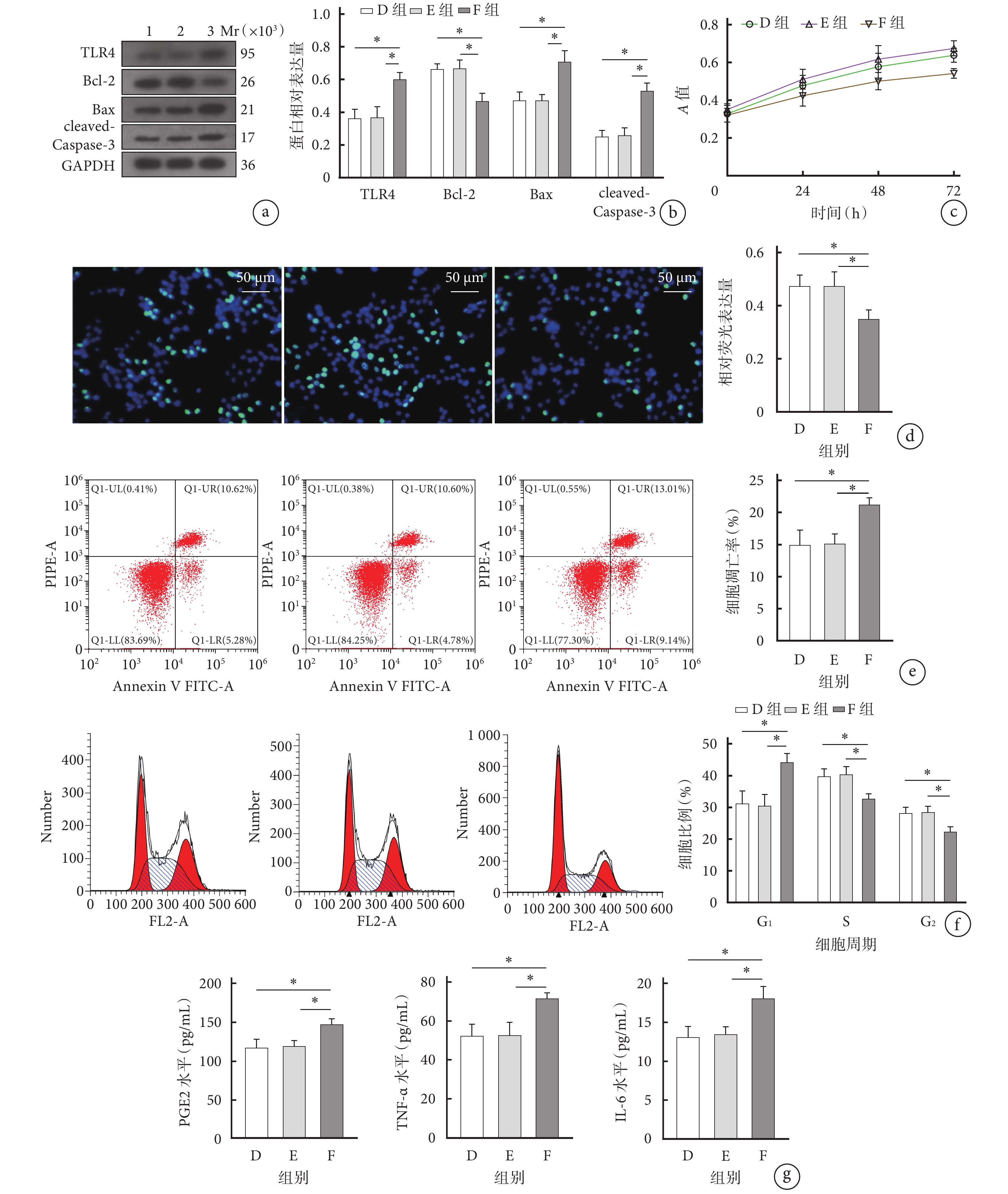 圖4
上調TLR4部分逆轉過表達miR-515-5p對IL-1β誘導的OA軟骨細胞凋亡的抑制作用及炎癥改善作用
圖4
上調TLR4部分逆轉過表達miR-515-5p對IL-1β誘導的OA軟骨細胞凋亡的抑制作用及炎癥改善作用
*
*
2.5 miR-515-5p靶向TLR4阻斷MyD88/NF-κB信號通路激活
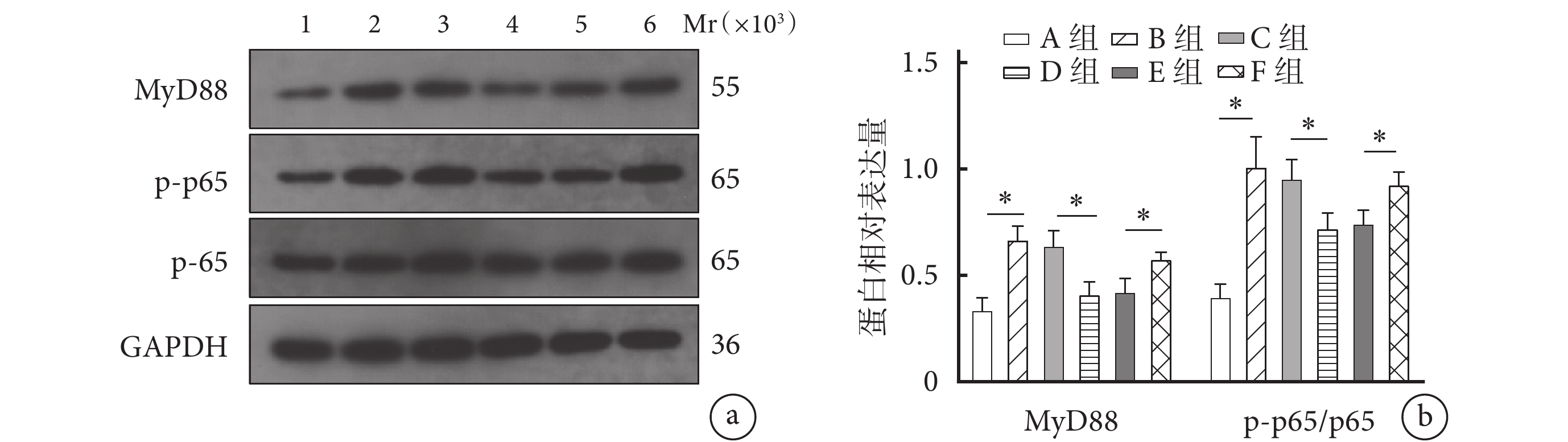
Western blot檢測示,B組細胞中MyD88及p-p65/p65蛋白相對表達量顯著高于A組,D組顯著低于C組,F組顯著高于E組,差異均有統計學意義(P<0.05)。見圖5。
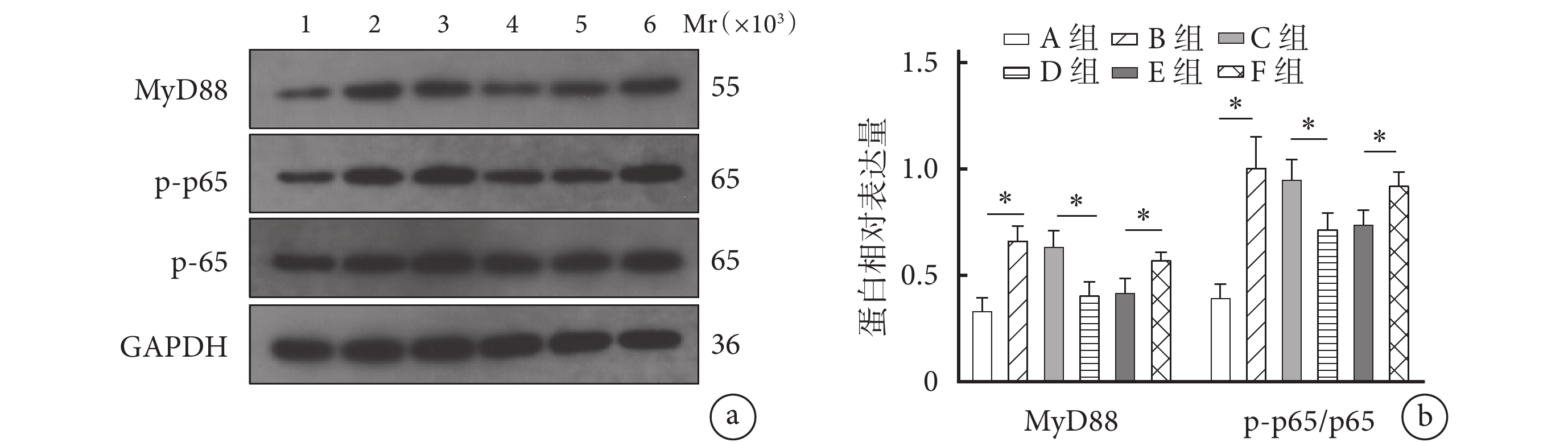 圖5
miR-515-5p靶向TLR4阻斷MyD88/NF-κB信號通路激活觀測
圖5
miR-515-5p靶向TLR4阻斷MyD88/NF-κB信號通路激活觀測
*
*
3 討論
OA是由嚴重關節變形引起的關節疼痛和功能障礙綜合征[21],其發生、進展與炎癥緊密相關。在OA發生過程中,滑膜細胞、關節軟骨細胞以及其他細胞均會表達炎癥介質[22]。為此,通過靶向調控相關炎癥途徑是治療OA的潛在策略。本研究中,我們首先使用IL-1β誘導C28/I2細胞模擬OA軟骨炎癥損傷,結果顯示,IL-1β可以顯著誘導PGE2、TNF-α和IL-6促炎因子的產生,這與既往研究報道一致[23]。
據報道,miRNA可通過調節軟骨細胞增殖和凋亡、細胞外基質代謝和炎癥反應參與OA的發生、發展[24-26]。研究表明,miR-181-5p能靶向負調控DDX3X(DEAD-box RNA解旋酶亞家族中研究最廣泛且進化保守的成員之一,被認為是癌癥和病毒的治療靶點)的表達,從而調控NF-κB信號通路的活化,進而減少炎癥因子TNF-α和IL-6的釋放[27]。與上述結果一致,本研究中我們使用IL-1β誘導軟骨細胞OA軟骨炎癥損傷模型,結果示miR-515-5p在OA中的表達水平下調;隨后,使用miR mimics轉染后誘導OA模型,結果顯示過表達miR-515-5p顯著減少了軟骨細胞PGE2、TNF-α和IL-6促炎因子的產生,緩解了細胞的炎癥反應。TLR4/MyD88/NF-κB信號通路是經典的炎癥反應信號通路,通過上調TLR4、p65等蛋白的表達能夠誘發炎癥反應,釋放TNF-α和IL-6促炎因子并參與OA的發展[14]。本研究誘導OA模型后發現,B組細胞中TLR4、MyD88及p-p65蛋白的表達水平均顯著升高,TNF-α、PGE2和IL-6促炎因子的釋放也顯著增加。TLR4是Toll樣受體家族成員之一,是NF-κB的上游靶標,能夠有效識別機體中某些損傷或病原體相關分子,從而激活信號,誘發炎癥反應,促進多種炎癥因子的產生和釋放[28]。MyD88是TLR4/NF-κB信號通路中重要的銜接蛋白。TLR4通過激活依賴性MyD88通路,促進MyD88與TNF受體相關因子6結合,從而激活下游NF-κB信號通路,進而激活細胞內信號轉錄表達,促進TNF-α和IL-6等促炎因子的釋放并產生信號級聯反應誘發OA[29]。因此,TLR4/MyD88/NF-κB信號通路是探究OA發病機制和治療機制的一個有效靶點。研究表明,miR-93可通過靶向負調控TLR4,抑制NF-κB信號通路的活化,減少TNF-α和IL-6等促炎因子的釋放從而緩解OA[15]。而在本研究中,IL-1β的誘導激活了TLR4/MyD88/NF-κB信號通路,促進了PGE2、TNF-α和IL-6促炎因子的釋放;而過表達miR-515-5p后,miR-515-5p通過靶向負調控TLR4抑制NF-κB信號通路的活化,減少了PGE2、TNF-α和IL-6促炎因子的釋放,從而緩解OA;上調TLR4的表達后,部分逆轉了過表達miR-515-5p對OA的抑制作用,進一步證實了miR-515-5p可通過靶向負調控TLR4抑制NF-κB信號通路的活化,從而影響OA的進展。
綜上述,本研究首次發現miR-515-5p通過靶向負調控TLR4阻斷MyD88/NF-κB信號通路的活化,從而抑制OA軟骨細胞凋亡,進而減輕炎癥反應,為治療OA提供了新思路。然而,本研究僅在人的軟骨細胞系C28/I2中進行了體外實驗,尚需結合動物實驗進一步驗證,并在未來研究中進一步探究其他潛在的調控機制。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
作者貢獻聲明 蔡東峰:研究設計、文章撰寫;楊子肖、鐘超:研究實施、數據收集整理;張靖:統計分析;洪嵩:對文章的知識性內容作批評性審閱,行政支持
骨關節炎(osteoarthritis,OA)是一種退行性關節疾病,主要表現為關節軟骨的漸進性損傷、軟骨細胞凋亡以及關節炎癥,導致患者身體殘疾,嚴重影響生活質量[1-2]。研究表明,軟骨細胞凋亡以及促炎因子的產生與OA進展密切相關[3-4]。因此,抑制軟骨細胞凋亡和緩解炎癥反應是治療OA的有效措施。然而,OA的具體發病機制尚不明確。
miRNA是一類非編碼小RNA,其可通過靶向結合mRNA的特定互補序列,從而負調控基因表達[5],且與OA等多種疾病的發展緊密相關[6-7]。研究表明,在OA發生過程中,miR-515-5p可能作為內源性競爭RNA的中間因子,其表達緩解了IL-1β誘導的軟骨細胞凋亡、炎癥反應和細胞外基質降解[8]。Toll樣受體4(Toll-like receptor 4,TLR4)是Toll樣受體家族成員之一且與多種炎癥性疾病密切相關,因其能夠識別OA中微生物或宿主衍生配體而被廣泛關注[9-11]。研究表明,TLR4在OA軟骨和活化的滑膜細胞中表達[12],抑制TLR4的表達能夠減少促炎因子產生,從而減輕OA[13]。TLR4通過激活髓樣分化因子88(myeloid differentiation primary response gene 88,MyD88)/NF-κB信號通路釋放促炎因子,從而促進炎癥反應[14];而抑制MyD88/NF-κB信號通路能夠有效緩解OA進展[15],提示TLR4/MyD88/NF-κB信號通路可能在OA進展中發揮重要作用。但目前關于miRNA與TLR4/MyD88/NF-κB信號通路在OA中作用機制的研究較少。本研究擬對此進行探究,為OA防治提供有效治療策略。
1 材料與方法
1.1 主要試劑及儀器
人軟骨細胞C28/I2、HEK293T細胞(上海雅吉生物科技有限公司)。mimics陰性對照(negative control,NC)和mimics miR(MedChemExpress公司,美國);pcDNA-TLR4和pcDNA3.1質粒(上海吉瑪制藥技術有限公司);pGL3-TLR4-MUT、pGL3-TLR4-WT和pGL3質粒(湖南豐暉生物科技有限公司);LipofectamineTM2000(Thermo Fisher公司,美國);細胞計數試劑盒8(cell counting kit 8,CCK-8;Dojindo Molecular Technologies公司,日本);Annexin Ⅴ-FITC/碘化丙啶(propidium iodide,PI)細胞凋亡檢測試劑盒(武漢伊萊瑞特生物科技股份有限公司);SYBR? Premix Ex TaqTM Ⅱ(Takara公司,日本);總蛋白提取試劑盒(沈陽萬類生物科技有限公司);人TNF-α ELISA試劑盒、人IL-6 ELISA試劑盒、抗Ⅱ型膠原抗體、抗B淋巴細胞瘤2蛋白(B-cell lymphoma 2 protein,Bcl-2)抗體、抗Bcl-2相關X蛋白(Bcl-2-associated X protein,Bax)抗體、抗裂解的半胱天冬酶3(cleaved-Caspase-3)抗體、抗TLR4蛋白抗體、抗MyD88蛋白抗體、抗p65蛋白抗體、抗磷酸化p65(phosphorylated p65,p-p65)蛋白抗體、GAPDH、辣根過氧化物酶標記的山羊抗兔IgG、前列腺素E2(prostaglandin E2,PGE2)ELISA試劑盒、EdU增殖試劑盒(Abcam公司,美國);TRIzol試劑盒、PrimeScript RT試劑盒(Invitrogen公司,美國)。
Bio-Rad 680酶標儀(Bio-Rad公司,美國);流式細胞儀(Aceabio公司,美國);Image J軟件(National Institutes of Health,美國);ABI 7900HT快速PCR實時系統(Applied Biosystems公司,美國);GraphPad Prism 8.01軟件(GraphPad Software公司,美國);熒光顯微鏡(Leica公司,德國)。
1.2 細胞培養及分組
取人軟骨細胞C28/I2接種于含10%FBS的DMEM培養基中,于37℃、5%CO2、95%濕度培養箱中培養[16],待細胞附著90%后行傳代培養,取第3代以后的對數期細胞經免疫熒光染色鑒定[17]后進行后續實驗。
取上述C28/I2細胞進行以下分組及處理:對照組(A組,細胞在上述培養條件下培養不作任何處理),OA組(B組,細胞采用10 ng/mL IL-1β處理24 h)[18],OA+mimics NC組(C組,mimics NC轉染細胞24 h后,10 ng/mL IL-1β處理細胞24 h),OA+mimics miR組(D組,mimics miR轉染細胞24 h后,10 ng/mL IL-1β處理細胞24 h),OA+mimics miR+過表達(over expression,oe)-NC組(E組,mimics miR與oe-NC共轉染細胞24 h后,10 ng/mL IL-1β處理細胞24 h),OA+mimics miR+oe-TLR4組(F組,mimics miR與oe-TLR4共轉染細胞24 h后,10 ng/mL IL-1β處理細胞24 h)。轉染方法:采用LipofectamineTM2000試劑將oe-TLR4和oe-NC、mimics NC和mimics miR轉染C28/I2細胞,轉染終濃度為50 nmol/L。
1.3 miR-515-5p抑制OA軟骨細胞凋亡
1.3.1 免疫熒光染色觀察
將培養的C28/I2細胞用4%多聚甲醛固定20 min,PBS洗3次,免疫染色通透液處理5 min,1%牛血清白蛋白封閉1 h;加入抗Ⅱ型膠原抗體4℃下孵育過夜;PBS洗3次,加入二抗孵育30 min;PBS洗3次,DAPI染色,熒光顯微鏡觀察。采用Image J軟件分析細胞內Ⅱ型膠原陽性率,鑒定細胞純度[17]。
1.3.2 CCK-8檢測細胞增殖
取A~D組細胞于37℃、5%CO2、95%濕度條件下分別培養0、24、48、72 h,加入25 μL CCK-8試劑孵育2 h,用酶標儀測定450 nm波長處吸光度(A)值;實驗重復3次[8]。
1.3.3 EdU檢測細胞增殖
取A~D組細胞,按照EdU增殖試劑盒說明書方法檢測細胞增殖,熒光顯微鏡下觀察EdU染色細胞并計數,以相對熒光表達量表示各組熒光素酶活性并反映細胞增殖活力[19]。
1.3.4 流式細胞術檢測細胞凋亡
取A~D組細胞,以0.25%胰蛋白酶消化離心后,PBS洗3次,結合緩沖液重懸細胞;根據Annexin Ⅴ-FITC/PI細胞凋亡檢測試劑盒說明書方法,將Annexin Ⅴ-FITC和PI于室溫避光條件下孵育細胞15~20 min,1 h內用流式細胞儀檢測細胞凋亡情況[20]。
1.3.5 Western blot檢測
取A~D組細胞,采用總蛋白提取試劑盒提取細胞總蛋白,BCA蛋白檢測試劑盒檢測蛋白濃度;行電泳、轉膜、封閉處理后,加入一抗(Bcl2、Bax、cleaved-Caspase-3)于4℃孵育過夜;洗膜,加入二抗37℃孵育1 h。采用化學發光試劑盒檢測蛋白條帶,使用Image J軟件進行灰度分析。
1.3.6 ELISA檢測
取A~D組細胞,采用ELISA試劑盒檢測細胞上清液中促炎因子(PGE2、TNF-α、IL-6)的表達水平。
1.3.7 實時熒光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)檢測
取A~D組細胞,使用TRIzol regent提取樣本總RNA,以PrimeScript RT試劑盒轉錄成cDNA;然后于ABI 7900HT快速PCR實時系統上使用SYBR? Premix Ex TaqTM Ⅱ進行qPCR。以U6為內參,采用2?ΔΔCt法計算miR-515-5p mRNA相對表達量。引物序列見表1。
1.4 miR-515-5p促進OA軟骨細胞周期
為研究miR-515-5p對IL-1β誘導的OA軟骨細胞周期的調控作用,采用流式細胞術檢測OA軟骨細胞的細胞周期情況。取A~D組細胞,使用無水乙醇4℃固定過夜,加入PI染色液孵育30 min,通過流式細胞儀檢測染色后的細胞并記錄不同細胞周期的細胞比例。
1.5 miR-515-5p靶向調控TLR4
為研究miR-515-5p與TLR4之間的靶向關系,采用BiBiServ2數據庫(https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid/RNAhybrid)預測miR-515-5p和TLR4之間的潛在結合位點,并采用雙熒光素酶報告實驗驗證miR-515-5p和TLR4的靶向關系。將miR-515-5p與TLR4的互補結合序列及其突變序列進行擴增,克隆至pGL3載體上,構建野生型質粒TLR4-WT和對應的突變型質粒TLR4-MUT。使用Lipofectamine 2000轉染試劑將TLR4-MUT+mimics NC、TLR4-MUT+mimics miR、TLR4-WT+mimics NC和TLR4-WT+mimics miR共轉染HEK293T細胞,雙熒光素酶報告實驗檢測熒光素酶活性。
然后,同1.3.5和1.3.7方法分別采用Western blot和RT-qPCR檢測各組TLR4蛋白和mRNA相對表達量,以GAPDH為內參,引物序列見表1。
1.6 TLR4逆轉miR-515-5p對OA軟骨細胞凋亡抑制及炎癥改善作用
取D~F組細胞,同1.3.2和1.3.3方法采用CCK-8法和EdU檢測細胞增殖能力,同1.3.4方法采用流式細胞術檢測細胞凋亡情況及細胞周期,ELISA法檢測細胞促炎因子(PGE2、TNF-α和IL-6)表達水平,同1.3.5方法采用Western blot檢測TLR4蛋白及凋亡相關蛋白(Bcl-2、Bax和cleaved-Caspase-3)相對表達量。
1.7 miR-515-5p靶向TLR4阻斷MyD88/NF-κB信號通路激活
為進一步研究miR-515-5p靶向負調控TLR4對MyD88/NF-κB信號通路的調控作用,同1.3.5方法采用Western blot檢測A~F組細胞中MyD88、p-p65、p65蛋白相對表達量。
1.8 統計學方法
采用GraphPad Prism 8.01統計軟件進行分析。計量資料經Shapiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,CCK-8檢測結果多組間比較采用雙因素方差分析,其余指標多組間比較采用單因素方差分析,兩兩比較采用Tukey多重比較檢驗;檢驗水準取雙側α=0.05。
2 結果
2.1 miR-515-5p抑制OA軟骨細胞凋亡
免疫熒光染色檢測示,C28/I2細胞的純度高于90%。見圖1a。
 圖1
過表達miR-515-5p對IL-1β誘導的OA軟骨細胞凋亡的抑制作用
圖1
過表達miR-515-5p對IL-1β誘導的OA軟骨細胞凋亡的抑制作用
*
*
CCK-8和EdU檢測示,B組細胞增殖能力顯著低于A組,D組顯著高于C組,培養24、48、72 h A值及EdU相對熒光表達量組間比較差異均有統計學意義(P<0.05)。見圖1b、c。
流式細胞術檢測示,B組細胞凋亡率顯著高于A組,D組顯著低于C組,差異均有統計學意義(P<0.05)。見圖1d。
Western blot檢測示,B組Bcl-2蛋白相對表達量顯著低于A組,D組顯著高于C組;B組Bax和cleaved-Caspase-3蛋白相對表達量顯著高于A組,D組顯著低于C組;差異均有統計學意義(P<0.05)。見圖1e、f。
ELISA檢測示,B組PGE2、TNF-α、IL-6表達水平顯著高于A組,D組顯著低于C組,差異均有統計學意義(P<0.05)。見圖1g。
RT-qPCR檢測示,B組miR-515-5p mRNA相對表達量顯著低于A組,D組顯著高于C組,差異均有統計學意義(P<0.05)。見圖1h。
2.2 miR-515-5p促進OA軟骨細胞周期
流式細胞術檢測示,與A組相比,B組G1期細胞比例顯著增加,而S期和G2期顯著減小;與C組相比,D組G1期細胞比例顯著減小,S期和G2期顯著增加;差異均有統計學意義(P<0.05)。見圖2。
 圖2
流式細胞術檢測過表達miR-515-5p對IL-1β誘導的OA軟骨細胞周期的促進作用
圖2
流式細胞術檢測過表達miR-515-5p對IL-1β誘導的OA軟骨細胞周期的促進作用
*
*
2.3 miR-515-5p靶向調控TLR4
BiBiServ2數據庫預測示,miR-515-5p與TLR4之間存在結合位點。雙熒光素酶報告實驗驗證示,在突變后的MUT組中,轉染mimics NC或mimics miR兩者之間的熒光素酶活性差異無統計學意義(P>0.05);但在野生型的WT組中,轉染mimics miR后其熒光素酶活性顯著降低(P<0.05),表明miR-515-5p能夠與TLR4靶向結合。RT-qPCR和Western blot檢測示,B組TLR4 mRNA和蛋白相對表達量顯著高于A組,D組均顯著低于C組,差異均有統計學意義(P<0.05)。見圖3。
 圖3
miR-515-5p靶向負調控TLR4相關檢測
圖3
miR-515-5p靶向負調控TLR4相關檢測
*
*
2.4 上調TLR4部分逆轉過表達miR-515-5p對IL-1β誘導的OA軟骨細胞凋亡的抑制作用及炎癥改善作用
與D、E組相比,F組細胞的增殖能力明顯降低,培養24、48、72 h A值及EdU相對熒光表達量比較差異均有統計學意義(P<0.05);細胞凋亡率顯著增加,G1期細胞比例顯著增加,S期和G2期細胞比例顯著減少;細胞上清液中促炎因子PGE2、TNF-α、IL-6表達水平均顯著升高;TLR4、Bax和cleaved-Caspase-3蛋白相對表達量顯著升高,Bcl-2蛋白相對表達量顯著降低;差異均有統計學意義(P<0.05)。以上指標D、E組間差異均無統計學意義(P>0.05)。見圖4。
 圖4
上調TLR4部分逆轉過表達miR-515-5p對IL-1β誘導的OA軟骨細胞凋亡的抑制作用及炎癥改善作用
圖4
上調TLR4部分逆轉過表達miR-515-5p對IL-1β誘導的OA軟骨細胞凋亡的抑制作用及炎癥改善作用
*
*
2.5 miR-515-5p靶向TLR4阻斷MyD88/NF-κB信號通路激活
Western blot檢測示,B組細胞中MyD88及p-p65/p65蛋白相對表達量顯著高于A組,D組顯著低于C組,F組顯著高于E組,差異均有統計學意義(P<0.05)。見圖5。
 圖5
miR-515-5p靶向TLR4阻斷MyD88/NF-κB信號通路激活觀測
圖5
miR-515-5p靶向TLR4阻斷MyD88/NF-κB信號通路激活觀測
*
*
3 討論
OA是由嚴重關節變形引起的關節疼痛和功能障礙綜合征[21],其發生、進展與炎癥緊密相關。在OA發生過程中,滑膜細胞、關節軟骨細胞以及其他細胞均會表達炎癥介質[22]。為此,通過靶向調控相關炎癥途徑是治療OA的潛在策略。本研究中,我們首先使用IL-1β誘導C28/I2細胞模擬OA軟骨炎癥損傷,結果顯示,IL-1β可以顯著誘導PGE2、TNF-α和IL-6促炎因子的產生,這與既往研究報道一致[23]。
據報道,miRNA可通過調節軟骨細胞增殖和凋亡、細胞外基質代謝和炎癥反應參與OA的發生、發展[24-26]。研究表明,miR-181-5p能靶向負調控DDX3X(DEAD-box RNA解旋酶亞家族中研究最廣泛且進化保守的成員之一,被認為是癌癥和病毒的治療靶點)的表達,從而調控NF-κB信號通路的活化,進而減少炎癥因子TNF-α和IL-6的釋放[27]。與上述結果一致,本研究中我們使用IL-1β誘導軟骨細胞OA軟骨炎癥損傷模型,結果示miR-515-5p在OA中的表達水平下調;隨后,使用miR mimics轉染后誘導OA模型,結果顯示過表達miR-515-5p顯著減少了軟骨細胞PGE2、TNF-α和IL-6促炎因子的產生,緩解了細胞的炎癥反應。TLR4/MyD88/NF-κB信號通路是經典的炎癥反應信號通路,通過上調TLR4、p65等蛋白的表達能夠誘發炎癥反應,釋放TNF-α和IL-6促炎因子并參與OA的發展[14]。本研究誘導OA模型后發現,B組細胞中TLR4、MyD88及p-p65蛋白的表達水平均顯著升高,TNF-α、PGE2和IL-6促炎因子的釋放也顯著增加。TLR4是Toll樣受體家族成員之一,是NF-κB的上游靶標,能夠有效識別機體中某些損傷或病原體相關分子,從而激活信號,誘發炎癥反應,促進多種炎癥因子的產生和釋放[28]。MyD88是TLR4/NF-κB信號通路中重要的銜接蛋白。TLR4通過激活依賴性MyD88通路,促進MyD88與TNF受體相關因子6結合,從而激活下游NF-κB信號通路,進而激活細胞內信號轉錄表達,促進TNF-α和IL-6等促炎因子的釋放并產生信號級聯反應誘發OA[29]。因此,TLR4/MyD88/NF-κB信號通路是探究OA發病機制和治療機制的一個有效靶點。研究表明,miR-93可通過靶向負調控TLR4,抑制NF-κB信號通路的活化,減少TNF-α和IL-6等促炎因子的釋放從而緩解OA[15]。而在本研究中,IL-1β的誘導激活了TLR4/MyD88/NF-κB信號通路,促進了PGE2、TNF-α和IL-6促炎因子的釋放;而過表達miR-515-5p后,miR-515-5p通過靶向負調控TLR4抑制NF-κB信號通路的活化,減少了PGE2、TNF-α和IL-6促炎因子的釋放,從而緩解OA;上調TLR4的表達后,部分逆轉了過表達miR-515-5p對OA的抑制作用,進一步證實了miR-515-5p可通過靶向負調控TLR4抑制NF-κB信號通路的活化,從而影響OA的進展。
綜上述,本研究首次發現miR-515-5p通過靶向負調控TLR4阻斷MyD88/NF-κB信號通路的活化,從而抑制OA軟骨細胞凋亡,進而減輕炎癥反應,為治療OA提供了新思路。然而,本研究僅在人的軟骨細胞系C28/I2中進行了體外實驗,尚需結合動物實驗進一步驗證,并在未來研究中進一步探究其他潛在的調控機制。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
作者貢獻聲明 蔡東峰:研究設計、文章撰寫;楊子肖、鐘超:研究實施、數據收集整理;張靖:統計分析;洪嵩:對文章的知識性內容作批評性審閱,行政支持