引用本文: 宋建國, 林浩東. 硒-甲基硒代半胱氨酸促進周圍神經再生的實驗研究. 中國修復重建外科雜志, 2024, 38(5): 598-607. doi: 10.7507/1002-1892.202402031 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
近年來,周圍神經損傷發生率居高不下,多由交通事故等外傷引起[1-2]。與中樞神經相比,周圍神經往往具有一定再生能力[3-4],但再生能力有限;相較于短距離神經缺損,長距離神經缺損修復是目前臨床治療難點。自體神經因具有無毒、無免疫原性和良好生物相容性,成為目前治療長距離神經缺損的“金標準”[5-6],但存在供區損傷嚴重、易形成神經瘤、供體神經來源有限、供體神經長短不匹配、愈合時間較長等不足[7]。
氧化應激是周圍神經損傷后神經元死亡和軸突脫髓鞘的主要原因之一[8]。 受損神經具有產生相應抗氧化物質來中和自由基(reactive oxygen species,ROS)的能力。然而,ROS的積累是不受控制的,在損傷后的氧化應激反應中,抗氧化防御系統對ROS的清除能力可能不足[9]。這種持續累積的狀態削弱了神經修復和功能恢復水平;同時,氧化應激因子可通過激活p38絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路導致神經細胞凋亡損傷,引起神經營養障礙[10],從而阻礙了神經再生。p38MAPK 蛋白同時作為神經髓鞘形成的負性調節因素[11],能夠抑制周圍神經系統髓鞘形成。硒(selenium,Se)是人體必需元素,在體內是清除ROS的谷胱甘肽過氧化物酶的主要成分[12],有卓越的抗氧化應激和抗炎能力[13]。大量研究表明,Se可降低患一系列癌癥的風險,包括乳腺癌、前列腺癌、肺癌、結腸癌、肝癌等[14]。Se也被證明與DNA損傷和氧化應激相關,可以增強免疫監視和調節細胞增殖[15]。而且與其他生物制品中的ROS清除劑相比,Se更穩定、更經濟[16]。硒-甲基硒代半胱氨酸(Se-methylselenocysteine,SMC)被認為是對人體最有益的Se化合物,它作為一種有機Se,相比無機Se具有更大生物活性和更小毒性[17]。已有研究證實SMC在阿爾茲海默癥小鼠中可提高抗氧化能力,調節氨基酸代謝,改善突觸缺陷,從而提高小鼠認知能力[18]。另外有研究者發現SMC具有一定抑菌功能,其可通過抑制氧化應激促進斷奶大鼠生長發育和緩解心肌組織及膝關節病變[19-20]。但是,SMC在周圍神經再生中是否起作用,以及是否可通過抗氧化應激抑制p38MAPK通路,最終促進軸突髓鞘形成尚無相關研究。鑒于此,本研究探討SMC對周圍神經再生的影響及其相關作用機制,以期為臨床治療周圍神經損傷提供一種有前景的治療方法。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
4周齡SD雄性大鼠36只,體質量220~240 g,由上海斯萊克實驗動物有限責任公司提供;大鼠雪旺細胞RSC96細胞由中國科學院細胞庫提供。
SMC(上海MCE公司);異氟烷(上海生工生物工程股份有限公司);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、過氧化氫酶(catalase,CAT)ELISA檢測試劑盒,ROS試劑盒和MTT試劑盒(上海碧云天生物技術有限公司);DMEM基礎培養基、FBS(GIBCO公司,美國);山羊抗兔IgG、山羊抗小鼠IgG、p38MAPK抗體、磷酸化p38MAPK(phosphorylation p38MAPK,p-p38MAPK)抗體、血紅素氧合酶1(heme oxygenase 1,HO-1)抗體、核因子紅細胞系2相關因子2(nuclear factor erythroid 2-related factor 2,Nrf2)抗體、膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)抗體、髓鞘堿性蛋白(myelinbasicprotein,MBP)抗體(Abcam公司,美國);蛋白提取試劑盒、超敏ECL發光檢測液(南京諾維贊生物科技股份有限公司);大鼠IL-6、IL-10、IL-17 ELISA檢測試劑盒(杭州聯科生物技術有限公司);H2O2(上海默克公司)。
共聚焦免疫熒光顯微鏡、超薄石蠟切片機(Leica公司,德國);酶標分析儀(Molecular Devices 公司,美國);恒溫CO2培養箱、超凈工作臺(Thermo Scientific公司,美國);肌電儀(浙江海神科技有限公司);透射電鏡(電子株式會社,日本);Image J軟件(National Institutes of Health,美國);GraphPad Prism 10.0 軟件(GraphPad Software公司,美國)。
1.2 SMC對雪旺細胞增殖及ROS水平的影響
1.2.1 細胞培養及分組
取RSC96細胞接種于含10%FBS的DMEM培養基,于37℃、5%CO2、96%濕度培養箱中培養,待細胞生長至培養皿底面積90%時進行傳代,取第3代后細胞進行后續實驗。將細胞以5×103個/mL密度接種于培養皿內,隨機分為5組,分別為A組(無任何處理,作為對照組)、B組(加入100 μmol/L H2O2)、C組(加入100 μmol/L H2O2+100 μmol/L SMC)、D組(加入100 μmol/L H2O2+200 μmol/L SMC)、E組(加入100 μmol/L H2O2+400 μmol/L SMC)。
1.2.2 細胞毒性檢測
各組細胞處理24 h后棄上清,每組加入20 μL MTT溶液,于37℃、5%CO2、96%濕度培養箱繼續培養4 h,加入Formazan溶解液再孵育4 h,然后采用酶標分析儀于波長570 nm處檢測吸光度(A)值,每組測量3孔,計算B~E組細胞抑制率,公式為:(A組A值?B~E任一組A值)/A組A值),篩選保護細胞活性的最佳藥物濃度組進行后續實驗。
1.2.3 ROS水平測量
取第3代RSC96細胞以5×103個/mL密度接種于培養皿內,隨機分為3組,分別以A、B組及上述篩選的最佳藥物濃度組方法處理細胞。將各組處理24 h細胞以2×106個/mL密度懸浮于10 μmol/L DCFH-DA溶液中孵育20 min,共聚焦免疫熒光顯微鏡觀察,每組隨機選3個視野,通過Image J軟件測量并按照以下公式計算ROS熒光強度:區域灰度值總和/區域總面積。
1.3 SMC 對神經損傷大鼠的治療作用及機制研究
1.3.1 動物分組及造模方法
取36只SD大鼠隨機分為3組,分別為假手術組(Sham組)、坐骨神經損傷組(PNI組)及SMC治療組(SMC組),每組12只。3組大鼠采用異氟烷麻醉后,暴露右側梨狀肌下緣1 cm處坐骨神經,Sham組立即進行縫合,正常喂食、水;其余兩組大鼠制備坐骨神經損傷模型。坐骨神經暴露后用大止血鉗夾閉坐骨神經干,夾滿3扣,擠壓5 s后松開止血鉗,間隔10 s后再夾閉5 s,再放松10 s,第3次再夾閉5 s;神經干擠壓傷寬度約5 mm,此時可見損傷神經呈透明扁平狀,周圍血腫形成,保證神經仍具有連續性;9-0無創縫線標記后將坐骨神經返回原位,隨后分層縫合。PNI組大鼠正常喂食、水,SMC組大鼠于每日飲用水中加入0.75 mg/kg SMC[21]。
1.3.2 神經電生理檢測
術后4周每組取3只大鼠,將大鼠俯臥于手術臺上,四肢固定在操作板上,小心逐層剝離找到損傷處坐骨神經,刺激電極插入坐骨粗結節下方坐骨神經兩側,腓腸肌中端放置記錄電極,接地電極黏貼于大鼠尾部;然后行強度2 mV、波寬3 ms的電刺激坐骨神經,觀察并記錄復合肌肉動作電位(compound muscle action potential,CMAP)的最高電位。采用雙人雙盲法,實驗重復3次,取均值。
1.3.3 血清炎癥因子和氧化應激因子檢測
術后4周取上述電生理檢測后的各組3只大鼠,用異氟烷麻醉后取頸動脈血2 mL,采用ELISA試劑盒檢測炎癥因子IL-17、IL-6、IL-10和氧化應激因子CAT、SOD、MDA水平。
1.3.4 勞克堅勞藍(luxol fast blue,LFB)染色
術后4周每組取3只大鼠,用異氟烷麻醉后以右側損傷處為中心取坐骨神經5 mm,置于4%多聚甲醛固定,24 h后修塊、脫水、石蠟包埋,制備4 mm厚切片,脫蠟后行LFB染色觀察再生髓鞘情況。每組隨機選取3個視野,采用Image J軟件計算髓鞘密度。
1.3.5 免疫熒光染色
術后4周取上述部分切片行免疫熒光染色。乙醇梯度脫水后,EDTA修復液抗原修復;0.2%Triton X-100溶液避光條件下透膜15 min,1%牛血清白蛋白室溫封閉1.5 h;去除封閉液,滴加GFAP(1∶1 000)、MBP(1∶500)一抗,4℃過夜;PBS漂洗3次,滴加對應二抗(山羊抗兔IgG、山羊抗小鼠IgG),4℃濕盒內孵育2 h;PBS漂洗后滴入含DAPI的防淬滅封片劑,封片,共聚焦免疫熒光顯微鏡觀察。
1.3.6 透射電鏡觀察
術后4周每組取3只大鼠,用異氟烷麻醉后以右側損傷處為中心取坐骨神經5 mm,置于2.5%戊二醛緩沖液中4℃過夜,然后用1%鋨酸溶液固定1.5 h;棄固定液,用0.1 mol/L PBS漂洗樣品3次,每次15 min;梯度濃度乙醇脫水,每種濃度處理15 min,然后包埋、修為梯形,切片,片厚80 mm,經檸檬酸鉛溶液和醋酸雙氧鈾50%乙醇飽和溶液各染色15 min,透射電鏡觀察髓鞘形態,每組隨機選取3個視野,用Image J軟件測量軸突直徑,取均值。
1.3.7 Western blot檢測
術后4周每組取3只大鼠,用異氟烷麻醉后,低溫(4℃)以右側損傷處為中心取坐骨神經5 mm,行組織研磨裂解,經BCA法評估蛋白濃度,并上樣、電泳、轉膜及封閉;滴加 p38MAPK(1∶1 000)、p-p38MAPK(1∶1 000)、HO-1(1∶1 000)、Nrf2(1∶1 000)一抗4℃過夜,洗膜后孵育二抗。加入ECL顯影液曝光拍照,采用Image J軟件分析目的蛋白灰度,計算目的蛋白相對表達量(即HO-1/β-actin、Nrf2/β-actin、p-p38MAPK/p38MAPK)。
1.4 統計學方法
采用SPSS27.0統計軟件進行分析。計量資料經Kolmogorov-Smirnov正態性檢驗,均符合正態分布,數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用SNK檢驗;檢驗水準α=0.05。
2 結果
2.1 SMC對雪旺細胞增殖及ROS水平的影響
MTT法檢測示,B~E組細胞抑制率分別為71.36%±1.35%、35.65%±2.32%、33.17%±2.50%、32.43%±1.56%。C~E組細胞抑制率顯著低于B組,差異均有統計學意義(P<0.05);C~E組間差異無統計學意義(P>0.05)。低濃度SMC即可促進雪旺細胞增殖并發揮保護雪旺細胞的功能,因此選擇C組進入后續實驗。
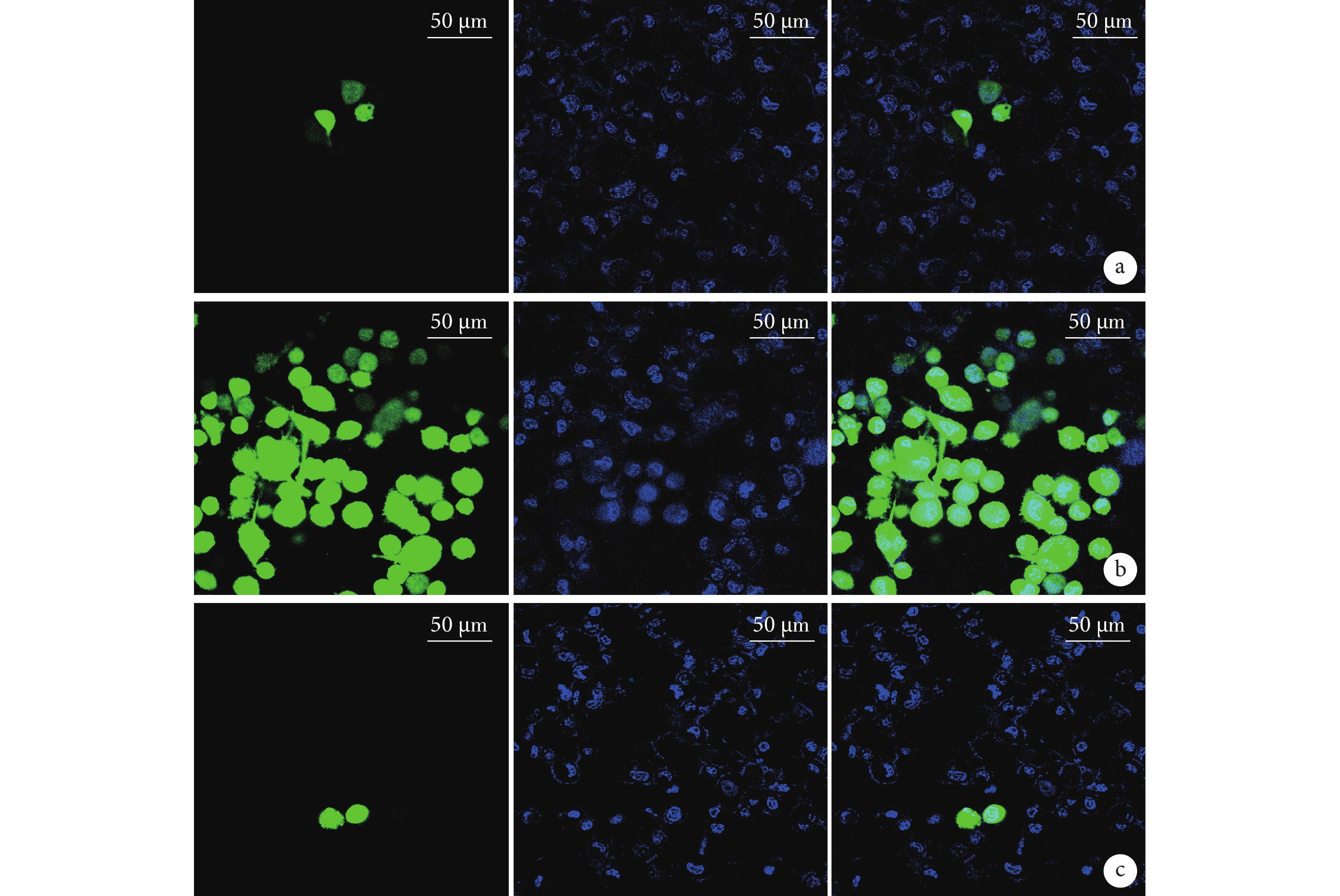
ROS免疫熒光檢測示,A、B、C組ROS熒光強度分別為(1.325±0.169)、(7.948±0.864)、(2.459±0.687)AU,B組ROS熒光強度顯著高于A、C組,差異均有統計學意義(P<0.05)。見圖1。
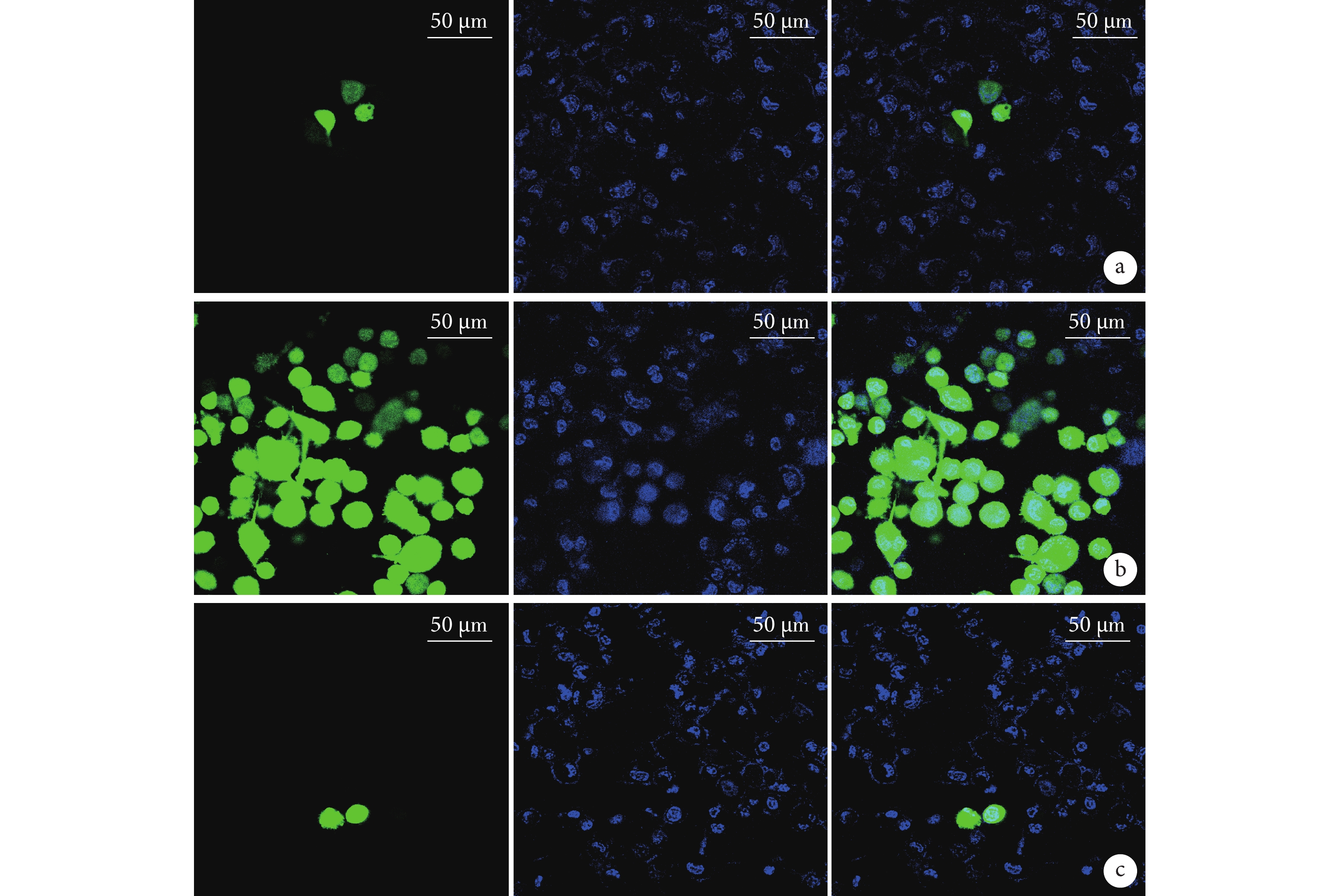 圖1
各組細胞處理48 h后ROS免疫熒光檢測(共聚焦免疫熒光顯微鏡×63)
圖1
各組細胞處理48 h后ROS免疫熒光檢測(共聚焦免疫熒光顯微鏡×63)
從左至右分別為ROS染色、Hoechst染色、二者重疊 a. A組;b. B組;c. C組
Figure1. ROS immunofluorescence detection of cells in each group after 48 hours of treatment (Confocal immunofluorescence microscope×63)From left to right for ROS staining, Hoechst staining, and merge, respectively a. Group A; b. Group B; c. Group C
2.2 SMC 對神經損傷大鼠的治療作用及機制研究
2.2.1 神經電生理檢測
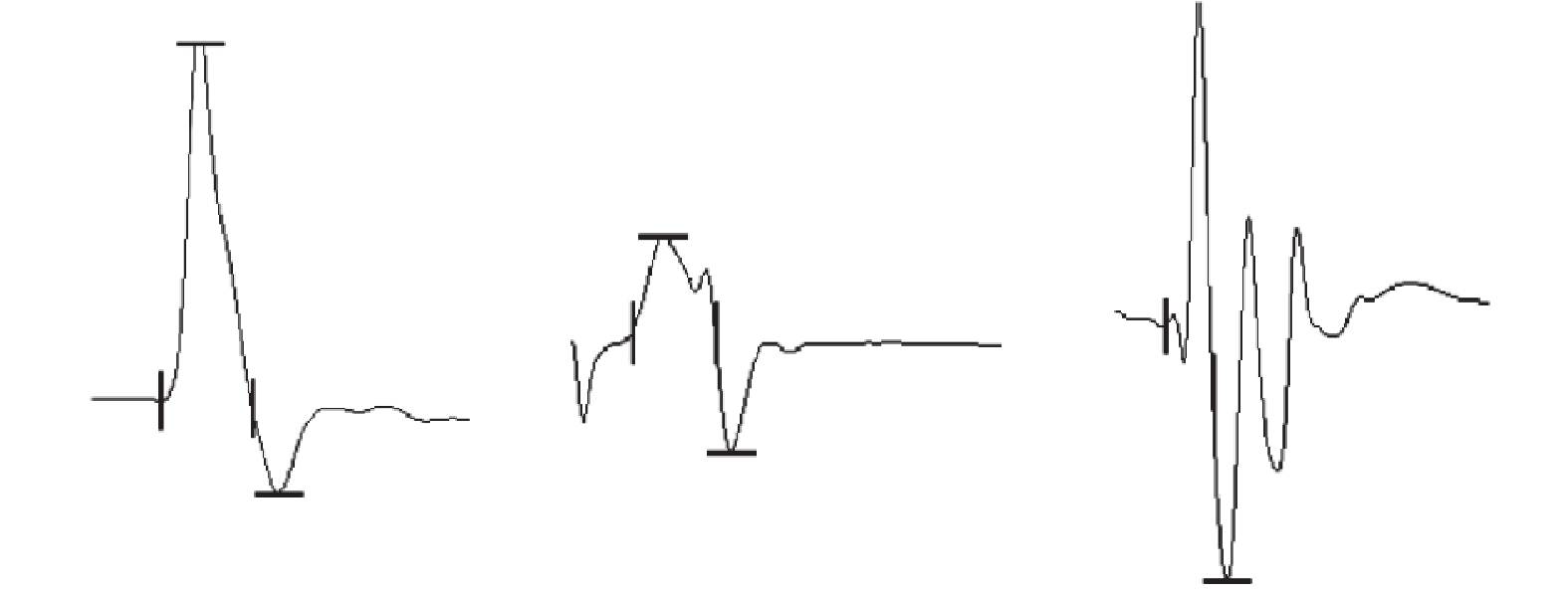
3組中SMC組CMAP最高電位最大、Sham組次之、PNI組最小,組間兩兩比較差異均有統計學意義(P<0.05)。見表1、2,圖2。
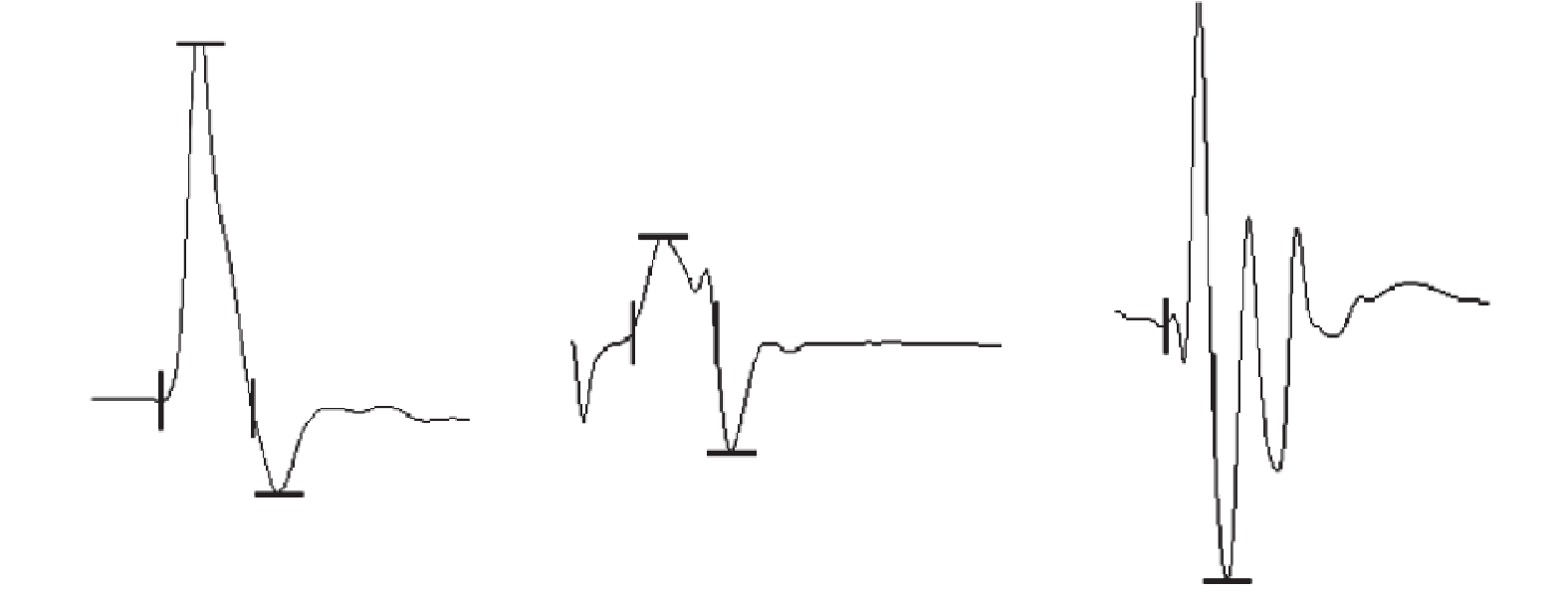 圖2
術后4周3組大鼠神經電生理檢測
圖2
術后4周3組大鼠神經電生理檢測
從左至右依次為Sham組、PNI組、SMC組
Figure2. Neurophysiological detection in 3 groups of rats at 4 weeks after operationFrom left to right for Sham group, PNI group, and SMC group, respectively
2.2.2 血清炎癥因子和氧化應激因子檢測
與Sham組比較,PNI組血清IL-10、SOD和CAT水平顯著降低,IL-6、IL-17和MDA水平明顯上升;與PNI組比較,SMC組血清IL-10、SOD和CAT水平顯著上升,IL-6、IL-17和MDA水平明顯下降;各組兩兩比較差異均有統計學意義(P<0.05)。見表1、2。
2.2.3 LFB染色
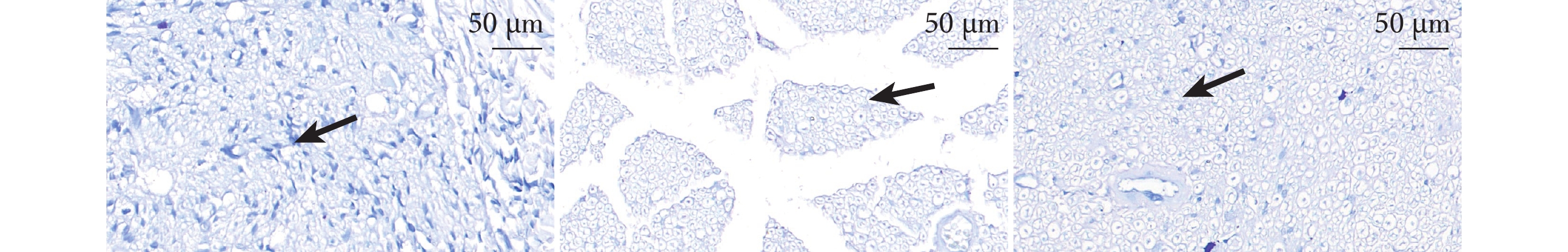
PNI組周圍組織較為稀疏,神經纖維面積明顯減少,單位面積髓鞘數量也大幅度降低,白質缺損;而Sham組和SMC組損傷較輕,可見大塊連續的髓鞘藍染結構。SMC組髓鞘密度最大、Sham組次之、PNI組最小,組間兩兩比較差異均有統計學意義(P<0.05)。見表1、2,圖3。
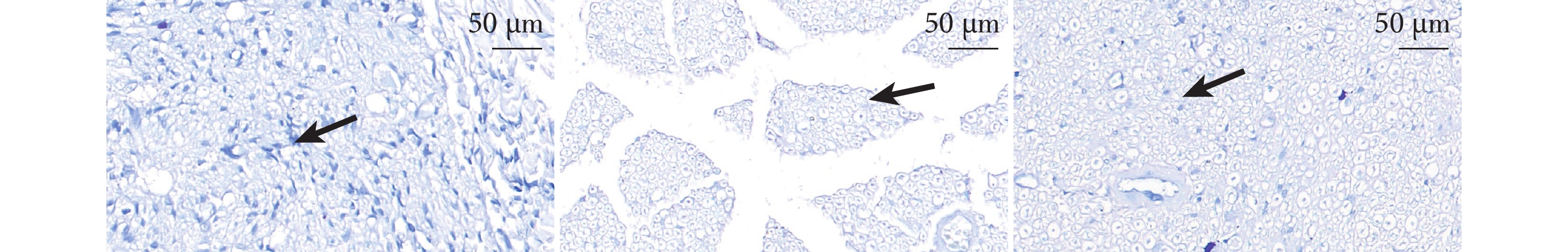 圖3
術后4周3組大鼠LFB染色觀察(共聚焦免疫熒光顯微鏡×63)
圖3
術后4周3組大鼠LFB染色觀察(共聚焦免疫熒光顯微鏡×63)
從左至右依次為Sham組、PNI組、SMC組,箭頭示髓鞘陽性區域
Figure3. LFB staining observation in 3 groups of rats at 4 weeks after operation (Confocal immunofluorescence microscope×63)From left to right for Sham group, PNI group, and SMC group, respectively, with arrows indicating myelin-positive areas
2.2.4 免疫熒光染色
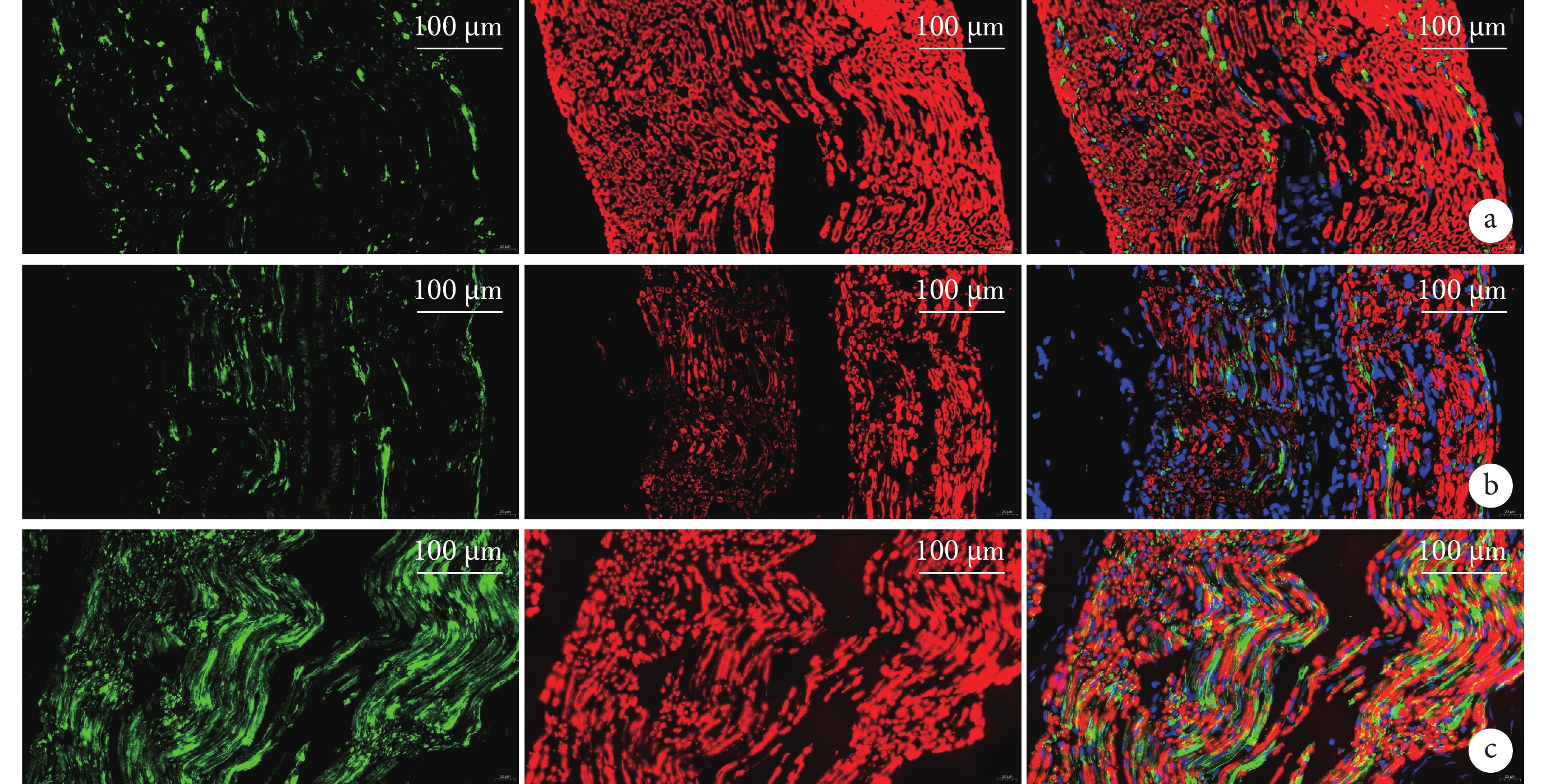
與Sham組比較,PNI組GFAP和MBP 熒光強度明顯下降,神經絲點狀分布,難以見到完整神經元,神經纖維數量較少;與PNI組比較,SMC組GFAP和MBP熒光強度明顯上升,神經元結構規整,排列致密。見圖4。
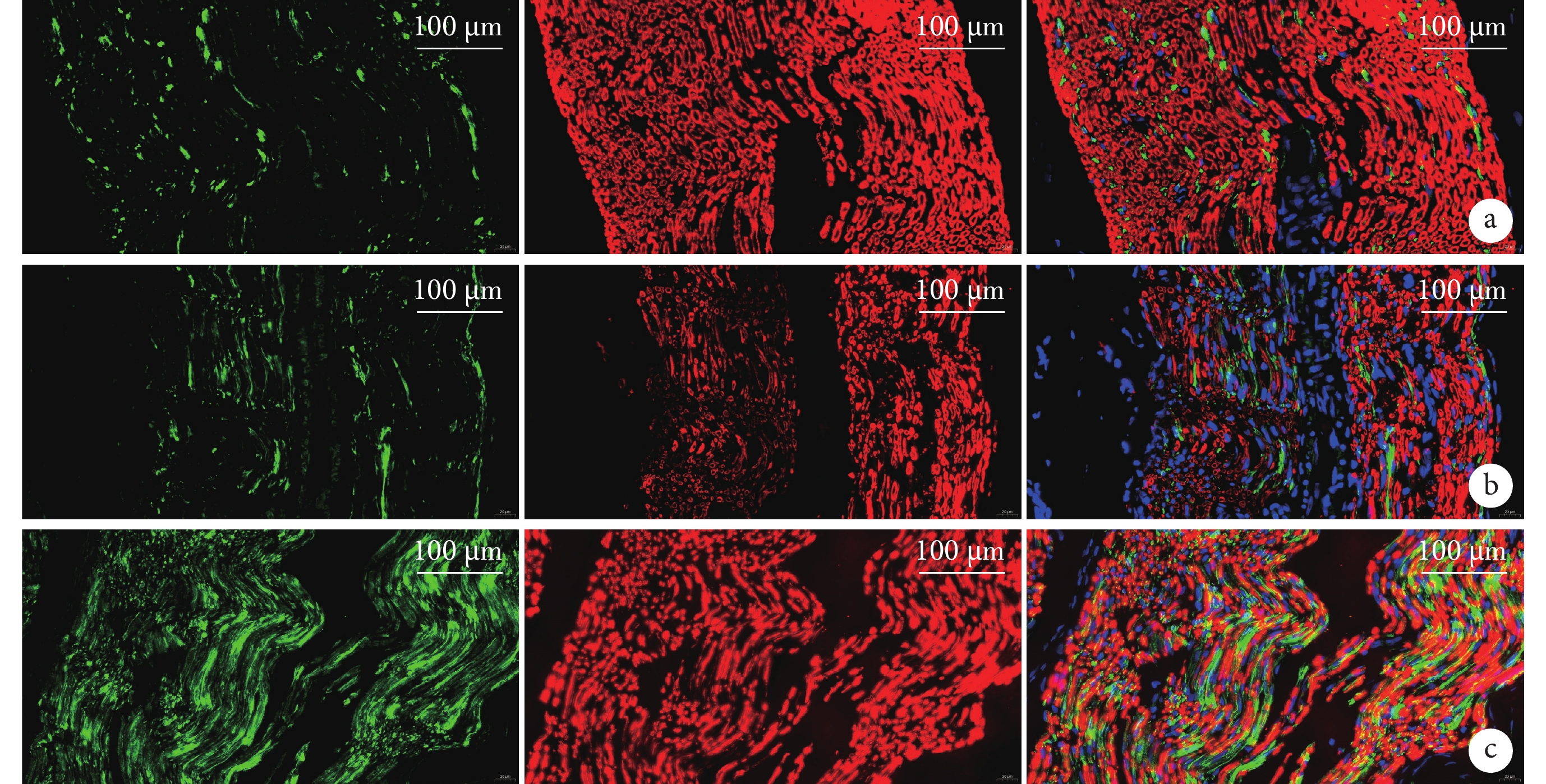 圖4
術后4周3組大鼠免疫熒光染色觀察(共聚焦免疫熒光顯微鏡×40)
圖4
術后4周3組大鼠免疫熒光染色觀察(共聚焦免疫熒光顯微鏡×40)
從左至右分別為GFAP染色、MBP染色、二者重疊 a. Sham組;b. PNI組;c. SMC組
Figure4. Immunofluorescence staining observation in 3 groups of rats at 4 weeks after operation (Confocal immunofluorescence microscope×40)From left to right for GFAP staining, MBP staining, and merge, respectively a. Sham group; b. PNI group; c. SMC group
2.2.5 透射電鏡觀察
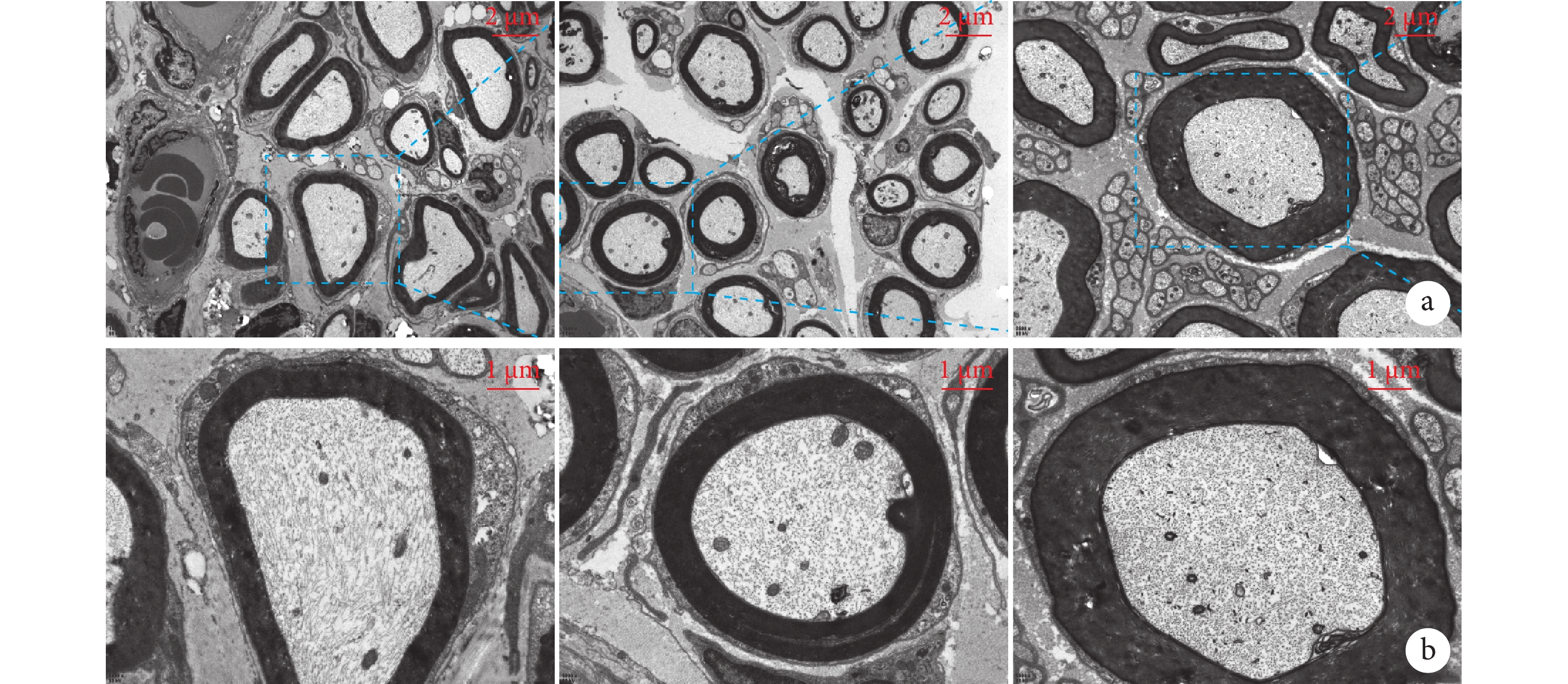
與Sham組比較,PNI組軸突直徑明顯減小,而SMC組軸突直徑較PNI組大幅度增加,形態更為規整。各組軸突直徑比較差異均有統計學意義(P<0.05)。見表1、2,圖5。
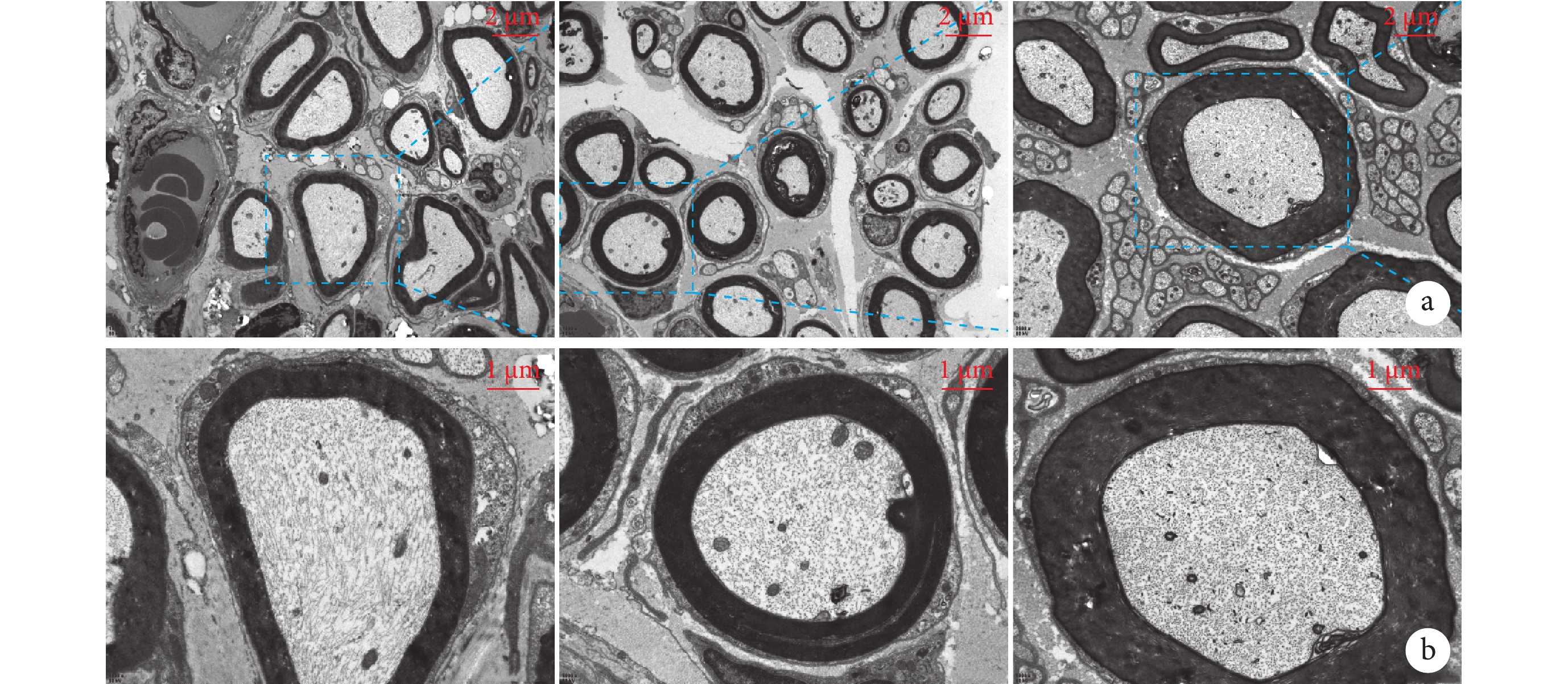 圖5
術后4周3組大鼠透射電鏡觀察
圖5
術后4周3組大鼠透射電鏡觀察
從左至右依次為Sham組、PNI組、SMC組 a. ×200;b. ×800
Figure5. Transmission electron microscopy observation in 3 groups of rats at 4 weeks after operationFrom left to right for Sham group, PNI group, and SMC group, respectively a. ×200; b. ×800
2.2.6 Western blot檢測
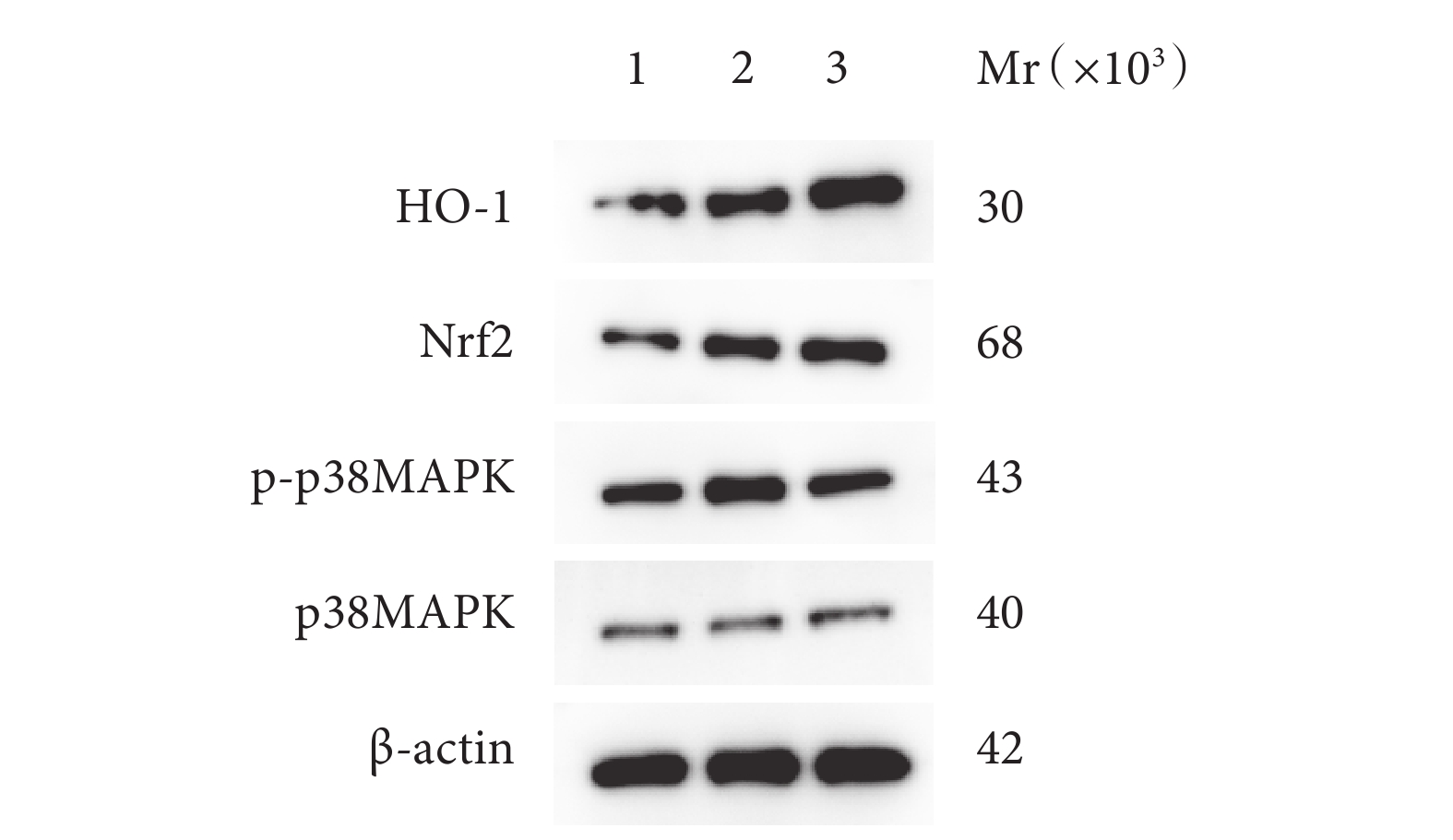
PNI組HO-1、Nrf2蛋白相對表達量顯著高于Sham組,SMC組顯著高于PNI組;PNI組p-p38MAPK/p38MAPK蛋白表達量比值顯著高于Sham組,SMC組顯著低于PNI組;上述組間差異均有統計學意義(P<0.05)。見表1、2,圖6。
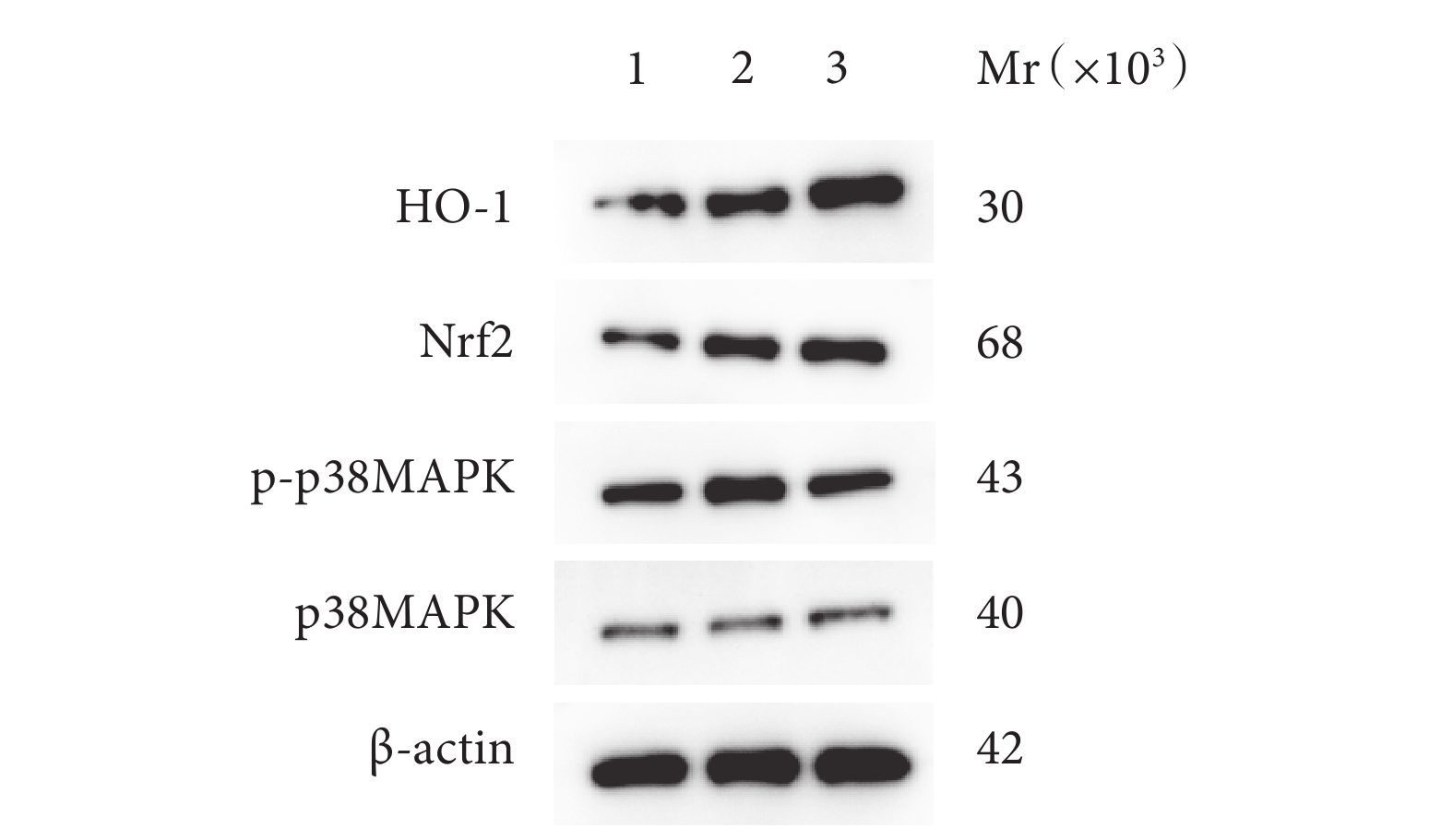 圖6
術后4周Western blot 檢測3組大鼠各蛋白表達凝膠電泳圖
圖6
術后4周Western blot 檢測3組大鼠各蛋白表達凝膠電泳圖
Mr:相對分子質量 1:Sham 組 2:PNI組 3:SMC 組
Figure6. Gel electrophoresis of each protein expression in 3 groups of rats detected by Western blot at 4 weeks after operationMr: Relative molecular mass 1: Sham group 2: PNI group 3: SMC group
3 討論
因交通事故創傷、腫瘤切除等原因造成的周圍神經損傷是目前常見疾病之一[22],近年發病率不斷上升,長時間疼痛和感覺缺失嚴重影響患者生活質量[23]。尋找一種治療周圍神經損傷的有效藥物非常必要。本研究中,我們通過細胞實驗驗證了低濃度SMC即可達到有效保護雪旺細胞免受氧化應激損傷的作用,因此后續均選取低濃度SMC進行實驗,這是因為Se的治療窗口比較狹窄[24],過量容易產生過高的細胞毒性,不利于神經愈合。
本研究初步探索了SMC在周圍神經損傷中的作用和機制。LFB染色發現SMC治療后神經排列有序,髓鞘緊致密集,髓鞘密度遠大于PNI組。神經電生理測試是衡量神經再生和功能修復的重要指標[25],SMC治療后在同樣電刺激下,CMAP最高電位遠大于PNI組,而CMAP最高電位差異同樣反映了術后神經再生速度,這也與LFB染色結果相印證,SMC可以增加神經電信號傳導,誘導軸突再生。
髓鞘是螺旋圍繞包裹周圍神經系統軸突的雪旺細胞質膜。髓鞘不僅對動作電位的快速傳導至關重要,對維持軸突完整性也很重要[26]。MBP是周圍神經系統中的主要髓鞘成分,位于髓鞘主要致密線的細胞質附著處[27]。許多研究表明,帶正電荷的MBP與帶負電荷的細胞質膜表面相互作用,這種結合可能對髓鞘的組裝至關重要[28]。GFAP是中間絲家族蛋白的神經膠質特異性成員,出現在雪旺細胞發育的相對較晚階段[29],主要是在未成熟的雪旺細胞形成時,并且在形成髓鞘的雪旺細胞中下調[30]。本研究發現術后4周,SMC組GFAP和MBP熒光強度均顯著上調,這也與LFB染色中髓鞘密度增加趨勢保持一致。同時透射電鏡以更微觀的角度反映了SMC治療神經損傷的有效性,結果顯示術后4周SMC組軸突直徑均明顯大于PNI組。進一步提示SMC可能通過促進髓鞘形成,增加軸突再生能力并加快神經恢復。
MAPK是一種絲氨酸-蘇氨酸蛋白激酶,可被不同細胞內外因素刺激,如細胞因子、神經遞質、激素、細胞應激等激活[31],p38MAPK可被蛋白激酶磷酸化從而發揮其活性功能,參與細胞增殖分化等。近年研究表明,p38MAPK通路在神經損傷及痛覺敏感中發揮重要作用[32];另有研究表明p38MAPK通路激活可促進雪旺細胞凋亡和增加炎癥因子表達[33]。而氧化應激同樣可促進p38MAPK磷酸化導致神經傳導異常[34]。本研究發現神經損傷后p38MAPK磷酸化程度顯著上升,加入SMC后p38MAPK磷酸化程度明顯下降,這也與軸突再生程度相對應,表明SMC可能通過抑制p38MAPK通路磷酸化,從而起到促進髓鞘形成、加速神經修復的作用。
既往有研究顯示神經損傷后,ROS產生過多及氧化因子過多累積往往是影響周圍神經再生的重要因素[35]。因為增加氧化應激刺激會影響溶酶體降解,同時ROS過量生成會導致DNA和蛋白質等大分子變性[36],致雪旺細胞損傷并大量死亡,而雪旺細胞分泌的神經營養因子可以減少神經元變性死亡并促進髓鞘再生[37],所以氧化應激會明顯抑制髓鞘形成和神經再生。本研究中體外細胞ROS免疫熒光染色結果顯示,SMC治療后ROS生成顯著減少,提示SMC可以通過抑制ROS水平起到抗氧化應激作用。此外,Nrf2蛋白是屬于亮氨酸調節蛋白家族,是機體調節氧化應激通路中的重要轉錄因子,以維持正常的線粒體功能和細胞穩態[38]。Nrf2可易位入細胞核與相應反應元件結合,從而激活一系列抗氧化保護因子表達,最終引起Nrf2 依賴性HO-1的表達上調[39]。HO-1是HO的3種同工酶之一,也是唯一一種在各種氧化應激因素刺激下可以迅速產生的蛋白質[40];它可催化血紅素降解為膽綠素、一氧化碳和游離鐵,其中一氧化碳起著核心作用[41],作用于細胞代謝,以保護細胞免受氧化應激并調節炎癥因子的產生。本研究中Western blot檢測示神經損傷后,抗氧化蛋白(Nrf2、HO-1)表達增加,而在加入SMC治療后,抗氧化蛋白表達水平進一步上升,提示SMC可能通過促進Nrf2/HO-1信號通路起到抑制氧化應激水平的作用。ROS如超氧自由基和活性羥基自由基通過氧化細胞膜脂質破壞細胞,這一過程被稱為脂質過氧化[42],并產生細胞毒性物質,如MDA等。本研究結果顯示MDA水平在神經損傷后顯著上升,SMC治療后顯著下降,同時抗氧化因子(SOD、CAT)水平也在SMC治療后明顯上升,說明SMC可以顯著抑制神經損傷后的脂質過氧化水平。
周圍神經損傷后,遠端神經會發生Wallerian變性[43],巨噬細胞等會釋放大量促炎因子,炎癥因子過多聚集會拖累神經再生速度[44]。本研究中發現SMC可以明顯減低炎癥因子(IL-6、IL-17)水平,顯著增加抗炎因子(IL-10)水平,提示SMC可以降低神經損傷后的炎癥反應,從而為神經再生創造良好微環境。
綜上述,SMC通過抑制Nrf2/HO-1信號通路抑制神經損傷后的氧化應激反應和ROS水平,抑制了損傷后炎癥反應程度,進而促進了雪旺細胞增殖并抑制了p38MAPK通路磷酸化,最終促進髓鞘形成和加快周圍神經再生,本研究為周圍神經損傷治療提供了新思路。但本研究也存在一定局限性,p38MAPK通路磷酸化過程可能與多個生物學過程相互串聯,我們并未對其中的因果關系進行研究,后續將進一步研究明確其確切調控作用。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經上海交通大學醫學院附屬第一人民醫院醫學倫理委員會批準(2022AW022);實驗動物使用許可證號:SYXK(滬)2019-0028
作者貢獻聲明 宋建國:研究實施,數據分析,文章撰寫;林浩東:資金提供及對文章內容作批評性審閱
近年來,周圍神經損傷發生率居高不下,多由交通事故等外傷引起[1-2]。與中樞神經相比,周圍神經往往具有一定再生能力[3-4],但再生能力有限;相較于短距離神經缺損,長距離神經缺損修復是目前臨床治療難點。自體神經因具有無毒、無免疫原性和良好生物相容性,成為目前治療長距離神經缺損的“金標準”[5-6],但存在供區損傷嚴重、易形成神經瘤、供體神經來源有限、供體神經長短不匹配、愈合時間較長等不足[7]。
氧化應激是周圍神經損傷后神經元死亡和軸突脫髓鞘的主要原因之一[8]。 受損神經具有產生相應抗氧化物質來中和自由基(reactive oxygen species,ROS)的能力。然而,ROS的積累是不受控制的,在損傷后的氧化應激反應中,抗氧化防御系統對ROS的清除能力可能不足[9]。這種持續累積的狀態削弱了神經修復和功能恢復水平;同時,氧化應激因子可通過激活p38絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路導致神經細胞凋亡損傷,引起神經營養障礙[10],從而阻礙了神經再生。p38MAPK 蛋白同時作為神經髓鞘形成的負性調節因素[11],能夠抑制周圍神經系統髓鞘形成。硒(selenium,Se)是人體必需元素,在體內是清除ROS的谷胱甘肽過氧化物酶的主要成分[12],有卓越的抗氧化應激和抗炎能力[13]。大量研究表明,Se可降低患一系列癌癥的風險,包括乳腺癌、前列腺癌、肺癌、結腸癌、肝癌等[14]。Se也被證明與DNA損傷和氧化應激相關,可以增強免疫監視和調節細胞增殖[15]。而且與其他生物制品中的ROS清除劑相比,Se更穩定、更經濟[16]。硒-甲基硒代半胱氨酸(Se-methylselenocysteine,SMC)被認為是對人體最有益的Se化合物,它作為一種有機Se,相比無機Se具有更大生物活性和更小毒性[17]。已有研究證實SMC在阿爾茲海默癥小鼠中可提高抗氧化能力,調節氨基酸代謝,改善突觸缺陷,從而提高小鼠認知能力[18]。另外有研究者發現SMC具有一定抑菌功能,其可通過抑制氧化應激促進斷奶大鼠生長發育和緩解心肌組織及膝關節病變[19-20]。但是,SMC在周圍神經再生中是否起作用,以及是否可通過抗氧化應激抑制p38MAPK通路,最終促進軸突髓鞘形成尚無相關研究。鑒于此,本研究探討SMC對周圍神經再生的影響及其相關作用機制,以期為臨床治療周圍神經損傷提供一種有前景的治療方法。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
4周齡SD雄性大鼠36只,體質量220~240 g,由上海斯萊克實驗動物有限責任公司提供;大鼠雪旺細胞RSC96細胞由中國科學院細胞庫提供。
SMC(上海MCE公司);異氟烷(上海生工生物工程股份有限公司);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、過氧化氫酶(catalase,CAT)ELISA檢測試劑盒,ROS試劑盒和MTT試劑盒(上海碧云天生物技術有限公司);DMEM基礎培養基、FBS(GIBCO公司,美國);山羊抗兔IgG、山羊抗小鼠IgG、p38MAPK抗體、磷酸化p38MAPK(phosphorylation p38MAPK,p-p38MAPK)抗體、血紅素氧合酶1(heme oxygenase 1,HO-1)抗體、核因子紅細胞系2相關因子2(nuclear factor erythroid 2-related factor 2,Nrf2)抗體、膠質纖維酸性蛋白(glial fibrillary acidic protein,GFAP)抗體、髓鞘堿性蛋白(myelinbasicprotein,MBP)抗體(Abcam公司,美國);蛋白提取試劑盒、超敏ECL發光檢測液(南京諾維贊生物科技股份有限公司);大鼠IL-6、IL-10、IL-17 ELISA檢測試劑盒(杭州聯科生物技術有限公司);H2O2(上海默克公司)。
共聚焦免疫熒光顯微鏡、超薄石蠟切片機(Leica公司,德國);酶標分析儀(Molecular Devices 公司,美國);恒溫CO2培養箱、超凈工作臺(Thermo Scientific公司,美國);肌電儀(浙江海神科技有限公司);透射電鏡(電子株式會社,日本);Image J軟件(National Institutes of Health,美國);GraphPad Prism 10.0 軟件(GraphPad Software公司,美國)。
1.2 SMC對雪旺細胞增殖及ROS水平的影響
1.2.1 細胞培養及分組
取RSC96細胞接種于含10%FBS的DMEM培養基,于37℃、5%CO2、96%濕度培養箱中培養,待細胞生長至培養皿底面積90%時進行傳代,取第3代后細胞進行后續實驗。將細胞以5×103個/mL密度接種于培養皿內,隨機分為5組,分別為A組(無任何處理,作為對照組)、B組(加入100 μmol/L H2O2)、C組(加入100 μmol/L H2O2+100 μmol/L SMC)、D組(加入100 μmol/L H2O2+200 μmol/L SMC)、E組(加入100 μmol/L H2O2+400 μmol/L SMC)。
1.2.2 細胞毒性檢測
各組細胞處理24 h后棄上清,每組加入20 μL MTT溶液,于37℃、5%CO2、96%濕度培養箱繼續培養4 h,加入Formazan溶解液再孵育4 h,然后采用酶標分析儀于波長570 nm處檢測吸光度(A)值,每組測量3孔,計算B~E組細胞抑制率,公式為:(A組A值?B~E任一組A值)/A組A值),篩選保護細胞活性的最佳藥物濃度組進行后續實驗。
1.2.3 ROS水平測量
取第3代RSC96細胞以5×103個/mL密度接種于培養皿內,隨機分為3組,分別以A、B組及上述篩選的最佳藥物濃度組方法處理細胞。將各組處理24 h細胞以2×106個/mL密度懸浮于10 μmol/L DCFH-DA溶液中孵育20 min,共聚焦免疫熒光顯微鏡觀察,每組隨機選3個視野,通過Image J軟件測量并按照以下公式計算ROS熒光強度:區域灰度值總和/區域總面積。
1.3 SMC 對神經損傷大鼠的治療作用及機制研究
1.3.1 動物分組及造模方法
取36只SD大鼠隨機分為3組,分別為假手術組(Sham組)、坐骨神經損傷組(PNI組)及SMC治療組(SMC組),每組12只。3組大鼠采用異氟烷麻醉后,暴露右側梨狀肌下緣1 cm處坐骨神經,Sham組立即進行縫合,正常喂食、水;其余兩組大鼠制備坐骨神經損傷模型。坐骨神經暴露后用大止血鉗夾閉坐骨神經干,夾滿3扣,擠壓5 s后松開止血鉗,間隔10 s后再夾閉5 s,再放松10 s,第3次再夾閉5 s;神經干擠壓傷寬度約5 mm,此時可見損傷神經呈透明扁平狀,周圍血腫形成,保證神經仍具有連續性;9-0無創縫線標記后將坐骨神經返回原位,隨后分層縫合。PNI組大鼠正常喂食、水,SMC組大鼠于每日飲用水中加入0.75 mg/kg SMC[21]。
1.3.2 神經電生理檢測
術后4周每組取3只大鼠,將大鼠俯臥于手術臺上,四肢固定在操作板上,小心逐層剝離找到損傷處坐骨神經,刺激電極插入坐骨粗結節下方坐骨神經兩側,腓腸肌中端放置記錄電極,接地電極黏貼于大鼠尾部;然后行強度2 mV、波寬3 ms的電刺激坐骨神經,觀察并記錄復合肌肉動作電位(compound muscle action potential,CMAP)的最高電位。采用雙人雙盲法,實驗重復3次,取均值。
1.3.3 血清炎癥因子和氧化應激因子檢測
術后4周取上述電生理檢測后的各組3只大鼠,用異氟烷麻醉后取頸動脈血2 mL,采用ELISA試劑盒檢測炎癥因子IL-17、IL-6、IL-10和氧化應激因子CAT、SOD、MDA水平。
1.3.4 勞克堅勞藍(luxol fast blue,LFB)染色
術后4周每組取3只大鼠,用異氟烷麻醉后以右側損傷處為中心取坐骨神經5 mm,置于4%多聚甲醛固定,24 h后修塊、脫水、石蠟包埋,制備4 mm厚切片,脫蠟后行LFB染色觀察再生髓鞘情況。每組隨機選取3個視野,采用Image J軟件計算髓鞘密度。
1.3.5 免疫熒光染色
術后4周取上述部分切片行免疫熒光染色。乙醇梯度脫水后,EDTA修復液抗原修復;0.2%Triton X-100溶液避光條件下透膜15 min,1%牛血清白蛋白室溫封閉1.5 h;去除封閉液,滴加GFAP(1∶1 000)、MBP(1∶500)一抗,4℃過夜;PBS漂洗3次,滴加對應二抗(山羊抗兔IgG、山羊抗小鼠IgG),4℃濕盒內孵育2 h;PBS漂洗后滴入含DAPI的防淬滅封片劑,封片,共聚焦免疫熒光顯微鏡觀察。
1.3.6 透射電鏡觀察
術后4周每組取3只大鼠,用異氟烷麻醉后以右側損傷處為中心取坐骨神經5 mm,置于2.5%戊二醛緩沖液中4℃過夜,然后用1%鋨酸溶液固定1.5 h;棄固定液,用0.1 mol/L PBS漂洗樣品3次,每次15 min;梯度濃度乙醇脫水,每種濃度處理15 min,然后包埋、修為梯形,切片,片厚80 mm,經檸檬酸鉛溶液和醋酸雙氧鈾50%乙醇飽和溶液各染色15 min,透射電鏡觀察髓鞘形態,每組隨機選取3個視野,用Image J軟件測量軸突直徑,取均值。
1.3.7 Western blot檢測
術后4周每組取3只大鼠,用異氟烷麻醉后,低溫(4℃)以右側損傷處為中心取坐骨神經5 mm,行組織研磨裂解,經BCA法評估蛋白濃度,并上樣、電泳、轉膜及封閉;滴加 p38MAPK(1∶1 000)、p-p38MAPK(1∶1 000)、HO-1(1∶1 000)、Nrf2(1∶1 000)一抗4℃過夜,洗膜后孵育二抗。加入ECL顯影液曝光拍照,采用Image J軟件分析目的蛋白灰度,計算目的蛋白相對表達量(即HO-1/β-actin、Nrf2/β-actin、p-p38MAPK/p38MAPK)。
1.4 統計學方法
采用SPSS27.0統計軟件進行分析。計量資料經Kolmogorov-Smirnov正態性檢驗,均符合正態分布,數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用SNK檢驗;檢驗水準α=0.05。
2 結果
2.1 SMC對雪旺細胞增殖及ROS水平的影響
MTT法檢測示,B~E組細胞抑制率分別為71.36%±1.35%、35.65%±2.32%、33.17%±2.50%、32.43%±1.56%。C~E組細胞抑制率顯著低于B組,差異均有統計學意義(P<0.05);C~E組間差異無統計學意義(P>0.05)。低濃度SMC即可促進雪旺細胞增殖并發揮保護雪旺細胞的功能,因此選擇C組進入后續實驗。
ROS免疫熒光檢測示,A、B、C組ROS熒光強度分別為(1.325±0.169)、(7.948±0.864)、(2.459±0.687)AU,B組ROS熒光強度顯著高于A、C組,差異均有統計學意義(P<0.05)。見圖1。
 圖1
各組細胞處理48 h后ROS免疫熒光檢測(共聚焦免疫熒光顯微鏡×63)
圖1
各組細胞處理48 h后ROS免疫熒光檢測(共聚焦免疫熒光顯微鏡×63)
從左至右分別為ROS染色、Hoechst染色、二者重疊 a. A組;b. B組;c. C組
Figure1. ROS immunofluorescence detection of cells in each group after 48 hours of treatment (Confocal immunofluorescence microscope×63)From left to right for ROS staining, Hoechst staining, and merge, respectively a. Group A; b. Group B; c. Group C
2.2 SMC 對神經損傷大鼠的治療作用及機制研究
2.2.1 神經電生理檢測
3組中SMC組CMAP最高電位最大、Sham組次之、PNI組最小,組間兩兩比較差異均有統計學意義(P<0.05)。見表1、2,圖2。
 圖2
術后4周3組大鼠神經電生理檢測
圖2
術后4周3組大鼠神經電生理檢測
從左至右依次為Sham組、PNI組、SMC組
Figure2. Neurophysiological detection in 3 groups of rats at 4 weeks after operationFrom left to right for Sham group, PNI group, and SMC group, respectively
2.2.2 血清炎癥因子和氧化應激因子檢測
與Sham組比較,PNI組血清IL-10、SOD和CAT水平顯著降低,IL-6、IL-17和MDA水平明顯上升;與PNI組比較,SMC組血清IL-10、SOD和CAT水平顯著上升,IL-6、IL-17和MDA水平明顯下降;各組兩兩比較差異均有統計學意義(P<0.05)。見表1、2。
2.2.3 LFB染色
PNI組周圍組織較為稀疏,神經纖維面積明顯減少,單位面積髓鞘數量也大幅度降低,白質缺損;而Sham組和SMC組損傷較輕,可見大塊連續的髓鞘藍染結構。SMC組髓鞘密度最大、Sham組次之、PNI組最小,組間兩兩比較差異均有統計學意義(P<0.05)。見表1、2,圖3。
 圖3
術后4周3組大鼠LFB染色觀察(共聚焦免疫熒光顯微鏡×63)
圖3
術后4周3組大鼠LFB染色觀察(共聚焦免疫熒光顯微鏡×63)
從左至右依次為Sham組、PNI組、SMC組,箭頭示髓鞘陽性區域
Figure3. LFB staining observation in 3 groups of rats at 4 weeks after operation (Confocal immunofluorescence microscope×63)From left to right for Sham group, PNI group, and SMC group, respectively, with arrows indicating myelin-positive areas
2.2.4 免疫熒光染色
與Sham組比較,PNI組GFAP和MBP 熒光強度明顯下降,神經絲點狀分布,難以見到完整神經元,神經纖維數量較少;與PNI組比較,SMC組GFAP和MBP熒光強度明顯上升,神經元結構規整,排列致密。見圖4。
 圖4
術后4周3組大鼠免疫熒光染色觀察(共聚焦免疫熒光顯微鏡×40)
圖4
術后4周3組大鼠免疫熒光染色觀察(共聚焦免疫熒光顯微鏡×40)
從左至右分別為GFAP染色、MBP染色、二者重疊 a. Sham組;b. PNI組;c. SMC組
Figure4. Immunofluorescence staining observation in 3 groups of rats at 4 weeks after operation (Confocal immunofluorescence microscope×40)From left to right for GFAP staining, MBP staining, and merge, respectively a. Sham group; b. PNI group; c. SMC group
2.2.5 透射電鏡觀察
與Sham組比較,PNI組軸突直徑明顯減小,而SMC組軸突直徑較PNI組大幅度增加,形態更為規整。各組軸突直徑比較差異均有統計學意義(P<0.05)。見表1、2,圖5。
 圖5
術后4周3組大鼠透射電鏡觀察
圖5
術后4周3組大鼠透射電鏡觀察
從左至右依次為Sham組、PNI組、SMC組 a. ×200;b. ×800
Figure5. Transmission electron microscopy observation in 3 groups of rats at 4 weeks after operationFrom left to right for Sham group, PNI group, and SMC group, respectively a. ×200; b. ×800
2.2.6 Western blot檢測
PNI組HO-1、Nrf2蛋白相對表達量顯著高于Sham組,SMC組顯著高于PNI組;PNI組p-p38MAPK/p38MAPK蛋白表達量比值顯著高于Sham組,SMC組顯著低于PNI組;上述組間差異均有統計學意義(P<0.05)。見表1、2,圖6。
 圖6
術后4周Western blot 檢測3組大鼠各蛋白表達凝膠電泳圖
圖6
術后4周Western blot 檢測3組大鼠各蛋白表達凝膠電泳圖
Mr:相對分子質量 1:Sham 組 2:PNI組 3:SMC 組
Figure6. Gel electrophoresis of each protein expression in 3 groups of rats detected by Western blot at 4 weeks after operationMr: Relative molecular mass 1: Sham group 2: PNI group 3: SMC group
3 討論
因交通事故創傷、腫瘤切除等原因造成的周圍神經損傷是目前常見疾病之一[22],近年發病率不斷上升,長時間疼痛和感覺缺失嚴重影響患者生活質量[23]。尋找一種治療周圍神經損傷的有效藥物非常必要。本研究中,我們通過細胞實驗驗證了低濃度SMC即可達到有效保護雪旺細胞免受氧化應激損傷的作用,因此后續均選取低濃度SMC進行實驗,這是因為Se的治療窗口比較狹窄[24],過量容易產生過高的細胞毒性,不利于神經愈合。
本研究初步探索了SMC在周圍神經損傷中的作用和機制。LFB染色發現SMC治療后神經排列有序,髓鞘緊致密集,髓鞘密度遠大于PNI組。神經電生理測試是衡量神經再生和功能修復的重要指標[25],SMC治療后在同樣電刺激下,CMAP最高電位遠大于PNI組,而CMAP最高電位差異同樣反映了術后神經再生速度,這也與LFB染色結果相印證,SMC可以增加神經電信號傳導,誘導軸突再生。
髓鞘是螺旋圍繞包裹周圍神經系統軸突的雪旺細胞質膜。髓鞘不僅對動作電位的快速傳導至關重要,對維持軸突完整性也很重要[26]。MBP是周圍神經系統中的主要髓鞘成分,位于髓鞘主要致密線的細胞質附著處[27]。許多研究表明,帶正電荷的MBP與帶負電荷的細胞質膜表面相互作用,這種結合可能對髓鞘的組裝至關重要[28]。GFAP是中間絲家族蛋白的神經膠質特異性成員,出現在雪旺細胞發育的相對較晚階段[29],主要是在未成熟的雪旺細胞形成時,并且在形成髓鞘的雪旺細胞中下調[30]。本研究發現術后4周,SMC組GFAP和MBP熒光強度均顯著上調,這也與LFB染色中髓鞘密度增加趨勢保持一致。同時透射電鏡以更微觀的角度反映了SMC治療神經損傷的有效性,結果顯示術后4周SMC組軸突直徑均明顯大于PNI組。進一步提示SMC可能通過促進髓鞘形成,增加軸突再生能力并加快神經恢復。
MAPK是一種絲氨酸-蘇氨酸蛋白激酶,可被不同細胞內外因素刺激,如細胞因子、神經遞質、激素、細胞應激等激活[31],p38MAPK可被蛋白激酶磷酸化從而發揮其活性功能,參與細胞增殖分化等。近年研究表明,p38MAPK通路在神經損傷及痛覺敏感中發揮重要作用[32];另有研究表明p38MAPK通路激活可促進雪旺細胞凋亡和增加炎癥因子表達[33]。而氧化應激同樣可促進p38MAPK磷酸化導致神經傳導異常[34]。本研究發現神經損傷后p38MAPK磷酸化程度顯著上升,加入SMC后p38MAPK磷酸化程度明顯下降,這也與軸突再生程度相對應,表明SMC可能通過抑制p38MAPK通路磷酸化,從而起到促進髓鞘形成、加速神經修復的作用。
既往有研究顯示神經損傷后,ROS產生過多及氧化因子過多累積往往是影響周圍神經再生的重要因素[35]。因為增加氧化應激刺激會影響溶酶體降解,同時ROS過量生成會導致DNA和蛋白質等大分子變性[36],致雪旺細胞損傷并大量死亡,而雪旺細胞分泌的神經營養因子可以減少神經元變性死亡并促進髓鞘再生[37],所以氧化應激會明顯抑制髓鞘形成和神經再生。本研究中體外細胞ROS免疫熒光染色結果顯示,SMC治療后ROS生成顯著減少,提示SMC可以通過抑制ROS水平起到抗氧化應激作用。此外,Nrf2蛋白是屬于亮氨酸調節蛋白家族,是機體調節氧化應激通路中的重要轉錄因子,以維持正常的線粒體功能和細胞穩態[38]。Nrf2可易位入細胞核與相應反應元件結合,從而激活一系列抗氧化保護因子表達,最終引起Nrf2 依賴性HO-1的表達上調[39]。HO-1是HO的3種同工酶之一,也是唯一一種在各種氧化應激因素刺激下可以迅速產生的蛋白質[40];它可催化血紅素降解為膽綠素、一氧化碳和游離鐵,其中一氧化碳起著核心作用[41],作用于細胞代謝,以保護細胞免受氧化應激并調節炎癥因子的產生。本研究中Western blot檢測示神經損傷后,抗氧化蛋白(Nrf2、HO-1)表達增加,而在加入SMC治療后,抗氧化蛋白表達水平進一步上升,提示SMC可能通過促進Nrf2/HO-1信號通路起到抑制氧化應激水平的作用。ROS如超氧自由基和活性羥基自由基通過氧化細胞膜脂質破壞細胞,這一過程被稱為脂質過氧化[42],并產生細胞毒性物質,如MDA等。本研究結果顯示MDA水平在神經損傷后顯著上升,SMC治療后顯著下降,同時抗氧化因子(SOD、CAT)水平也在SMC治療后明顯上升,說明SMC可以顯著抑制神經損傷后的脂質過氧化水平。
周圍神經損傷后,遠端神經會發生Wallerian變性[43],巨噬細胞等會釋放大量促炎因子,炎癥因子過多聚集會拖累神經再生速度[44]。本研究中發現SMC可以明顯減低炎癥因子(IL-6、IL-17)水平,顯著增加抗炎因子(IL-10)水平,提示SMC可以降低神經損傷后的炎癥反應,從而為神經再生創造良好微環境。
綜上述,SMC通過抑制Nrf2/HO-1信號通路抑制神經損傷后的氧化應激反應和ROS水平,抑制了損傷后炎癥反應程度,進而促進了雪旺細胞增殖并抑制了p38MAPK通路磷酸化,最終促進髓鞘形成和加快周圍神經再生,本研究為周圍神經損傷治療提供了新思路。但本研究也存在一定局限性,p38MAPK通路磷酸化過程可能與多個生物學過程相互串聯,我們并未對其中的因果關系進行研究,后續將進一步研究明確其確切調控作用。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經上海交通大學醫學院附屬第一人民醫院醫學倫理委員會批準(2022AW022);實驗動物使用許可證號:SYXK(滬)2019-0028
作者貢獻聲明 宋建國:研究實施,數據分析,文章撰寫;林浩東:資金提供及對文章內容作批評性審閱