引用本文: 藍益南, 張靜逸, 冉永峰, 李博, 蔡曉斌, 江濤, 薛德挺. 脫細胞真皮基質/磷酸氫鈣骨復合支架的制備和體內成骨研究. 中國修復重建外科雜志, 2024, 38(6): 755-762. doi: 10.7507/1002-1892.202403059 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
骨缺損修復一直是骨科面臨挑戰之一,每年有數百萬骨缺損患者需要進行骨移植治療。自體骨移植是骨缺損修復的“金標準”,但自體骨量有限,無法滿足較大缺損部位移植需求[1-3],同種異體骨或異種骨移植存在免疫排斥反應和交叉感染等隱患;而組織工程骨作為骨修復材料,在骨外科手術中具有廣闊應用前景。
膠原基生物材料因具有極優的生物活性、較高強度和可塑性,被廣泛應用于各醫療領域[4]。作為基質材料時,膠原的三維網狀結構易于與其他骨傳導性材料結合,如羥基磷灰石、β-磷酸三鈣和磷酸氫鈣(dicalcium phosphate,DCP)等。膠原占據大多數組織和器官干重的近90%[5],礦化膠原也是骨組織的最主要成分,其由成骨細胞所分泌并礦化,膠原蛋白可結合血凝塊和宿主自身骨細胞,已被證實可以加速骨骼再生[6]。因此,基于天然仿生構建思路,膠原蛋白-生物陶瓷復合物是構建骨修復支架的理想材料。
然而,目前市場上的膠原類產品多使用化學提純制備,如Healos?(Johnson & Johnson公司,美國)、Vitoss?(Stryker公司,美國)等[7],制備工藝中的膠原純化處理會破壞膠原的天然結構和基質中的活性因子,影響產品的組織再生性能。同時,為了提高材料機械性能和減緩材料降解,會對提純膠原材料用醛類交聯劑進行化學交聯處理,造成潛在材料毒性[8-10]。由于提純膠原材料存在的局限性,脫細胞基質相關研究和應用逐漸得到發展。天然材料如脫細胞軟組織或骨組織等具有豐富的膠原蛋白等細胞外基質成分和多種活性因子[8,11],脫細胞處理在結構上保留了細胞外基質的天然三維微觀結構和膠原分子的天然三螺旋結構,在成分上有效利用了脫細胞材料中膠原等生物活性成分,且維持基質的自然交聯,具有良好生物相容性[12]。大量研究和臨床應用使用脫細胞軟組織(如真皮和小腸黏膜下層等)用于腹疝、心肌、腸胃[13-15]、跟腱[16]修復,或脫細胞骨軟骨用于軟骨重建再生[17]等,取得了良好療效。
為了提高膠原基材料的骨再生性能和生物相容性,我們開發了基于天然豬真皮基質的新型骨組織工程支架,對豬真皮進行脫細胞和微纖維化處理后,將其與具有良好生物可吸收性的DCP陶瓷顆粒通過物理方法復合[18],制備具有高孔隙率和孔連通率的多孔支架材料,以探索脫細胞軟組織在骨修復再生中的應用潛力。
1 材料與方法
1.1 實驗動物、材料及主要試劑、儀器
健康成年雄性新西蘭大白兔12只,體質量>2.5 kg,由浙江中醫藥大學動物實驗研究中心提供。豬皮(浙江天天田園控股集團有限公司);無水DCP(湖州展望藥業有限公司);骼金?人工骨修復材料(主要成分為Ⅰ型膠原及羥基磷灰石;北京奧精醫療科技有限公司)。
GM 200刀式研磨儀(Restch公司,德國);FESEM SU-8010場發射掃描電鏡(Hitachi公司,日本);AutoPore Ⅳ 9510壓汞儀 [麥克默瑞提克(上海)儀器有限公司];SmartLab X射線衍射儀(上海力晶科學儀器有限公司)。
1.2 脫細胞真皮基質(acellular dermal matrix,ADM)/DCP復合支架制備及表征
1.2.1 豬ADM和ADM/DCP復合支架制備
取新鮮豬皮去除表皮層和皮下脂肪得到真皮層,將真皮層裁切為寬3~5 mm、長3~5 cm的條狀,用0.2%過氧乙酸-2%碳酸氫鈉溶液浸泡消毒2 h。將消毒并清洗后的豬真皮層置于刀式研磨儀中,高速攪拌研磨處理為微纖維;然后于24 mmol/L脫氧膽酸鈉-0.2%EDTA溶液中振搖24 h后,生理鹽水清洗15次,離心除去多余液體,得到豬ADM。
對豬ADM進行水分測定并計算其干重,稱取其2倍干重的無水DCP混合放入燒杯中,加入與ADM和DCP總質量等重的生理鹽水,攪拌均勻后倒入刀式研磨儀高速攪拌混合;然后將材料倒入模具中,凍干,密封包裝,經20 kGy 60Co輻照滅菌后,得到ADM/DCP復合支架,備用。
1.2.2 支架脫細胞效果檢測
對ADM/DCP復合支架行大體觀察;并進行DNA殘留、脂肪含量及α-半乳糖基抗原(α-1,3-galactosyle,α-Gal)抗原表位數檢測[19-22],定量分析ADM/DCP復合支架的脫細胞效果,以豬ADM作為對照。
1.2.3 支架微觀結構表征
將ADM/DCP復合支架樣品噴金后,使用場發射掃描電鏡對產品表面形貌進行表征;使用壓汞儀測定支架孔隙率(n=6),真空6.65 kPa,平衡5 min,計算范圍為0.1~30.0 psia。
1.2.4 支架的X射線衍射分析
將ADM/DCP復合支架裁切為10 mm×10 mm×2 mm的薄片,同時稱取無水DCP 0.5 g,分別使用X射線衍射儀進行表征分析,對比圖譜分析晶型是否發生變化。
1.2.5 支架溶解性檢測
按照標準方法檢測ADM/DCP復合支架溶解性[23]。裁切并稱取80 mg材料,置于離心管中,按照2.0 mg/mL比例加入Tris緩沖溶液(pH=7.3±0.1),(37±1)℃、200 r/min條件下振蕩浸泡,于0、24、48、72 h后分別取樣測量溶液pH值(n=9,以與0 h pH值的差值計算)和鈣離子含量(n=3)。
1.2.6 支架的體外礦化實驗
按照Kokubo等[24]報道的方法配制模擬體液(simulated body fluid,SBF)。無菌操作下將ADM/DCP復合支架裁切為10 mm×10 mm×2 mm的薄片,游標卡尺測量其尺寸(精確至±0.1 mm),并計算表面積。按以下公式計算所用SBF體積:SBF體積=100 mm×樣品表面積。
于離心管中加入相應體積SBF并放置于36.5℃ CO2培養箱中預熱,然后將樣品浸沒于SBF中,每天更換SBF。分別于浸泡1、2、4、8周時取樣,用純化水輕柔清洗5 min后常溫干燥。使用掃描電鏡進行表面礦化物檢測,確定磷灰石層存在與否。
1.3 兔股骨髁缺損修復實驗
1.3.1 實驗分組及方法
材料準備:將ADM/DCP復合支架用環鉆鉆取為直徑6 mm、高8 mm的圓柱體,將骼金?人工骨修復材料鉆取為直徑6 mm、高4 mm的圓柱體,備用。取12只健康新西蘭大白兔,采用耳緣靜脈注射陸眠寧、舒泰溶液進行麻醉;于兔雙側髂骨處備皮、穿刺抽取紅骨髓1 mL于采血管中備用。于兔雙側股骨外側髁各鉆取一直徑6 mm、深8 mm的腔洞,將兩組材料分別混合吸收自體紅骨髓后,左側股骨髁植入1個ADM/DCP復合支架圓柱體(實驗組),右側植入2個骼金?人工骨修復材料圓柱體(對照組);逐層縫合筋膜和皮膚,術后3 d連續皮下注射青霉素40萬U/d。
1.3.2 兔股骨髁缺損修復評價指標
術后6、12周分別處死6只動物,取股骨髁修復組織標本進行評價。① 大體觀察:觀察缺損部位及周邊骨是否存在骨痂、骨贅,以及與正常組織的整合情況。② Micro-CT檢測:將術后12周組織標本置于中性甲醛固定48 h,行Micro-CT掃描并定量分析植入區域的骨體積(bone volume,BV)、骨體積分數(bone volume/tissue volume,BV/TV)、骨表面積和骨體積之比(bone surface/bone volume,BS/BV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁數目(trabecular number,Tb.N)、骨小梁間隙(trabecular separation,Tb.Sp)、骨密度(bone mineral density,BMD)。③ 組織學觀察:將術后6、12周組織標本置于中性甲醛固定48 h,經常規脫鈣、梯度脫水、石蠟包埋,5 μm厚切片,行HE染色和Masson染色,觀察骨缺損修復及骨基質成熟情況。
1.4 統計學方法
采用SPSS23.0統計軟件進行分析。計量資料經Shapiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,組間比較采用獨立樣本t檢驗;檢驗水準α=0.05。
2 結果
2.1 ADM/DCP復合支架表征
大體觀察示所制備的ADM/DCP復合支架為白色海綿狀固體(圖1a);與豬ADM比較,ADM/DCP復合支架的DNA殘留、脂肪含量和α-Gal抗原含量均大幅降低,差異有統計學意義(P<0.05),說明脫細胞處理具有較高的去核酸、去抗原效率;且ADM/DCP復合支架的DNA殘留量滿足DNA殘留安全限度(50 ng/mg)[25]。見表1。
 圖1
ADM/DCP復合支架表征
圖1
ADM/DCP復合支架表征
a. 大體觀察;b. 場發射掃描電鏡觀察 右圖(×200)為左圖(×100)白色虛線框放大圖,白色顆粒為DCP,纖維為豬真皮纖維;c. ADM/DCP復合支架和無水DCP的X射線衍射分析圖譜;d、e. ADM/DCP復合支架溶解性實驗pH值和鈣離子濃度;f. ADM/DCP復合支架在SBF中礦化不同時間點掃描電鏡觀察(×1 000) 內嵌圖為局部放大(×10 k),從左至右依次為礦化1、2、4、8周
Figure1. Characterization of the ADM/DCP composite scaffolda. Gross observation; b. Field emission scanning electron microscopy obsevation The right image (×200) was the white dotted box enlargement of the left image (×100), the white granules were DCP, and the fibers were porcine dermal fibers; c. X-ray diffraction analysis of ADM/DCP composite scaffolds and DCP; d, e. pH value and calcium ion concentration in the solubility experiment of ADM/DCP composite scaffold; f. Scanning electron microscopy observation of ADM/DCP composite scaffolds mineralized in SBF at different time points (×1 000) The embedded image was a local magnification (×10 k), from left to right for the mineralization at 1, 2, 4, and 8 weeks, respectively
場發射掃描電鏡觀察示ADM/DCP復合支架具有多孔聯通結構,豬真皮纖維上附著DCP顆粒(圖1b)。壓汞儀測得ADM/DCP復合支架的孔隙率為76.32%±1.63%。
X射線衍射分析示,兩個圖譜的衍射峰基本重合,與無水DCP相比,ADM/DCP復合支架的衍射峰未明顯變寬(圖1c)。表明ADM/DCP復合支架中的DCP晶相保持完整,ADM與DCP僅通過物理作用結合。
ADM/DCP復合支架溶解性檢測示,與0 h相比,浸泡72 h內溶液pH值變化均<0.3,滿足標準要求[23];鈣離子濃度在24~72 h內較為穩定,且均低于8.0 μg/g。見圖1d、e。
ADM/DCP復合支架在SBF中浸泡1周,材料表面生成大量細小羥基磷灰石晶核,鋪滿整個表面;2周,礦化形成的羥基磷灰石層與1周時相比存在起伏,部分晶體形成較大顆粒;4周,大量羥基磷灰石晶體形成較大顆粒,逐漸向成熟期轉化;8周,羥基磷灰石層基本成熟,形成球形晶簇并互相融合形成板狀磷灰石覆蓋層。球形晶簇均生長在膠原纖維表面,由于纖維直徑限制和纖維承重限制,球型晶簇直徑最大為200~300 nm。
2.2 兔股骨髁缺損修復實驗
2.2.1 大體觀察
術后6周,實驗動物手術部位均未出現血腫、水腫或囊腔,切口完全愈合,無骨痂、骨贅;左、右兩側均未見植入材料發生位移,有一定程度的骨性愈合。12周,切口完全愈合,無骨痂、骨贅,左、右兩側植入部位已完全愈合。
2.2.2 Micro-CT檢測
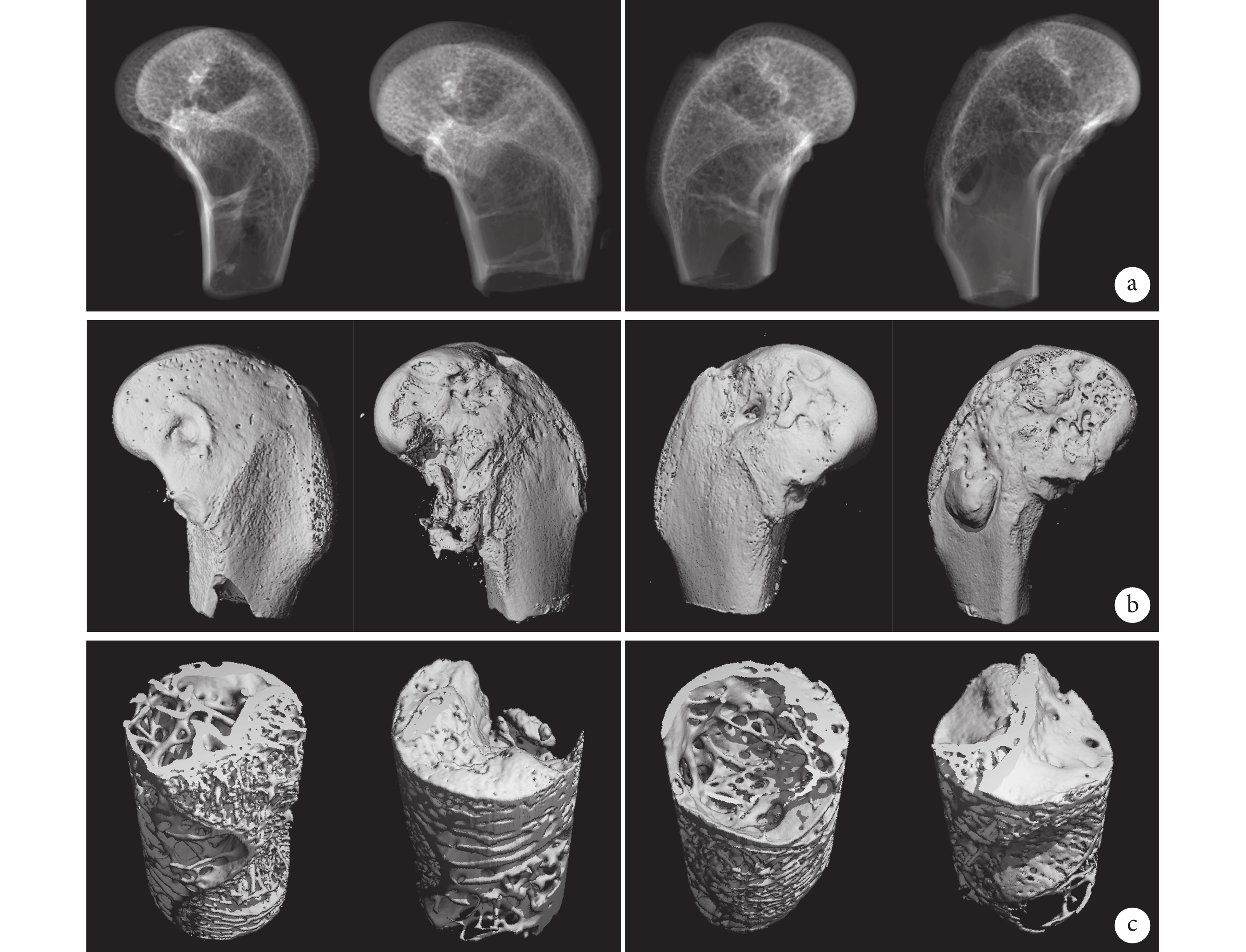
術后12周Micro-CT掃描觀察示,兩組骨缺損部位和宿主骨無明顯邊界,股骨髁表面無明顯缺損邊界,缺損部位生成大量新生骨組織,密度與周圍骨組織無差異,兩組材料成骨性能相當。見圖2。
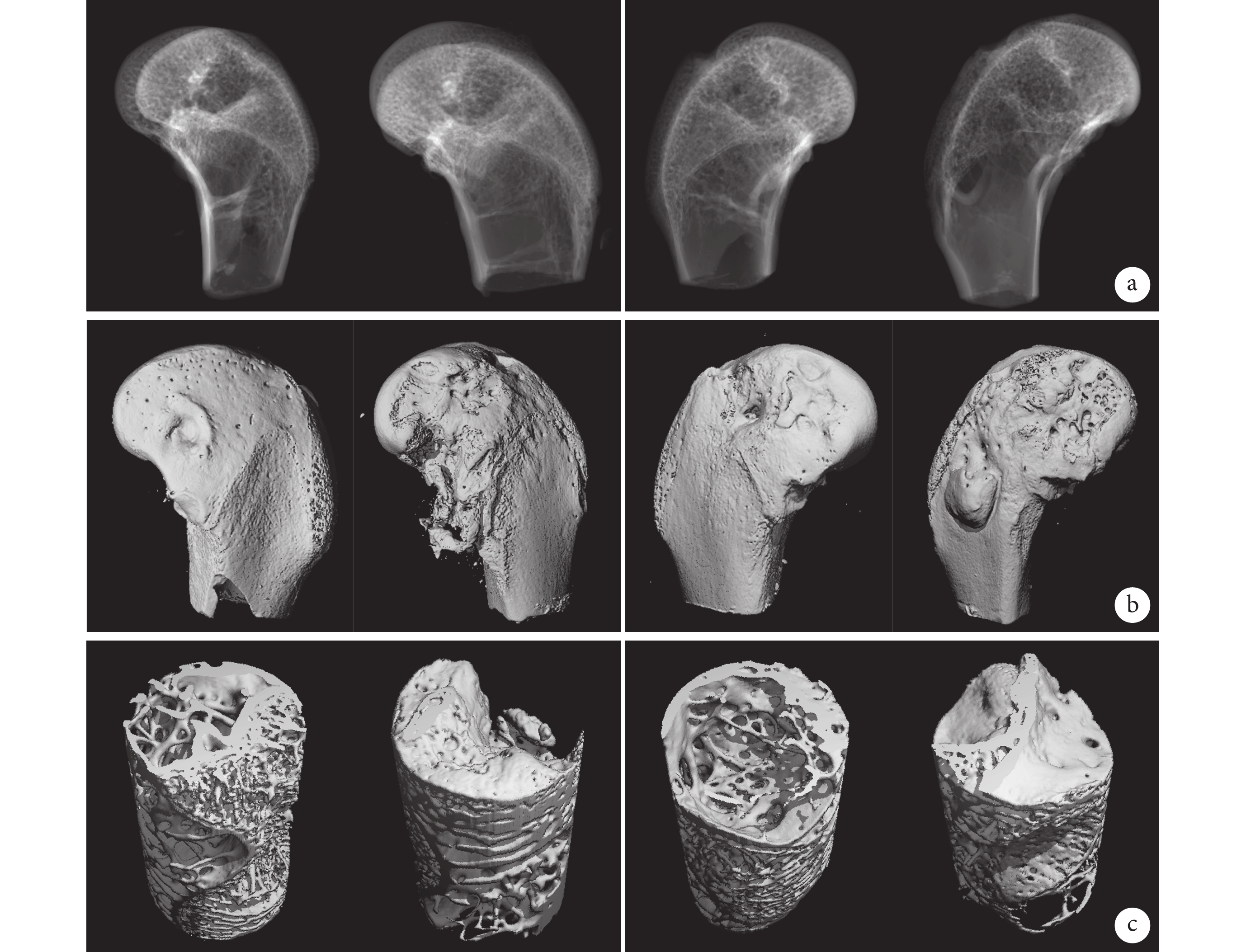 圖2
術后12周實驗組(左)和對照組(右)Micro-CT掃描及三維重建觀察(每組各展示2只動物股骨髁植入部位情況)
圖2
術后12周實驗組(左)和對照組(右)Micro-CT掃描及三維重建觀察(每組各展示2只動物股骨髁植入部位情況)
a. Micro-CT掃描;b. 股骨髁Micro-CT三維重建;c. 缺損部位Micro-CT三維重建
Figure2. Micro-CT scan and three-dimensional reconstruction of the experimental group (left) and control group (right) at 12 weeks after operation (the implanted sites of the femoral condyles of 2 animals in each group)a. Micro-CT scan; b. Micro-CT three-dimensional reconstruction of femoral condyle; c. Micro-CT three-dimensional reconstruction of defect site
定量分析示,除實驗組Tb.Sp 顯著大于對照組,差異有統計學意義(P<0.05)外,兩組BV、BV/TV、BS/BV、Tb.Th、Tb.N、BMD比較差異均無統計學意義(P>0.05)。見表2。兩組新骨的BMD均已接近正常骨(871.595 mg HA/cc),說明新骨礦化程度高,具有正常骨的理化特點。
2.2.3 組織學觀察
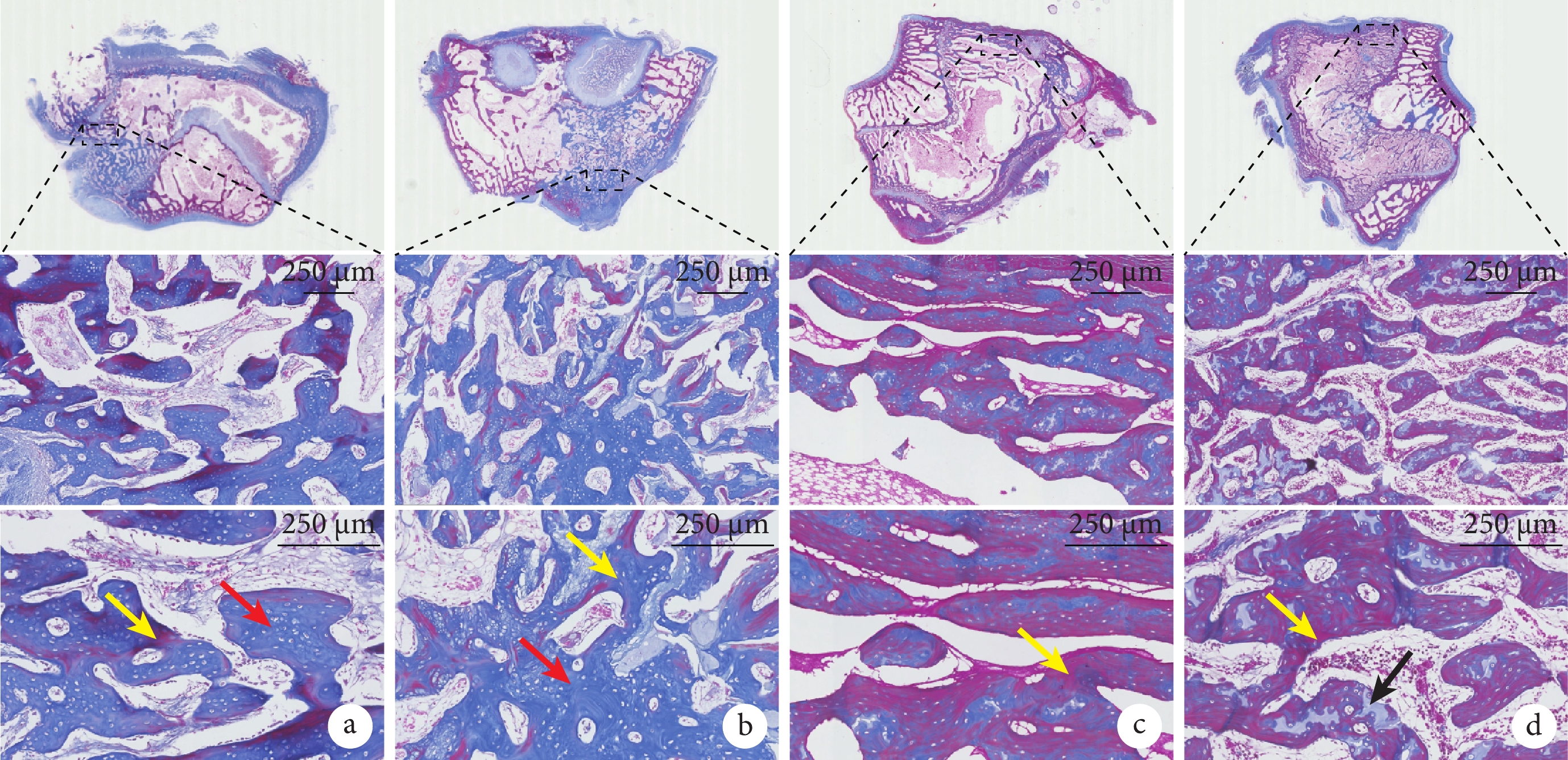
術后6周,HE染色示各組材料均大部分降解,植入部位無組織炎癥反應,缺損處尚未完全愈合,缺損口和骨髓腔內有大量新生骨小梁和血管浸潤;Masson染色示類骨質已開始成熟。術后12周,HE染色示缺損孔均已完全閉合,新生骨和自體骨融合良好;Masson染色呈紅色,顯示兩組骨組織均趨于形成成熟松質骨。見圖3、4。
 圖3
術后兩組HE染色觀察
圖3
術后兩組HE染色觀察
從上至下依次為股骨髁切面以及虛線框局部放大(×20、×40);紅箭頭示血管結構及其內大量血細胞,黑箭頭示骨小梁表面成骨細胞 a. 術后6周實驗組;b. 術后6周對照組;c. 術后12周實驗組;d. 術后12周對照組
Figure3. HE staining observation in both groups after operationFrom top to bottom for the femoral condyle section and the dotted box were enlarged (×20, ×40); the red arrow showed the vascular structure and a large number of blood cells in it, and the black arrow showed the osteoblasts on the surface of bone trabecula a. Experimental group at 6 weeks after operation; b. Control group at 6 weeks after operation; c. Experimental group at 12 weeks after operation; d. Control group at 12 weeks after operation
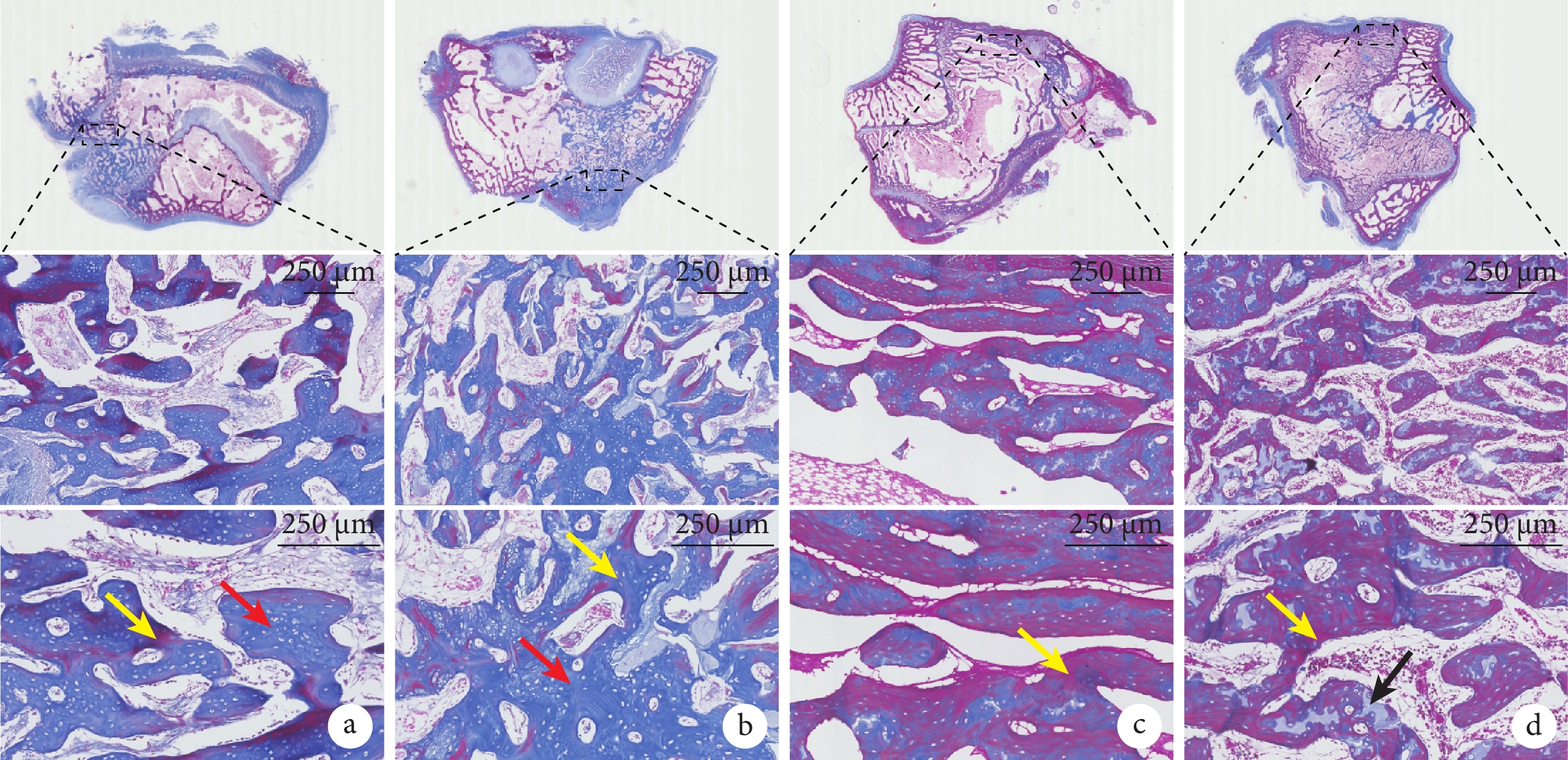 圖4
術后兩組Masson染色觀察
圖4
術后兩組Masson染色觀察
從上至下依次為股骨髁切面以及虛線框局部放大(×20、×40);紅箭頭示尚未成熟的類骨質,黃箭頭示成熟骨基質,黑箭頭示軟骨類骨質 a. 術后6周實驗組;b. 術后6周對照組;c. 術后12周實驗組;d. 術后12周對照組
Figure4. Masson staining observation in both groups after operationFrom top to bottom for the femoral condyle section and the dotted box were enlarged (×20, ×40); the red arrow showed the immature osteoid, the yellow arrow showed the mature bone matrix, and the black arrow showed the cartilage bone a. Experimental group at 6 weeks after operation; b. Control group at 6 weeks after operation; c. Experimental group at 12 weeks after operation; d. Control group at 12 weeks after operation
3 討論
基于天然材料的復合材料開發是骨組織工程支架的重要研究方向。本研究中,采用豬ADM和DCP復合,制備了具有良好生物活性、成骨性能的骨修復材料,并通過動物體內實驗驗證了其在該動物模型上具有與已上市產品相似的修復能力。
目前,ADM已廣泛用于各類組織工程產品的開發,如皮膚修復、軟骨修復和軟組織補片等[26-28]。不同于提純的膠原材料,ADM避免引入毒性試劑和破壞膠原結構成分,且保留了大量細胞外基質中的活性蛋白和因子,是促進細胞生成黏附的關鍵。
多種材料的復合技術也是制備復合支架的難點,常見復合技術大部分是液-液相或固-液相材料復合,天然脫細胞材料為固相,不再進行溶解、提純等后續處理,且不宜引入其他化學合成方法和試劑,而是直接復合兩種固相材料。基于此,我們開發了真皮基質的微纖維化技術,結合前期研究中探索的適宜微纖維化參數,本研究將兩種固相成分物理混合;同時,此技術也成功將致密的真皮基質處理為具有微觀多孔、高孔隙率結構的材料,拓展了真皮基質的應用空間。本研究所制備的ADM/DCP復合支架材料的DNA殘留、脂肪殘留和α-Gal抗原含量低,提示有較高的去核酸、去抗原效率,與對照組骼金?人工骨修復材料相比,可能具有更好的生物相容性。場發射掃描電鏡和X射線衍射表征結果示,所制備的復合支架材料具有良好的均一性和較高孔隙率;溶解性檢測和體外礦化實驗也驗證了DCP與ADM的穩定結合。
我們進一步將所制備的ADM/DCP復合支架植入兔股骨髁缺損處,并與骼金?人工骨修復材料進行比較,通過Micro-CT及組織學檢查等進行評價。結果顯示,植入材料12周后,Micro-CT分析示兩組在成骨方面除Tb.Sp差異有統計學意義外,其他成骨性能無明顯差異。組織學檢測發現植入材料6周后,HE染色示兩組材料均大部分降解,植入部位無組織炎癥反應,缺損處尚未完全愈合,孔口和骨髓腔內有大量新生骨小梁和血管浸潤,Masson染色示類骨質已開始成熟;植入后12周,缺損孔均已完全閉合,新生骨和自體骨融合良好。上述結果表明,ADM/DCP復合支架與骼金?人工骨修復材料修復兔股骨髁缺損具有相似效果,術后12周可實現缺損處完全修復。
綜上述,本研究開發的ADM/DCP組織工程復合支架材料具有良好生物相容性,應用于兔股骨髁缺損模型具有與骼金?人工骨修復材料相似的修復效果,是骨修復領域具有較大應用潛力的新型支架材料。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;基金項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 動物實驗經浙江中醫藥大學動物實驗倫理委員會批準(1ACUC-20180212-02);實驗動物使用許可證號:SYXK(浙)2018-0012
作者貢獻聲明 藍益南:研究設計、文章撰寫;冉永峰:研究實施;張靜逸:數據統計分析;薛德挺:起草文章、對文章的知識性內容作批評性審閱;蔡曉斌:行政支持,數據整理;江濤:經費支持、數據整理;李博:數據收集整理
骨缺損修復一直是骨科面臨挑戰之一,每年有數百萬骨缺損患者需要進行骨移植治療。自體骨移植是骨缺損修復的“金標準”,但自體骨量有限,無法滿足較大缺損部位移植需求[1-3],同種異體骨或異種骨移植存在免疫排斥反應和交叉感染等隱患;而組織工程骨作為骨修復材料,在骨外科手術中具有廣闊應用前景。
膠原基生物材料因具有極優的生物活性、較高強度和可塑性,被廣泛應用于各醫療領域[4]。作為基質材料時,膠原的三維網狀結構易于與其他骨傳導性材料結合,如羥基磷灰石、β-磷酸三鈣和磷酸氫鈣(dicalcium phosphate,DCP)等。膠原占據大多數組織和器官干重的近90%[5],礦化膠原也是骨組織的最主要成分,其由成骨細胞所分泌并礦化,膠原蛋白可結合血凝塊和宿主自身骨細胞,已被證實可以加速骨骼再生[6]。因此,基于天然仿生構建思路,膠原蛋白-生物陶瓷復合物是構建骨修復支架的理想材料。
然而,目前市場上的膠原類產品多使用化學提純制備,如Healos?(Johnson & Johnson公司,美國)、Vitoss?(Stryker公司,美國)等[7],制備工藝中的膠原純化處理會破壞膠原的天然結構和基質中的活性因子,影響產品的組織再生性能。同時,為了提高材料機械性能和減緩材料降解,會對提純膠原材料用醛類交聯劑進行化學交聯處理,造成潛在材料毒性[8-10]。由于提純膠原材料存在的局限性,脫細胞基質相關研究和應用逐漸得到發展。天然材料如脫細胞軟組織或骨組織等具有豐富的膠原蛋白等細胞外基質成分和多種活性因子[8,11],脫細胞處理在結構上保留了細胞外基質的天然三維微觀結構和膠原分子的天然三螺旋結構,在成分上有效利用了脫細胞材料中膠原等生物活性成分,且維持基質的自然交聯,具有良好生物相容性[12]。大量研究和臨床應用使用脫細胞軟組織(如真皮和小腸黏膜下層等)用于腹疝、心肌、腸胃[13-15]、跟腱[16]修復,或脫細胞骨軟骨用于軟骨重建再生[17]等,取得了良好療效。
為了提高膠原基材料的骨再生性能和生物相容性,我們開發了基于天然豬真皮基質的新型骨組織工程支架,對豬真皮進行脫細胞和微纖維化處理后,將其與具有良好生物可吸收性的DCP陶瓷顆粒通過物理方法復合[18],制備具有高孔隙率和孔連通率的多孔支架材料,以探索脫細胞軟組織在骨修復再生中的應用潛力。
1 材料與方法
1.1 實驗動物、材料及主要試劑、儀器
健康成年雄性新西蘭大白兔12只,體質量>2.5 kg,由浙江中醫藥大學動物實驗研究中心提供。豬皮(浙江天天田園控股集團有限公司);無水DCP(湖州展望藥業有限公司);骼金?人工骨修復材料(主要成分為Ⅰ型膠原及羥基磷灰石;北京奧精醫療科技有限公司)。
GM 200刀式研磨儀(Restch公司,德國);FESEM SU-8010場發射掃描電鏡(Hitachi公司,日本);AutoPore Ⅳ 9510壓汞儀 [麥克默瑞提克(上海)儀器有限公司];SmartLab X射線衍射儀(上海力晶科學儀器有限公司)。
1.2 脫細胞真皮基質(acellular dermal matrix,ADM)/DCP復合支架制備及表征
1.2.1 豬ADM和ADM/DCP復合支架制備
取新鮮豬皮去除表皮層和皮下脂肪得到真皮層,將真皮層裁切為寬3~5 mm、長3~5 cm的條狀,用0.2%過氧乙酸-2%碳酸氫鈉溶液浸泡消毒2 h。將消毒并清洗后的豬真皮層置于刀式研磨儀中,高速攪拌研磨處理為微纖維;然后于24 mmol/L脫氧膽酸鈉-0.2%EDTA溶液中振搖24 h后,生理鹽水清洗15次,離心除去多余液體,得到豬ADM。
對豬ADM進行水分測定并計算其干重,稱取其2倍干重的無水DCP混合放入燒杯中,加入與ADM和DCP總質量等重的生理鹽水,攪拌均勻后倒入刀式研磨儀高速攪拌混合;然后將材料倒入模具中,凍干,密封包裝,經20 kGy 60Co輻照滅菌后,得到ADM/DCP復合支架,備用。
1.2.2 支架脫細胞效果檢測
對ADM/DCP復合支架行大體觀察;并進行DNA殘留、脂肪含量及α-半乳糖基抗原(α-1,3-galactosyle,α-Gal)抗原表位數檢測[19-22],定量分析ADM/DCP復合支架的脫細胞效果,以豬ADM作為對照。
1.2.3 支架微觀結構表征
將ADM/DCP復合支架樣品噴金后,使用場發射掃描電鏡對產品表面形貌進行表征;使用壓汞儀測定支架孔隙率(n=6),真空6.65 kPa,平衡5 min,計算范圍為0.1~30.0 psia。
1.2.4 支架的X射線衍射分析
將ADM/DCP復合支架裁切為10 mm×10 mm×2 mm的薄片,同時稱取無水DCP 0.5 g,分別使用X射線衍射儀進行表征分析,對比圖譜分析晶型是否發生變化。
1.2.5 支架溶解性檢測
按照標準方法檢測ADM/DCP復合支架溶解性[23]。裁切并稱取80 mg材料,置于離心管中,按照2.0 mg/mL比例加入Tris緩沖溶液(pH=7.3±0.1),(37±1)℃、200 r/min條件下振蕩浸泡,于0、24、48、72 h后分別取樣測量溶液pH值(n=9,以與0 h pH值的差值計算)和鈣離子含量(n=3)。
1.2.6 支架的體外礦化實驗
按照Kokubo等[24]報道的方法配制模擬體液(simulated body fluid,SBF)。無菌操作下將ADM/DCP復合支架裁切為10 mm×10 mm×2 mm的薄片,游標卡尺測量其尺寸(精確至±0.1 mm),并計算表面積。按以下公式計算所用SBF體積:SBF體積=100 mm×樣品表面積。
于離心管中加入相應體積SBF并放置于36.5℃ CO2培養箱中預熱,然后將樣品浸沒于SBF中,每天更換SBF。分別于浸泡1、2、4、8周時取樣,用純化水輕柔清洗5 min后常溫干燥。使用掃描電鏡進行表面礦化物檢測,確定磷灰石層存在與否。
1.3 兔股骨髁缺損修復實驗
1.3.1 實驗分組及方法
材料準備:將ADM/DCP復合支架用環鉆鉆取為直徑6 mm、高8 mm的圓柱體,將骼金?人工骨修復材料鉆取為直徑6 mm、高4 mm的圓柱體,備用。取12只健康新西蘭大白兔,采用耳緣靜脈注射陸眠寧、舒泰溶液進行麻醉;于兔雙側髂骨處備皮、穿刺抽取紅骨髓1 mL于采血管中備用。于兔雙側股骨外側髁各鉆取一直徑6 mm、深8 mm的腔洞,將兩組材料分別混合吸收自體紅骨髓后,左側股骨髁植入1個ADM/DCP復合支架圓柱體(實驗組),右側植入2個骼金?人工骨修復材料圓柱體(對照組);逐層縫合筋膜和皮膚,術后3 d連續皮下注射青霉素40萬U/d。
1.3.2 兔股骨髁缺損修復評價指標
術后6、12周分別處死6只動物,取股骨髁修復組織標本進行評價。① 大體觀察:觀察缺損部位及周邊骨是否存在骨痂、骨贅,以及與正常組織的整合情況。② Micro-CT檢測:將術后12周組織標本置于中性甲醛固定48 h,行Micro-CT掃描并定量分析植入區域的骨體積(bone volume,BV)、骨體積分數(bone volume/tissue volume,BV/TV)、骨表面積和骨體積之比(bone surface/bone volume,BS/BV)、骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁數目(trabecular number,Tb.N)、骨小梁間隙(trabecular separation,Tb.Sp)、骨密度(bone mineral density,BMD)。③ 組織學觀察:將術后6、12周組織標本置于中性甲醛固定48 h,經常規脫鈣、梯度脫水、石蠟包埋,5 μm厚切片,行HE染色和Masson染色,觀察骨缺損修復及骨基質成熟情況。
1.4 統計學方法
采用SPSS23.0統計軟件進行分析。計量資料經Shapiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,組間比較采用獨立樣本t檢驗;檢驗水準α=0.05。
2 結果
2.1 ADM/DCP復合支架表征
大體觀察示所制備的ADM/DCP復合支架為白色海綿狀固體(圖1a);與豬ADM比較,ADM/DCP復合支架的DNA殘留、脂肪含量和α-Gal抗原含量均大幅降低,差異有統計學意義(P<0.05),說明脫細胞處理具有較高的去核酸、去抗原效率;且ADM/DCP復合支架的DNA殘留量滿足DNA殘留安全限度(50 ng/mg)[25]。見表1。
 圖1
ADM/DCP復合支架表征
圖1
ADM/DCP復合支架表征
a. 大體觀察;b. 場發射掃描電鏡觀察 右圖(×200)為左圖(×100)白色虛線框放大圖,白色顆粒為DCP,纖維為豬真皮纖維;c. ADM/DCP復合支架和無水DCP的X射線衍射分析圖譜;d、e. ADM/DCP復合支架溶解性實驗pH值和鈣離子濃度;f. ADM/DCP復合支架在SBF中礦化不同時間點掃描電鏡觀察(×1 000) 內嵌圖為局部放大(×10 k),從左至右依次為礦化1、2、4、8周
Figure1. Characterization of the ADM/DCP composite scaffolda. Gross observation; b. Field emission scanning electron microscopy obsevation The right image (×200) was the white dotted box enlargement of the left image (×100), the white granules were DCP, and the fibers were porcine dermal fibers; c. X-ray diffraction analysis of ADM/DCP composite scaffolds and DCP; d, e. pH value and calcium ion concentration in the solubility experiment of ADM/DCP composite scaffold; f. Scanning electron microscopy observation of ADM/DCP composite scaffolds mineralized in SBF at different time points (×1 000) The embedded image was a local magnification (×10 k), from left to right for the mineralization at 1, 2, 4, and 8 weeks, respectively
場發射掃描電鏡觀察示ADM/DCP復合支架具有多孔聯通結構,豬真皮纖維上附著DCP顆粒(圖1b)。壓汞儀測得ADM/DCP復合支架的孔隙率為76.32%±1.63%。
X射線衍射分析示,兩個圖譜的衍射峰基本重合,與無水DCP相比,ADM/DCP復合支架的衍射峰未明顯變寬(圖1c)。表明ADM/DCP復合支架中的DCP晶相保持完整,ADM與DCP僅通過物理作用結合。
ADM/DCP復合支架溶解性檢測示,與0 h相比,浸泡72 h內溶液pH值變化均<0.3,滿足標準要求[23];鈣離子濃度在24~72 h內較為穩定,且均低于8.0 μg/g。見圖1d、e。
ADM/DCP復合支架在SBF中浸泡1周,材料表面生成大量細小羥基磷灰石晶核,鋪滿整個表面;2周,礦化形成的羥基磷灰石層與1周時相比存在起伏,部分晶體形成較大顆粒;4周,大量羥基磷灰石晶體形成較大顆粒,逐漸向成熟期轉化;8周,羥基磷灰石層基本成熟,形成球形晶簇并互相融合形成板狀磷灰石覆蓋層。球形晶簇均生長在膠原纖維表面,由于纖維直徑限制和纖維承重限制,球型晶簇直徑最大為200~300 nm。
2.2 兔股骨髁缺損修復實驗
2.2.1 大體觀察
術后6周,實驗動物手術部位均未出現血腫、水腫或囊腔,切口完全愈合,無骨痂、骨贅;左、右兩側均未見植入材料發生位移,有一定程度的骨性愈合。12周,切口完全愈合,無骨痂、骨贅,左、右兩側植入部位已完全愈合。
2.2.2 Micro-CT檢測
術后12周Micro-CT掃描觀察示,兩組骨缺損部位和宿主骨無明顯邊界,股骨髁表面無明顯缺損邊界,缺損部位生成大量新生骨組織,密度與周圍骨組織無差異,兩組材料成骨性能相當。見圖2。
 圖2
術后12周實驗組(左)和對照組(右)Micro-CT掃描及三維重建觀察(每組各展示2只動物股骨髁植入部位情況)
圖2
術后12周實驗組(左)和對照組(右)Micro-CT掃描及三維重建觀察(每組各展示2只動物股骨髁植入部位情況)
a. Micro-CT掃描;b. 股骨髁Micro-CT三維重建;c. 缺損部位Micro-CT三維重建
Figure2. Micro-CT scan and three-dimensional reconstruction of the experimental group (left) and control group (right) at 12 weeks after operation (the implanted sites of the femoral condyles of 2 animals in each group)a. Micro-CT scan; b. Micro-CT three-dimensional reconstruction of femoral condyle; c. Micro-CT three-dimensional reconstruction of defect site
定量分析示,除實驗組Tb.Sp 顯著大于對照組,差異有統計學意義(P<0.05)外,兩組BV、BV/TV、BS/BV、Tb.Th、Tb.N、BMD比較差異均無統計學意義(P>0.05)。見表2。兩組新骨的BMD均已接近正常骨(871.595 mg HA/cc),說明新骨礦化程度高,具有正常骨的理化特點。
2.2.3 組織學觀察
術后6周,HE染色示各組材料均大部分降解,植入部位無組織炎癥反應,缺損處尚未完全愈合,缺損口和骨髓腔內有大量新生骨小梁和血管浸潤;Masson染色示類骨質已開始成熟。術后12周,HE染色示缺損孔均已完全閉合,新生骨和自體骨融合良好;Masson染色呈紅色,顯示兩組骨組織均趨于形成成熟松質骨。見圖3、4。
 圖3
術后兩組HE染色觀察
圖3
術后兩組HE染色觀察
從上至下依次為股骨髁切面以及虛線框局部放大(×20、×40);紅箭頭示血管結構及其內大量血細胞,黑箭頭示骨小梁表面成骨細胞 a. 術后6周實驗組;b. 術后6周對照組;c. 術后12周實驗組;d. 術后12周對照組
Figure3. HE staining observation in both groups after operationFrom top to bottom for the femoral condyle section and the dotted box were enlarged (×20, ×40); the red arrow showed the vascular structure and a large number of blood cells in it, and the black arrow showed the osteoblasts on the surface of bone trabecula a. Experimental group at 6 weeks after operation; b. Control group at 6 weeks after operation; c. Experimental group at 12 weeks after operation; d. Control group at 12 weeks after operation
 圖4
術后兩組Masson染色觀察
圖4
術后兩組Masson染色觀察
從上至下依次為股骨髁切面以及虛線框局部放大(×20、×40);紅箭頭示尚未成熟的類骨質,黃箭頭示成熟骨基質,黑箭頭示軟骨類骨質 a. 術后6周實驗組;b. 術后6周對照組;c. 術后12周實驗組;d. 術后12周對照組
Figure4. Masson staining observation in both groups after operationFrom top to bottom for the femoral condyle section and the dotted box were enlarged (×20, ×40); the red arrow showed the immature osteoid, the yellow arrow showed the mature bone matrix, and the black arrow showed the cartilage bone a. Experimental group at 6 weeks after operation; b. Control group at 6 weeks after operation; c. Experimental group at 12 weeks after operation; d. Control group at 12 weeks after operation
3 討論
基于天然材料的復合材料開發是骨組織工程支架的重要研究方向。本研究中,采用豬ADM和DCP復合,制備了具有良好生物活性、成骨性能的骨修復材料,并通過動物體內實驗驗證了其在該動物模型上具有與已上市產品相似的修復能力。
目前,ADM已廣泛用于各類組織工程產品的開發,如皮膚修復、軟骨修復和軟組織補片等[26-28]。不同于提純的膠原材料,ADM避免引入毒性試劑和破壞膠原結構成分,且保留了大量細胞外基質中的活性蛋白和因子,是促進細胞生成黏附的關鍵。
多種材料的復合技術也是制備復合支架的難點,常見復合技術大部分是液-液相或固-液相材料復合,天然脫細胞材料為固相,不再進行溶解、提純等后續處理,且不宜引入其他化學合成方法和試劑,而是直接復合兩種固相材料。基于此,我們開發了真皮基質的微纖維化技術,結合前期研究中探索的適宜微纖維化參數,本研究將兩種固相成分物理混合;同時,此技術也成功將致密的真皮基質處理為具有微觀多孔、高孔隙率結構的材料,拓展了真皮基質的應用空間。本研究所制備的ADM/DCP復合支架材料的DNA殘留、脂肪殘留和α-Gal抗原含量低,提示有較高的去核酸、去抗原效率,與對照組骼金?人工骨修復材料相比,可能具有更好的生物相容性。場發射掃描電鏡和X射線衍射表征結果示,所制備的復合支架材料具有良好的均一性和較高孔隙率;溶解性檢測和體外礦化實驗也驗證了DCP與ADM的穩定結合。
我們進一步將所制備的ADM/DCP復合支架植入兔股骨髁缺損處,并與骼金?人工骨修復材料進行比較,通過Micro-CT及組織學檢查等進行評價。結果顯示,植入材料12周后,Micro-CT分析示兩組在成骨方面除Tb.Sp差異有統計學意義外,其他成骨性能無明顯差異。組織學檢測發現植入材料6周后,HE染色示兩組材料均大部分降解,植入部位無組織炎癥反應,缺損處尚未完全愈合,孔口和骨髓腔內有大量新生骨小梁和血管浸潤,Masson染色示類骨質已開始成熟;植入后12周,缺損孔均已完全閉合,新生骨和自體骨融合良好。上述結果表明,ADM/DCP復合支架與骼金?人工骨修復材料修復兔股骨髁缺損具有相似效果,術后12周可實現缺損處完全修復。
綜上述,本研究開發的ADM/DCP組織工程復合支架材料具有良好生物相容性,應用于兔股骨髁缺損模型具有與骼金?人工骨修復材料相似的修復效果,是骨修復領域具有較大應用潛力的新型支架材料。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;基金項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 動物實驗經浙江中醫藥大學動物實驗倫理委員會批準(1ACUC-20180212-02);實驗動物使用許可證號:SYXK(浙)2018-0012
作者貢獻聲明 藍益南:研究設計、文章撰寫;冉永峰:研究實施;張靜逸:數據統計分析;薛德挺:起草文章、對文章的知識性內容作批評性審閱;蔡曉斌:行政支持,數據整理;江濤:經費支持、數據整理;李博:數據收集整理