引用本文: 田文晗, 何觀平, 劉玉增, 管娟. 適配骨組織工程的蠶絲增強聚己內酯復合材料理化及生物特征研究. 中國修復重建外科雜志, 2024, 38(9): 1123-1129. doi: 10.7507/1002-1892.202404120 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
骨腫瘤、骨修復、脊柱融合以及創傷性骨折等原因,每年導致數百萬患者需進行骨移植和修復手術。在臨床手術尤其是脊柱融合手術中,所使用的材料仍然存在一些問題,如高模量引起的應力屏蔽和骨質疏松,以及不可降解引發的長期慢性炎癥和異物反應等[1]。理想的骨移植替代材料應具備以下基本特性:① 與骨主體或松質骨相近的模量,以避免應力屏蔽;② 與皮質骨相近的壓縮強度,以實現結構承載功能;③ 降解速率與組織生長速率相匹配[2-3]。盡管已有大量研究結合多種物理化學手段構建了不同的可降解人工骨材料[4-5],但因為材料特性如模量和強度與降解速率之間存在制約關系,同時具備上述特性的理想材料仍然稀缺。
自然界利用多材料復合和多層級結構設計策略,將膠原蛋白、殼聚糖與磷酸鈣、碳酸鈣等單相本體力學性能較弱的材料,構筑成堅韌耐用的骨骼和貝殼等高性能天然復合材料[6-7]。然而,人們通過結構仿生來重現天然模型體中近乎完美的多層級結構(特別是在微納尺度上),進而獲得具有相似性能和功能的人造材料仍面臨挑戰。
僅由蛋白質組成的蠶絲是唯一一種具有宏觀連續性和高度有序性的多尺度結構天然動物纖維。蠶絲作為重要的生物醫用材料具備良好的生物相容性、可降解性和出色的綜合力學性能[8-9]。在化學纖維發明之前,天然蠶絲享有“紡織皇后”的美譽;近幾百年,蠶絲也被用作臨床縫合線等醫學領域[10-11]。近三十年,研究人員開發了大量新型蠶絲基生物材料,主要集中在再生絲蛋白及其衍生材料[12-13]。但是,再生絲蛋白的提取過程破壞了天然蠶絲的多級有序結構,只保留了其蛋白質的氨基酸序列結構[14],未能繼承天然蠶絲的優異力學性能。最新研究表明[15],天然蠶絲與再生絲蛋白復合,可以形成力學性能優越的可降解骨科植入材料,體現了蠶絲對復合材料基體的強韌化效果。但是,再生絲蛋白的加工性能不佳,導致復合界面性能不足,在體內應用時出現了界面破壞、分層的現象。因此,在設計蠶絲增強復合材料時,應當在滿足骨組織工程力學和生物學需求的同時,選擇具有優異加工性能的高分子基體材料。
本研究選取具有優異加工性能的聚己內酯(polycaprolactone,PCL)作為基體,與天然蠶絲纖維織物復合,模仿天然骨組織中微米尺度上骨小梁增強骨基質的結構,設計了一種骨組織工程用蠶絲增強PCL復合材料(silk reinforced PCL composite,SPC),通過層層組裝和熱壓技術,制備了不同蠶絲含量的SPC。本研究在材料表征的基礎上,通過體外和體內生物學實驗評價SPC的生物相容性和降解特性,為其進一步動物實驗及臨床應用提供實驗依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
10周齡SPF級雄性SD大鼠6只,體質量250~300 g,由成都藥康生物科技有限公司提供。
PCL(上海麥克林生化科技股份有限公司);脫膠平紋絲綢織物 [瑞蚨祥(北京)投資管理有限公司];小鼠胚胎成骨細胞前體細胞(MC3T3-E1)[賽百慷(上海)生物技術股份有限公司];DMEM 培養基(Corning公司,美國);細胞計數試劑盒8(cell counting kit 8,CCK-8;同仁公司,日本)。JSM-
1.2 SPC的制備
1.2.1 蠶絲-PCL預浸料制備
先將脫膠平紋絲綢織物在去離子水中進行超聲波清洗30 min,再于高溫滅菌室中滅菌處理2 h;然后將PCL顆粒制成薄膜,與已滅菌的單層脫膠平紋絲綢織物在500 kPa和120℃條件下熱壓10 min,并自然冷卻至室溫,得到單層蠶絲-PCL復合材料,稱為蠶絲-PCL預浸料。
1.2.2 不同蠶絲含量的SPC制備
首先,在模具表面均勻噴灑脫模劑,等待30 min后繼續噴灑,重復3次。接著,將蠶絲-PCL預浸料按預設層數層層組裝于模具中,蠶絲的纖維體積分數分別為20%、40%和60%。在500 kPa和120℃條件下熱壓20 min,再自然冷卻至環境溫度并進行脫模,得到的材料分別標記為20%-SPC、40%-SPC和60%-SPC,通過機械切割制成不同尺寸的待測試樣。
1.3 SPC的表征
1.3.1 大體形態及微觀結構
觀察蠶絲-PCL預浸料及SPC的大體形態。取3種SPC樣本,真空干燥48 h后,表面噴金,掃描電鏡觀察材料內部微觀結構。
1.3.2 力學性能檢測
在Instron 8801力學試驗機上測試3種SPC樣本的壓縮性能,包括壓縮模量和壓縮強度(最大壓縮應力)。壓縮試樣長12 mm、寬5 mm、厚5 mm,應變速率為2 mm/s,使用橫梁位移,壓縮彈性模量取0.5%和3.0%應變之間的線性擬合斜率。每個樣本重復3~5個試樣。
1.3.3 體外降解測試
取3種SPC樣本置于37℃模擬體液(PBS緩沖液)中,于3、30、90、180 d分別取出試樣(n=4),同1.3.2方法測試壓縮強度(離開模擬體液5 min內完成測試)。180 d后取出樣本,用去離子水充分沖洗后干燥,稱重并記錄降解后質量。
1.3.4 表面潤濕性檢測
在OCA-20接觸角測量儀上,使用去離子水在25℃條件下對3種SPC樣本表面進行靜態水接觸角測量,以單純PCL材料作為對照,記錄5次取均值。
1.3.5 細胞增殖實驗
取PCL、20%-SPC、40%-SPC樣本經紫外線滅菌處理后,在材料表面按1×104個/孔濃度添加20 μL MC3T3-E1細胞懸浮液,轉移至96孔板;溫育2 h后,細胞穩定并黏附于材料;隨后按1×104個/100 μL濃度加入MC3T3-E1細胞懸浮液繼續培養,每隔1 d更換1次培養基。于培養1、3、5 d后,取浸提液10 μL加入CCK-8試劑盒,孵育2 h后使用酶標儀測定各組在450 nm波長下的吸光度(A)值。
1.3.6 大鼠皮下植入實驗
將SPC切割成2 mm3大小立方體,PCL為直徑2 mm的球形顆粒,均經60Co輻照滅菌備用。取6只SD大鼠背部消毒后,用手術刀切開表皮,將PCL和20%-SPC兩種試樣左右對稱植入每只大鼠背部皮下,縫合表皮。植入后30 d和180 d分別實施安樂死處死3只大鼠,于背部植入區域取材,行組織切片及Masson染色。基于染色圖像中膠原纖維的分布確定材料與組織界面,定量分析30 d和180 d材料體內降解率;以單位面積內皮細胞成環數量作為新生組織中血管數量。
1.4 統計學方法
采用SPSS27.0統計軟件進行分析。計量資料經Sharpiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,多組間比較采用單因素方差分析,兩兩比較采用SNK檢驗;兩組間比較采用獨立樣本t檢驗。檢驗水準α=0.05。
2 結果
2.1 SPC的大體形態和微觀結構
單層蠶絲-PCL預浸料厚度約0.2 mm。預浸料疊層組裝熱壓后制得的SPC塊體為硬質堅韌材料,厚度可達幾厘米;通過機械切削加工,這些塊體材料可以制成形狀不規則、尺寸較大的植入材料。見圖1。
 圖1
SPC材料大體觀察
圖1
SPC材料大體觀察
a. 蠶絲-PCL預浸料;b. SPC塊體
Figure1. Macroscopic images of SPC materialsa. Silk-PCL prepreg; b. SPC bulk specimen
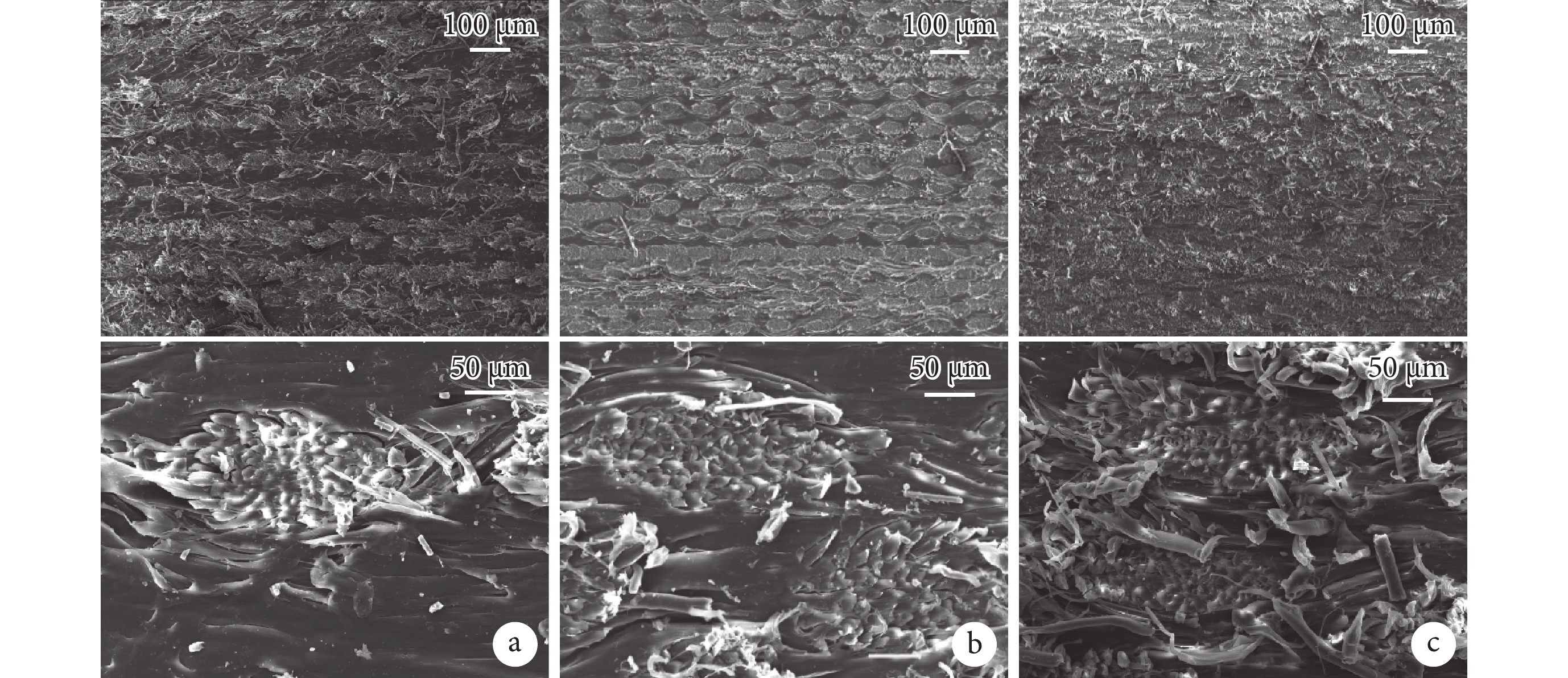
掃描電鏡觀察示,3種SPC斷面的孔隙缺陷均較少。隨著蠶絲含量從20%增至60%,PCL含量越來越少,蠶絲織物層間距變小,紗線排布越來越密集,纖維幾乎布滿整個斷面;60%-SPC中出現了紗線中心浸漬不良的現象。見圖2。
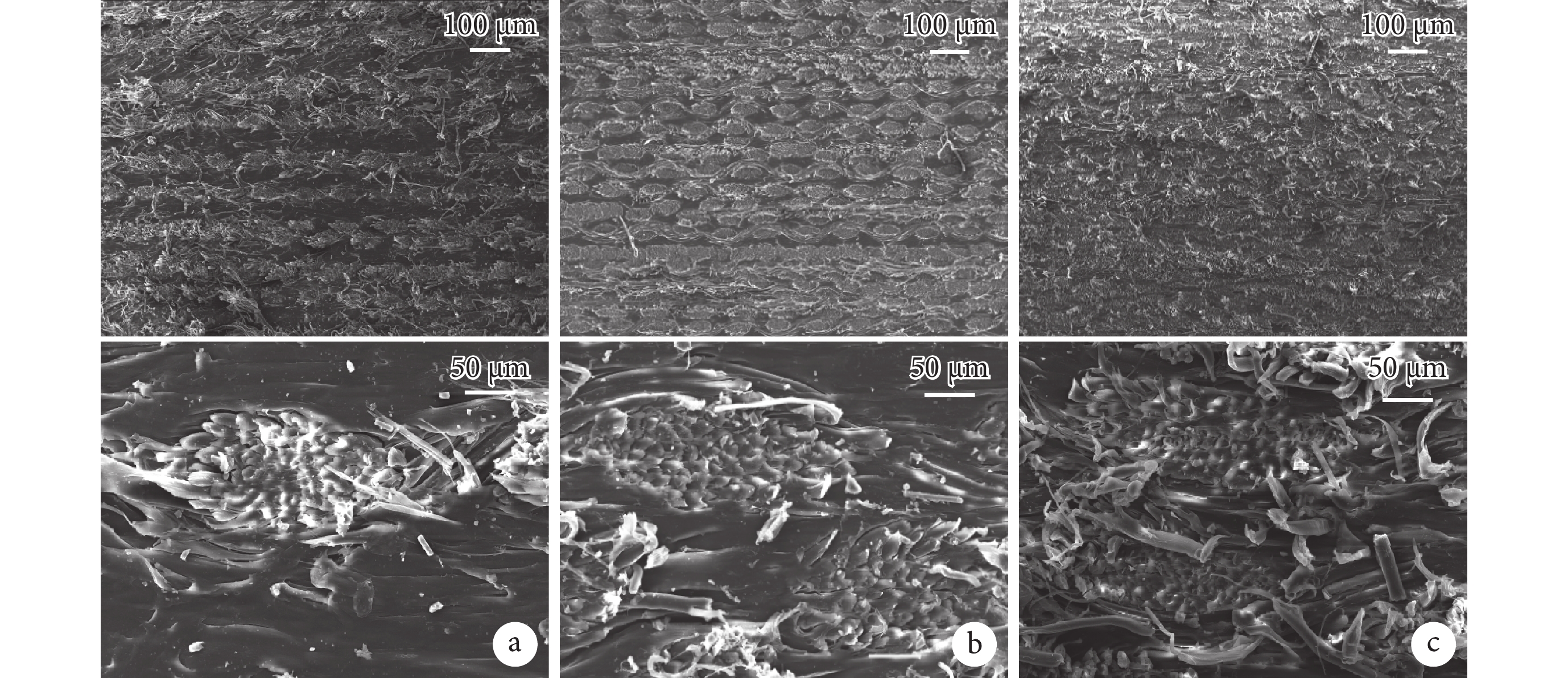 圖2
SPC掃描電鏡觀察
圖2
SPC掃描電鏡觀察
a. 20%-SPC;b. 40%-SPC;c. 60%-SPC
Figure2. Scanning electron microscope observation of SPCa. 20%-SPC; b. 40%-SPC; c. 60%-SPC
2.2 SPC的力學性能
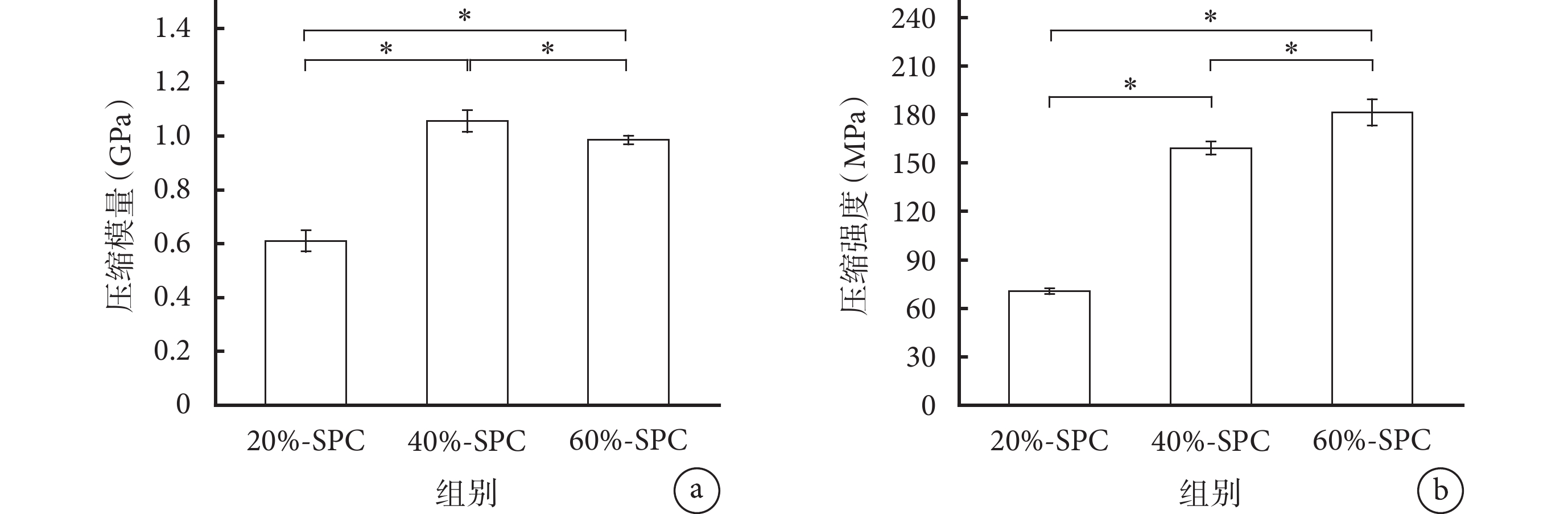
隨著蠶絲含量從20%增至60%,SPC的壓縮強度顯著增加,但壓縮模量增加較少,60%-SPC的壓縮模量較40%-SPC下降。各材料壓縮強度和壓縮模量兩兩比較差異均有統計學意義(P<0.05)。見圖3。
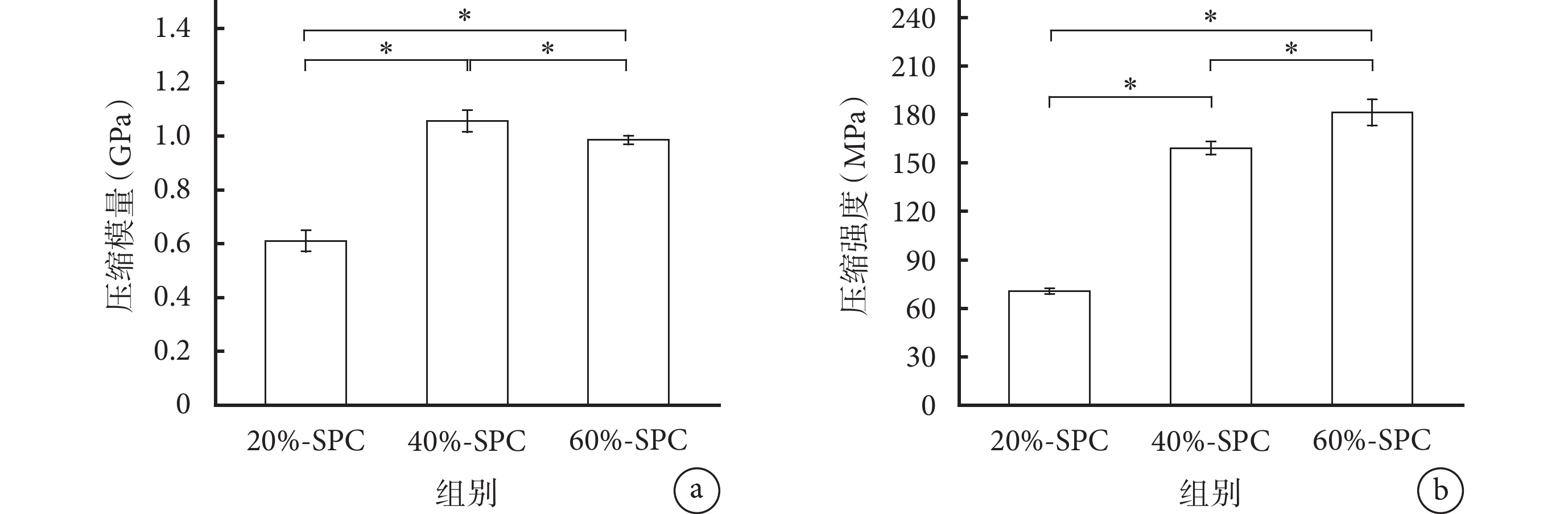 圖3
SPC的壓縮力學性能
圖3
SPC的壓縮力學性能
*
*
2.3 SPC的體外降解分析
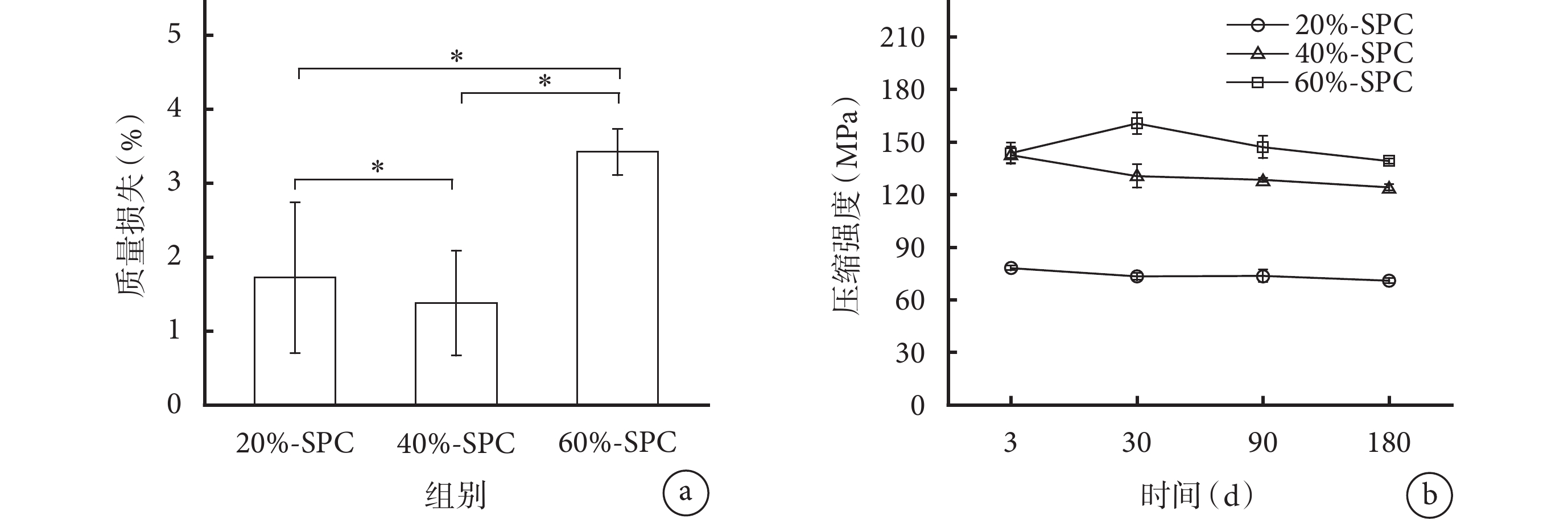
3種SPC在模擬體液中降解180 d的質量損失均在5%以內,60%-SPC的質量損失最大,顯著高于另外兩組。各材料間質量損失比較差異均有統計學意義(P<0.05)。見圖4a。
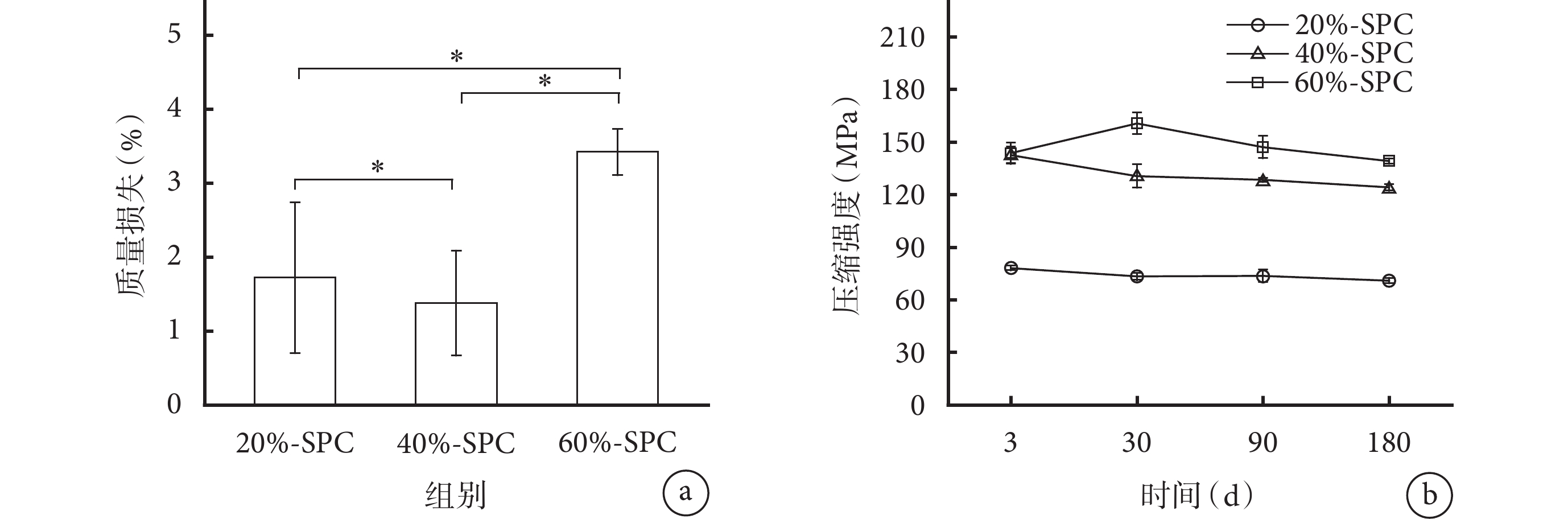 圖4
SPC的體外降解性能
圖4
SPC的體外降解性能
a. 降解180 d的質量損失 *
a. The mass loss after 180 days of degradation *
降解力學測試示,3 d后3種SPC由干態轉變為濕態,其壓縮強度較干態時顯著下降;但在隨后180 d中,各時間點3種SPC的壓縮強度下降均較少。除3 d時40%-SPC和60%-SPC壓縮強度差異無統計學意義(P>0.05)外,其余時間點各材料間壓縮強度差異均有統計學意義(P<0.05)。見圖4b。
2.4 SPC的表面潤濕性
單純PCL表面呈現疏水性,靜態水接觸角較大;隨著蠶絲含量增加至60%,靜態水接觸角顯著減小,水滴在SPC表面幾乎完全鋪展。除40%-SPC和60%-SPC間靜態水接觸角差異無統計學意義(P>0.05)外,其余組間差異均有統計學意義(P<0.05)。見圖5。
 圖5
SPC的表面潤濕性檢測
圖5
SPC的表面潤濕性檢測
a. 平衡水滴形態;b. 靜態水接觸角 *
a. Equilibrium water droplet morphology; b. Static water contact angles *
2.5 SPC的成骨細胞相容性
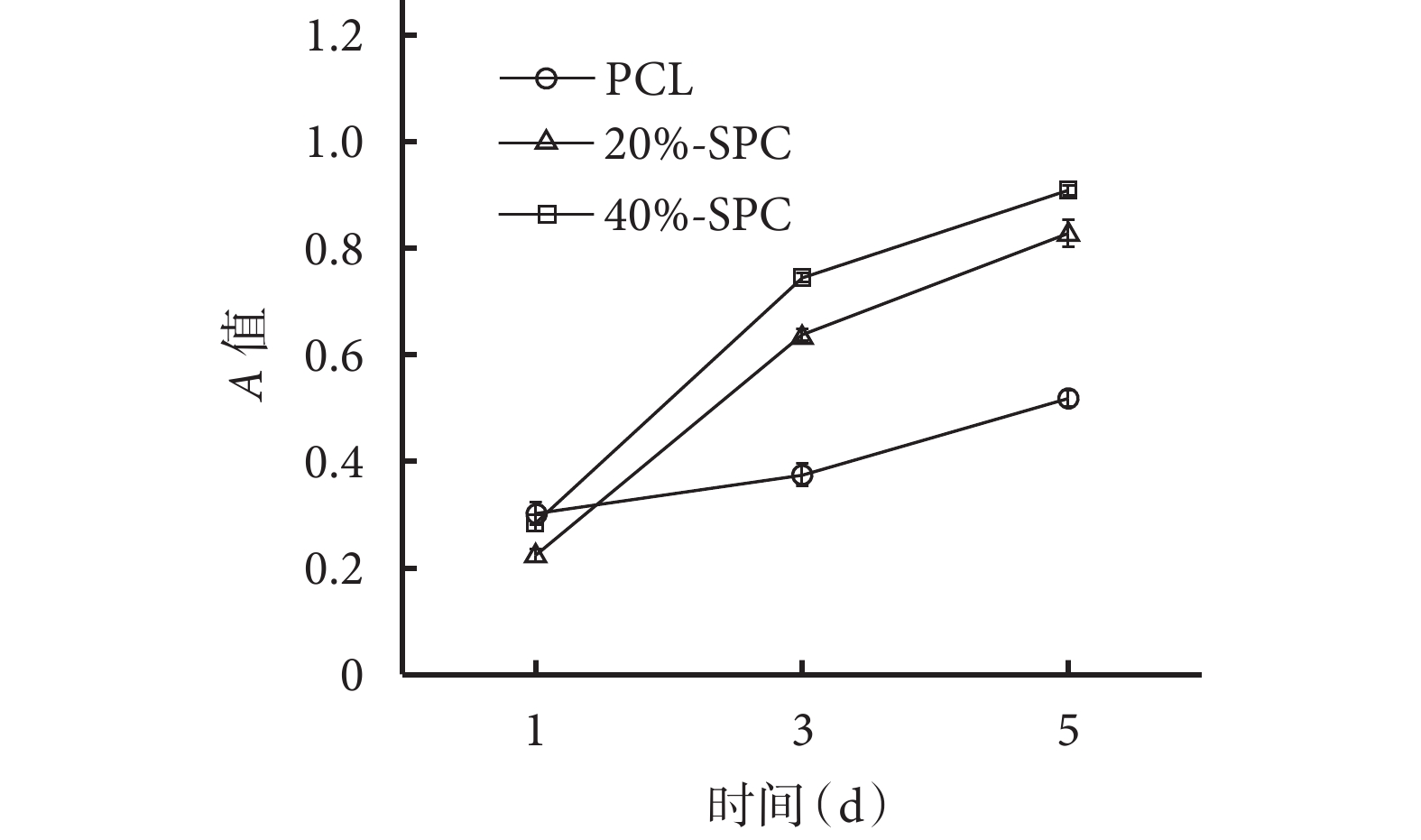
隨培養時間延長,各材料組A值均逐漸增加。1 d時20%-SPC組A值低于PCL組和40%-SPC組,差異有統計學意義(P<0.05);3、5 d時,20%-SPC組和40%-SPC組A值均高于PCL組,40%-SPC組高于20%-SPC組,差異均有統計學意義(P<0.05)。見圖6。
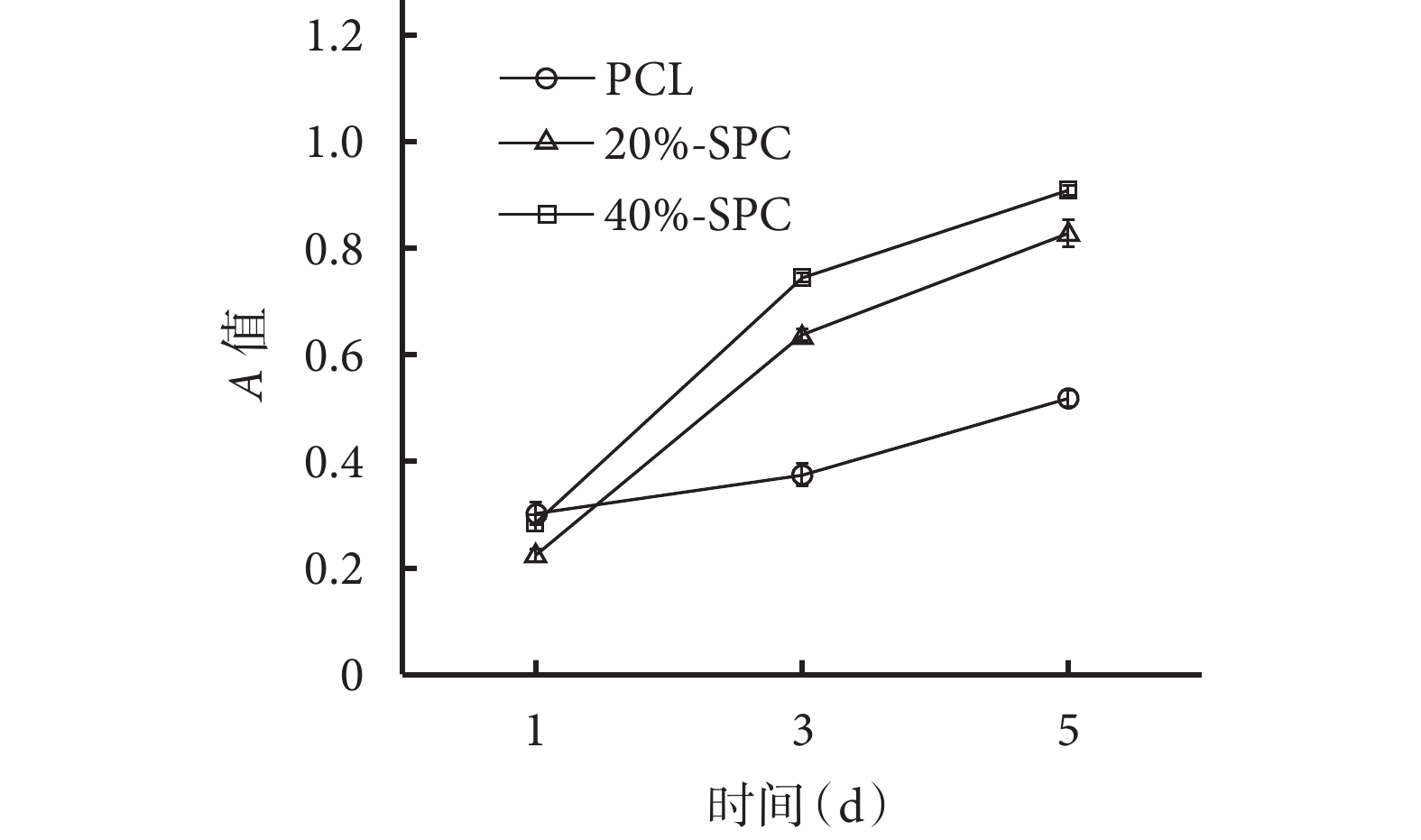 圖6
CCK-8檢測各材料細胞增殖
Figure6.
Cell proliferation of materials detected by CCK-8 assay
圖6
CCK-8檢測各材料細胞增殖
Figure6.
Cell proliferation of materials detected by CCK-8 assay
2.6 SPC的體內降解特征
大鼠皮下植入30 d,兩組均無明顯血管生成,PCL組材料無降解跡象,而在材料周圍形成了薄層纖維囊;20%-SPC組材料與周圍組織界面開始變得模糊,初步出現材料降解、組織向內生長跡象。180 d,PCL組材料仍未見明顯降解,纖維囊增厚,且周圍缺乏血管組織;20%-SPC組材料降解十分顯著,原位新生組織逐漸替代了最初的PCL,剩余未降解的大量蠶絲被新生組織包裹,與組織融合良好,并促進生成了大量血管,部分血管已進入材料內部。定量分析示,20%-SPC組植入30 d和180 d后體內降解率分別為5.33%±3.33%和61.11%±20.12%。20%-SPC組180 d的血管數量顯著高于PCL組,差異有統計學意義(t=10.300,P<0.001)。見圖7。
 圖7
大鼠皮下植入材料Masson染色觀察
圖7
大鼠皮下植入材料Masson染色觀察
a. PCL植入后30 d;b. PCL植入后180 d;c. 20%-SPC植入后30 d;d. 20%-SPC植入后180 d;e. 20%-SPC植入后180 d觀察血管生成情況,白框示內皮細胞構成的環形血管;f. 為圖e白框局部放大;g. 基于圖像分析的20%-SPC植入后180 d體內降解情況,金色區域為新生組織/被替代的材料;h. PCL和20%-SPC植入后不同時間點血管數量比較
Figure7. Masson staining observation of subcutaneous implanted materials in ratsa. PCL at 30 days after implantation; b. PCL at 180 days after implantation; c. 20%-SPC at 30 days after implantation; d. 20%-SPC at 180 days after implantation; e. Vascularization in 20%-SPC at 180 days after implantation, white boxes denoted circular blood vessels constituted by endothelial cells; f. Enlarged view of fig.e; g. The degradation
3 討論
用于骨修復的可降解骨植入物不僅需具備良好的生物相容性和體內可降解性,還需具備高強度以提供力學穩定性,同時需要適配松質骨的較低模量以避免應力屏蔽[16-17]。然而,目前的可降解材料在強度達到或超過皮質骨(約150 MPa)水平時[18],往往模量過高[17,19];而當模量與皮質骨相近或更低時,強度則顯著過低[20]。經過數億年進化形成的強韌骨骼,由膠原蛋白和磷酸鈣礦物兩種物質復合而成,具有多層級有序結構[18,21]。本研究選擇了可降解高分子PCL與蠶絲纖維復合,模仿天然骨骼的異質組成,同時通過復合材料制備工藝,獲得了模量較低、強度較高的新型可降解復合材料,具有骨組織工程應用潛力。
SPC微觀形貌顯示蠶絲與PCL界面結合良好,孔隙等缺陷較少。一方面,PCL熔體在高溫下黏度較低,容易流動;另一方面,熱壓工藝提供的壓力使其能夠向蠶絲織物內部和絲束中心充分滲透。蠶絲體積分數對復合材料的力學性能具有直接影響[22]。疊層組裝和熱壓工藝能夠將體積分數高達60%的蠶絲引入SPC。當蠶絲的體積分數從20%增加至40%時,壓縮模量和壓縮強度均顯著提高。然而,當蠶絲的體積分數進一步增加至60%時,SPC的壓縮模量開始下降。這可能是因為PCL含量過低,難以滲入蠶絲紗線內部,且無法形成有效的連續基體相,導致材料力學性能下降。
生物材料的親水性增加更利于細胞黏附和增殖。由于蠶絲可吸收其質量20%~30%的水分[23],因此蠶絲纖維的加入顯著提高了SPC材料的親水性,降低了材料表面靜態水接觸角。細胞增殖實驗也表明,更加親水的20%-SPC和40%-SPC的細胞增殖顯著高于PCL,且蠶絲含量越高,細胞黏附和生長越容易。
綜合體外實驗結果,SPC具備骨組織力學適配性、親水性、成骨前體細胞相容性等關鍵特性。在骨植入物應用方面,植入材料初始時需具有高強度,同時需要在組織完全愈合/承重前,即6個月內保持力學穩定性。本研究長達180 d的SPC體外降解實驗表明,SPC中PCL的水解反應緩慢,質量損失微小。但SPC的壓縮強度卻能夠維持在濕態90%以上的水平。
在大鼠皮下植入實驗中,SPC表現出比體內更快的降解速率,180 d時外層PCL逐漸降解,新生組織逐漸替代材料并包裹剩余蠶絲纖維。這一現象再次印證了蠶絲纖維及其絲蛋白材料具有優異的體內相容性[24-25]。體內生物因素復雜,蠶絲作為親水、與細胞親和的材料,改變了SPC中PCL的降解模式,從被動水解轉變為細胞主導的機體主動降解/吸收,呈現出完全不同的降解行為[5,26]。Masson染色分析進一步表明,SPC周圍存在大量血管,體現明顯的促血管化作用,加速了組織的生長和修復。
綜上述,通過熱壓和層層組裝制備的SPC成功繼承了天然蠶絲纖維的力學特性,實現了適配骨組織的模量和強度的平衡,在模擬體液中的力學性能長期穩定,可用于骨組織工程,特別是承重骨植入物。SPC的體內降解模式受宿主免疫系統控制,表現出更快的降解速率。同時,SPC具有一定的促血管化效應,能夠加速組織修復。但是,在體內降解過程中,機體如何調控巨噬細胞等免疫細胞對SPC進行降解,PCL降解如何影響組織再生微環境,仍然需要進一步探究。本研究將為研發新型骨修復材料提供啟示,并為蠶絲復合材料的動物實驗功能性驗證和臨床試驗奠定基礎。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;基金項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經首都醫科大學附屬北京朝陽醫院動物福利與倫理工作委員會批準(2021-動-42);實驗動物生產許可證批準號:SCXK(川)2020-034,使用許可證批準號:SYXK(渝)2019-0002
作者貢獻聲明 田文晗:參與研究設計,材料實驗,數據收集、整理、分析,撰寫文章;何觀平:參與研究設計,動物實驗,收集實驗原始數據、分析;劉玉增:指導研究設計,文章修改;管娟:指導研究設計、統籌實驗進度及文章修改
骨腫瘤、骨修復、脊柱融合以及創傷性骨折等原因,每年導致數百萬患者需進行骨移植和修復手術。在臨床手術尤其是脊柱融合手術中,所使用的材料仍然存在一些問題,如高模量引起的應力屏蔽和骨質疏松,以及不可降解引發的長期慢性炎癥和異物反應等[1]。理想的骨移植替代材料應具備以下基本特性:① 與骨主體或松質骨相近的模量,以避免應力屏蔽;② 與皮質骨相近的壓縮強度,以實現結構承載功能;③ 降解速率與組織生長速率相匹配[2-3]。盡管已有大量研究結合多種物理化學手段構建了不同的可降解人工骨材料[4-5],但因為材料特性如模量和強度與降解速率之間存在制約關系,同時具備上述特性的理想材料仍然稀缺。
自然界利用多材料復合和多層級結構設計策略,將膠原蛋白、殼聚糖與磷酸鈣、碳酸鈣等單相本體力學性能較弱的材料,構筑成堅韌耐用的骨骼和貝殼等高性能天然復合材料[6-7]。然而,人們通過結構仿生來重現天然模型體中近乎完美的多層級結構(特別是在微納尺度上),進而獲得具有相似性能和功能的人造材料仍面臨挑戰。
僅由蛋白質組成的蠶絲是唯一一種具有宏觀連續性和高度有序性的多尺度結構天然動物纖維。蠶絲作為重要的生物醫用材料具備良好的生物相容性、可降解性和出色的綜合力學性能[8-9]。在化學纖維發明之前,天然蠶絲享有“紡織皇后”的美譽;近幾百年,蠶絲也被用作臨床縫合線等醫學領域[10-11]。近三十年,研究人員開發了大量新型蠶絲基生物材料,主要集中在再生絲蛋白及其衍生材料[12-13]。但是,再生絲蛋白的提取過程破壞了天然蠶絲的多級有序結構,只保留了其蛋白質的氨基酸序列結構[14],未能繼承天然蠶絲的優異力學性能。最新研究表明[15],天然蠶絲與再生絲蛋白復合,可以形成力學性能優越的可降解骨科植入材料,體現了蠶絲對復合材料基體的強韌化效果。但是,再生絲蛋白的加工性能不佳,導致復合界面性能不足,在體內應用時出現了界面破壞、分層的現象。因此,在設計蠶絲增強復合材料時,應當在滿足骨組織工程力學和生物學需求的同時,選擇具有優異加工性能的高分子基體材料。
本研究選取具有優異加工性能的聚己內酯(polycaprolactone,PCL)作為基體,與天然蠶絲纖維織物復合,模仿天然骨組織中微米尺度上骨小梁增強骨基質的結構,設計了一種骨組織工程用蠶絲增強PCL復合材料(silk reinforced PCL composite,SPC),通過層層組裝和熱壓技術,制備了不同蠶絲含量的SPC。本研究在材料表征的基礎上,通過體外和體內生物學實驗評價SPC的生物相容性和降解特性,為其進一步動物實驗及臨床應用提供實驗依據。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
10周齡SPF級雄性SD大鼠6只,體質量250~300 g,由成都藥康生物科技有限公司提供。
PCL(上海麥克林生化科技股份有限公司);脫膠平紋絲綢織物 [瑞蚨祥(北京)投資管理有限公司];小鼠胚胎成骨細胞前體細胞(MC3T3-E1)[賽百慷(上海)生物技術股份有限公司];DMEM 培養基(Corning公司,美國);細胞計數試劑盒8(cell counting kit 8,CCK-8;同仁公司,日本)。JSM-
1.2 SPC的制備
1.2.1 蠶絲-PCL預浸料制備
先將脫膠平紋絲綢織物在去離子水中進行超聲波清洗30 min,再于高溫滅菌室中滅菌處理2 h;然后將PCL顆粒制成薄膜,與已滅菌的單層脫膠平紋絲綢織物在500 kPa和120℃條件下熱壓10 min,并自然冷卻至室溫,得到單層蠶絲-PCL復合材料,稱為蠶絲-PCL預浸料。
1.2.2 不同蠶絲含量的SPC制備
首先,在模具表面均勻噴灑脫模劑,等待30 min后繼續噴灑,重復3次。接著,將蠶絲-PCL預浸料按預設層數層層組裝于模具中,蠶絲的纖維體積分數分別為20%、40%和60%。在500 kPa和120℃條件下熱壓20 min,再自然冷卻至環境溫度并進行脫模,得到的材料分別標記為20%-SPC、40%-SPC和60%-SPC,通過機械切割制成不同尺寸的待測試樣。
1.3 SPC的表征
1.3.1 大體形態及微觀結構
觀察蠶絲-PCL預浸料及SPC的大體形態。取3種SPC樣本,真空干燥48 h后,表面噴金,掃描電鏡觀察材料內部微觀結構。
1.3.2 力學性能檢測
在Instron 8801力學試驗機上測試3種SPC樣本的壓縮性能,包括壓縮模量和壓縮強度(最大壓縮應力)。壓縮試樣長12 mm、寬5 mm、厚5 mm,應變速率為2 mm/s,使用橫梁位移,壓縮彈性模量取0.5%和3.0%應變之間的線性擬合斜率。每個樣本重復3~5個試樣。
1.3.3 體外降解測試
取3種SPC樣本置于37℃模擬體液(PBS緩沖液)中,于3、30、90、180 d分別取出試樣(n=4),同1.3.2方法測試壓縮強度(離開模擬體液5 min內完成測試)。180 d后取出樣本,用去離子水充分沖洗后干燥,稱重并記錄降解后質量。
1.3.4 表面潤濕性檢測
在OCA-20接觸角測量儀上,使用去離子水在25℃條件下對3種SPC樣本表面進行靜態水接觸角測量,以單純PCL材料作為對照,記錄5次取均值。
1.3.5 細胞增殖實驗
取PCL、20%-SPC、40%-SPC樣本經紫外線滅菌處理后,在材料表面按1×104個/孔濃度添加20 μL MC3T3-E1細胞懸浮液,轉移至96孔板;溫育2 h后,細胞穩定并黏附于材料;隨后按1×104個/100 μL濃度加入MC3T3-E1細胞懸浮液繼續培養,每隔1 d更換1次培養基。于培養1、3、5 d后,取浸提液10 μL加入CCK-8試劑盒,孵育2 h后使用酶標儀測定各組在450 nm波長下的吸光度(A)值。
1.3.6 大鼠皮下植入實驗
將SPC切割成2 mm3大小立方體,PCL為直徑2 mm的球形顆粒,均經60Co輻照滅菌備用。取6只SD大鼠背部消毒后,用手術刀切開表皮,將PCL和20%-SPC兩種試樣左右對稱植入每只大鼠背部皮下,縫合表皮。植入后30 d和180 d分別實施安樂死處死3只大鼠,于背部植入區域取材,行組織切片及Masson染色。基于染色圖像中膠原纖維的分布確定材料與組織界面,定量分析30 d和180 d材料體內降解率;以單位面積內皮細胞成環數量作為新生組織中血管數量。
1.4 統計學方法
采用SPSS27.0統計軟件進行分析。計量資料經Sharpiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,多組間比較采用單因素方差分析,兩兩比較采用SNK檢驗;兩組間比較采用獨立樣本t檢驗。檢驗水準α=0.05。
2 結果
2.1 SPC的大體形態和微觀結構
單層蠶絲-PCL預浸料厚度約0.2 mm。預浸料疊層組裝熱壓后制得的SPC塊體為硬質堅韌材料,厚度可達幾厘米;通過機械切削加工,這些塊體材料可以制成形狀不規則、尺寸較大的植入材料。見圖1。
 圖1
SPC材料大體觀察
圖1
SPC材料大體觀察
a. 蠶絲-PCL預浸料;b. SPC塊體
Figure1. Macroscopic images of SPC materialsa. Silk-PCL prepreg; b. SPC bulk specimen
掃描電鏡觀察示,3種SPC斷面的孔隙缺陷均較少。隨著蠶絲含量從20%增至60%,PCL含量越來越少,蠶絲織物層間距變小,紗線排布越來越密集,纖維幾乎布滿整個斷面;60%-SPC中出現了紗線中心浸漬不良的現象。見圖2。
 圖2
SPC掃描電鏡觀察
圖2
SPC掃描電鏡觀察
a. 20%-SPC;b. 40%-SPC;c. 60%-SPC
Figure2. Scanning electron microscope observation of SPCa. 20%-SPC; b. 40%-SPC; c. 60%-SPC
2.2 SPC的力學性能
隨著蠶絲含量從20%增至60%,SPC的壓縮強度顯著增加,但壓縮模量增加較少,60%-SPC的壓縮模量較40%-SPC下降。各材料壓縮強度和壓縮模量兩兩比較差異均有統計學意義(P<0.05)。見圖3。
 圖3
SPC的壓縮力學性能
圖3
SPC的壓縮力學性能
*
*
2.3 SPC的體外降解分析
3種SPC在模擬體液中降解180 d的質量損失均在5%以內,60%-SPC的質量損失最大,顯著高于另外兩組。各材料間質量損失比較差異均有統計學意義(P<0.05)。見圖4a。
 圖4
SPC的體外降解性能
圖4
SPC的體外降解性能
a. 降解180 d的質量損失 *
a. The mass loss after 180 days of degradation *
降解力學測試示,3 d后3種SPC由干態轉變為濕態,其壓縮強度較干態時顯著下降;但在隨后180 d中,各時間點3種SPC的壓縮強度下降均較少。除3 d時40%-SPC和60%-SPC壓縮強度差異無統計學意義(P>0.05)外,其余時間點各材料間壓縮強度差異均有統計學意義(P<0.05)。見圖4b。
2.4 SPC的表面潤濕性
單純PCL表面呈現疏水性,靜態水接觸角較大;隨著蠶絲含量增加至60%,靜態水接觸角顯著減小,水滴在SPC表面幾乎完全鋪展。除40%-SPC和60%-SPC間靜態水接觸角差異無統計學意義(P>0.05)外,其余組間差異均有統計學意義(P<0.05)。見圖5。
 圖5
SPC的表面潤濕性檢測
圖5
SPC的表面潤濕性檢測
a. 平衡水滴形態;b. 靜態水接觸角 *
a. Equilibrium water droplet morphology; b. Static water contact angles *
2.5 SPC的成骨細胞相容性
隨培養時間延長,各材料組A值均逐漸增加。1 d時20%-SPC組A值低于PCL組和40%-SPC組,差異有統計學意義(P<0.05);3、5 d時,20%-SPC組和40%-SPC組A值均高于PCL組,40%-SPC組高于20%-SPC組,差異均有統計學意義(P<0.05)。見圖6。
 圖6
CCK-8檢測各材料細胞增殖
Figure6.
Cell proliferation of materials detected by CCK-8 assay
圖6
CCK-8檢測各材料細胞增殖
Figure6.
Cell proliferation of materials detected by CCK-8 assay
2.6 SPC的體內降解特征
大鼠皮下植入30 d,兩組均無明顯血管生成,PCL組材料無降解跡象,而在材料周圍形成了薄層纖維囊;20%-SPC組材料與周圍組織界面開始變得模糊,初步出現材料降解、組織向內生長跡象。180 d,PCL組材料仍未見明顯降解,纖維囊增厚,且周圍缺乏血管組織;20%-SPC組材料降解十分顯著,原位新生組織逐漸替代了最初的PCL,剩余未降解的大量蠶絲被新生組織包裹,與組織融合良好,并促進生成了大量血管,部分血管已進入材料內部。定量分析示,20%-SPC組植入30 d和180 d后體內降解率分別為5.33%±3.33%和61.11%±20.12%。20%-SPC組180 d的血管數量顯著高于PCL組,差異有統計學意義(t=10.300,P<0.001)。見圖7。
 圖7
大鼠皮下植入材料Masson染色觀察
圖7
大鼠皮下植入材料Masson染色觀察
a. PCL植入后30 d;b. PCL植入后180 d;c. 20%-SPC植入后30 d;d. 20%-SPC植入后180 d;e. 20%-SPC植入后180 d觀察血管生成情況,白框示內皮細胞構成的環形血管;f. 為圖e白框局部放大;g. 基于圖像分析的20%-SPC植入后180 d體內降解情況,金色區域為新生組織/被替代的材料;h. PCL和20%-SPC植入后不同時間點血管數量比較
Figure7. Masson staining observation of subcutaneous implanted materials in ratsa. PCL at 30 days after implantation; b. PCL at 180 days after implantation; c. 20%-SPC at 30 days after implantation; d. 20%-SPC at 180 days after implantation; e. Vascularization in 20%-SPC at 180 days after implantation, white boxes denoted circular blood vessels constituted by endothelial cells; f. Enlarged view of fig.e; g. The degradation
3 討論
用于骨修復的可降解骨植入物不僅需具備良好的生物相容性和體內可降解性,還需具備高強度以提供力學穩定性,同時需要適配松質骨的較低模量以避免應力屏蔽[16-17]。然而,目前的可降解材料在強度達到或超過皮質骨(約150 MPa)水平時[18],往往模量過高[17,19];而當模量與皮質骨相近或更低時,強度則顯著過低[20]。經過數億年進化形成的強韌骨骼,由膠原蛋白和磷酸鈣礦物兩種物質復合而成,具有多層級有序結構[18,21]。本研究選擇了可降解高分子PCL與蠶絲纖維復合,模仿天然骨骼的異質組成,同時通過復合材料制備工藝,獲得了模量較低、強度較高的新型可降解復合材料,具有骨組織工程應用潛力。
SPC微觀形貌顯示蠶絲與PCL界面結合良好,孔隙等缺陷較少。一方面,PCL熔體在高溫下黏度較低,容易流動;另一方面,熱壓工藝提供的壓力使其能夠向蠶絲織物內部和絲束中心充分滲透。蠶絲體積分數對復合材料的力學性能具有直接影響[22]。疊層組裝和熱壓工藝能夠將體積分數高達60%的蠶絲引入SPC。當蠶絲的體積分數從20%增加至40%時,壓縮模量和壓縮強度均顯著提高。然而,當蠶絲的體積分數進一步增加至60%時,SPC的壓縮模量開始下降。這可能是因為PCL含量過低,難以滲入蠶絲紗線內部,且無法形成有效的連續基體相,導致材料力學性能下降。
生物材料的親水性增加更利于細胞黏附和增殖。由于蠶絲可吸收其質量20%~30%的水分[23],因此蠶絲纖維的加入顯著提高了SPC材料的親水性,降低了材料表面靜態水接觸角。細胞增殖實驗也表明,更加親水的20%-SPC和40%-SPC的細胞增殖顯著高于PCL,且蠶絲含量越高,細胞黏附和生長越容易。
綜合體外實驗結果,SPC具備骨組織力學適配性、親水性、成骨前體細胞相容性等關鍵特性。在骨植入物應用方面,植入材料初始時需具有高強度,同時需要在組織完全愈合/承重前,即6個月內保持力學穩定性。本研究長達180 d的SPC體外降解實驗表明,SPC中PCL的水解反應緩慢,質量損失微小。但SPC的壓縮強度卻能夠維持在濕態90%以上的水平。
在大鼠皮下植入實驗中,SPC表現出比體內更快的降解速率,180 d時外層PCL逐漸降解,新生組織逐漸替代材料并包裹剩余蠶絲纖維。這一現象再次印證了蠶絲纖維及其絲蛋白材料具有優異的體內相容性[24-25]。體內生物因素復雜,蠶絲作為親水、與細胞親和的材料,改變了SPC中PCL的降解模式,從被動水解轉變為細胞主導的機體主動降解/吸收,呈現出完全不同的降解行為[5,26]。Masson染色分析進一步表明,SPC周圍存在大量血管,體現明顯的促血管化作用,加速了組織的生長和修復。
綜上述,通過熱壓和層層組裝制備的SPC成功繼承了天然蠶絲纖維的力學特性,實現了適配骨組織的模量和強度的平衡,在模擬體液中的力學性能長期穩定,可用于骨組織工程,特別是承重骨植入物。SPC的體內降解模式受宿主免疫系統控制,表現出更快的降解速率。同時,SPC具有一定的促血管化效應,能夠加速組織修復。但是,在體內降解過程中,機體如何調控巨噬細胞等免疫細胞對SPC進行降解,PCL降解如何影響組織再生微環境,仍然需要進一步探究。本研究將為研發新型骨修復材料提供啟示,并為蠶絲復合材料的動物實驗功能性驗證和臨床試驗奠定基礎。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;基金項目經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經首都醫科大學附屬北京朝陽醫院動物福利與倫理工作委員會批準(2021-動-42);實驗動物生產許可證批準號:SCXK(川)2020-034,使用許可證批準號:SYXK(渝)2019-0002
作者貢獻聲明 田文晗:參與研究設計,材料實驗,數據收集、整理、分析,撰寫文章;何觀平:參與研究設計,動物實驗,收集實驗原始數據、分析;劉玉增:指導研究設計,文章修改;管娟:指導研究設計、統籌實驗進度及文章修改