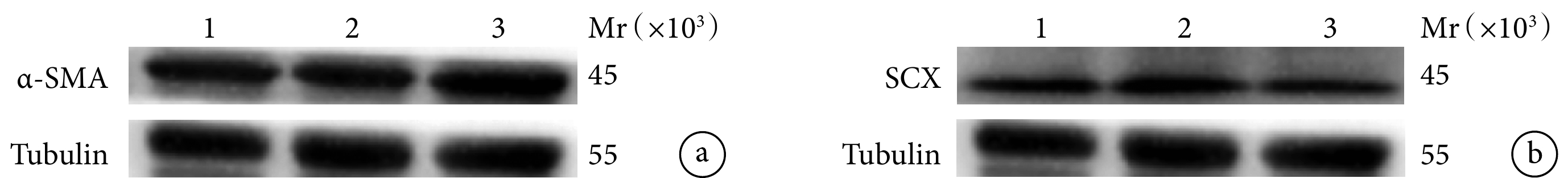引用本文: 吳佳妮, 蔣瀅梓, 汪官玉, 王禮燎, 鮑捷, 王駿. 動、靜態應力刺激在大鼠跟腱損傷早期愈合過程中抗粘連作用及其機制的研究. 中國修復重建外科雜志, 2024, 38(11): 1391-1398. doi: 10.7507/1002-1892.202405090 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
肌腱愈合是內源性愈合和外源性愈合的共同作用。肌腱粘連是由肌腱細胞主導的內源性愈合和成纖維細胞主導的外源性愈合之間不平衡引起的。其中,外源性愈合在肌腱愈合早期階段占主導地位,肌腱周圍成纖維細胞的增殖促進肌腱斷裂端生長,最終導致瘢痕組織形成,破壞肌腱滑動[1-2]。為防止肌腱修復術后肌腱粘連,影響功能恢復,臨床康復策略中常采用石膏或支具功能位固定以及主被動活動,通過應力刺激肌腱活性(促進成纖維細胞增殖,膠原合成、重排)以及控制應力刺激強度,加快肌腱修復和重塑,增加肌腱直徑和拉伸強度[3]。肌腱修復部位的應力刺激會導致損傷部位沉積的膠原蛋白增加,還可能影響細胞外基質(extra-cellular matrix,ECM)重塑,促進成纖維細胞遷移和增殖,增加膠原蛋白生成[2]。
肌腱損傷的同時,由于力學信號喪失也會導致細胞死亡,所以肌腱細胞對應力刺激的響應對于維持損傷后肌腱的穩態和再生至關重要。在肌腱損傷早期愈合階段,康復方案選擇功能位固定制動(靜態應力刺激)還是安全位下主被動活動(動態應力刺激)來改善肌腱粘連情況,仍存在爭議。鑒于此,本研究將通過體外細胞模型和體內動物實驗,探究動、靜態應力刺激對大鼠跟腱損傷早期愈合過程中的抗粘連作用及其機制。
1 材料與方法
1.1 實驗動物及主要材料、儀器
4~6周齡雄性SD大鼠45只,體質量200~250 g,購于斯貝福(北京)生物技術有限公司,飼養于無錫市第九人民醫院SPF級屏障設施內,每籠3~5只。飼養條件:溫度(23±1)℃,相對濕度40%~70%,晝夜明暗交替時間各12 h,平均每3天更換1次墊料,自由攝取水和食物。
重組大鼠TNF-α(MedChemExpress公司,美國);ELISA試劑盒(武漢酶免生物科技有限公司);cDNA逆轉錄試劑盒(上海愛必夢生物科技有限公司);PCR引物(蘇州金唯智生物科技有限公司);細胞活性與細胞毒性檢測試劑盒(北京索萊寶科技有限公司);RNA試劑盒(Bioflux公司,美國);反轉錄試劑盒、SensiFASTTMSYBR?Hi-ROX試劑盒(Bioline公司,英國);增強型BCA蛋白質測定試劑盒(上海碧云天生物科技有限公司)。
力學加載細胞培養系統、硅膠拉伸皿(蘇州皓冕精密科技有限公司);動物吸入式氣體麻醉機(深圳瑞沃德生命科技有限公司);拉扭動靜態材料試驗機(英斯特朗公司,英國);熒光顯微鏡(Leica公司,德國)。
1.2 體外細胞模型實驗
1.2.1 原代跟腱細胞的提取與培養
取15只SD大鼠過量麻醉法處死,取出跟腱,用Ⅰ型膠原酶按比例(30 mg膠原酶∶15 mL DMEM培養基)消化,用含20%FBS的DMEM培養基培養;8~10 d后第1次傳代,分離跟腱細胞,用含10%FBS的DMEM培養基繼續培養;當細胞融合至80%~90%時傳代,使用第3~5代細胞進行后續實驗。
1.2.2 構建損傷愈合早期跟腱細胞模型
將跟腱細胞以2×104個/cm2密度接種至滅菌后的硅膠拉伸皿中,細胞生長融合達90%~95%后,用無血清的H-DMEM培養基饑餓培養12 h;再加入3 mL含TNF-α(10 ng/mL)的無血清DMEM培養基誘導24 h。
1.2.3 施加動、靜態應力刺激
將接種有跟腱細胞的硅膠拉伸皿隨機分為3組,每組3個皿,分別設置為對照組(無應力刺激)、動態組(動態應力刺激)和靜態組(靜態應力刺激)。其中,對照組繼續于細胞培養箱中培養1 h。通過夾具固定裝置分別將動、靜態組固定于動態及靜態加載平臺上,置于細胞培養箱中。設置動態應力刺激條件:頻率0.5 Hz,拉伸幅度6%,拉伸1 h[4-7];靜態應力刺激條件:拉伸幅度6%,持續拉伸1 h。
1.2.4 活/死細胞雙染檢測
取出3組培養皿,用1×Assay Buffer浸洗2次,每孔加入Calcein-AM原液避光孵育20~25 min,再加入PI原液室溫避光染色。PBS清洗5次,熒光顯微鏡下使用(490±10)nm激發濾片同時檢測活細胞和死細胞,活細胞呈綠色熒光,死細胞呈紅色熒光。于放大400倍條件下隨機取3個視野計數活細胞。
1.2.5 ELISA檢測
將3組貼壁細胞用胰蛋白酶消化,以離心半徑20 cm、1 200 r/min離心5 min,制成細胞懸液(濃度1×107個/mL),冰上使用超聲波破碎細胞儀破碎細胞,以離心半徑10 cm、2 000~3 000 r/min離心20 min,收集蛋白樣品。使用ELISA試劑盒按說明書操作檢測肌腱纖維化標志分子α平滑肌肌動蛋白(α smooth muscle actin,α-SMA)含量。
1.2.6 實時熒光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)檢測
取3組貼壁細胞,用RNA試劑盒分離細胞中總RNA,用反轉錄試劑盒將總RNA逆轉錄為cDNA。以上述逆轉錄后的cDNA為模板,采用SensiFASTTMSYBR?Hi-ROX試劑盒進行擴增。以GAPDH為內對照,采用2–ΔΔCt法計算目的基因 [維持肌腱韌性的標志分子Ⅰ型膠原蛋白(collagen type Ⅰ,COL1A1)、維持肌腱彈性的標志分子Ⅲ型膠原蛋白(collagen type Ⅲ,COL3A1)和負責肌腱力傳遞的標志轉錄因子Scleraxis(SCX)]mRNA相對表達量。各基因引物序列見表1。
1.3 體內動物實驗
1.3.1 實驗分組及方法
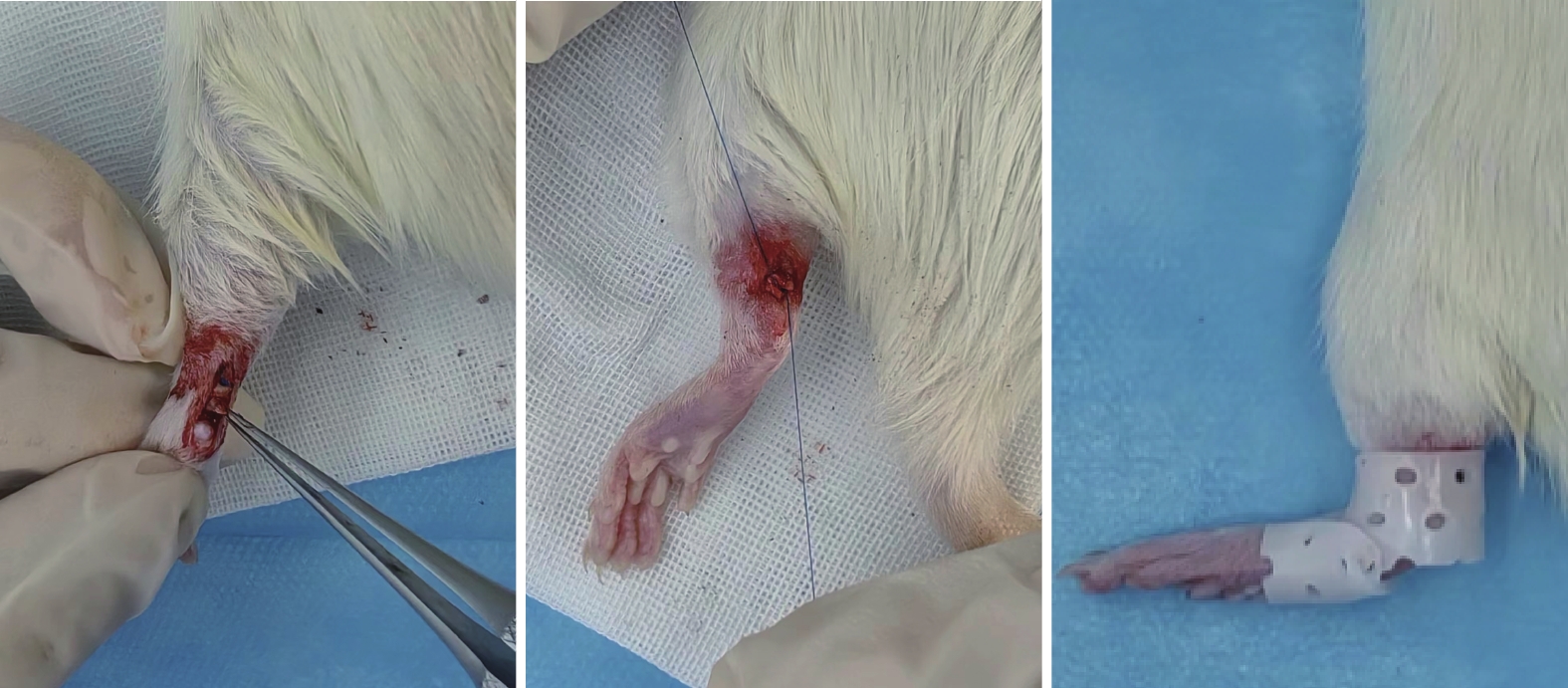
取30只SD大鼠,隨機分為對照組、動態組和靜態組,每組10只。異氟烷吸入式氣體麻醉后,于大鼠單側后肢跟腱處作“一”字形切口,仔細顯露單側跟腱;于跟腱止點上0.3 cm處橫斷。對照組大鼠跟腱切斷后不予以縫合;其余兩組用4-0 PDS-Ⅱ肌腱縫合線以改良Kessler縫合法端對端縫合,距斷端0.2 cm[8]。術后動態組大鼠不施加其他刺激和外固定,不限制自由活動;靜態組在動態組操作基礎上,利用低溫熱塑板制作支具,將大鼠踝關節固定于中立位。見圖1。
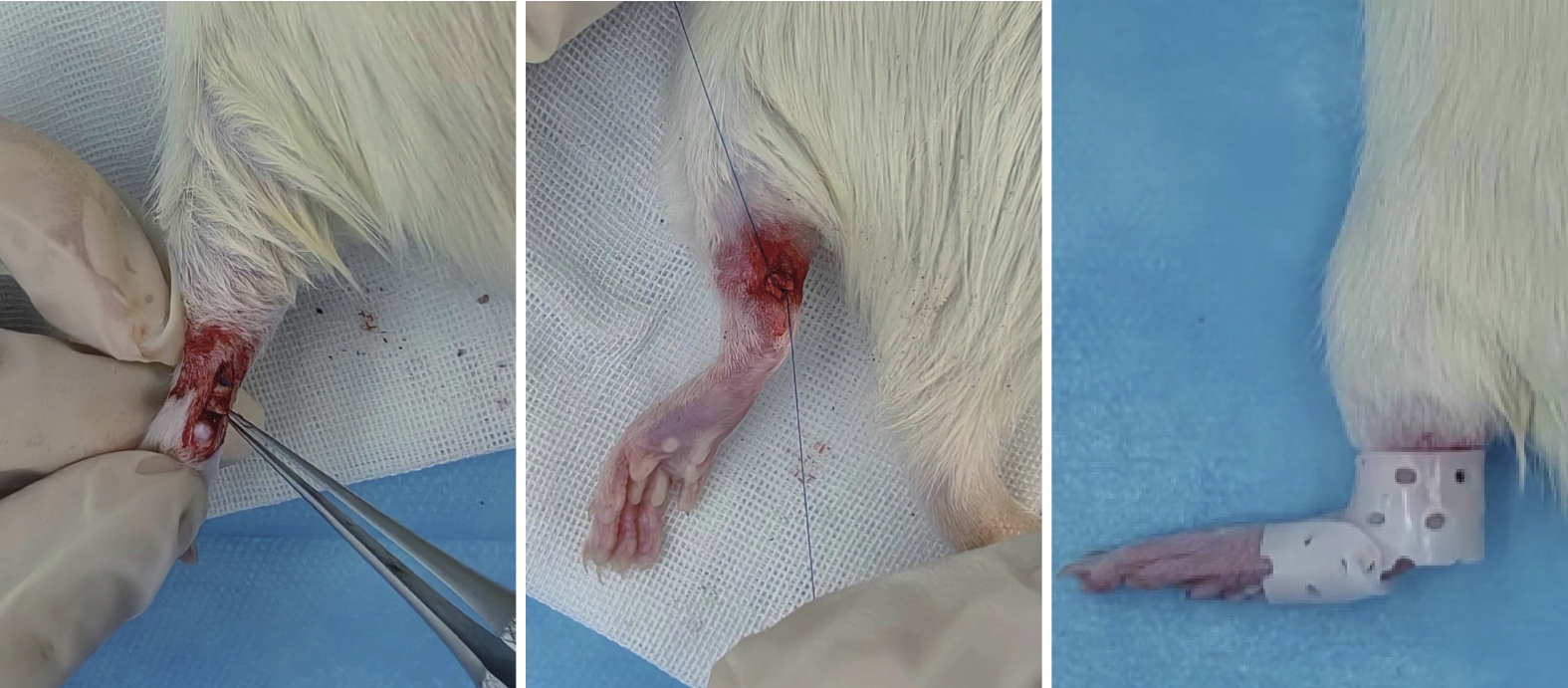 圖1
各組大鼠跟腱橫斷后處理示意圖
圖1
各組大鼠跟腱橫斷后處理示意圖
從左至右分別為對照組、動態組和靜態組
Figure1. Schematic diagram of treatment after Achilles tendon transection of rats in each groupFrom left to right for control group, dynamic group, and static group, respectively
1.3.2 HE染色觀察
術后8 d過量麻醉法處死全部大鼠后取材,將跟腱組織于4%多聚甲醛固定后乙醇脫水、石蠟包埋,5 μm厚切片,常規行HE染色觀察;由2名實驗人員在不知曉實驗結果下獨立行HE染色評分[9],評分項目包括纖維結構、纖維排列、細胞核形態、細胞結構區域變化、血管化、膠原染色、玻璃樣變性。
1.3.3 免疫組織化學染色觀察
取上述部分石蠟切片復水后,浸泡于檸檬酸鹽緩沖液中微波10 min進行抗原修復;滴加封閉液封閉1 h;滴加一抗(COL1A1、COL3A1)4℃孵育過夜;次日依次滴加二抗、三抗和DAB顯色液孵育,并用蘇木素復染以標記細胞核位置。免疫組織化學陽性區域表達得分=高陽性(%)×3+陽性(%)×2+低陽性(%)×1[10]。
1.3.4 Western blot檢測
取3組跟腱組織,按100 mg∶1 mL比例加入RIPA裂解液,按100∶1比例加入蛋白酶抑制劑研磨并裂解跟腱組織,提取組織蛋白;用BCA試劑盒測算蛋白濃度,確定蛋白樣品量;再進行制膠、電泳、轉膜、封閉、抗體孵育和洗脫、顯影;最后行α-SMA和SCX蛋白條帶灰度值定量分析,計算各目的蛋白相對表達量。
1.3.5 生物力學拉伸測試
將3組愈合跟腱組織的兩端垂直固定于拉扭動靜態材料試驗機的夾具上,施加0.1 N預緊力以消除肌腱的黏彈性;以0.1 mm/s拉伸速率行肌腱生物力學載荷-失效測試,直至肌腱斷裂或拔出。繪制軸向力-位移曲線以獲得生物力學性能參數(最大肌腱斷裂力和肌腱剛度)。
1.4 統計學方法
采用GraphPad Prism9.5.0統計軟件進行分析。計量資料經Shapiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用Tukey檢驗;檢驗水準α=0.05。
2 結果
2.1 體外細胞模型實驗
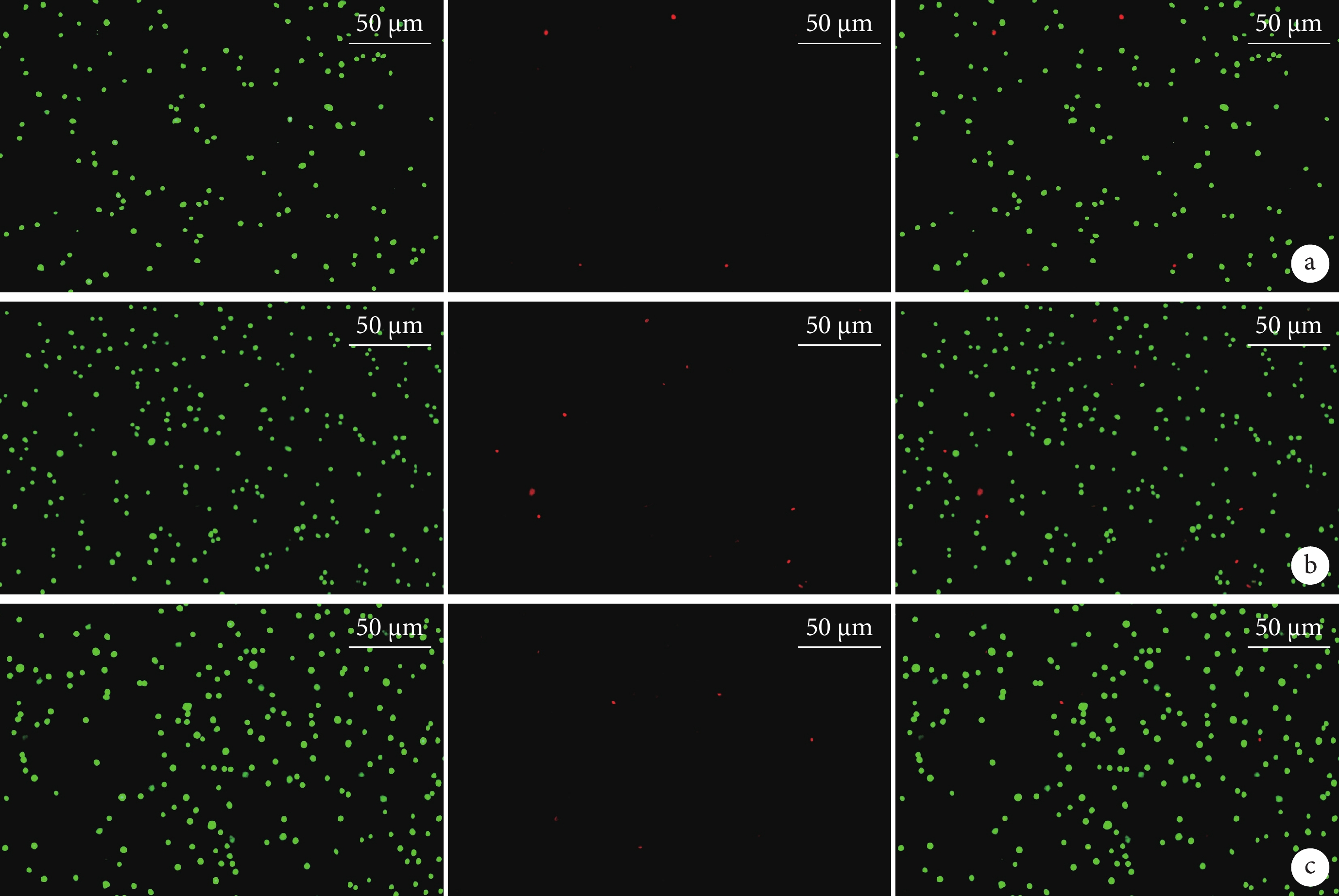
活/死細胞雙染觀察示,動態組和靜態組活細胞數顯著多于對照組,動態組多于靜態組,差異均有統計學意義(P<0.05)。見圖2,表2、3。
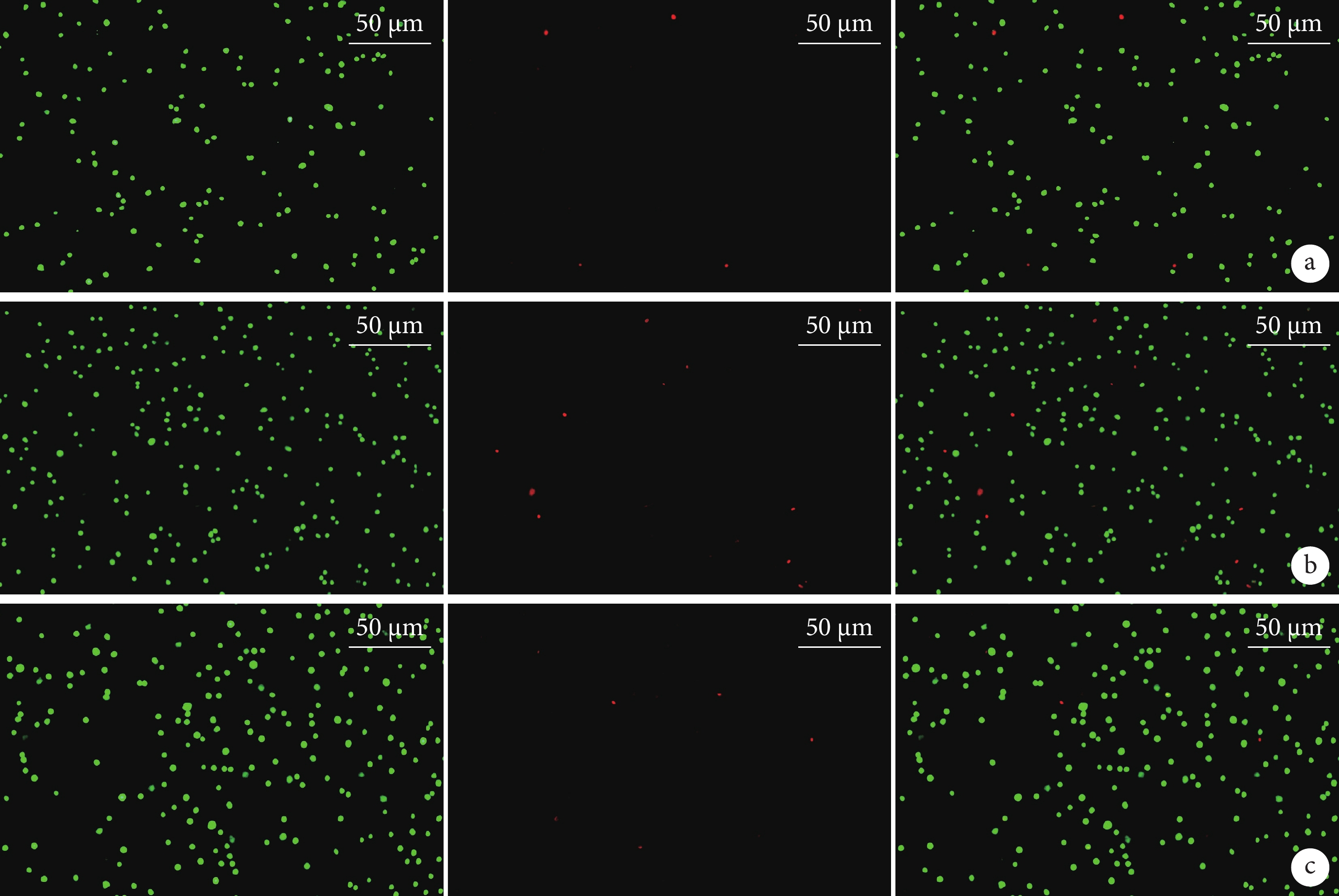 圖2
活/死細胞雙染觀察(熒光顯微鏡×400)
圖2
活/死細胞雙染觀察(熒光顯微鏡×400)
從左至右分別為活細胞染色、死細胞染色及二者重疊 a. 對照組;b. 動態組;c. 靜態組
Figure2. Live/dead double staining observation (Fluorescence microscope×400)From left to right for live cell staining, dead cell staining, and merge a. Control group; b. Dynamic group; c. Static group
ELISA檢測示對照組和靜態組α-SMA含量高于動態組,差異有統計學意義(P<0.05);對照組和靜態組間差異無統計學意義(P>0.05)。見表2、3。
RT-qPCR檢測示,動態組COL1A1 mRNA相對表達量高于對照組,差異有統計學意義(P<0.05);其余組間差異無統計學意義(P>0.05)。動態組COL3A1 mRNA相對表達量顯著低于對照組和靜態組,靜態組低于對照組,差異均有統計學意義(P<0.05)。動態組SCX mRNA相對表達量顯著高于對照組和靜態組,差異有統計學意義(P<0.05);但對照組和靜態組間差異無統計學意義(P>0.05)。見表2、3。
2.2 體內動物實驗
2.2.1 HE染色觀察
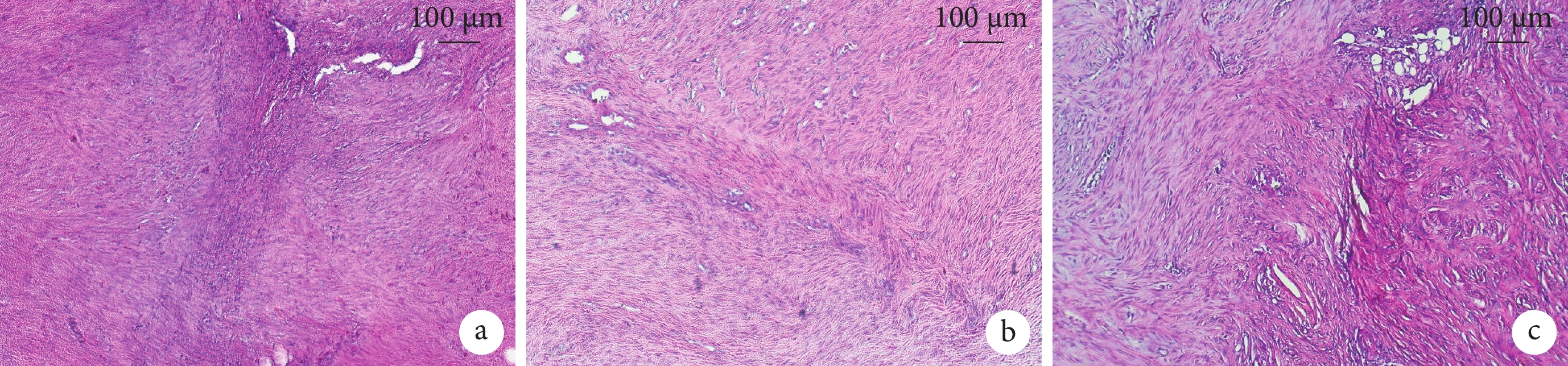
鏡下3組細胞核形態均完好,均出現血管化增生。對照組和靜態組纖維結構稍松散,纖維排列錯亂,且靜態組出現玻璃樣變形;而動態組纖維結構致密、排列整齊。見圖3。動態組HE染色評分低于靜態組,差異有統計學意義(P<0.05);其余組間差異均無統計學意義(P>0.05)。見表2、3。
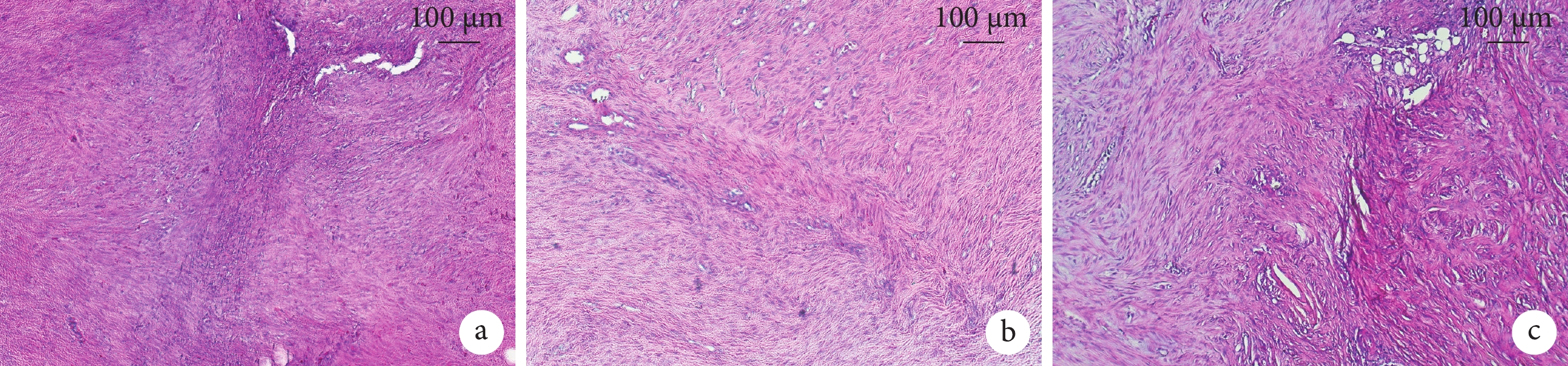 圖3
術后8 d各組大鼠跟腱組織HE染色觀察(×200)
圖3
術后8 d各組大鼠跟腱組織HE染色觀察(×200)
a. 對照組;b. 動態組;c. 靜態組
Figure3. HE staining observation of Achilles tendon tissue of rats in each group at 8 days after operation (×200)a. Control group; b. Dynamic group; c. Static group
2.2.2 免疫組織化學染色觀察
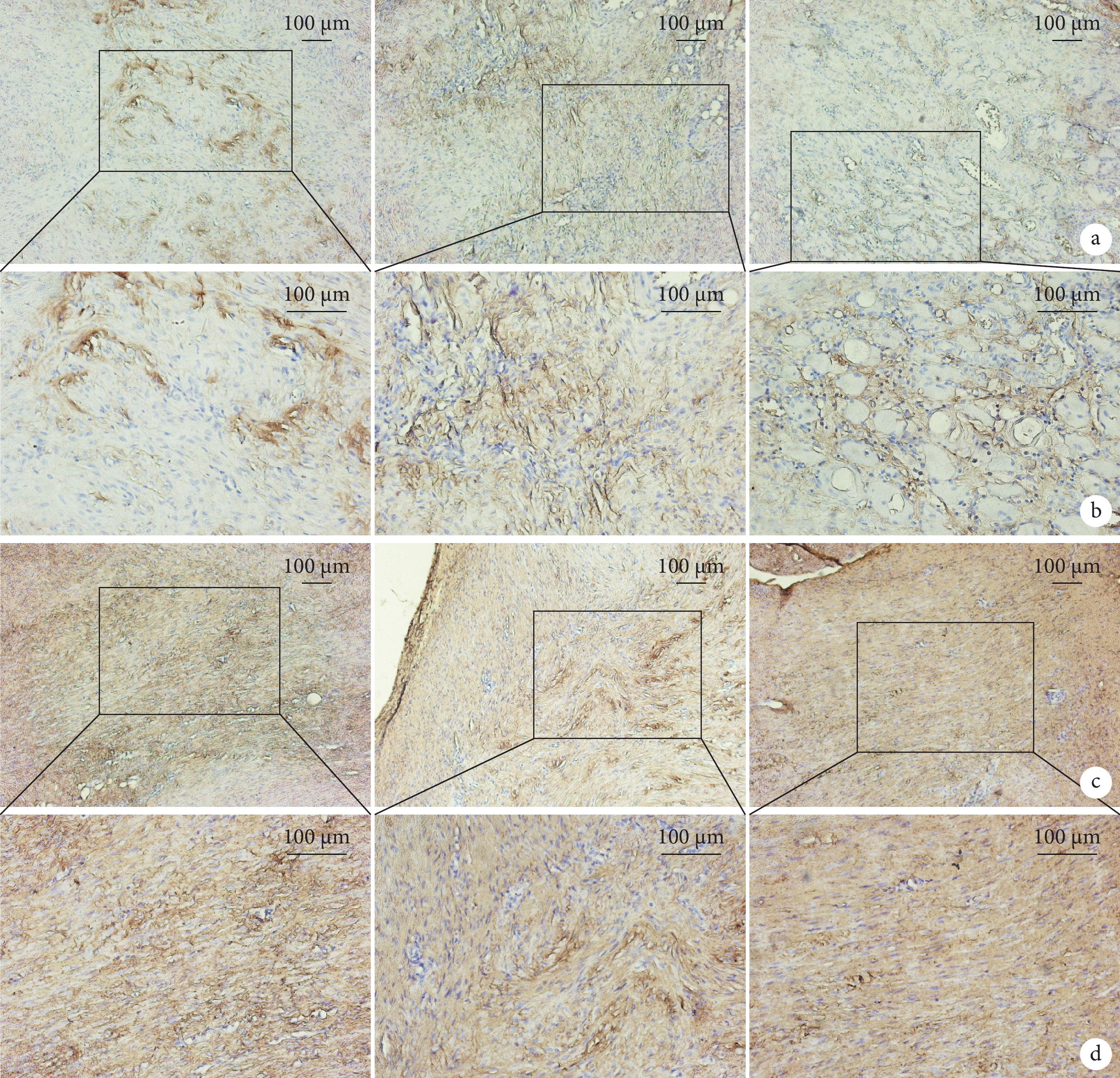
動態組愈合組織COL1A1陽性區域表達得分高于對照組和靜態組,差異有統計學意義(P<0.05);對照組和靜態組間差異無統計學意義(P>0.05)。動態組COL3A1陽性區域表達得分低于對照組和靜態組,對照組低于靜態組,差異均有統計學意義(P<0.05)。見圖4,表2、3。
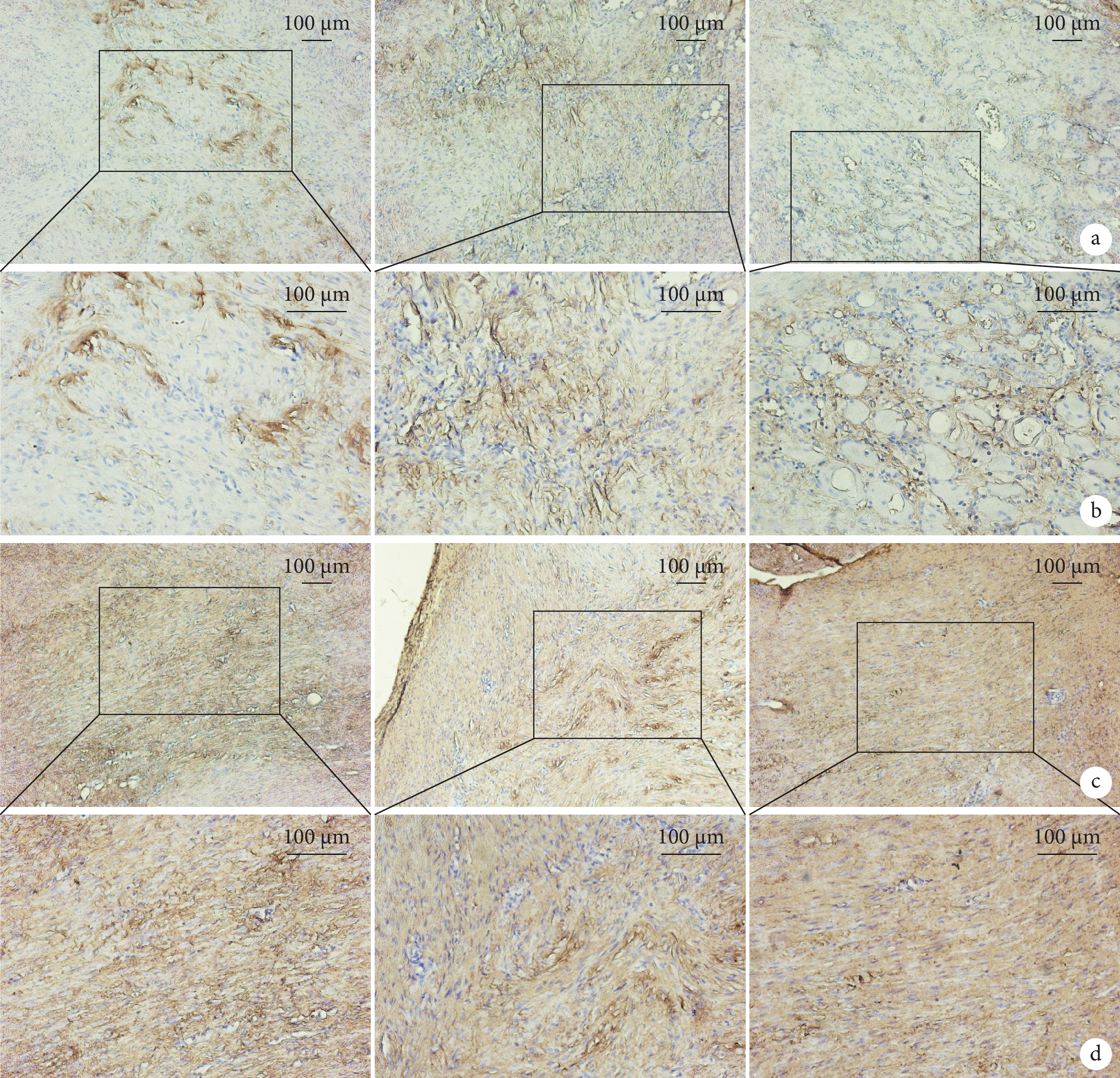 圖4
術后8 d各組大鼠跟腱組織免疫組織化學染色觀察
圖4
術后8 d各組大鼠跟腱組織免疫組織化學染色觀察
從左至右依次為對照組、動態組、靜態組 a. COL1A1(×200);b. 圖a方框處局部放大(×400);c. COL3A1(×200);d. 圖c方框處局部放大(×400)
Figure4. Immunohistochemical staining observation of Achilles tendon tissues of rats in each group at 8 days after operationFrom left to right for control group, dynamic group, and static group, respectively a. COL1A1 (×200); b. Partial enlargement at the box in fig.a (×400); c. COL3A1 (×200); d. Partial enlargement at the box in fig.c (×400)
2.2.3 Western blot檢測
靜態組α-SMA蛋白相對表達量顯著高于對照組和動態組,差異有統計學意義(P<0.05);對照組和動態組間差異無統計學意義(P>0.05)。動態組SCX蛋白相對表達量顯著高于對照組和靜態組,對照組高于靜態組,差異均有統計學意義(P<0.05)。見圖5,表2、3。
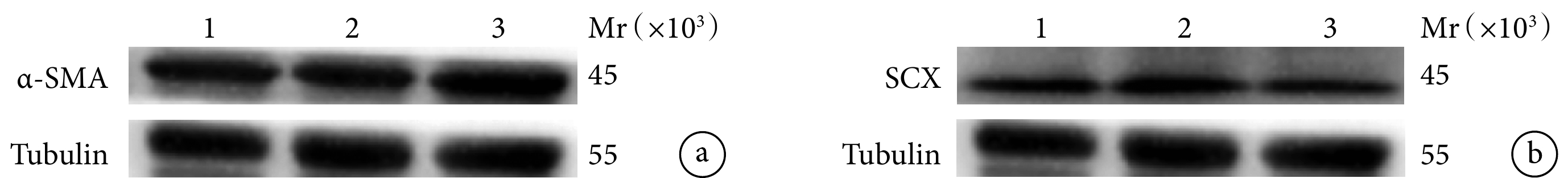 圖5
術后8 d各組大鼠Western blot檢測蛋白相對表達量
圖5
術后8 d各組大鼠Western blot檢測蛋白相對表達量
Mr:相對分子質量 1:對照組 2:動態組 3:靜態組 a. α-SMA;b. SCX
Figure5. Western blot detection of protein relative expression of rats in each group at 8 days after operationMr: Relative molecular mass 1: Control group 2: Dynamic group 3: Static group a. α-SMA; b. SCX
2.2.4 生物力學拉伸測試
各組最大肌腱斷裂力比較差異均無統計學意義(P>0.05);動態組肌腱剛度顯著大于對照組和靜態組,差異有統計學意義(P<0.05),對照組和靜態組間差異無統計學意義(P>0.05)。見表2、3。
3 討論
3.1 動、靜態應力刺激可提高大鼠跟腱損傷早期愈合的細胞活性
活/死細胞雙染實驗用于評估動、靜態應力刺激后的細胞活性。有研究表明,與施加應力刺激尤其是動態循環拉伸刺激的主動脈瓣內皮細胞相比,無應力刺激情況下的細胞出現明顯死亡[11]。本研究結果顯示動、靜態應力刺激下大鼠跟腱細胞活性均明顯增強。
3.2 動態應力刺激可改善大鼠跟腱損傷愈合早期纖維化
α-SMA是一種響應炎癥信號的肌成纖維細胞標記物[12]。肌成纖維細胞的特征是α-SMA表達增加、膠原蛋白分泌和細胞增殖[13]。成纖維細胞與機械應力可啟動肌成纖維細胞活化,表達α-SMA[14-15],因此研究者認為α-SMA是纖維化的標志蛋白[16-18]。有研究使用動態拉伸SD大鼠皮膚移植模型,發現α-SMA蛋白表達有所降低,減輕了皮膚移植的攣縮[19];在炎癥條件下,體外機械振動能夠下調人聲帶成纖維細胞中α-SMA的蛋白表達[20],故認為適當的應力刺激可以下調α-SMA表達。本研究中細胞ELISA和大鼠跟腱組織Western blot檢測結果均表明,動態應力刺激下α-SMA蛋白表達明顯降低,提示動態應力刺激能夠降低損傷早期肌腱細胞的纖維化程度,減少粘連組織產生,抑制外源性愈合。
3.3 動態應力刺激可促進大鼠跟腱損傷早期愈合
肌腱組織的關鍵結構ECM是維持肌腱穩態及力學性能的重要組成部分。ECM的主要成分是COL1A1(占肌腱干重的80%~90%,維持肌腱組織的韌性)和COL3A1(對快速交聯和維持損傷部位的穩定性很重要,維持肌腱組織的彈性)[21]。前期研究發現生理性循環拉伸應變刺激能夠上調COL1A1表達[22];人子宮旁韌帶成纖維細胞在機械應力刺激下,COL3A1表達降低[23]。SCX是一種含有堿性螺旋-環-螺旋的轉錄因子,主要用于標記肌腱細胞或韌帶細胞[12],在調節成年小鼠對機械負荷的反應中發揮重要作用,肌腱卸載后表達降低,生理負荷后表達增加。有研究在離體拉伸動物模型中發現,與未拉伸的對照組相比,SCX基因表達在輕度機械應力下上調了4倍[24];以1 Hz和2 Hz拉伸頻率刺激的肌腱細胞其SCX蛋白表達量顯著高于無拉伸培養的細胞[25];動態拉伸肌腱細胞的SCX基因表達量高于靜態拉伸3周的細胞[26]。本研究體外細胞實驗發現,在動態應力刺激下SCX基因表達增高,表明促進了損傷肌腱細胞愈合;同時COL1A1基因表達上升、COL3A1基因表達下降,表明損傷肌腱細胞的膠原蛋白表達趨于正常,促纖維化機械信號傳導減弱[27],有利于重建健康的肌腱組織。
以上變化在動物體內也得到了驗證。通過HE染色評估細胞形態和細胞周圍結構,研究者觀察到動態應力刺激下細胞在密集平行的膠原纖維之間排列成行,大多數細胞具有成熟肌腱中的肌腱細胞外觀,具有特征性細長的細胞核形態[9],本研究結果與該結論相符。同時本研究通過免疫組織化學染色對 COL1A1、COL3A1以及Western blot對SCX進行蛋白定量分析,發現動態應力刺激下上述因子RT-qPCR檢測的基因表達和蛋白表達趨勢一致。
3.4 動態應力刺激可增強大鼠跟腱損傷早期愈合生物力學性能
生物力學性能是肌腱組織重要特性,腱-骨愈合以及肌腱止點重建等研究中,通過生物力學拉伸測試來檢測相關組織的生物力學參數,如最大肌腱斷裂力、肌腱剛度、拉伸強度和模量,以評估愈合組織的生物力學性能[28-29]。有研究通過實時超聲成像、等速測力法等方式評估跟腱的載荷性能,發現適宜的負荷運動能夠增強跟腱的形態特性和力學性能[30]。本研究發現在動態應力刺激下,肌腱早期愈合組織的力學性能有一定增強,與上述研究結論相符。
綜上述,本研究結果顯示,動態應力刺激在大鼠跟腱損傷早期愈合過程中,能夠增強細胞活性,減輕愈合早期跟腱組織纖維化程度,具有一定程度抗粘連作用;并且能改善愈合跟腱組織的生物力學性能,提高跟腱抗拉強度。其作用機制可能是動態應力刺激能夠通過激活TGF-β1/Smad2、3信號通路,調控SCX,從而介導下游纖維化因子α-SMA和ECM膠原組成COL1A1、COL3A1的表達,控制瘢痕生長[31]。但由于體內力學刺激的不可控性,目前只能構建相對動態和靜態的動物模型。進一步實驗中將優化此方案,并對其應力刺激的具體機制展開研究。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經無錫市第九人民醫院醫學倫理委員會批準(KS2023076);實驗動物使用許可證號:SYXK(蘇)2021-0065
作者貢獻聲明 吳佳妮:研究實施,數據分析,文章撰寫;蔣瀅梓、汪官玉:指導實驗操作,負責部分實驗內容;王禮燎:論文審校;鮑捷、王駿:對文章內容作批評性審閱,經費支持
肌腱愈合是內源性愈合和外源性愈合的共同作用。肌腱粘連是由肌腱細胞主導的內源性愈合和成纖維細胞主導的外源性愈合之間不平衡引起的。其中,外源性愈合在肌腱愈合早期階段占主導地位,肌腱周圍成纖維細胞的增殖促進肌腱斷裂端生長,最終導致瘢痕組織形成,破壞肌腱滑動[1-2]。為防止肌腱修復術后肌腱粘連,影響功能恢復,臨床康復策略中常采用石膏或支具功能位固定以及主被動活動,通過應力刺激肌腱活性(促進成纖維細胞增殖,膠原合成、重排)以及控制應力刺激強度,加快肌腱修復和重塑,增加肌腱直徑和拉伸強度[3]。肌腱修復部位的應力刺激會導致損傷部位沉積的膠原蛋白增加,還可能影響細胞外基質(extra-cellular matrix,ECM)重塑,促進成纖維細胞遷移和增殖,增加膠原蛋白生成[2]。
肌腱損傷的同時,由于力學信號喪失也會導致細胞死亡,所以肌腱細胞對應力刺激的響應對于維持損傷后肌腱的穩態和再生至關重要。在肌腱損傷早期愈合階段,康復方案選擇功能位固定制動(靜態應力刺激)還是安全位下主被動活動(動態應力刺激)來改善肌腱粘連情況,仍存在爭議。鑒于此,本研究將通過體外細胞模型和體內動物實驗,探究動、靜態應力刺激對大鼠跟腱損傷早期愈合過程中的抗粘連作用及其機制。
1 材料與方法
1.1 實驗動物及主要材料、儀器
4~6周齡雄性SD大鼠45只,體質量200~250 g,購于斯貝福(北京)生物技術有限公司,飼養于無錫市第九人民醫院SPF級屏障設施內,每籠3~5只。飼養條件:溫度(23±1)℃,相對濕度40%~70%,晝夜明暗交替時間各12 h,平均每3天更換1次墊料,自由攝取水和食物。
重組大鼠TNF-α(MedChemExpress公司,美國);ELISA試劑盒(武漢酶免生物科技有限公司);cDNA逆轉錄試劑盒(上海愛必夢生物科技有限公司);PCR引物(蘇州金唯智生物科技有限公司);細胞活性與細胞毒性檢測試劑盒(北京索萊寶科技有限公司);RNA試劑盒(Bioflux公司,美國);反轉錄試劑盒、SensiFASTTMSYBR?Hi-ROX試劑盒(Bioline公司,英國);增強型BCA蛋白質測定試劑盒(上海碧云天生物科技有限公司)。
力學加載細胞培養系統、硅膠拉伸皿(蘇州皓冕精密科技有限公司);動物吸入式氣體麻醉機(深圳瑞沃德生命科技有限公司);拉扭動靜態材料試驗機(英斯特朗公司,英國);熒光顯微鏡(Leica公司,德國)。
1.2 體外細胞模型實驗
1.2.1 原代跟腱細胞的提取與培養
取15只SD大鼠過量麻醉法處死,取出跟腱,用Ⅰ型膠原酶按比例(30 mg膠原酶∶15 mL DMEM培養基)消化,用含20%FBS的DMEM培養基培養;8~10 d后第1次傳代,分離跟腱細胞,用含10%FBS的DMEM培養基繼續培養;當細胞融合至80%~90%時傳代,使用第3~5代細胞進行后續實驗。
1.2.2 構建損傷愈合早期跟腱細胞模型
將跟腱細胞以2×104個/cm2密度接種至滅菌后的硅膠拉伸皿中,細胞生長融合達90%~95%后,用無血清的H-DMEM培養基饑餓培養12 h;再加入3 mL含TNF-α(10 ng/mL)的無血清DMEM培養基誘導24 h。
1.2.3 施加動、靜態應力刺激
將接種有跟腱細胞的硅膠拉伸皿隨機分為3組,每組3個皿,分別設置為對照組(無應力刺激)、動態組(動態應力刺激)和靜態組(靜態應力刺激)。其中,對照組繼續于細胞培養箱中培養1 h。通過夾具固定裝置分別將動、靜態組固定于動態及靜態加載平臺上,置于細胞培養箱中。設置動態應力刺激條件:頻率0.5 Hz,拉伸幅度6%,拉伸1 h[4-7];靜態應力刺激條件:拉伸幅度6%,持續拉伸1 h。
1.2.4 活/死細胞雙染檢測
取出3組培養皿,用1×Assay Buffer浸洗2次,每孔加入Calcein-AM原液避光孵育20~25 min,再加入PI原液室溫避光染色。PBS清洗5次,熒光顯微鏡下使用(490±10)nm激發濾片同時檢測活細胞和死細胞,活細胞呈綠色熒光,死細胞呈紅色熒光。于放大400倍條件下隨機取3個視野計數活細胞。
1.2.5 ELISA檢測
將3組貼壁細胞用胰蛋白酶消化,以離心半徑20 cm、1 200 r/min離心5 min,制成細胞懸液(濃度1×107個/mL),冰上使用超聲波破碎細胞儀破碎細胞,以離心半徑10 cm、2 000~3 000 r/min離心20 min,收集蛋白樣品。使用ELISA試劑盒按說明書操作檢測肌腱纖維化標志分子α平滑肌肌動蛋白(α smooth muscle actin,α-SMA)含量。
1.2.6 實時熒光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)檢測
取3組貼壁細胞,用RNA試劑盒分離細胞中總RNA,用反轉錄試劑盒將總RNA逆轉錄為cDNA。以上述逆轉錄后的cDNA為模板,采用SensiFASTTMSYBR?Hi-ROX試劑盒進行擴增。以GAPDH為內對照,采用2–ΔΔCt法計算目的基因 [維持肌腱韌性的標志分子Ⅰ型膠原蛋白(collagen type Ⅰ,COL1A1)、維持肌腱彈性的標志分子Ⅲ型膠原蛋白(collagen type Ⅲ,COL3A1)和負責肌腱力傳遞的標志轉錄因子Scleraxis(SCX)]mRNA相對表達量。各基因引物序列見表1。
1.3 體內動物實驗
1.3.1 實驗分組及方法
取30只SD大鼠,隨機分為對照組、動態組和靜態組,每組10只。異氟烷吸入式氣體麻醉后,于大鼠單側后肢跟腱處作“一”字形切口,仔細顯露單側跟腱;于跟腱止點上0.3 cm處橫斷。對照組大鼠跟腱切斷后不予以縫合;其余兩組用4-0 PDS-Ⅱ肌腱縫合線以改良Kessler縫合法端對端縫合,距斷端0.2 cm[8]。術后動態組大鼠不施加其他刺激和外固定,不限制自由活動;靜態組在動態組操作基礎上,利用低溫熱塑板制作支具,將大鼠踝關節固定于中立位。見圖1。
 圖1
各組大鼠跟腱橫斷后處理示意圖
圖1
各組大鼠跟腱橫斷后處理示意圖
從左至右分別為對照組、動態組和靜態組
Figure1. Schematic diagram of treatment after Achilles tendon transection of rats in each groupFrom left to right for control group, dynamic group, and static group, respectively
1.3.2 HE染色觀察
術后8 d過量麻醉法處死全部大鼠后取材,將跟腱組織于4%多聚甲醛固定后乙醇脫水、石蠟包埋,5 μm厚切片,常規行HE染色觀察;由2名實驗人員在不知曉實驗結果下獨立行HE染色評分[9],評分項目包括纖維結構、纖維排列、細胞核形態、細胞結構區域變化、血管化、膠原染色、玻璃樣變性。
1.3.3 免疫組織化學染色觀察
取上述部分石蠟切片復水后,浸泡于檸檬酸鹽緩沖液中微波10 min進行抗原修復;滴加封閉液封閉1 h;滴加一抗(COL1A1、COL3A1)4℃孵育過夜;次日依次滴加二抗、三抗和DAB顯色液孵育,并用蘇木素復染以標記細胞核位置。免疫組織化學陽性區域表達得分=高陽性(%)×3+陽性(%)×2+低陽性(%)×1[10]。
1.3.4 Western blot檢測
取3組跟腱組織,按100 mg∶1 mL比例加入RIPA裂解液,按100∶1比例加入蛋白酶抑制劑研磨并裂解跟腱組織,提取組織蛋白;用BCA試劑盒測算蛋白濃度,確定蛋白樣品量;再進行制膠、電泳、轉膜、封閉、抗體孵育和洗脫、顯影;最后行α-SMA和SCX蛋白條帶灰度值定量分析,計算各目的蛋白相對表達量。
1.3.5 生物力學拉伸測試
將3組愈合跟腱組織的兩端垂直固定于拉扭動靜態材料試驗機的夾具上,施加0.1 N預緊力以消除肌腱的黏彈性;以0.1 mm/s拉伸速率行肌腱生物力學載荷-失效測試,直至肌腱斷裂或拔出。繪制軸向力-位移曲線以獲得生物力學性能參數(最大肌腱斷裂力和肌腱剛度)。
1.4 統計學方法
采用GraphPad Prism9.5.0統計軟件進行分析。計量資料經Shapiro-Wilk正態性檢驗,均符合正態分布,數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用Tukey檢驗;檢驗水準α=0.05。
2 結果
2.1 體外細胞模型實驗
活/死細胞雙染觀察示,動態組和靜態組活細胞數顯著多于對照組,動態組多于靜態組,差異均有統計學意義(P<0.05)。見圖2,表2、3。
 圖2
活/死細胞雙染觀察(熒光顯微鏡×400)
圖2
活/死細胞雙染觀察(熒光顯微鏡×400)
從左至右分別為活細胞染色、死細胞染色及二者重疊 a. 對照組;b. 動態組;c. 靜態組
Figure2. Live/dead double staining observation (Fluorescence microscope×400)From left to right for live cell staining, dead cell staining, and merge a. Control group; b. Dynamic group; c. Static group
ELISA檢測示對照組和靜態組α-SMA含量高于動態組,差異有統計學意義(P<0.05);對照組和靜態組間差異無統計學意義(P>0.05)。見表2、3。
RT-qPCR檢測示,動態組COL1A1 mRNA相對表達量高于對照組,差異有統計學意義(P<0.05);其余組間差異無統計學意義(P>0.05)。動態組COL3A1 mRNA相對表達量顯著低于對照組和靜態組,靜態組低于對照組,差異均有統計學意義(P<0.05)。動態組SCX mRNA相對表達量顯著高于對照組和靜態組,差異有統計學意義(P<0.05);但對照組和靜態組間差異無統計學意義(P>0.05)。見表2、3。
2.2 體內動物實驗
2.2.1 HE染色觀察
鏡下3組細胞核形態均完好,均出現血管化增生。對照組和靜態組纖維結構稍松散,纖維排列錯亂,且靜態組出現玻璃樣變形;而動態組纖維結構致密、排列整齊。見圖3。動態組HE染色評分低于靜態組,差異有統計學意義(P<0.05);其余組間差異均無統計學意義(P>0.05)。見表2、3。
 圖3
術后8 d各組大鼠跟腱組織HE染色觀察(×200)
圖3
術后8 d各組大鼠跟腱組織HE染色觀察(×200)
a. 對照組;b. 動態組;c. 靜態組
Figure3. HE staining observation of Achilles tendon tissue of rats in each group at 8 days after operation (×200)a. Control group; b. Dynamic group; c. Static group
2.2.2 免疫組織化學染色觀察
動態組愈合組織COL1A1陽性區域表達得分高于對照組和靜態組,差異有統計學意義(P<0.05);對照組和靜態組間差異無統計學意義(P>0.05)。動態組COL3A1陽性區域表達得分低于對照組和靜態組,對照組低于靜態組,差異均有統計學意義(P<0.05)。見圖4,表2、3。
 圖4
術后8 d各組大鼠跟腱組織免疫組織化學染色觀察
圖4
術后8 d各組大鼠跟腱組織免疫組織化學染色觀察
從左至右依次為對照組、動態組、靜態組 a. COL1A1(×200);b. 圖a方框處局部放大(×400);c. COL3A1(×200);d. 圖c方框處局部放大(×400)
Figure4. Immunohistochemical staining observation of Achilles tendon tissues of rats in each group at 8 days after operationFrom left to right for control group, dynamic group, and static group, respectively a. COL1A1 (×200); b. Partial enlargement at the box in fig.a (×400); c. COL3A1 (×200); d. Partial enlargement at the box in fig.c (×400)
2.2.3 Western blot檢測
靜態組α-SMA蛋白相對表達量顯著高于對照組和動態組,差異有統計學意義(P<0.05);對照組和動態組間差異無統計學意義(P>0.05)。動態組SCX蛋白相對表達量顯著高于對照組和靜態組,對照組高于靜態組,差異均有統計學意義(P<0.05)。見圖5,表2、3。
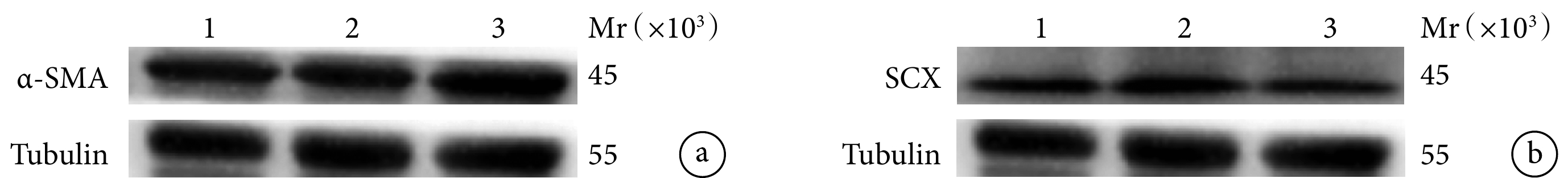 圖5
術后8 d各組大鼠Western blot檢測蛋白相對表達量
圖5
術后8 d各組大鼠Western blot檢測蛋白相對表達量
Mr:相對分子質量 1:對照組 2:動態組 3:靜態組 a. α-SMA;b. SCX
Figure5. Western blot detection of protein relative expression of rats in each group at 8 days after operationMr: Relative molecular mass 1: Control group 2: Dynamic group 3: Static group a. α-SMA; b. SCX
2.2.4 生物力學拉伸測試
各組最大肌腱斷裂力比較差異均無統計學意義(P>0.05);動態組肌腱剛度顯著大于對照組和靜態組,差異有統計學意義(P<0.05),對照組和靜態組間差異無統計學意義(P>0.05)。見表2、3。
3 討論
3.1 動、靜態應力刺激可提高大鼠跟腱損傷早期愈合的細胞活性
活/死細胞雙染實驗用于評估動、靜態應力刺激后的細胞活性。有研究表明,與施加應力刺激尤其是動態循環拉伸刺激的主動脈瓣內皮細胞相比,無應力刺激情況下的細胞出現明顯死亡[11]。本研究結果顯示動、靜態應力刺激下大鼠跟腱細胞活性均明顯增強。
3.2 動態應力刺激可改善大鼠跟腱損傷愈合早期纖維化
α-SMA是一種響應炎癥信號的肌成纖維細胞標記物[12]。肌成纖維細胞的特征是α-SMA表達增加、膠原蛋白分泌和細胞增殖[13]。成纖維細胞與機械應力可啟動肌成纖維細胞活化,表達α-SMA[14-15],因此研究者認為α-SMA是纖維化的標志蛋白[16-18]。有研究使用動態拉伸SD大鼠皮膚移植模型,發現α-SMA蛋白表達有所降低,減輕了皮膚移植的攣縮[19];在炎癥條件下,體外機械振動能夠下調人聲帶成纖維細胞中α-SMA的蛋白表達[20],故認為適當的應力刺激可以下調α-SMA表達。本研究中細胞ELISA和大鼠跟腱組織Western blot檢測結果均表明,動態應力刺激下α-SMA蛋白表達明顯降低,提示動態應力刺激能夠降低損傷早期肌腱細胞的纖維化程度,減少粘連組織產生,抑制外源性愈合。
3.3 動態應力刺激可促進大鼠跟腱損傷早期愈合
肌腱組織的關鍵結構ECM是維持肌腱穩態及力學性能的重要組成部分。ECM的主要成分是COL1A1(占肌腱干重的80%~90%,維持肌腱組織的韌性)和COL3A1(對快速交聯和維持損傷部位的穩定性很重要,維持肌腱組織的彈性)[21]。前期研究發現生理性循環拉伸應變刺激能夠上調COL1A1表達[22];人子宮旁韌帶成纖維細胞在機械應力刺激下,COL3A1表達降低[23]。SCX是一種含有堿性螺旋-環-螺旋的轉錄因子,主要用于標記肌腱細胞或韌帶細胞[12],在調節成年小鼠對機械負荷的反應中發揮重要作用,肌腱卸載后表達降低,生理負荷后表達增加。有研究在離體拉伸動物模型中發現,與未拉伸的對照組相比,SCX基因表達在輕度機械應力下上調了4倍[24];以1 Hz和2 Hz拉伸頻率刺激的肌腱細胞其SCX蛋白表達量顯著高于無拉伸培養的細胞[25];動態拉伸肌腱細胞的SCX基因表達量高于靜態拉伸3周的細胞[26]。本研究體外細胞實驗發現,在動態應力刺激下SCX基因表達增高,表明促進了損傷肌腱細胞愈合;同時COL1A1基因表達上升、COL3A1基因表達下降,表明損傷肌腱細胞的膠原蛋白表達趨于正常,促纖維化機械信號傳導減弱[27],有利于重建健康的肌腱組織。
以上變化在動物體內也得到了驗證。通過HE染色評估細胞形態和細胞周圍結構,研究者觀察到動態應力刺激下細胞在密集平行的膠原纖維之間排列成行,大多數細胞具有成熟肌腱中的肌腱細胞外觀,具有特征性細長的細胞核形態[9],本研究結果與該結論相符。同時本研究通過免疫組織化學染色對 COL1A1、COL3A1以及Western blot對SCX進行蛋白定量分析,發現動態應力刺激下上述因子RT-qPCR檢測的基因表達和蛋白表達趨勢一致。
3.4 動態應力刺激可增強大鼠跟腱損傷早期愈合生物力學性能
生物力學性能是肌腱組織重要特性,腱-骨愈合以及肌腱止點重建等研究中,通過生物力學拉伸測試來檢測相關組織的生物力學參數,如最大肌腱斷裂力、肌腱剛度、拉伸強度和模量,以評估愈合組織的生物力學性能[28-29]。有研究通過實時超聲成像、等速測力法等方式評估跟腱的載荷性能,發現適宜的負荷運動能夠增強跟腱的形態特性和力學性能[30]。本研究發現在動態應力刺激下,肌腱早期愈合組織的力學性能有一定增強,與上述研究結論相符。
綜上述,本研究結果顯示,動態應力刺激在大鼠跟腱損傷早期愈合過程中,能夠增強細胞活性,減輕愈合早期跟腱組織纖維化程度,具有一定程度抗粘連作用;并且能改善愈合跟腱組織的生物力學性能,提高跟腱抗拉強度。其作用機制可能是動態應力刺激能夠通過激活TGF-β1/Smad2、3信號通路,調控SCX,從而介導下游纖維化因子α-SMA和ECM膠原組成COL1A1、COL3A1的表達,控制瘢痕生長[31]。但由于體內力學刺激的不可控性,目前只能構建相對動態和靜態的動物模型。進一步實驗中將優化此方案,并對其應力刺激的具體機制展開研究。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經無錫市第九人民醫院醫學倫理委員會批準(KS2023076);實驗動物使用許可證號:SYXK(蘇)2021-0065
作者貢獻聲明 吳佳妮:研究實施,數據分析,文章撰寫;蔣瀅梓、汪官玉:指導實驗操作,負責部分實驗內容;王禮燎:論文審校;鮑捷、王駿:對文章內容作批評性審閱,經費支持