引用本文: 柳鑫, 石博文, 蔡成闊, 王昊天, 賈鵬. 脊椎蛋白2對BMSCs成骨分化及卵巢去勢小鼠骨代謝的作用研究. 中國修復重建外科雜志, 2024, 38(11): 1399-1407. doi: 10.7507/1002-1892.202406083 復制
版權信息: ?四川大學華西醫院華西期刊社《中國修復重建外科雜志》版權所有,未經授權不得轉載、改編
骨質疏松癥是一種常見的全身性骨骼疾病,其特點是骨礦物質密度低和骨質微結構退化,從而降低了骨強度,脆性骨折風險增加[1],目前臨床尚缺少安全、有效的治療手段。骨量是通過成骨細胞骨形成和破骨細胞骨吸收的持續骨重塑來控制,如兩者之間平衡打破,骨形成速度低于骨吸收,就會導致骨質疏松癥。BMSCs由祖細胞和多能骨骼干細胞組成,可在體外分化為成骨細胞、骨細胞、脂肪細胞和軟骨細胞[2]。目前,研究表明幾乎所有成骨細胞都來源于BMSCs[3],由于BMSCs可分化成骨骼細胞表型,因此被認為是最理想的骨代謝研究對象[4]。
脊椎蛋白(R-spondin,Rspo)家族由4種分泌型糖蛋白(Rspo1~4)組成[5],與發育和癌癥等許多疾病病理性改變密切相關[6-7]。研究顯示小鼠體內缺失Rspo受體LGR4會導致骨形成減少和骨吸收增加,發生骨質丟失,表明Rspo表達對維持骨代謝穩態至關重要[8]。Rspo2基因敲除小鼠表現出面部骨骼缺陷、遠端肢體缺失和肺發育不全[9]。此外,骨關節炎患者體內的Rspo2 mRNA和蛋白表達量均減少,Rspo2表達下調會抑制體內成骨細胞礦化,而且重組Rspo2則能提高此類患者成骨細胞礦化度[10]。然而,Rspo2對BMSCs誘導骨形成和分化的影響尚不清楚。為此,本研究擬探究Rspo2在體外和體內對BMSCs向成骨分化的影響和其具體作用機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
雌性C57BL/6小鼠25只,其中10周齡小鼠18只,體質量21~24 g;4周齡小鼠7只,體質量12~14 g;均由華阜康生物科技股份有限公司提供。實驗前適應性喂養1周,分籠飼養,每籠最多5只,自由飲食、飲水,光照時間12 h/d,溫度25℃。
α-MEM培養基、FBS、青霉素溶液、硫酸鏈霉素、0.25%胰蛋白酶-EDTA 溶液(GIBCO公司,美國);Rspo2重組蛋白(R&D公司,美國);HE染色液(Sigma-Aldrich公司,美國);細胞計數試劑盒8(cell counting kit 8,CCK-8;江蘇凱基生物技術股份有限公司);抗Runx2抗體(Abcam公司,美國);FACS緩沖液(BD Biosciences公司,美國);抗CD29、CD105、CD34、CD45流式抗體(BioLegend公司,美國);TRIzol試劑(Life Technologies公司,美國);ALP染色試劑盒(上海碧云天生物技術有限公司); PrimeScript RT逆轉錄試劑盒、SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)試劑盒(TaKaRa公司,日本);羊抗鼠IgG2b-辣根過氧化物酶標記二抗(武漢賽維爾生物科技有限公司);DAB顯色試劑盒(北京索萊寶科技有限公司);ELISA 檢測試劑盒(武漢賽培生物科技有限公司)。
超速離心機(Beckman公司,美國);酶標儀(Omega公司,德國);倒置相差顯微鏡(Olympus公司,日本);實時熒光定量PCR儀(Bio-Rad公司,美國);流式細胞儀(BD公司,美國);Micro-CT(Scanco Medical公司,瑞士);Image-Pro Plus軟件(Media Cybernetics公司,美國);GraphPad Prism軟件(GraphPad Software公司,美國)。
1.2 體外實驗
1.2.1 BMSCs分離培養及鑒定
取7只4周齡小鼠,過量麻醉處死后置于75%乙醇5 min;分離股骨及脛骨,剪開長骨兩端,以適量α-MEM培養基沖洗骨髓腔,收集沖洗液;以離心半徑13 cm、
取對數生長期第3代細胞行細胞表型鑒定,流式細胞學檢測示細胞表型標志物CD29、CD105呈陽性表達,表達率分別為96.38%、97.81%;CD34、CD45呈陰性表達,表達率分別為1.26%、0.82%。分離培養細胞符合MSCs表達特性,取第3代細胞用于下一步實驗。
1.2.2 Rspo2對BMSCs活性的影響
取BMSCs以1×104個/孔密度接種于96孔板,于37℃、5%CO2孵箱中孵育24 h后,分別加入濃度為10、20、40、80和100 nmol/L的Rspo2共培養24 h,以正常培養BMSCs作為對照;每個濃度取6孔細胞,采用CCK-8法觀測增殖情況,記錄450 nm處吸光度(A)值,取均值。觀察不同濃度Rspo2處理后BMSCs增殖差異。并選取24 h細胞活性最強的濃度組連續培養24、48、72 h,并與對照組比較,觀察Rspo2對BMSCs增殖的影響。篩選不影響細胞活性的Rspo2濃度進行后續實驗
1.2.3 Rspo2對BMSCs成骨能力的影響
將BMSCs以1×106個/孔接種于12孔板,孔板中分別滴加篩選的不同濃度Rspo2以及含15%FBS的α-MEM培養基;于37℃、5%CO2 孵箱中培養5 d后,加入25 μg/mL維生素C和5 mmol/L β-甘油磷酸以誘導成骨分化;誘導培養7 d后,取細胞進行ALP染色及實時熒光定量PCR(real time fluorescence quantitative PCR,RT-qPCR)檢測。以正常培養BMSCs作為對照。
① ALP染色:將細胞固定于10%甲醛15 min,PBS清洗3遍后加入ALP染色液,室溫下孵育30 min后移除染色液,光鏡下觀察呈藍紫色的陽性細胞,采用Image-Pro Plus軟件測量ALP陽性細胞面積。實驗重復3次。
② RT-qPCR檢測:取細胞采用TRIzol試劑分離總RNA后,以PrimeScript RT逆轉錄試劑盒轉化為cDNA,使用SYBR Premix Ex TaqⅡ試劑盒進行RCR擴增。熱循環條件:95℃初始變性30 s,95℃ 5 s、60℃ 20 s、72℃ 15 s,共40個循環。以GAPDH為內參,采用2–ΔΔCt方法計算成骨相關基因RUNX家族轉錄因子2(RUNX family transcription factor 2,Runx2)、Ⅰ型膠原(collagen type Ⅰ alpha 1,Col1)、骨鈣素(osteocalcin,OCN)相對表達量。實驗重復3次。引物序列見表1。
1.3 動物實驗
1.3.1 動物模型制備及分組
取18只10周齡小鼠隨機分為3組:假手術組、卵巢去勢(ovariectomy,OVX)組和OVX+Rspo2組,每組6只。腹腔注射10%水合氯醛(0.04 mL/10 g)麻醉后,假手術組僅行雙側背部切開縫合,其余兩組通過雙側OVX建立骨質疏松模型。術后OVX+Rspo2組每周腹腔注射Rspo2(1 mg/kg)[11],假手術組和OVX組接受相同劑量生理鹽水。干預12周后,3組采用心臟取血方法獲得全血,處死后取脛骨、子宮進行觀測。
1.3.2 觀測指標
① 一般情況:觀察術后各組小鼠存活情況,稱重小鼠體質量及子宮質量,評估OVX模型制備是否成功。
② 組織學及免疫組織化學染色: 將部分小鼠脛骨按順序分別置于4%多聚甲醛4℃固定24 h、15%乙二胺四乙酸(pH7.2)脫鈣14 d后,石蠟包埋、厚2~5 μm切片。取部分切片行常規HE染色,光鏡下觀察骨小梁數量、排列疏松度及連接性。剩余切片脫蠟水化后PBS洗滌,3%H2O2中孵育30 min以抑制內源性過氧化物酶活性,然后應用Runx2一抗(1∶200)4℃孵育過夜,PBS洗滌后應用羊抗鼠IgG2b-辣根過氧化物酶標記二抗室溫下孵育1 h,DAB顯色;光鏡下觀察陽性染色細胞,Image-Pro Plus軟件對Runx2陽性表達進行定量分析。
③ ELISA檢測:將小鼠全血以離心半徑13 cm、1 200 r/min離心10 min,取血清按ELISA檢測試劑盒標準操作步驟,檢測小鼠血清骨代謝標記物Ⅰ型前膠原氨基端肽(type Ⅰ procollagen aminoter-minal peptide,PINP)、ALP、OCN以及骨吸收標記物β膠原降解產物(β-isomerized C-telopeptide,β-CTX)含量。
④ Micro-CT 檢測:將剩余小鼠脛骨置于4%多聚甲醛固定過夜后行Micro-CT掃描分析。掃描參數:電壓89 kV、電流112 μA、厚度20 μm。采用自帶SCANCO Evaluation軟件對脛骨截面圖像行三維組織形態計量分析,包括骨小梁厚度(trabeculae thickness,Tb.Th)、骨小梁數量(trabeculae number,Tb.N)、骨小梁分離度(trabeculae separation,Tb.Sp)和骨體積分數(bone volume fraction,BV/TV)。
1.4 統計學方法
采用GraphPad Prism軟件進行統計分析。計量資料經Shapiro-Wilk檢驗均符合正態分布,數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;檢驗水準α=0.05。
2 結果
2.1 體外實驗
2.1.1 Rspo2對BMSCs活性的影響
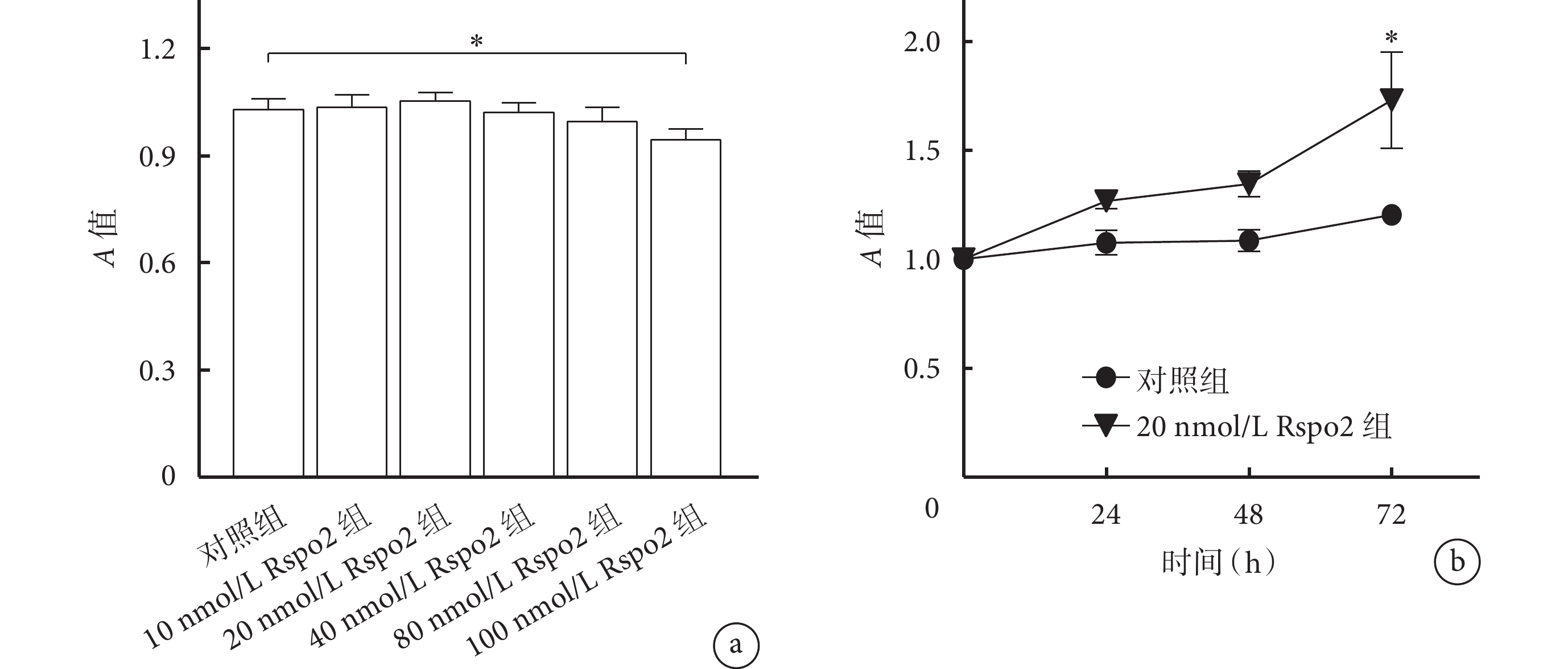
CCK-8檢測示,培養24 h后100 nmol/L Rspo2組A值低于對照組,差異有統計學意義(P<0.05);其余濃度Rspo2組A值與對照組比較,差異均無統計學意義(P>0.05),其中20 nmol/L Rspo2組細胞活性最強。隨培養時間延長,20 nmol/L Rspo2組A值逐漸升高,其中72 h時A值明顯高于對照組,差異有統計學意義(P<0.05)。見圖1。基于上述結果,選擇10、20和40 nmol/L Rspo2進行后續實驗。
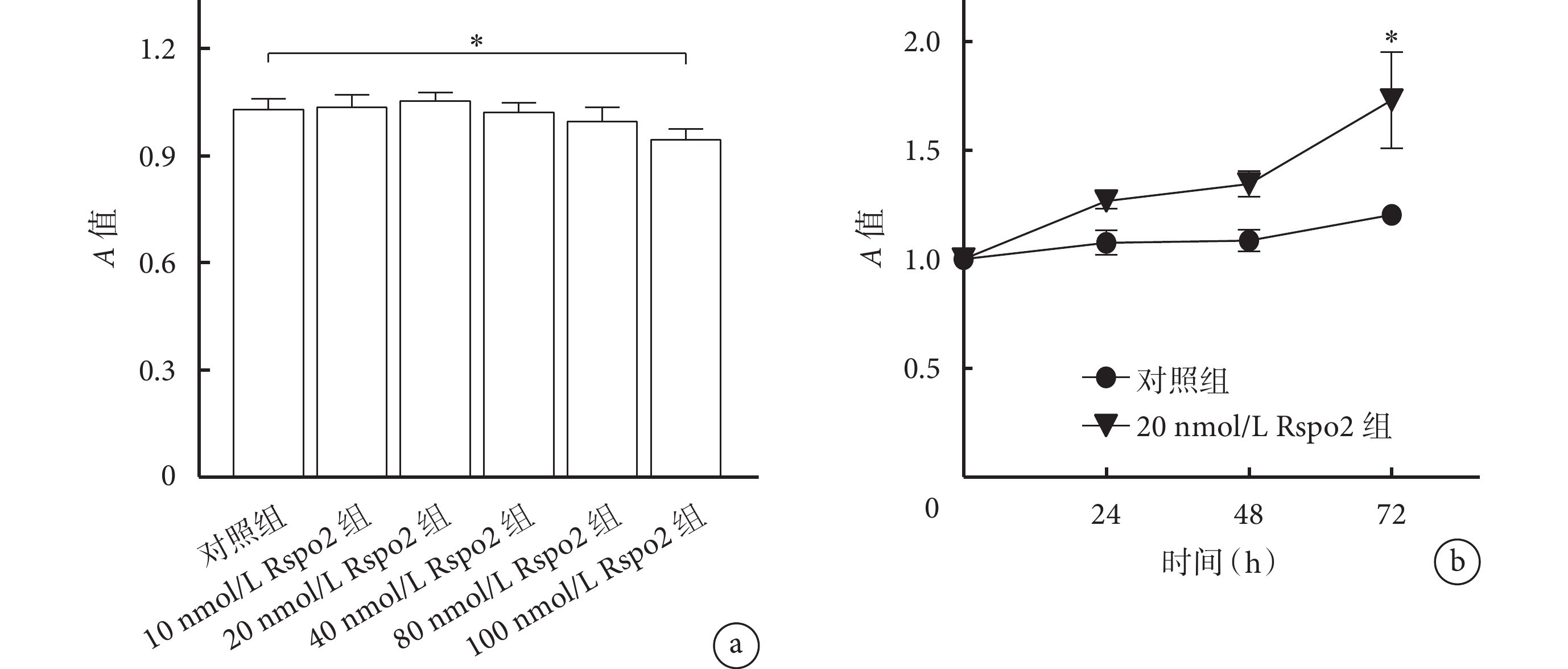 圖1
CCK-8檢測Rspo2對BMSCs活性的影響
圖1
CCK-8檢測Rspo2對BMSCs活性的影響
*
*
2.1.2 Rspo2對BMSCs成骨能力的影響
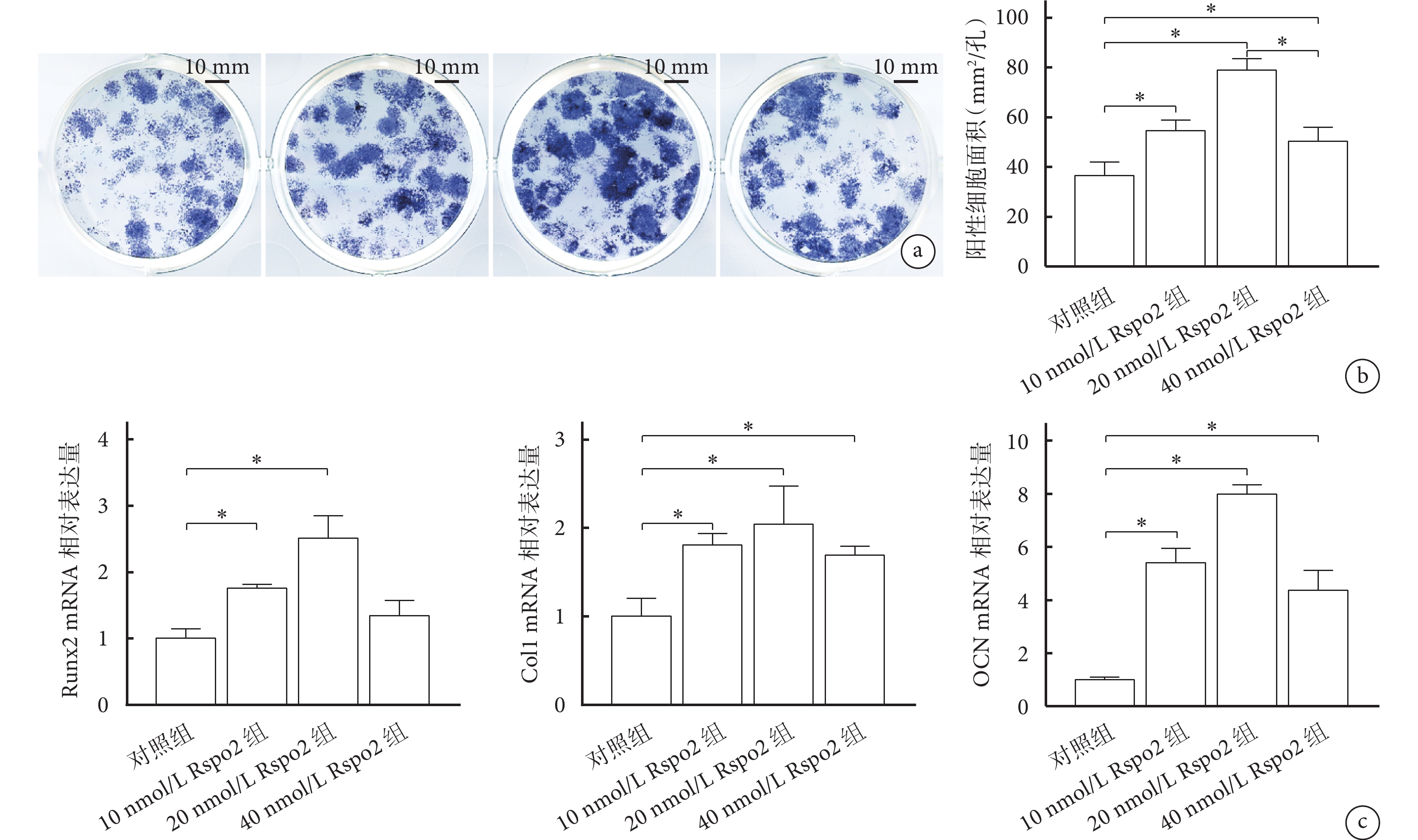
① ALP染色:成骨誘導培養7 d后,鏡下觀察陽性細胞的細胞膜和細胞質內均可見大量散在、深染的藍紫色顆粒,疊加成結節狀。各濃度Rspo2組陽性細胞面積明顯大于對照組,其中20 nmol/L Rspo2組最高,組間差異有統計學意義(P<0.05)。見圖2a、b。
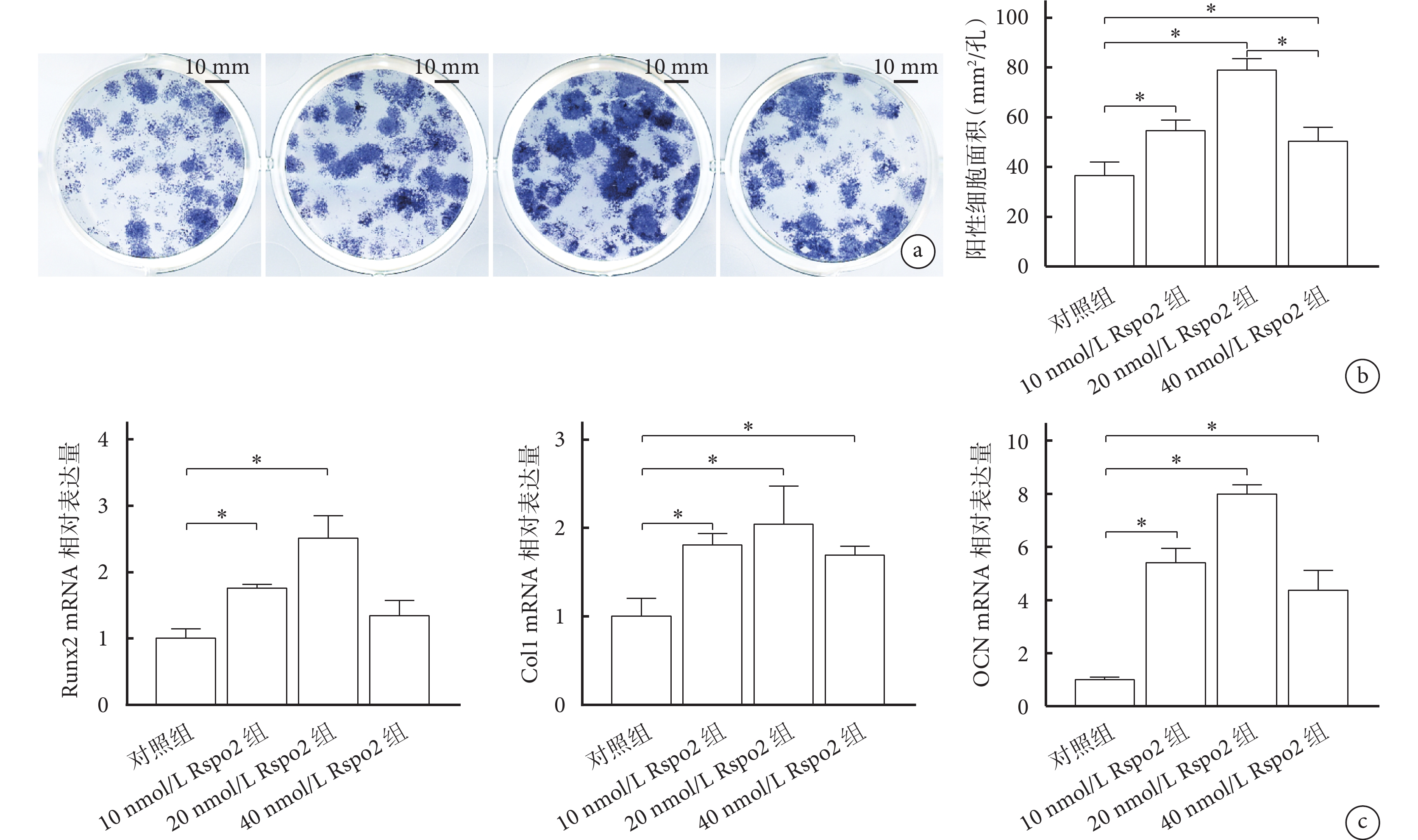 圖2
Rspo2對BMSCs成骨分化的影響
圖2
Rspo2對BMSCs成骨分化的影響
*
*
② RT-qPCR檢測:各濃度Rspo2組成骨相關基因相對表達量均高于對照組。其中,10、20 nmol/L Rspo2組Runx2、Col1和OCN及40 nmol/L Rspo2組Col1和OCN 相對表達量與對照組相比,差異有統計學意義(P<0.05)。見圖2c。
2.2 動物實驗
2.2.1 一般情況
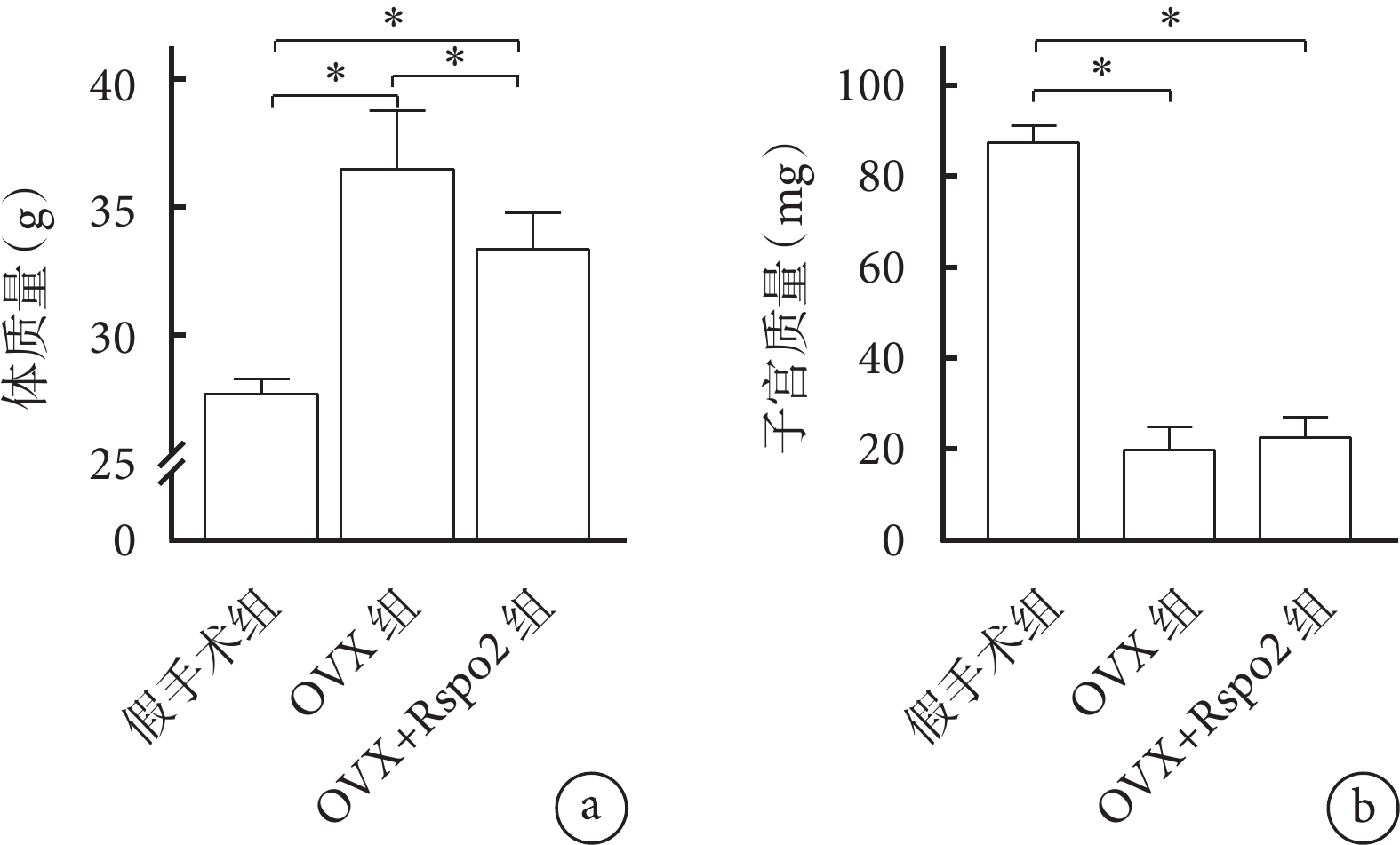
各組小鼠術后均存活至實驗完成。干預12周后,OVX組、OVX+Rspo2組小鼠體質量均較假手術組增加,但OVX+Rspo2組低于OVX組,組間差異均有統計學意義(P<0.05)。OVX組、OVX+Rspo2組子宮質量低于假手術組,差異均有統計學意義(P<0.05);OVX+Rspo2組較OVX組有所增加,但組間差異無統計學意義(P>0.05)。見圖3。上述結果提示小鼠OVX模型制備成功。
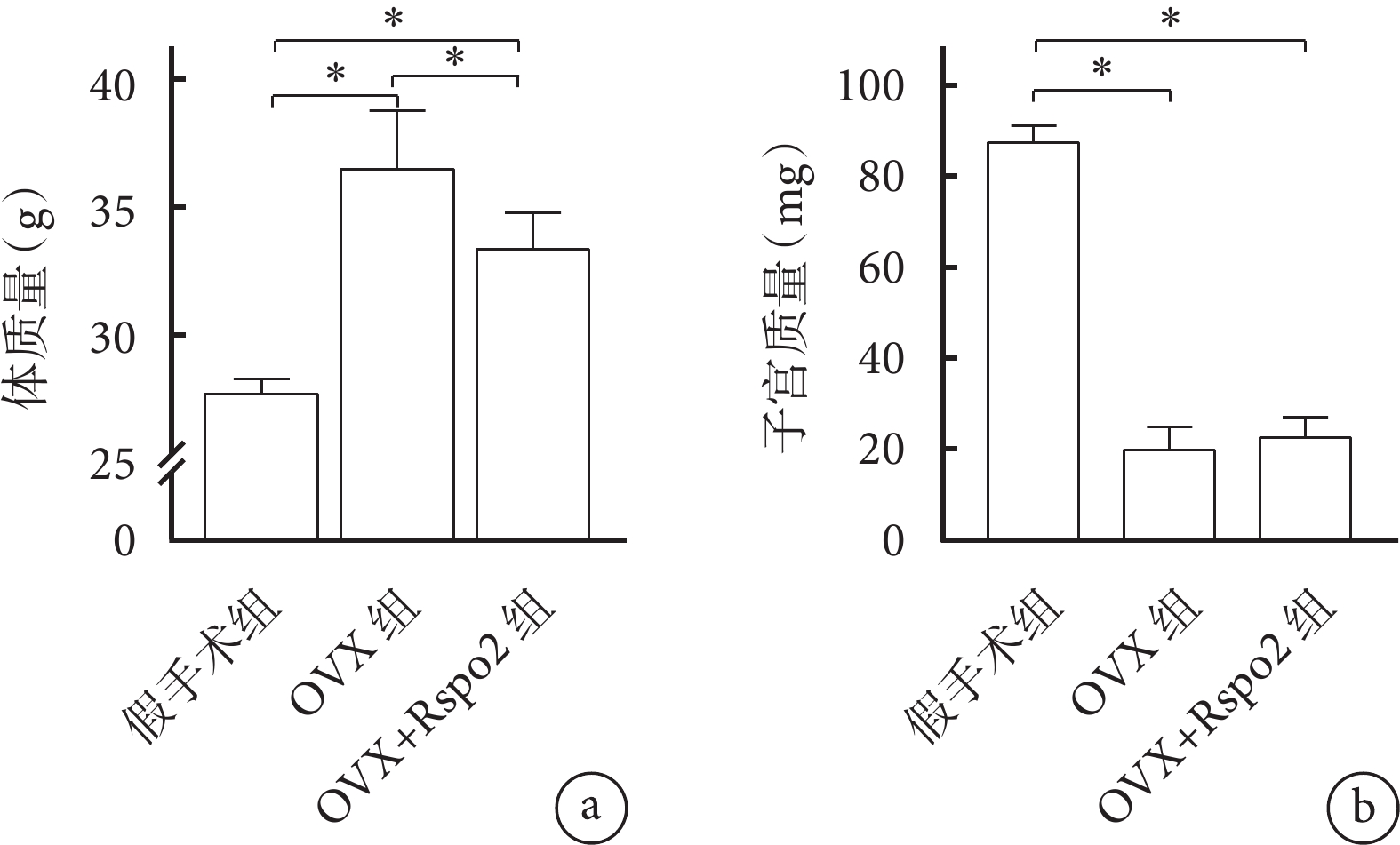 圖3
小鼠體質量及子宮質量比較
圖3
小鼠體質量及子宮質量比較
*
*
2.2.2 組織學及免疫組織化學染色
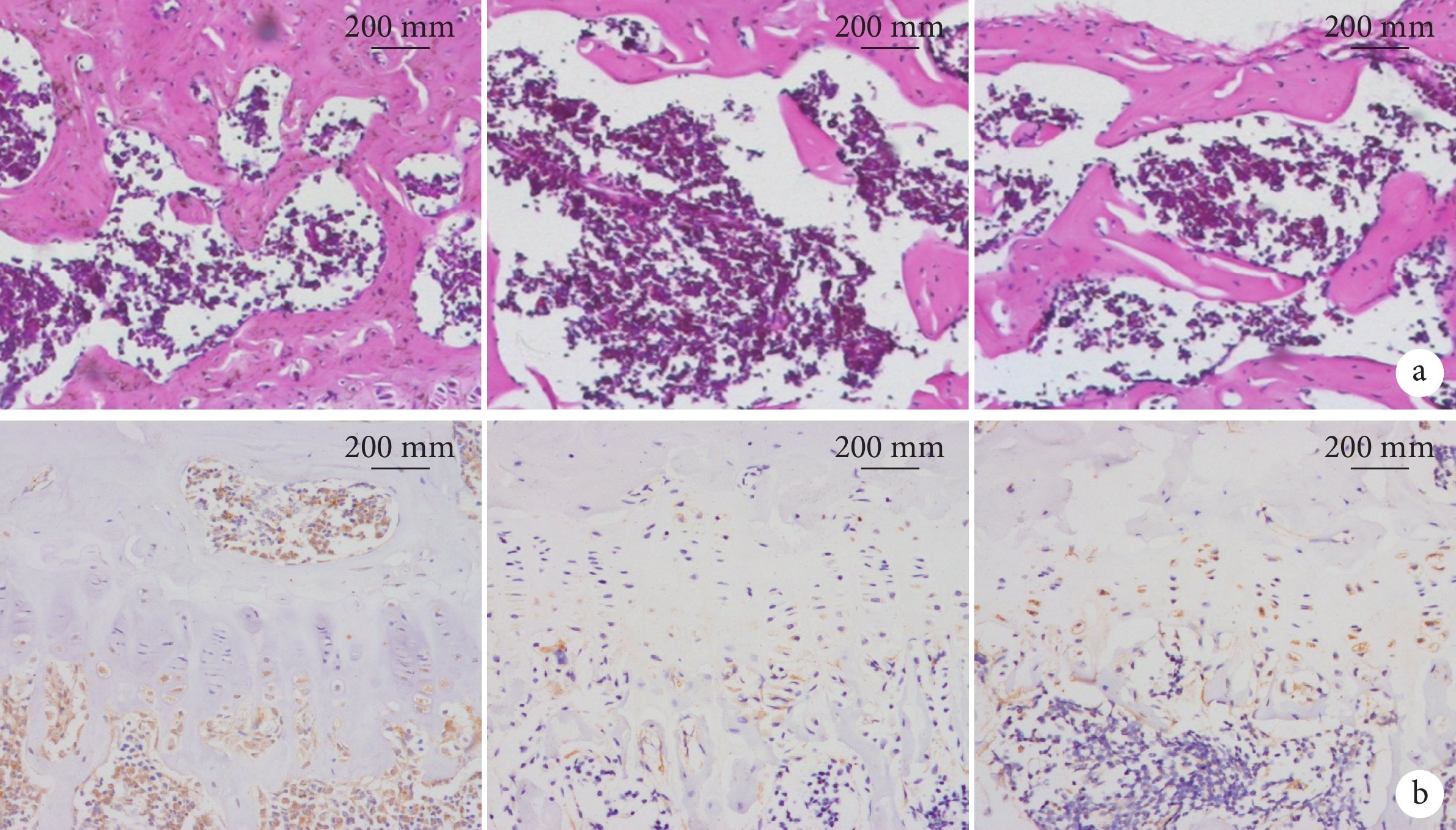
HE染色示,與假手術組相比,OVX組小鼠骨小梁排列疏松、骨小梁寬度增加、數量減少且小梁間連接性差,而OVX+Rspo2組這一現象明顯改善。見圖4a。
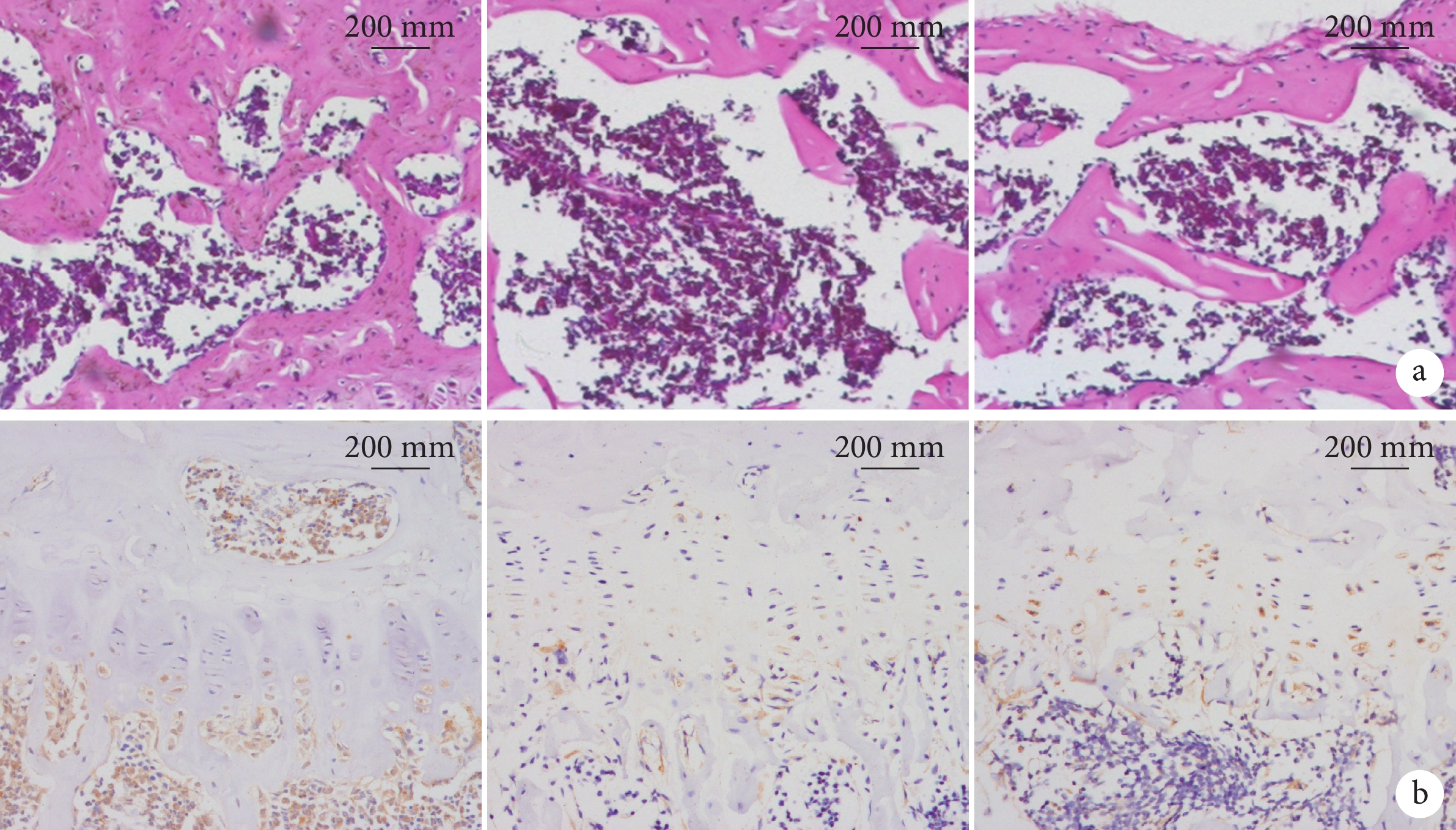 圖4
小鼠脛骨組織學及免疫組織化學染色觀察(×20)
圖4
小鼠脛骨組織學及免疫組織化學染色觀察(×20)
從左至右分別為假手術組、OVX組、OVX+Rspo2組 a. HE染色;b. Runx2免疫組織化學染色
Figure4. Histological and immunohistochemical staining of mice tibia (×20)From left to right for sham group, OVX group, and OVX+Rspo2 group, respectively a. HE staining; b. Runx2 immunohistochemical staining
免疫組織化學染色示,假手術組、OVX組以及OVX+Rspo2組Runx2陽性表達分別為62.98±5.73、23.83±6.65、38.52±6.05。與假手術組相比OVX組表達降低,而OVX+Rspo2組經Rspo2干預后表達較OVX組增加,但尚未達假手術組水平,組間差異均有統計學意義(P<0.05)。見圖4b。
2.2.3 ELISA檢測
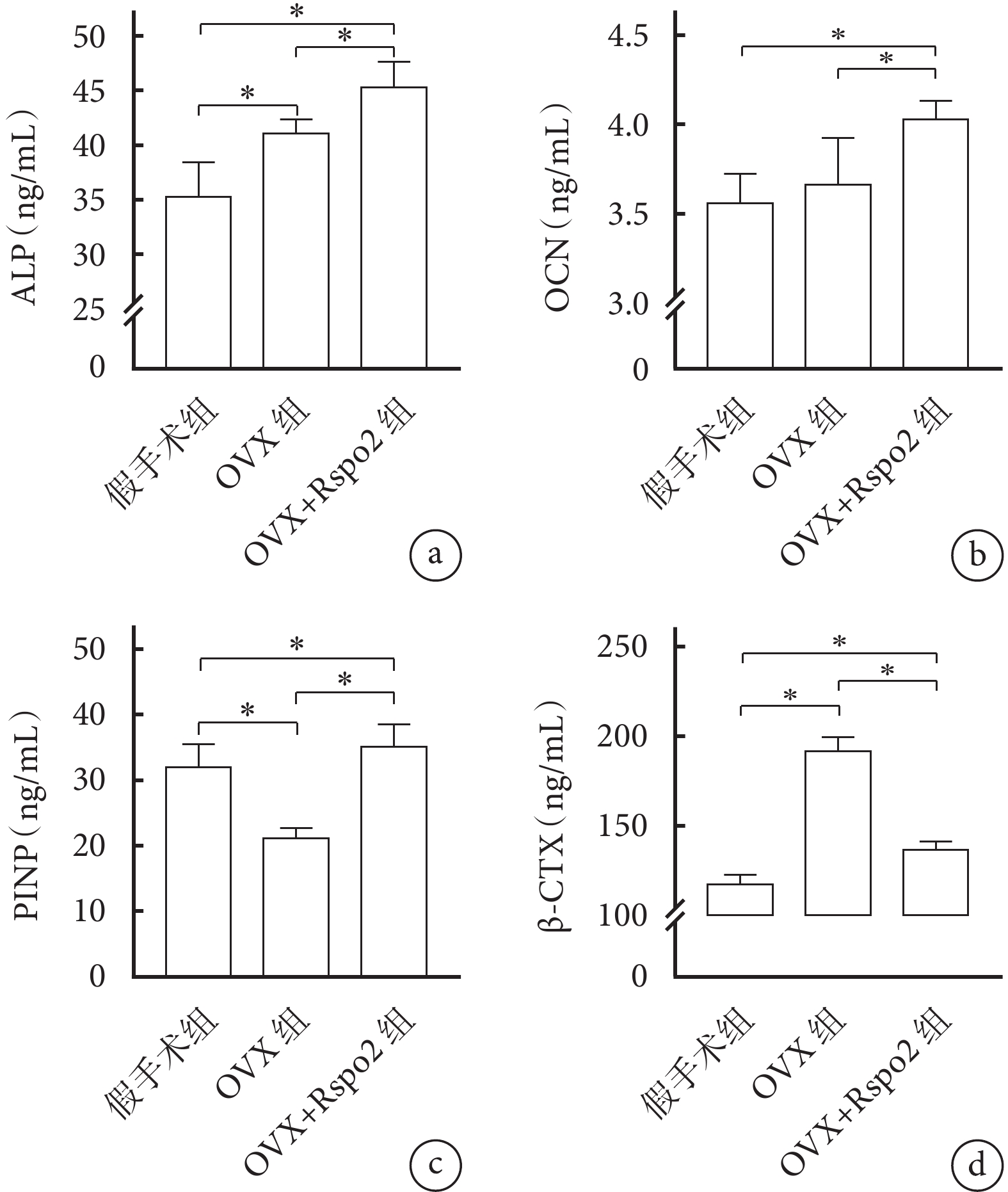
① 骨代謝標記物:與假手術組相比,OVX組ALP表達升高、PINP表達下降,差異有統計學意義(P<0.05);OCN組間差異無統計學意義(P>0.05)。OVX+Rspo2組經Rspo2干預后,PINP表達得到逆轉,且ALP、OCN表達亦維持在較高水平,均高于假手術組及OVX組,差異有統計學意義(P<0.05)。② 骨吸收標記物: OVX組β-CTX高于假手術組;OVX+Rspo2組較OVX組明顯下降,但尚未達假手術組水平;組間差異均有統計學意義(P<0.05)。見圖5。
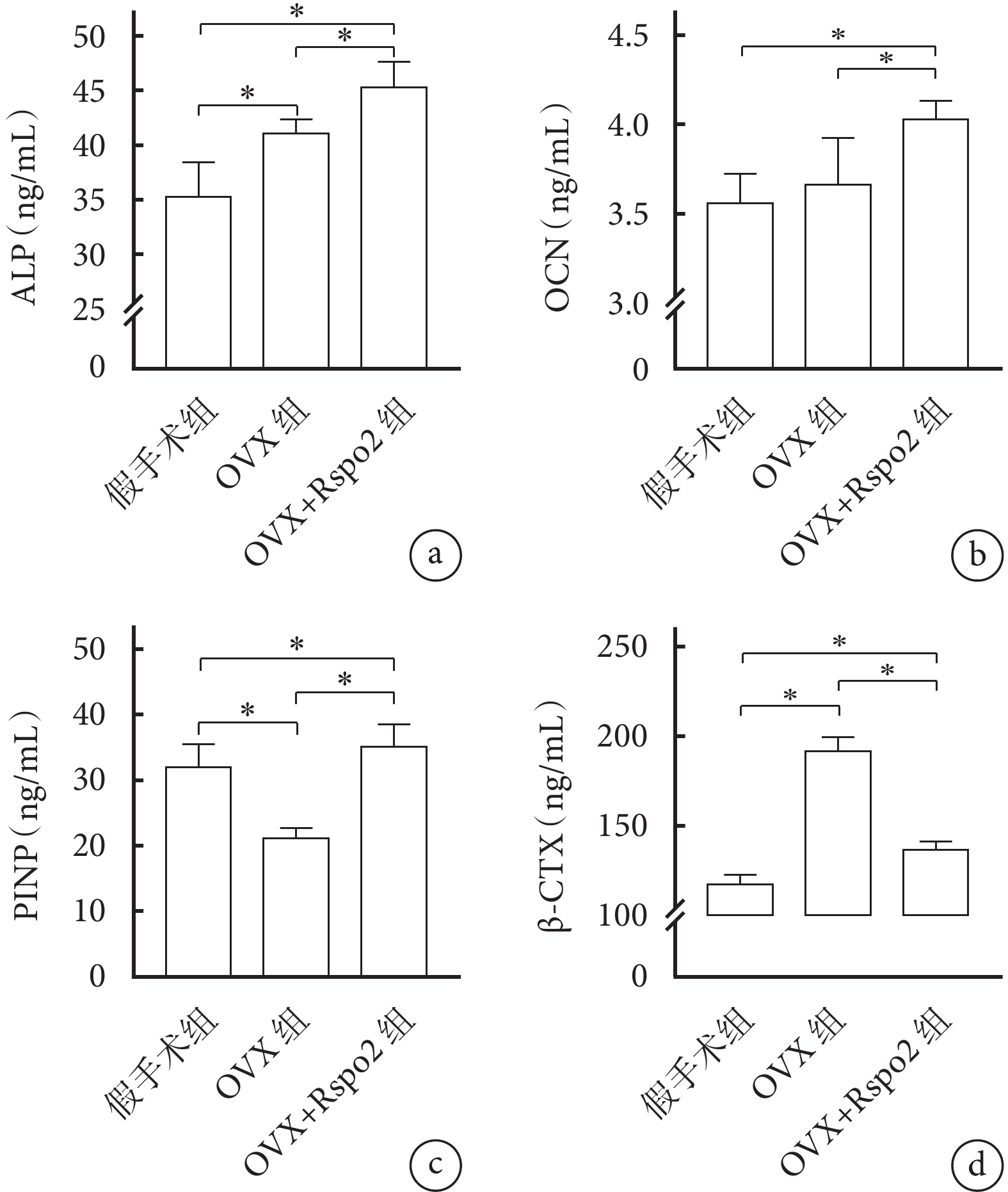 圖5
ELISA檢測血清骨代謝及骨吸收標記物表達
圖5
ELISA檢測血清骨代謝及骨吸收標記物表達
*
*
2.2.4 Micro-CT 檢測
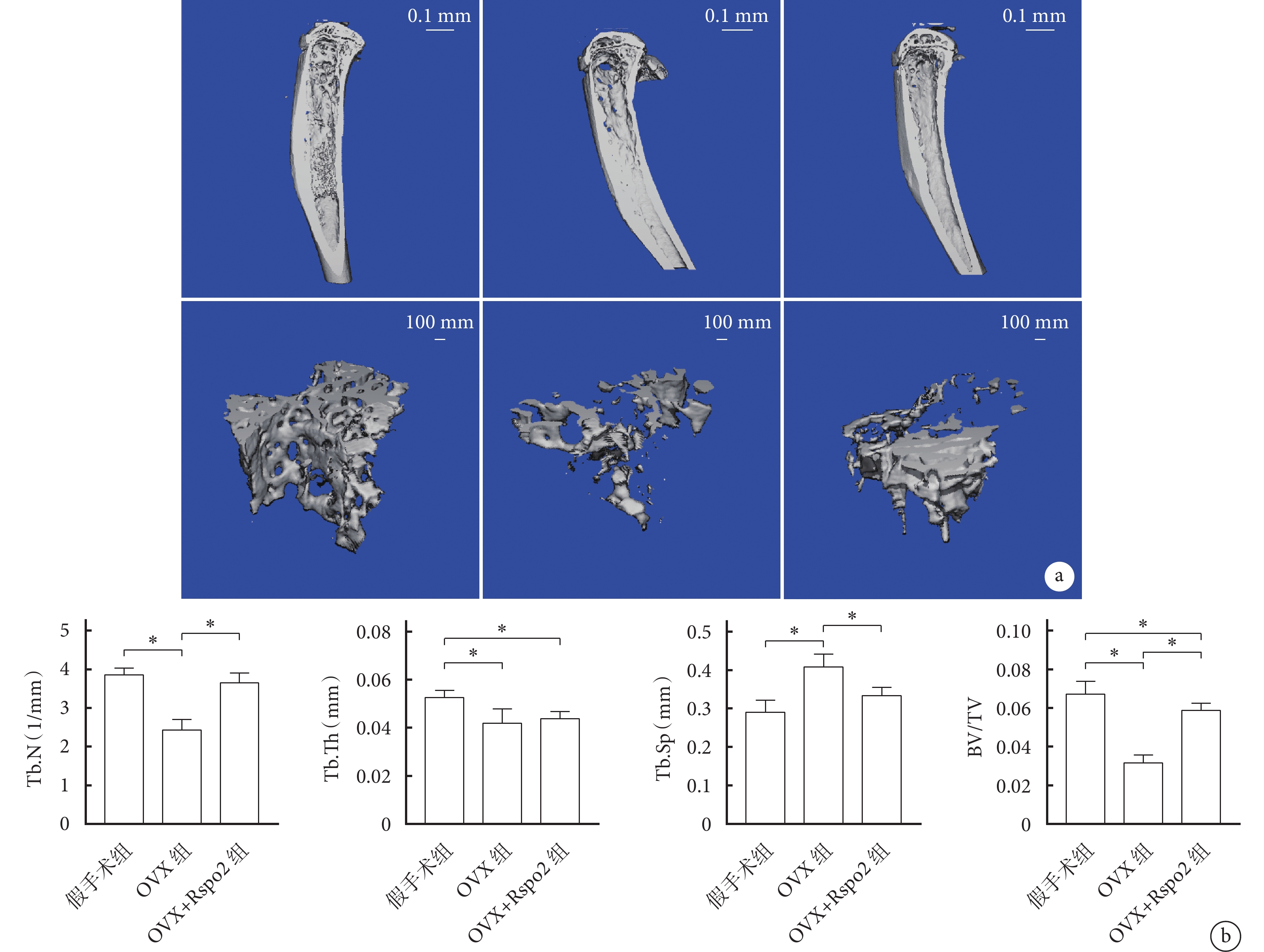
與假手術組相比,OVX組Tb.Th、Tb.N和BV/TV降低,而Tb.Sp增高,差異均有統計學意義(P<0.05)。與OVX組相比,OVX+Rspo2組BV/TV、Tb.N增高、Tb.Sp降低,差異有統計學意義(P<0.05);Tb.Th組間差異無統計學意義(P>0.05)。OVX+Rspo2組BV/TV、Tb.Th仍低于假手術組,差異有統計學意義(P<0.05);Tb.N和Tb.Sp與假手術組差異無統計學意義(P>0.05)。見圖6。
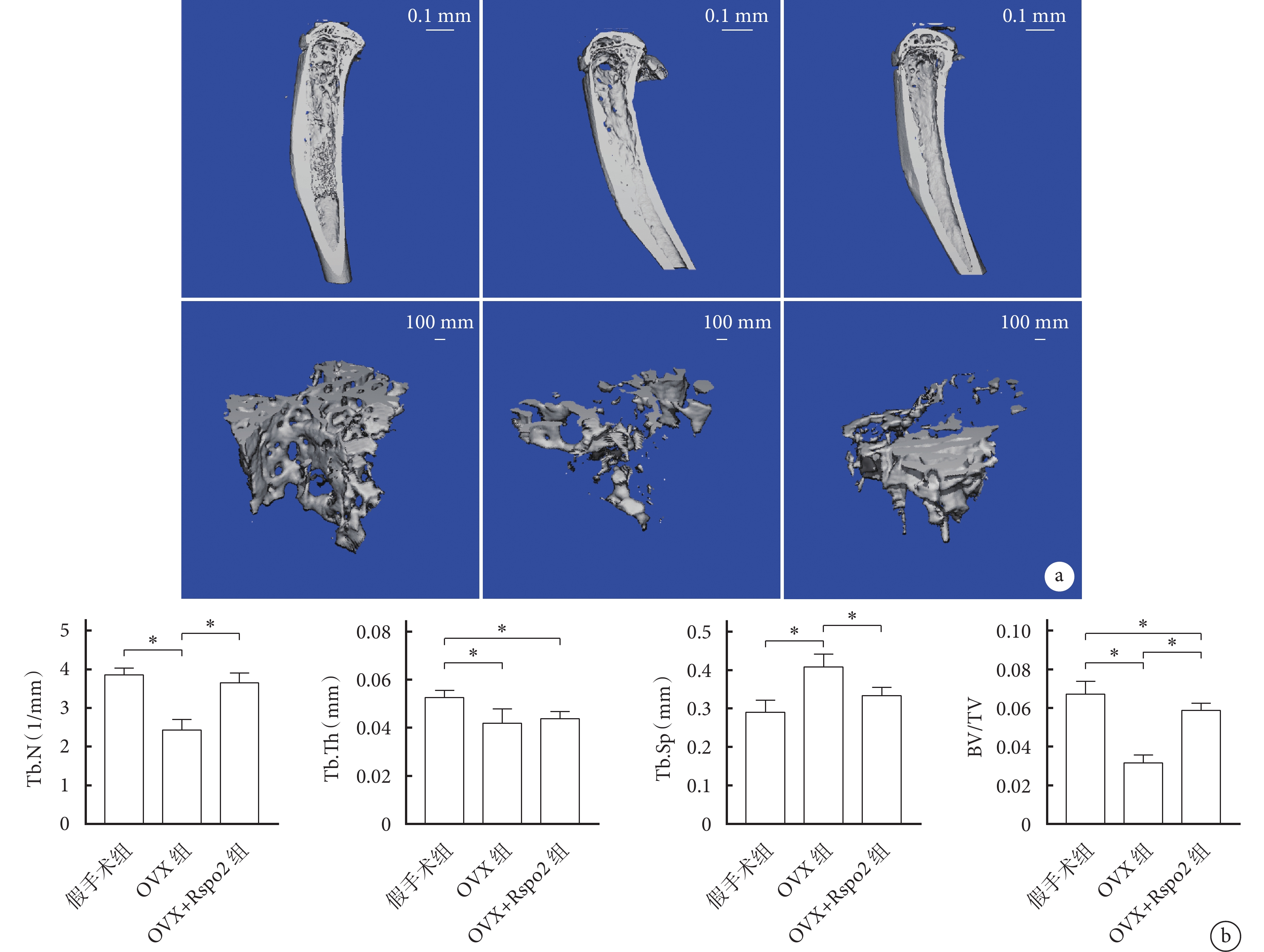 圖6
小鼠脛骨Micro-CT檢測
圖6
小鼠脛骨Micro-CT檢測
a. 脛骨三維重建圖 從左至右分別為假手術組、OVX組、OVX+Rspo2組; b. 骨參數定量分析 *
a. Three-dimensional reconstruction of tibia From left to right for sham group, OVX group, and OVX+Rspo2 group, respectively; b. Quantitative analysis of bone parameters *
3 討論
骨質疏松癥是一種與年齡相關的疾病,其特征是骨密度和骨量下降,會引起嚴重社會問題[12]。骨質疏松癥的主要病因尚不清楚,包括內分泌、營養和遺傳因素在內的各種病因都會導致骨質疏松[13]。其臨床治療主要包括抗骨吸收和促骨形成藥物,盡管這些藥物可以延緩骨質疏松癥的發展,但雙磷酸鹽和特立帕肽在治療后會損害骨重塑并導致骨壞死[14-15]。在本研究中,我們使用OVX小鼠模型來模擬絕經后骨質疏松癥。OVX小鼠骨密度下降主要歸因于破骨細胞壽命延長和破骨細胞增加[16],雌激素水平降低將導致成骨細胞數量和活性降低。使用通過增加成骨細胞增殖或誘導成骨細胞分化和減少破骨細胞數量發揮作用的藥物,可以增強骨形成并減少骨質疏松癥。本研究結果顯示,OVX小鼠脛骨區域內骨小梁大片融合,骨小梁稀疏度增加,小梁間連接性差,取而代之出現巨大空腔,而Rspo2干預后顯著改善了OVX小鼠脛骨骨小梁微結構,骨小梁的密度及小梁間連接性顯著改善。這表明Rspo2在OVX誘導的骨丟失過程中對成骨調節起到積極作用。
Rspos是一組由4種相關分泌蛋白組成的蛋白質,在器官發育、成體干細胞存活以及癌癥發展中起著關鍵作用[17]。它們最初被分離為含有血小板反應蛋白結構域的基因,在神經元管的頂板中高表達,因此被稱為“反應蛋白”。小鼠Rspo2基因敲除會導致胚胎死亡,這是因為肺和四肢發育存在重大缺陷[18]。一項研究表明,Rspo2通過促進破骨細胞生成來加速骨溶解[19]。骨形成和骨吸收是骨重建過程中發生的兩種主要活動,盡管骨吸收的減少可以減緩骨質疏松癥的發展,但骨量并不能顯著有效增加以抵抗骨質疏松癥導致的病理性骨折頻發。因此,本研究中我們探討了Rspo2對體外BMSCs成骨分化和OVX誘導的體內骨丟失的影響。ALP是一種細胞膜相關酶,在礦物沉積的早期提供高濃度磷酸鹽,ALP活性與礦化開始前成骨細胞中細胞外基質的形成相關,并被公認為成骨細胞分化的標志[20]。本研究結果表明,Rspo2干預能顯著增加BMSCs成骨分化過程中ALP的表達量,且二者表達在一定程度上成現正相關趨勢,說明Rspo2可能在成骨分化過程中有重要作用。
成骨細胞的分化過程通常分為間充質祖細胞、前成骨細胞和成骨細胞階段。成骨細胞通常以OCN表達為特征,而成骨前細胞通常被認為表達轉錄因子Runx2,或者在更晚期的分化階段同時表達Runx2和鋅指蛋白,后者是包括OCN和ALP在內的關鍵成骨蛋白的主要轉錄因子[21]。成骨分化是一個復雜過程,導致礦化細胞外基質的形成。大量調節因子參與成骨分化。Runx2是成骨細胞分化的重要轉錄因子,與關鍵成骨細胞特異性基因的啟動子區域直接相互作用[22]。有研究顯示Runx2可能是更年期婦女骨代謝的有用遺傳標記,并可能在骨密度中發揮重要作用[23]。OCN是一種編碼骨鈣素的基因,在骨骼形成和骨質疏松等骨代謝過程中起重要作用[24]。Col1是骨細胞外基質的重要成分,它將細胞表面整合素與其他細胞外基質蛋白連接起來,作為成骨細胞產生的分泌糖蛋白[25]。本研究發現BMSCs成骨分化過程中,Rspo2處理后成骨細胞標記基因Runx2、OCN、ALP和Col1表達量顯著提升,說明Rspo2在祖細胞成骨分化中起到重要作用。但骨形成是一個復雜且連續過程,諸多基因及生物因子交互作用,本研究只是明確了Rspo2能夠促進祖細胞的成骨分化,但具體作用機制仍需后續研究明確。
綜上述,Rspo2通過在組織和細胞水平上調Runx2、ALP和OCN來促進成骨,從而促進BMSCs向成骨細胞譜系分化,進一步支持了Rspo2作為一種潛在的骨質疏松治療策略的實用性。在未來研究中,我們將進行藥代動力學、毒理學分析及隨機對照研究,驗證Rspo2對于刺激絕經后婦女骨形成以及伴隨癥狀功效,探討其潛在作用機制。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經天津醫院醫學倫理委員會批準(2024醫倫局預019);實驗動物使用許可證號:SYXK(津)2023-011
作者貢獻聲明 柳鑫:研究設計、數據分析及論文撰寫;石博文:動物模型制作及數據收集;蔡成闊,王昊天:數據收集整理及統計分析;賈鵬:研究設計及論文指導
骨質疏松癥是一種常見的全身性骨骼疾病,其特點是骨礦物質密度低和骨質微結構退化,從而降低了骨強度,脆性骨折風險增加[1],目前臨床尚缺少安全、有效的治療手段。骨量是通過成骨細胞骨形成和破骨細胞骨吸收的持續骨重塑來控制,如兩者之間平衡打破,骨形成速度低于骨吸收,就會導致骨質疏松癥。BMSCs由祖細胞和多能骨骼干細胞組成,可在體外分化為成骨細胞、骨細胞、脂肪細胞和軟骨細胞[2]。目前,研究表明幾乎所有成骨細胞都來源于BMSCs[3],由于BMSCs可分化成骨骼細胞表型,因此被認為是最理想的骨代謝研究對象[4]。
脊椎蛋白(R-spondin,Rspo)家族由4種分泌型糖蛋白(Rspo1~4)組成[5],與發育和癌癥等許多疾病病理性改變密切相關[6-7]。研究顯示小鼠體內缺失Rspo受體LGR4會導致骨形成減少和骨吸收增加,發生骨質丟失,表明Rspo表達對維持骨代謝穩態至關重要[8]。Rspo2基因敲除小鼠表現出面部骨骼缺陷、遠端肢體缺失和肺發育不全[9]。此外,骨關節炎患者體內的Rspo2 mRNA和蛋白表達量均減少,Rspo2表達下調會抑制體內成骨細胞礦化,而且重組Rspo2則能提高此類患者成骨細胞礦化度[10]。然而,Rspo2對BMSCs誘導骨形成和分化的影響尚不清楚。為此,本研究擬探究Rspo2在體外和體內對BMSCs向成骨分化的影響和其具體作用機制。
1 材料與方法
1.1 實驗動物及主要試劑、儀器
雌性C57BL/6小鼠25只,其中10周齡小鼠18只,體質量21~24 g;4周齡小鼠7只,體質量12~14 g;均由華阜康生物科技股份有限公司提供。實驗前適應性喂養1周,分籠飼養,每籠最多5只,自由飲食、飲水,光照時間12 h/d,溫度25℃。
α-MEM培養基、FBS、青霉素溶液、硫酸鏈霉素、0.25%胰蛋白酶-EDTA 溶液(GIBCO公司,美國);Rspo2重組蛋白(R&D公司,美國);HE染色液(Sigma-Aldrich公司,美國);細胞計數試劑盒8(cell counting kit 8,CCK-8;江蘇凱基生物技術股份有限公司);抗Runx2抗體(Abcam公司,美國);FACS緩沖液(BD Biosciences公司,美國);抗CD29、CD105、CD34、CD45流式抗體(BioLegend公司,美國);TRIzol試劑(Life Technologies公司,美國);ALP染色試劑盒(上海碧云天生物技術有限公司); PrimeScript RT逆轉錄試劑盒、SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)試劑盒(TaKaRa公司,日本);羊抗鼠IgG2b-辣根過氧化物酶標記二抗(武漢賽維爾生物科技有限公司);DAB顯色試劑盒(北京索萊寶科技有限公司);ELISA 檢測試劑盒(武漢賽培生物科技有限公司)。
超速離心機(Beckman公司,美國);酶標儀(Omega公司,德國);倒置相差顯微鏡(Olympus公司,日本);實時熒光定量PCR儀(Bio-Rad公司,美國);流式細胞儀(BD公司,美國);Micro-CT(Scanco Medical公司,瑞士);Image-Pro Plus軟件(Media Cybernetics公司,美國);GraphPad Prism軟件(GraphPad Software公司,美國)。
1.2 體外實驗
1.2.1 BMSCs分離培養及鑒定
取7只4周齡小鼠,過量麻醉處死后置于75%乙醇5 min;分離股骨及脛骨,剪開長骨兩端,以適量α-MEM培養基沖洗骨髓腔,收集沖洗液;以離心半徑13 cm、
取對數生長期第3代細胞行細胞表型鑒定,流式細胞學檢測示細胞表型標志物CD29、CD105呈陽性表達,表達率分別為96.38%、97.81%;CD34、CD45呈陰性表達,表達率分別為1.26%、0.82%。分離培養細胞符合MSCs表達特性,取第3代細胞用于下一步實驗。
1.2.2 Rspo2對BMSCs活性的影響
取BMSCs以1×104個/孔密度接種于96孔板,于37℃、5%CO2孵箱中孵育24 h后,分別加入濃度為10、20、40、80和100 nmol/L的Rspo2共培養24 h,以正常培養BMSCs作為對照;每個濃度取6孔細胞,采用CCK-8法觀測增殖情況,記錄450 nm處吸光度(A)值,取均值。觀察不同濃度Rspo2處理后BMSCs增殖差異。并選取24 h細胞活性最強的濃度組連續培養24、48、72 h,并與對照組比較,觀察Rspo2對BMSCs增殖的影響。篩選不影響細胞活性的Rspo2濃度進行后續實驗
1.2.3 Rspo2對BMSCs成骨能力的影響
將BMSCs以1×106個/孔接種于12孔板,孔板中分別滴加篩選的不同濃度Rspo2以及含15%FBS的α-MEM培養基;于37℃、5%CO2 孵箱中培養5 d后,加入25 μg/mL維生素C和5 mmol/L β-甘油磷酸以誘導成骨分化;誘導培養7 d后,取細胞進行ALP染色及實時熒光定量PCR(real time fluorescence quantitative PCR,RT-qPCR)檢測。以正常培養BMSCs作為對照。
① ALP染色:將細胞固定于10%甲醛15 min,PBS清洗3遍后加入ALP染色液,室溫下孵育30 min后移除染色液,光鏡下觀察呈藍紫色的陽性細胞,采用Image-Pro Plus軟件測量ALP陽性細胞面積。實驗重復3次。
② RT-qPCR檢測:取細胞采用TRIzol試劑分離總RNA后,以PrimeScript RT逆轉錄試劑盒轉化為cDNA,使用SYBR Premix Ex TaqⅡ試劑盒進行RCR擴增。熱循環條件:95℃初始變性30 s,95℃ 5 s、60℃ 20 s、72℃ 15 s,共40個循環。以GAPDH為內參,采用2–ΔΔCt方法計算成骨相關基因RUNX家族轉錄因子2(RUNX family transcription factor 2,Runx2)、Ⅰ型膠原(collagen type Ⅰ alpha 1,Col1)、骨鈣素(osteocalcin,OCN)相對表達量。實驗重復3次。引物序列見表1。
1.3 動物實驗
1.3.1 動物模型制備及分組
取18只10周齡小鼠隨機分為3組:假手術組、卵巢去勢(ovariectomy,OVX)組和OVX+Rspo2組,每組6只。腹腔注射10%水合氯醛(0.04 mL/10 g)麻醉后,假手術組僅行雙側背部切開縫合,其余兩組通過雙側OVX建立骨質疏松模型。術后OVX+Rspo2組每周腹腔注射Rspo2(1 mg/kg)[11],假手術組和OVX組接受相同劑量生理鹽水。干預12周后,3組采用心臟取血方法獲得全血,處死后取脛骨、子宮進行觀測。
1.3.2 觀測指標
① 一般情況:觀察術后各組小鼠存活情況,稱重小鼠體質量及子宮質量,評估OVX模型制備是否成功。
② 組織學及免疫組織化學染色: 將部分小鼠脛骨按順序分別置于4%多聚甲醛4℃固定24 h、15%乙二胺四乙酸(pH7.2)脫鈣14 d后,石蠟包埋、厚2~5 μm切片。取部分切片行常規HE染色,光鏡下觀察骨小梁數量、排列疏松度及連接性。剩余切片脫蠟水化后PBS洗滌,3%H2O2中孵育30 min以抑制內源性過氧化物酶活性,然后應用Runx2一抗(1∶200)4℃孵育過夜,PBS洗滌后應用羊抗鼠IgG2b-辣根過氧化物酶標記二抗室溫下孵育1 h,DAB顯色;光鏡下觀察陽性染色細胞,Image-Pro Plus軟件對Runx2陽性表達進行定量分析。
③ ELISA檢測:將小鼠全血以離心半徑13 cm、1 200 r/min離心10 min,取血清按ELISA檢測試劑盒標準操作步驟,檢測小鼠血清骨代謝標記物Ⅰ型前膠原氨基端肽(type Ⅰ procollagen aminoter-minal peptide,PINP)、ALP、OCN以及骨吸收標記物β膠原降解產物(β-isomerized C-telopeptide,β-CTX)含量。
④ Micro-CT 檢測:將剩余小鼠脛骨置于4%多聚甲醛固定過夜后行Micro-CT掃描分析。掃描參數:電壓89 kV、電流112 μA、厚度20 μm。采用自帶SCANCO Evaluation軟件對脛骨截面圖像行三維組織形態計量分析,包括骨小梁厚度(trabeculae thickness,Tb.Th)、骨小梁數量(trabeculae number,Tb.N)、骨小梁分離度(trabeculae separation,Tb.Sp)和骨體積分數(bone volume fraction,BV/TV)。
1.4 統計學方法
采用GraphPad Prism軟件進行統計分析。計量資料經Shapiro-Wilk檢驗均符合正態分布,數據以均數±標準差表示,組間比較采用單因素方差分析,兩兩比較采用LSD檢驗;檢驗水準α=0.05。
2 結果
2.1 體外實驗
2.1.1 Rspo2對BMSCs活性的影響
CCK-8檢測示,培養24 h后100 nmol/L Rspo2組A值低于對照組,差異有統計學意義(P<0.05);其余濃度Rspo2組A值與對照組比較,差異均無統計學意義(P>0.05),其中20 nmol/L Rspo2組細胞活性最強。隨培養時間延長,20 nmol/L Rspo2組A值逐漸升高,其中72 h時A值明顯高于對照組,差異有統計學意義(P<0.05)。見圖1。基于上述結果,選擇10、20和40 nmol/L Rspo2進行后續實驗。
 圖1
CCK-8檢測Rspo2對BMSCs活性的影響
圖1
CCK-8檢測Rspo2對BMSCs活性的影響
*
*
2.1.2 Rspo2對BMSCs成骨能力的影響
① ALP染色:成骨誘導培養7 d后,鏡下觀察陽性細胞的細胞膜和細胞質內均可見大量散在、深染的藍紫色顆粒,疊加成結節狀。各濃度Rspo2組陽性細胞面積明顯大于對照組,其中20 nmol/L Rspo2組最高,組間差異有統計學意義(P<0.05)。見圖2a、b。
 圖2
Rspo2對BMSCs成骨分化的影響
圖2
Rspo2對BMSCs成骨分化的影響
*
*
② RT-qPCR檢測:各濃度Rspo2組成骨相關基因相對表達量均高于對照組。其中,10、20 nmol/L Rspo2組Runx2、Col1和OCN及40 nmol/L Rspo2組Col1和OCN 相對表達量與對照組相比,差異有統計學意義(P<0.05)。見圖2c。
2.2 動物實驗
2.2.1 一般情況
各組小鼠術后均存活至實驗完成。干預12周后,OVX組、OVX+Rspo2組小鼠體質量均較假手術組增加,但OVX+Rspo2組低于OVX組,組間差異均有統計學意義(P<0.05)。OVX組、OVX+Rspo2組子宮質量低于假手術組,差異均有統計學意義(P<0.05);OVX+Rspo2組較OVX組有所增加,但組間差異無統計學意義(P>0.05)。見圖3。上述結果提示小鼠OVX模型制備成功。
 圖3
小鼠體質量及子宮質量比較
圖3
小鼠體質量及子宮質量比較
*
*
2.2.2 組織學及免疫組織化學染色
HE染色示,與假手術組相比,OVX組小鼠骨小梁排列疏松、骨小梁寬度增加、數量減少且小梁間連接性差,而OVX+Rspo2組這一現象明顯改善。見圖4a。
 圖4
小鼠脛骨組織學及免疫組織化學染色觀察(×20)
圖4
小鼠脛骨組織學及免疫組織化學染色觀察(×20)
從左至右分別為假手術組、OVX組、OVX+Rspo2組 a. HE染色;b. Runx2免疫組織化學染色
Figure4. Histological and immunohistochemical staining of mice tibia (×20)From left to right for sham group, OVX group, and OVX+Rspo2 group, respectively a. HE staining; b. Runx2 immunohistochemical staining
免疫組織化學染色示,假手術組、OVX組以及OVX+Rspo2組Runx2陽性表達分別為62.98±5.73、23.83±6.65、38.52±6.05。與假手術組相比OVX組表達降低,而OVX+Rspo2組經Rspo2干預后表達較OVX組增加,但尚未達假手術組水平,組間差異均有統計學意義(P<0.05)。見圖4b。
2.2.3 ELISA檢測
① 骨代謝標記物:與假手術組相比,OVX組ALP表達升高、PINP表達下降,差異有統計學意義(P<0.05);OCN組間差異無統計學意義(P>0.05)。OVX+Rspo2組經Rspo2干預后,PINP表達得到逆轉,且ALP、OCN表達亦維持在較高水平,均高于假手術組及OVX組,差異有統計學意義(P<0.05)。② 骨吸收標記物: OVX組β-CTX高于假手術組;OVX+Rspo2組較OVX組明顯下降,但尚未達假手術組水平;組間差異均有統計學意義(P<0.05)。見圖5。
 圖5
ELISA檢測血清骨代謝及骨吸收標記物表達
圖5
ELISA檢測血清骨代謝及骨吸收標記物表達
*
*
2.2.4 Micro-CT 檢測
與假手術組相比,OVX組Tb.Th、Tb.N和BV/TV降低,而Tb.Sp增高,差異均有統計學意義(P<0.05)。與OVX組相比,OVX+Rspo2組BV/TV、Tb.N增高、Tb.Sp降低,差異有統計學意義(P<0.05);Tb.Th組間差異無統計學意義(P>0.05)。OVX+Rspo2組BV/TV、Tb.Th仍低于假手術組,差異有統計學意義(P<0.05);Tb.N和Tb.Sp與假手術組差異無統計學意義(P>0.05)。見圖6。
 圖6
小鼠脛骨Micro-CT檢測
圖6
小鼠脛骨Micro-CT檢測
a. 脛骨三維重建圖 從左至右分別為假手術組、OVX組、OVX+Rspo2組; b. 骨參數定量分析 *
a. Three-dimensional reconstruction of tibia From left to right for sham group, OVX group, and OVX+Rspo2 group, respectively; b. Quantitative analysis of bone parameters *
3 討論
骨質疏松癥是一種與年齡相關的疾病,其特征是骨密度和骨量下降,會引起嚴重社會問題[12]。骨質疏松癥的主要病因尚不清楚,包括內分泌、營養和遺傳因素在內的各種病因都會導致骨質疏松[13]。其臨床治療主要包括抗骨吸收和促骨形成藥物,盡管這些藥物可以延緩骨質疏松癥的發展,但雙磷酸鹽和特立帕肽在治療后會損害骨重塑并導致骨壞死[14-15]。在本研究中,我們使用OVX小鼠模型來模擬絕經后骨質疏松癥。OVX小鼠骨密度下降主要歸因于破骨細胞壽命延長和破骨細胞增加[16],雌激素水平降低將導致成骨細胞數量和活性降低。使用通過增加成骨細胞增殖或誘導成骨細胞分化和減少破骨細胞數量發揮作用的藥物,可以增強骨形成并減少骨質疏松癥。本研究結果顯示,OVX小鼠脛骨區域內骨小梁大片融合,骨小梁稀疏度增加,小梁間連接性差,取而代之出現巨大空腔,而Rspo2干預后顯著改善了OVX小鼠脛骨骨小梁微結構,骨小梁的密度及小梁間連接性顯著改善。這表明Rspo2在OVX誘導的骨丟失過程中對成骨調節起到積極作用。
Rspos是一組由4種相關分泌蛋白組成的蛋白質,在器官發育、成體干細胞存活以及癌癥發展中起著關鍵作用[17]。它們最初被分離為含有血小板反應蛋白結構域的基因,在神經元管的頂板中高表達,因此被稱為“反應蛋白”。小鼠Rspo2基因敲除會導致胚胎死亡,這是因為肺和四肢發育存在重大缺陷[18]。一項研究表明,Rspo2通過促進破骨細胞生成來加速骨溶解[19]。骨形成和骨吸收是骨重建過程中發生的兩種主要活動,盡管骨吸收的減少可以減緩骨質疏松癥的發展,但骨量并不能顯著有效增加以抵抗骨質疏松癥導致的病理性骨折頻發。因此,本研究中我們探討了Rspo2對體外BMSCs成骨分化和OVX誘導的體內骨丟失的影響。ALP是一種細胞膜相關酶,在礦物沉積的早期提供高濃度磷酸鹽,ALP活性與礦化開始前成骨細胞中細胞外基質的形成相關,并被公認為成骨細胞分化的標志[20]。本研究結果表明,Rspo2干預能顯著增加BMSCs成骨分化過程中ALP的表達量,且二者表達在一定程度上成現正相關趨勢,說明Rspo2可能在成骨分化過程中有重要作用。
成骨細胞的分化過程通常分為間充質祖細胞、前成骨細胞和成骨細胞階段。成骨細胞通常以OCN表達為特征,而成骨前細胞通常被認為表達轉錄因子Runx2,或者在更晚期的分化階段同時表達Runx2和鋅指蛋白,后者是包括OCN和ALP在內的關鍵成骨蛋白的主要轉錄因子[21]。成骨分化是一個復雜過程,導致礦化細胞外基質的形成。大量調節因子參與成骨分化。Runx2是成骨細胞分化的重要轉錄因子,與關鍵成骨細胞特異性基因的啟動子區域直接相互作用[22]。有研究顯示Runx2可能是更年期婦女骨代謝的有用遺傳標記,并可能在骨密度中發揮重要作用[23]。OCN是一種編碼骨鈣素的基因,在骨骼形成和骨質疏松等骨代謝過程中起重要作用[24]。Col1是骨細胞外基質的重要成分,它將細胞表面整合素與其他細胞外基質蛋白連接起來,作為成骨細胞產生的分泌糖蛋白[25]。本研究發現BMSCs成骨分化過程中,Rspo2處理后成骨細胞標記基因Runx2、OCN、ALP和Col1表達量顯著提升,說明Rspo2在祖細胞成骨分化中起到重要作用。但骨形成是一個復雜且連續過程,諸多基因及生物因子交互作用,本研究只是明確了Rspo2能夠促進祖細胞的成骨分化,但具體作用機制仍需后續研究明確。
綜上述,Rspo2通過在組織和細胞水平上調Runx2、ALP和OCN來促進成骨,從而促進BMSCs向成骨細胞譜系分化,進一步支持了Rspo2作為一種潛在的骨質疏松治療策略的實用性。在未來研究中,我們將進行藥代動力學、毒理學分析及隨機對照研究,驗證Rspo2對于刺激絕經后婦女骨形成以及伴隨癥狀功效,探討其潛在作用機制。
利益沖突 在課題研究和文章撰寫過程中不存在利益沖突;經費支持沒有影響文章觀點和對研究數據客觀結果的統計分析及其報道
倫理聲明 研究方案經天津醫院醫學倫理委員會批準(2024醫倫局預019);實驗動物使用許可證號:SYXK(津)2023-011
作者貢獻聲明 柳鑫:研究設計、數據分析及論文撰寫;石博文:動物模型制作及數據收集;蔡成闊,王昊天:數據收集整理及統計分析;賈鵬:研究設計及論文指導