引用本文: 姚益, 胡秋霞, 楊彥輝, 謝曉陽, 王毅, 李曉亮, 羅雷, 李季. 囊腔型肺結節CT影像學特征探究及良惡性預測模型的建立. 中國胸心血管外科臨床雜志, 2024, 31(2): 249-254. doi: 10.7507/1007-4848.202203071 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
目前,肺癌發病率及死亡率不斷攀升,肺癌已居于全球癌癥死亡的首位[1]。隨著薄層CT的普及,一種特殊的肺部結節受到廣泛關注,其CT表現為肺內充氣囊腔,壁厚多<4 mm,囊腔外周常伴有肺癌的普遍征象,我們稱之為囊腔型肺結節。前期研究[2]將影像學上表現為囊性、75%以上囊壁厚度<4 mm且病理確診肺癌的囊腔型肺結節定義為囊腔型肺癌。英國的Anderson和Pierce[3]在1954年首先報道了表現為囊性病變的肺癌。囊腔型肺結節并不常見,占初次CT診斷肺癌的3.7%和每年重復CT最終確定為肺癌患者的12%[4]。由于囊腔型肺癌的CT表現薄壁空洞特征與肺氣腫、肺大泡等良性疾病鑒別困難且難以穿刺活檢獲取病理診斷,使有囊性氣腔的早期肺癌被誤診、延診[5],這可能導致早期肺癌轉變為晚期甚至腫瘤轉移,5年生存率約為5.3%[6]。當臨床決策在肺結節惡性風險和有創操作風險間難以取舍時,指南[7]推薦臨床醫生可使用肺結節惡性概率預測模型為臨床決策提供參考。結合囊腔型肺結節薄壁囊性這一特殊CT特征,基于CT特征的囊腔型肺結節鑒別診斷對臨床抉擇及患者診治至關重要[8-9]。本研究收集本中心囊腔型肺結節患者的臨床資料,探討囊腔型肺結節惡性病變的獨立危險因素,建立惡性概率預測模型,為囊腔型這一特殊類型肺結節的早期篩查提供新的診斷依據,對高危人群做到早預防、早干預。
1 資料與方法
1.1 臨床資料和分組
回顧性納入2017年1月—2022年2月內江市第一人民醫院胸外科收治的囊腔型肺結節患者,根據病灶良惡性,將患者分為惡性組和良性組。由兩名經驗豐富的放射科醫師讀片,診斷囊腔型肺結節,讀片中的任何爭議均由另一位資深影像學專家審查后共同決定。納入標準:(1)單個或多個時間點CT影像特征報告為囊性空腔;(2)行手術或經皮肺穿刺活檢明確病理。排除標準:(1)先前實性病變中心的囊腔提示空洞;(2)囊腔不能與周圍的肺氣腫、支氣管擴張或囊性間質性肺病區分開來[5,8-9]。
1.2 數據收集
通過手術或肺穿刺活檢明確囊腔型結節病理。收集兩組患者臨床資料、CT影像學相關指標。其中,臨床資料包括性別、年齡、肺病史、腫瘤病史、癌胚抗原(carcinoembryonic antigen,CEA),CT影像學相關指標包括病灶直徑、囊腔壁結節、囊腔內血管穿行、充氣征、短毛刺、胸膜牽拉、囊腔壁形態、壁厚度、囊腔個數。
1.3 統計學分析
采用以SPSS 26.0統計軟件分析數據,服從正態分布的計量資料以均數±標準差( ±s)描述,兩組間比較采用獨立樣本t檢驗。不服從正態分布的計量資料以中位數(上下四分位數)[M(P25,P75)]描述,兩組間比較采用Kruskal-Wallis H檢驗。計數資料以例數和百分比描述,組間比較采用χ2檢驗或Fisher確切概率法。將性別、年齡、肺病史、腫瘤病史、CEA、病灶直徑、囊腔壁結節、囊腔內血管穿行、充氣征、短毛刺、胸膜牽拉、囊腔壁形態、壁厚度、囊腔個數共14項因素納入單因素分析。將單因素分析結果中差異有統計學意義(P≤0.05)的變量及具有重要臨床意義的變量納入多因素logistic回歸分析,分析囊腔型肺結節惡性病變的獨立危險因素,建立惡性概率預測模型。分別繪制受試者工作特征(receiver operating characteristic,ROC)曲線,計算曲線下面積(area under the curve,AUC),分析模型的靈敏度、特異性。檢驗水準α=0.05。
±s)描述,兩組間比較采用獨立樣本t檢驗。不服從正態分布的計量資料以中位數(上下四分位數)[M(P25,P75)]描述,兩組間比較采用Kruskal-Wallis H檢驗。計數資料以例數和百分比描述,組間比較采用χ2檢驗或Fisher確切概率法。將性別、年齡、肺病史、腫瘤病史、CEA、病灶直徑、囊腔壁結節、囊腔內血管穿行、充氣征、短毛刺、胸膜牽拉、囊腔壁形態、壁厚度、囊腔個數共14項因素納入單因素分析。將單因素分析結果中差異有統計學意義(P≤0.05)的變量及具有重要臨床意義的變量納入多因素logistic回歸分析,分析囊腔型肺結節惡性病變的獨立危險因素,建立惡性概率預測模型。分別繪制受試者工作特征(receiver operating characteristic,ROC)曲線,計算曲線下面積(area under the curve,AUC),分析模型的靈敏度、特異性。檢驗水準α=0.05。
1.4 倫理審查
本研究已通過內江市第一人民醫院倫理委員會批準,審批號:2021-l倫審批-43。
2 結果
2.1 患者一般資料比較
共納入107例患者,惡性組76例,其中男36例、女40例,年齡37~82(59.65±11.74)歲。病灶直徑5~52(18.68±0.95)mm,病理類型:腺癌67例(原位腺癌6例、微潤性腺癌24例、浸潤性腺癌37例),鱗狀細胞癌(鱗癌)6例,小細胞肺癌2例,大細胞肺癌1例;良性組31例,其中男16例、女15例,年齡38~74(58.96±13.91)歲。病灶直徑5~42(19.41±0.91)mm,病理類型:支氣管腺瘤21例,肺大泡5例,肺結核1例,細菌或真菌感染4例。囊腔壁結節、短毛刺、囊腔壁形態、囊腔個數為囊腔型肺結節較為特殊的CT影像學特征。兩組患者的囊腔壁結節、短毛刺、囊腔壁形態、囊腔個數差異有統計學意義(P<0.05);見表1。
 )
)
2.2 囊腔型肺結節惡性病變的危險因素分析
多因素分析顯示,囊腔壁結節[OR=3.538,95%CI(1.231,10.164),P=0.019]、短毛刺[OR=4.106,95%CI(1.454,11.598),P=0.008]、囊腔壁形態[OR=6.978,95%CI(2.374,20.505),P<0.001]、囊腔個數[OR=4.179,95%CI(1.438,12.146),P=0.009]是惡性囊腔型肺結節的潛在危險因素;見表2。
2.3 建立臨床預測模型
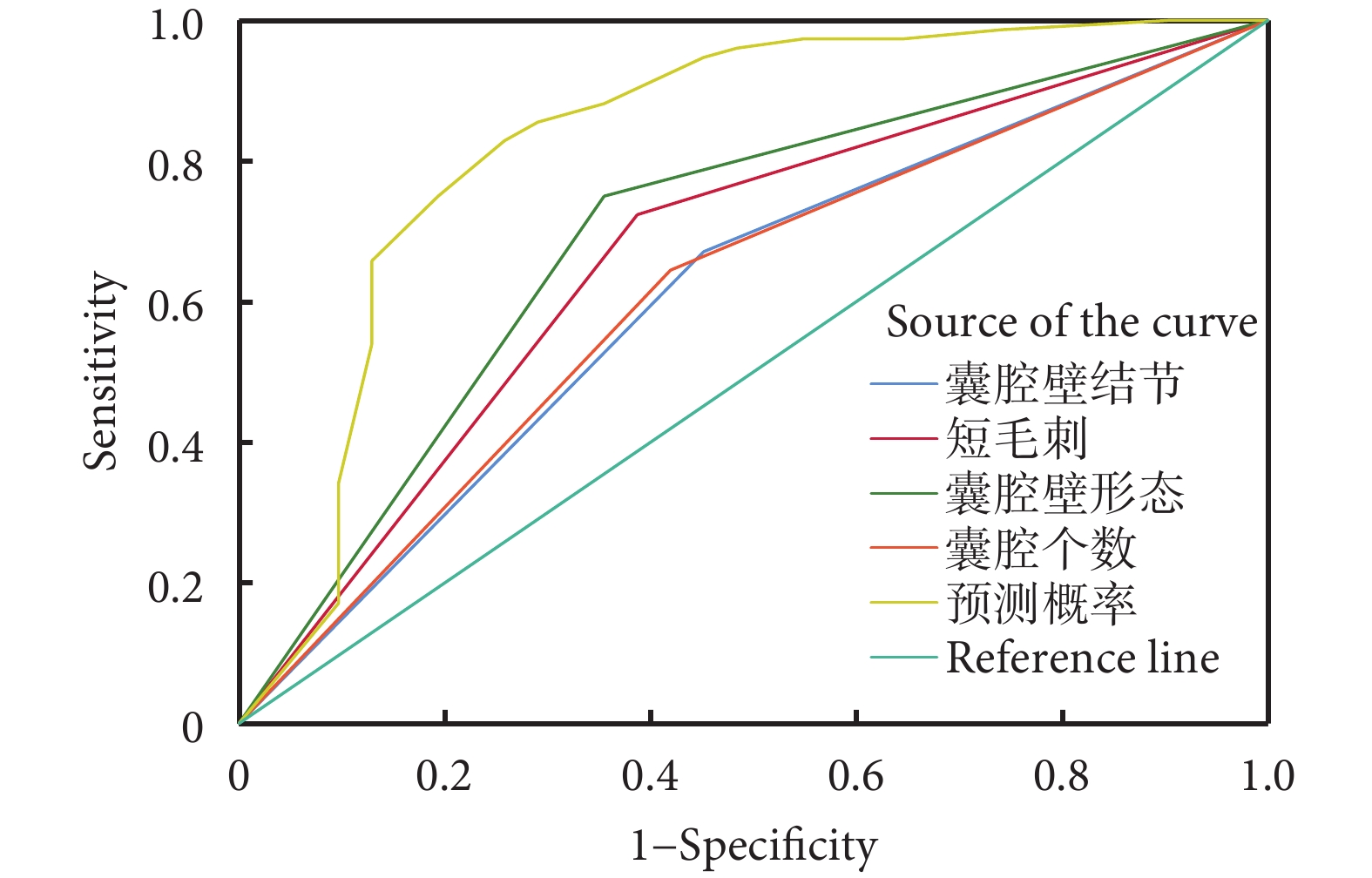
根據多因素分析結果,建立囊腔型肺結節良惡性預測模型:P=ex/(1+ex),X=?2.453+1.264×囊腔壁結節+1.412×短毛刺+1.943×囊腔壁形態+1.430×囊腔個數。其中P為惡性結節預測值概率,e為自然對數,X因各項研究結果的不同而有所差別,定量結果有則記為1,無則記為0。有囊腔壁結節=1,無囊腔壁結節=0;有短毛刺=1,無短毛刺=0;囊腔壁不光滑=1,囊腔壁光滑=0;多囊腔=1,單囊腔=0。ROC曲線分析結果顯示,預測模型對囊腔型肺癌的預測價值最高。單個影像學特征的預測價值分別為:有囊腔壁結節的AUC為0.610,敏感度和特異性分別為67.1%、54.8%;有短毛刺的AUC為0.668,敏感度和特異性分別為72.4%、61.3%;囊腔壁不光滑的AUC為0.698,敏感度和特異性分別為75.0%、64.5%;多囊腔型的AUC為0.613,敏感度和特異性分別為64.5%、58.1%。預測模型的AUC為0.830,敏感度和特異性分別為82.9%、74.2%;見圖1、表3。
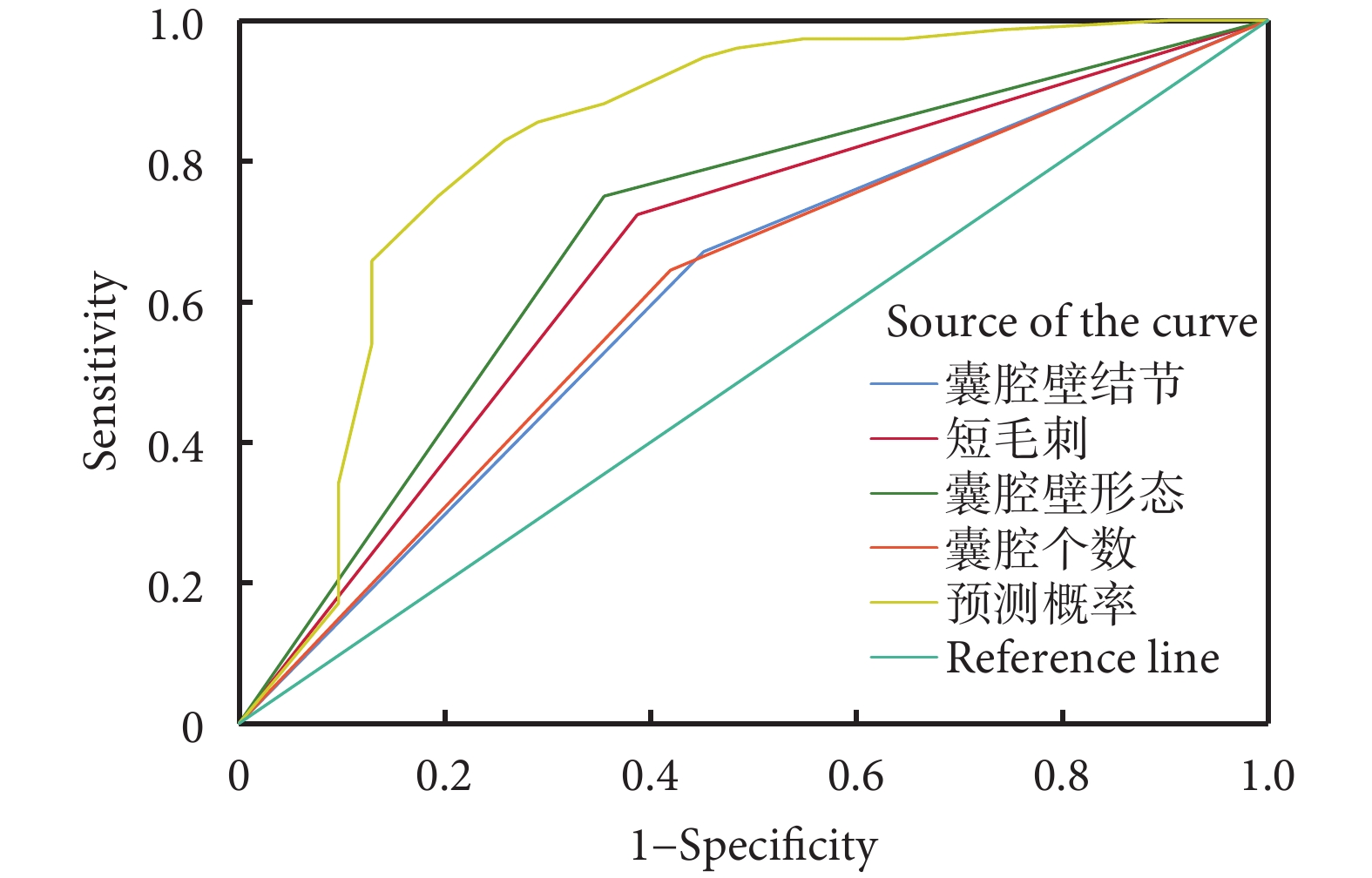 圖1
基于預測模型及CT特征繪制的受試者工作特征曲線
圖1
基于預測模型及CT特征繪制的受試者工作特征曲線
3 討論
早期國內外學者就曾設計相關模型對肺結節進行良惡性評估,如Mayo模型[10]、VA模型[11]、Brock模型[12]和PKUPH模型[13]等,但均具有一定局限性。前瞻性的Mayo模型數據源于20多年前,有限的隨訪時間對結節性質不能完全明確,導致時效性差及準確性較低;VA模型因影像學基礎為X線而喪失臨床意義;PKUPH模型對CT選擇時間點界定不清。然而,由于囊腔型肺結節與普通肺結節具有明顯的影像學差異,臨床醫生缺乏對薄壁囊性肺癌的認識,導致在針對肺癌篩查試驗漏診病例的回顧性研究中,囊腔型肺癌被漏診為“肺泡壁增厚”占漏診患者的22.7%[14]。因此,可在傳統模型的基礎上建立適用于囊腔型肺結節的良惡性預測模型,提高惡性囊腔型肺結節的臨床篩查率。
本研究將性別、年齡、肺病史、腫瘤病史、CEA、病灶直徑、囊腔壁結節、動脈血管穿行、充氣征、短毛刺、胸膜牽拉、囊腔壁不光滑、壁厚度、多囊腔、結節病理特征納入研究。低劑量薄層CT為影像學檢查手段,相較于Mayo、VA、Brock及PKUPH等傳統模型增加了腫瘤標志物CEA及囊腔型肺結節特異性的囊腔壁結節、囊腔壁形態、壁厚度、囊腔個數4項特異性影像學特征,是結合了患者病史、腫瘤標志物、影像學資料的綜合診斷模型。囊腔壁結節、短毛刺、囊腔壁形態、囊腔個數為囊腔型肺結節較為特殊的CT影像學特征,且發現這4項特征在良性組與惡性組間差異有統計學意義。囊腔壁結節是指囊性薄壁上實性成分增加形成結節。Elia等[15]在亞實性肺結節隨訪中發現實性成分的增加高度懷疑惡性腫瘤。前期亦有研究[4]對26例惡性囊腔型肺結節病例進行隨訪,結果表明,在最初均勻薄壁約1 mm的囊性病變中,初次CT掃描后35(12~118)個月均出現壁結節,并且成為判斷腫瘤侵襲程度的關鍵因素[16]。由此可見囊腔形成是實性肺癌變化過程中的一個階段,實性成分增加形成的壁結節可視為囊腔型肺癌的特異性表現,可能與囊腔型肺結節形成機制有關。
眾多機制中,止回閥機制被學者普遍認同,其認為腫瘤細胞起源于肺泡壁和支氣管壁,直接侵入支氣管,引起局部狹窄,形成單向活瓣。隨著進入囊性空腔的氣體積累,隨著內部壓力的增加,空腔變得越來越大。但當腫瘤組織完全阻塞支氣管時,腫瘤組織長入囊性空腔,實性成分增加,囊性空腔變得越來越小[17-18]。同時Shen等[19]發現具有壁結節的囊腔型肺癌(Ⅲ型)可能侵襲性更高、預后更差,與其他形態學(Ⅰ、Ⅱ和Ⅳ型)相比,Ⅲ型囊腔型肺癌分化程度更差,中分化或低分化的頻率達到85%,且生存率更低[20]。肺結節的邊緣特征有利于其良惡性診斷,其中惡性結節邊緣多不光滑,出現毛刺征、胸膜牽拉等特征。肺結節毛刺征是由于腫瘤細胞向周圍組織浸潤生長并牽拉周圍組織而表現出的一種惡性特征,高度提示結節惡性可能,短毛刺這一特征在肺腺癌中發生率為81%~100%[21-22]。本研究發現,短毛刺同樣為囊腔型肺癌的獨立危險因素。Tan等[17]研究囊腔型肺結節病理時發現,CT上不規則的囊性邊緣對應于腫瘤細胞產生的纖維組織,而 CT 上看到的多囊分隔對應于纖維組織或穿過的氣道或血管,預示惡性可能。在惡性囊腔型肺結節中,具有分隔的多囊占58.4%。亦有研究[21-22]表明囊腔型肺癌可能起源于已有肺大泡的囊壁細胞,有慢性阻塞性肺疾病和肺氣腫的個體患肺癌的幾率可能更高,風險增加4~5倍[23]。在肺氣腫患者中,囊腫可能會干擾通氣和肺清除,從而導致致癌物沉積導致惡變[24]。本研究數據顯示,兩組患者肺病史(包括肺大泡、肺氣腫病史)差異無統計學意義,但本研究排除了囊腔不能與周圍的肺氣腫區分的患者,這可能對結果具有干擾。肺結節惡性率與結節大小有一定的相關性,隨著結節直徑增加,惡性率增加[25]。然而囊腔型肺結節CT病灶大小往往大于相應的病灶病理測量值[20]。本研究得到囊腔型肺結節直徑與良惡性間無明顯關聯的結果,這可能是因為本研究中納入的是CT病灶直徑,而不是實性或磨玻璃成分直徑。
囊腔型肺結節的形成可能是肺癌發展過程中的一個階段,首次觀察到囊性氣腔與肺癌診斷之間的中位時間為25.5個月[26]。目前暫無針對囊腔型肺結節隨訪指南,在隨訪過程中出現囊壁、壁結節實性成分或密度增加應考慮肺癌可能。且當囊腔壁開始不規則增厚或出現壁結節時,病理結果中附壁和腺泡亞型比例下降,而實性和微乳頭亞型比例上升[18]。可根據現有指南隨訪,必要時手術切除以明確診斷[17,27-28]。密切隨訪囊腔型肺癌的成像特征和時間演變可最大限度地減少肺癌診斷的延誤。
由于囊腔型肺結節發病率較低,本研究納入樣本量較小,所獲得的結論可能存在一定偏差,需加大樣本量繼續展開研究。同時,動態觀察囊腔型肺結節對于鑒定其良惡性意義重大,后期研究需要將動態監測納入研究范圍,以獲得更為準確的結論。總之,本研究對比分析了囊腔型肺結節的臨床資料、CT影像學特征。經logistic回歸分析,囊腔壁結節、短毛刺、囊腔壁形態、囊腔個數是判斷囊腔型肺結節惡性病變的獨立危險因素。根據該危險因素首次建立了肺結節中特殊的囊腔型肺結節良惡性預測模型,可為臨床提供一定參考,減少囊腔型肺癌的漏診、延診,做到早診斷、早干預。
利益沖突:無。
作者貢獻:姚益負責論文設計,數據收集與分析和論文初稿撰寫;胡秋霞、楊彥輝、王毅、李曉亮、羅雷負責數據收集、整理與分析;李季、謝曉陽負責論文審閱與修改。
目前,肺癌發病率及死亡率不斷攀升,肺癌已居于全球癌癥死亡的首位[1]。隨著薄層CT的普及,一種特殊的肺部結節受到廣泛關注,其CT表現為肺內充氣囊腔,壁厚多<4 mm,囊腔外周常伴有肺癌的普遍征象,我們稱之為囊腔型肺結節。前期研究[2]將影像學上表現為囊性、75%以上囊壁厚度<4 mm且病理確診肺癌的囊腔型肺結節定義為囊腔型肺癌。英國的Anderson和Pierce[3]在1954年首先報道了表現為囊性病變的肺癌。囊腔型肺結節并不常見,占初次CT診斷肺癌的3.7%和每年重復CT最終確定為肺癌患者的12%[4]。由于囊腔型肺癌的CT表現薄壁空洞特征與肺氣腫、肺大泡等良性疾病鑒別困難且難以穿刺活檢獲取病理診斷,使有囊性氣腔的早期肺癌被誤診、延診[5],這可能導致早期肺癌轉變為晚期甚至腫瘤轉移,5年生存率約為5.3%[6]。當臨床決策在肺結節惡性風險和有創操作風險間難以取舍時,指南[7]推薦臨床醫生可使用肺結節惡性概率預測模型為臨床決策提供參考。結合囊腔型肺結節薄壁囊性這一特殊CT特征,基于CT特征的囊腔型肺結節鑒別診斷對臨床抉擇及患者診治至關重要[8-9]。本研究收集本中心囊腔型肺結節患者的臨床資料,探討囊腔型肺結節惡性病變的獨立危險因素,建立惡性概率預測模型,為囊腔型這一特殊類型肺結節的早期篩查提供新的診斷依據,對高危人群做到早預防、早干預。
1 資料與方法
1.1 臨床資料和分組
回顧性納入2017年1月—2022年2月內江市第一人民醫院胸外科收治的囊腔型肺結節患者,根據病灶良惡性,將患者分為惡性組和良性組。由兩名經驗豐富的放射科醫師讀片,診斷囊腔型肺結節,讀片中的任何爭議均由另一位資深影像學專家審查后共同決定。納入標準:(1)單個或多個時間點CT影像特征報告為囊性空腔;(2)行手術或經皮肺穿刺活檢明確病理。排除標準:(1)先前實性病變中心的囊腔提示空洞;(2)囊腔不能與周圍的肺氣腫、支氣管擴張或囊性間質性肺病區分開來[5,8-9]。
1.2 數據收集
通過手術或肺穿刺活檢明確囊腔型結節病理。收集兩組患者臨床資料、CT影像學相關指標。其中,臨床資料包括性別、年齡、肺病史、腫瘤病史、癌胚抗原(carcinoembryonic antigen,CEA),CT影像學相關指標包括病灶直徑、囊腔壁結節、囊腔內血管穿行、充氣征、短毛刺、胸膜牽拉、囊腔壁形態、壁厚度、囊腔個數。
1.3 統計學分析
采用以SPSS 26.0統計軟件分析數據,服從正態分布的計量資料以均數±標準差( ±s)描述,兩組間比較采用獨立樣本t檢驗。不服從正態分布的計量資料以中位數(上下四分位數)[M(P25,P75)]描述,兩組間比較采用Kruskal-Wallis H檢驗。計數資料以例數和百分比描述,組間比較采用χ2檢驗或Fisher確切概率法。將性別、年齡、肺病史、腫瘤病史、CEA、病灶直徑、囊腔壁結節、囊腔內血管穿行、充氣征、短毛刺、胸膜牽拉、囊腔壁形態、壁厚度、囊腔個數共14項因素納入單因素分析。將單因素分析結果中差異有統計學意義(P≤0.05)的變量及具有重要臨床意義的變量納入多因素logistic回歸分析,分析囊腔型肺結節惡性病變的獨立危險因素,建立惡性概率預測模型。分別繪制受試者工作特征(receiver operating characteristic,ROC)曲線,計算曲線下面積(area under the curve,AUC),分析模型的靈敏度、特異性。檢驗水準α=0.05。
±s)描述,兩組間比較采用獨立樣本t檢驗。不服從正態分布的計量資料以中位數(上下四分位數)[M(P25,P75)]描述,兩組間比較采用Kruskal-Wallis H檢驗。計數資料以例數和百分比描述,組間比較采用χ2檢驗或Fisher確切概率法。將性別、年齡、肺病史、腫瘤病史、CEA、病灶直徑、囊腔壁結節、囊腔內血管穿行、充氣征、短毛刺、胸膜牽拉、囊腔壁形態、壁厚度、囊腔個數共14項因素納入單因素分析。將單因素分析結果中差異有統計學意義(P≤0.05)的變量及具有重要臨床意義的變量納入多因素logistic回歸分析,分析囊腔型肺結節惡性病變的獨立危險因素,建立惡性概率預測模型。分別繪制受試者工作特征(receiver operating characteristic,ROC)曲線,計算曲線下面積(area under the curve,AUC),分析模型的靈敏度、特異性。檢驗水準α=0.05。
1.4 倫理審查
本研究已通過內江市第一人民醫院倫理委員會批準,審批號:2021-l倫審批-43。
2 結果
2.1 患者一般資料比較
共納入107例患者,惡性組76例,其中男36例、女40例,年齡37~82(59.65±11.74)歲。病灶直徑5~52(18.68±0.95)mm,病理類型:腺癌67例(原位腺癌6例、微潤性腺癌24例、浸潤性腺癌37例),鱗狀細胞癌(鱗癌)6例,小細胞肺癌2例,大細胞肺癌1例;良性組31例,其中男16例、女15例,年齡38~74(58.96±13.91)歲。病灶直徑5~42(19.41±0.91)mm,病理類型:支氣管腺瘤21例,肺大泡5例,肺結核1例,細菌或真菌感染4例。囊腔壁結節、短毛刺、囊腔壁形態、囊腔個數為囊腔型肺結節較為特殊的CT影像學特征。兩組患者的囊腔壁結節、短毛刺、囊腔壁形態、囊腔個數差異有統計學意義(P<0.05);見表1。
 )
)
2.2 囊腔型肺結節惡性病變的危險因素分析
多因素分析顯示,囊腔壁結節[OR=3.538,95%CI(1.231,10.164),P=0.019]、短毛刺[OR=4.106,95%CI(1.454,11.598),P=0.008]、囊腔壁形態[OR=6.978,95%CI(2.374,20.505),P<0.001]、囊腔個數[OR=4.179,95%CI(1.438,12.146),P=0.009]是惡性囊腔型肺結節的潛在危險因素;見表2。
2.3 建立臨床預測模型
根據多因素分析結果,建立囊腔型肺結節良惡性預測模型:P=ex/(1+ex),X=?2.453+1.264×囊腔壁結節+1.412×短毛刺+1.943×囊腔壁形態+1.430×囊腔個數。其中P為惡性結節預測值概率,e為自然對數,X因各項研究結果的不同而有所差別,定量結果有則記為1,無則記為0。有囊腔壁結節=1,無囊腔壁結節=0;有短毛刺=1,無短毛刺=0;囊腔壁不光滑=1,囊腔壁光滑=0;多囊腔=1,單囊腔=0。ROC曲線分析結果顯示,預測模型對囊腔型肺癌的預測價值最高。單個影像學特征的預測價值分別為:有囊腔壁結節的AUC為0.610,敏感度和特異性分別為67.1%、54.8%;有短毛刺的AUC為0.668,敏感度和特異性分別為72.4%、61.3%;囊腔壁不光滑的AUC為0.698,敏感度和特異性分別為75.0%、64.5%;多囊腔型的AUC為0.613,敏感度和特異性分別為64.5%、58.1%。預測模型的AUC為0.830,敏感度和特異性分別為82.9%、74.2%;見圖1、表3。
 圖1
基于預測模型及CT特征繪制的受試者工作特征曲線
圖1
基于預測模型及CT特征繪制的受試者工作特征曲線
3 討論
早期國內外學者就曾設計相關模型對肺結節進行良惡性評估,如Mayo模型[10]、VA模型[11]、Brock模型[12]和PKUPH模型[13]等,但均具有一定局限性。前瞻性的Mayo模型數據源于20多年前,有限的隨訪時間對結節性質不能完全明確,導致時效性差及準確性較低;VA模型因影像學基礎為X線而喪失臨床意義;PKUPH模型對CT選擇時間點界定不清。然而,由于囊腔型肺結節與普通肺結節具有明顯的影像學差異,臨床醫生缺乏對薄壁囊性肺癌的認識,導致在針對肺癌篩查試驗漏診病例的回顧性研究中,囊腔型肺癌被漏診為“肺泡壁增厚”占漏診患者的22.7%[14]。因此,可在傳統模型的基礎上建立適用于囊腔型肺結節的良惡性預測模型,提高惡性囊腔型肺結節的臨床篩查率。
本研究將性別、年齡、肺病史、腫瘤病史、CEA、病灶直徑、囊腔壁結節、動脈血管穿行、充氣征、短毛刺、胸膜牽拉、囊腔壁不光滑、壁厚度、多囊腔、結節病理特征納入研究。低劑量薄層CT為影像學檢查手段,相較于Mayo、VA、Brock及PKUPH等傳統模型增加了腫瘤標志物CEA及囊腔型肺結節特異性的囊腔壁結節、囊腔壁形態、壁厚度、囊腔個數4項特異性影像學特征,是結合了患者病史、腫瘤標志物、影像學資料的綜合診斷模型。囊腔壁結節、短毛刺、囊腔壁形態、囊腔個數為囊腔型肺結節較為特殊的CT影像學特征,且發現這4項特征在良性組與惡性組間差異有統計學意義。囊腔壁結節是指囊性薄壁上實性成分增加形成結節。Elia等[15]在亞實性肺結節隨訪中發現實性成分的增加高度懷疑惡性腫瘤。前期亦有研究[4]對26例惡性囊腔型肺結節病例進行隨訪,結果表明,在最初均勻薄壁約1 mm的囊性病變中,初次CT掃描后35(12~118)個月均出現壁結節,并且成為判斷腫瘤侵襲程度的關鍵因素[16]。由此可見囊腔形成是實性肺癌變化過程中的一個階段,實性成分增加形成的壁結節可視為囊腔型肺癌的特異性表現,可能與囊腔型肺結節形成機制有關。
眾多機制中,止回閥機制被學者普遍認同,其認為腫瘤細胞起源于肺泡壁和支氣管壁,直接侵入支氣管,引起局部狹窄,形成單向活瓣。隨著進入囊性空腔的氣體積累,隨著內部壓力的增加,空腔變得越來越大。但當腫瘤組織完全阻塞支氣管時,腫瘤組織長入囊性空腔,實性成分增加,囊性空腔變得越來越小[17-18]。同時Shen等[19]發現具有壁結節的囊腔型肺癌(Ⅲ型)可能侵襲性更高、預后更差,與其他形態學(Ⅰ、Ⅱ和Ⅳ型)相比,Ⅲ型囊腔型肺癌分化程度更差,中分化或低分化的頻率達到85%,且生存率更低[20]。肺結節的邊緣特征有利于其良惡性診斷,其中惡性結節邊緣多不光滑,出現毛刺征、胸膜牽拉等特征。肺結節毛刺征是由于腫瘤細胞向周圍組織浸潤生長并牽拉周圍組織而表現出的一種惡性特征,高度提示結節惡性可能,短毛刺這一特征在肺腺癌中發生率為81%~100%[21-22]。本研究發現,短毛刺同樣為囊腔型肺癌的獨立危險因素。Tan等[17]研究囊腔型肺結節病理時發現,CT上不規則的囊性邊緣對應于腫瘤細胞產生的纖維組織,而 CT 上看到的多囊分隔對應于纖維組織或穿過的氣道或血管,預示惡性可能。在惡性囊腔型肺結節中,具有分隔的多囊占58.4%。亦有研究[21-22]表明囊腔型肺癌可能起源于已有肺大泡的囊壁細胞,有慢性阻塞性肺疾病和肺氣腫的個體患肺癌的幾率可能更高,風險增加4~5倍[23]。在肺氣腫患者中,囊腫可能會干擾通氣和肺清除,從而導致致癌物沉積導致惡變[24]。本研究數據顯示,兩組患者肺病史(包括肺大泡、肺氣腫病史)差異無統計學意義,但本研究排除了囊腔不能與周圍的肺氣腫區分的患者,這可能對結果具有干擾。肺結節惡性率與結節大小有一定的相關性,隨著結節直徑增加,惡性率增加[25]。然而囊腔型肺結節CT病灶大小往往大于相應的病灶病理測量值[20]。本研究得到囊腔型肺結節直徑與良惡性間無明顯關聯的結果,這可能是因為本研究中納入的是CT病灶直徑,而不是實性或磨玻璃成分直徑。
囊腔型肺結節的形成可能是肺癌發展過程中的一個階段,首次觀察到囊性氣腔與肺癌診斷之間的中位時間為25.5個月[26]。目前暫無針對囊腔型肺結節隨訪指南,在隨訪過程中出現囊壁、壁結節實性成分或密度增加應考慮肺癌可能。且當囊腔壁開始不規則增厚或出現壁結節時,病理結果中附壁和腺泡亞型比例下降,而實性和微乳頭亞型比例上升[18]。可根據現有指南隨訪,必要時手術切除以明確診斷[17,27-28]。密切隨訪囊腔型肺癌的成像特征和時間演變可最大限度地減少肺癌診斷的延誤。
由于囊腔型肺結節發病率較低,本研究納入樣本量較小,所獲得的結論可能存在一定偏差,需加大樣本量繼續展開研究。同時,動態觀察囊腔型肺結節對于鑒定其良惡性意義重大,后期研究需要將動態監測納入研究范圍,以獲得更為準確的結論。總之,本研究對比分析了囊腔型肺結節的臨床資料、CT影像學特征。經logistic回歸分析,囊腔壁結節、短毛刺、囊腔壁形態、囊腔個數是判斷囊腔型肺結節惡性病變的獨立危險因素。根據該危險因素首次建立了肺結節中特殊的囊腔型肺結節良惡性預測模型,可為臨床提供一定參考,減少囊腔型肺癌的漏診、延診,做到早診斷、早干預。
利益沖突:無。
作者貢獻:姚益負責論文設計,數據收集與分析和論文初稿撰寫;胡秋霞、楊彥輝、王毅、李曉亮、羅雷負責數據收集、整理與分析;李季、謝曉陽負責論文審閱與修改。