引用本文: 周翔, 梁小龍, 游賓, 曹勍, 劉洪淼, 趙宏穎, 李雪. 1 263例肺部結節術中冰凍病理診斷分析. 中國胸心血管外科臨床雜志, 2024, 31(1): 78-84. doi: 10.7507/1007-4848.202207028 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
肺癌是世界范圍內高發惡性腫瘤之一[1],隨著胸部計算機斷層掃描(computed tomography,CT)檢查在日常醫療診療過程中的應用,以及我國居民健康體檢意識的增強,越來越多的無癥狀肺部磨玻璃結節(ground-glass nodules,GGN)和有癥狀的肺部腫瘤被發現。肺部腫瘤的術前診斷方法包括經纖維支氣管鏡肺活檢和CT引導下經皮肺穿刺等,但術前穿刺具有一定的局限性,活檢組織可能無法很好地顯示出腫瘤的主要特點,病理診斷困難。因此,肺部腫瘤的冰凍送檢率很高,術中快速冰凍病理診斷成為一項重要工作。
由于術中冰凍檢查對病變良惡性的判斷影響外科醫師對手術方式的選擇,但術中冰凍檢查具有其局限性,如何避免對患者造成過度治療或治療不足是對臨床醫生及病理醫生共同的考驗。Shima等[2]在其研究中探討了避免對術中診斷為原位腺癌(adenocarcinoma in situ,AIS)的病例造成過度治療的可行性。陳金平等[3]分析了肺原發性良性黏液上皮性病變冰凍病理誤診為黏液腺癌的主要原因。提高術中冰凍病理診斷的準確率極為重要,本文通過對我院1 263例肺部結節術中冰凍診斷情況進行分析,探討冰凍誤診的主要原因,提高日后冰凍診斷的準確性。
1 資料與方法
1.1 一般資料
收集首都醫科大學附屬北京朝陽醫院病理科2021年1月—2022年1月期間肺部結節病例的術中冰凍病理診斷結果及術后石蠟病理診斷結果。納入標準:(1)手術過程中送檢術中冰凍病理檢查;(2)冰凍制片成功;(3)手術切除標本經過充分固定、取材;(4)術后石蠟病理診斷明確。排除術后病理診斷不明確、有爭議的病例。
1.2 方法
冰凍對照及冰凍剩余標本經10%中性福爾馬林充分固定,常規脫水,石蠟包埋,制片,蘇木素-伊紅染色。免疫組織化學染色采用EnVision兩步法,按照試劑盒說明書進行操作。免疫組織化學抗體包括p40、p63、CK5/6、EMA、CKpan,其中p40抗體購自羅氏公司,CKpan購自中杉公司,p63、CK5/6及EMA抗體購自邁新生物技術有限公司。特殊染色彈力纖維染色試劑購自貝索公司,網織纖維染色試劑購自羅氏公司。由兩名高年資病理醫師重新閱片,將1 263例冰凍切片與術后石蠟切片進行比對,并結合術后石蠟組織的免疫組織化學染色及特殊染色結果,以最終手術切除標本的石蠟病理結果為金標準,分析術中冰凍切片誤診病例的主要原因,總結易誤診病例的類型及在冰凍中鑒別診斷的要點及難點。
1.3 倫理審查
本研究已通過首都醫科大學附屬北京朝陽醫院醫學倫理審查委員會審批,審查編號:2021-科-614。
2 結果
按照納入標準共1 178例患者的1 263例冰凍病理結果納入研究,其中男475例、女703例,平均年齡58.7(23~86)歲。1 263例冰凍送檢的肺部病變中,主要為腫瘤性病變,其中惡性腫瘤以浸潤性腺癌最多見(524例,41.49%),其次分別為AIS(292例,23.12%)、微浸潤性腺癌(minimally invasive adenocarcinoma,MIA,191例,15.12%)、鱗狀細胞癌(38例,3.01%)、黏液腺癌(20例,1.58%)、高級別神經內分泌癌(14例,1.11%)、黏液型AIS(3例,0.24%)等。良性腫瘤性病變最常見的為錯構瘤(23例,1.82%),其次分別為硬化性肺細胞瘤(7例,0.55%)、細支氣管腺瘤(3例,0.24%)、乳頭狀腺瘤(1例,0.08%)。在非腫瘤性病變中,常見病變分別為局灶纖維組織增生伴玻璃樣變性(21例,1.66)、結核(13例,1.03%)、其他肉芽腫性炎(12例,0.95%)、IgG4相關性疾病(3例,0.24%)等。
冰凍診斷正確率為95.65%,誤診率為4.35%,冰凍誤診病例55例,依次為:浸潤性腺癌18例(3.44%)、AIS 17例(5.82%)、黏液腺癌7例(35.00%)、MIA 4例(2.09%)、IgG4相關性疾病3例(100.00%)、黏液型AIS 2例(66.67%)、非典型腺瘤樣增生(atypical adenomatous hyperplasia,AAH)1例(16.67%)、硬化性肺細胞瘤1例(14.29%)、細支氣管腺瘤1例(33.33%)、乳頭狀腺瘤1例(100.00%)。病種構成及誤診構成比見表1。誤診病例冰凍切片結果與術后石蠟結果對比見表2,各誤診原因所占比例見表3。
3 討論
術中快速冰凍診斷已成為一項成熟的病理技術,與普通病理診斷不同的是,術中病理診斷主要目的是回答指導手術方式所需的具體問題,如:(1)病變性質;(2)手術切緣是否切凈,在肺部惡性腫瘤中主要是判定支氣管斷端是否切凈;(3)淋巴結有無癌轉移等。在肺臟腫瘤中,對于非小細胞肺癌,外科醫生主要選擇肺葉切除和/或淋巴結清掃,對于AIS或MIA,可以選擇更為局限的手術方式,如肺楔形切除、亞肺段切除或肺段切除,無需淋巴結清掃[4-5],因此在冰凍切片中做出正確診斷非常重要。
在此次研究中,我們共收集了1 263例因CT報告胸部陰影或肺部結節送檢術中冰凍病例,對比最終的術后常規石蠟病理報告結果,冰凍診斷正確率為95.65%,誤診率為4.35%,分析如下。
3.1 制片技術問題
(1)冰凍切片過厚,不利于對送檢組織的細胞形態進行仔細觀察,所以對于不同的組織應調節冰凍切片機的溫度,保證切出厚薄最佳的組織薄片。
(2)組織褶皺增加讀片難度,當冰凍切片中判別關鍵區域的組織有皺褶時應及時與技師溝通,重新切片。
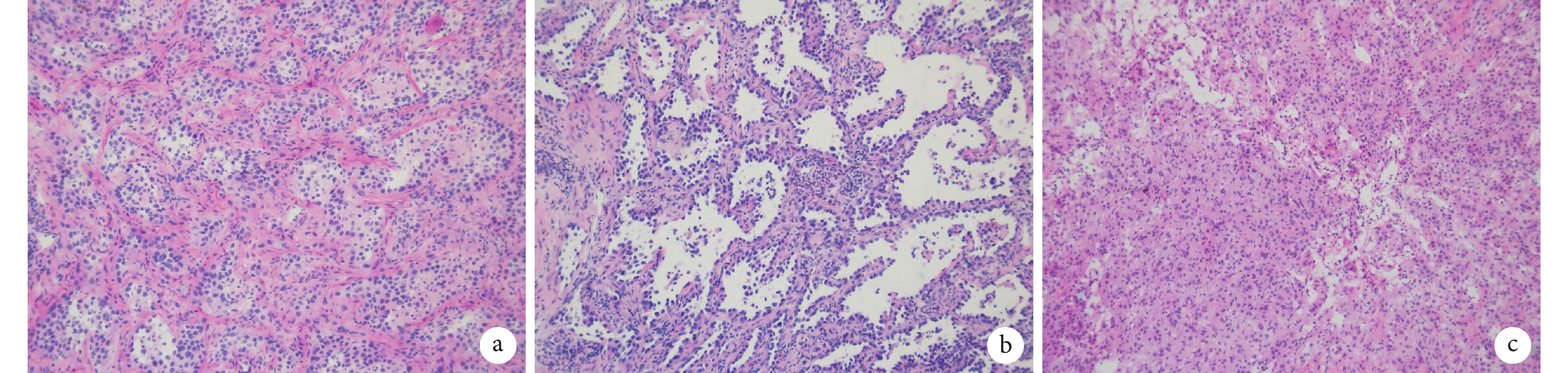
(3)產生冰晶,冰凍破壞細胞膜和其他結構導致組織發生永久性變化,冰晶的產生屬于一種人工假象,細胞核看起來更大,多形性更加明顯,容易造成過診斷;見圖1a~b。診斷醫師因考慮冰凍制片過程中會導致細胞異型性更大,選擇保守診斷為AIS,但術后石蠟診斷為浸潤性腺癌,從而導致診斷不足;見圖1c。
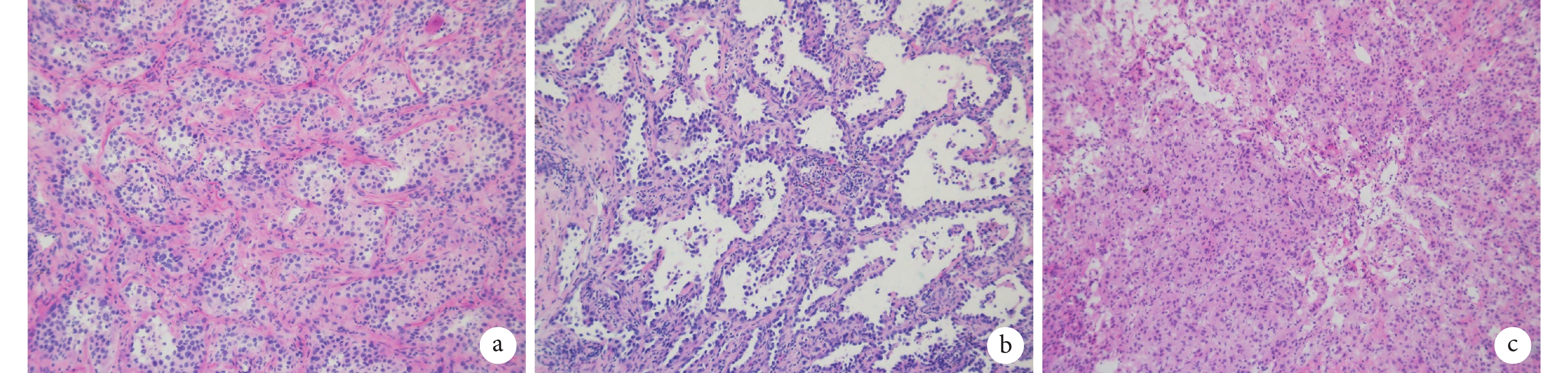 圖1
制片問題導致誤診的蘇木素-伊紅染色(×10)
圖1
制片問題導致誤診的蘇木素-伊紅染色(×10)
a:冰凍切片中細胞腫脹,并且與肺泡腔內吞噬細胞鑒別困難,冰凍診斷為腺癌;b:術后石蠟病理診斷為原位腺癌;c:因考慮冰凍制片過程中會導致細胞異型性更大,選擇保守診斷為原位腺癌,但術后石蠟病理診斷為浸潤性腺癌
3.2 冰凍取材的注意事項
在本組研究中,有6例病例在冰凍取材時未準確取到腫瘤成分,術后診斷1例為附壁生長為主的腺癌,5例為AIS。如圖2a所示,冰凍組織制片鏡下僅表現為肺部彈性纖維瘢痕伴碳末沉積,未見明確腫瘤細胞。為避免因取材造成的冰凍診斷假陰性,應注意以下幾點:(1)當冰凍切片出現陰性結果時,應考慮進行額外取材,如未發現可觸及的結節,則將標本連續切成薄片,仔細檢查每片是否有可見病灶,并輕輕觸診,病變可能是較周圍肺實質稍硬的細微區域,顏色較周圍肺實質淺[6];(2)標本中如果無法識別病變,則必須考慮病變未被切除的可能性,要及時與臨床醫生溝通;(3)對于小的病變,臨床可在送檢時使用縫線進行標記,幫助病理醫師更好地尋找腫物。另外,應避免冰凍結果假陽性,其中,在冰凍取材、制片過程中應避免污染。如圖2b中所見,肺泡腔內見核異型細胞團,冰凍診斷考慮為污染,外科予以楔形切除,該病例術后病理為壞死性肉芽腫性炎。
 圖2
取材問題導致誤診的蘇木素-伊紅染色(×10)
圖2
取材問題導致誤診的蘇木素-伊紅染色(×10)
a:冰凍切片鏡下僅表現為肺部彈性纖維瘢痕,伴碳末沉積;b:箭頭處肺泡腔內可見小團顯著核異型細胞,考慮為污染
3.3 病理醫師診斷經驗不足
術中冰凍檢查要求病理醫師在十幾分鐘內做出正確診斷,這需要病理醫師有豐富的診斷經驗和很高的診斷水平。肺部疾病有很多病種在石蠟切片中都很難做出正確診斷,需要借助免疫組織化學染色和特殊染色。冰凍病理中目前尚未普遍應用術中快速免疫組織化學染色方法,所以更考驗診斷醫師的能力。當遇到診斷困難的病例,要與臨床醫生溝通,并求助高年資病理醫師或科室討論后給出最終診斷。
3.4 部分疾病難以在術中冰凍切片中明確診斷
3.4.1 浸潤性腺癌、AIS與MIA
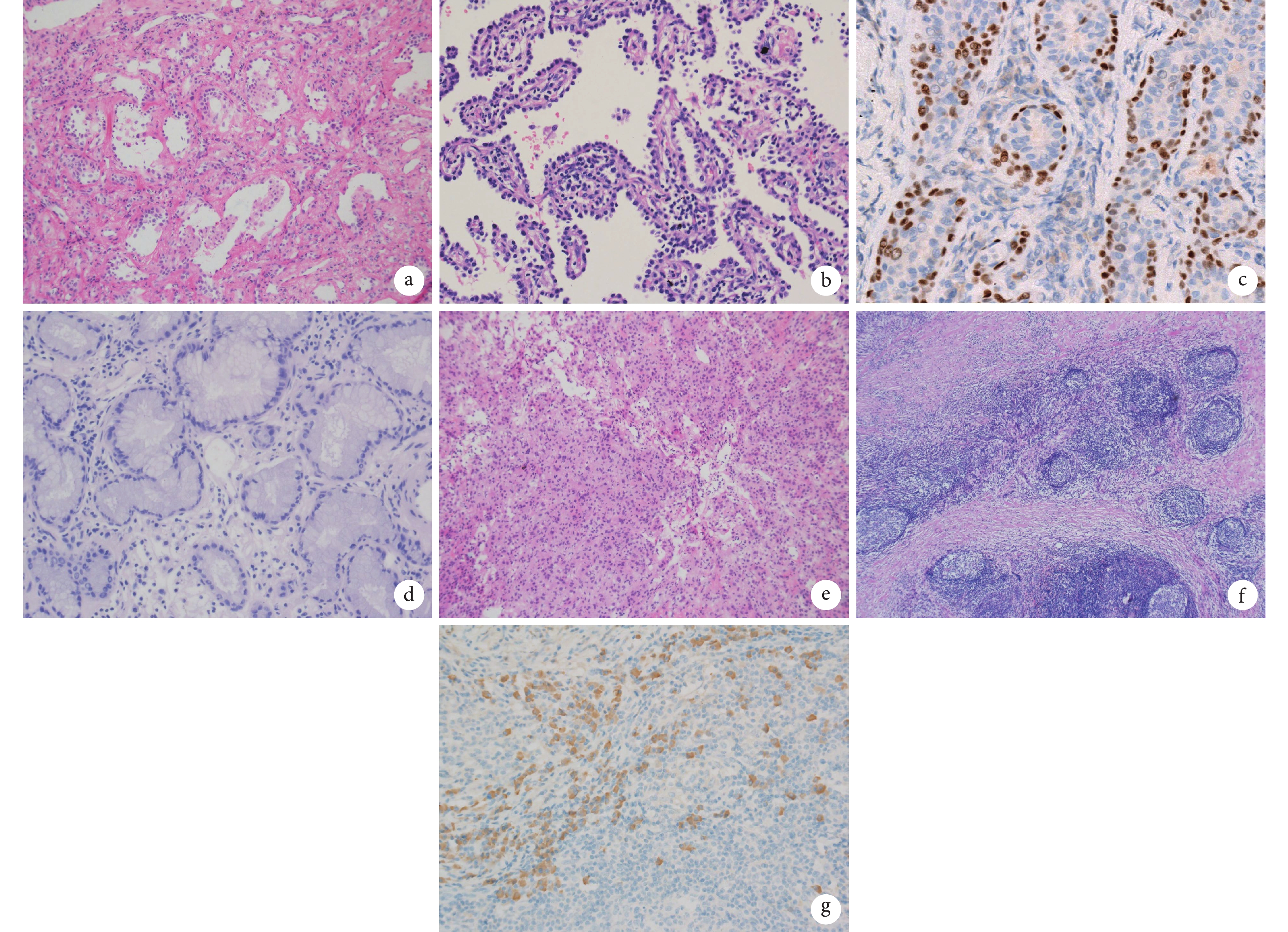
在本組研究中,25例病例為浸潤性腺癌、MIA和AIS的判斷失誤,誤診構成比占45.5%。其中15例冰凍病理診斷為AIS,術后石蠟病理診斷為浸潤性腺癌,歸為冰凍病理診斷不足;10例冰凍病理診斷為浸潤性腺癌,術后石蠟病理診斷4例為MIA,6例為AIS,歸為冰凍病理過診斷。首先,判斷腫瘤浸潤及浸潤灶大小是這3種病變診斷與鑒別診斷的關鍵,可以觀察間質是否有纖維反應及炎癥反應,細胞異型性是否較周圍附壁生長的腫瘤細胞更異型等。如圖3a所示,由于受到肺泡塌陷、間質纖維化和炎癥的影響,局部AIS的腫瘤性肺泡內陷,但并非真正的浸潤,內陷的腫瘤細胞形態與未內陷的AIS形態一致,所以應診斷為AIS。另外,有學者[7-8]研究彈力纖維染色在判斷腫瘤浸潤中的作用,且證實以彈力纖維的完整性作為肺腺癌侵襲程度的判斷標準是可行的。AIS肺泡間隔中的彈力纖維輕度增生,彈力纖維連續而完整,排列方向規則,分布均勻,肺泡結構保留,未見破壞;而MIA及浸潤性腺癌中因腫瘤的間質反應,癌細胞周圍的彈力纖維增生、減少甚至缺失,排列方向紊亂、分布不均,原有的肺泡結構被破壞。
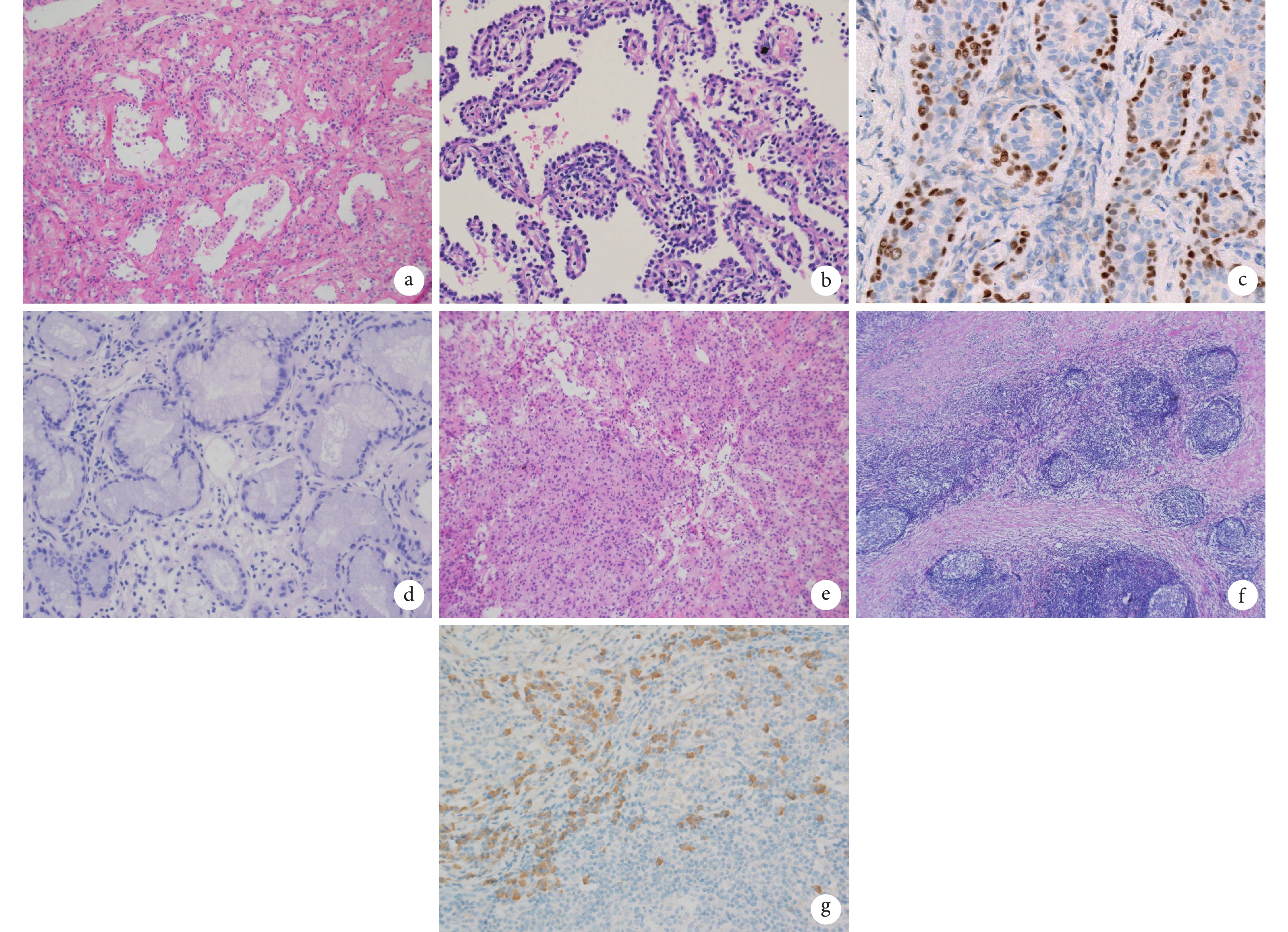 圖3
冰凍切片難以明確診斷的疾病
圖3
冰凍切片難以明確診斷的疾病
a:由于受到肺泡塌陷、間質纖維化和炎癥的影響,局部原位腺癌的腫瘤性肺泡內陷,但并非真正的浸潤,內陷的腫瘤細胞形態與未內陷的原位腺癌形態一致(HE,×10);b:有時由于切面或制片的關系,原位腺癌可以形成少量的假乳頭結構(HE,×20);c:細支氣管腺瘤,p40免疫組織化學染色顯示出基底細胞層(×20);d:浸潤性黏液腺癌,分化較好的柱狀黏液細胞形成腺管狀結構,無基底細胞層(HE,×20);e:冰凍切片中僅可見乳頭狀結構,未見其他3種結構(HE,×10);f:肺組織中正常肺泡結構消失,代之以明顯的纖維化及大量淋巴細胞、漿細胞浸潤伴淋巴濾泡形成(HE,×10);g:IgG4免疫組織化學染色陽性漿細胞數>50個/高倍視野(×20)
其次,腫瘤的氣腔播散(spread through air spaces,STAS)、淋巴管、血管、氣道或胸膜的浸潤均屬于浸潤的表現,一旦出現則不能診斷為AIS和/或MIA,而需診斷為浸潤性腺癌[9-10]。最后,由于冰凍取材只能反映所取部分組織的情況,具有一定的隨機性,對于AIS和MIA的明確診斷需要評估石蠟切片上的整個病變[11],如果決定手術方式,則需要一系列臨床特征的判斷,例如影像學表現及影像學診斷[12]。在Liu等[13]的研究中,AIS/MIA術中冰凍切片診斷在術后病理升級為浸潤性腺癌的發生率為4.6%,其中貼壁型占56.5%,腺管型占39.1%,乳頭型占4.3%。國內外指南[4,13-14]指出,對于冰凍診斷AIS/MIA的病例,術中行楔形切除,術后病理最終診斷為浸潤性腺癌,需根據浸潤性腺癌的亞型決定下一步處理方案:若為微乳頭型或實體型,建議再次手術切除肺段或肺葉;若為附壁型、乳頭型或腺管型,則建議隨訪。
術中病理診斷是判斷腫瘤是否浸潤的直接途徑,但也具有其局限性,臨床醫生需充分結合肺部結節的CT表現,包括結節大小和密度、邊界是否有毛刺征和胸膜牽拉等,做出判斷,選擇最終的手術方式。
3.4.2 AIS與微乳頭狀腺癌
在本組研究中,有2例冰凍報告為微乳頭狀腺癌與AIS待鑒別,術后石蠟病理診斷1例為浸潤性腺癌,1例為AIS。有時由于切面或制片的關系,AIS可以形成少量的假乳頭(圖3b),并不是真正具有二級和三級分支的乳頭狀結構,容易與乳頭狀腺癌和/或微乳頭狀腺癌混淆。AIS的癌細胞沿著肺泡壁生長,細胞僅見輕度異型性,而乳頭狀腺癌和微乳頭狀腺癌的腫瘤細胞異型性較大,且細胞常擁擠、重疊[15]。
3.4.3 AAH、AIS與反應性增生
在本組研究中,有3例冰凍病理診斷為AAH,術后石蠟病理診斷為AIS;有2例冰凍考慮為肺泡上皮良性反應性增生,術后石蠟病理診斷分別為AAH和AIS。AAH與AIS均屬于肺腺癌的浸潤前病變,其鑒別要點主要是觀察肺泡上皮的密度以及與周圍正常肺泡的關系,AAH的腫瘤細胞在肺泡壁上常是不連續排列的,相對而言AIS中的腫瘤細胞排列密集,通常無明顯間隙;AAH與周圍正常的肺泡呈漸續性轉換,而AIS的腫瘤性肺泡形態與周圍正常肺泡轉換更加突然[16]。相對于AAH與肺泡上皮反應性增生來說,AIS表現出更明顯的細胞異型性,例如核大小不一、非典型增生和不規則的細胞核、突出的大核仁(<10%的病例)和非典型核分裂像(約25%的病例)[17]。對于早期病變,包括AAH、AIS、MIA及附壁生長為主的腺癌,不同病理醫師的冰凍診斷一致率并不高[18]。
3.4.4 細支氣管腺瘤與黏液性腫瘤的鑒別
在本組研究中,有10例病例在冰凍切片中僅提示臨床細支氣管腺瘤與黏液腺癌待鑒別,最終,7例石蠟結果為黏液腺癌,2例為黏液型AIS,1例為細支氣管腺瘤,可見在冰凍切片中鑒別細支氣管腺瘤與黏液腺癌十分困難。細支氣管腺瘤是由Chang等[19]近年來新提出的診斷名詞,屬于一種良性病變,最先是由Ishikawa[20]在2002年首先報道并命名為“纖毛黏液結節性乳頭狀腫瘤(ciliated muconodular papillary tumor of the peripheral lung,CMPT)”。其組織學特點是由基底細胞層和腔面細胞層構成的雙層結構,組織學上可出現纖毛細胞性微乳頭、沿肺泡壁跳躍式生長、肺泡間隔增寬以及肺泡壁斷裂后充滿黏液的黏液湖,形態學與浸潤性黏液腺癌、腺泡型腺癌等惡性腫瘤非常相似。診斷細支氣管腺瘤的關鍵是要識別是否存在連續的基底細胞層纖毛細胞,冰凍切片中對于存在多層基底細胞比較容易辨認,但對僅存在單層基底細胞時辨認有一定的困難,并且在冰凍切片中,纖毛可能表現為游離緣的皺褶或頂端胞質突,不容易辨認為纖毛細胞,這給在冰凍切片上做出正確診斷帶來巨大挑戰[21-22]。應用免疫組織化學染色p63、p40、CK5/6可以很好地顯示出細支氣管腺瘤中的基底細胞層(圖3c),而在圖3d所示的浸潤性黏液腺癌中,分化較好的柱狀黏液細胞形成腺管狀結構,p40、p63免疫組織化學染色均提示無基底細胞層。對于此類在冰凍診斷難以區分的病例,臨床醫生與病理醫生應建立閉環式交流、學習,追蹤術后石蠟結果,總結影像學表現及冰凍診斷的疑難點。
3.4.5 硬化性肺細胞瘤
在本組研究中,有2例冰凍報告為腺瘤與腺癌待鑒別,術后石蠟病理診斷1例為浸潤性腺癌,1例為硬化性肺細胞瘤;另有2例冰凍報告為硬化性肺細胞瘤,術后診斷1例為AIS,1例為乳頭狀腺瘤。硬化性肺細胞瘤鏡下腫瘤細胞的結構可表現為實性區、乳頭區、硬化區及血管瘤樣區,但多數腫瘤同時含有兩種或兩種以上結構,比例不等,由于冰凍切片無法充分取材,可僅出現單一成分,無法顯示特征性的4種結構以提示診斷。如圖3e所示,冰凍切片中僅可見乳頭狀結構,未見其他3種結構,且無法準確辨認存在兩種細胞,冰凍病理未給出明確診斷,術后石蠟切片診斷為硬化性肺細胞瘤。國內學者[23]報道的427例肺部腫物冰凍病理分析中,硬化性肺細胞瘤的誤診率高達36.4%。Yang等[24]報道的59例病例中,10例(16.9%)硬化性肺泡細胞瘤誤診為惡性腫瘤,導致了不必要的肺葉切除及縱隔淋巴結清掃。因此,有學者[25]研究了術中冰凍切片快速免疫組織化學染色在硬化性肺細胞瘤冰凍診斷中的應用,發現TTF-1、ER和Ki-67將術中診斷硬化性肺細胞瘤的準確率從58.33%(7/12)提高到100.00%(12/12),可作為術中冰凍切片鑒別診斷硬化性肺細胞瘤及肺腺癌的快速免疫組織化學指標。有待進一步開展大樣本研究。
3.4.6 IgG4相關性肺疾病
在本組研究中,有3例IgG4相關性疾病在冰凍診斷中均未給出明確診斷。如圖3f所示,肺組織中正常肺泡結構消失,代之以明顯的纖維化及大量淋巴細胞、漿細胞浸潤伴淋巴濾泡形成,在沒有免疫組織化學染色輔助診斷時,需與炎性假瘤、淋巴瘤及炎癥性肺疾病鑒別。其主要病理改變為組織纖維化,術后石蠟組織免疫組織化學染色IgG4陽性漿細胞數>50個/高倍視野(圖3g),IgG4/IgG>40%,而炎癥性肺疾病中組織纖維化并不是主要改變,淋巴瘤則表現為腫瘤細胞較單一、彌漫分布,可見細胞異型性及核分裂像。在冰凍切片中診斷IgG4相關性肺疾病有一定的困難,血清IgG4升高具有提示作用[26-27]。
綜上所述,肺部病變錯綜復雜,非腫瘤性病變、良性腫瘤及惡性腫瘤均可在胸部CT中表現為肺部陰影或結節,冰凍診斷對臨床醫生選擇手術方式有重要的臨床價值。為避免過度治療或治療不足,提高冰凍診斷正確率至關重要。臨床醫生需提供患者既往腫瘤史,必要時指導病理醫生取材,取材醫師需仔細準確地找到腫瘤病灶,技術人員要制出高質量的冰凍切片,更需要經驗豐富的診斷醫師給出正確判斷。但術中冰凍診斷仍具有其局限性,臨床醫生需結合影像學檢查及臨床經驗綜合判斷。
利益沖突:無。
作者貢獻:周翔負責論文設計,篩選文獻,整理及分析數據,撰寫論文;李雪負責論文設計,進行論文質量評價,修改論文;梁小龍參與數據整理與分析;曹勍、劉洪淼、趙宏穎進行免疫組織化學染色及彈力纖維染色;游賓參與修改論文。
肺癌是世界范圍內高發惡性腫瘤之一[1],隨著胸部計算機斷層掃描(computed tomography,CT)檢查在日常醫療診療過程中的應用,以及我國居民健康體檢意識的增強,越來越多的無癥狀肺部磨玻璃結節(ground-glass nodules,GGN)和有癥狀的肺部腫瘤被發現。肺部腫瘤的術前診斷方法包括經纖維支氣管鏡肺活檢和CT引導下經皮肺穿刺等,但術前穿刺具有一定的局限性,活檢組織可能無法很好地顯示出腫瘤的主要特點,病理診斷困難。因此,肺部腫瘤的冰凍送檢率很高,術中快速冰凍病理診斷成為一項重要工作。
由于術中冰凍檢查對病變良惡性的判斷影響外科醫師對手術方式的選擇,但術中冰凍檢查具有其局限性,如何避免對患者造成過度治療或治療不足是對臨床醫生及病理醫生共同的考驗。Shima等[2]在其研究中探討了避免對術中診斷為原位腺癌(adenocarcinoma in situ,AIS)的病例造成過度治療的可行性。陳金平等[3]分析了肺原發性良性黏液上皮性病變冰凍病理誤診為黏液腺癌的主要原因。提高術中冰凍病理診斷的準確率極為重要,本文通過對我院1 263例肺部結節術中冰凍診斷情況進行分析,探討冰凍誤診的主要原因,提高日后冰凍診斷的準確性。
1 資料與方法
1.1 一般資料
收集首都醫科大學附屬北京朝陽醫院病理科2021年1月—2022年1月期間肺部結節病例的術中冰凍病理診斷結果及術后石蠟病理診斷結果。納入標準:(1)手術過程中送檢術中冰凍病理檢查;(2)冰凍制片成功;(3)手術切除標本經過充分固定、取材;(4)術后石蠟病理診斷明確。排除術后病理診斷不明確、有爭議的病例。
1.2 方法
冰凍對照及冰凍剩余標本經10%中性福爾馬林充分固定,常規脫水,石蠟包埋,制片,蘇木素-伊紅染色。免疫組織化學染色采用EnVision兩步法,按照試劑盒說明書進行操作。免疫組織化學抗體包括p40、p63、CK5/6、EMA、CKpan,其中p40抗體購自羅氏公司,CKpan購自中杉公司,p63、CK5/6及EMA抗體購自邁新生物技術有限公司。特殊染色彈力纖維染色試劑購自貝索公司,網織纖維染色試劑購自羅氏公司。由兩名高年資病理醫師重新閱片,將1 263例冰凍切片與術后石蠟切片進行比對,并結合術后石蠟組織的免疫組織化學染色及特殊染色結果,以最終手術切除標本的石蠟病理結果為金標準,分析術中冰凍切片誤診病例的主要原因,總結易誤診病例的類型及在冰凍中鑒別診斷的要點及難點。
1.3 倫理審查
本研究已通過首都醫科大學附屬北京朝陽醫院醫學倫理審查委員會審批,審查編號:2021-科-614。
2 結果
按照納入標準共1 178例患者的1 263例冰凍病理結果納入研究,其中男475例、女703例,平均年齡58.7(23~86)歲。1 263例冰凍送檢的肺部病變中,主要為腫瘤性病變,其中惡性腫瘤以浸潤性腺癌最多見(524例,41.49%),其次分別為AIS(292例,23.12%)、微浸潤性腺癌(minimally invasive adenocarcinoma,MIA,191例,15.12%)、鱗狀細胞癌(38例,3.01%)、黏液腺癌(20例,1.58%)、高級別神經內分泌癌(14例,1.11%)、黏液型AIS(3例,0.24%)等。良性腫瘤性病變最常見的為錯構瘤(23例,1.82%),其次分別為硬化性肺細胞瘤(7例,0.55%)、細支氣管腺瘤(3例,0.24%)、乳頭狀腺瘤(1例,0.08%)。在非腫瘤性病變中,常見病變分別為局灶纖維組織增生伴玻璃樣變性(21例,1.66)、結核(13例,1.03%)、其他肉芽腫性炎(12例,0.95%)、IgG4相關性疾病(3例,0.24%)等。
冰凍診斷正確率為95.65%,誤診率為4.35%,冰凍誤診病例55例,依次為:浸潤性腺癌18例(3.44%)、AIS 17例(5.82%)、黏液腺癌7例(35.00%)、MIA 4例(2.09%)、IgG4相關性疾病3例(100.00%)、黏液型AIS 2例(66.67%)、非典型腺瘤樣增生(atypical adenomatous hyperplasia,AAH)1例(16.67%)、硬化性肺細胞瘤1例(14.29%)、細支氣管腺瘤1例(33.33%)、乳頭狀腺瘤1例(100.00%)。病種構成及誤診構成比見表1。誤診病例冰凍切片結果與術后石蠟結果對比見表2,各誤診原因所占比例見表3。
3 討論
術中快速冰凍診斷已成為一項成熟的病理技術,與普通病理診斷不同的是,術中病理診斷主要目的是回答指導手術方式所需的具體問題,如:(1)病變性質;(2)手術切緣是否切凈,在肺部惡性腫瘤中主要是判定支氣管斷端是否切凈;(3)淋巴結有無癌轉移等。在肺臟腫瘤中,對于非小細胞肺癌,外科醫生主要選擇肺葉切除和/或淋巴結清掃,對于AIS或MIA,可以選擇更為局限的手術方式,如肺楔形切除、亞肺段切除或肺段切除,無需淋巴結清掃[4-5],因此在冰凍切片中做出正確診斷非常重要。
在此次研究中,我們共收集了1 263例因CT報告胸部陰影或肺部結節送檢術中冰凍病例,對比最終的術后常規石蠟病理報告結果,冰凍診斷正確率為95.65%,誤診率為4.35%,分析如下。
3.1 制片技術問題
(1)冰凍切片過厚,不利于對送檢組織的細胞形態進行仔細觀察,所以對于不同的組織應調節冰凍切片機的溫度,保證切出厚薄最佳的組織薄片。
(2)組織褶皺增加讀片難度,當冰凍切片中判別關鍵區域的組織有皺褶時應及時與技師溝通,重新切片。
(3)產生冰晶,冰凍破壞細胞膜和其他結構導致組織發生永久性變化,冰晶的產生屬于一種人工假象,細胞核看起來更大,多形性更加明顯,容易造成過診斷;見圖1a~b。診斷醫師因考慮冰凍制片過程中會導致細胞異型性更大,選擇保守診斷為AIS,但術后石蠟診斷為浸潤性腺癌,從而導致診斷不足;見圖1c。
 圖1
制片問題導致誤診的蘇木素-伊紅染色(×10)
圖1
制片問題導致誤診的蘇木素-伊紅染色(×10)
a:冰凍切片中細胞腫脹,并且與肺泡腔內吞噬細胞鑒別困難,冰凍診斷為腺癌;b:術后石蠟病理診斷為原位腺癌;c:因考慮冰凍制片過程中會導致細胞異型性更大,選擇保守診斷為原位腺癌,但術后石蠟病理診斷為浸潤性腺癌
3.2 冰凍取材的注意事項
在本組研究中,有6例病例在冰凍取材時未準確取到腫瘤成分,術后診斷1例為附壁生長為主的腺癌,5例為AIS。如圖2a所示,冰凍組織制片鏡下僅表現為肺部彈性纖維瘢痕伴碳末沉積,未見明確腫瘤細胞。為避免因取材造成的冰凍診斷假陰性,應注意以下幾點:(1)當冰凍切片出現陰性結果時,應考慮進行額外取材,如未發現可觸及的結節,則將標本連續切成薄片,仔細檢查每片是否有可見病灶,并輕輕觸診,病變可能是較周圍肺實質稍硬的細微區域,顏色較周圍肺實質淺[6];(2)標本中如果無法識別病變,則必須考慮病變未被切除的可能性,要及時與臨床醫生溝通;(3)對于小的病變,臨床可在送檢時使用縫線進行標記,幫助病理醫師更好地尋找腫物。另外,應避免冰凍結果假陽性,其中,在冰凍取材、制片過程中應避免污染。如圖2b中所見,肺泡腔內見核異型細胞團,冰凍診斷考慮為污染,外科予以楔形切除,該病例術后病理為壞死性肉芽腫性炎。
 圖2
取材問題導致誤診的蘇木素-伊紅染色(×10)
圖2
取材問題導致誤診的蘇木素-伊紅染色(×10)
a:冰凍切片鏡下僅表現為肺部彈性纖維瘢痕,伴碳末沉積;b:箭頭處肺泡腔內可見小團顯著核異型細胞,考慮為污染
3.3 病理醫師診斷經驗不足
術中冰凍檢查要求病理醫師在十幾分鐘內做出正確診斷,這需要病理醫師有豐富的診斷經驗和很高的診斷水平。肺部疾病有很多病種在石蠟切片中都很難做出正確診斷,需要借助免疫組織化學染色和特殊染色。冰凍病理中目前尚未普遍應用術中快速免疫組織化學染色方法,所以更考驗診斷醫師的能力。當遇到診斷困難的病例,要與臨床醫生溝通,并求助高年資病理醫師或科室討論后給出最終診斷。
3.4 部分疾病難以在術中冰凍切片中明確診斷
3.4.1 浸潤性腺癌、AIS與MIA
在本組研究中,25例病例為浸潤性腺癌、MIA和AIS的判斷失誤,誤診構成比占45.5%。其中15例冰凍病理診斷為AIS,術后石蠟病理診斷為浸潤性腺癌,歸為冰凍病理診斷不足;10例冰凍病理診斷為浸潤性腺癌,術后石蠟病理診斷4例為MIA,6例為AIS,歸為冰凍病理過診斷。首先,判斷腫瘤浸潤及浸潤灶大小是這3種病變診斷與鑒別診斷的關鍵,可以觀察間質是否有纖維反應及炎癥反應,細胞異型性是否較周圍附壁生長的腫瘤細胞更異型等。如圖3a所示,由于受到肺泡塌陷、間質纖維化和炎癥的影響,局部AIS的腫瘤性肺泡內陷,但并非真正的浸潤,內陷的腫瘤細胞形態與未內陷的AIS形態一致,所以應診斷為AIS。另外,有學者[7-8]研究彈力纖維染色在判斷腫瘤浸潤中的作用,且證實以彈力纖維的完整性作為肺腺癌侵襲程度的判斷標準是可行的。AIS肺泡間隔中的彈力纖維輕度增生,彈力纖維連續而完整,排列方向規則,分布均勻,肺泡結構保留,未見破壞;而MIA及浸潤性腺癌中因腫瘤的間質反應,癌細胞周圍的彈力纖維增生、減少甚至缺失,排列方向紊亂、分布不均,原有的肺泡結構被破壞。
 圖3
冰凍切片難以明確診斷的疾病
圖3
冰凍切片難以明確診斷的疾病
a:由于受到肺泡塌陷、間質纖維化和炎癥的影響,局部原位腺癌的腫瘤性肺泡內陷,但并非真正的浸潤,內陷的腫瘤細胞形態與未內陷的原位腺癌形態一致(HE,×10);b:有時由于切面或制片的關系,原位腺癌可以形成少量的假乳頭結構(HE,×20);c:細支氣管腺瘤,p40免疫組織化學染色顯示出基底細胞層(×20);d:浸潤性黏液腺癌,分化較好的柱狀黏液細胞形成腺管狀結構,無基底細胞層(HE,×20);e:冰凍切片中僅可見乳頭狀結構,未見其他3種結構(HE,×10);f:肺組織中正常肺泡結構消失,代之以明顯的纖維化及大量淋巴細胞、漿細胞浸潤伴淋巴濾泡形成(HE,×10);g:IgG4免疫組織化學染色陽性漿細胞數>50個/高倍視野(×20)
其次,腫瘤的氣腔播散(spread through air spaces,STAS)、淋巴管、血管、氣道或胸膜的浸潤均屬于浸潤的表現,一旦出現則不能診斷為AIS和/或MIA,而需診斷為浸潤性腺癌[9-10]。最后,由于冰凍取材只能反映所取部分組織的情況,具有一定的隨機性,對于AIS和MIA的明確診斷需要評估石蠟切片上的整個病變[11],如果決定手術方式,則需要一系列臨床特征的判斷,例如影像學表現及影像學診斷[12]。在Liu等[13]的研究中,AIS/MIA術中冰凍切片診斷在術后病理升級為浸潤性腺癌的發生率為4.6%,其中貼壁型占56.5%,腺管型占39.1%,乳頭型占4.3%。國內外指南[4,13-14]指出,對于冰凍診斷AIS/MIA的病例,術中行楔形切除,術后病理最終診斷為浸潤性腺癌,需根據浸潤性腺癌的亞型決定下一步處理方案:若為微乳頭型或實體型,建議再次手術切除肺段或肺葉;若為附壁型、乳頭型或腺管型,則建議隨訪。
術中病理診斷是判斷腫瘤是否浸潤的直接途徑,但也具有其局限性,臨床醫生需充分結合肺部結節的CT表現,包括結節大小和密度、邊界是否有毛刺征和胸膜牽拉等,做出判斷,選擇最終的手術方式。
3.4.2 AIS與微乳頭狀腺癌
在本組研究中,有2例冰凍報告為微乳頭狀腺癌與AIS待鑒別,術后石蠟病理診斷1例為浸潤性腺癌,1例為AIS。有時由于切面或制片的關系,AIS可以形成少量的假乳頭(圖3b),并不是真正具有二級和三級分支的乳頭狀結構,容易與乳頭狀腺癌和/或微乳頭狀腺癌混淆。AIS的癌細胞沿著肺泡壁生長,細胞僅見輕度異型性,而乳頭狀腺癌和微乳頭狀腺癌的腫瘤細胞異型性較大,且細胞常擁擠、重疊[15]。
3.4.3 AAH、AIS與反應性增生
在本組研究中,有3例冰凍病理診斷為AAH,術后石蠟病理診斷為AIS;有2例冰凍考慮為肺泡上皮良性反應性增生,術后石蠟病理診斷分別為AAH和AIS。AAH與AIS均屬于肺腺癌的浸潤前病變,其鑒別要點主要是觀察肺泡上皮的密度以及與周圍正常肺泡的關系,AAH的腫瘤細胞在肺泡壁上常是不連續排列的,相對而言AIS中的腫瘤細胞排列密集,通常無明顯間隙;AAH與周圍正常的肺泡呈漸續性轉換,而AIS的腫瘤性肺泡形態與周圍正常肺泡轉換更加突然[16]。相對于AAH與肺泡上皮反應性增生來說,AIS表現出更明顯的細胞異型性,例如核大小不一、非典型增生和不規則的細胞核、突出的大核仁(<10%的病例)和非典型核分裂像(約25%的病例)[17]。對于早期病變,包括AAH、AIS、MIA及附壁生長為主的腺癌,不同病理醫師的冰凍診斷一致率并不高[18]。
3.4.4 細支氣管腺瘤與黏液性腫瘤的鑒別
在本組研究中,有10例病例在冰凍切片中僅提示臨床細支氣管腺瘤與黏液腺癌待鑒別,最終,7例石蠟結果為黏液腺癌,2例為黏液型AIS,1例為細支氣管腺瘤,可見在冰凍切片中鑒別細支氣管腺瘤與黏液腺癌十分困難。細支氣管腺瘤是由Chang等[19]近年來新提出的診斷名詞,屬于一種良性病變,最先是由Ishikawa[20]在2002年首先報道并命名為“纖毛黏液結節性乳頭狀腫瘤(ciliated muconodular papillary tumor of the peripheral lung,CMPT)”。其組織學特點是由基底細胞層和腔面細胞層構成的雙層結構,組織學上可出現纖毛細胞性微乳頭、沿肺泡壁跳躍式生長、肺泡間隔增寬以及肺泡壁斷裂后充滿黏液的黏液湖,形態學與浸潤性黏液腺癌、腺泡型腺癌等惡性腫瘤非常相似。診斷細支氣管腺瘤的關鍵是要識別是否存在連續的基底細胞層纖毛細胞,冰凍切片中對于存在多層基底細胞比較容易辨認,但對僅存在單層基底細胞時辨認有一定的困難,并且在冰凍切片中,纖毛可能表現為游離緣的皺褶或頂端胞質突,不容易辨認為纖毛細胞,這給在冰凍切片上做出正確診斷帶來巨大挑戰[21-22]。應用免疫組織化學染色p63、p40、CK5/6可以很好地顯示出細支氣管腺瘤中的基底細胞層(圖3c),而在圖3d所示的浸潤性黏液腺癌中,分化較好的柱狀黏液細胞形成腺管狀結構,p40、p63免疫組織化學染色均提示無基底細胞層。對于此類在冰凍診斷難以區分的病例,臨床醫生與病理醫生應建立閉環式交流、學習,追蹤術后石蠟結果,總結影像學表現及冰凍診斷的疑難點。
3.4.5 硬化性肺細胞瘤
在本組研究中,有2例冰凍報告為腺瘤與腺癌待鑒別,術后石蠟病理診斷1例為浸潤性腺癌,1例為硬化性肺細胞瘤;另有2例冰凍報告為硬化性肺細胞瘤,術后診斷1例為AIS,1例為乳頭狀腺瘤。硬化性肺細胞瘤鏡下腫瘤細胞的結構可表現為實性區、乳頭區、硬化區及血管瘤樣區,但多數腫瘤同時含有兩種或兩種以上結構,比例不等,由于冰凍切片無法充分取材,可僅出現單一成分,無法顯示特征性的4種結構以提示診斷。如圖3e所示,冰凍切片中僅可見乳頭狀結構,未見其他3種結構,且無法準確辨認存在兩種細胞,冰凍病理未給出明確診斷,術后石蠟切片診斷為硬化性肺細胞瘤。國內學者[23]報道的427例肺部腫物冰凍病理分析中,硬化性肺細胞瘤的誤診率高達36.4%。Yang等[24]報道的59例病例中,10例(16.9%)硬化性肺泡細胞瘤誤診為惡性腫瘤,導致了不必要的肺葉切除及縱隔淋巴結清掃。因此,有學者[25]研究了術中冰凍切片快速免疫組織化學染色在硬化性肺細胞瘤冰凍診斷中的應用,發現TTF-1、ER和Ki-67將術中診斷硬化性肺細胞瘤的準確率從58.33%(7/12)提高到100.00%(12/12),可作為術中冰凍切片鑒別診斷硬化性肺細胞瘤及肺腺癌的快速免疫組織化學指標。有待進一步開展大樣本研究。
3.4.6 IgG4相關性肺疾病
在本組研究中,有3例IgG4相關性疾病在冰凍診斷中均未給出明確診斷。如圖3f所示,肺組織中正常肺泡結構消失,代之以明顯的纖維化及大量淋巴細胞、漿細胞浸潤伴淋巴濾泡形成,在沒有免疫組織化學染色輔助診斷時,需與炎性假瘤、淋巴瘤及炎癥性肺疾病鑒別。其主要病理改變為組織纖維化,術后石蠟組織免疫組織化學染色IgG4陽性漿細胞數>50個/高倍視野(圖3g),IgG4/IgG>40%,而炎癥性肺疾病中組織纖維化并不是主要改變,淋巴瘤則表現為腫瘤細胞較單一、彌漫分布,可見細胞異型性及核分裂像。在冰凍切片中診斷IgG4相關性肺疾病有一定的困難,血清IgG4升高具有提示作用[26-27]。
綜上所述,肺部病變錯綜復雜,非腫瘤性病變、良性腫瘤及惡性腫瘤均可在胸部CT中表現為肺部陰影或結節,冰凍診斷對臨床醫生選擇手術方式有重要的臨床價值。為避免過度治療或治療不足,提高冰凍診斷正確率至關重要。臨床醫生需提供患者既往腫瘤史,必要時指導病理醫生取材,取材醫師需仔細準確地找到腫瘤病灶,技術人員要制出高質量的冰凍切片,更需要經驗豐富的診斷醫師給出正確判斷。但術中冰凍診斷仍具有其局限性,臨床醫生需結合影像學檢查及臨床經驗綜合判斷。
利益沖突:無。
作者貢獻:周翔負責論文設計,篩選文獻,整理及分析數據,撰寫論文;李雪負責論文設計,進行論文質量評價,修改論文;梁小龍參與數據整理與分析;曹勍、劉洪淼、趙宏穎進行免疫組織化學染色及彈力纖維染色;游賓參與修改論文。