引用本文: 古麗娜孜·葉斯塔依, 王琪, 伊力哈木江·克尤木, 馬翔. 主動脈夾層細胞焦亡相關miRNAs篩選及功能分析. 中國胸心血管外科臨床雜志, 2024, 31(8): 1181-1189. doi: 10.7507/1007-4848.202305023 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
急性主動脈夾層(acute aortic dissection,AAD)發病急且進展迅速,嚴重威脅患者的生命和健康[1]。2019年全球心血管相關疾病負擔與危險因素數據[2]顯示,AAD給個人、家庭和社會帶來了沉重負擔。AAD的形成是由于血管壁無法承受腔內高壓,導致主動脈壁擴張、主動脈內側層破裂使血液從破口處流入內中膜之間,剝離的內膜將血管腔分隔形成真假腔,最壞的情況是夾層破裂,患者猝死[3]。其中急性Stanford A型主動脈夾層,若不進行緊急干預,發病1周內死亡率達50%以上[4]。目前針對AAD的治療方法中,手術被認為是根除主動脈破裂的最有效方法,包括開放手術修復和血管腔內治療。此外,一些藥物如β-阻滯劑等,已廣泛被用于AAD治療,但臨床療效有限[5]。因此,鑒于臨床上治療AAD的局限性,亟需探索AAD發病過程中可能引起血管損傷的機制,尋找其中關鍵機制及潛在的藥物治療靶點。
細胞焦亡是機體內程序性細胞死亡的方式之一[6]。近幾年,諸多研究[7]已證明焦亡在心血管疾病中發揮重要作用,如動脈粥樣硬化、心肌缺血-再灌注損傷等。焦亡發生時細胞首先形成氣道、質膜破裂、細胞內促炎因子及細胞因子的釋放,最終導致細胞炎癥與死亡,同時具有細胞凋亡和壞死的特點[8]。研究[9]發現,與正常主動脈相比,AAD主動脈中焦亡相關蛋白,如半胱氨酸天冬氨酸酶-1(cysteine aspartase-1,Caspase-1)、Nod樣受體熱蛋白結構域相關蛋白-3和凋亡相關斑點樣蛋白的表達顯著上調,這表明細胞焦亡參與了主動脈夾層的發病過程。同時,體內研究[10]表明,Caspase-1的缺失減輕了高脂飲食和血管緊張素Ⅱ誘導的AAD的發展,并減輕主動脈直徑的擴張程度。上述研究表明細胞焦亡是AAD發生發展過程中的關鍵一環,但細胞焦亡在AAD中的調控機制尚未完全闡明。
非編碼RNA(non-coding RNAs,ncRNAs)是一群沒有蛋白質編碼能力的RNA分子,占哺乳動物中所有基因組RNA的90%以上[11],其中微小RNAs(microRNAs,miRNAs)是一類長度為17~25個核苷酸的內源性ncRNAs,可以通過與靶mRNAs的3'端非翻譯區(3'UTRs)配對來調控基因表達[12-13]。近十幾年來,越來越多的研究[14-15]表明,miRNAs可能通過不同的機制參與AAD的發生發展,通過比較正常主動脈和夾層主動脈中的miRNAs表達譜篩選出異常表達的miRNAs較多,AAD患者中miR-134-5p、miR-15a、miR-23a和miR-21表達顯著上調等,都與AAD中血管病理學改變高度相關。綜上所述,我們認為miRNAs可能介導了主動脈夾層患者的焦亡病變,但具體的生物標志物及機制尚不清楚。
1 資料與方法
1.1 數據來源
基于人類AAD組織的miRNAs芯片數據來自GEO數據庫(
1.2 主動脈組織的獲取及納入和排除標準
收集AAD患者撕裂的主動脈,取材部位為升主動脈夾層破口處,大小為2 cm×2 cm;同時,收集對照健康人群的主動脈,取材部位為腹主動脈和肝臟分支吻合處,大小為1.5 cm×1.5 cm。術中留取組織標本后立即轉移至?80℃冰箱保存。納入標準:AAD組:在新疆醫科大學第一附屬醫院經全主動脈CT血管造影診斷為AAD,并接受手術治療的Stanford A型AAD患者;健康對照組:年齡、性別匹配的肝臟移植健康供體的主動脈組織。排除標準:AAD組:(1)遺傳性主動脈疾病、自身免疫或結締組織疾病;(2)家族性主動脈夾層及復發性主動脈夾層;(3)二葉式主動脈瓣等結構性心臟病;(4)合并有急性心肌梗死、急性腦梗死、嚴重肝腎疾病及癌癥。對照組:(1)自身免疫或結締組織疾病;(2)嚴重血液系統疾病、肝腎疾病及癌癥;(3)合并大血管病變。
1.3 差異表達miRNAs的篩選及靶基因預測
通過GEO數據庫下載的miRNAs芯片表達數據采用R語言軟件(version4.2.1,
1.4 AAD細胞焦亡相關基因篩選及生物信息學分析
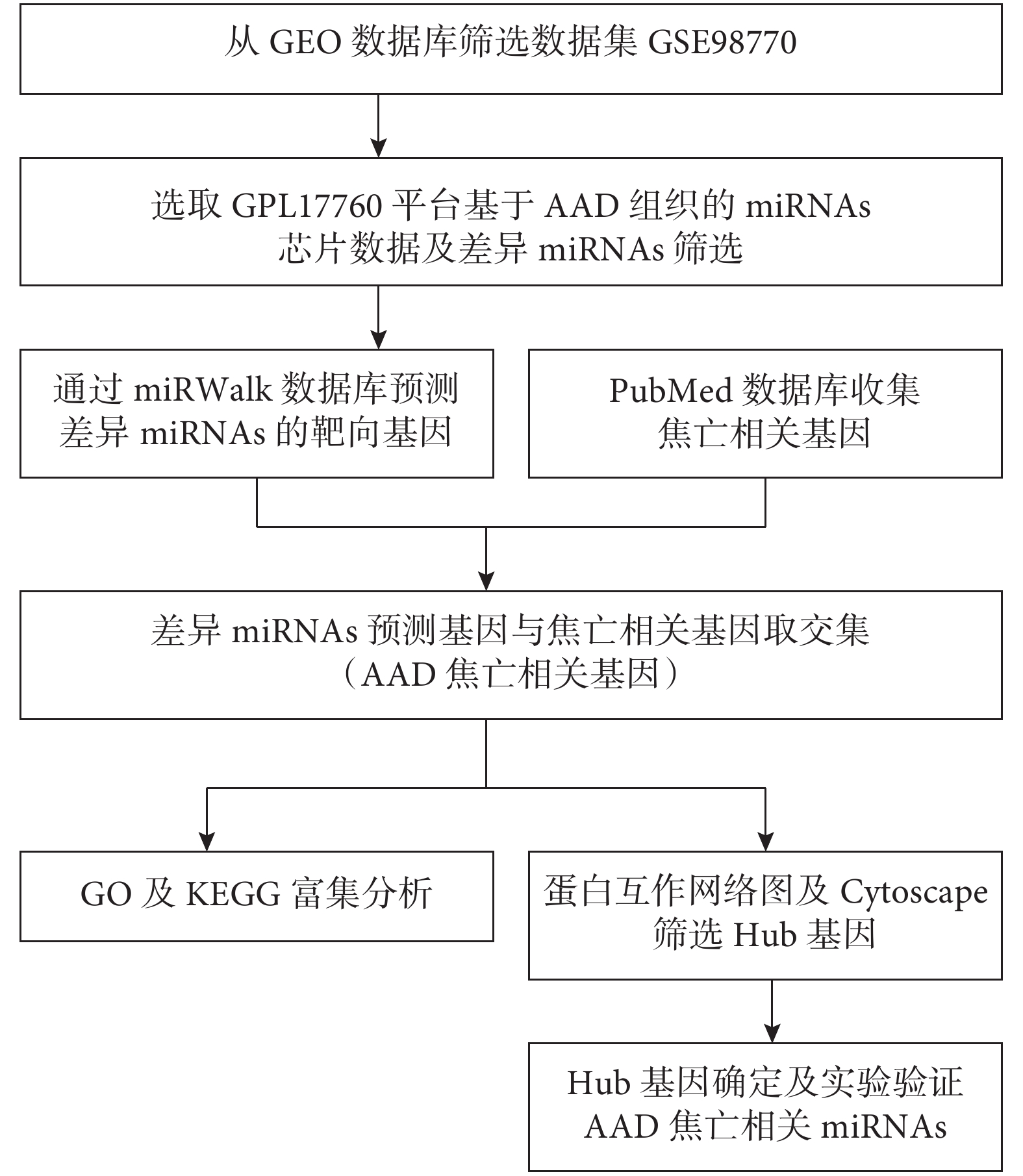
取miRWalk數據庫預測的靶向基因和細胞焦亡相關基因的交集基因,此為AAD細胞焦亡相關基因,具體研究流程見圖1。將用于基因GO和KEGG富集分析的AAD細胞焦亡相關基因導入DAVID網站,通過R語言腳本進行分析。GO富集分析包括生物過程(biological process,BP)、分子功能(molecular function,MF)和細胞成分(cellular component,CC)3個方面。富集分析以P≤0.05為差異有統計學意義。
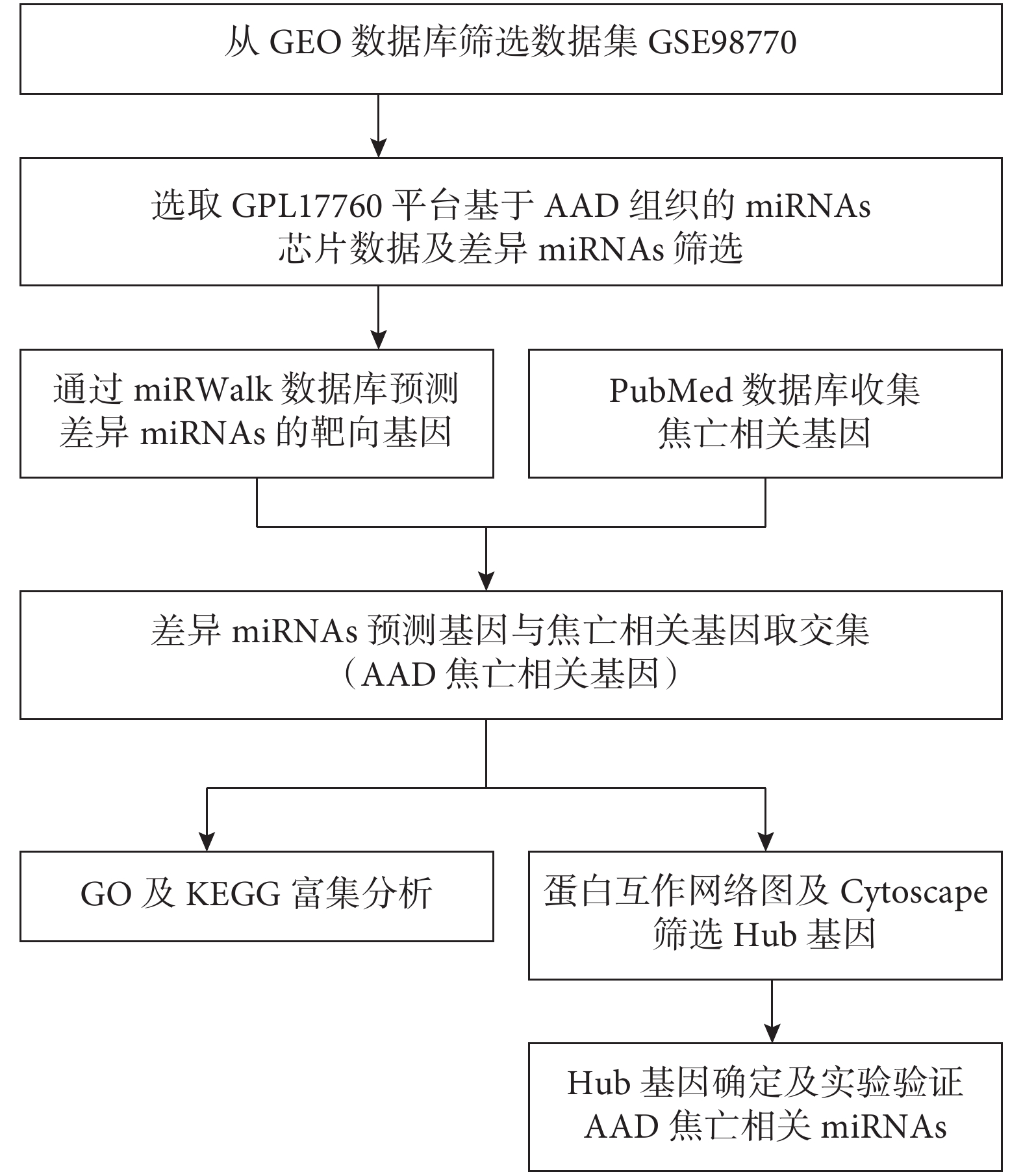 圖1
AAD細胞焦亡相關miRNAs篩選及分析流程圖
圖1
AAD細胞焦亡相關miRNAs篩選及分析流程圖
AAD:急性主動脈夾層
1.5 PPI網絡互作構建與核心基因篩選
將AAD細胞焦亡相關基因放入STRING數據庫(http://string-db.org)中構建蛋白互作(protein-protein interaction,PPI)網絡,通過Cytoscape軟件對PPI網絡進行可視化分析,進一步通過cytoHubba的Degree算法篩選核心基因,其中連通度最大的前3個基因作為AAD的關鍵細胞焦亡相關基因。
1.6 Western blotting 檢測相關蛋白
(1)提取人主動脈組織蛋白:將人主動脈組織剪碎至適量大小裝入EP管中,按比例加入裂解液和蛋白酶抑制劑,冰上裂解、勻漿;超聲波破碎儀進一步破碎組織,冰上靜置30 min;低溫高速(
1.7 RT-qPCR檢測AAD細胞焦亡相關miRNAs水平
(1)提取人主動脈總mRNA:向剪碎的主動脈組織中加入Trizol,冰上靜置5 min;在組織研磨器中研磨勻漿,將氯仿按5∶1的比例加入震蕩混勻;離心后取上清,加入等體積的異丙醇;離心后棄上清,75%乙醇洗滌沉淀3遍,用無菌無酶水溶解沉淀后測定總RNA的純度和濃度。(2)配制10 μL的ployA加尾反應體系,反應條件為37℃ 1 h,85℃ 5 s。(3)按照反轉錄試劑盒說明書將總RNA反轉錄為cDNA。(4)利用熒光實時定量PCR儀進行RT-qPCR反應:反應體系為2×qPCR Mix 10 μL,miRNA qPCR Primer 2 μL,PCR Primer 2 μL,cDNA 2 μL,ddH2O 4 μL。反應條件為95℃ 30 s(預變性),94℃ 5 s,60℃ 34 s(退火),72℃ 10 s(延伸),共40個循環。通過U6對表達數據進行歸一化,并應用2?ΔΔCT方法對結果進行分析。每個樣本檢測3次,取平均值。引物序列信息見表1。
1.8 統計學分析
采用GraphPad Prism 9.2進行統計分析。計量資料以均數±標準差( ±s)描述,組間比較采用獨立樣本t檢驗。計數資料采用頻數(百分比)描述,組間比較采用χ2檢驗。檢驗水準α=0.05。
±s)描述,組間比較采用獨立樣本t檢驗。計數資料采用頻數(百分比)描述,組間比較采用χ2檢驗。檢驗水準α=0.05。
1.9 倫理審查
本研究符合醫學倫理規范,遵從《赫爾辛基宣言》原則,本實驗經新疆醫科大學第一附屬醫院倫理委員會批準,倫理審查編號:230306-88。
2 結果
2.1 AAD細胞焦亡相關基因的選取
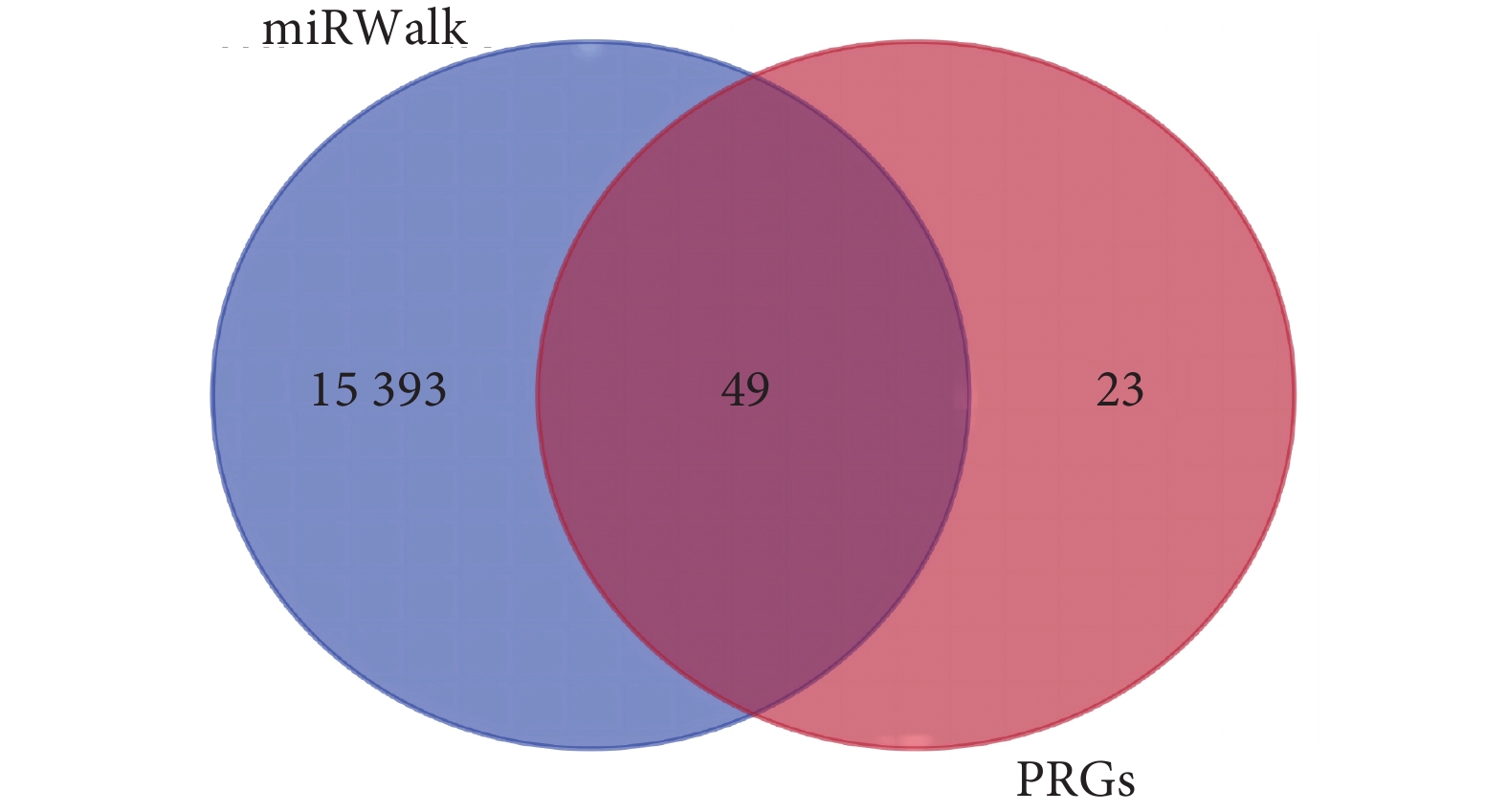
本研究通過PubMed數據庫獲取72個細胞焦亡相關基因。基于miRNAs芯片數據篩選出46個差異表達miRNAs,其中26個上調、20個下調miRNAs(見附表1,
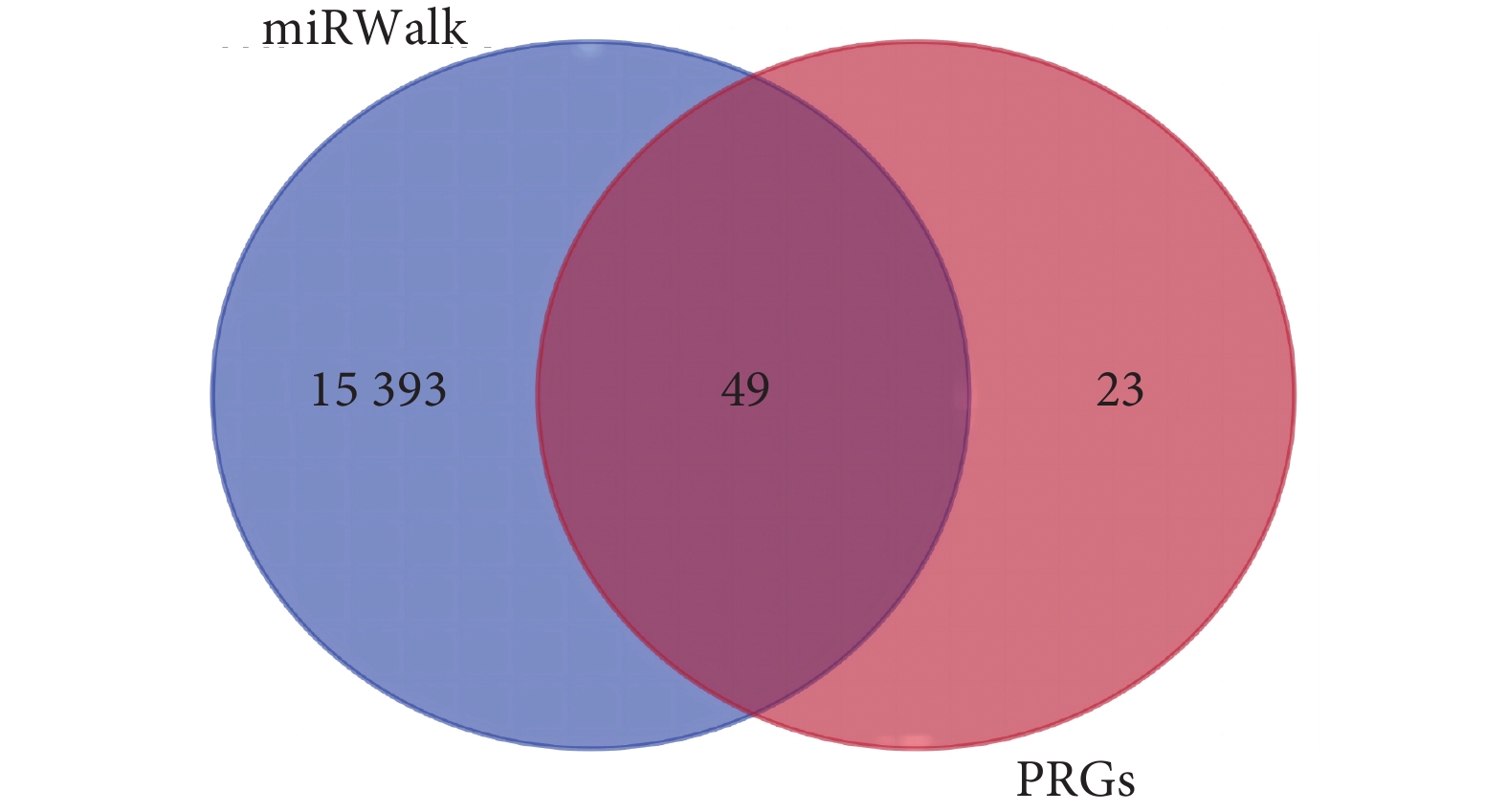 圖2
46個差異miRNAs通過miRWalk數據庫預測的靶向基因與PRGs的韋恩圖
圖2
46個差異miRNAs通過miRWalk數據庫預測的靶向基因與PRGs的韋恩圖
PRGs:細胞焦亡相關基因
2.2 GO和KEGG富集分析
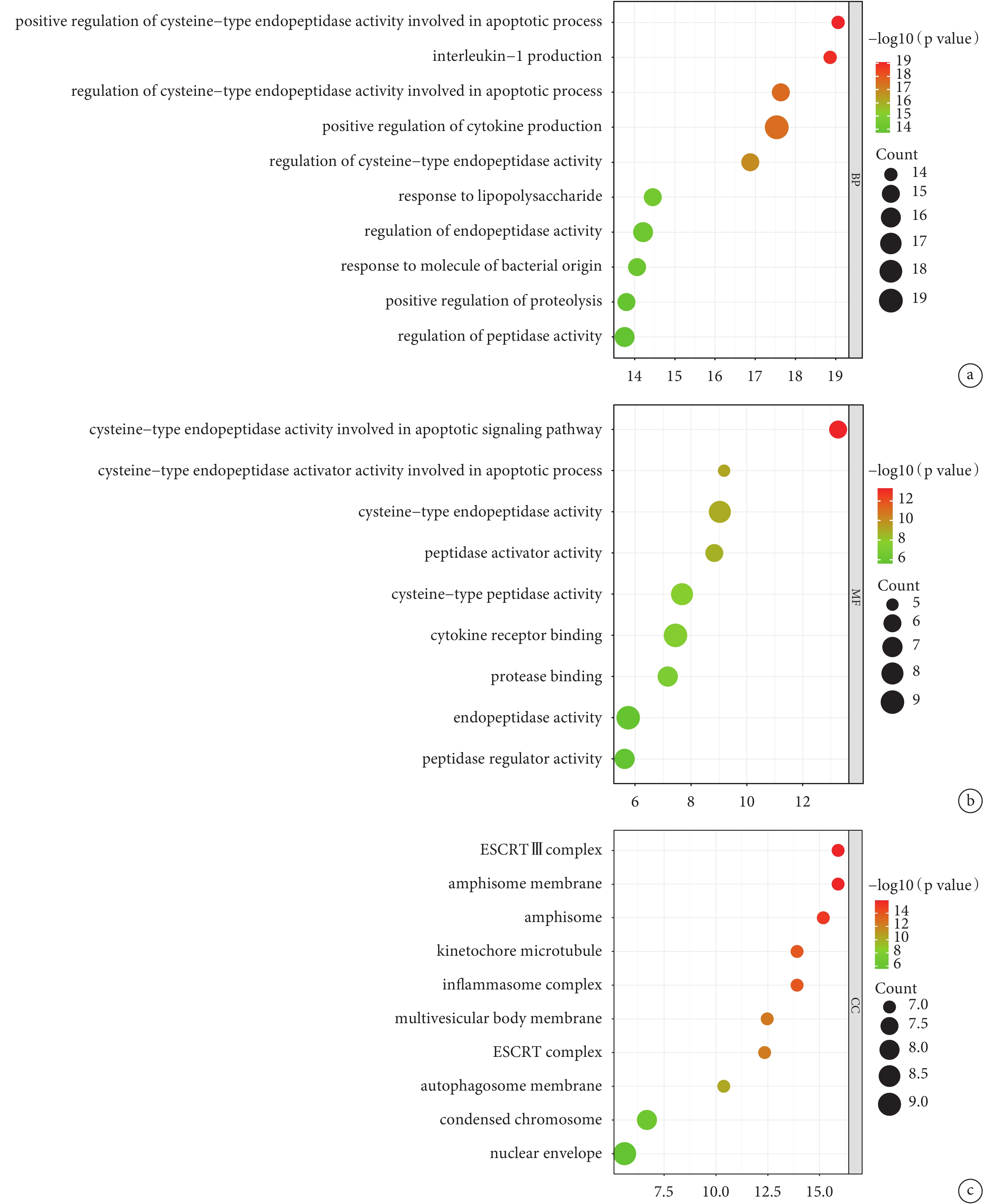
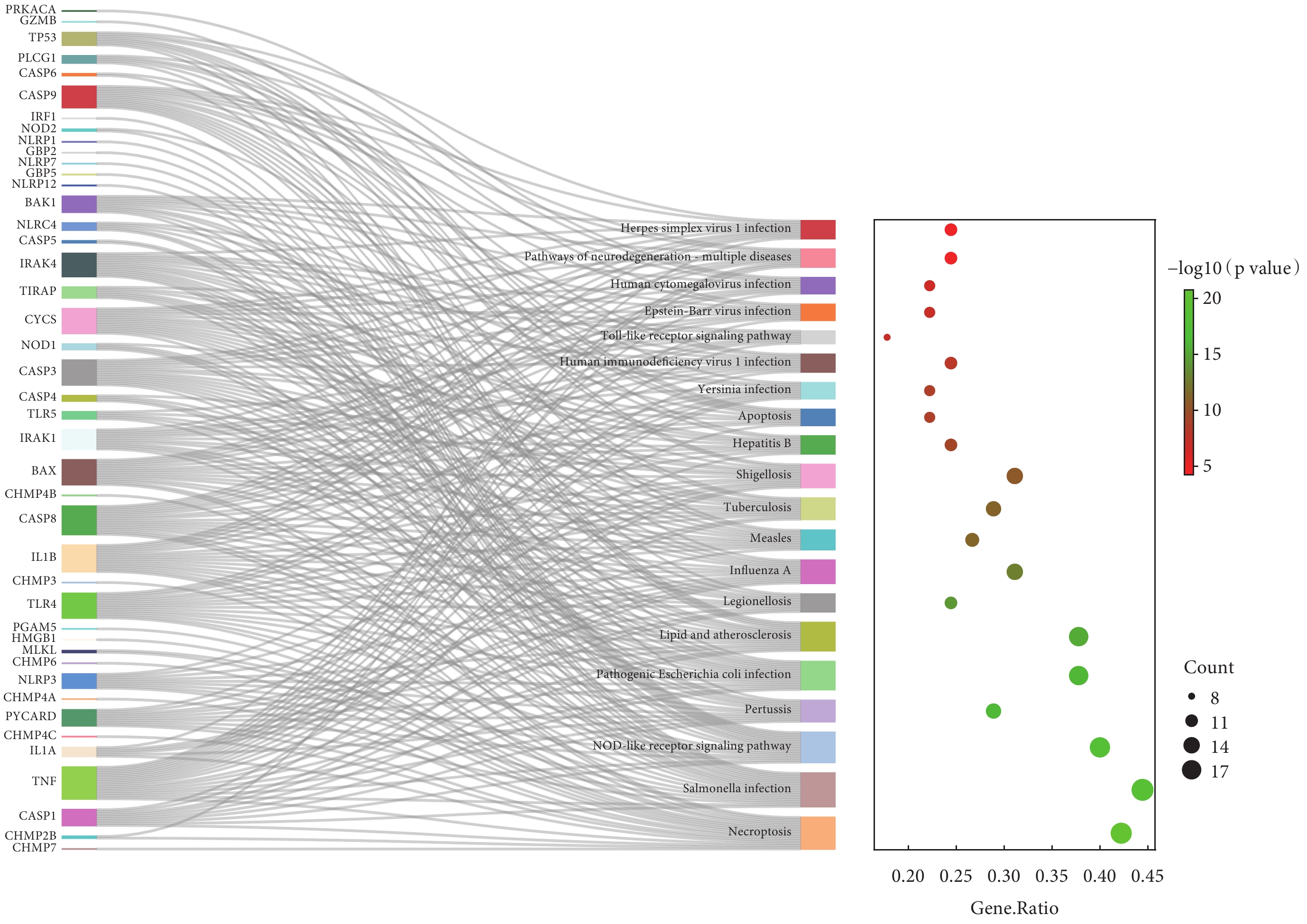
對AAD細胞焦亡相關基因進行GO分析。BP分析結果表明,差異表達的AAD細胞焦亡相關基因主要涉及半胱氨酸內肽酶活性的正向調節、白介素-1和細胞因子的正向調節、對脂多糖及細菌來源分子的反應等;見圖3a。MF分析結果表明,差異表達的AAD細胞焦亡相關基因主要富集于半胱氨酸內肽酶活性、細胞因子受體結合、肽酶連接及肽酶活性調節等;見圖3b。CC分析結果表明,差異表達的AAD細胞焦亡相關基因主要富集于ESCRTⅢ復合體、囊泡膜、動粒微管、炎性小體、多泡體膜及自噬體膜等;見圖3c。此外,本研究通過KEGG富集分析發現,上述AAD細胞焦亡相關基因涉及到的信號通路為沙門氏菌感染、程序性壞死、Nod樣受體信號通路、致病性大腸桿菌感染、血脂與動脈粥樣硬化、志賀氏菌病、Toll樣受體信號通路、凋亡等;見圖4。
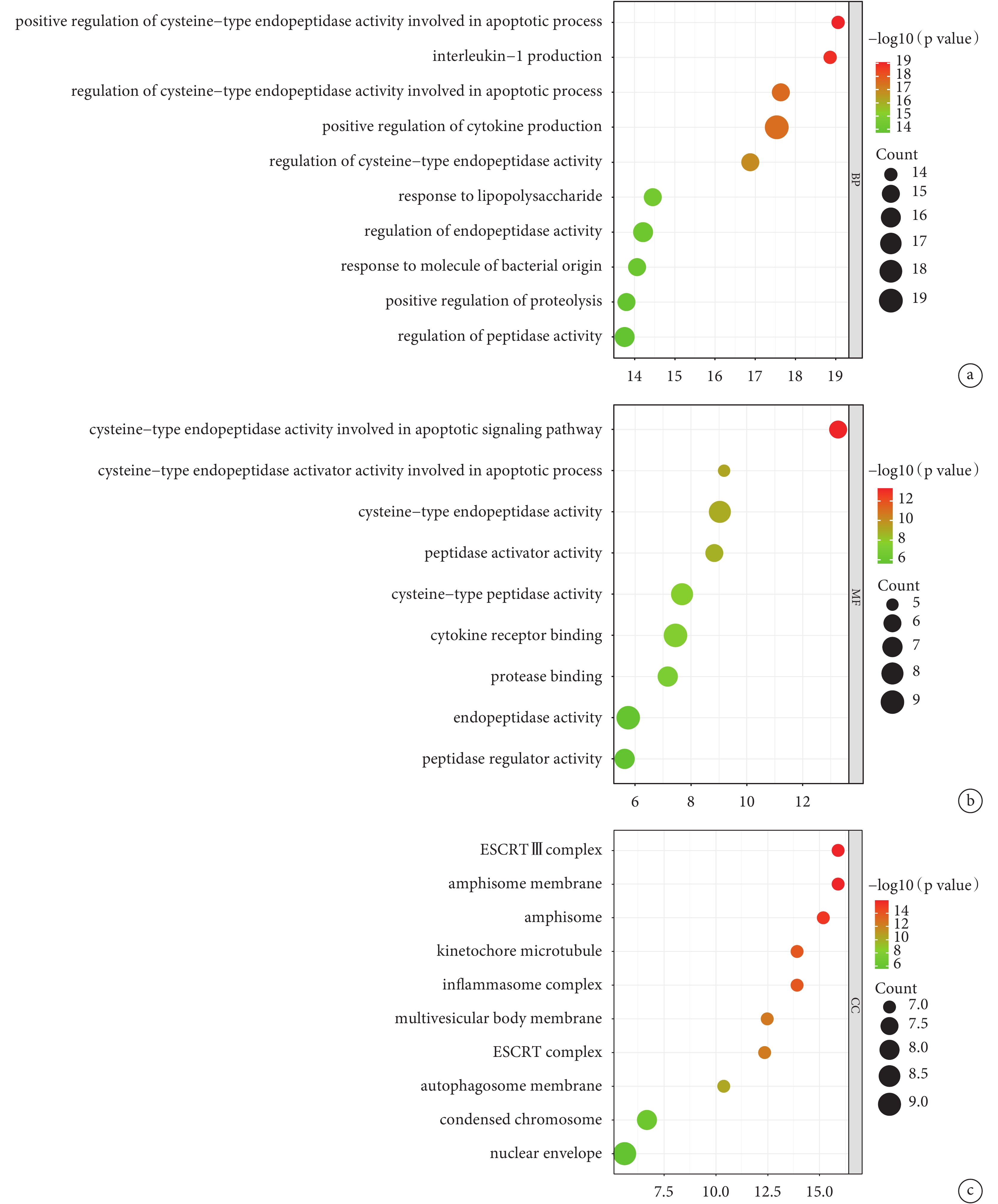 圖3
AAD細胞焦亡相關基因的GO富集分析
圖3
AAD細胞焦亡相關基因的GO富集分析
a:生物過程富集分析;b:分子功能富集分析;c:細胞成分富集分析;AAD:急性主動脈夾層
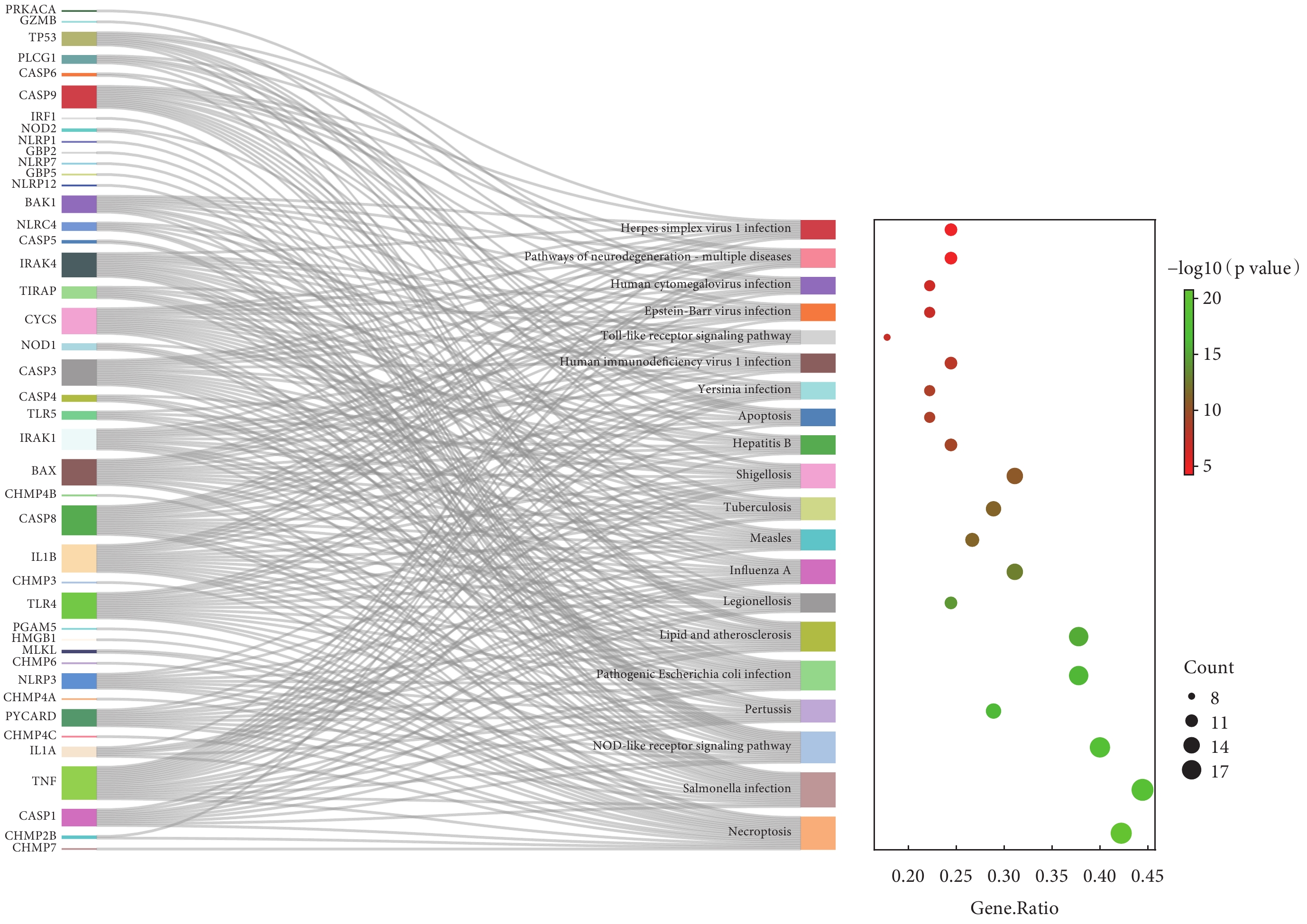 圖4
急性主動脈夾層細胞焦亡相關基因的KEGG富集分析
圖4
急性主動脈夾層細胞焦亡相關基因的KEGG富集分析
2.3 PPI網絡圖和核心基因篩選
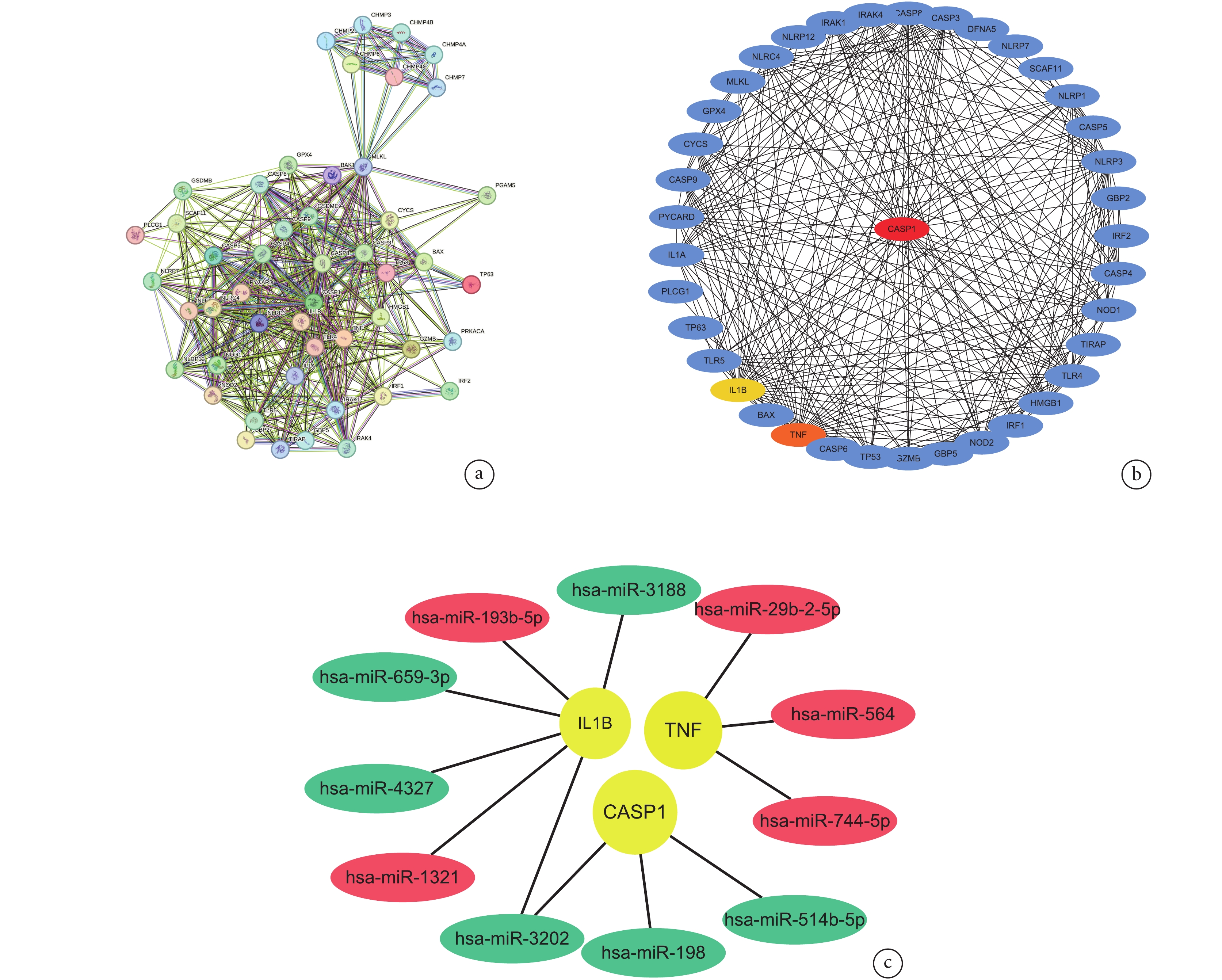
將AAD細胞焦亡相關基因導入到STRING數據庫得到一個含有49個節點和326條邊的PPI網絡圖;見圖5a。基于Cytoscape的cytoHubba插件中Degree算法選取前3個關鍵AAD細胞焦亡相關基因分別為Caspase-1、IL-1β和TNF;見圖5b。這3個關鍵AAD細胞焦亡相關基因對應的12個AAD細胞焦亡相關差異表達miRNAs見圖5c。Caspase-1對應的差異表達miRNAs分別為miR-198、miR-3202和miR-514b-5p,在AAD組織中均下調;IL-1β對應的miRNAs包括下調的miR-1321、miR-3188、miR-3202和miR-4327,上調的miR-659-3p和miR-193-5P;而TNF對應的miRNAs包括miR-29b-2-5p、miR-564和miR-744-5p,在AAD組織中均下調。
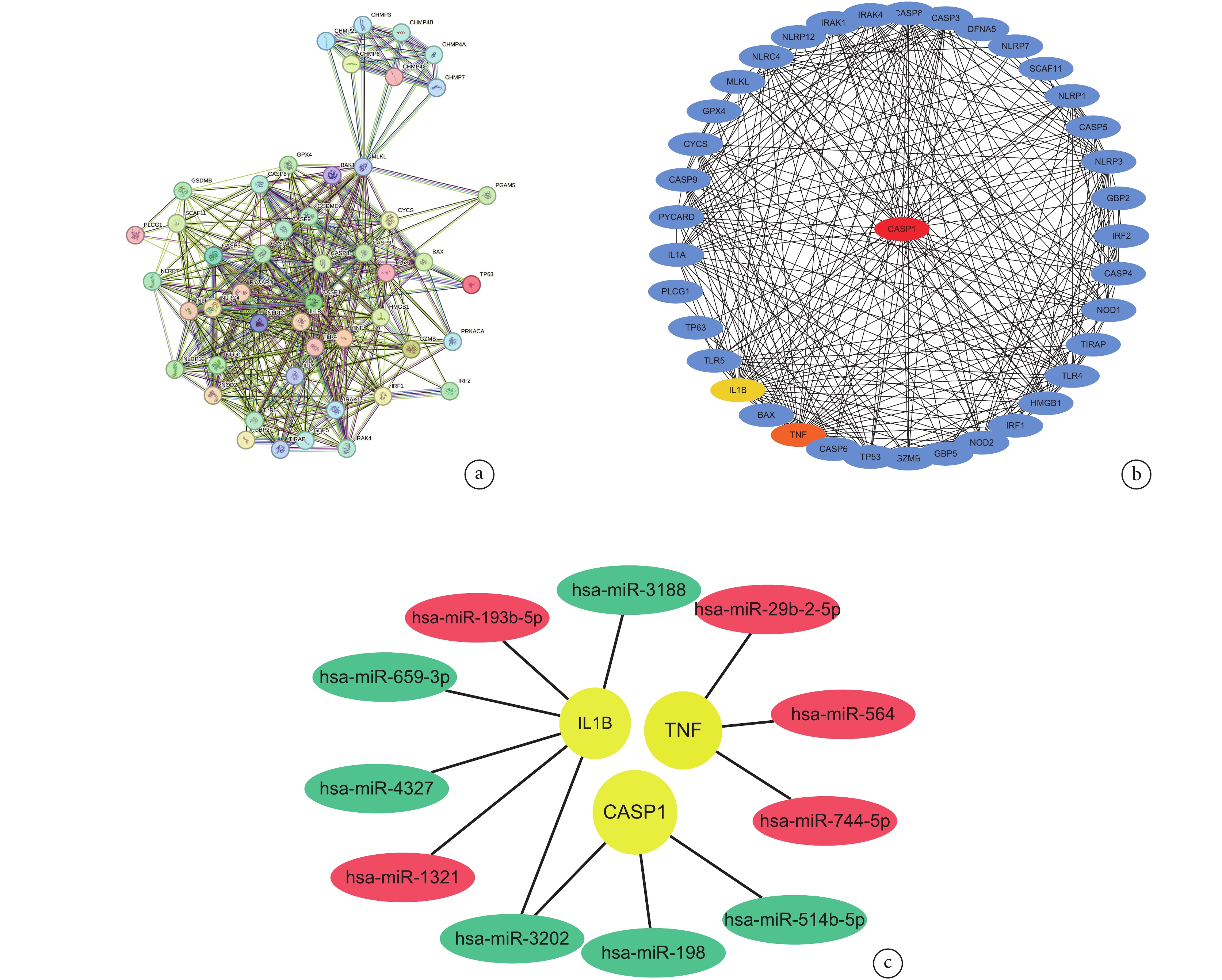 圖5
AAD細胞焦亡相關基因
圖5
AAD細胞焦亡相關基因
a:AAD細胞焦亡相關基因的蛋白互作網絡圖;b:Cytoscape篩選關鍵的AAD細胞焦亡相關基因;c:AAD細胞焦亡相關miRNAs;AAD:急性主動脈夾層
2.4 AAD及健康主動脈中Caspase-1的表達
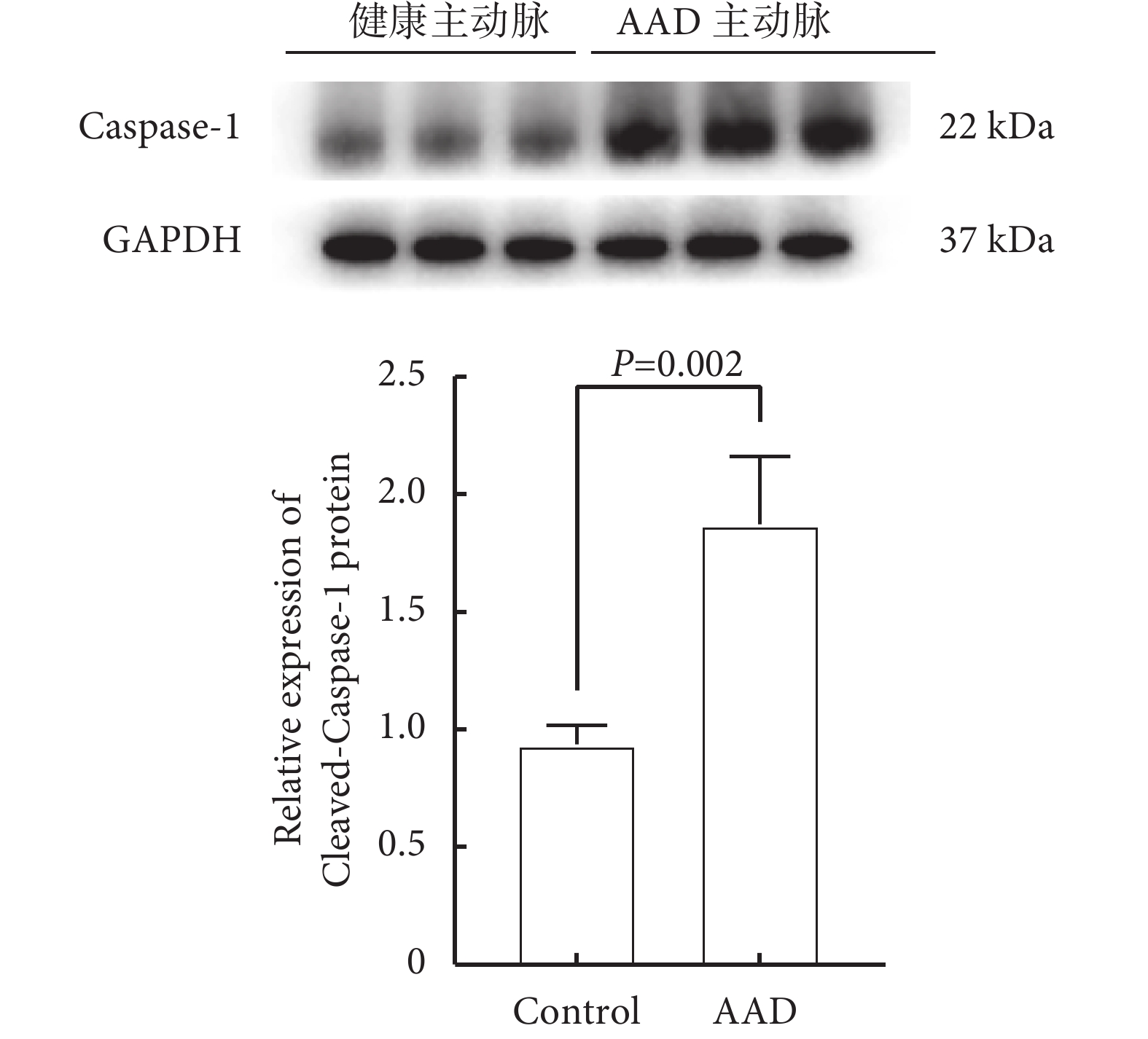
為進一步驗證細胞焦亡在AAD中發揮的關鍵作用,我們分別獲取了AAD患者和健康人的主動脈,各6例。AAD組男5例、女1例,平均年齡(48.70±6.35)歲;健康對照組男4例、女2例,平均年齡(45.30±4.58)歲。兩組性別、年齡、吸煙史、高血壓病史、糖尿病史和冠心病史差異均無統計學意義(P>0.05)。Western blotting檢測了49個AAD細胞焦亡相關基因中最顯著的核心基因Caspase-1,與健康主動脈組織相比,Caspase-1在AAD患者撕裂的主動脈組織中的表達水平顯著上調,差異有統計學意義(Ρ=0.002);見圖6。
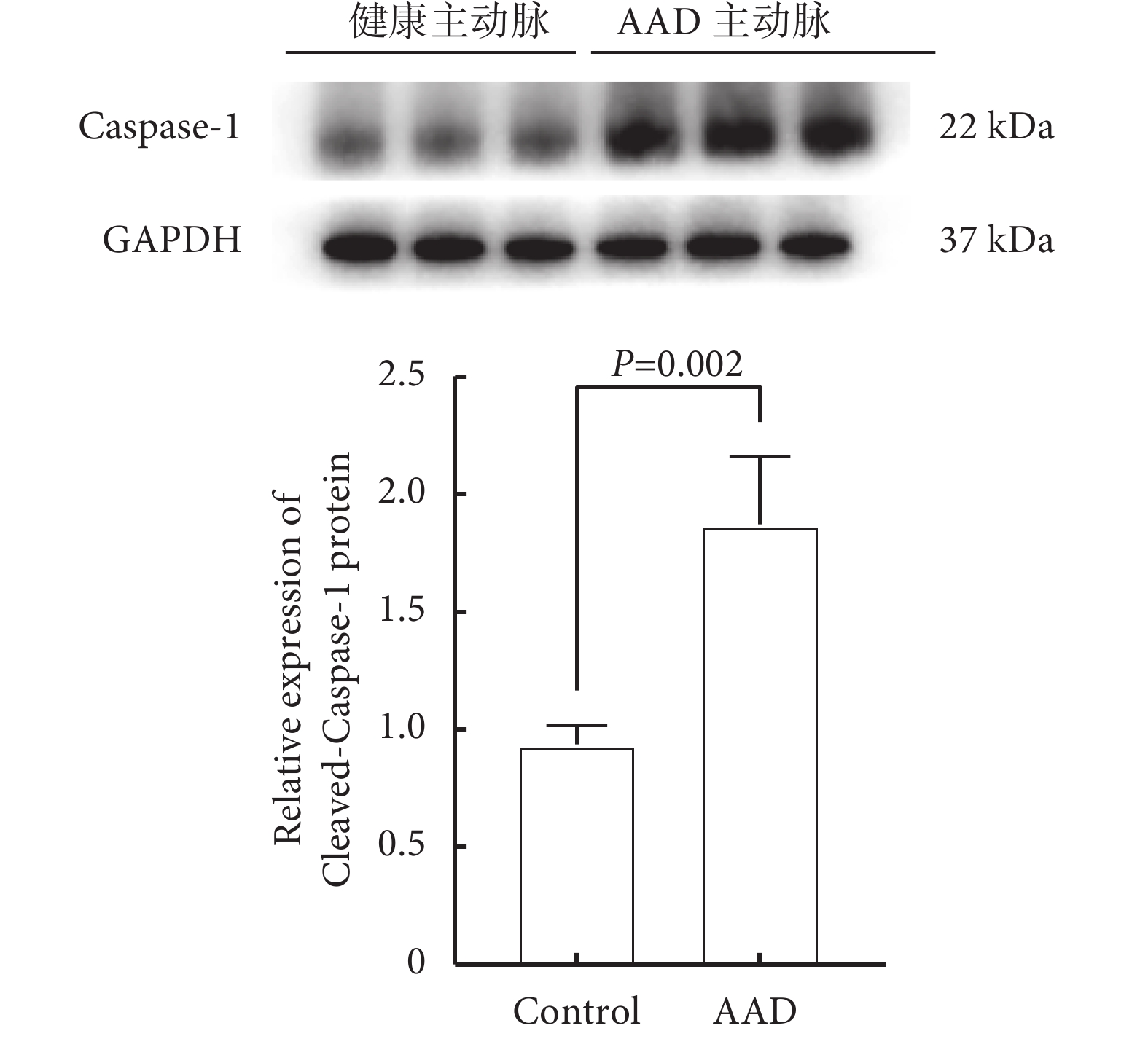 圖6
AAD與健康主動脈組織Caspase-1表達水平(n=6)
圖6
AAD與健康主動脈組織Caspase-1表達水平(n=6)
AAD:急性主動脈夾層
2.5 AAD細胞焦亡相關差異表達的miRNAs
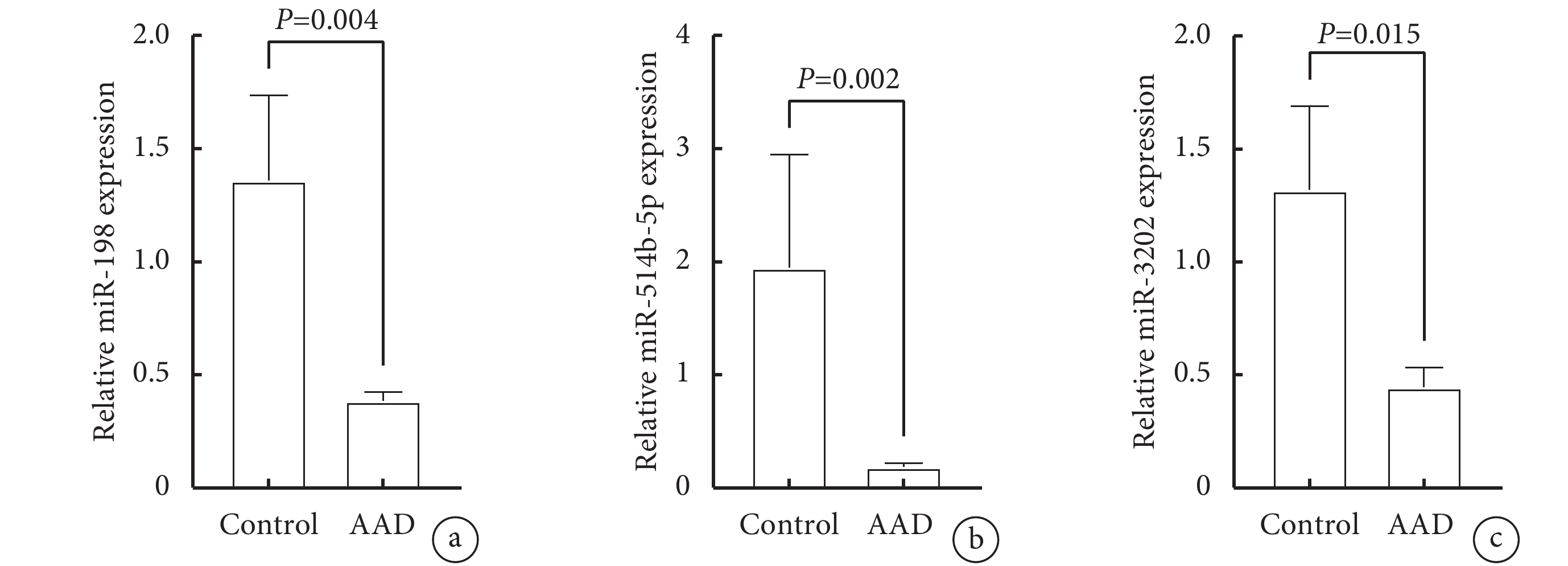
為進一步評估核心基因Caspase-1對應的AAD細胞焦亡相關miRNAs的水平,我們用RT-qPCR技術分別檢測了miR-198、miR-3202和miR-514b-5p在AAD組織中的轉錄水平。圖7顯示,RT-qPCR實驗表明,與健康主動脈組織相比,3個miRNAs在AAD主動脈組織中顯著下調且差異有統計學意義(miR-198:P=0.004;miR-3202:P=0.015;miR-514b-5p:P=0.002),這一結果與GEO公共數據庫中篩選的差異表達的miRNAs結果一致。因此,我們認為miR-198、miR-3202和miR-514b-5p的下調可能在由細胞焦亡介導的AAD的發病過程中發揮至關重要的作用,需進一步探索它們在AAD中的具體分子途徑,為AAD治療提供新的靶點。
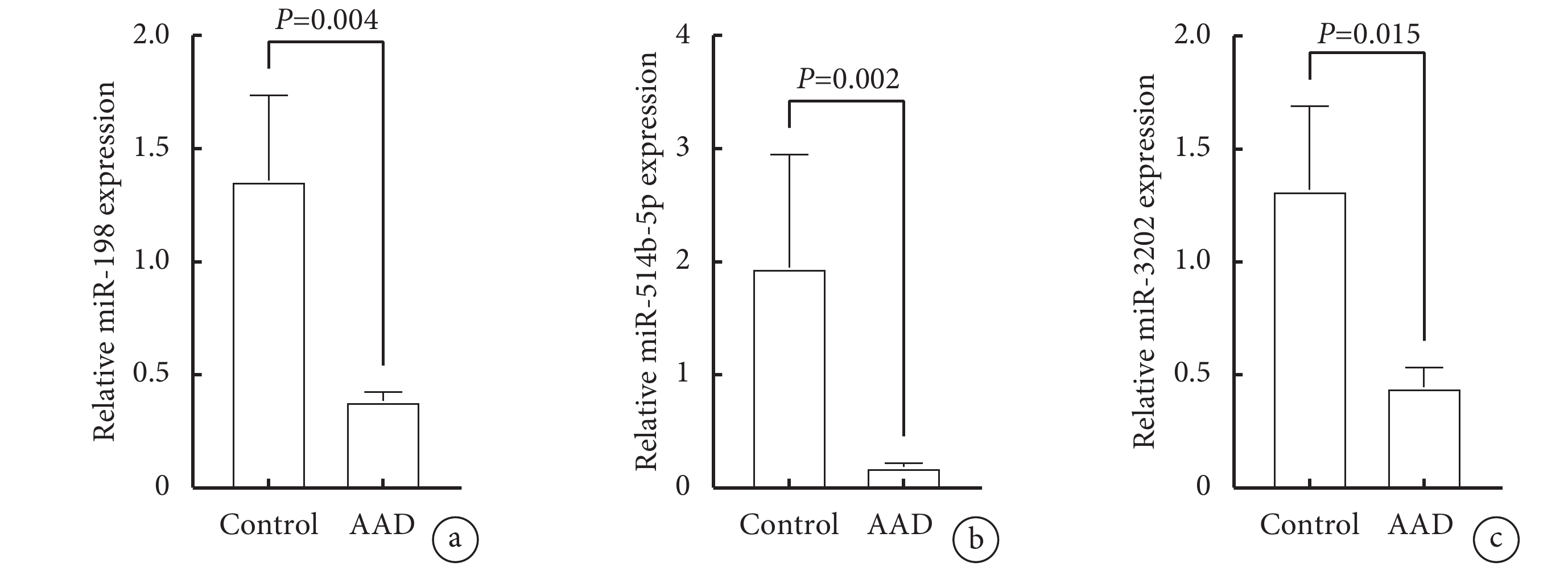 圖7
RT-qPCR驗證ADD與健康主動脈組織AAD細胞焦亡關鍵miRNAs的表達水平(n=3)
圖7
RT-qPCR驗證ADD與健康主動脈組織AAD細胞焦亡關鍵miRNAs的表達水平(n=3)
a:miR-198;b:miR-514b-5p;c:miR-3202;AAD:急性主動脈夾層
3 討論
AAD是一種災難性疾病,仍然是全球公共衛生面臨的一個重大挑戰[16]。AAD進展的病理特征主要包括內側層免疫系統炎癥過度激活、中層平滑肌表型轉換以及細胞外基質降解導致的主動脈壁減弱及血管重塑異常。血管內膜在生理狀態下位于血液和間質組織的交界處,是抵御內源性危險信號的屏障,能有效隔離血液和組織液且使血管壁免受體內外各種物理、化學因素的損傷[17]。但當血管內膜受到高速血流的沖刷、血脂紊亂、煙草、藥物、病原微生物等危險因素的刺激時,就會導致血管功能紊亂[18]。因此,AAD中血管內膜的內側層免疫系統炎癥過程如何被激活、血管結構的平衡以何種形式被破壞,是針對性干預和治療的關鍵。miRNAs能夠通過調節細胞增殖、分化、凋亡和遷移在轉錄后水平參與機體炎癥和腫瘤等疾病過程,除了作為疾病生物標志物還可成為治療靶點。細胞焦亡,作為一種炎性程序性死亡參與AAD的發生發展,可以被多種方式誘導發生,如化療藥物、細菌內容物、病毒感染、人體的部分調節因子等[19]。其過程有經典及非經典途徑,經典途徑細胞焦亡主要通過Caspase-1調控,過程主要依賴Caspase-1、消皮素D(GSDMD)等分子導致細胞腫脹破裂,細胞內容物釋放,進而產生強烈的炎癥反應[20];非經典途徑則通過Caspase-4/5/11通路調控[21],同時還有Caspase-3、Caspase-8等途徑[22-23]。我們認為在形成AAD前,差異表達的miRNAs在細胞焦亡產生的炎性小體及因子介導的AAD發生發展中發揮重要的作用。
因此,本研究整合了GEO數據庫中AAD患者的差異miRNAs和PubMed數據庫中的細胞焦亡相關基因,篩選了AAD細胞焦亡相關基因,進一步探索了AAD細胞焦亡相關基因的功能分析,其中KEGG富集分析結果表明其主要富集于沙門氏菌感染、程序性壞死、Nod樣受體信號通路、致病性大腸桿菌感染、血脂與動脈粥樣硬化等。通過Cytoscape軟件篩選出前3個關鍵基因:Caspase-1、IL-1β和TNF。這3個關鍵AAD細胞焦亡相關基因對應12個AAD細胞焦亡相關差異表達miRNAs。其中與AAD最顯著相關的細胞焦亡基因為Caspase-1,對應的顯著差異表達的miRNAs為:miR-198、miR-514b-5p和miR-3202。Alvandi等[17]從小鼠組織和人類細胞系中克隆了miR-198,其是為數不多的外顯子miRNA之一(3.9%),miR-198被預測受其宿主基因FSTL1啟動子的調控。Sundaram等[24]在健康表皮中發現,miR-198通過下調參與遷移和增殖的靶mRNA,在健康穩定狀態下減少角質形成細胞遷移。在慢性糖尿病潰瘍的人體皮膚離體器官損傷后,miR-198表達降低,不利于傷口愈合。本研究發現,AAD患者組織中miR-198下調,且參與調控了Caspase-1途徑。因此,miR-198是否在血管損傷時通過焦亡途徑導致愈合失衡有待探索。另一個與Caspase-1調控相關的下調miRNA為miR-514b-5p,其在非小細胞肺癌(non-small cell lung cancer,NSCLC)中表達顯著增加,通過靶向SGTB,阻斷PI3K/AKT和p38信號通路促進NSCLC細胞分裂而促進細胞凋亡,被認為是治療NSCLC的有前途的診斷和治療靶點[25]。而miR-514b-5p是否在AAD中也具有治療靶點的潛力仍需進一步研究。最后,miR-3202作為AAD組織中顯著下調的miRNA,同時調控了AAD細胞焦亡相關基因Caspase-1和IL-1β。既往研究[26-27]表明,miR-3202靶向抗凋亡蛋白FAIM2,過表達FAIM2的人成肌細胞對DUX4誘導的細胞死亡表現出更強的抵抗力,從而為研究面肩肱肌營養不良的藥物靶點開辟了新途徑。此外,研究[28]發現,miR-3202通過抑制FAIM2保護吸煙者免于慢性阻塞性肺疾病。與此同時,吸煙作為AAD重要的危險因素,miR-3202的下調是否誘導焦亡從而減少其在AAD發展過程中的保護作用還未知。綜上所述,我們認為miR-198、miR-514b-5p和miR-3202的下調可能與焦亡介導的AAD密切相關。
本研究利用GEO數據庫挖掘基于AAD組織中顯著差異表達的miRNAs,通過預測差異表達miRNAs的靶向基因,從中選取AAD細胞焦亡相關基因并進行富集分析,進一步探索焦亡介導AAD可能的生物學過程。一方面,cytoHubba篩選調控AAD細胞焦亡關鍵基因分別為Caspase-1、IL-1β及TNF,進而確定了12個AAD細胞焦亡相關的關鍵miRNAs。另一方面,人主動脈組織的Western blotting結果顯示,在AAD患者主動脈中Caspase-1顯著上調意味細胞焦亡參與了AAD的發病過程;利用RT-qPCR技術檢測AAD患者和健康對照人群主動脈中miR-198、miR-3202和miR-514b-5p的表達水平,發現上述miRNAs均顯著下調且與數據庫中miRNAs的芯片表達譜一致。本研究從介導AAD細胞焦亡相關差異表達的miRNAs出發,為進一步探索AAD的焦亡機制及新的治療靶點提供了依據。
利益沖突:無。
作者貢獻:古麗娜孜·葉斯塔依負責研究設計,數據統計分析,論文撰寫;王琪負責數據收集、整理;伊力哈木江·克尤木負責樣本收集;馬翔負責對文章的知識性內容作批評性審閱。
急性主動脈夾層(acute aortic dissection,AAD)發病急且進展迅速,嚴重威脅患者的生命和健康[1]。2019年全球心血管相關疾病負擔與危險因素數據[2]顯示,AAD給個人、家庭和社會帶來了沉重負擔。AAD的形成是由于血管壁無法承受腔內高壓,導致主動脈壁擴張、主動脈內側層破裂使血液從破口處流入內中膜之間,剝離的內膜將血管腔分隔形成真假腔,最壞的情況是夾層破裂,患者猝死[3]。其中急性Stanford A型主動脈夾層,若不進行緊急干預,發病1周內死亡率達50%以上[4]。目前針對AAD的治療方法中,手術被認為是根除主動脈破裂的最有效方法,包括開放手術修復和血管腔內治療。此外,一些藥物如β-阻滯劑等,已廣泛被用于AAD治療,但臨床療效有限[5]。因此,鑒于臨床上治療AAD的局限性,亟需探索AAD發病過程中可能引起血管損傷的機制,尋找其中關鍵機制及潛在的藥物治療靶點。
細胞焦亡是機體內程序性細胞死亡的方式之一[6]。近幾年,諸多研究[7]已證明焦亡在心血管疾病中發揮重要作用,如動脈粥樣硬化、心肌缺血-再灌注損傷等。焦亡發生時細胞首先形成氣道、質膜破裂、細胞內促炎因子及細胞因子的釋放,最終導致細胞炎癥與死亡,同時具有細胞凋亡和壞死的特點[8]。研究[9]發現,與正常主動脈相比,AAD主動脈中焦亡相關蛋白,如半胱氨酸天冬氨酸酶-1(cysteine aspartase-1,Caspase-1)、Nod樣受體熱蛋白結構域相關蛋白-3和凋亡相關斑點樣蛋白的表達顯著上調,這表明細胞焦亡參與了主動脈夾層的發病過程。同時,體內研究[10]表明,Caspase-1的缺失減輕了高脂飲食和血管緊張素Ⅱ誘導的AAD的發展,并減輕主動脈直徑的擴張程度。上述研究表明細胞焦亡是AAD發生發展過程中的關鍵一環,但細胞焦亡在AAD中的調控機制尚未完全闡明。
非編碼RNA(non-coding RNAs,ncRNAs)是一群沒有蛋白質編碼能力的RNA分子,占哺乳動物中所有基因組RNA的90%以上[11],其中微小RNAs(microRNAs,miRNAs)是一類長度為17~25個核苷酸的內源性ncRNAs,可以通過與靶mRNAs的3'端非翻譯區(3'UTRs)配對來調控基因表達[12-13]。近十幾年來,越來越多的研究[14-15]表明,miRNAs可能通過不同的機制參與AAD的發生發展,通過比較正常主動脈和夾層主動脈中的miRNAs表達譜篩選出異常表達的miRNAs較多,AAD患者中miR-134-5p、miR-15a、miR-23a和miR-21表達顯著上調等,都與AAD中血管病理學改變高度相關。綜上所述,我們認為miRNAs可能介導了主動脈夾層患者的焦亡病變,但具體的生物標志物及機制尚不清楚。
1 資料與方法
1.1 數據來源
基于人類AAD組織的miRNAs芯片數據來自GEO數據庫(
1.2 主動脈組織的獲取及納入和排除標準
收集AAD患者撕裂的主動脈,取材部位為升主動脈夾層破口處,大小為2 cm×2 cm;同時,收集對照健康人群的主動脈,取材部位為腹主動脈和肝臟分支吻合處,大小為1.5 cm×1.5 cm。術中留取組織標本后立即轉移至?80℃冰箱保存。納入標準:AAD組:在新疆醫科大學第一附屬醫院經全主動脈CT血管造影診斷為AAD,并接受手術治療的Stanford A型AAD患者;健康對照組:年齡、性別匹配的肝臟移植健康供體的主動脈組織。排除標準:AAD組:(1)遺傳性主動脈疾病、自身免疫或結締組織疾病;(2)家族性主動脈夾層及復發性主動脈夾層;(3)二葉式主動脈瓣等結構性心臟病;(4)合并有急性心肌梗死、急性腦梗死、嚴重肝腎疾病及癌癥。對照組:(1)自身免疫或結締組織疾病;(2)嚴重血液系統疾病、肝腎疾病及癌癥;(3)合并大血管病變。
1.3 差異表達miRNAs的篩選及靶基因預測
通過GEO數據庫下載的miRNAs芯片表達數據采用R語言軟件(version4.2.1,
1.4 AAD細胞焦亡相關基因篩選及生物信息學分析
取miRWalk數據庫預測的靶向基因和細胞焦亡相關基因的交集基因,此為AAD細胞焦亡相關基因,具體研究流程見圖1。將用于基因GO和KEGG富集分析的AAD細胞焦亡相關基因導入DAVID網站,通過R語言腳本進行分析。GO富集分析包括生物過程(biological process,BP)、分子功能(molecular function,MF)和細胞成分(cellular component,CC)3個方面。富集分析以P≤0.05為差異有統計學意義。
 圖1
AAD細胞焦亡相關miRNAs篩選及分析流程圖
圖1
AAD細胞焦亡相關miRNAs篩選及分析流程圖
AAD:急性主動脈夾層
1.5 PPI網絡互作構建與核心基因篩選
將AAD細胞焦亡相關基因放入STRING數據庫(http://string-db.org)中構建蛋白互作(protein-protein interaction,PPI)網絡,通過Cytoscape軟件對PPI網絡進行可視化分析,進一步通過cytoHubba的Degree算法篩選核心基因,其中連通度最大的前3個基因作為AAD的關鍵細胞焦亡相關基因。
1.6 Western blotting 檢測相關蛋白
(1)提取人主動脈組織蛋白:將人主動脈組織剪碎至適量大小裝入EP管中,按比例加入裂解液和蛋白酶抑制劑,冰上裂解、勻漿;超聲波破碎儀進一步破碎組織,冰上靜置30 min;低溫高速(
1.7 RT-qPCR檢測AAD細胞焦亡相關miRNAs水平
(1)提取人主動脈總mRNA:向剪碎的主動脈組織中加入Trizol,冰上靜置5 min;在組織研磨器中研磨勻漿,將氯仿按5∶1的比例加入震蕩混勻;離心后取上清,加入等體積的異丙醇;離心后棄上清,75%乙醇洗滌沉淀3遍,用無菌無酶水溶解沉淀后測定總RNA的純度和濃度。(2)配制10 μL的ployA加尾反應體系,反應條件為37℃ 1 h,85℃ 5 s。(3)按照反轉錄試劑盒說明書將總RNA反轉錄為cDNA。(4)利用熒光實時定量PCR儀進行RT-qPCR反應:反應體系為2×qPCR Mix 10 μL,miRNA qPCR Primer 2 μL,PCR Primer 2 μL,cDNA 2 μL,ddH2O 4 μL。反應條件為95℃ 30 s(預變性),94℃ 5 s,60℃ 34 s(退火),72℃ 10 s(延伸),共40個循環。通過U6對表達數據進行歸一化,并應用2?ΔΔCT方法對結果進行分析。每個樣本檢測3次,取平均值。引物序列信息見表1。
1.8 統計學分析
采用GraphPad Prism 9.2進行統計分析。計量資料以均數±標準差( ±s)描述,組間比較采用獨立樣本t檢驗。計數資料采用頻數(百分比)描述,組間比較采用χ2檢驗。檢驗水準α=0.05。
±s)描述,組間比較采用獨立樣本t檢驗。計數資料采用頻數(百分比)描述,組間比較采用χ2檢驗。檢驗水準α=0.05。
1.9 倫理審查
本研究符合醫學倫理規范,遵從《赫爾辛基宣言》原則,本實驗經新疆醫科大學第一附屬醫院倫理委員會批準,倫理審查編號:230306-88。
2 結果
2.1 AAD細胞焦亡相關基因的選取
本研究通過PubMed數據庫獲取72個細胞焦亡相關基因。基于miRNAs芯片數據篩選出46個差異表達miRNAs,其中26個上調、20個下調miRNAs(見附表1,
 圖2
46個差異miRNAs通過miRWalk數據庫預測的靶向基因與PRGs的韋恩圖
圖2
46個差異miRNAs通過miRWalk數據庫預測的靶向基因與PRGs的韋恩圖
PRGs:細胞焦亡相關基因
2.2 GO和KEGG富集分析
對AAD細胞焦亡相關基因進行GO分析。BP分析結果表明,差異表達的AAD細胞焦亡相關基因主要涉及半胱氨酸內肽酶活性的正向調節、白介素-1和細胞因子的正向調節、對脂多糖及細菌來源分子的反應等;見圖3a。MF分析結果表明,差異表達的AAD細胞焦亡相關基因主要富集于半胱氨酸內肽酶活性、細胞因子受體結合、肽酶連接及肽酶活性調節等;見圖3b。CC分析結果表明,差異表達的AAD細胞焦亡相關基因主要富集于ESCRTⅢ復合體、囊泡膜、動粒微管、炎性小體、多泡體膜及自噬體膜等;見圖3c。此外,本研究通過KEGG富集分析發現,上述AAD細胞焦亡相關基因涉及到的信號通路為沙門氏菌感染、程序性壞死、Nod樣受體信號通路、致病性大腸桿菌感染、血脂與動脈粥樣硬化、志賀氏菌病、Toll樣受體信號通路、凋亡等;見圖4。
 圖3
AAD細胞焦亡相關基因的GO富集分析
圖3
AAD細胞焦亡相關基因的GO富集分析
a:生物過程富集分析;b:分子功能富集分析;c:細胞成分富集分析;AAD:急性主動脈夾層
 圖4
急性主動脈夾層細胞焦亡相關基因的KEGG富集分析
圖4
急性主動脈夾層細胞焦亡相關基因的KEGG富集分析
2.3 PPI網絡圖和核心基因篩選
將AAD細胞焦亡相關基因導入到STRING數據庫得到一個含有49個節點和326條邊的PPI網絡圖;見圖5a。基于Cytoscape的cytoHubba插件中Degree算法選取前3個關鍵AAD細胞焦亡相關基因分別為Caspase-1、IL-1β和TNF;見圖5b。這3個關鍵AAD細胞焦亡相關基因對應的12個AAD細胞焦亡相關差異表達miRNAs見圖5c。Caspase-1對應的差異表達miRNAs分別為miR-198、miR-3202和miR-514b-5p,在AAD組織中均下調;IL-1β對應的miRNAs包括下調的miR-1321、miR-3188、miR-3202和miR-4327,上調的miR-659-3p和miR-193-5P;而TNF對應的miRNAs包括miR-29b-2-5p、miR-564和miR-744-5p,在AAD組織中均下調。
 圖5
AAD細胞焦亡相關基因
圖5
AAD細胞焦亡相關基因
a:AAD細胞焦亡相關基因的蛋白互作網絡圖;b:Cytoscape篩選關鍵的AAD細胞焦亡相關基因;c:AAD細胞焦亡相關miRNAs;AAD:急性主動脈夾層
2.4 AAD及健康主動脈中Caspase-1的表達
為進一步驗證細胞焦亡在AAD中發揮的關鍵作用,我們分別獲取了AAD患者和健康人的主動脈,各6例。AAD組男5例、女1例,平均年齡(48.70±6.35)歲;健康對照組男4例、女2例,平均年齡(45.30±4.58)歲。兩組性別、年齡、吸煙史、高血壓病史、糖尿病史和冠心病史差異均無統計學意義(P>0.05)。Western blotting檢測了49個AAD細胞焦亡相關基因中最顯著的核心基因Caspase-1,與健康主動脈組織相比,Caspase-1在AAD患者撕裂的主動脈組織中的表達水平顯著上調,差異有統計學意義(Ρ=0.002);見圖6。
 圖6
AAD與健康主動脈組織Caspase-1表達水平(n=6)
圖6
AAD與健康主動脈組織Caspase-1表達水平(n=6)
AAD:急性主動脈夾層
2.5 AAD細胞焦亡相關差異表達的miRNAs
為進一步評估核心基因Caspase-1對應的AAD細胞焦亡相關miRNAs的水平,我們用RT-qPCR技術分別檢測了miR-198、miR-3202和miR-514b-5p在AAD組織中的轉錄水平。圖7顯示,RT-qPCR實驗表明,與健康主動脈組織相比,3個miRNAs在AAD主動脈組織中顯著下調且差異有統計學意義(miR-198:P=0.004;miR-3202:P=0.015;miR-514b-5p:P=0.002),這一結果與GEO公共數據庫中篩選的差異表達的miRNAs結果一致。因此,我們認為miR-198、miR-3202和miR-514b-5p的下調可能在由細胞焦亡介導的AAD的發病過程中發揮至關重要的作用,需進一步探索它們在AAD中的具體分子途徑,為AAD治療提供新的靶點。
 圖7
RT-qPCR驗證ADD與健康主動脈組織AAD細胞焦亡關鍵miRNAs的表達水平(n=3)
圖7
RT-qPCR驗證ADD與健康主動脈組織AAD細胞焦亡關鍵miRNAs的表達水平(n=3)
a:miR-198;b:miR-514b-5p;c:miR-3202;AAD:急性主動脈夾層
3 討論
AAD是一種災難性疾病,仍然是全球公共衛生面臨的一個重大挑戰[16]。AAD進展的病理特征主要包括內側層免疫系統炎癥過度激活、中層平滑肌表型轉換以及細胞外基質降解導致的主動脈壁減弱及血管重塑異常。血管內膜在生理狀態下位于血液和間質組織的交界處,是抵御內源性危險信號的屏障,能有效隔離血液和組織液且使血管壁免受體內外各種物理、化學因素的損傷[17]。但當血管內膜受到高速血流的沖刷、血脂紊亂、煙草、藥物、病原微生物等危險因素的刺激時,就會導致血管功能紊亂[18]。因此,AAD中血管內膜的內側層免疫系統炎癥過程如何被激活、血管結構的平衡以何種形式被破壞,是針對性干預和治療的關鍵。miRNAs能夠通過調節細胞增殖、分化、凋亡和遷移在轉錄后水平參與機體炎癥和腫瘤等疾病過程,除了作為疾病生物標志物還可成為治療靶點。細胞焦亡,作為一種炎性程序性死亡參與AAD的發生發展,可以被多種方式誘導發生,如化療藥物、細菌內容物、病毒感染、人體的部分調節因子等[19]。其過程有經典及非經典途徑,經典途徑細胞焦亡主要通過Caspase-1調控,過程主要依賴Caspase-1、消皮素D(GSDMD)等分子導致細胞腫脹破裂,細胞內容物釋放,進而產生強烈的炎癥反應[20];非經典途徑則通過Caspase-4/5/11通路調控[21],同時還有Caspase-3、Caspase-8等途徑[22-23]。我們認為在形成AAD前,差異表達的miRNAs在細胞焦亡產生的炎性小體及因子介導的AAD發生發展中發揮重要的作用。
因此,本研究整合了GEO數據庫中AAD患者的差異miRNAs和PubMed數據庫中的細胞焦亡相關基因,篩選了AAD細胞焦亡相關基因,進一步探索了AAD細胞焦亡相關基因的功能分析,其中KEGG富集分析結果表明其主要富集于沙門氏菌感染、程序性壞死、Nod樣受體信號通路、致病性大腸桿菌感染、血脂與動脈粥樣硬化等。通過Cytoscape軟件篩選出前3個關鍵基因:Caspase-1、IL-1β和TNF。這3個關鍵AAD細胞焦亡相關基因對應12個AAD細胞焦亡相關差異表達miRNAs。其中與AAD最顯著相關的細胞焦亡基因為Caspase-1,對應的顯著差異表達的miRNAs為:miR-198、miR-514b-5p和miR-3202。Alvandi等[17]從小鼠組織和人類細胞系中克隆了miR-198,其是為數不多的外顯子miRNA之一(3.9%),miR-198被預測受其宿主基因FSTL1啟動子的調控。Sundaram等[24]在健康表皮中發現,miR-198通過下調參與遷移和增殖的靶mRNA,在健康穩定狀態下減少角質形成細胞遷移。在慢性糖尿病潰瘍的人體皮膚離體器官損傷后,miR-198表達降低,不利于傷口愈合。本研究發現,AAD患者組織中miR-198下調,且參與調控了Caspase-1途徑。因此,miR-198是否在血管損傷時通過焦亡途徑導致愈合失衡有待探索。另一個與Caspase-1調控相關的下調miRNA為miR-514b-5p,其在非小細胞肺癌(non-small cell lung cancer,NSCLC)中表達顯著增加,通過靶向SGTB,阻斷PI3K/AKT和p38信號通路促進NSCLC細胞分裂而促進細胞凋亡,被認為是治療NSCLC的有前途的診斷和治療靶點[25]。而miR-514b-5p是否在AAD中也具有治療靶點的潛力仍需進一步研究。最后,miR-3202作為AAD組織中顯著下調的miRNA,同時調控了AAD細胞焦亡相關基因Caspase-1和IL-1β。既往研究[26-27]表明,miR-3202靶向抗凋亡蛋白FAIM2,過表達FAIM2的人成肌細胞對DUX4誘導的細胞死亡表現出更強的抵抗力,從而為研究面肩肱肌營養不良的藥物靶點開辟了新途徑。此外,研究[28]發現,miR-3202通過抑制FAIM2保護吸煙者免于慢性阻塞性肺疾病。與此同時,吸煙作為AAD重要的危險因素,miR-3202的下調是否誘導焦亡從而減少其在AAD發展過程中的保護作用還未知。綜上所述,我們認為miR-198、miR-514b-5p和miR-3202的下調可能與焦亡介導的AAD密切相關。
本研究利用GEO數據庫挖掘基于AAD組織中顯著差異表達的miRNAs,通過預測差異表達miRNAs的靶向基因,從中選取AAD細胞焦亡相關基因并進行富集分析,進一步探索焦亡介導AAD可能的生物學過程。一方面,cytoHubba篩選調控AAD細胞焦亡關鍵基因分別為Caspase-1、IL-1β及TNF,進而確定了12個AAD細胞焦亡相關的關鍵miRNAs。另一方面,人主動脈組織的Western blotting結果顯示,在AAD患者主動脈中Caspase-1顯著上調意味細胞焦亡參與了AAD的發病過程;利用RT-qPCR技術檢測AAD患者和健康對照人群主動脈中miR-198、miR-3202和miR-514b-5p的表達水平,發現上述miRNAs均顯著下調且與數據庫中miRNAs的芯片表達譜一致。本研究從介導AAD細胞焦亡相關差異表達的miRNAs出發,為進一步探索AAD的焦亡機制及新的治療靶點提供了依據。
利益沖突:無。
作者貢獻:古麗娜孜·葉斯塔依負責研究設計,數據統計分析,論文撰寫;王琪負責數據收集、整理;伊力哈木江·克尤木負責樣本收集;馬翔負責對文章的知識性內容作批評性審閱。