食管癌是河南區域高發腫瘤,給家庭和社會帶來沉重醫療負擔。手術治療在非晚期食管癌治療中占主導地位,但食管癌病灶內癌細胞具有較強的浸潤性,術后復發率和轉移率均很高,亟需更為有效的全身綜合治療來改善預后。我們組織32家河南省各級醫院,52位食管外科、腫瘤科、病理科、影像科及放療科醫師,結合國內外循證醫學證據及臨床實踐經驗,反復磋商和充分討論,制定《河南省食管癌新輔助免疫治療診療路徑》,從目標人群、患者評估、方案選擇、手術時機、術后管理、器官保留、總則等7個角度提出了7條推薦意見,供食管癌外科相關醫務人員參考使用。
引用本文: 魏立, 邢文群, 楊洋, 代表《河南省食管癌新輔助免疫治療診療路徑》編寫組. 河南省食管癌新輔助免疫治療診療路徑. 中國胸心血管外科臨床雜志, 2024, 31(2): 186-195. doi: 10.7507/1007-4848.202308005 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
中國是食管癌發病率和病死率最高的國家。術前新輔助免疫治療可消除微小轉移病灶,降低腫瘤臨床分期,減少術中腫瘤種植轉移風險[1],為患者帶來更多手術成功的可能,最大程度地實現根治。食管癌新輔助免疫治療還處于探索階段,目前已發布的數據多為Ⅰb/Ⅱ期小樣本研究,但在降期、縮瘤、病理改善及R0切除等方面已經取得了令人鼓舞的成績,長期獲益還需要進一步觀察。雖然多項Ⅲ期大樣本臨床研究尚在進行中,相信在不久的將來,食管癌新輔助免疫治療將會進入快車道,急需在適應人群、患者評估、免疫聯合方案選擇、術后管理及新輔助免疫治療后器官保留策略等方面達成共識,指導臨床實踐。食管癌是河南區域高發腫瘤,我們聯合河南省內32家各級醫院的52位食管外科、腫瘤科、病理科、影像科及放療科醫師協作分工,制定《河南省食管癌新輔助免疫治療診療路徑》,供食管癌外科相關醫務人員參考。
1 證據與方法
本臨床路徑采用專家集中討論方式形成文中內容。主要流程包括編委專家遴選、執筆專家撰寫初稿、現場集中討論及投票、修改反饋、重新討論及表決、結果匯總等。參與制定臨床路徑的編委來自河南省內的省級、市級及縣級醫院食管外科。由來自河南省人民醫院、河南省腫瘤醫院、鄭州大學第一附屬醫院及安陽市腫瘤醫院的執筆專家負責檢索文獻。檢索PubMed、Web of Science等外文數據庫,萬方數據、CNKI等中文數據庫以及ASCO和ESMO的會議摘要(檢索時間從建庫截至2023年6月10日)。共納入52 篇文獻[1-52]。按照GRADE 證據質量分級與定義對納入的文獻進行質量評價,其中A級證據10條[6-7, 11-12, 14, 34-35, 37, 48-49],B級證據11條[2, 5, 8, 15, 41-45, 47, 50],C級證據31條[1, 3-4, 9-10, 13, 16-33, 36, 38-40, 46, 51-52]。經過對篩選文獻進行分析并草擬臨床路徑初稿,全體編委多次現場參與投票,最終形成區域臨床路徑。
本臨床路徑的推薦強度包括4級。Ⅰ級:強烈推薦,證據強度高等,專家組一致同意;ⅡA級:推薦,證據強度中等,專家組已達成共識;ⅡB類:推薦,證據強度低等,專家組基本同意,基本達成共識;Ⅲ類:證據強度極低,專家組提出相關建議,但尚存在一定分歧。基于證據和臨床經驗,并經專家5次討論與投票(循證證據與專家共識分值各占50%),共提出7條推薦意見,其中Ⅰ級推薦1條,ⅡA級推薦3條,ⅡB級推薦3條。
2 新輔助免疫治療目標人群
2.1 臨床分期
臨床分期采用國際抗癌聯盟(Union for International Cancer Control,UICC)與美國癌癥聯合會(American Joint Committee on Cancer,AJCC)聯合發布惡性腫瘤TNM分期系統(2017年第8版)。結合《中國臨床腫瘤學會(CSCO)食管癌診療指南2023》[2]及既往食管癌新輔助免疫治療研究,適應人群臨床分期為Ⅱ~ⅣA期,TNM分期為cT1b~cT2 N+ M0,cT3~cT4a任何N M0;可疑累及周圍器官但未明確cT4b任何N M0(胸段食管癌)。
2.2 目標人群
(1)具有區域淋巴結轉移的局部晚期可切除食管癌患者;(2)潛在可切除的局部晚期食管癌患者;(3)具有低分化、高T分期等高危復發因素可手術的食管癌患者[3-4]。
推薦1(目標人群):推薦具有淋巴結轉移、低分化、高T分期等高危復發因素的可手術患者作為新輔助免疫治療首選人群(ⅡA)。
3 患者評估
食管癌新輔助免疫治療患者在用藥前,要綜合評估患者的一般情況、實驗室檢查、輔助檢查及臨床分期等情況,從而制定出個體化的精準治療方案。
3.1 一般情況評估
評估內容包括既往史、家族史、基礎疾病、心肺功能、肝腎功能、營養狀況等。
(1)既往史和基礎疾病評估:包括各系統疾病病史,尤其關注心、肺、肝、腎等臟器功能不全的相關重癥疾病、內分泌疾病病史、自身免疫病史等。
(2)心血管疾病風險評估:主要評估手段包括患者的主觀癥狀、體征,心肌酶譜、肌鈣蛋白及B型鈉尿肽檢測,心電圖、超聲心動圖以及冠狀動脈CT血管成像或冠狀動脈造影等檢查。
(3)呼吸系統疾病風險評估:注意詢問呼吸道疾病史,再結合患者日常活動狀況、屏氣試驗、肺功能檢查(肺通氣功能及彌散功能)、血氧飽和度測定、血氣分析及CT檢查等,判斷患者肺功能狀況是否能夠耐受新輔助免疫治療及后續的手術治療。
(4)肝腎功能評估:對于乙肝、丙肝患者,需要進一步行病毒定量檢測。肝功能檢查指標主要包括膽紅素代謝、蛋白質合成代謝、脂肪分解代謝等。腎功能檢查項目主要包括尿常規、生化(血清尿素氮、肌酐、肌酐清除率)等。免疫抑制劑的清除率在輕度肝和/或腎功能受損患者與肝腎功能正常患者之間不存在差異。而對存在中度及以上肝和/或腎功能受損的患者,建議請相關專業醫師會診評估以確定能否行新輔助免疫治療和手術治療。
(5)內分泌系統評估:側重對甲狀腺功能進行檢查以評估患者甲狀腺狀況;詢問有無垂體、腎上腺、胰腺等相關內分泌疾病病史,主要檢查指標包括性激素六項、血糖、血皮質醇晝夜節律測定等;對于既往有內分泌疾病病史或自身免疫病病史(如潰瘍性結腸炎、克羅恩病、系統性紅斑狼瘡等)的患者,建議請相關專業醫師會診評估以確定能否使用免疫抑制劑行新輔助免疫治療。
(6)營養狀況評估:關注患者近期體重下降(5 kg以上)、進食(流食、半流食)等狀況,對2周以上只進少量流食患者,應通過腸內和/或腸外營養支持來改善其營養狀況。
3.2 實驗室檢查
在食管癌新輔助免疫治療前后,應警惕免疫治療相關不良反應發生的風險并及時診治,監測項目包括血常規、凝血分析、電解質、空腹血糖、肝腎功能、肌酸激酶、乳酸脫氫酶、甲狀腺功能五項、紅細胞沉降率及C反應蛋白等。
目前尚缺乏能夠準確預測新輔助免疫治療療效的分子標志物。瘤床和區域淋巴結組織程序性死亡配體1(PD-L1)的表達水平,可能會對臨床治療決策有一定作用。另外,潛在替代指標還包括腫瘤突變負荷、微衛星不穩定、神經營養酪氨酸受體以及循環腫瘤DNA[5],除非臨床研究范疇內,目前不推薦常規臨床診療。
推薦2(患者評估):新輔助免疫治療前需全面評估患者病史及整體狀況,監測患者心肌酶、甲狀腺功能及肝功能等指標,排除免疫及手術相關禁忌證人群,警惕免疫治療相關不良反應(ⅡB)。
3.3 輔助檢查
在對食管癌患者進行診斷時,可以通過超聲內鏡與影像學檢查結合的方式提高臨床分期準確率,對后續治療起到十分積極的作用。
3.3.1 影像學檢查[6 ]
(1)食管造影:食管造影是食管癌診斷和療效評價的重要方法,對于確定病灶的部位、長度以及浸潤情況具有非常重要的價值,同時觀察食管管壁的擴張情況,如懷疑存在食管胸膜瘺時,應采用非離子型對比劑。
(2)CT:食管癌治療及隨診過程中需行胸部、上腹部CT檢查,推薦增強掃描,根據病變位置和范圍可適當增加掃描范圍(如鎖骨上區及頸部等)。
(3)磁共振成像(MRI):MRI在食管癌診斷和療效評估中可作為CT檢查的補充手段,特別對于CT無法判斷食管癌原發灶與周圍氣管、支氣管膜部、主動脈外膜臨界關系時,MRI可提供有價值的判斷信息。
(4)正電子發射斷層掃描-計算機斷層掃描(PET-CT):PET-CT在評估食管癌遠處轉移及新輔助免疫治療療效中有重要價值。
(5)超聲檢查:指常規體表超聲檢查,主要應用于食管癌患者雙側頸區、鎖骨上區淋巴結以及腹腔相關臟器轉移的評估診斷。超聲引導下穿刺活檢可獲得病理學診斷證據。
3.3.2 細胞、組織病理學檢查
內鏡下活檢以獲得病理學結果是診斷食管癌的金標準,對食管癌的定位、定性診斷和選擇治療方案具有不可替代的價值。
(1)食管普通光鏡[7]:食管普通光鏡是食管癌臨床診斷的必要檢查項目之一,兼顧食管病灶大體分型與活檢病理學確診。
(2)食管色素內鏡[7]:食管色素內鏡通過噴灑色素對比正常黏膜顯示上皮不典型增生或多原發早癌區域,來提高定位活檢準確性。
(3)纖維支氣管鏡:纖維支氣管鏡對于食管癌病變累及氣管、支氣管者,應行纖維支氣管鏡檢查以明確受累狀況。
(4)食管超聲內鏡[8-10]:食管超聲內鏡是一種能充分了解食管與鄰近組織器官的解剖關系、區分腫瘤深度(T分期)和局部淋巴結受累情況的消化道檢查技術,尤其對早期階段(T1~T2)的腫瘤精確評估有重要意義。
3.4 臨床分期
TNM分期可參考UICC /AJCC 分期系統(2017年第8版)。
4 新輔助免疫治療方案選擇
目前食管癌新輔助化療方案療效仍然有限。文獻[11-14]報道,新輔助化療的病理完全緩解(pathologic complete response,pCR)率為2.5%~18.6%(1項Meta分析[11]結果為6.7%)。免疫聯合療法的應用是一種潛在有益的新輔助治療選擇,新輔助免疫聯合化療pCR率高達31.4%[15],相較于新輔助化療方案,新輔助免疫聯合化療的近期療效顯著(表1),pCR率提升20%~30%[14,22-32],遠期療效尚需進一步觀察。
4.1 免疫聯合化療方案選擇
不同化療藥物確定或潛在的致免疫原性效果各有差異,基礎研究[16]顯示紫杉類/順鉑的潛在致免疫原性優于氟脲嘧啶類藥物。現有國內食管鱗癌新輔助臨床探索也多為免疫聯合紫杉類和鉑類方案,不同研究數據發現白蛋白結合型紫杉醇聯合方案相比紫杉醇聯合方案有近期療效更好的趨勢(表1)。用藥周期多為2~3周期[22-32]。基層患者推薦細胞程序性死亡蛋白1(PD-1)抑制劑聯合紫杉醇(或白蛋白結合型紫杉醇)/含鉑類方案。食管癌新輔助治療用藥方案包括8種。
(1)TD-NICE研究用藥方案(食管鱗癌)[22] 替雷利珠單抗+白蛋白結合型紫杉醇+卡鉑:替雷利珠單抗:200 mg,靜脈滴注,第1 d;白蛋白結合型紫杉醇:130 mg/m2,靜脈滴注,第1 d、8 d;卡鉑:曲線下面積(AUC)=5,靜脈滴注,第1 d。每21 d為1周期,術前共3個周期。
(2)NICE研究用藥方案(食管鱗癌)[23] 卡瑞利珠單抗+白蛋白結合型紫杉醇+卡鉑:卡瑞利珠單抗:200 mg,靜脈滴注,第1 d;白蛋白結合型紫杉醇:100 mg/m2,靜脈滴注,第1、8、15 d;卡鉑:AUC=5,靜脈滴注,第1 d。每21 d為1周期,術前2個周期。
(3)ChiCTR1900026593研究用藥方案(食管鱗癌)[24] 信迪利單抗+紫杉醇+卡鉑:信迪利單抗:200 mg,靜脈滴注,第1 d;紫杉醇:135 mg/m2,靜脈滴注,第1 d;卡鉑:AUC=5,靜脈滴注,第1 d。每21 d為1周期,術前2個周期。
(4)Keystone-001研究用藥方案(食管鱗癌)[27] 帕博利珠單抗+紫杉醇+順鉑:帕博利珠單抗:200 mg,靜脈滴注,第1 d;紫杉醇:135 mg/m2,靜脈滴注,第 2 d;順鉑:20 mg/m2,靜脈滴注,第2~4 d。每21 d為1周期,術前3個周期。
(5)NCT04177797研究用藥方案(食管鱗癌)[25] 特瑞普利單抗+白蛋白結合型紫杉醇+卡鉑:特瑞普利單抗:240 mg,靜脈滴注,第1 d;白蛋白結合型紫杉醇:260 mg/m2,靜脈滴注,第1 d;卡鉑:AUC=5,靜脈滴注,第1 d。每21 d為1周期,術前2~3個周期。
(6)JCOG1804E研究(A組)用藥方案(食管鱗癌)[33] 納武利尤單抗+5-氟尿嘧啶+順鉑:納武利尤單抗:360 mg,靜脈滴注,第1 d;5-氟尿嘧啶:800 mg/m2,24 h持續靜脈滴注,第 1~5 d;順鉑:80 mg/m2,靜脈滴注,第1 d。每21 d為1周期,術前2個周期。
(7)NCT04354662 研究用藥方案(胃食管交界處腺癌)[32] 特瑞普利單抗+FLOT方案:特瑞普利單抗:240 mg,靜脈滴注,第1 d;多西他賽:50 mg/m2,第1 d;奧沙利鉑:85 mg/m2,第1 d;亞葉酸:200 mg/m2,第1 d;5-氟尿嘧啶:800 mg/m2,24 h持續靜脈滴注,第1 d。每2周為1周期,術前4個周期。
(8)基層推薦方案 PD-1抑制劑+紫杉醇+卡鉑方案 PD-1抑制劑:劑量參考藥物說明書,靜脈滴注,第1 d;紫杉醇:135 mg/m2,靜脈滴注,第1 d;卡鉑:AUC=5,靜脈滴注,第1 d;每21 d為1周期,術前2~4個周期。
4.2 免疫聯合放化療方案選擇
放療仍屬于局部治療,對腫瘤體積相對較大、以局部侵犯為主要表現的進展期食管癌有較好療效,而對以淋巴結轉移為表現(可能同時有淋巴管或血管微轉移)的進展期食管癌患者,可采用免疫聯合放化療方案。
食管癌新輔助放療多采用40~50 Gy的標準劑量,但在加入免疫和化療治療后,此劑量是否合理,目前仍無統一的標準。結合既往新輔助放化療NEOCRTEC5010研究[34]、CROSS研究[35]及JCOG1109 NExT 研究[14]及新輔助放化療聯合免疫治療研究中的PERFECT[19]和PALACE-1[18]研究,放療劑量以41.4 Gy(1.8 Gy,23 f)為主,每日1次,每周5次。
(1)NCT05323890研究用藥方案(食管鱗癌)[21] 同步放療+替雷利珠單抗+紫杉醇+順鉑:放療方案:41.4 Gy/23 f方案,每日1次,每周5次。替雷利珠單抗:200 mg,靜脈滴注,第1 d;白蛋白結合紫杉醇:100 mg/m2,靜脈滴注,第1 d;順鉑:75 mg/m2,靜脈滴注,第1~3 d;每21 d為1周期,術前2個周期。
(2)PALACE-01研究用藥方案(食管鱗癌)[18] 同步放療+帕博利珠單抗+紫杉醇+卡鉑:放療方案:41.4 Gy/23 f方案,每日1次,每周5次。帕博利珠單抗:2 mg/kg,靜脈滴注,第 1 d和第 22 d;紫杉醇:50 mg/m 2,靜脈滴注,每周1次,第1 d、8 d、15 d、22 d、29 d;卡鉑:AUC=2,靜脈滴注,每周1次,第1 d、8 d、15 d、22 d、29 d。
(3)PERFECT研究用藥方案(食管腺癌)[19] 同步放療+阿替利珠單抗+紫杉醇+卡鉑:放療方案:41.4 Gy/23 f方案,每日1次,每周5次。阿替利珠單抗:1 200 mg,靜脈滴注,第1 d、22 d、43 d、64 d、85 d;紫杉醇:50 mg/m 2,靜脈滴注,每周1次,第1 d、8 d、15 d、22 d、29 d;卡鉑:AUC=2,靜脈滴注,每周1次,第1 d、8 d、15 d、22 d、29 d。
推薦3(方案選擇):新輔助免疫治療方案應結合各級醫院藥物可及性及醫保政策自主選擇;免疫聯合化療方案用藥周期多為2~3周期;基層患者推薦PD-1抑制劑聯合紫杉醇/鉑類方案(ⅡA)。
5 新輔助免疫治療后手術時機
新輔助治療后手術時機因新輔助治療方案不同而異,特別是新輔助放療后有組織纖維化、組織水腫可能,過早手術會增加術中的解剖難度、組織滲出導致的愈合能力延遲,可能造成纖維化明顯,增加手術難度,還可能發生病變局部及全身進展可能。
結合食管癌免疫新輔助相關研究資料/數據[22-32],免疫聯合化療新輔助治療方案建議用藥治療結束后3~6周內手術。新輔助同步放化療后適度的休息可讓患者體質得到恢復,且不會導致腫瘤再次生長,考慮到放療后手術難度的增加,結合既往新輔助放化療聯合免疫治療中所采用的手術間隔時間多為4~6或6~8周[17-21],建議新輔助免疫聯合放化療至手術時間間隔為4~8周。
推薦4(手術時機):新輔助免疫治療后手術時機:免疫聯合化療方案治療結束后3~6周內手術,免疫聯合放化療后手術時間間隔為4~8周(Ⅰ)。
6 臨床療效的評估方法和標準
食管癌新輔助免疫治療后療效評估主要包括病理學評估、影像學評估、生活質量評估。多數新輔助免疫治療的臨床研究將主要病理緩解(major pathologic response,MPR)和pCR作為主要臨床研究終點,同時會結合影像學檢查。循環腫瘤DNA或許可作為新的有效預測標志物,但目前還沒有得到普遍推廣,尚缺乏統一規范。
6.1 病理學評估
6.1.1 病理學評估標準及局限性
病理學評估是術前新輔助療效判斷的主要標準[36],以手術切除瘤床和區域淋巴結組織的病理標本為依據,通過鏡下評估腫瘤組織退縮改變的程度。
目前尚無統一的腫瘤退縮分級評估系統,在多項研究病理評估中,美國病理學家協會(College of American Pathologists,CAP)/美國國立綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)指南分級、ypTNM病理分級較多見。ypT分期和術后腫瘤殘余量(Becker 標準)對預后分層有重要作用,被廣泛引用至多項研究并作為評估腫瘤反應的金標準[37]。
目前病理評估仍存在檢測標本不能反映治療前病情、無統一的病理學反應評估標準、易受外科及病理檢查取材和切片制作要求等質量控制因素的影響等局限性[38-40],需要胸外科與病理科醫師共同參與探討。
6.1.2 新輔助治療后標本取材要點
(1)“腫瘤床”和周邊1 cm內的組織全部取材,并進行編號;(2)建議取材照相:碘染前、后、取材切面(含編號);(3)腫瘤不明顯時,根據治療前內鏡、相關影像學資料及手術醫生標記確定“腫瘤床”,能辨識的潰瘍、壞死或瘢痕化的瘤床部位要全部取材,避免遺漏腫瘤;(4)食管腫瘤組織塊:建議按照每個組織塊約1 cm×2 cm大小進行包埋;(5)“腫瘤床”取完后再查找食管旁及胃左賁門旁淋巴結并取材;(6)單獨送檢的分組淋巴結應全部包埋取材;(7)對于較大的淋巴結(≥2 cm),建議將其切開取材放入多個包埋盒進行全部包埋,并進行取材編號備注。
6.2 影像學評估
影像學檢查目前仍是新輔助治療療效預測和評估的主要方法,包括內鏡超聲(EUS)、CT、PET-CT、MRI等,《醫學影像學在食管癌治療決策中應用的專家共識》[41]建議PET-CT及胸腹部CT增強用于食管癌新輔助放化療效果評價及隨訪,《NCCN食管和食管胃結合部癌臨床實踐指南(2022 V3版)》[5]也有同樣推薦。對于檢測殘存腫瘤并確認是否合適手術切除,仍需內鏡活檢及EUS檢查。由于MRI可更好顯示病變范圍和侵犯深度,其預測病理學上完全緩解的敏感性相對較好[42],在食管癌診斷及新輔助療效評價方面已經展現優勢。
實體瘤療效評價標準(response evaluation criteria in solid tumors,RECIST)1.1 和實體瘤免疫療效評價標準(immune response evaluation criteria in solid tumors,iRECIST)是目前臨床應用最為廣泛的實體瘤療效評判方法。但與病理學相比,常規的影像學檢查不能完全、及時地反映腫瘤組織在新輔助治療后發生的腫瘤組織學和代謝方面的變化,所以可采取CT聯合PET-CT、MRI評估食管癌的療效,并作為病情惡化判斷及新病灶發現的輔助手段。
6.3 生活質量評估
生活質量評估應在患者接受新輔助治療前后從生理功能、心理、滿意度、癥狀等方面進行綜合評估。目前食管癌的生活質量評價量表較多,臨床研究中常采用歐洲癌癥研究與治療組織(European Organisation for Research and Treatment of Cancer,EORTC)開發的核心量表QLQ-C30[43]及子量表QLQ-OES18[44]和QLQ-OG25[45]等,供臨床參考。
7 術后管理
7.1 術后并發癥管理及預防
吻合口瘺、肺部并發癥、心血管并發癥是最常見的食管癌術后并發癥[47-48]。新輔助治療后術前應結合患者基線病情、營養狀況、行為狀況、臟器功能及免疫相關性指標進行綜合評估,如:免疫力低下、基礎肺功能差的患者,肺炎風險相對高;從病理生理角度分析,化療可能對毛細血管的局部微循環有一定影響,局部微循環障礙導致吻合口周圍及肺部微循環血液供應減少,一定程度上增加了術后吻合口瘺、肺部感染的風險[47];新輔助放化療方案術后心血管并發癥發生率高于新輔助化療方案[11],應特別注意患者的心血管病史及心血管功能;營養差的患者,需重視圍術期營養支持。
新輔助免疫治療后還需關注免疫治療相關不良反應,包括肺毒性、心臟毒性、胃腸道毒性、內分泌毒性等,監測指標包括血常規、凝血分析、電解質、空腹血糖、肝腎功能、肌酸激酶、乳酸脫氫酶、甲狀腺功能、紅細胞沉降率及C反應蛋白[49],監測指標異常應警惕免疫相關不良反應的風險并及時診治,必要時多學科會診。
7.2 術后輔助治療
新輔助化療(放化療)聯合免疫治療后的患者術后是否進行輔助治療,應根據切除范圍、淋巴結清掃程度、有無殘留、病理結果(是否pCR)進行綜合評估。對于輔助治療方案,可根據新輔助用藥類型、用藥敏感程度及患者一般情況進行個性化治療。
CheckMate-577研究[50]結果顯示,新輔助放化療聯合手術切除的食管癌患者,對有病理殘存的病灶患者進行輔助免疫治療,與安慰劑相比,術后單獨輔助免疫治療可顯著延長患者無病生存期,降低遠處轉移和死亡風險,且免疫治療長期使用安全性良好。《中國臨床腫瘤學會(CSCO)食管癌診療指南2023》[2]推薦局部進展期食管或食管胃交界癌經新輔助同步放化療聯合R0切除后病理評估非pCR患者,術后輔助納武利尤單抗治療1年,可顯著提高無病生存率。
對于新輔助聯合免疫治療的患者,目前尚無定論。對于手術有殘留或淋巴結清掃范圍較小的患者,可考慮輔助放療;對于新輔助治療后病理評價腫瘤退縮不明顯的患者,可考慮更換用藥方案或聯合放療;對于病理評價腫瘤明顯緩解或完全緩解的患者,應結合術前分期和治療療程,可以考慮單獨免疫輔助治療或化療聯合免疫治療。
推薦5(術后管理):食管癌術后需密切監測并發癥及免疫治療相關不良反應的發生;并根據基線特征、病理緩解程度、R0切除率、免疫用藥敏感程度等因素分層評估,進行個性化治療(ⅡB)。
8 新輔助治療后器官保留策略
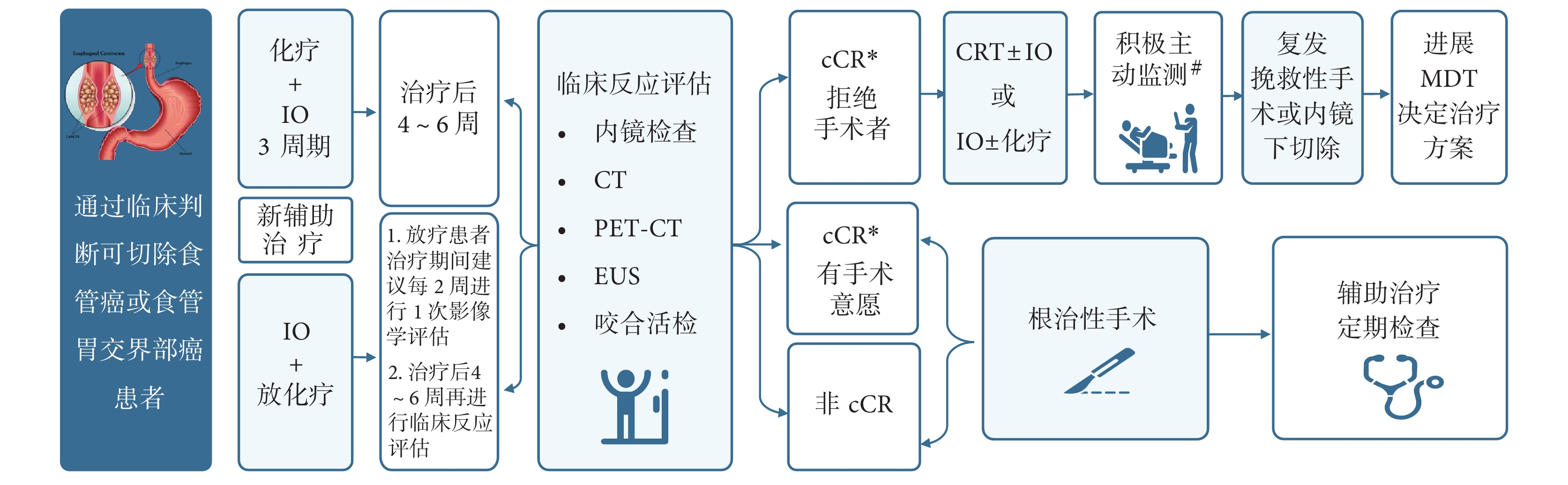
由于食管所處的特殊解剖部位,在不影響患者整體療效及生存年限的基礎上,采用保留食管的非手術治療方法對于改善患者生活質量具有重要的意義。一項Meta分析[51]結果顯示,接受新輔助放化療后達到臨床完全緩解(clinical complete response,cCR)的患者,與接受主動監測或標準食管切除術的總生存期相當。臨床上由于各種原因拒絕手術或不能耐受手術的患者,可考慮選擇器官保留策略。但任何保留食管的決策都需要在主管醫生指導下,經誘導治療后臨床評估為cCR,由患者及家屬要求或同意情況下進行,后期需要積極主動監測,及早發現復發并進行可能的挽救治療[52]。新輔助免疫治療后器官保留策略應包括新輔助治療、臨床反應綜合評估、個體化鞏固治療及全程積極主動監測及復發評估等內容(圖1)。
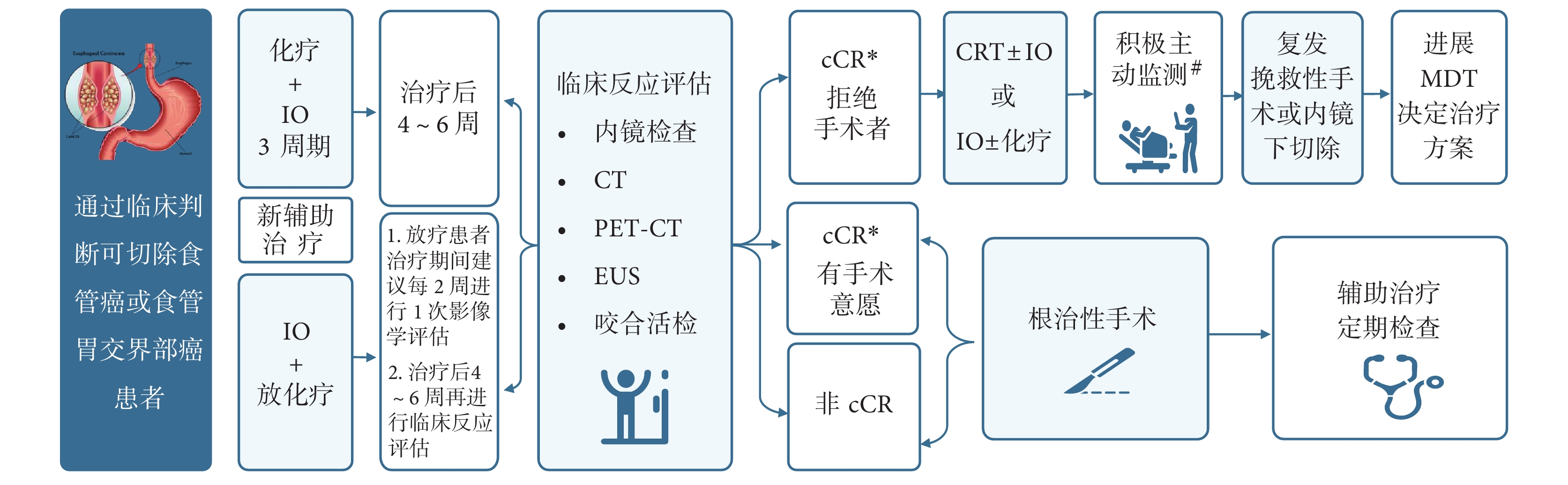 圖1
新輔助免疫治療后器官保留策略路徑圖
圖1
新輔助免疫治療后器官保留策略路徑圖
*結合影像學、內鏡檢查及內鏡下咬合活檢結果判定,即影像學和內徑下檢查未見異常病灶,內鏡下咬合活檢未見癌細胞(原發腫瘤部位和食管任何可疑病變處至少3個不同的位置);#在新輔助免疫治療完成后6、9、12、16、20、24、30、36、48個月和60個月進行隨訪;若懷疑復發,將進行胸腹CT,PET-CT和/或上消化道內窺鏡檢查;IO:腫瘤免疫治療;PET-CT:正電子發射斷層掃描-計算機斷層掃描;EUS:內鏡超聲;cCR:臨床完全緩解;CRT:新輔助放化療;MDT:多學科協作
8.1 新輔助治療
針對不同個體化人群采用最佳新輔助治療方案。preSANO研究[37]結果顯示:采用同步放化療篩選,治療后通過評估cCR預測pCR的準確率達84%。日本CROC研究[52]采用DCF三藥方案(多西紫杉醇+鉑類+氟尿嘧啶類)3周期誘導化療,臨床評估達到顯著應答(remarkable response,RR)的患者給與同步放化療,1年和3年總體生存率分別為100.0%和83.7%。在免疫時代,可進行多種模式的新輔助治療(參考第4部分方案)。
8.2 臨床反應綜合評估
第一次臨床反應評估一般在新輔助治療結束后4~6周進行,應包括內窺鏡超聲檢查、咬合活檢和可疑淋巴結細針穿刺檢測局部殘留病灶,并結合 CT、PET-CT 檢測等綜合評估[37]。cCR判定標準:影像學和內鏡下檢查未見異常病灶,內鏡下咬合活檢未見癌細胞(原發腫瘤部位和食管任何可疑病變處至少3個不同的位置);患者達到cCR后方可進行后續鞏固治療;不符合條件者應進行根治性手術。
8.3 鞏固治療
應結合新輔助治療方案及患者反應結果,制定個性化方案;免疫治療在增強鞏固治療中發揮重要作用。
8.4 積極主動監測
在強化治療完成后6、9、12、16、20、24、30、36、48個月和60個月進行隨訪。在懷疑復發的情況下,進行胸腹CT,PET-CT和內窺鏡檢查,確認復發后行挽救性內鏡切除或微創手術。
推薦6(器官保留策略):器官保留策略是患者新輔助治療后的另一種選擇,任何保留食管的決策都需要在主管醫生指導下,并經新輔助免疫治療后臨床評估為cCR,由患者及家屬要求或同意情況下進行,后期需要積極主動監測,及早發現復發并進行可能的挽救治療(ⅡB)。
9 食管癌新輔助免疫治療總則
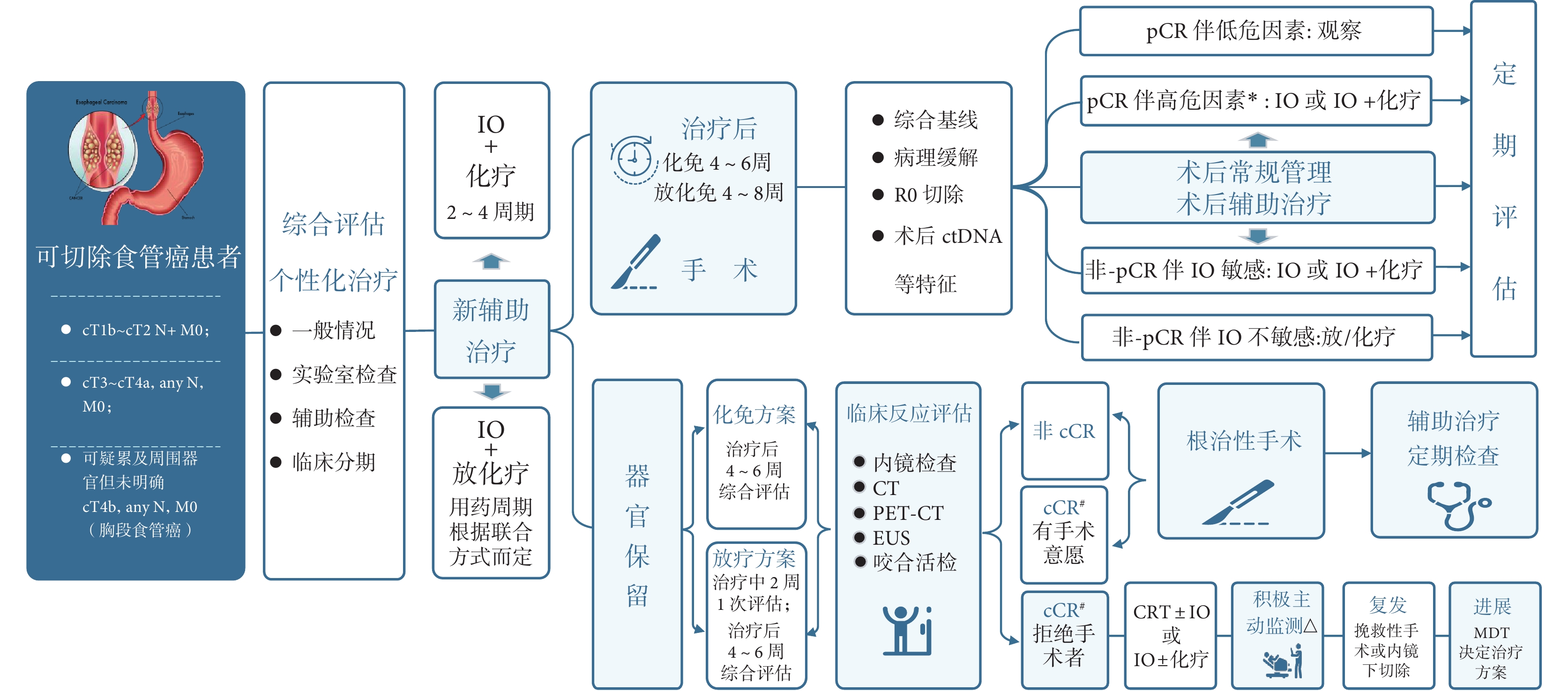
食管癌新輔助免疫治療的主要目的是縮瘤和改善患者預后。治療前應充分篩選適應人群,綜合評估患者狀況,排除免疫及手術相關禁忌證人群。根據患者特征及醫療條件制定個性化方案;術后加強監測并發癥及免疫治療相關不良反應的發生,同時對高危復發患者制定后期治療方案。新輔助免疫治療后選擇器官保留的患者,需要在主管醫生指導下,由患者及家屬要求或同意情況下進行,并積極主動監測。食管癌新輔助免疫治療診療路徑流程見圖2。
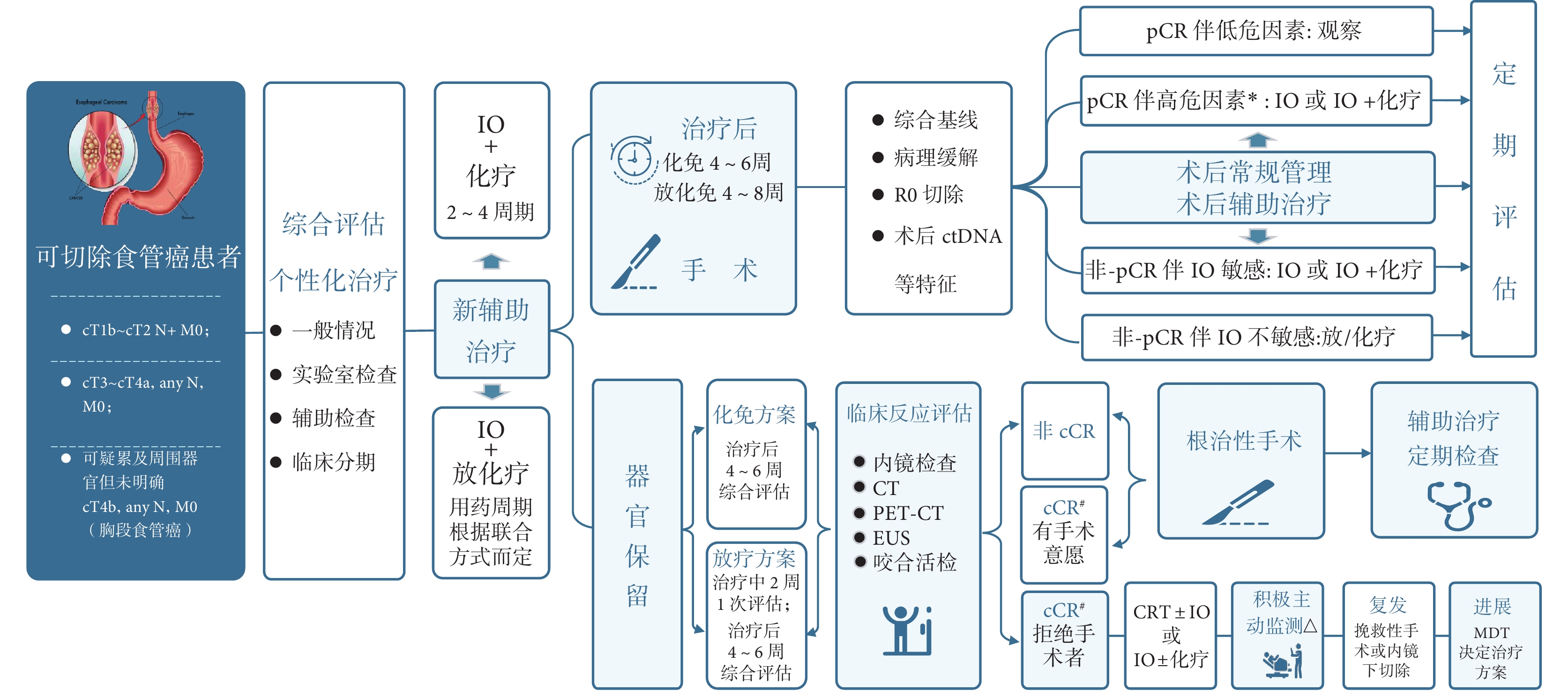 圖2
食管癌新輔助免疫治療診療路徑流程圖
圖2
食管癌新輔助免疫治療診療路徑流程圖
*高危因素:T分期晚、轉移淋巴結數量大于4個、淋巴血管侵犯(LVI)、腫瘤長度> 3 cm、術后ctDNA陽性等;# cCR:結合影像學、內鏡檢查及內鏡下咬合活檢結果判定,即影像學和內徑下檢查未見異常病灶,內鏡下咬合活檢未見癌細胞(原發腫瘤部位和食管任何可疑病變處至少3個不同的位置);△在新輔助治療完成后6、9、12、16、20、24、30、36、48個月和60個月進行隨訪;在懷疑復發的情況下,將進行胸腹CT,PET-CT和/或上消化道內窺鏡檢查;PET-CT:正電子發射斷層掃描-計算機斷層掃描;EUS:內鏡超聲;cCR:臨床完全緩解;CRT:新輔助放化療;MDT:多學科協作
推薦7(總則):食管癌新輔助免疫治療應根據患者綜合狀況,制定個體化治療方案,且全程關注患者免疫治療相關不良反應的發生及處理。術后分層評估,進行個性化管理。器官保留者應積極主動監測,及早發現復發并進行可能的挽救治療(ⅡA)。
《河南省食管癌新輔助免疫治療診療路徑》專家名單
負責人:魏立(河南省人民醫院)、邢文群(河南省腫瘤醫院)、楊洋(鄭州大學第一附屬醫院)
執筆專家:務森(河南省人民醫院)、巴玉峰(河南省腫瘤醫院)、何苡(河南省人民醫院)、耿明飛(安陽市腫瘤醫院)、楊軍峰(河南省人民醫院)、王建軍(河南省人民醫院)、張國慶(鄭州大學第一附屬醫院)、劉寶興(河南省腫瘤醫院)、申思寧(河南省腫瘤醫院)
專家組成員(按姓氏漢語拼音排序):楚社錄(三門峽市中心醫院)、崔文鵬(漯河市中心醫院)、曹志坤(河南省人民醫院)、戴坤朋(永城市人民醫院)、杜大軍(信陽市中心醫院)、郭金成(焦作市第二人民醫院)、郭偉(駐馬店中心醫院)、韓倩(河南省人民醫院)、韓衛寧(太康縣人民醫院)、胡紅軍(新鄉市中心醫院)、胡金龍(河南省人民醫院)、郎保平(洛陽市中心醫院)、 李貴明(長垣市中醫院)、李紀遠(河南科技大學第一附屬醫院)、李攀科(濮陽縣人民醫院)、李偉(南陽市中心醫院)、李偉民(鶴壁市人民醫院)、李陽(南召縣人民醫院)、林慶勝(濮陽市油田總醫院)、劉秋雨(河南省人民醫院)、劉洋洋(信陽市中心醫院)、劉勇(光山縣人民醫院)、呂傳劍(河南省人民醫院)、苗旺(鄭州市第三人民醫院)、秦新躍(魯山縣人民醫院)、邵軍喜(淇縣人民醫院)、宋兵川(許昌市中心醫院)、譚博(臨潁縣人民醫院)、唐東方(開封市腫瘤醫院)、王國偉(尉氏縣第一人民醫院)、王獻增(林州市人民醫院)、王憲中(永城市人民醫院)、魏文學(河南省人民醫院)、閆紹宏(宜陽縣人民醫院)、楊家樂(襄城縣人民醫院)、張超(洛陽市中心醫院)、張劉軍(武陟濟民醫院)、張玉良(許昌市中心醫院)、趙冰超(嵩縣人民醫院)、鄭燕(河南省腫瘤醫院)
中國是食管癌發病率和病死率最高的國家。術前新輔助免疫治療可消除微小轉移病灶,降低腫瘤臨床分期,減少術中腫瘤種植轉移風險[1],為患者帶來更多手術成功的可能,最大程度地實現根治。食管癌新輔助免疫治療還處于探索階段,目前已發布的數據多為Ⅰb/Ⅱ期小樣本研究,但在降期、縮瘤、病理改善及R0切除等方面已經取得了令人鼓舞的成績,長期獲益還需要進一步觀察。雖然多項Ⅲ期大樣本臨床研究尚在進行中,相信在不久的將來,食管癌新輔助免疫治療將會進入快車道,急需在適應人群、患者評估、免疫聯合方案選擇、術后管理及新輔助免疫治療后器官保留策略等方面達成共識,指導臨床實踐。食管癌是河南區域高發腫瘤,我們聯合河南省內32家各級醫院的52位食管外科、腫瘤科、病理科、影像科及放療科醫師協作分工,制定《河南省食管癌新輔助免疫治療診療路徑》,供食管癌外科相關醫務人員參考。
1 證據與方法
本臨床路徑采用專家集中討論方式形成文中內容。主要流程包括編委專家遴選、執筆專家撰寫初稿、現場集中討論及投票、修改反饋、重新討論及表決、結果匯總等。參與制定臨床路徑的編委來自河南省內的省級、市級及縣級醫院食管外科。由來自河南省人民醫院、河南省腫瘤醫院、鄭州大學第一附屬醫院及安陽市腫瘤醫院的執筆專家負責檢索文獻。檢索PubMed、Web of Science等外文數據庫,萬方數據、CNKI等中文數據庫以及ASCO和ESMO的會議摘要(檢索時間從建庫截至2023年6月10日)。共納入52 篇文獻[1-52]。按照GRADE 證據質量分級與定義對納入的文獻進行質量評價,其中A級證據10條[6-7, 11-12, 14, 34-35, 37, 48-49],B級證據11條[2, 5, 8, 15, 41-45, 47, 50],C級證據31條[1, 3-4, 9-10, 13, 16-33, 36, 38-40, 46, 51-52]。經過對篩選文獻進行分析并草擬臨床路徑初稿,全體編委多次現場參與投票,最終形成區域臨床路徑。
本臨床路徑的推薦強度包括4級。Ⅰ級:強烈推薦,證據強度高等,專家組一致同意;ⅡA級:推薦,證據強度中等,專家組已達成共識;ⅡB類:推薦,證據強度低等,專家組基本同意,基本達成共識;Ⅲ類:證據強度極低,專家組提出相關建議,但尚存在一定分歧。基于證據和臨床經驗,并經專家5次討論與投票(循證證據與專家共識分值各占50%),共提出7條推薦意見,其中Ⅰ級推薦1條,ⅡA級推薦3條,ⅡB級推薦3條。
2 新輔助免疫治療目標人群
2.1 臨床分期
臨床分期采用國際抗癌聯盟(Union for International Cancer Control,UICC)與美國癌癥聯合會(American Joint Committee on Cancer,AJCC)聯合發布惡性腫瘤TNM分期系統(2017年第8版)。結合《中國臨床腫瘤學會(CSCO)食管癌診療指南2023》[2]及既往食管癌新輔助免疫治療研究,適應人群臨床分期為Ⅱ~ⅣA期,TNM分期為cT1b~cT2 N+ M0,cT3~cT4a任何N M0;可疑累及周圍器官但未明確cT4b任何N M0(胸段食管癌)。
2.2 目標人群
(1)具有區域淋巴結轉移的局部晚期可切除食管癌患者;(2)潛在可切除的局部晚期食管癌患者;(3)具有低分化、高T分期等高危復發因素可手術的食管癌患者[3-4]。
推薦1(目標人群):推薦具有淋巴結轉移、低分化、高T分期等高危復發因素的可手術患者作為新輔助免疫治療首選人群(ⅡA)。
3 患者評估
食管癌新輔助免疫治療患者在用藥前,要綜合評估患者的一般情況、實驗室檢查、輔助檢查及臨床分期等情況,從而制定出個體化的精準治療方案。
3.1 一般情況評估
評估內容包括既往史、家族史、基礎疾病、心肺功能、肝腎功能、營養狀況等。
(1)既往史和基礎疾病評估:包括各系統疾病病史,尤其關注心、肺、肝、腎等臟器功能不全的相關重癥疾病、內分泌疾病病史、自身免疫病史等。
(2)心血管疾病風險評估:主要評估手段包括患者的主觀癥狀、體征,心肌酶譜、肌鈣蛋白及B型鈉尿肽檢測,心電圖、超聲心動圖以及冠狀動脈CT血管成像或冠狀動脈造影等檢查。
(3)呼吸系統疾病風險評估:注意詢問呼吸道疾病史,再結合患者日常活動狀況、屏氣試驗、肺功能檢查(肺通氣功能及彌散功能)、血氧飽和度測定、血氣分析及CT檢查等,判斷患者肺功能狀況是否能夠耐受新輔助免疫治療及后續的手術治療。
(4)肝腎功能評估:對于乙肝、丙肝患者,需要進一步行病毒定量檢測。肝功能檢查指標主要包括膽紅素代謝、蛋白質合成代謝、脂肪分解代謝等。腎功能檢查項目主要包括尿常規、生化(血清尿素氮、肌酐、肌酐清除率)等。免疫抑制劑的清除率在輕度肝和/或腎功能受損患者與肝腎功能正常患者之間不存在差異。而對存在中度及以上肝和/或腎功能受損的患者,建議請相關專業醫師會診評估以確定能否行新輔助免疫治療和手術治療。
(5)內分泌系統評估:側重對甲狀腺功能進行檢查以評估患者甲狀腺狀況;詢問有無垂體、腎上腺、胰腺等相關內分泌疾病病史,主要檢查指標包括性激素六項、血糖、血皮質醇晝夜節律測定等;對于既往有內分泌疾病病史或自身免疫病病史(如潰瘍性結腸炎、克羅恩病、系統性紅斑狼瘡等)的患者,建議請相關專業醫師會診評估以確定能否使用免疫抑制劑行新輔助免疫治療。
(6)營養狀況評估:關注患者近期體重下降(5 kg以上)、進食(流食、半流食)等狀況,對2周以上只進少量流食患者,應通過腸內和/或腸外營養支持來改善其營養狀況。
3.2 實驗室檢查
在食管癌新輔助免疫治療前后,應警惕免疫治療相關不良反應發生的風險并及時診治,監測項目包括血常規、凝血分析、電解質、空腹血糖、肝腎功能、肌酸激酶、乳酸脫氫酶、甲狀腺功能五項、紅細胞沉降率及C反應蛋白等。
目前尚缺乏能夠準確預測新輔助免疫治療療效的分子標志物。瘤床和區域淋巴結組織程序性死亡配體1(PD-L1)的表達水平,可能會對臨床治療決策有一定作用。另外,潛在替代指標還包括腫瘤突變負荷、微衛星不穩定、神經營養酪氨酸受體以及循環腫瘤DNA[5],除非臨床研究范疇內,目前不推薦常規臨床診療。
推薦2(患者評估):新輔助免疫治療前需全面評估患者病史及整體狀況,監測患者心肌酶、甲狀腺功能及肝功能等指標,排除免疫及手術相關禁忌證人群,警惕免疫治療相關不良反應(ⅡB)。
3.3 輔助檢查
在對食管癌患者進行診斷時,可以通過超聲內鏡與影像學檢查結合的方式提高臨床分期準確率,對后續治療起到十分積極的作用。
3.3.1 影像學檢查[6 ]
(1)食管造影:食管造影是食管癌診斷和療效評價的重要方法,對于確定病灶的部位、長度以及浸潤情況具有非常重要的價值,同時觀察食管管壁的擴張情況,如懷疑存在食管胸膜瘺時,應采用非離子型對比劑。
(2)CT:食管癌治療及隨診過程中需行胸部、上腹部CT檢查,推薦增強掃描,根據病變位置和范圍可適當增加掃描范圍(如鎖骨上區及頸部等)。
(3)磁共振成像(MRI):MRI在食管癌診斷和療效評估中可作為CT檢查的補充手段,特別對于CT無法判斷食管癌原發灶與周圍氣管、支氣管膜部、主動脈外膜臨界關系時,MRI可提供有價值的判斷信息。
(4)正電子發射斷層掃描-計算機斷層掃描(PET-CT):PET-CT在評估食管癌遠處轉移及新輔助免疫治療療效中有重要價值。
(5)超聲檢查:指常規體表超聲檢查,主要應用于食管癌患者雙側頸區、鎖骨上區淋巴結以及腹腔相關臟器轉移的評估診斷。超聲引導下穿刺活檢可獲得病理學診斷證據。
3.3.2 細胞、組織病理學檢查
內鏡下活檢以獲得病理學結果是診斷食管癌的金標準,對食管癌的定位、定性診斷和選擇治療方案具有不可替代的價值。
(1)食管普通光鏡[7]:食管普通光鏡是食管癌臨床診斷的必要檢查項目之一,兼顧食管病灶大體分型與活檢病理學確診。
(2)食管色素內鏡[7]:食管色素內鏡通過噴灑色素對比正常黏膜顯示上皮不典型增生或多原發早癌區域,來提高定位活檢準確性。
(3)纖維支氣管鏡:纖維支氣管鏡對于食管癌病變累及氣管、支氣管者,應行纖維支氣管鏡檢查以明確受累狀況。
(4)食管超聲內鏡[8-10]:食管超聲內鏡是一種能充分了解食管與鄰近組織器官的解剖關系、區分腫瘤深度(T分期)和局部淋巴結受累情況的消化道檢查技術,尤其對早期階段(T1~T2)的腫瘤精確評估有重要意義。
3.4 臨床分期
TNM分期可參考UICC /AJCC 分期系統(2017年第8版)。
4 新輔助免疫治療方案選擇
目前食管癌新輔助化療方案療效仍然有限。文獻[11-14]報道,新輔助化療的病理完全緩解(pathologic complete response,pCR)率為2.5%~18.6%(1項Meta分析[11]結果為6.7%)。免疫聯合療法的應用是一種潛在有益的新輔助治療選擇,新輔助免疫聯合化療pCR率高達31.4%[15],相較于新輔助化療方案,新輔助免疫聯合化療的近期療效顯著(表1),pCR率提升20%~30%[14,22-32],遠期療效尚需進一步觀察。
4.1 免疫聯合化療方案選擇
不同化療藥物確定或潛在的致免疫原性效果各有差異,基礎研究[16]顯示紫杉類/順鉑的潛在致免疫原性優于氟脲嘧啶類藥物。現有國內食管鱗癌新輔助臨床探索也多為免疫聯合紫杉類和鉑類方案,不同研究數據發現白蛋白結合型紫杉醇聯合方案相比紫杉醇聯合方案有近期療效更好的趨勢(表1)。用藥周期多為2~3周期[22-32]。基層患者推薦細胞程序性死亡蛋白1(PD-1)抑制劑聯合紫杉醇(或白蛋白結合型紫杉醇)/含鉑類方案。食管癌新輔助治療用藥方案包括8種。
(1)TD-NICE研究用藥方案(食管鱗癌)[22] 替雷利珠單抗+白蛋白結合型紫杉醇+卡鉑:替雷利珠單抗:200 mg,靜脈滴注,第1 d;白蛋白結合型紫杉醇:130 mg/m2,靜脈滴注,第1 d、8 d;卡鉑:曲線下面積(AUC)=5,靜脈滴注,第1 d。每21 d為1周期,術前共3個周期。
(2)NICE研究用藥方案(食管鱗癌)[23] 卡瑞利珠單抗+白蛋白結合型紫杉醇+卡鉑:卡瑞利珠單抗:200 mg,靜脈滴注,第1 d;白蛋白結合型紫杉醇:100 mg/m2,靜脈滴注,第1、8、15 d;卡鉑:AUC=5,靜脈滴注,第1 d。每21 d為1周期,術前2個周期。
(3)ChiCTR1900026593研究用藥方案(食管鱗癌)[24] 信迪利單抗+紫杉醇+卡鉑:信迪利單抗:200 mg,靜脈滴注,第1 d;紫杉醇:135 mg/m2,靜脈滴注,第1 d;卡鉑:AUC=5,靜脈滴注,第1 d。每21 d為1周期,術前2個周期。
(4)Keystone-001研究用藥方案(食管鱗癌)[27] 帕博利珠單抗+紫杉醇+順鉑:帕博利珠單抗:200 mg,靜脈滴注,第1 d;紫杉醇:135 mg/m2,靜脈滴注,第 2 d;順鉑:20 mg/m2,靜脈滴注,第2~4 d。每21 d為1周期,術前3個周期。
(5)NCT04177797研究用藥方案(食管鱗癌)[25] 特瑞普利單抗+白蛋白結合型紫杉醇+卡鉑:特瑞普利單抗:240 mg,靜脈滴注,第1 d;白蛋白結合型紫杉醇:260 mg/m2,靜脈滴注,第1 d;卡鉑:AUC=5,靜脈滴注,第1 d。每21 d為1周期,術前2~3個周期。
(6)JCOG1804E研究(A組)用藥方案(食管鱗癌)[33] 納武利尤單抗+5-氟尿嘧啶+順鉑:納武利尤單抗:360 mg,靜脈滴注,第1 d;5-氟尿嘧啶:800 mg/m2,24 h持續靜脈滴注,第 1~5 d;順鉑:80 mg/m2,靜脈滴注,第1 d。每21 d為1周期,術前2個周期。
(7)NCT04354662 研究用藥方案(胃食管交界處腺癌)[32] 特瑞普利單抗+FLOT方案:特瑞普利單抗:240 mg,靜脈滴注,第1 d;多西他賽:50 mg/m2,第1 d;奧沙利鉑:85 mg/m2,第1 d;亞葉酸:200 mg/m2,第1 d;5-氟尿嘧啶:800 mg/m2,24 h持續靜脈滴注,第1 d。每2周為1周期,術前4個周期。
(8)基層推薦方案 PD-1抑制劑+紫杉醇+卡鉑方案 PD-1抑制劑:劑量參考藥物說明書,靜脈滴注,第1 d;紫杉醇:135 mg/m2,靜脈滴注,第1 d;卡鉑:AUC=5,靜脈滴注,第1 d;每21 d為1周期,術前2~4個周期。
4.2 免疫聯合放化療方案選擇
放療仍屬于局部治療,對腫瘤體積相對較大、以局部侵犯為主要表現的進展期食管癌有較好療效,而對以淋巴結轉移為表現(可能同時有淋巴管或血管微轉移)的進展期食管癌患者,可采用免疫聯合放化療方案。
食管癌新輔助放療多采用40~50 Gy的標準劑量,但在加入免疫和化療治療后,此劑量是否合理,目前仍無統一的標準。結合既往新輔助放化療NEOCRTEC5010研究[34]、CROSS研究[35]及JCOG1109 NExT 研究[14]及新輔助放化療聯合免疫治療研究中的PERFECT[19]和PALACE-1[18]研究,放療劑量以41.4 Gy(1.8 Gy,23 f)為主,每日1次,每周5次。
(1)NCT05323890研究用藥方案(食管鱗癌)[21] 同步放療+替雷利珠單抗+紫杉醇+順鉑:放療方案:41.4 Gy/23 f方案,每日1次,每周5次。替雷利珠單抗:200 mg,靜脈滴注,第1 d;白蛋白結合紫杉醇:100 mg/m2,靜脈滴注,第1 d;順鉑:75 mg/m2,靜脈滴注,第1~3 d;每21 d為1周期,術前2個周期。
(2)PALACE-01研究用藥方案(食管鱗癌)[18] 同步放療+帕博利珠單抗+紫杉醇+卡鉑:放療方案:41.4 Gy/23 f方案,每日1次,每周5次。帕博利珠單抗:2 mg/kg,靜脈滴注,第 1 d和第 22 d;紫杉醇:50 mg/m 2,靜脈滴注,每周1次,第1 d、8 d、15 d、22 d、29 d;卡鉑:AUC=2,靜脈滴注,每周1次,第1 d、8 d、15 d、22 d、29 d。
(3)PERFECT研究用藥方案(食管腺癌)[19] 同步放療+阿替利珠單抗+紫杉醇+卡鉑:放療方案:41.4 Gy/23 f方案,每日1次,每周5次。阿替利珠單抗:1 200 mg,靜脈滴注,第1 d、22 d、43 d、64 d、85 d;紫杉醇:50 mg/m 2,靜脈滴注,每周1次,第1 d、8 d、15 d、22 d、29 d;卡鉑:AUC=2,靜脈滴注,每周1次,第1 d、8 d、15 d、22 d、29 d。
推薦3(方案選擇):新輔助免疫治療方案應結合各級醫院藥物可及性及醫保政策自主選擇;免疫聯合化療方案用藥周期多為2~3周期;基層患者推薦PD-1抑制劑聯合紫杉醇/鉑類方案(ⅡA)。
5 新輔助免疫治療后手術時機
新輔助治療后手術時機因新輔助治療方案不同而異,特別是新輔助放療后有組織纖維化、組織水腫可能,過早手術會增加術中的解剖難度、組織滲出導致的愈合能力延遲,可能造成纖維化明顯,增加手術難度,還可能發生病變局部及全身進展可能。
結合食管癌免疫新輔助相關研究資料/數據[22-32],免疫聯合化療新輔助治療方案建議用藥治療結束后3~6周內手術。新輔助同步放化療后適度的休息可讓患者體質得到恢復,且不會導致腫瘤再次生長,考慮到放療后手術難度的增加,結合既往新輔助放化療聯合免疫治療中所采用的手術間隔時間多為4~6或6~8周[17-21],建議新輔助免疫聯合放化療至手術時間間隔為4~8周。
推薦4(手術時機):新輔助免疫治療后手術時機:免疫聯合化療方案治療結束后3~6周內手術,免疫聯合放化療后手術時間間隔為4~8周(Ⅰ)。
6 臨床療效的評估方法和標準
食管癌新輔助免疫治療后療效評估主要包括病理學評估、影像學評估、生活質量評估。多數新輔助免疫治療的臨床研究將主要病理緩解(major pathologic response,MPR)和pCR作為主要臨床研究終點,同時會結合影像學檢查。循環腫瘤DNA或許可作為新的有效預測標志物,但目前還沒有得到普遍推廣,尚缺乏統一規范。
6.1 病理學評估
6.1.1 病理學評估標準及局限性
病理學評估是術前新輔助療效判斷的主要標準[36],以手術切除瘤床和區域淋巴結組織的病理標本為依據,通過鏡下評估腫瘤組織退縮改變的程度。
目前尚無統一的腫瘤退縮分級評估系統,在多項研究病理評估中,美國病理學家協會(College of American Pathologists,CAP)/美國國立綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)指南分級、ypTNM病理分級較多見。ypT分期和術后腫瘤殘余量(Becker 標準)對預后分層有重要作用,被廣泛引用至多項研究并作為評估腫瘤反應的金標準[37]。
目前病理評估仍存在檢測標本不能反映治療前病情、無統一的病理學反應評估標準、易受外科及病理檢查取材和切片制作要求等質量控制因素的影響等局限性[38-40],需要胸外科與病理科醫師共同參與探討。
6.1.2 新輔助治療后標本取材要點
(1)“腫瘤床”和周邊1 cm內的組織全部取材,并進行編號;(2)建議取材照相:碘染前、后、取材切面(含編號);(3)腫瘤不明顯時,根據治療前內鏡、相關影像學資料及手術醫生標記確定“腫瘤床”,能辨識的潰瘍、壞死或瘢痕化的瘤床部位要全部取材,避免遺漏腫瘤;(4)食管腫瘤組織塊:建議按照每個組織塊約1 cm×2 cm大小進行包埋;(5)“腫瘤床”取完后再查找食管旁及胃左賁門旁淋巴結并取材;(6)單獨送檢的分組淋巴結應全部包埋取材;(7)對于較大的淋巴結(≥2 cm),建議將其切開取材放入多個包埋盒進行全部包埋,并進行取材編號備注。
6.2 影像學評估
影像學檢查目前仍是新輔助治療療效預測和評估的主要方法,包括內鏡超聲(EUS)、CT、PET-CT、MRI等,《醫學影像學在食管癌治療決策中應用的專家共識》[41]建議PET-CT及胸腹部CT增強用于食管癌新輔助放化療效果評價及隨訪,《NCCN食管和食管胃結合部癌臨床實踐指南(2022 V3版)》[5]也有同樣推薦。對于檢測殘存腫瘤并確認是否合適手術切除,仍需內鏡活檢及EUS檢查。由于MRI可更好顯示病變范圍和侵犯深度,其預測病理學上完全緩解的敏感性相對較好[42],在食管癌診斷及新輔助療效評價方面已經展現優勢。
實體瘤療效評價標準(response evaluation criteria in solid tumors,RECIST)1.1 和實體瘤免疫療效評價標準(immune response evaluation criteria in solid tumors,iRECIST)是目前臨床應用最為廣泛的實體瘤療效評判方法。但與病理學相比,常規的影像學檢查不能完全、及時地反映腫瘤組織在新輔助治療后發生的腫瘤組織學和代謝方面的變化,所以可采取CT聯合PET-CT、MRI評估食管癌的療效,并作為病情惡化判斷及新病灶發現的輔助手段。
6.3 生活質量評估
生活質量評估應在患者接受新輔助治療前后從生理功能、心理、滿意度、癥狀等方面進行綜合評估。目前食管癌的生活質量評價量表較多,臨床研究中常采用歐洲癌癥研究與治療組織(European Organisation for Research and Treatment of Cancer,EORTC)開發的核心量表QLQ-C30[43]及子量表QLQ-OES18[44]和QLQ-OG25[45]等,供臨床參考。
7 術后管理
7.1 術后并發癥管理及預防
吻合口瘺、肺部并發癥、心血管并發癥是最常見的食管癌術后并發癥[47-48]。新輔助治療后術前應結合患者基線病情、營養狀況、行為狀況、臟器功能及免疫相關性指標進行綜合評估,如:免疫力低下、基礎肺功能差的患者,肺炎風險相對高;從病理生理角度分析,化療可能對毛細血管的局部微循環有一定影響,局部微循環障礙導致吻合口周圍及肺部微循環血液供應減少,一定程度上增加了術后吻合口瘺、肺部感染的風險[47];新輔助放化療方案術后心血管并發癥發生率高于新輔助化療方案[11],應特別注意患者的心血管病史及心血管功能;營養差的患者,需重視圍術期營養支持。
新輔助免疫治療后還需關注免疫治療相關不良反應,包括肺毒性、心臟毒性、胃腸道毒性、內分泌毒性等,監測指標包括血常規、凝血分析、電解質、空腹血糖、肝腎功能、肌酸激酶、乳酸脫氫酶、甲狀腺功能、紅細胞沉降率及C反應蛋白[49],監測指標異常應警惕免疫相關不良反應的風險并及時診治,必要時多學科會診。
7.2 術后輔助治療
新輔助化療(放化療)聯合免疫治療后的患者術后是否進行輔助治療,應根據切除范圍、淋巴結清掃程度、有無殘留、病理結果(是否pCR)進行綜合評估。對于輔助治療方案,可根據新輔助用藥類型、用藥敏感程度及患者一般情況進行個性化治療。
CheckMate-577研究[50]結果顯示,新輔助放化療聯合手術切除的食管癌患者,對有病理殘存的病灶患者進行輔助免疫治療,與安慰劑相比,術后單獨輔助免疫治療可顯著延長患者無病生存期,降低遠處轉移和死亡風險,且免疫治療長期使用安全性良好。《中國臨床腫瘤學會(CSCO)食管癌診療指南2023》[2]推薦局部進展期食管或食管胃交界癌經新輔助同步放化療聯合R0切除后病理評估非pCR患者,術后輔助納武利尤單抗治療1年,可顯著提高無病生存率。
對于新輔助聯合免疫治療的患者,目前尚無定論。對于手術有殘留或淋巴結清掃范圍較小的患者,可考慮輔助放療;對于新輔助治療后病理評價腫瘤退縮不明顯的患者,可考慮更換用藥方案或聯合放療;對于病理評價腫瘤明顯緩解或完全緩解的患者,應結合術前分期和治療療程,可以考慮單獨免疫輔助治療或化療聯合免疫治療。
推薦5(術后管理):食管癌術后需密切監測并發癥及免疫治療相關不良反應的發生;并根據基線特征、病理緩解程度、R0切除率、免疫用藥敏感程度等因素分層評估,進行個性化治療(ⅡB)。
8 新輔助治療后器官保留策略
由于食管所處的特殊解剖部位,在不影響患者整體療效及生存年限的基礎上,采用保留食管的非手術治療方法對于改善患者生活質量具有重要的意義。一項Meta分析[51]結果顯示,接受新輔助放化療后達到臨床完全緩解(clinical complete response,cCR)的患者,與接受主動監測或標準食管切除術的總生存期相當。臨床上由于各種原因拒絕手術或不能耐受手術的患者,可考慮選擇器官保留策略。但任何保留食管的決策都需要在主管醫生指導下,經誘導治療后臨床評估為cCR,由患者及家屬要求或同意情況下進行,后期需要積極主動監測,及早發現復發并進行可能的挽救治療[52]。新輔助免疫治療后器官保留策略應包括新輔助治療、臨床反應綜合評估、個體化鞏固治療及全程積極主動監測及復發評估等內容(圖1)。
 圖1
新輔助免疫治療后器官保留策略路徑圖
圖1
新輔助免疫治療后器官保留策略路徑圖
*結合影像學、內鏡檢查及內鏡下咬合活檢結果判定,即影像學和內徑下檢查未見異常病灶,內鏡下咬合活檢未見癌細胞(原發腫瘤部位和食管任何可疑病變處至少3個不同的位置);#在新輔助免疫治療完成后6、9、12、16、20、24、30、36、48個月和60個月進行隨訪;若懷疑復發,將進行胸腹CT,PET-CT和/或上消化道內窺鏡檢查;IO:腫瘤免疫治療;PET-CT:正電子發射斷層掃描-計算機斷層掃描;EUS:內鏡超聲;cCR:臨床完全緩解;CRT:新輔助放化療;MDT:多學科協作
8.1 新輔助治療
針對不同個體化人群采用最佳新輔助治療方案。preSANO研究[37]結果顯示:采用同步放化療篩選,治療后通過評估cCR預測pCR的準確率達84%。日本CROC研究[52]采用DCF三藥方案(多西紫杉醇+鉑類+氟尿嘧啶類)3周期誘導化療,臨床評估達到顯著應答(remarkable response,RR)的患者給與同步放化療,1年和3年總體生存率分別為100.0%和83.7%。在免疫時代,可進行多種模式的新輔助治療(參考第4部分方案)。
8.2 臨床反應綜合評估
第一次臨床反應評估一般在新輔助治療結束后4~6周進行,應包括內窺鏡超聲檢查、咬合活檢和可疑淋巴結細針穿刺檢測局部殘留病灶,并結合 CT、PET-CT 檢測等綜合評估[37]。cCR判定標準:影像學和內鏡下檢查未見異常病灶,內鏡下咬合活檢未見癌細胞(原發腫瘤部位和食管任何可疑病變處至少3個不同的位置);患者達到cCR后方可進行后續鞏固治療;不符合條件者應進行根治性手術。
8.3 鞏固治療
應結合新輔助治療方案及患者反應結果,制定個性化方案;免疫治療在增強鞏固治療中發揮重要作用。
8.4 積極主動監測
在強化治療完成后6、9、12、16、20、24、30、36、48個月和60個月進行隨訪。在懷疑復發的情況下,進行胸腹CT,PET-CT和內窺鏡檢查,確認復發后行挽救性內鏡切除或微創手術。
推薦6(器官保留策略):器官保留策略是患者新輔助治療后的另一種選擇,任何保留食管的決策都需要在主管醫生指導下,并經新輔助免疫治療后臨床評估為cCR,由患者及家屬要求或同意情況下進行,后期需要積極主動監測,及早發現復發并進行可能的挽救治療(ⅡB)。
9 食管癌新輔助免疫治療總則
食管癌新輔助免疫治療的主要目的是縮瘤和改善患者預后。治療前應充分篩選適應人群,綜合評估患者狀況,排除免疫及手術相關禁忌證人群。根據患者特征及醫療條件制定個性化方案;術后加強監測并發癥及免疫治療相關不良反應的發生,同時對高危復發患者制定后期治療方案。新輔助免疫治療后選擇器官保留的患者,需要在主管醫生指導下,由患者及家屬要求或同意情況下進行,并積極主動監測。食管癌新輔助免疫治療診療路徑流程見圖2。
 圖2
食管癌新輔助免疫治療診療路徑流程圖
圖2
食管癌新輔助免疫治療診療路徑流程圖
*高危因素:T分期晚、轉移淋巴結數量大于4個、淋巴血管侵犯(LVI)、腫瘤長度> 3 cm、術后ctDNA陽性等;# cCR:結合影像學、內鏡檢查及內鏡下咬合活檢結果判定,即影像學和內徑下檢查未見異常病灶,內鏡下咬合活檢未見癌細胞(原發腫瘤部位和食管任何可疑病變處至少3個不同的位置);△在新輔助治療完成后6、9、12、16、20、24、30、36、48個月和60個月進行隨訪;在懷疑復發的情況下,將進行胸腹CT,PET-CT和/或上消化道內窺鏡檢查;PET-CT:正電子發射斷層掃描-計算機斷層掃描;EUS:內鏡超聲;cCR:臨床完全緩解;CRT:新輔助放化療;MDT:多學科協作
推薦7(總則):食管癌新輔助免疫治療應根據患者綜合狀況,制定個體化治療方案,且全程關注患者免疫治療相關不良反應的發生及處理。術后分層評估,進行個性化管理。器官保留者應積極主動監測,及早發現復發并進行可能的挽救治療(ⅡA)。
《河南省食管癌新輔助免疫治療診療路徑》專家名單
負責人:魏立(河南省人民醫院)、邢文群(河南省腫瘤醫院)、楊洋(鄭州大學第一附屬醫院)
執筆專家:務森(河南省人民醫院)、巴玉峰(河南省腫瘤醫院)、何苡(河南省人民醫院)、耿明飛(安陽市腫瘤醫院)、楊軍峰(河南省人民醫院)、王建軍(河南省人民醫院)、張國慶(鄭州大學第一附屬醫院)、劉寶興(河南省腫瘤醫院)、申思寧(河南省腫瘤醫院)
專家組成員(按姓氏漢語拼音排序):楚社錄(三門峽市中心醫院)、崔文鵬(漯河市中心醫院)、曹志坤(河南省人民醫院)、戴坤朋(永城市人民醫院)、杜大軍(信陽市中心醫院)、郭金成(焦作市第二人民醫院)、郭偉(駐馬店中心醫院)、韓倩(河南省人民醫院)、韓衛寧(太康縣人民醫院)、胡紅軍(新鄉市中心醫院)、胡金龍(河南省人民醫院)、郎保平(洛陽市中心醫院)、 李貴明(長垣市中醫院)、李紀遠(河南科技大學第一附屬醫院)、李攀科(濮陽縣人民醫院)、李偉(南陽市中心醫院)、李偉民(鶴壁市人民醫院)、李陽(南召縣人民醫院)、林慶勝(濮陽市油田總醫院)、劉秋雨(河南省人民醫院)、劉洋洋(信陽市中心醫院)、劉勇(光山縣人民醫院)、呂傳劍(河南省人民醫院)、苗旺(鄭州市第三人民醫院)、秦新躍(魯山縣人民醫院)、邵軍喜(淇縣人民醫院)、宋兵川(許昌市中心醫院)、譚博(臨潁縣人民醫院)、唐東方(開封市腫瘤醫院)、王國偉(尉氏縣第一人民醫院)、王獻增(林州市人民醫院)、王憲中(永城市人民醫院)、魏文學(河南省人民醫院)、閆紹宏(宜陽縣人民醫院)、楊家樂(襄城縣人民醫院)、張超(洛陽市中心醫院)、張劉軍(武陟濟民醫院)、張玉良(許昌市中心醫院)、趙冰超(嵩縣人民醫院)、鄭燕(河南省腫瘤醫院)