引用本文: 任清林, 何文博, 岳佳瑞, 肖洪壁, 束余聲. 基于增強CT影像組學列線圖鑒別胸腺瘤風險程度的單中心回顧性研究. 中國胸心血管外科臨床雜志, 2024, 31(8): 1109-1118. doi: 10.7507/1007-4848.202308054 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
胸腺瘤是一種胸腺上皮性腫瘤[1] ,在前縱隔腫物中最常見。世界衛生組織(World Health Organization,WHO)根據腫瘤上皮細胞形態及淋巴細胞-上皮細胞比值將胸腺瘤分為5種亞型[2–4],分別為A、AB、B1、B2和 B3型[2];又根據惡性程度,將這5種亞型分為低危(A、AB和 B1型)和高危(B2和 B3型)[3-4]。兩者的預后不同,治療方案也有差異。低危胸腺瘤可以在Ⅲ期完整切除而無需進一步治療,而高危胸腺瘤則需要全面的治療,包括化療、放療和手術治療等[5-6],胸腺瘤的高低風險分組在手術方式、手術切除范圍、患者預后和治療決策中起重要作用。所以術前精準區分高低風險胸腺瘤可以決定術前術后的治療方案,對患者的遠期預后十分重要[7-8],穿刺活檢是術前診斷的金標準之一,但由于有創,取活檢的組織不能代表整個腫瘤組織,并且有腫瘤種植的風險,故美國國家綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)腫瘤學臨床實踐指南[9]指示應避免經胸腔活檢。開發一種高效、無創鑒別高低風險胸腺瘤的檢查方式十分必要[10]。
炎癥因子有幫助惡性細胞生存、增殖,促進血管生成和轉移,還可以通過腫瘤微環境促進癌癥發生發展的作用[11-12],已經在多個腫瘤中發現其與腫瘤的不良預后有關[13-14]。胸部增強CT(contrast-enhanced CT,CECT)是胸腺腫瘤影像學評估的標準檢查[9],在前縱隔腫物(囊性病變除外)診斷方面與磁共振成像(magnetic resonance imaging,MRI)相當或更優[15]。在早期的研究[16-18]中,內部密度和周圍脂肪浸潤等影像學特征已經運用到預測胸腺瘤亞型中,不過醫生的主觀評價可能會對影像特征預測的結果有影響,通過客觀的方法去提取影像組學特征并且加以分析是一種新的解決辦法。
影像組學是一個新興且前景廣闊的領域,通過高通量的圖像特征提取和挖掘,提供了腫瘤類型的全面定量分析[19],基于影像組學的機器學習模型已經應用于許多疾病的診斷和預后,包括胸腺瘤[20-21]。這些研究表明,影像組學可以幫助我們解決臨床問題,優化治療方案。因此,我們的目標是開發和驗證一種基于胸部CECT的影像組學列線圖,結合臨床獨立危險因素和影像組學特征,用于術前區分胸腺瘤風險程度。
1 資料與方法
1.1 臨床資料和分組
回顧性分析2018年1月—2023年2月在我院行手術切除并經病理證實胸腺瘤患者的臨床資料。 納入標準:(1)胸腺瘤的病理診斷基于活檢或手術病理;(2)術前或活檢前經過胸部CECT掃描;(3)患者的臨床病歷資料齊全;(4)無放療、化療史,無其他惡性腫瘤病史。排除標準:由于人工或其他原因導致的圖像質量差。
采用2015年WHO組織學分類標準確定病理亞分類,將胸腺瘤分為低危和高危。根據混合物中惡性程度的高低確定病理分型,如B1/B2胸腺瘤被歸為B2型。將所有病例按照7∶3的比例隨機分為訓練組和測試組。
1.2 臨床信息
納入的臨床特征為年齡、性別、吸煙、重癥肌無力和炎癥因子。重癥肌無力的納入標準為首次發現,未經激素治療,并且癥狀存在于胸部CECT掃描之前。在腫瘤切除或活檢前1周的常規檢查中測定血清白細胞、中性粒細胞、單核細胞、血小板、白蛋白和淋巴細胞計數。我院檢驗科進行數據分析。中性粒細胞、單核細胞和血小板計數除以淋巴細胞計數分別計算出中性粒細胞與淋巴細胞比率(neutrophil-to-lymphocyte ratio,NLR)、單核細胞與淋巴細胞比率(monocyte-to-lymphocyte ratio,MLR)和血小板與淋巴細胞比率(platelet-to-lymphocyte ratio,PLR)。
1.3 CT的基本信息
所有患者在術前或者穿刺活檢前經胸部CECT掃描。采用兩個不同的CT掃描儀:Discovery CT750 HD (GE MEDICAL SYSTEMS)和 Aquilion ONE (TOSHIBA)。掃描參數如下:Discovery CT750 HD:管電壓120 kV,管電流425 mA, 層厚5 mm,節距0.984;Aquilion ONE:管電壓120 kV,管電流200 mA,層厚5 mm,節距0.828。所有患者均采用仰臥位檢查,雙臂向上,深吸氣,掃描。通過前臂靜脈快速注入造影劑,造影劑包括碘丙胺和碘己醇,增強階段延遲60 s。
影像特征評價:輪廓(光滑或不光滑),內部密度(均勻或非均勻),鈣化(有或無),周圍脂肪浸潤(有或無);周圍組織侵犯(有或無);通過3D-slicer軟件(
1.4 腫瘤分割
每例患者的感興趣區(region of interest,ROI)都是由有7年經驗的影像科醫生使用3D-slicer 軟件(version 5.3.0,
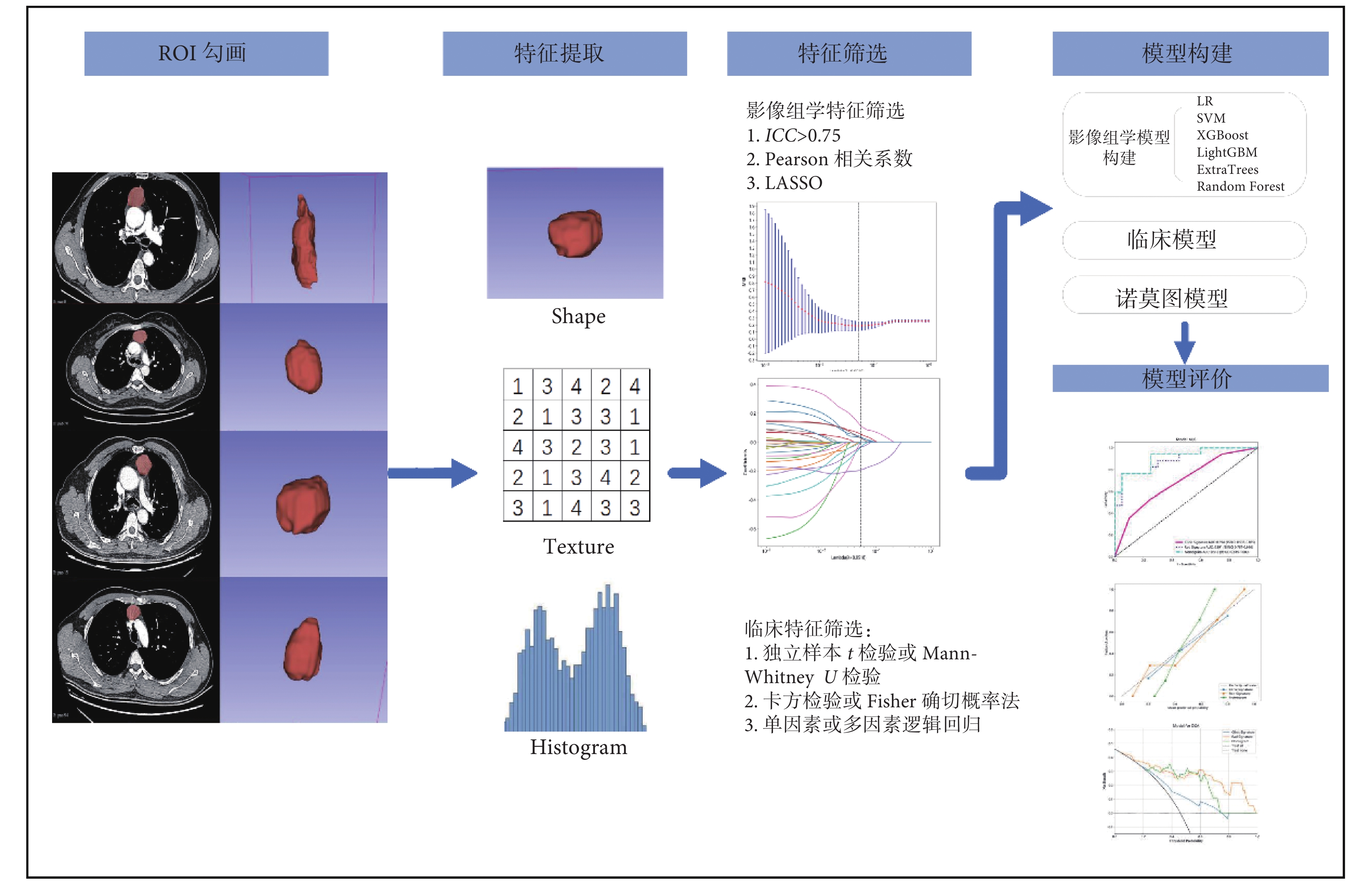
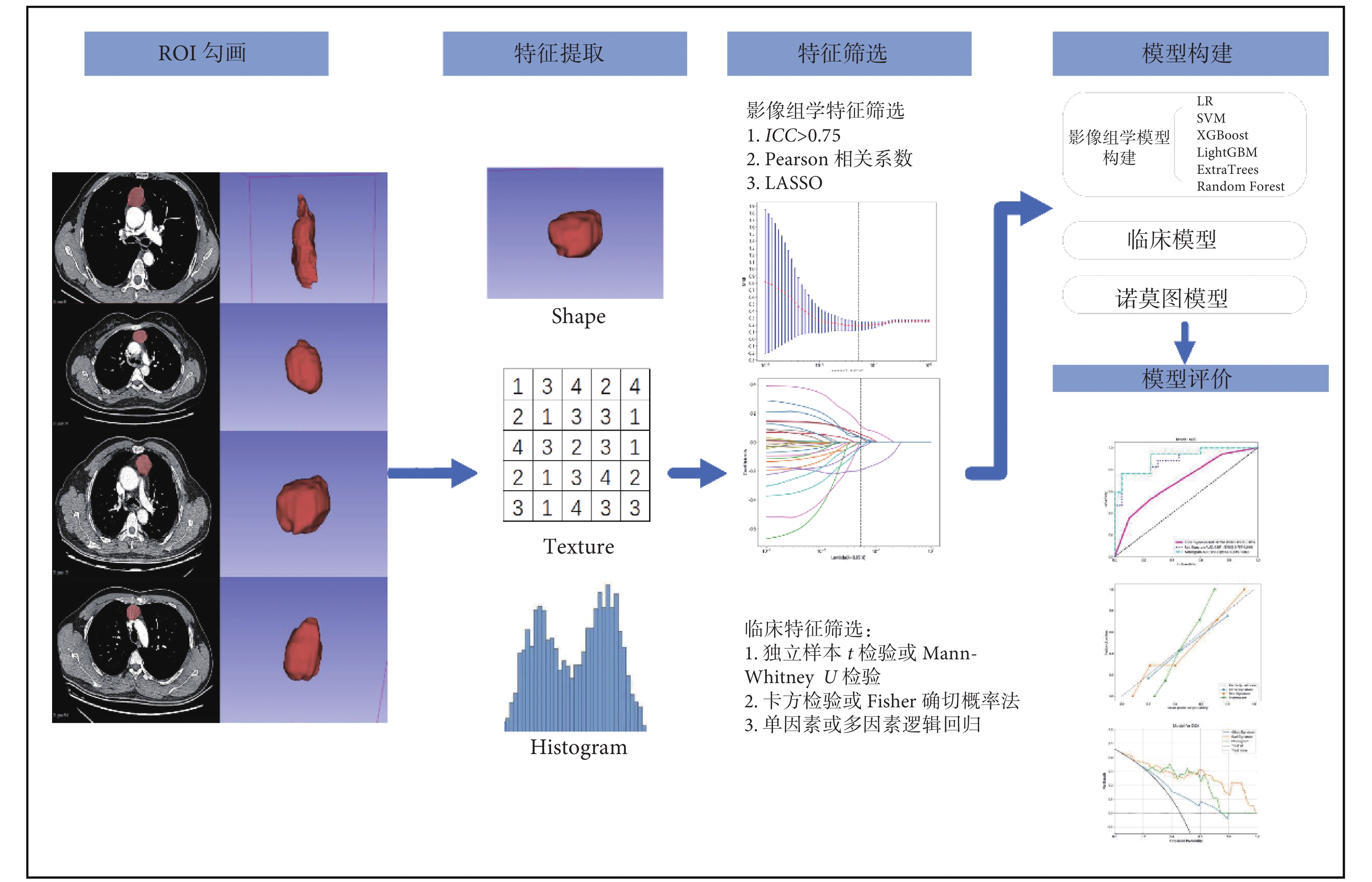 圖1
模型構建流程圖
圖1
模型構建流程圖
ROI:感興趣區;
1.5 影像特征提取和選擇
在執行特征提取之前,圖像被重新采樣,大小為1 mm×1 mm×1 mm。使用PyRadiomics,一個專門用于從醫學圖像中提取影像組學特征的開源Python程序(版本3.0.1,
1.6 影像特征模型的建立
通過機器學習算法旨在訓練出識別高危組和低危組胸腺瘤最準確的機器學習模型。采用6種不同的機器學習分類器用于訓練:邏輯回歸(logistic regression,LR),支持向量機(support vector machine,SVM),隨機森林(random forest),極端隨機樹(extremely randomized trees,ExtraTrees),極限梯度提升(extreme gradient boosting,XGBoost)和輕量級梯度提升機(light gradient boosting machine,LightGBM)。使用曲線下面積(area under the curve,AUC)、準確率、敏感度、特異度、陽性預測值和陰性預測值來評估這6種機器學習的診斷能力。通過比較這些性能指標,評估和比較各種機器學習算法在研究中的診斷能力。其中最佳算法將篩選出的影像組學特征構建1個影像組學標簽。
1.7 臨床模型和列線圖的構建
對性別、年齡、吸煙史、重癥肌無力、白細胞、中性粒細胞、淋巴細胞、單核細胞、血小板、白蛋白、NLR、MLR、PLR、腫瘤內部密度、輪廓是否光滑、有無鈣化、有無脂肪浸潤、腫瘤最大直徑、腫瘤體積等臨床特征和影像學特征進行了單因素和多因素logistic回歸分析,篩選區別高低危胸腺瘤的獨立預測因子,據此開發出臨床模型。構建1個綜合影像組學標簽與臨床特征的列線圖模型。對訓練組和測試組使用AUC、準確性、敏感性、特異性、陽性預測值和陰性預測值來評估和驗證模型的性能,并評估模型的一致性和臨床實用性。
1.8 統計學分析
使用Python軟件(版本3.7.12,
1.9 倫理審查
本研究經蘇北人民醫院醫學倫理委員會批準,免除知情同意要求。倫理審查編號:2021ky010-1。
2 結果
2.1 基線資料
最終共納入120例患者,其中女59例、男61例,平均年齡(56.30±12.10)歲。訓練組84例,測試組36例。高危胸腺瘤患者58例,低危胸腺瘤患者62例。訓練組中,高危和低危胸腺瘤患者重癥肌無力、縱隔脂肪浸潤差異有統計學意義(P<0.05)。測試組中,高危和低危胸腺瘤患者白細胞計數、中性粒細胞計數和NLR差異有統計學意義(P<0.05);見表1。經過單因素和多因素logistic回歸分析,結果顯示周圍脂肪浸潤和重癥肌無力是區分高低風險胸腺瘤的獨立危險因素(表2),以此構建臨床模型。
 /例(%)]
/例(%)]
2.2 影像組學特征分析及特征篩選
通過PyRadiomics提取ROI中的影像組學特征,共提取出
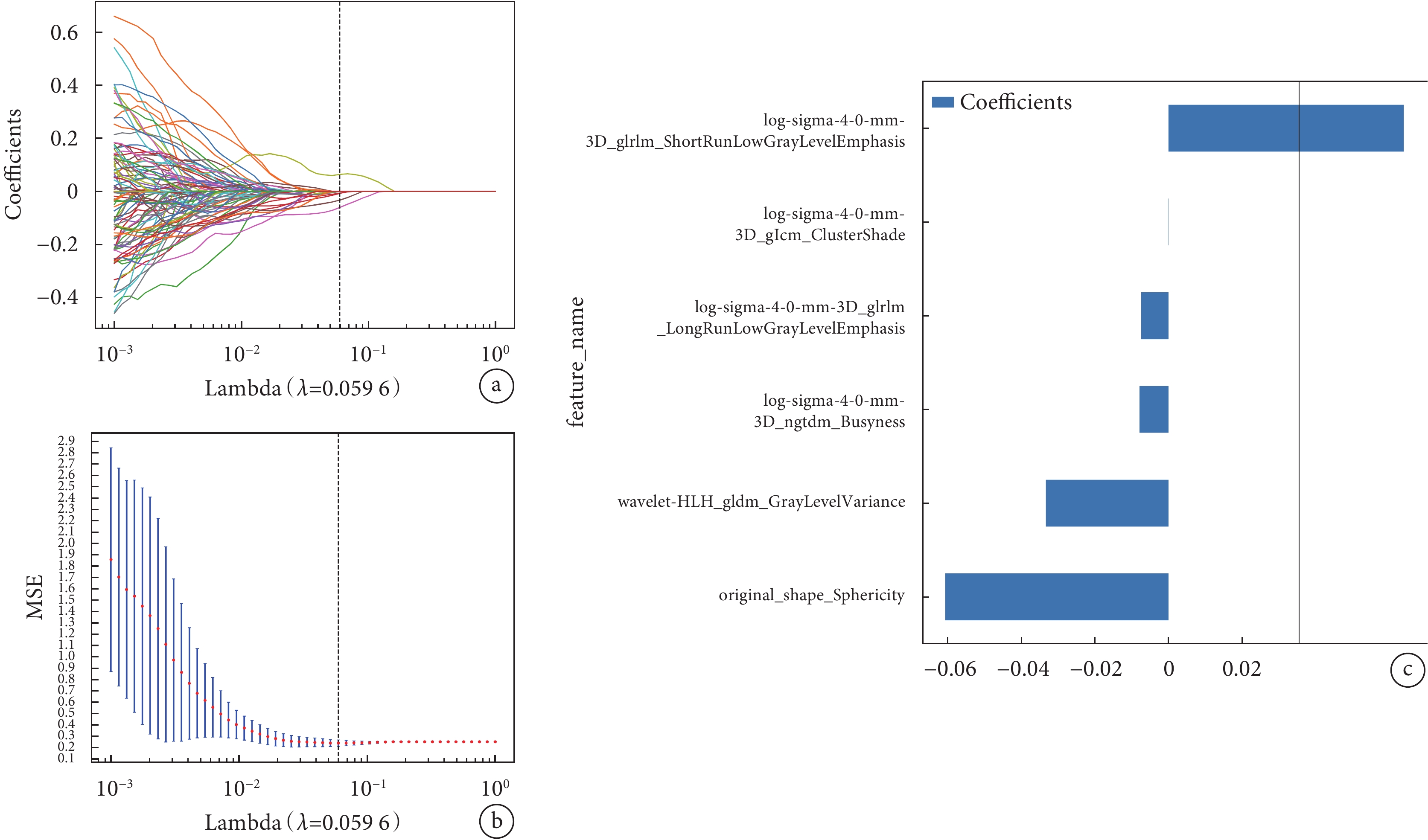
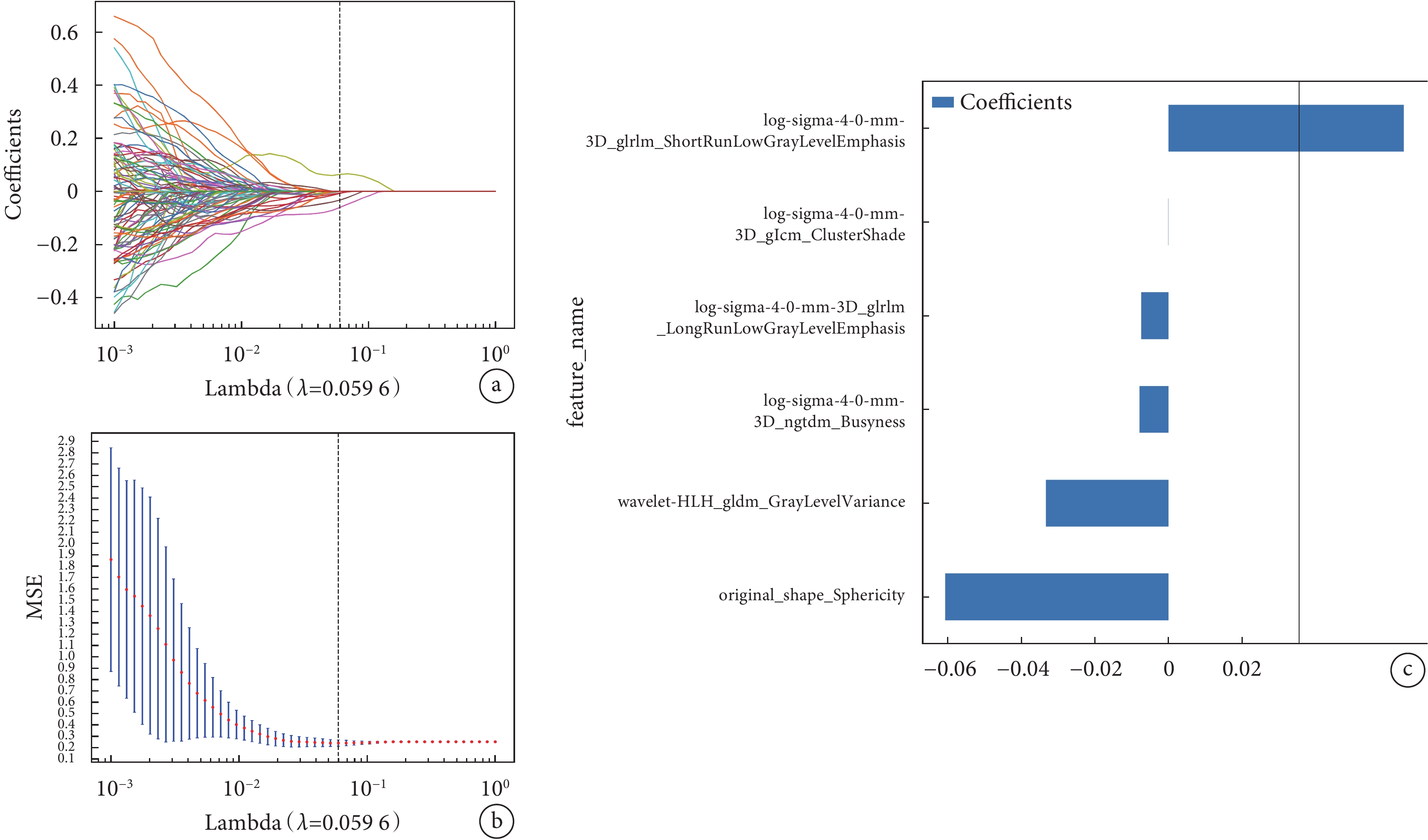 圖2
LASSO 回歸模型中采用 10折交叉驗證選擇最佳調優參數以及納入模型的影像組學特征
圖2
LASSO 回歸模型中采用 10折交叉驗證選擇最佳調優參數以及納入模型的影像組學特征
a:均方誤差圖;b:回歸系數圖;c:最佳特征集合
2.3 影像組學模型及其表現
隨機森林模型在訓練組中表現最好,AUC達0.873,準確率為0.786,敏感度為0.829,特異度為0.744,陽性預測值和陰性預測值分別為0.756和0.821。然而,在測試組中,ExtraTrees成為最好的影像組學模型,AUC、準確率、敏感度、特異度、陽性預測值和陰性預測值分別為0.802、0.806、0.765、0.842、0.812和0.800;見表3。隨機森林模型在訓練組和測試組中表現出過擬合的趨勢。因此,我們認為ExtraTrees是理想的影像組學模型,具有可持續性和穩定性。同一機器學習算法也運用到臨床模型的構建。
2.4 列線圖的建立
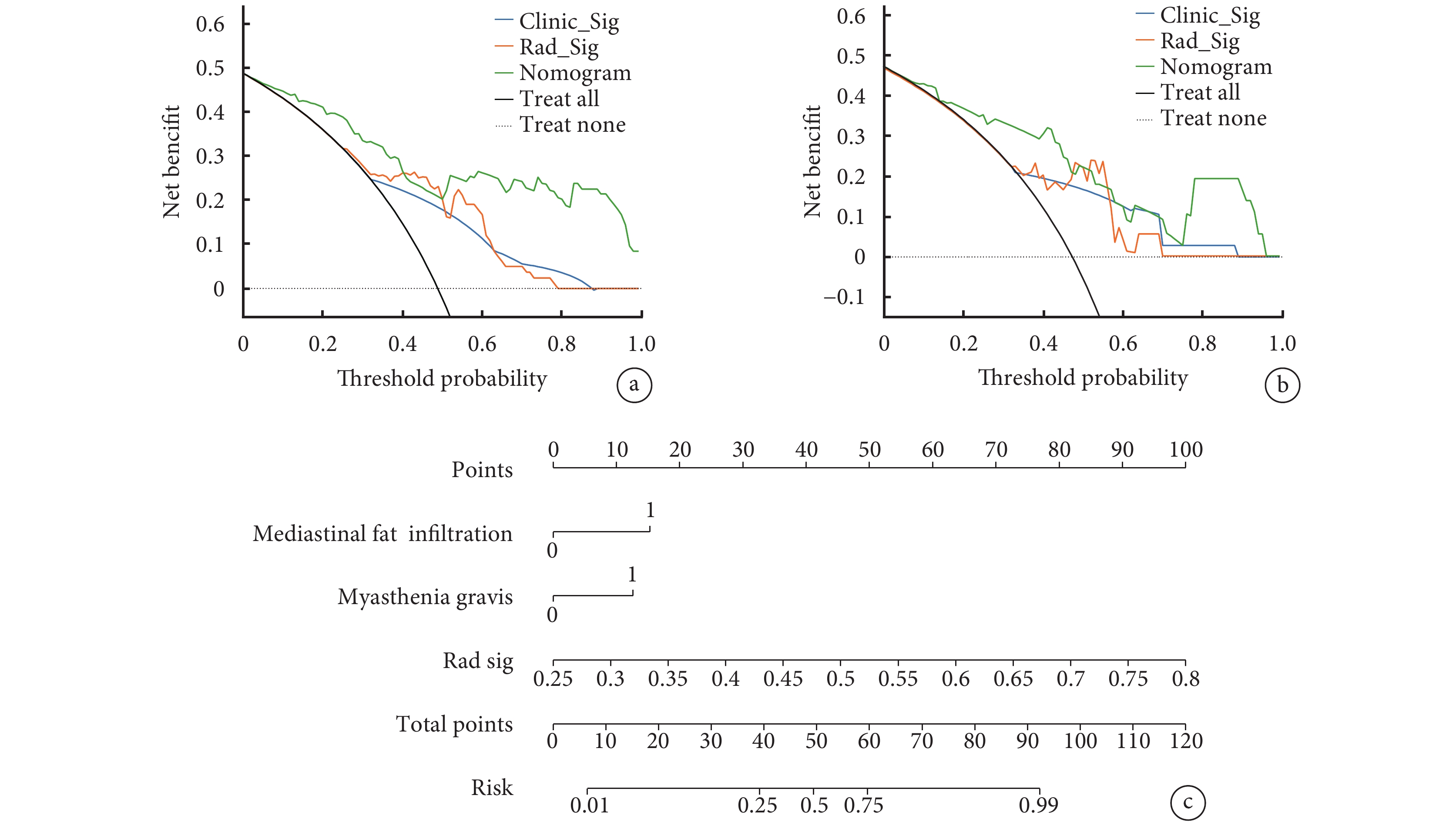
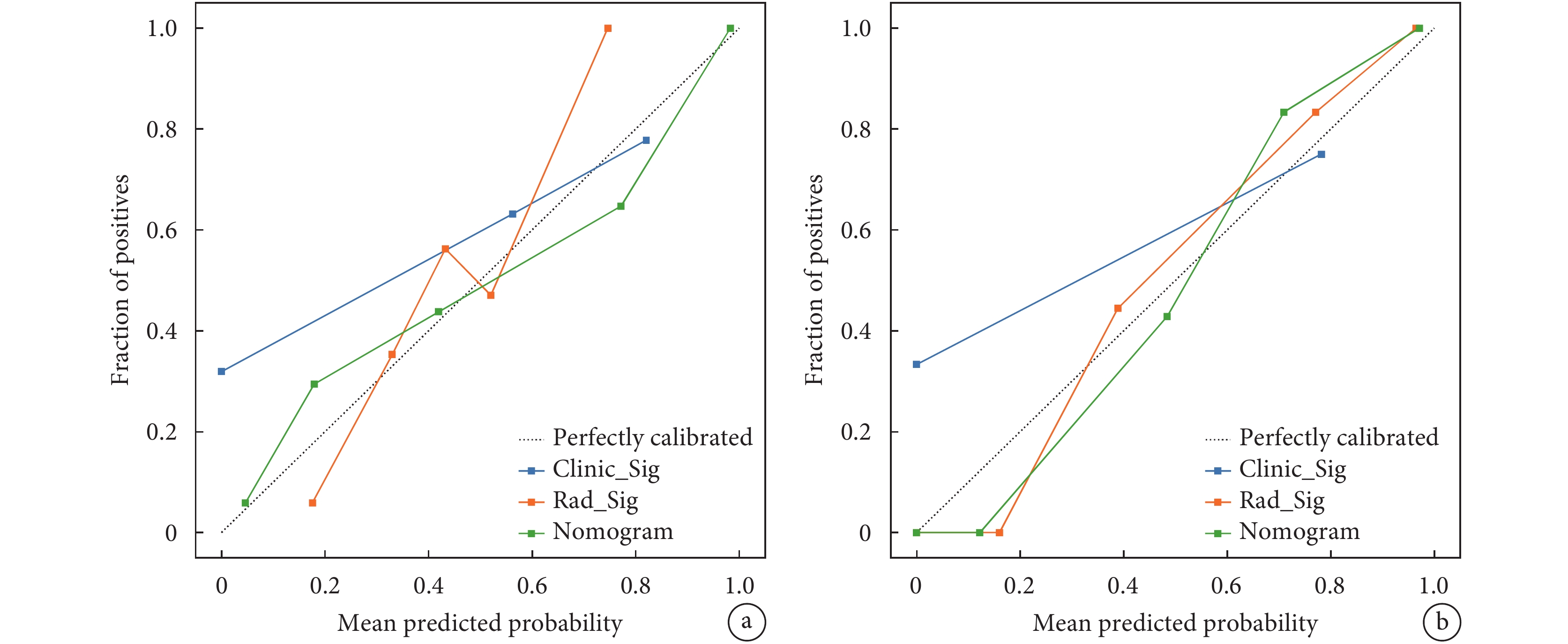
周圍脂肪浸潤和重癥肌無力是預測高低風險胸腺瘤的獨立危險因素,其構成的臨床模型,與影像組學標簽結合,創建了最終的列線圖模型(圖3)。該模型在訓練組和測試組中表現出卓越的鑒別高低風險胸腺瘤的性能。在訓練組中,AUC為0.872[95%CI(0.800,0.944)],敏感度和特異度分別為0.683和0.907。在測試組中,該模型的AUC為0.833[95%CI(0.700,0.965)],敏感度為0.882,特異度為0.737(表4)。這些結果顯著優于臨床模型和影像組學標簽模型的結果(表4)。構建臨床模型、影像組學標簽模型和列線圖的校準曲線(圖4),Hosmer-Lemeshow檢驗顯示3個模型P值分別為0.983 、0.256、0.142,說明構建的模型校準度良好。
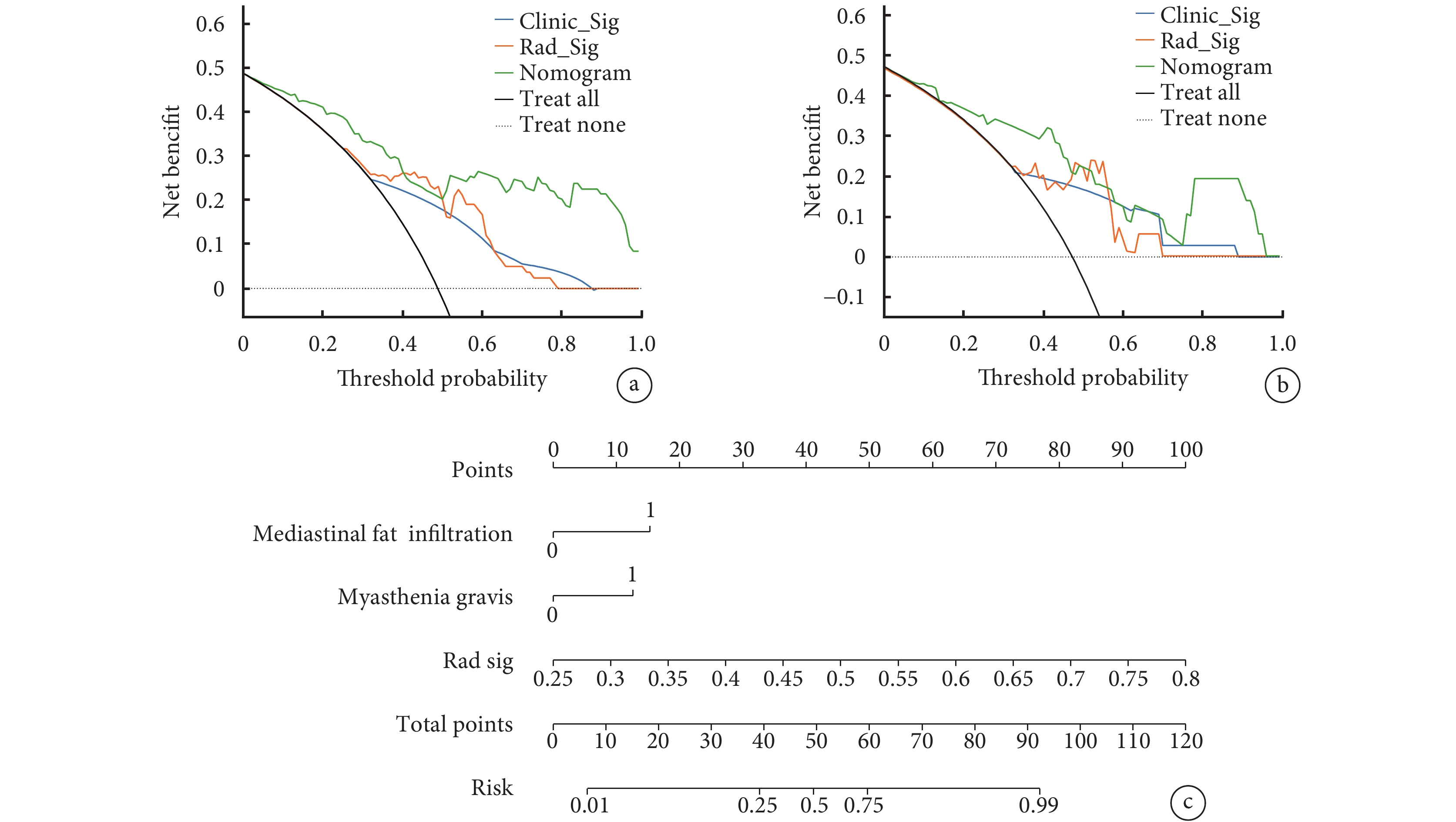 圖3
臨床模型、影像組學標簽模型和列線圖在訓練集和測試集中的決策曲線和列線圖
圖3
臨床模型、影像組學標簽模型和列線圖在訓練集和測試集中的決策曲線和列線圖
a:臨床模型、影像組學標簽模型和列線圖模型在訓練集中的決策曲線;b:臨床模型、影像組學標簽模型和列線圖在測試集中的決策曲線;c:聯合模型鑒別高風險與低風險胸腺瘤的可視化列線圖;Mediastinal fat infiltration :縱隔脂肪浸潤;Myasthenia gravis:重癥肌無力;Rad sig:影像組學標簽
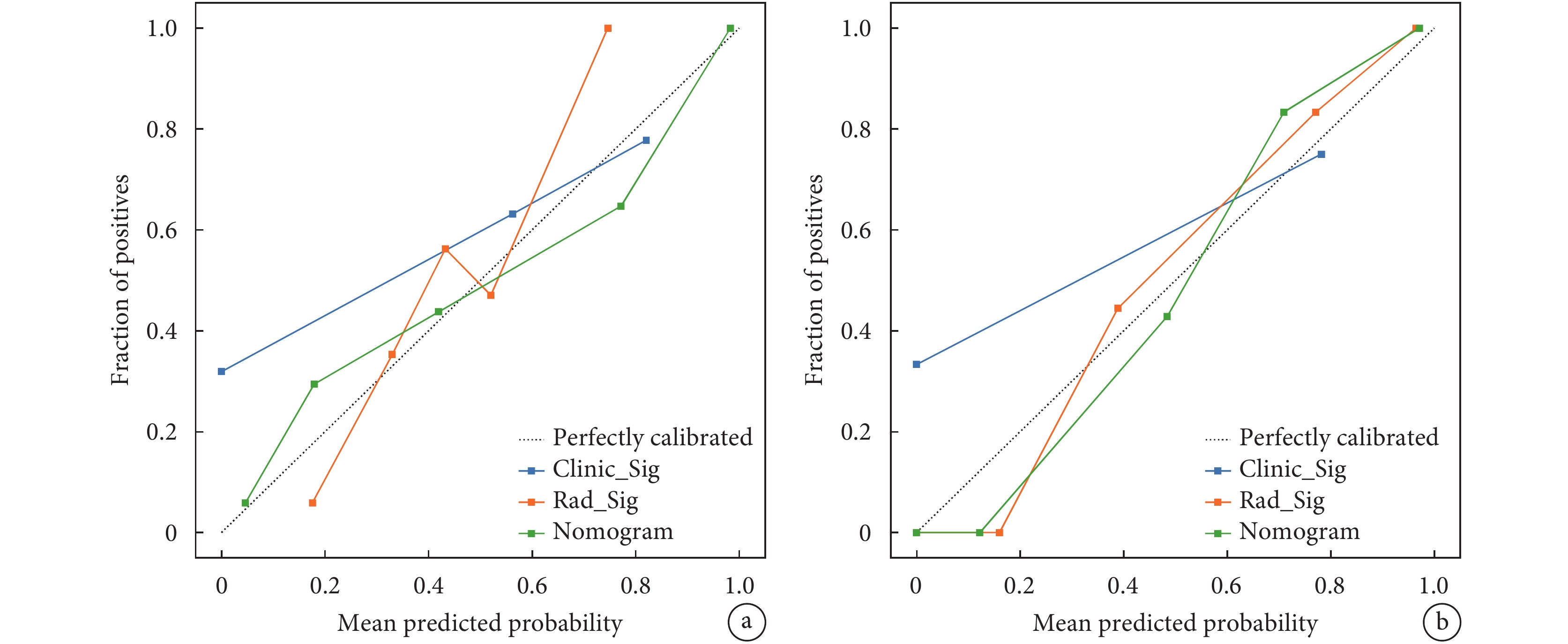 圖4
臨床模型、影像組學標簽模型和列線圖模型在訓練集和測試集中的校準曲線
圖4
臨床模型、影像組學標簽模型和列線圖模型在訓練集和測試集中的校準曲線
a:臨床模型、影像組學標簽模型和列線圖模型在訓練集中的校準曲線;b:臨床模型、影像組學標簽模型和列線圖模型在測試集中的校準曲線
此外, 決策曲線分析顯示,與單獨的臨床模型和單獨的影像組學模型相比,列線圖模型在臨床上具有更高的實用性(圖4)。
3 討論
本研究提出,基于胸部CECT的影像組學模型可以有效區分低風險和高風險胸腺瘤,從而提高臨床模型的診斷性能,因此我們構建了一個包含臨床特征和影像組學標簽特征的列線圖模型,通過這種無創的方法在術前評估胸腺瘤的風險,為下一步治療方案提供了可靠的方法。
炎癥因子雖然可以通過腫瘤微環境促進腫瘤的發生發展,并且可以影響患者的預后,在多個腫瘤中與其不良預后相關[13-14]。但是在多因素logistic回歸分析中炎癥因子并不是獨立的預測因素,在辨別胸腺瘤高低風險中沒有起作用。既往研究[22–24]顯示重癥肌無力最常出現在AB型、B1型和B2型胸腺瘤,可能與抗乙酰膽堿受體抗體有關。周圍脂肪浸潤也作為一種典型的影像學特征,運用在預測胸腺瘤TNM分期、組織學分型,以及鑒別低風險和高風險胸腺瘤分組、胸腺瘤和胸腺癌中 [1]。在我們的研究中,通過多因素logistic回歸分析,周圍脂肪浸潤和重癥肌無力被證明為胸腺瘤高低風險的獨立預測因素,該結果與既往研究一致。不過基于周圍脂肪浸潤和重癥肌無力這兩個臨床因素構建的臨床模型在區分高低風險胸腺瘤中并沒有達到較高的AUC值(訓練組0.707,測試組0.701)。
影像組學最早用應用于胸腺瘤是基于MRI預測胸腺上皮腫瘤病理分類和TNM分期[25-26],由于在實體腫瘤中,MRI與CECT的鑒別能力相當[15],且由于MRI費用昂貴、等待時間較長等缺點,CECT在NCCN 胸腺瘤和胸腺癌臨床實踐指南[9]中被推薦為初始評估縱隔腫物的首選影像學方法。通過基于CT的影像組學特征預測胸腺上皮腫瘤的危險分層[27],TNM分期[28]的研究驗證了CT影像組學的實用性和可靠性。機器學習通過從大量數據中學習如何執行特定任務,并在學習過程中逐漸提升該任務的執行表現,最終產生可以順利執行該任務的計算機算法,包含深度學習和機器學習算法,已經應用于區分前縱隔囊腫和胸腺瘤[29],或鑒別胸腺上皮腫瘤的風險分層[29-30]。但由于胸腺瘤和胸腺癌差別較大,應該分開比較,而不是將胸腺癌歸為高風險胸腺瘤進行比較。有些研究雖分開比較,但由于發病率低或者有些胸腺癌患者沒有手術機會,導致符合納入條件的胸腺癌患者過少,而與胸腺瘤患者例數不匹配,而且機器學習模型在訓練組和測試組的表現有時差距較大,這都對臨床應用構成了挑戰。在這項研究中,我們基于CECT影像組學分析,比較了6種不同的機器學習模型在辨別高低風險胸腺瘤分組的性能。綜合其他指標,雖然LightGBM的診斷價值略高于ExtraTrees,但在測試組中發現ExtraTrees更穩定。機器學習分類器的穩定性對其模型構建和臨床應用非常重要[31]。因此,選擇ExtraTrees構建影像組學模型和臨床模型。結合影像組學標簽和臨床特征的列線圖明顯優于影像組學特征模型和臨床模型。本研究表明,列線圖可用于辨別胸腺瘤風險程度。準確的術前鑒別診斷有助于決定手術方式及切除范圍,我們構建的列線圖模型,可以大大提高診斷的準確性,優化手術工作量,并減少不必要的MRI或正電子發射斷層掃描(PET/CT)檢測所需的時間和成本,并且可以避免任何途徑的術前活檢。
然而,我們的研究仍存在一些不足。首先,這是一項在單中心進行的回顧性研究,需要在更大的隊列中進行外部多中心驗證我們模型的普適性。其次,ROI的勾畫采用全手工,不能避免主觀因素的影響,在未來的研究中可以通過開發半自動或者自動分割來避免。第三,由于疾病的發病率較低,我們的研究病例較少,未來的研究需要納入多個中心和更大樣本量,以完善我們的模型。
綜上,本研究構建并驗證了一種基于CECT,結合臨床和影像學特征,用于區分高低風險胸腺瘤的列線圖預測模型,影像學特征可以作為術前非侵入性的生物標志物來預測這些疾病。然而,需要注意的是,使用影像組學作為臨床生物標志物仍在研究中,需要進一步研究才能有效應用于臨床實踐中。希望將來我們構建的預測模型可以幫助醫生做出精準的臨床決策,改善患者預后。
利益沖突:無。
作者貢獻:任清林主要負責論文設計,初稿撰寫、審閱與修改;何文博、岳佳瑞負責論文審閱與修改;肖洪壁負責論文審閱;束余聲主要負責論文設計、審閱。
胸腺瘤是一種胸腺上皮性腫瘤[1] ,在前縱隔腫物中最常見。世界衛生組織(World Health Organization,WHO)根據腫瘤上皮細胞形態及淋巴細胞-上皮細胞比值將胸腺瘤分為5種亞型[2–4],分別為A、AB、B1、B2和 B3型[2];又根據惡性程度,將這5種亞型分為低危(A、AB和 B1型)和高危(B2和 B3型)[3-4]。兩者的預后不同,治療方案也有差異。低危胸腺瘤可以在Ⅲ期完整切除而無需進一步治療,而高危胸腺瘤則需要全面的治療,包括化療、放療和手術治療等[5-6],胸腺瘤的高低風險分組在手術方式、手術切除范圍、患者預后和治療決策中起重要作用。所以術前精準區分高低風險胸腺瘤可以決定術前術后的治療方案,對患者的遠期預后十分重要[7-8],穿刺活檢是術前診斷的金標準之一,但由于有創,取活檢的組織不能代表整個腫瘤組織,并且有腫瘤種植的風險,故美國國家綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)腫瘤學臨床實踐指南[9]指示應避免經胸腔活檢。開發一種高效、無創鑒別高低風險胸腺瘤的檢查方式十分必要[10]。
炎癥因子有幫助惡性細胞生存、增殖,促進血管生成和轉移,還可以通過腫瘤微環境促進癌癥發生發展的作用[11-12],已經在多個腫瘤中發現其與腫瘤的不良預后有關[13-14]。胸部增強CT(contrast-enhanced CT,CECT)是胸腺腫瘤影像學評估的標準檢查[9],在前縱隔腫物(囊性病變除外)診斷方面與磁共振成像(magnetic resonance imaging,MRI)相當或更優[15]。在早期的研究[16-18]中,內部密度和周圍脂肪浸潤等影像學特征已經運用到預測胸腺瘤亞型中,不過醫生的主觀評價可能會對影像特征預測的結果有影響,通過客觀的方法去提取影像組學特征并且加以分析是一種新的解決辦法。
影像組學是一個新興且前景廣闊的領域,通過高通量的圖像特征提取和挖掘,提供了腫瘤類型的全面定量分析[19],基于影像組學的機器學習模型已經應用于許多疾病的診斷和預后,包括胸腺瘤[20-21]。這些研究表明,影像組學可以幫助我們解決臨床問題,優化治療方案。因此,我們的目標是開發和驗證一種基于胸部CECT的影像組學列線圖,結合臨床獨立危險因素和影像組學特征,用于術前區分胸腺瘤風險程度。
1 資料與方法
1.1 臨床資料和分組
回顧性分析2018年1月—2023年2月在我院行手術切除并經病理證實胸腺瘤患者的臨床資料。 納入標準:(1)胸腺瘤的病理診斷基于活檢或手術病理;(2)術前或活檢前經過胸部CECT掃描;(3)患者的臨床病歷資料齊全;(4)無放療、化療史,無其他惡性腫瘤病史。排除標準:由于人工或其他原因導致的圖像質量差。
采用2015年WHO組織學分類標準確定病理亞分類,將胸腺瘤分為低危和高危。根據混合物中惡性程度的高低確定病理分型,如B1/B2胸腺瘤被歸為B2型。將所有病例按照7∶3的比例隨機分為訓練組和測試組。
1.2 臨床信息
納入的臨床特征為年齡、性別、吸煙、重癥肌無力和炎癥因子。重癥肌無力的納入標準為首次發現,未經激素治療,并且癥狀存在于胸部CECT掃描之前。在腫瘤切除或活檢前1周的常規檢查中測定血清白細胞、中性粒細胞、單核細胞、血小板、白蛋白和淋巴細胞計數。我院檢驗科進行數據分析。中性粒細胞、單核細胞和血小板計數除以淋巴細胞計數分別計算出中性粒細胞與淋巴細胞比率(neutrophil-to-lymphocyte ratio,NLR)、單核細胞與淋巴細胞比率(monocyte-to-lymphocyte ratio,MLR)和血小板與淋巴細胞比率(platelet-to-lymphocyte ratio,PLR)。
1.3 CT的基本信息
所有患者在術前或者穿刺活檢前經胸部CECT掃描。采用兩個不同的CT掃描儀:Discovery CT750 HD (GE MEDICAL SYSTEMS)和 Aquilion ONE (TOSHIBA)。掃描參數如下:Discovery CT750 HD:管電壓120 kV,管電流425 mA, 層厚5 mm,節距0.984;Aquilion ONE:管電壓120 kV,管電流200 mA,層厚5 mm,節距0.828。所有患者均采用仰臥位檢查,雙臂向上,深吸氣,掃描。通過前臂靜脈快速注入造影劑,造影劑包括碘丙胺和碘己醇,增強階段延遲60 s。
影像特征評價:輪廓(光滑或不光滑),內部密度(均勻或非均勻),鈣化(有或無),周圍脂肪浸潤(有或無);周圍組織侵犯(有或無);通過3D-slicer軟件(
1.4 腫瘤分割
每例患者的感興趣區(region of interest,ROI)都是由有7年經驗的影像科醫生使用3D-slicer 軟件(version 5.3.0,
 圖1
模型構建流程圖
圖1
模型構建流程圖
ROI:感興趣區;
1.5 影像特征提取和選擇
在執行特征提取之前,圖像被重新采樣,大小為1 mm×1 mm×1 mm。使用PyRadiomics,一個專門用于從醫學圖像中提取影像組學特征的開源Python程序(版本3.0.1,
1.6 影像特征模型的建立
通過機器學習算法旨在訓練出識別高危組和低危組胸腺瘤最準確的機器學習模型。采用6種不同的機器學習分類器用于訓練:邏輯回歸(logistic regression,LR),支持向量機(support vector machine,SVM),隨機森林(random forest),極端隨機樹(extremely randomized trees,ExtraTrees),極限梯度提升(extreme gradient boosting,XGBoost)和輕量級梯度提升機(light gradient boosting machine,LightGBM)。使用曲線下面積(area under the curve,AUC)、準確率、敏感度、特異度、陽性預測值和陰性預測值來評估這6種機器學習的診斷能力。通過比較這些性能指標,評估和比較各種機器學習算法在研究中的診斷能力。其中最佳算法將篩選出的影像組學特征構建1個影像組學標簽。
1.7 臨床模型和列線圖的構建
對性別、年齡、吸煙史、重癥肌無力、白細胞、中性粒細胞、淋巴細胞、單核細胞、血小板、白蛋白、NLR、MLR、PLR、腫瘤內部密度、輪廓是否光滑、有無鈣化、有無脂肪浸潤、腫瘤最大直徑、腫瘤體積等臨床特征和影像學特征進行了單因素和多因素logistic回歸分析,篩選區別高低危胸腺瘤的獨立預測因子,據此開發出臨床模型。構建1個綜合影像組學標簽與臨床特征的列線圖模型。對訓練組和測試組使用AUC、準確性、敏感性、特異性、陽性預測值和陰性預測值來評估和驗證模型的性能,并評估模型的一致性和臨床實用性。
1.8 統計學分析
使用Python軟件(版本3.7.12,
1.9 倫理審查
本研究經蘇北人民醫院醫學倫理委員會批準,免除知情同意要求。倫理審查編號:2021ky010-1。
2 結果
2.1 基線資料
最終共納入120例患者,其中女59例、男61例,平均年齡(56.30±12.10)歲。訓練組84例,測試組36例。高危胸腺瘤患者58例,低危胸腺瘤患者62例。訓練組中,高危和低危胸腺瘤患者重癥肌無力、縱隔脂肪浸潤差異有統計學意義(P<0.05)。測試組中,高危和低危胸腺瘤患者白細胞計數、中性粒細胞計數和NLR差異有統計學意義(P<0.05);見表1。經過單因素和多因素logistic回歸分析,結果顯示周圍脂肪浸潤和重癥肌無力是區分高低風險胸腺瘤的獨立危險因素(表2),以此構建臨床模型。
 /例(%)]
/例(%)]
2.2 影像組學特征分析及特征篩選
通過PyRadiomics提取ROI中的影像組學特征,共提取出
 圖2
LASSO 回歸模型中采用 10折交叉驗證選擇最佳調優參數以及納入模型的影像組學特征
圖2
LASSO 回歸模型中采用 10折交叉驗證選擇最佳調優參數以及納入模型的影像組學特征
a:均方誤差圖;b:回歸系數圖;c:最佳特征集合
2.3 影像組學模型及其表現
隨機森林模型在訓練組中表現最好,AUC達0.873,準確率為0.786,敏感度為0.829,特異度為0.744,陽性預測值和陰性預測值分別為0.756和0.821。然而,在測試組中,ExtraTrees成為最好的影像組學模型,AUC、準確率、敏感度、特異度、陽性預測值和陰性預測值分別為0.802、0.806、0.765、0.842、0.812和0.800;見表3。隨機森林模型在訓練組和測試組中表現出過擬合的趨勢。因此,我們認為ExtraTrees是理想的影像組學模型,具有可持續性和穩定性。同一機器學習算法也運用到臨床模型的構建。
2.4 列線圖的建立
周圍脂肪浸潤和重癥肌無力是預測高低風險胸腺瘤的獨立危險因素,其構成的臨床模型,與影像組學標簽結合,創建了最終的列線圖模型(圖3)。該模型在訓練組和測試組中表現出卓越的鑒別高低風險胸腺瘤的性能。在訓練組中,AUC為0.872[95%CI(0.800,0.944)],敏感度和特異度分別為0.683和0.907。在測試組中,該模型的AUC為0.833[95%CI(0.700,0.965)],敏感度為0.882,特異度為0.737(表4)。這些結果顯著優于臨床模型和影像組學標簽模型的結果(表4)。構建臨床模型、影像組學標簽模型和列線圖的校準曲線(圖4),Hosmer-Lemeshow檢驗顯示3個模型P值分別為0.983 、0.256、0.142,說明構建的模型校準度良好。
 圖3
臨床模型、影像組學標簽模型和列線圖在訓練集和測試集中的決策曲線和列線圖
圖3
臨床模型、影像組學標簽模型和列線圖在訓練集和測試集中的決策曲線和列線圖
a:臨床模型、影像組學標簽模型和列線圖模型在訓練集中的決策曲線;b:臨床模型、影像組學標簽模型和列線圖在測試集中的決策曲線;c:聯合模型鑒別高風險與低風險胸腺瘤的可視化列線圖;Mediastinal fat infiltration :縱隔脂肪浸潤;Myasthenia gravis:重癥肌無力;Rad sig:影像組學標簽
 圖4
臨床模型、影像組學標簽模型和列線圖模型在訓練集和測試集中的校準曲線
圖4
臨床模型、影像組學標簽模型和列線圖模型在訓練集和測試集中的校準曲線
a:臨床模型、影像組學標簽模型和列線圖模型在訓練集中的校準曲線;b:臨床模型、影像組學標簽模型和列線圖模型在測試集中的校準曲線
此外, 決策曲線分析顯示,與單獨的臨床模型和單獨的影像組學模型相比,列線圖模型在臨床上具有更高的實用性(圖4)。
3 討論
本研究提出,基于胸部CECT的影像組學模型可以有效區分低風險和高風險胸腺瘤,從而提高臨床模型的診斷性能,因此我們構建了一個包含臨床特征和影像組學標簽特征的列線圖模型,通過這種無創的方法在術前評估胸腺瘤的風險,為下一步治療方案提供了可靠的方法。
炎癥因子雖然可以通過腫瘤微環境促進腫瘤的發生發展,并且可以影響患者的預后,在多個腫瘤中與其不良預后相關[13-14]。但是在多因素logistic回歸分析中炎癥因子并不是獨立的預測因素,在辨別胸腺瘤高低風險中沒有起作用。既往研究[22–24]顯示重癥肌無力最常出現在AB型、B1型和B2型胸腺瘤,可能與抗乙酰膽堿受體抗體有關。周圍脂肪浸潤也作為一種典型的影像學特征,運用在預測胸腺瘤TNM分期、組織學分型,以及鑒別低風險和高風險胸腺瘤分組、胸腺瘤和胸腺癌中 [1]。在我們的研究中,通過多因素logistic回歸分析,周圍脂肪浸潤和重癥肌無力被證明為胸腺瘤高低風險的獨立預測因素,該結果與既往研究一致。不過基于周圍脂肪浸潤和重癥肌無力這兩個臨床因素構建的臨床模型在區分高低風險胸腺瘤中并沒有達到較高的AUC值(訓練組0.707,測試組0.701)。
影像組學最早用應用于胸腺瘤是基于MRI預測胸腺上皮腫瘤病理分類和TNM分期[25-26],由于在實體腫瘤中,MRI與CECT的鑒別能力相當[15],且由于MRI費用昂貴、等待時間較長等缺點,CECT在NCCN 胸腺瘤和胸腺癌臨床實踐指南[9]中被推薦為初始評估縱隔腫物的首選影像學方法。通過基于CT的影像組學特征預測胸腺上皮腫瘤的危險分層[27],TNM分期[28]的研究驗證了CT影像組學的實用性和可靠性。機器學習通過從大量數據中學習如何執行特定任務,并在學習過程中逐漸提升該任務的執行表現,最終產生可以順利執行該任務的計算機算法,包含深度學習和機器學習算法,已經應用于區分前縱隔囊腫和胸腺瘤[29],或鑒別胸腺上皮腫瘤的風險分層[29-30]。但由于胸腺瘤和胸腺癌差別較大,應該分開比較,而不是將胸腺癌歸為高風險胸腺瘤進行比較。有些研究雖分開比較,但由于發病率低或者有些胸腺癌患者沒有手術機會,導致符合納入條件的胸腺癌患者過少,而與胸腺瘤患者例數不匹配,而且機器學習模型在訓練組和測試組的表現有時差距較大,這都對臨床應用構成了挑戰。在這項研究中,我們基于CECT影像組學分析,比較了6種不同的機器學習模型在辨別高低風險胸腺瘤分組的性能。綜合其他指標,雖然LightGBM的診斷價值略高于ExtraTrees,但在測試組中發現ExtraTrees更穩定。機器學習分類器的穩定性對其模型構建和臨床應用非常重要[31]。因此,選擇ExtraTrees構建影像組學模型和臨床模型。結合影像組學標簽和臨床特征的列線圖明顯優于影像組學特征模型和臨床模型。本研究表明,列線圖可用于辨別胸腺瘤風險程度。準確的術前鑒別診斷有助于決定手術方式及切除范圍,我們構建的列線圖模型,可以大大提高診斷的準確性,優化手術工作量,并減少不必要的MRI或正電子發射斷層掃描(PET/CT)檢測所需的時間和成本,并且可以避免任何途徑的術前活檢。
然而,我們的研究仍存在一些不足。首先,這是一項在單中心進行的回顧性研究,需要在更大的隊列中進行外部多中心驗證我們模型的普適性。其次,ROI的勾畫采用全手工,不能避免主觀因素的影響,在未來的研究中可以通過開發半自動或者自動分割來避免。第三,由于疾病的發病率較低,我們的研究病例較少,未來的研究需要納入多個中心和更大樣本量,以完善我們的模型。
綜上,本研究構建并驗證了一種基于CECT,結合臨床和影像學特征,用于區分高低風險胸腺瘤的列線圖預測模型,影像學特征可以作為術前非侵入性的生物標志物來預測這些疾病。然而,需要注意的是,使用影像組學作為臨床生物標志物仍在研究中,需要進一步研究才能有效應用于臨床實踐中。希望將來我們構建的預測模型可以幫助醫生做出精準的臨床決策,改善患者預后。
利益沖突:無。
作者貢獻:任清林主要負責論文設計,初稿撰寫、審閱與修改;何文博、岳佳瑞負責論文審閱與修改;肖洪壁負責論文審閱;束余聲主要負責論文設計、審閱。