引用本文: 韓林江, 劉湘, 馬堅銳, 周子秦, 涂賈子超, 張如月, 田苗, 李瑩, 袁海云, 溫樹生, 陳寄梅. 全腔靜脈-肺動脈連接術治療功能性單心室合并內臟異位綜合征的傾向性評分匹配研究. 中國胸心血管外科臨床雜志, 2024, 31(4): 510-518. doi: 10.7507/1007-4848.202310032 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
功能性單心室(functional single ventricle,FSV)是一類解剖結構復雜的先天性心臟病,手術治療的挑戰性極大,通常無法完成雙心室修復,全腔靜脈-肺動脈連接術(total cavopulmonary connection,TCPC)成為多數患者的最終治療手段[1]。FSV合并內臟異位綜合征(heterotaxy syndrome,HS)患者常并發廣泛的心內和心外解剖異常,包括共同房室瓣、體靜脈或肺靜脈異常引流、無脾和纖毛運動障礙等[2-3]。盡管手術和圍術期管理水平明顯提高,這類患者在各期姑息手術或等待完成TCPC手術期間的死亡率和發病率仍較高,整體生存情況較差[4-5]。傳統上,合并HS被認為是影響TCPC術后生存的危險因素[6-9]。但近年來一些研究[10-12]也指出,合并HS患者TCPC術后的遠期生存情況與非HS患者無異。目前觀點對于合并HS是否影響TCPC術后結局存在分歧,本研究通過回顧性分析本中心合并HS的FSV患者資料,并與匹配的同手術時期非HS患者進行比較,總結本中心的手術經驗及結果。
1 資料與方法
1.1 臨床資料和分組
回顧性分析2004—2021年在本中心診斷為FSV合并HS患者(HS組)的臨床資料。納入標準:(1)行單心室矯治;(2)完成TCPC手術。診斷根據患者術前超聲心動圖、心導管造影和增強CT報告并且術中探查證實,或術中探查發現對稱心房結構,本研究的形態學納入標準依據Jacobs等[2]報道的命名和分類方案,雙側心房表現為右心耳結構者為右房異構,常合并無脾,雙側支氣管和肺組織均為右肺結構;左房異構特征為雙側左心耳結構,多合并多脾,雙側支氣管和肺組織均為左肺結構。納入同時期非HS患者作為非HS組。
1.2 研究變量定義
早期死亡定義為術后30 d內發生死亡。術后感染依據國家衛生部制定的《醫院感染診斷標準(試行)》[13]進行診斷,根據患者臨床癥狀(咳痰、濕啰音等)、影像學陽性結果、感染指標(發熱、白細胞計數、降鈣素、C反應蛋白等)、病原學送檢結果、抗菌藥使用情況等綜合判定。肝功能損害的判定按照世界衛生組織發布的常見不良反應術語評定標準(CTCAE)6.0版,考慮到TCPC術后下腔靜脈壓力升高,患者普遍存在肝功酶升高,將術后轉氨酶超出正常上限值3倍以上判斷為肝功能損害。符合以下情形之一可診斷為急性腎損傷:(1)48 h內血清肌酐上升至0.3 mg/dL(≥26.5 μmol/L);(2)已知或假定腎功能損傷發生在1周內,血清肌酐上升超過基礎值的1.5倍;(3)尿量持續6 h低于0.5 mL/(kg?h)[14]。
1.3 手術方法
TCPC手術類型包括:(1)心外管道:離斷下腔靜脈,縫閉近心端,用Gore-Tex管道連接下腔靜脈和主肺動脈;合并開口靠近下腔靜脈開口的肝靜脈單獨回流入心房(separate hepatic venous drainage,SHVD),離斷包含肝靜脈開口和下腔靜脈開口的心房組織,近心端縫閉,遠心端的肝靜脈和下腔靜脈與Gore-Tex 管道端端吻合。(2)心內-心外管道:心尖和下腔靜脈位于同側者,將Gore-Tex管道一端剪成斜口,與下腔靜脈開口吻合,另一端自右心房切口穿出心房并與肺動脈吻合,心房切口邊緣與Gore-Tex管道外壁包繞縫合,需要開窗者,直接在管道心內段進行打孔即可;合并開口距離下腔靜脈開口較遠的SHVD,取合適大小的Gore-Tex管道,將一端開口剪成寬大的裙邊狀,同時覆蓋肝靜脈開口與下腔靜脈開口,另一端穿出心房與肺動脈下緣端側吻合。(3)主肺動脈-下腔靜脈直接吻合:肺動脈發育好且靠近下腔靜脈,充分游離肺動脈直接下拉與下腔靜脈吻合。
1.4 隨訪
術后早期存活患者在出院后第1個月、3個月、6個月、12個月門診隨訪復查,而后每年門診規律隨訪,隨訪內容主要包括患者主觀癥狀、運動耐量、生長發育情況,復查超聲心動圖、心電圖、凝血功能,必要時完善心臟增強CT或者磁共振成像。根據電子病歷系統記錄的最新門診和住院信息或通過電話隨訪確定與時間相關的結局。
1.5 統計學分析
采用SPSS 25.0(IBM)統計軟件進行數據分析。符合正態分布的計量資料采用均數±標準差(x±s)描述,非正態分布則采用中位數(上下四分位數)[M(P25,P75)]描述,計數資料以頻數和百分比[n(%)]描述。計量資料的組間比較采用t檢驗或Mann-Whitney U檢驗。計數資料的組間比較采用χ2檢驗或Fisher確切概率法。對影響術后死亡的可能因素進行單因素分析,P≤0.1則納入多因素Cox回歸分析。采用1∶2傾向性評分匹配法匹配兩組患者,匹配變量包括年齡、性別、體重、體表面積、Nakata指數、優勢心室形態、是否一期完成TCPC、TCPC類型、是否開窗、是否合并中度及以上的房室瓣反流、是否同期行完全性肺靜脈異位引流或肺靜脈回流梗阻矯治和房室瓣整形或置換術。Kaplan-Meier法計算累計生存率,log-rank檢驗比較不同組間生存差異。P≤0.05為差異有統計學意義。
1.6 倫理審查
本研究已通過廣東省人民醫院(廣東省醫學科學院)醫學研究倫理委員會審批,倫理批號:KY-Q-2021-109-04。
2 結果
2.1 TCPC手術情況
傾向性評分匹配前,HS組納入患者55例,其中男42例、女13例,手術時中位年齡為6.0(4.2,11.8)歲,中位體重為17.0(14.2,28.8)kg,術前血氧飽和度81.5%±5.0%,Nakata指數252.9(170.1,320.6)。53例為右房異構,14例合并無脾,2例為左房異構。38例患者存在完全性房室間隔缺損,7例患者存在右室雙出口,18例合并大動脈轉位。術前8例患者存在中度及以上的房室瓣反流,2例存在肺靜脈回流梗阻;見表1。45例患者術前心導管檢查肺動脈壓力資料可獲得,平均肺動脈壓(mPAP)為15.0(11.0,17.0)mm Hg(1 mm Hg=0.133 kPa),3例存在輕度肺動脈高壓(26~31 mm Hg)。
 /例(%)/M(P25,P75)]
/例(%)/M(P25,P75)]
HS組55例患者中8例一期完成TCPC,分期手術是主要的治療策略,既往手術包括體-肺分流2例、肺動脈環縮3例、肺動脈成形1例、完全性肺靜脈異位引流矯治7例、房室瓣整形或置換14例和雙向Glenn手術47例。TCPC手術類型包括心外管道39例、心內-心外管道14例、主肺動脈-下腔靜脈直接吻合2例、管道開窗32例。同期手術包括房室瓣整形或置換8例、完全性肺靜脈異位引流或肺靜脈回流梗阻矯治3例、肺動脈成形3例。
HS組55例患者中位體外循環時間為153.0(105.0,193.0)min,中位主動脈阻斷時間為70.0(13.0,101.0)min。術后中位機械通氣時間為15.5(6.3,64.0)h,中位ICU停留時間為4.5(2.5,6.7)d。術后27例發生感染,其中肺部感染16例,19例出現肝功能損害,11例出現急性腎損傷,心律失常5例。術后結果和并發癥發生情況見表2。傾向性評分匹配后HS組45例,非HS組81例。HS組手術時間、機械通氣時間長于非HS組,術后感染率顯著高于非HS組(P<0.05)。兩組在體外循環時間、ICU停留時間、非計劃再手術率、并發癥發生率、術后住院時間、術后早期死亡等方面差異無統計學意義(P>0.05);見表3。
2.2 再手術
HS組55例患者術后早期非計劃再手術5例,3例為開胸探查止血,1例無法耐受Fontan循環行TCPC拆除,1例術后嚴重低氧血癥再次手術探查行左下腔靜脈結扎。4例患者隨訪期間需要再次手術干預。早期術后存活患者1年免于再手術率為94.0%,5年為92.0%。1例術后52個月為改善血氧飽和度和預防癲癇發作行經皮心導管介入外管道留孔封堵,1例術后6個月因降主動脈-肺動脈側枝形成行主肺側枝封堵,1例術后11個月因重度房室瓣反流行房室瓣置換,1例術后第56 d因Ⅲ度房室傳導阻滯藥物治療效果差行永久性起搏器置入術。4例再手術患者隨訪過程中,1例死亡,1例術后第6年失訪,2例仍在隨訪中。
2.3 死亡
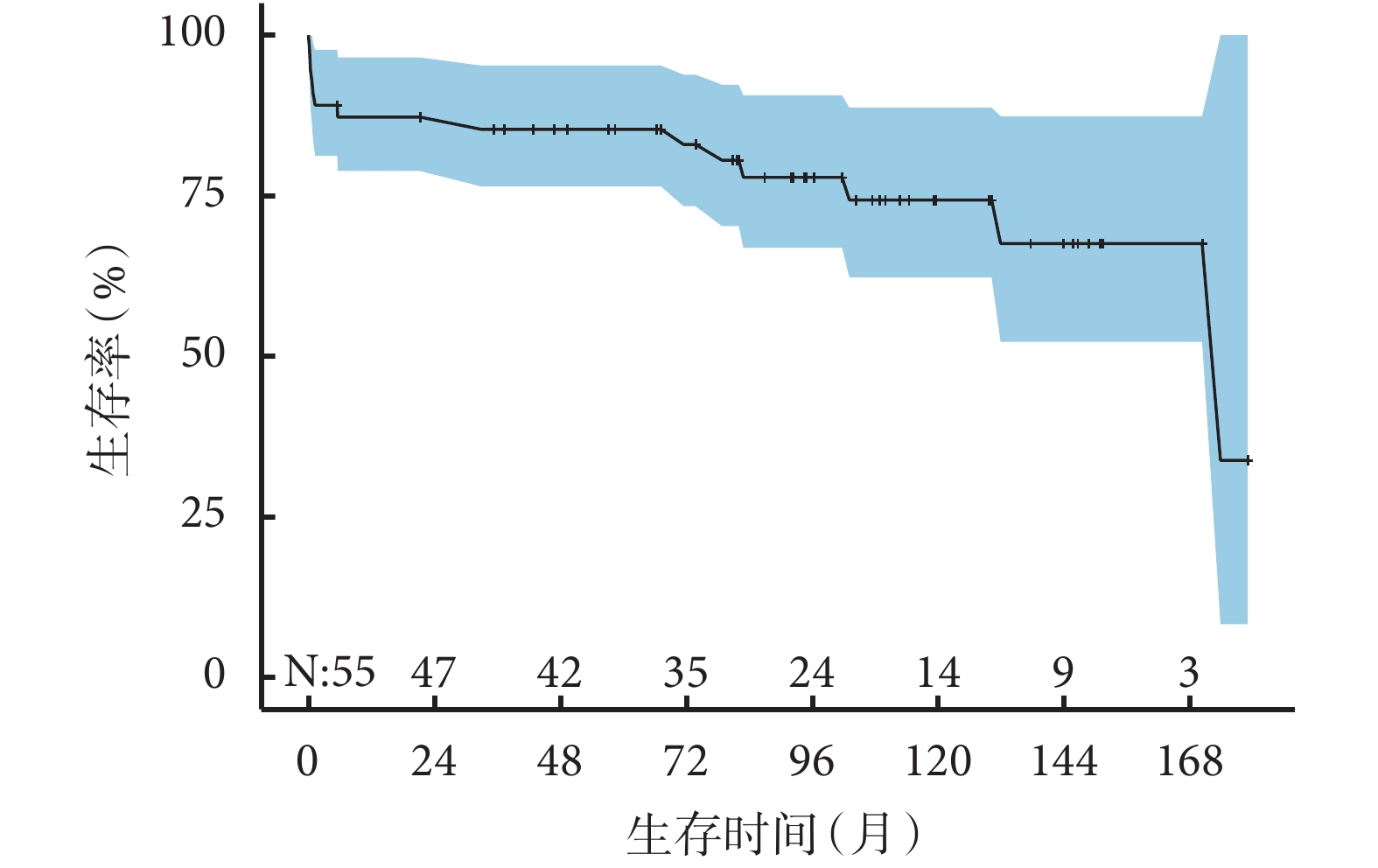
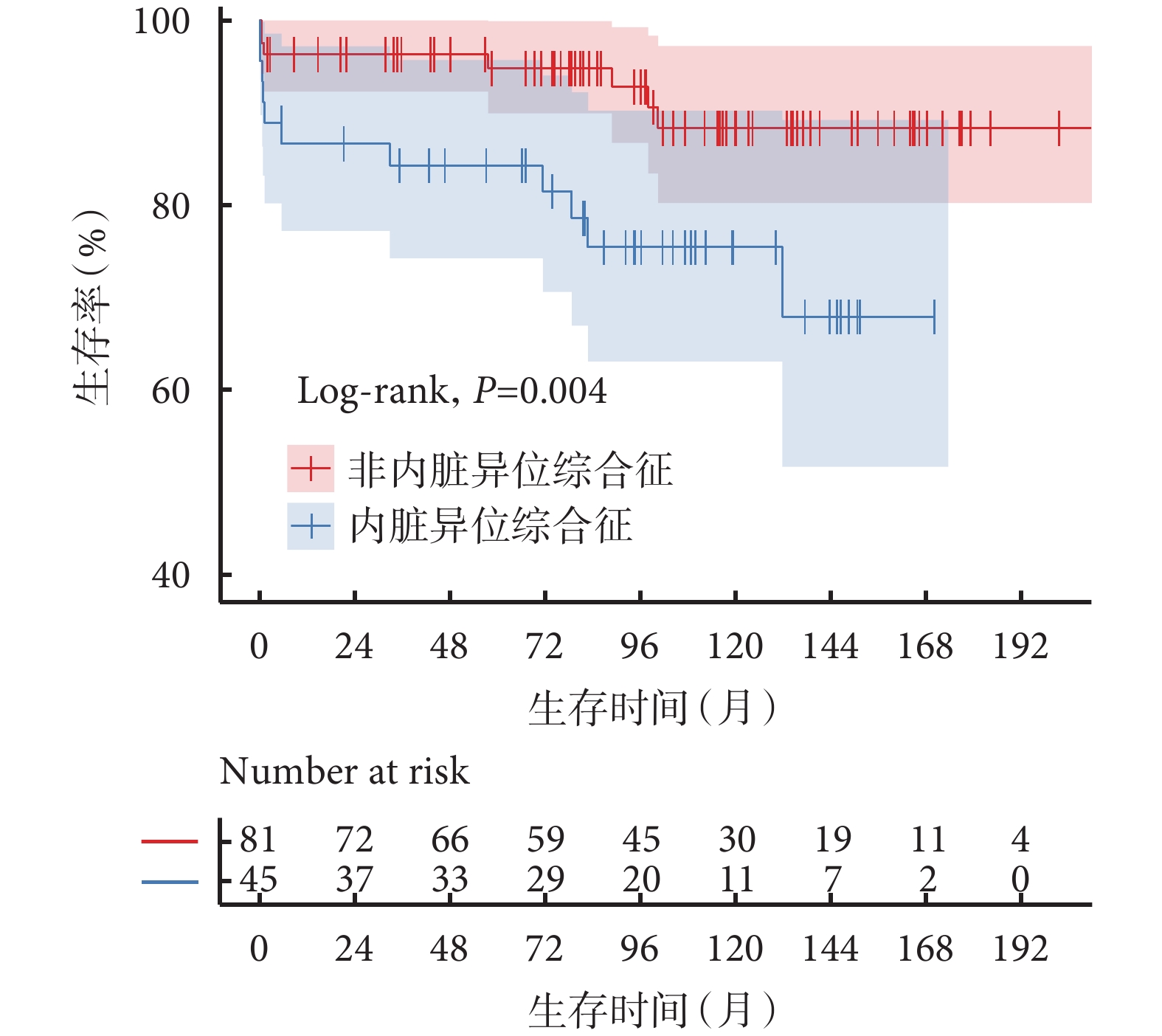
HS組55例患者中,6例患者分別在隨訪的第5.5、21.3、37.3、73.8、104.3、170.3個月失訪。術后5例(9.1%)患者發生早期死亡,存活患者隨訪1.3~179.0個月,中位隨訪時間94.7(64.3,129.8)個月,9例患者在隨訪過程中死亡,估計總生存率1年為87.2%±5.2%,5年為85.3%±5.6%,10年為74.3%±9.0%;見圖1。所有死亡患者資料見表4。與同時期非HS的FSV相比,合并HS的FSV患者總生存率顯著下降(P=0.004),1年生存率為86.6%、96.3%,5年生存率84.3%、94.8%,10年生存率75.4%、88.3%;見圖2。多因素Cox回歸分析提示:無脾[HR=8.98,95%CI(1.86,43.34),P=0.006]是影響患者總體生存的獨立危險因素;見表5。
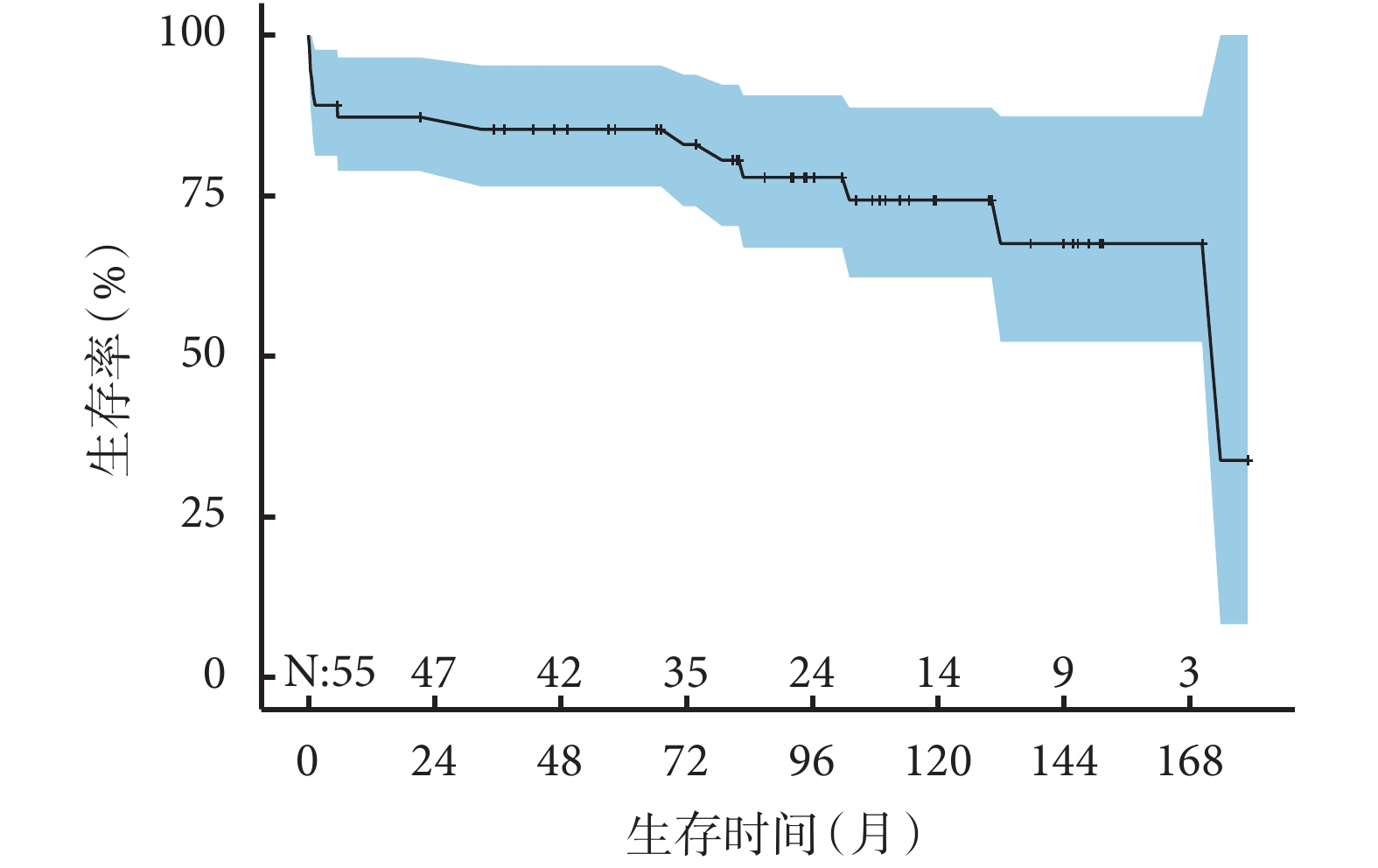 圖1
功能性單心室合并內臟異位綜合征患者的Kaplan-Meier曲線
圖1
功能性單心室合并內臟異位綜合征患者的Kaplan-Meier曲線
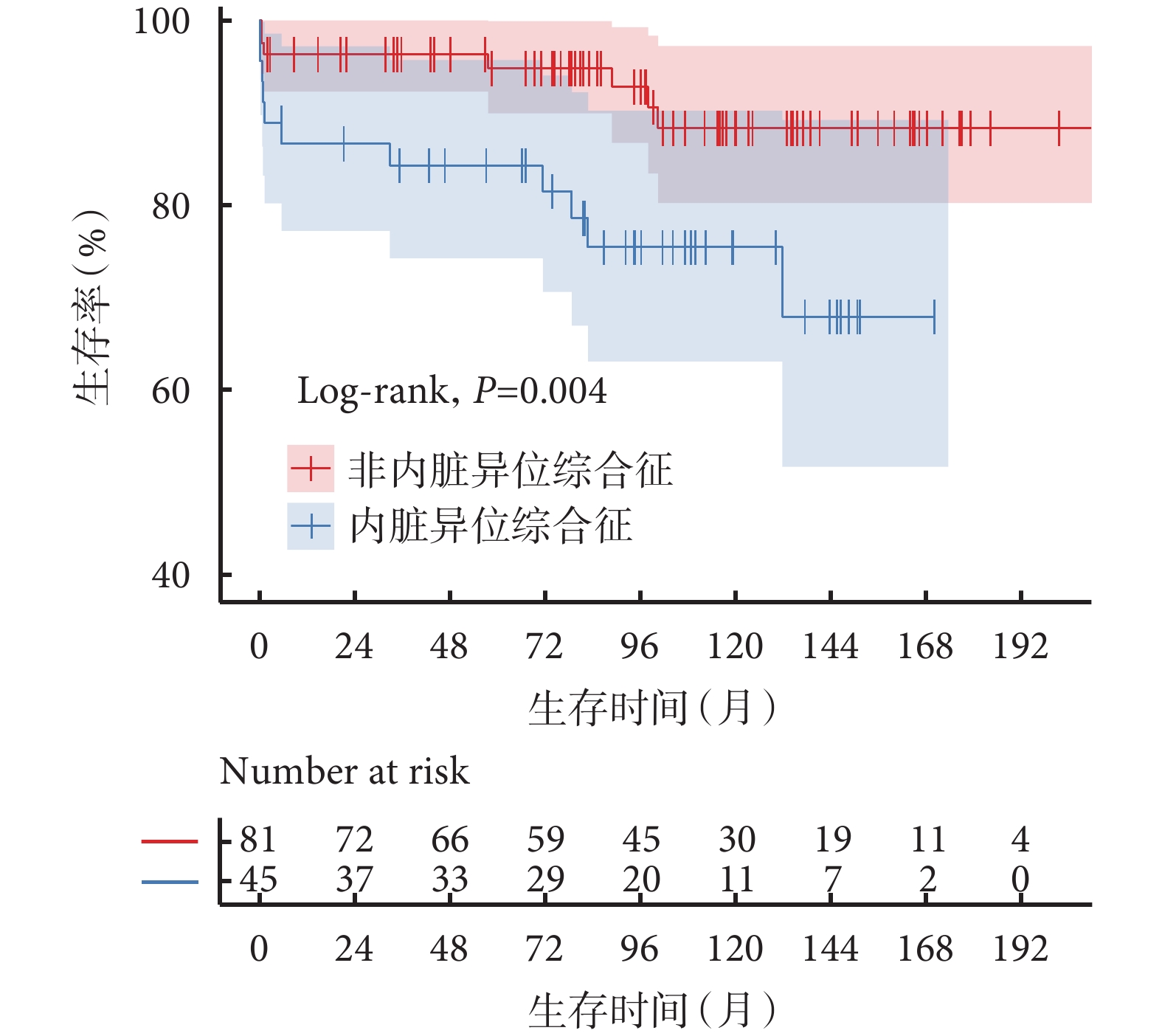 圖2
合并內臟異位綜合征與非內臟異位綜合征功能性單心室患者的生存情況比較
圖2
合并內臟異位綜合征與非內臟異位綜合征功能性單心室患者的生存情況比較
3 討論
本研究通過回顧性分析55例合并HS的FSV患者,并與匹配的同手術時期非HS患者比較發現:合并HS患者手術時間、機械通氣時間和術后感染率顯著長于或高于非HS患者,并且術后總生存率較非HS患者低,無脾是FSV合并HS患者術后死亡的獨立危險因素。
盡管FSV的姑息手術策略和圍手術期的管理已經取得很大進步,合并HS的FSV患者由于廣泛的心內及心外解剖異常,使得這部分患者的手術管理仍具有挑戰性。國外文獻[15–17]對TCPC手術治療合并HS的FSV患者報道顯示,早期死亡率為2%~10%,10年生存率為57%~93%。國內對于此類患者TCPC術后結局報道有限,上海兒童醫學中心納入的81例HS患者術后早期死亡率為18.5%,缺乏遠期隨訪結果[18]。本研究患者術后早期死亡率為9.1%,10年生存率為74.3%。值得注意的是,部分研究[19-21]提示右房異構患者的生存率明顯低于左房異構患者。我國HS患者以右房異構居多,本組病例右房異構比例更是高達96%,而西方國家則納入了更高比例的左房異構患者[10,16,18,21-22]。
合并HS是否影響TCPC手術預后仍然存在爭議,大量研究[5-6,23-24]表明,在各期姑息性手術或分期手術間期,合并HS的FSV患者的發病率和死亡率明顯增加。一份50年經驗報告[23]表明TCPC術后HS患者的生存率明顯低于非HS患者。而部分研究[10-11,25]也表明,HS并非TCPC術后不良結局的危險因素。Marathe等[10]通過對109例合并HS患者與1 431例非HS患者進行傾向性評分匹配,發現兩組患者TCPC術后遠期不良結局發生率沒有差異,但該研究忽略了術后早期死亡人群。這種結局上的差異可能與各中心患者廣泛的解剖結構差異和手術實踐有關,通過傾向性評分匹配同手術時期的非HS患者,可提高兩組患者術后整體生存情況比較的可靠性。本研究通過與匹配的同時期非HS患者比較,結果顯示由于手術策略和圍術期管理的改善,HS不再是影響早期死亡的危險因素,但合并HS患者術后總生存仍較差。我們的研究結果表明,TCPC術后影響患者生存的因素,除了Fontan循環的固有缺陷外,還應包括HS相關的解剖異常。
體靜脈和肺靜脈異位引流以及房室瓣反流在HS患者中高發,尤其是右房異構患者[4-5,26],這些合并畸形無疑使手術管理更加復雜和個體化,這也解釋了為何這類患者的手術時間較非HS患者明顯延長。體靜脈異位引流可能會漏診,尤其在不停跳手術情況下,正如本中心之前所報道的漏診SHVD可能會引起術后不可耐受的低氧血癥,需再次手術探查,甚至導致死亡[27]。本組1例患者術后因嚴重低氧血癥再次手術探查發現左側下腔靜脈回流入心房,所以此類患者的影像學檢查應特別注意排除固有下腔靜脈以外的異常回流,并在術中進行探查以避免漏診異常的體靜脈回流。部分研究者[16,28-29]注意到合并完全性肺靜脈異位引流是HS患者姑息手術后死亡的預測因子,我們的結果提示需要手術的完全性肺靜脈異常引流在矯治完成后不會明顯影響TCPC手術預后,并且本中心經驗認為肺靜脈異位引流至共同心房的全身側或非常靠近上腔靜脈近心端,在不存在梗阻的情況下,通常不需要進行修復。此外,本組病例大多數患者具有共同房室瓣,并且房室瓣反流發生率高。房室瓣反流與Fontan前的心臟功能損害和肺血管阻力增加密切相關,明顯的房室瓣反流已被指出是死亡的預測指標[30-31],但我們未發現術前中度及以上的房室瓣反流與術后死亡有關。本中心在既往姑息手術或分期手術間期積極對中度以上房室瓣反流實施了手術,很大程度上保護了心臟功能,并減輕肺血流阻力,為后續的TCPC手術成功實施創造了有利條件。并且我們認為對于TCPC術前新發的肺靜脈回流梗阻和中度以上房室瓣反流,在心室功能穩定和肺動脈發育好的情況下,同期手術矯治是可行的。
本研究發現HS患者術后機械通氣時間明顯延長,可能與高發的纖毛運動障礙有關,Jonas等[3]指出纖毛運動障礙與術后呼吸機依賴和呼吸系統并發癥風險增加有關。呼吸道纖毛清除能力降低,可導致黏液積聚和呼吸道阻塞,使機械通氣時間延長,繼而增加并發呼吸道感染和肺炎的風險。術前可通過鼻竇黏膜活檢和基因檢測等手段結合臨床癥狀和體征評估患者的纖毛運動功能,并采取適當的預防和管理措施。此外,我們的研究發現無脾是術后死亡的獨立危險因素,脾臟參與血液過濾和對病原的免疫反應,合并無脾可增加術后感染和血栓形成的風險,并且已被證實與術后生存率下降相關[23,32-33]。無脾與纖毛運動障礙的聯合作用可增加術后感染風險,這解釋了為何HS患者術后感染的發生率明顯高于非HS組。Orangzeb等[34]指出脾切除患者接種疫苗可預防至少28%的感染發生,包括肺炎鏈球菌、b型流感嗜血桿菌、腦膜炎奈瑟菌等。對于無脾患者采取疫苗接種或注射免疫球蛋白以提高患者免疫力,有助于減少醫院和社區感染的發生,并降低相關并發癥和死亡的風險。
本研究具有單中心回顧性研究的局限性,且FSV合并HS發病率極低,納入的HS患者數量有限,多中心參與有助于更好地了解該人群生存情況。此外,我們未關注該類患者TCPC術前的生存情況。
綜上所述,盡管FSV合并HS患者的早期手術結果滿意,合并HS仍是影響FSV患者TCPC術后總生存的危險因素,有必要針對患者特征制定個體化的隨訪策略。與非無脾綜合征的患者相比,無脾患者的死亡風險高。
利益沖突:無。
作者貢獻:韓林江、劉湘負責論文總體設計及初稿撰寫;馬堅銳、周子秦、涂賈子超、張如月負責論文部分設計及數據篩選、收集與分析;田苗、李瑩負責論文初稿修改;袁海云、溫樹生負責手術技術解釋和參與論文核修;陳寄梅負責論文審閱。
功能性單心室(functional single ventricle,FSV)是一類解剖結構復雜的先天性心臟病,手術治療的挑戰性極大,通常無法完成雙心室修復,全腔靜脈-肺動脈連接術(total cavopulmonary connection,TCPC)成為多數患者的最終治療手段[1]。FSV合并內臟異位綜合征(heterotaxy syndrome,HS)患者常并發廣泛的心內和心外解剖異常,包括共同房室瓣、體靜脈或肺靜脈異常引流、無脾和纖毛運動障礙等[2-3]。盡管手術和圍術期管理水平明顯提高,這類患者在各期姑息手術或等待完成TCPC手術期間的死亡率和發病率仍較高,整體生存情況較差[4-5]。傳統上,合并HS被認為是影響TCPC術后生存的危險因素[6-9]。但近年來一些研究[10-12]也指出,合并HS患者TCPC術后的遠期生存情況與非HS患者無異。目前觀點對于合并HS是否影響TCPC術后結局存在分歧,本研究通過回顧性分析本中心合并HS的FSV患者資料,并與匹配的同手術時期非HS患者進行比較,總結本中心的手術經驗及結果。
1 資料與方法
1.1 臨床資料和分組
回顧性分析2004—2021年在本中心診斷為FSV合并HS患者(HS組)的臨床資料。納入標準:(1)行單心室矯治;(2)完成TCPC手術。診斷根據患者術前超聲心動圖、心導管造影和增強CT報告并且術中探查證實,或術中探查發現對稱心房結構,本研究的形態學納入標準依據Jacobs等[2]報道的命名和分類方案,雙側心房表現為右心耳結構者為右房異構,常合并無脾,雙側支氣管和肺組織均為右肺結構;左房異構特征為雙側左心耳結構,多合并多脾,雙側支氣管和肺組織均為左肺結構。納入同時期非HS患者作為非HS組。
1.2 研究變量定義
早期死亡定義為術后30 d內發生死亡。術后感染依據國家衛生部制定的《醫院感染診斷標準(試行)》[13]進行診斷,根據患者臨床癥狀(咳痰、濕啰音等)、影像學陽性結果、感染指標(發熱、白細胞計數、降鈣素、C反應蛋白等)、病原學送檢結果、抗菌藥使用情況等綜合判定。肝功能損害的判定按照世界衛生組織發布的常見不良反應術語評定標準(CTCAE)6.0版,考慮到TCPC術后下腔靜脈壓力升高,患者普遍存在肝功酶升高,將術后轉氨酶超出正常上限值3倍以上判斷為肝功能損害。符合以下情形之一可診斷為急性腎損傷:(1)48 h內血清肌酐上升至0.3 mg/dL(≥26.5 μmol/L);(2)已知或假定腎功能損傷發生在1周內,血清肌酐上升超過基礎值的1.5倍;(3)尿量持續6 h低于0.5 mL/(kg?h)[14]。
1.3 手術方法
TCPC手術類型包括:(1)心外管道:離斷下腔靜脈,縫閉近心端,用Gore-Tex管道連接下腔靜脈和主肺動脈;合并開口靠近下腔靜脈開口的肝靜脈單獨回流入心房(separate hepatic venous drainage,SHVD),離斷包含肝靜脈開口和下腔靜脈開口的心房組織,近心端縫閉,遠心端的肝靜脈和下腔靜脈與Gore-Tex 管道端端吻合。(2)心內-心外管道:心尖和下腔靜脈位于同側者,將Gore-Tex管道一端剪成斜口,與下腔靜脈開口吻合,另一端自右心房切口穿出心房并與肺動脈吻合,心房切口邊緣與Gore-Tex管道外壁包繞縫合,需要開窗者,直接在管道心內段進行打孔即可;合并開口距離下腔靜脈開口較遠的SHVD,取合適大小的Gore-Tex管道,將一端開口剪成寬大的裙邊狀,同時覆蓋肝靜脈開口與下腔靜脈開口,另一端穿出心房與肺動脈下緣端側吻合。(3)主肺動脈-下腔靜脈直接吻合:肺動脈發育好且靠近下腔靜脈,充分游離肺動脈直接下拉與下腔靜脈吻合。
1.4 隨訪
術后早期存活患者在出院后第1個月、3個月、6個月、12個月門診隨訪復查,而后每年門診規律隨訪,隨訪內容主要包括患者主觀癥狀、運動耐量、生長發育情況,復查超聲心動圖、心電圖、凝血功能,必要時完善心臟增強CT或者磁共振成像。根據電子病歷系統記錄的最新門診和住院信息或通過電話隨訪確定與時間相關的結局。
1.5 統計學分析
采用SPSS 25.0(IBM)統計軟件進行數據分析。符合正態分布的計量資料采用均數±標準差(x±s)描述,非正態分布則采用中位數(上下四分位數)[M(P25,P75)]描述,計數資料以頻數和百分比[n(%)]描述。計量資料的組間比較采用t檢驗或Mann-Whitney U檢驗。計數資料的組間比較采用χ2檢驗或Fisher確切概率法。對影響術后死亡的可能因素進行單因素分析,P≤0.1則納入多因素Cox回歸分析。采用1∶2傾向性評分匹配法匹配兩組患者,匹配變量包括年齡、性別、體重、體表面積、Nakata指數、優勢心室形態、是否一期完成TCPC、TCPC類型、是否開窗、是否合并中度及以上的房室瓣反流、是否同期行完全性肺靜脈異位引流或肺靜脈回流梗阻矯治和房室瓣整形或置換術。Kaplan-Meier法計算累計生存率,log-rank檢驗比較不同組間生存差異。P≤0.05為差異有統計學意義。
1.6 倫理審查
本研究已通過廣東省人民醫院(廣東省醫學科學院)醫學研究倫理委員會審批,倫理批號:KY-Q-2021-109-04。
2 結果
2.1 TCPC手術情況
傾向性評分匹配前,HS組納入患者55例,其中男42例、女13例,手術時中位年齡為6.0(4.2,11.8)歲,中位體重為17.0(14.2,28.8)kg,術前血氧飽和度81.5%±5.0%,Nakata指數252.9(170.1,320.6)。53例為右房異構,14例合并無脾,2例為左房異構。38例患者存在完全性房室間隔缺損,7例患者存在右室雙出口,18例合并大動脈轉位。術前8例患者存在中度及以上的房室瓣反流,2例存在肺靜脈回流梗阻;見表1。45例患者術前心導管檢查肺動脈壓力資料可獲得,平均肺動脈壓(mPAP)為15.0(11.0,17.0)mm Hg(1 mm Hg=0.133 kPa),3例存在輕度肺動脈高壓(26~31 mm Hg)。
 /例(%)/M(P25,P75)]
/例(%)/M(P25,P75)]
HS組55例患者中8例一期完成TCPC,分期手術是主要的治療策略,既往手術包括體-肺分流2例、肺動脈環縮3例、肺動脈成形1例、完全性肺靜脈異位引流矯治7例、房室瓣整形或置換14例和雙向Glenn手術47例。TCPC手術類型包括心外管道39例、心內-心外管道14例、主肺動脈-下腔靜脈直接吻合2例、管道開窗32例。同期手術包括房室瓣整形或置換8例、完全性肺靜脈異位引流或肺靜脈回流梗阻矯治3例、肺動脈成形3例。
HS組55例患者中位體外循環時間為153.0(105.0,193.0)min,中位主動脈阻斷時間為70.0(13.0,101.0)min。術后中位機械通氣時間為15.5(6.3,64.0)h,中位ICU停留時間為4.5(2.5,6.7)d。術后27例發生感染,其中肺部感染16例,19例出現肝功能損害,11例出現急性腎損傷,心律失常5例。術后結果和并發癥發生情況見表2。傾向性評分匹配后HS組45例,非HS組81例。HS組手術時間、機械通氣時間長于非HS組,術后感染率顯著高于非HS組(P<0.05)。兩組在體外循環時間、ICU停留時間、非計劃再手術率、并發癥發生率、術后住院時間、術后早期死亡等方面差異無統計學意義(P>0.05);見表3。
2.2 再手術
HS組55例患者術后早期非計劃再手術5例,3例為開胸探查止血,1例無法耐受Fontan循環行TCPC拆除,1例術后嚴重低氧血癥再次手術探查行左下腔靜脈結扎。4例患者隨訪期間需要再次手術干預。早期術后存活患者1年免于再手術率為94.0%,5年為92.0%。1例術后52個月為改善血氧飽和度和預防癲癇發作行經皮心導管介入外管道留孔封堵,1例術后6個月因降主動脈-肺動脈側枝形成行主肺側枝封堵,1例術后11個月因重度房室瓣反流行房室瓣置換,1例術后第56 d因Ⅲ度房室傳導阻滯藥物治療效果差行永久性起搏器置入術。4例再手術患者隨訪過程中,1例死亡,1例術后第6年失訪,2例仍在隨訪中。
2.3 死亡
HS組55例患者中,6例患者分別在隨訪的第5.5、21.3、37.3、73.8、104.3、170.3個月失訪。術后5例(9.1%)患者發生早期死亡,存活患者隨訪1.3~179.0個月,中位隨訪時間94.7(64.3,129.8)個月,9例患者在隨訪過程中死亡,估計總生存率1年為87.2%±5.2%,5年為85.3%±5.6%,10年為74.3%±9.0%;見圖1。所有死亡患者資料見表4。與同時期非HS的FSV相比,合并HS的FSV患者總生存率顯著下降(P=0.004),1年生存率為86.6%、96.3%,5年生存率84.3%、94.8%,10年生存率75.4%、88.3%;見圖2。多因素Cox回歸分析提示:無脾[HR=8.98,95%CI(1.86,43.34),P=0.006]是影響患者總體生存的獨立危險因素;見表5。
 圖1
功能性單心室合并內臟異位綜合征患者的Kaplan-Meier曲線
圖1
功能性單心室合并內臟異位綜合征患者的Kaplan-Meier曲線
 圖2
合并內臟異位綜合征與非內臟異位綜合征功能性單心室患者的生存情況比較
圖2
合并內臟異位綜合征與非內臟異位綜合征功能性單心室患者的生存情況比較
3 討論
本研究通過回顧性分析55例合并HS的FSV患者,并與匹配的同手術時期非HS患者比較發現:合并HS患者手術時間、機械通氣時間和術后感染率顯著長于或高于非HS患者,并且術后總生存率較非HS患者低,無脾是FSV合并HS患者術后死亡的獨立危險因素。
盡管FSV的姑息手術策略和圍手術期的管理已經取得很大進步,合并HS的FSV患者由于廣泛的心內及心外解剖異常,使得這部分患者的手術管理仍具有挑戰性。國外文獻[15–17]對TCPC手術治療合并HS的FSV患者報道顯示,早期死亡率為2%~10%,10年生存率為57%~93%。國內對于此類患者TCPC術后結局報道有限,上海兒童醫學中心納入的81例HS患者術后早期死亡率為18.5%,缺乏遠期隨訪結果[18]。本研究患者術后早期死亡率為9.1%,10年生存率為74.3%。值得注意的是,部分研究[19-21]提示右房異構患者的生存率明顯低于左房異構患者。我國HS患者以右房異構居多,本組病例右房異構比例更是高達96%,而西方國家則納入了更高比例的左房異構患者[10,16,18,21-22]。
合并HS是否影響TCPC手術預后仍然存在爭議,大量研究[5-6,23-24]表明,在各期姑息性手術或分期手術間期,合并HS的FSV患者的發病率和死亡率明顯增加。一份50年經驗報告[23]表明TCPC術后HS患者的生存率明顯低于非HS患者。而部分研究[10-11,25]也表明,HS并非TCPC術后不良結局的危險因素。Marathe等[10]通過對109例合并HS患者與1 431例非HS患者進行傾向性評分匹配,發現兩組患者TCPC術后遠期不良結局發生率沒有差異,但該研究忽略了術后早期死亡人群。這種結局上的差異可能與各中心患者廣泛的解剖結構差異和手術實踐有關,通過傾向性評分匹配同手術時期的非HS患者,可提高兩組患者術后整體生存情況比較的可靠性。本研究通過與匹配的同時期非HS患者比較,結果顯示由于手術策略和圍術期管理的改善,HS不再是影響早期死亡的危險因素,但合并HS患者術后總生存仍較差。我們的研究結果表明,TCPC術后影響患者生存的因素,除了Fontan循環的固有缺陷外,還應包括HS相關的解剖異常。
體靜脈和肺靜脈異位引流以及房室瓣反流在HS患者中高發,尤其是右房異構患者[4-5,26],這些合并畸形無疑使手術管理更加復雜和個體化,這也解釋了為何這類患者的手術時間較非HS患者明顯延長。體靜脈異位引流可能會漏診,尤其在不停跳手術情況下,正如本中心之前所報道的漏診SHVD可能會引起術后不可耐受的低氧血癥,需再次手術探查,甚至導致死亡[27]。本組1例患者術后因嚴重低氧血癥再次手術探查發現左側下腔靜脈回流入心房,所以此類患者的影像學檢查應特別注意排除固有下腔靜脈以外的異常回流,并在術中進行探查以避免漏診異常的體靜脈回流。部分研究者[16,28-29]注意到合并完全性肺靜脈異位引流是HS患者姑息手術后死亡的預測因子,我們的結果提示需要手術的完全性肺靜脈異常引流在矯治完成后不會明顯影響TCPC手術預后,并且本中心經驗認為肺靜脈異位引流至共同心房的全身側或非常靠近上腔靜脈近心端,在不存在梗阻的情況下,通常不需要進行修復。此外,本組病例大多數患者具有共同房室瓣,并且房室瓣反流發生率高。房室瓣反流與Fontan前的心臟功能損害和肺血管阻力增加密切相關,明顯的房室瓣反流已被指出是死亡的預測指標[30-31],但我們未發現術前中度及以上的房室瓣反流與術后死亡有關。本中心在既往姑息手術或分期手術間期積極對中度以上房室瓣反流實施了手術,很大程度上保護了心臟功能,并減輕肺血流阻力,為后續的TCPC手術成功實施創造了有利條件。并且我們認為對于TCPC術前新發的肺靜脈回流梗阻和中度以上房室瓣反流,在心室功能穩定和肺動脈發育好的情況下,同期手術矯治是可行的。
本研究發現HS患者術后機械通氣時間明顯延長,可能與高發的纖毛運動障礙有關,Jonas等[3]指出纖毛運動障礙與術后呼吸機依賴和呼吸系統并發癥風險增加有關。呼吸道纖毛清除能力降低,可導致黏液積聚和呼吸道阻塞,使機械通氣時間延長,繼而增加并發呼吸道感染和肺炎的風險。術前可通過鼻竇黏膜活檢和基因檢測等手段結合臨床癥狀和體征評估患者的纖毛運動功能,并采取適當的預防和管理措施。此外,我們的研究發現無脾是術后死亡的獨立危險因素,脾臟參與血液過濾和對病原的免疫反應,合并無脾可增加術后感染和血栓形成的風險,并且已被證實與術后生存率下降相關[23,32-33]。無脾與纖毛運動障礙的聯合作用可增加術后感染風險,這解釋了為何HS患者術后感染的發生率明顯高于非HS組。Orangzeb等[34]指出脾切除患者接種疫苗可預防至少28%的感染發生,包括肺炎鏈球菌、b型流感嗜血桿菌、腦膜炎奈瑟菌等。對于無脾患者采取疫苗接種或注射免疫球蛋白以提高患者免疫力,有助于減少醫院和社區感染的發生,并降低相關并發癥和死亡的風險。
本研究具有單中心回顧性研究的局限性,且FSV合并HS發病率極低,納入的HS患者數量有限,多中心參與有助于更好地了解該人群生存情況。此外,我們未關注該類患者TCPC術前的生存情況。
綜上所述,盡管FSV合并HS患者的早期手術結果滿意,合并HS仍是影響FSV患者TCPC術后總生存的危險因素,有必要針對患者特征制定個體化的隨訪策略。與非無脾綜合征的患者相比,無脾患者的死亡風險高。
利益沖突:無。
作者貢獻:韓林江、劉湘負責論文總體設計及初稿撰寫;馬堅銳、周子秦、涂賈子超、張如月負責論文部分設計及數據篩選、收集與分析;田苗、李瑩負責論文初稿修改;袁海云、溫樹生負責手術技術解釋和參與論文核修;陳寄梅負責論文審閱。