引用本文: 周凱, 鄧朝強, 張揚. 經手術切除肺癌腫瘤大小測量和臨床T分期準確性:1 880例患者的回顧性分析. 中國胸心血管外科臨床雜志, 2024, 31(2): 223-228. doi: 10.7507/1007-4848.202310061 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
肺癌是世界上癌癥相關死亡率最高的腫瘤[1],也是我國發病率和死亡率最高的腫瘤[2]。準確的肺癌臨床分期對于指導治療決策和預后評估至關重要。臨床分期低估等不正確的分期可能會使患者面臨手術切除不完全和接受無意義治療的風險。而臨床分期高估則可能導致可切除腫瘤患者接受過度治療,甚至無法手術。JCOG0802及CALGB 140503兩項前瞻性隨機對照臨床試驗證實了2 cm以下周圍型肺癌可接受亞肺葉切除術,因此,精準的影像學腫瘤大小(radiological tumor size,RTS)測量及臨床T分期可直接影響肺癌患者手術方式的選擇[3-4]。
國際肺癌研究協會(International Association for the Study of Lung Cancer,IASLC)在第8版癌癥分期中修訂了肺癌的TNM分類[5-6]。這次修訂對腫瘤大小臨界值進行了重新評估:將之前的 T1(<3 cm)細分為 T1a(≤1 cm)、T1b(>1 至≤2 cm)和 T1c(>2 cm 至≤ 3 cm)。鑒于這一背景,臨床(即影像學)與術后(即病理學)對腫瘤大小評估的一致性空前重要。然而,目前根據第8版TNM分類標準分析肺癌腫瘤大小的臨床-病理一致性和臨床T分期的準確性研究較少。Lampen-Sachar 等[7]報道了在 47 例診斷為Ⅰ期或Ⅱ期肺腺癌的患者中,CT測量的腫瘤直徑與病理診斷上的直徑差異有統計學意義。一些研究[8-9]也報道了高度不準確的臨床分期現象。
因此本研究的主要目的是分析肺癌切除術后患者影像學和病理學腫瘤大小(pathological tumor size,PTS)測量之間的相關性,并依據肺癌第8版分期標準判斷以上患者臨床T分期的準確性,從而探討T分期不準確將如何影響這些患者的治療策略。
1 資料與方法
1.1 臨床資料
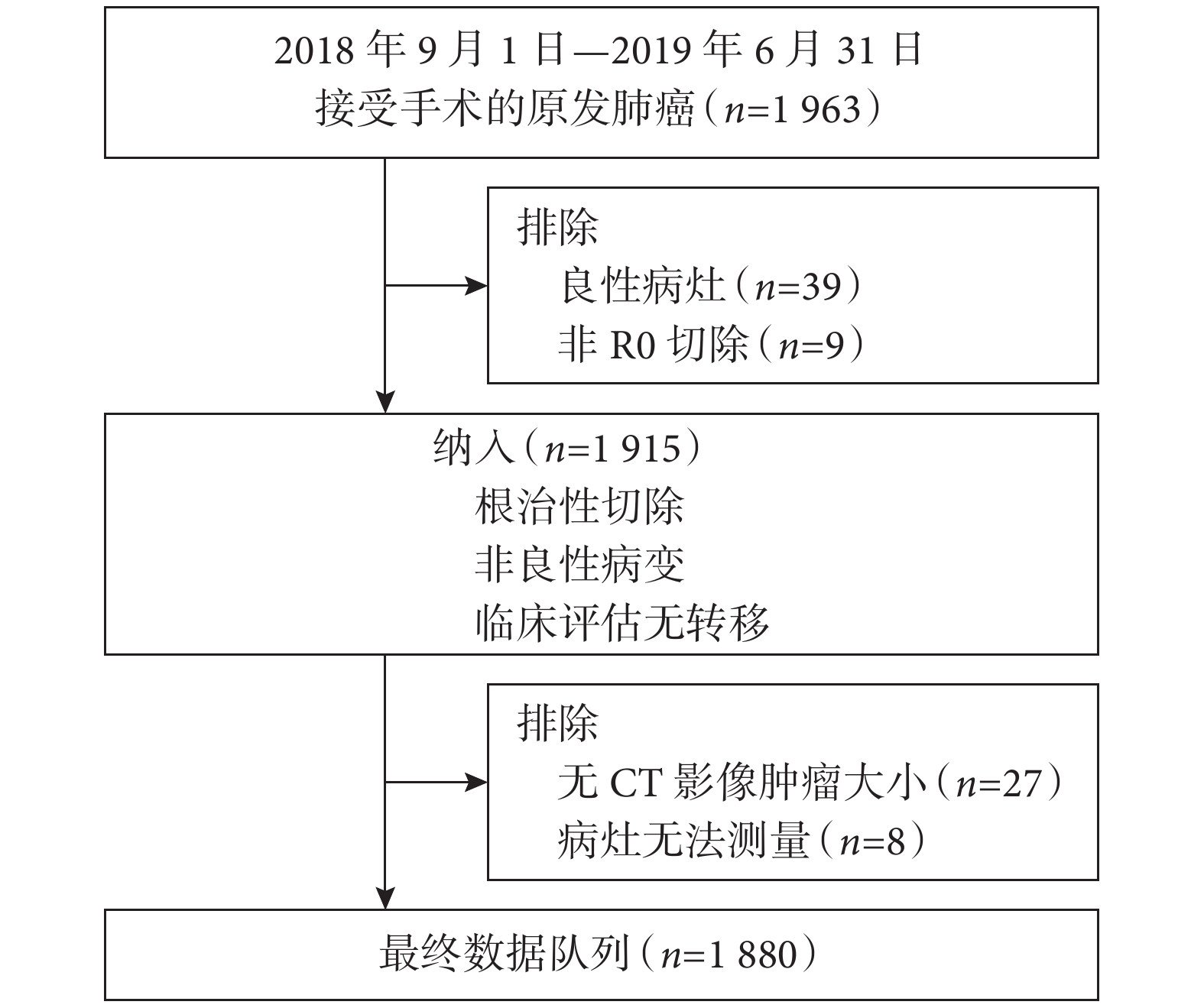
我們回顧性收集2018年9月—2019 年6月于復旦大學附屬腫瘤醫院胸外科行手術切除肺癌患者的臨床資料。患者納入標準:(1)患者影像學CT及術后病理學資料完整;(2)病理診斷為肺惡性病變;(3)臨床評估無遠處轉移;(4)接受根治性手術切除。圖1為納入與排除標準的流程圖。納入過程共排除83例患者,其中包括39例良性結節、9例非根治性切除、27例無CT影像及8例無法測量的病灶。由于本研究為回顧性研究,樣本量由最終符合標準的患者實際數量決定。根據本研究目的前瞻性收集以下變量,包括診斷時年齡、性別、薄層CT軸向面RTS和PTS、臨床和病理 T分期、結節形態學特征如有無磨玻璃成分(ground-glass opacity,GGO)、是否存在分葉、毛刺和空洞以及組織學類型。術后病理診斷參照IASLC /美國胸外科協會(ATS) /歐洲呼吸學會(ERS)分級[10]。主要分型根據最大百分比(不一定達到50%或更高的比例)的組織學成分來定義。根據第8版 TNM 分期,進行術前薄層CT和術后病理報告重新評估,以確定腫瘤大小和分期。本研究納入患者中包含多原發患者,對于這類患者我們選取直徑最大的腫物進行測量與比較。
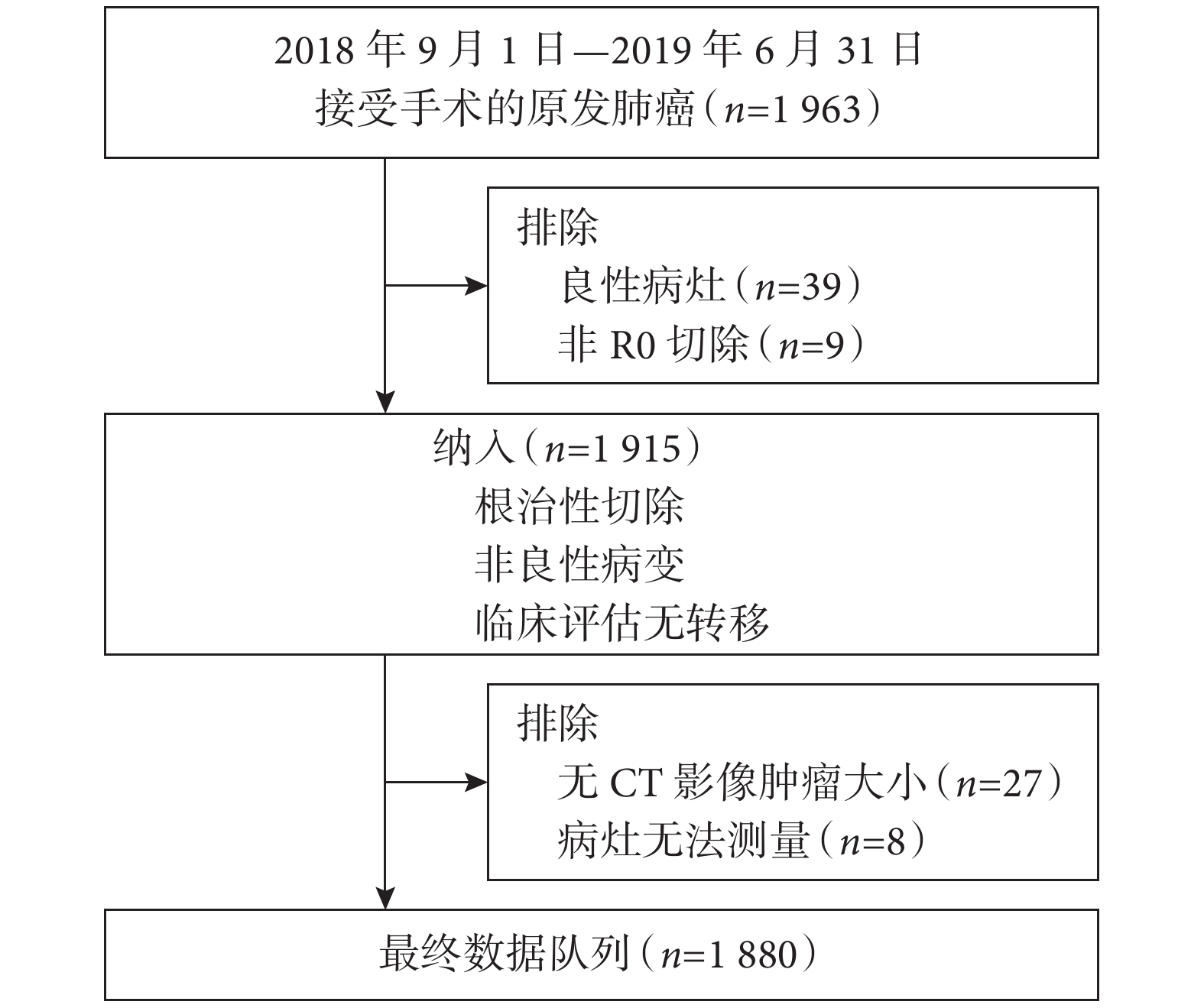 圖1
納入患者流程圖及排除原因
圖1
納入患者流程圖及排除原因
CT:計算機斷層掃描
1.2 統計學分析
統計分析采用 SPSS(version 22.0;IBM Corp,Armonk,NY) 和 R Statistical Language(版本 3.6.1)。正態分布的計量資料采用Pearson相關系數,計數資料采用Pearson相關系數分析RTS與PTS的相關性。采用配對 t 檢驗用于檢驗 RTS 和 PTS 之間的差異。使用 Bland-Altman 圖來分析觀測差異與假設真實腫瘤大小之間的關系。為了評估臨床和病理T分期之間的一致性,我們計算了一致性百分比和加權Cohen’s κ指數。使用多因素logistic回歸模型來評估臨床病理特征是否可能與臨床T分期的準確性相關。將單因素分析中 P≤0.05 的變量納入多因素分析。所有檢驗均采用雙側分析,檢驗水準α=0.05。
2 結果
2.1 一般臨床資料
共納入1 880例肺癌患者,其中男778例、女1 102例,平均年齡(57±11)歲。肺腺癌是最常見的病理類型,其次是鱗狀細胞癌和其他/未知類型。RTS和PTS的平均直徑分別為(19.1±13.5)mm和(17.7±14.0)mm。患者的臨床病理特征已總結(表1)。
2.2 RTS與PTS的相關性
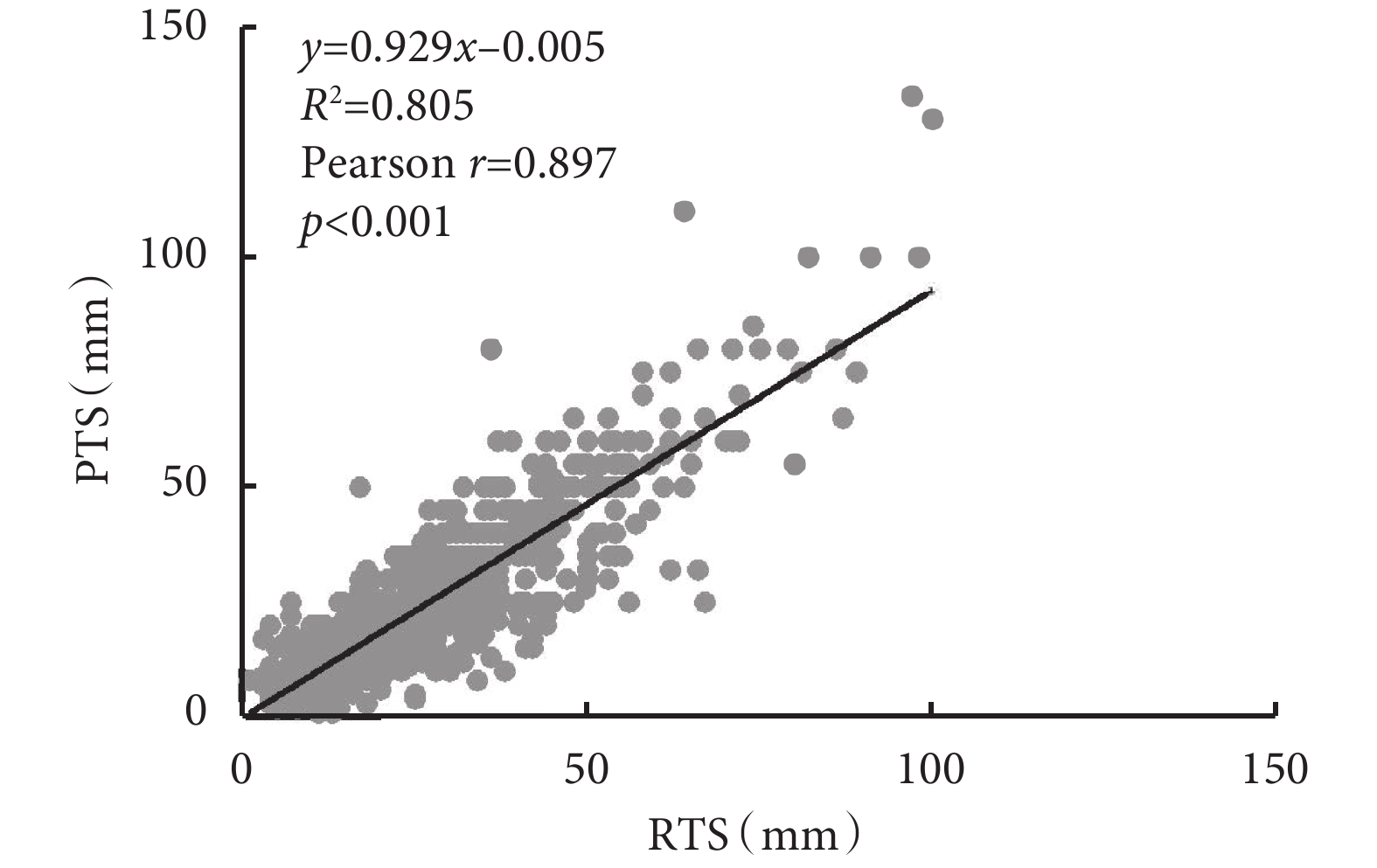
術前影像學測量的RTS與病理學測量的PTS呈正線性關系(圖2)。Pearson相關系數(r)為 0.897(P<0.001),表明這兩個變量之間的關聯強度較高。回歸公式如下:y=0.929x–0.005。0.929的斜率表明,與整個隊列中的PTS相比,RTS略微高估了腫瘤真實大小。
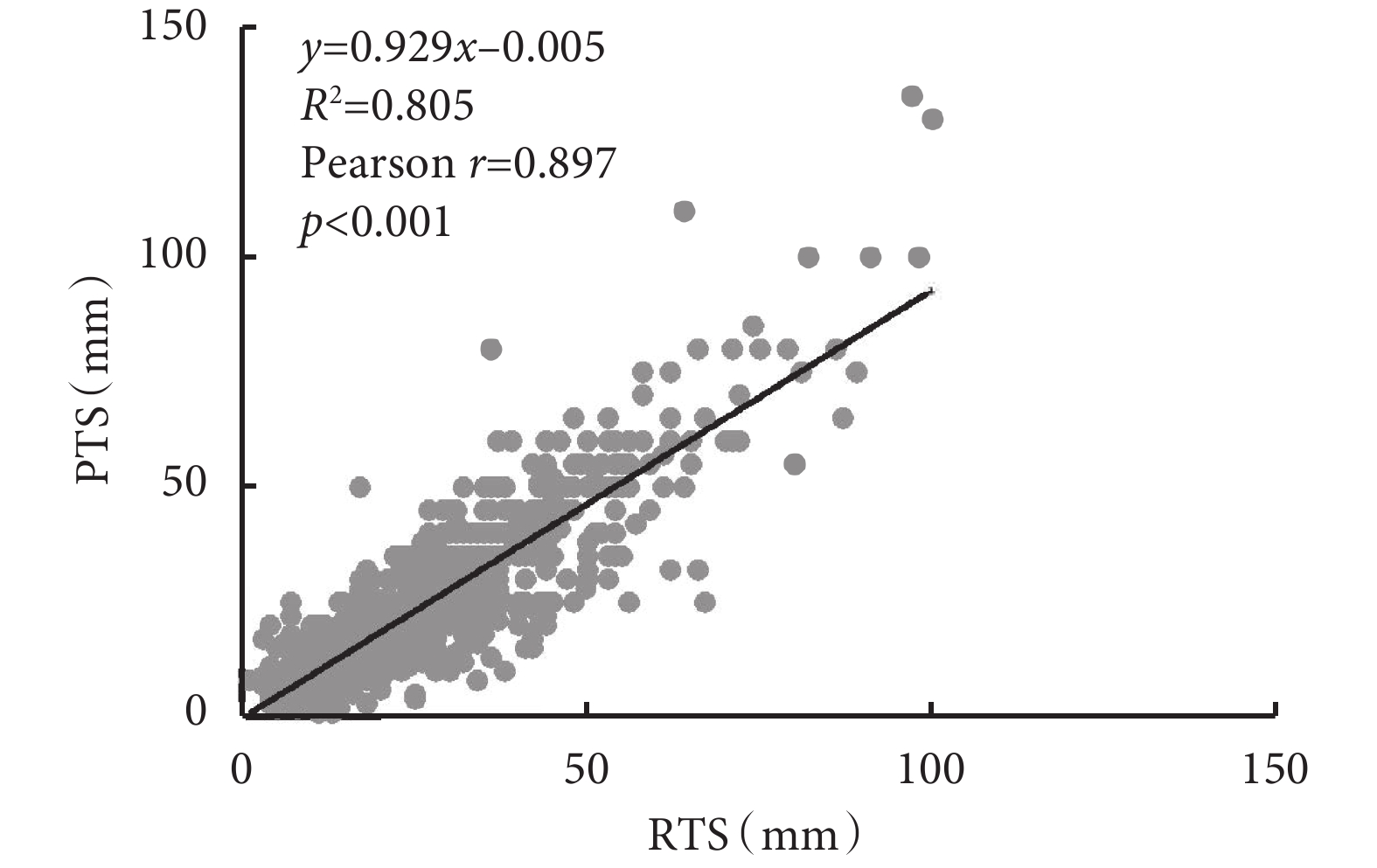 圖2
薄層計算機斷層掃描圖像上的RTS與PTS的相關性分析
圖2
薄層計算機斷層掃描圖像上的RTS與PTS的相關性分析
RTS:影像學腫瘤大小;PTS:病理學腫瘤大小
與PTS相比,RTS在整個隊列(S<0.001)和特定的分層分析中顯著高估了腫瘤真實大小(表2)。然而,當分層分析僅限于腫瘤>4 cm的患者時,RTS 與 PTS 相比低估了腫瘤真實大小,在腫瘤>3 cm而≤4 cm的患者差異無統計學意義(P=0.734,表2)。在微乳頭狀生長為主的腺癌(MPA)/以實性生長為主的腺癌(SPA)或鱗狀細胞癌患者中,RTS和PTS之間未觀察到顯著差異。
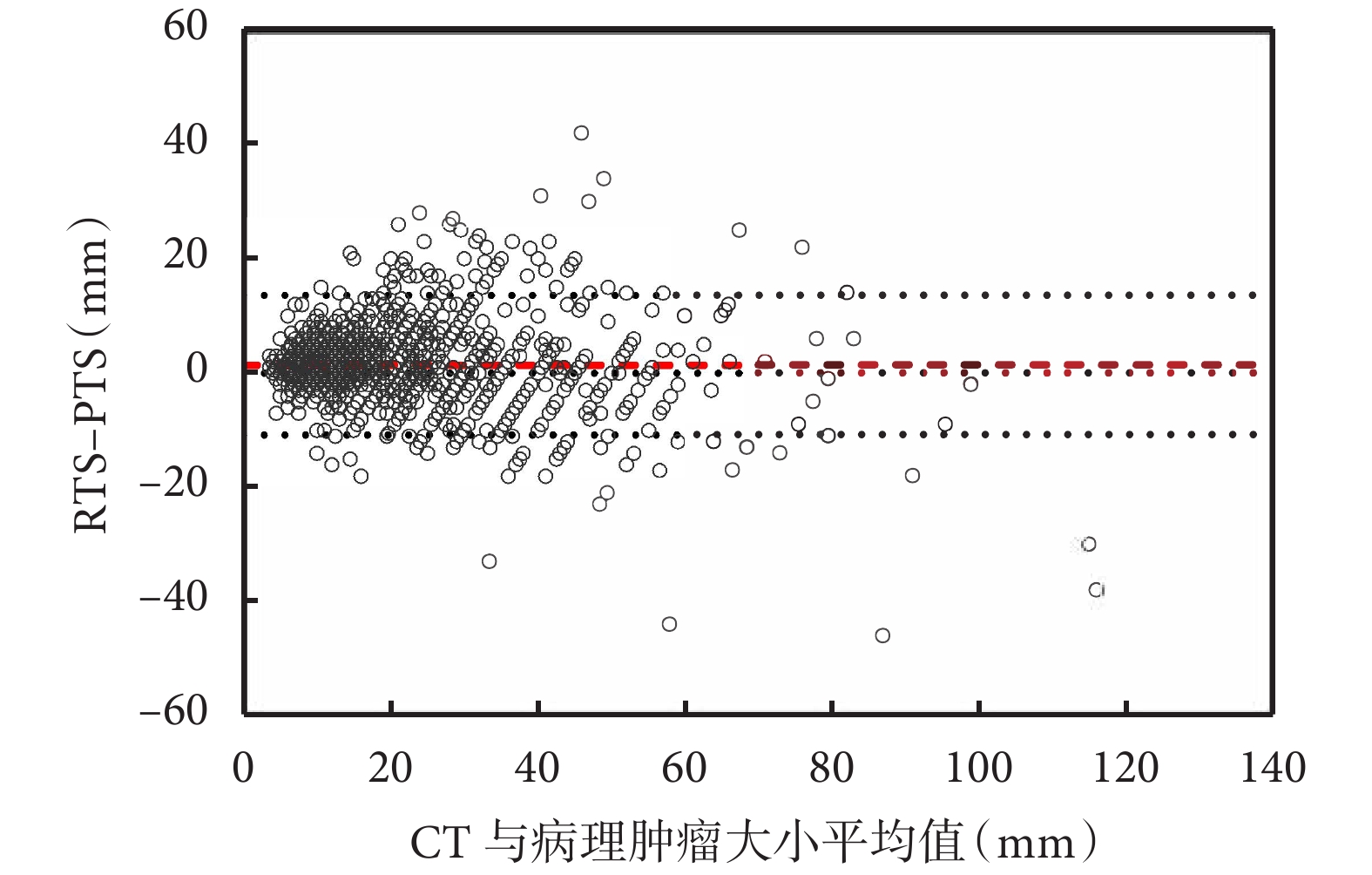
RTS 和 PTS 之間的差異沒有隨著腫瘤真實大小的變化而改變,未觀察到明顯的模式(圖3)。
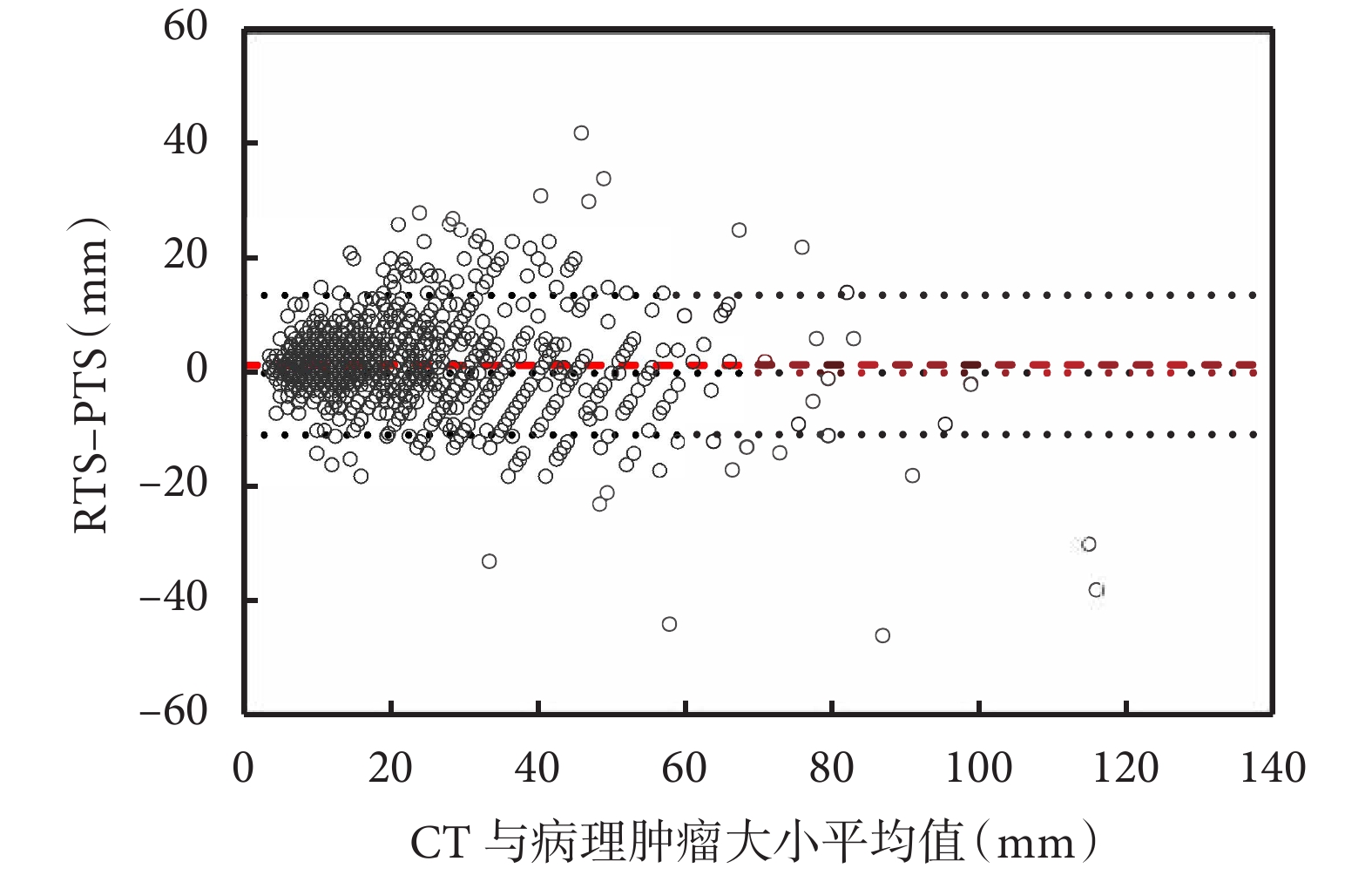 圖3
Bland-Altman 圖用于評估估計的真實腫瘤大小與觀察到的差異之間的相關性
圖3
Bland-Altman 圖用于評估估計的真實腫瘤大小與觀察到的差異之間的相關性
影像學腫瘤大小(RTS)和病理學腫瘤大小(PTS)之間的平均差異在1.4 mm處用紅線表示
2.3 cT與pT分期差異
cT 與 pT 分期的一致率為 65.6%[加權Cohen κ =0.548,95%CI (0.519,0.577)](表3)。9.0%的患者臨床分期低估了病理分期,24.6%的患者臨床分期高估了病理分期(表3)。pT1 和 pT2~4 的準確率分別為 67.9%、49.4%。29.4%的患者臨床分期未能檢測到T4疾病。與此同時,有5例患者最初被分為cT4,但在手術后的評估中被降為T3。
在 logistic 回歸分析中,年齡、GGO、分葉、毛刺、pT 分期和組織學類型與 cT 分期的準確性無顯著相關,而男性及結節內存在空腔是導致 cT分期不準確的獨立危險因素(P=0.002;P< 0.001,表4)。
3 討論
目前,臨床(即影像學)和術后(即病理學)對腫瘤大小的評估之間的相關性仍然存在爭議。最大腫瘤平面上的微小測量差異很可能會改變患者的T分期,而臨床分期對于指導治療策略和預后評價具有重要意義。既往研究[7, 11-13]發現影像學上測量的腫瘤大小會普遍高估腫瘤真實大小。 Lim 等[11]報道,在252例切除的病理性T1或T2腺癌患者中,整體RTS顯著大于PTS(P<0.001)。CT測量反映的是膨脹肺內的腫瘤尺寸,而病理學測量的標本來自塌陷肺組織,這一因素可能導致腫瘤測量體積減小。然而,本研究通過分層分析發現在腫瘤>4 cm的患者中,RTS與PTS相比反而顯著低估了腫瘤大小,這一現象未在其他研究中被發現。我們認為,由于指導后續手術策略的壓力,影像科醫生在進行CT測量時可能偏向保守,特別是對于直徑較大的腫瘤。此外,直徑較大的腫瘤往往形狀更不規則,這可能會增加精確測量的難度。而既往研究未發現該結果的原因可能是納入的隊列例數不足,尤其是結節>4 cm的肺癌患者。本研究共納入1 880例患者,其中155例結節>4 cm,因此足以進行不同腫瘤大小的分層分析。
既往一些研究[9,14-16]報道了臨床分期不準確的情況。高估的臨床T分期可能導致原本可切除腫瘤患者無法接受有潛在治愈可能性的手術,對于腫瘤大小位于閾值邊緣的患者來說更為如此。反之,T分期低估可能會導致患者接受不完全手術切除的風險。在我們的研究中,高達29.4%的患者被發現有未評估到的T4疾病。其中1例被診斷為cT2a,4例診斷為cT3。如前所述,在T2b~4腫瘤患者中,與病理性的PTS相比,RTS低估了腫瘤真實大小,這可能部分解釋了為什么臨床分期沒有檢測到 T4 疾病。Navani 等[9]報道,72例患者最終被診斷為 pT4,而只有2例患者術前被正確分類為 T4。臨床和病理T分期之間的這種差異可能導致不同的治療策略和不完全切除。因此,迫切需要進一步研究提高臨床T分期準確性的方法和技術。本研究通過多因素logistic回歸分析發現肺癌結節內存在空腔是導致臨床T分期不準確的獨立危險因素。因此,影像學醫師應當細致、反復測量存在空腔的肺部結節以提高分期準確性。
綜上所述,RTS與PTS之間的相關性隨實際腫瘤大小而變化。肺癌臨床T分期的準確性仍不令人滿意。外科醫師以及影像學醫師應特別重視對較大直徑腫瘤以及內部存在空腔腫瘤的評估與測量,以避免不準確分期對臨床診治策略的影響。
利益沖突:無。
作者貢獻:周凱、鄧朝強負責數據錄入、數據整理、查閱文獻及文章撰寫;鄧朝強、張揚負責文章內容調整、語言修改、文章總體設想和構思。
肺癌是世界上癌癥相關死亡率最高的腫瘤[1],也是我國發病率和死亡率最高的腫瘤[2]。準確的肺癌臨床分期對于指導治療決策和預后評估至關重要。臨床分期低估等不正確的分期可能會使患者面臨手術切除不完全和接受無意義治療的風險。而臨床分期高估則可能導致可切除腫瘤患者接受過度治療,甚至無法手術。JCOG0802及CALGB 140503兩項前瞻性隨機對照臨床試驗證實了2 cm以下周圍型肺癌可接受亞肺葉切除術,因此,精準的影像學腫瘤大小(radiological tumor size,RTS)測量及臨床T分期可直接影響肺癌患者手術方式的選擇[3-4]。
國際肺癌研究協會(International Association for the Study of Lung Cancer,IASLC)在第8版癌癥分期中修訂了肺癌的TNM分類[5-6]。這次修訂對腫瘤大小臨界值進行了重新評估:將之前的 T1(<3 cm)細分為 T1a(≤1 cm)、T1b(>1 至≤2 cm)和 T1c(>2 cm 至≤ 3 cm)。鑒于這一背景,臨床(即影像學)與術后(即病理學)對腫瘤大小評估的一致性空前重要。然而,目前根據第8版TNM分類標準分析肺癌腫瘤大小的臨床-病理一致性和臨床T分期的準確性研究較少。Lampen-Sachar 等[7]報道了在 47 例診斷為Ⅰ期或Ⅱ期肺腺癌的患者中,CT測量的腫瘤直徑與病理診斷上的直徑差異有統計學意義。一些研究[8-9]也報道了高度不準確的臨床分期現象。
因此本研究的主要目的是分析肺癌切除術后患者影像學和病理學腫瘤大小(pathological tumor size,PTS)測量之間的相關性,并依據肺癌第8版分期標準判斷以上患者臨床T分期的準確性,從而探討T分期不準確將如何影響這些患者的治療策略。
1 資料與方法
1.1 臨床資料
我們回顧性收集2018年9月—2019 年6月于復旦大學附屬腫瘤醫院胸外科行手術切除肺癌患者的臨床資料。患者納入標準:(1)患者影像學CT及術后病理學資料完整;(2)病理診斷為肺惡性病變;(3)臨床評估無遠處轉移;(4)接受根治性手術切除。圖1為納入與排除標準的流程圖。納入過程共排除83例患者,其中包括39例良性結節、9例非根治性切除、27例無CT影像及8例無法測量的病灶。由于本研究為回顧性研究,樣本量由最終符合標準的患者實際數量決定。根據本研究目的前瞻性收集以下變量,包括診斷時年齡、性別、薄層CT軸向面RTS和PTS、臨床和病理 T分期、結節形態學特征如有無磨玻璃成分(ground-glass opacity,GGO)、是否存在分葉、毛刺和空洞以及組織學類型。術后病理診斷參照IASLC /美國胸外科協會(ATS) /歐洲呼吸學會(ERS)分級[10]。主要分型根據最大百分比(不一定達到50%或更高的比例)的組織學成分來定義。根據第8版 TNM 分期,進行術前薄層CT和術后病理報告重新評估,以確定腫瘤大小和分期。本研究納入患者中包含多原發患者,對于這類患者我們選取直徑最大的腫物進行測量與比較。
 圖1
納入患者流程圖及排除原因
圖1
納入患者流程圖及排除原因
CT:計算機斷層掃描
1.2 統計學分析
統計分析采用 SPSS(version 22.0;IBM Corp,Armonk,NY) 和 R Statistical Language(版本 3.6.1)。正態分布的計量資料采用Pearson相關系數,計數資料采用Pearson相關系數分析RTS與PTS的相關性。采用配對 t 檢驗用于檢驗 RTS 和 PTS 之間的差異。使用 Bland-Altman 圖來分析觀測差異與假設真實腫瘤大小之間的關系。為了評估臨床和病理T分期之間的一致性,我們計算了一致性百分比和加權Cohen’s κ指數。使用多因素logistic回歸模型來評估臨床病理特征是否可能與臨床T分期的準確性相關。將單因素分析中 P≤0.05 的變量納入多因素分析。所有檢驗均采用雙側分析,檢驗水準α=0.05。
2 結果
2.1 一般臨床資料
共納入1 880例肺癌患者,其中男778例、女1 102例,平均年齡(57±11)歲。肺腺癌是最常見的病理類型,其次是鱗狀細胞癌和其他/未知類型。RTS和PTS的平均直徑分別為(19.1±13.5)mm和(17.7±14.0)mm。患者的臨床病理特征已總結(表1)。
2.2 RTS與PTS的相關性
術前影像學測量的RTS與病理學測量的PTS呈正線性關系(圖2)。Pearson相關系數(r)為 0.897(P<0.001),表明這兩個變量之間的關聯強度較高。回歸公式如下:y=0.929x–0.005。0.929的斜率表明,與整個隊列中的PTS相比,RTS略微高估了腫瘤真實大小。
 圖2
薄層計算機斷層掃描圖像上的RTS與PTS的相關性分析
圖2
薄層計算機斷層掃描圖像上的RTS與PTS的相關性分析
RTS:影像學腫瘤大小;PTS:病理學腫瘤大小
與PTS相比,RTS在整個隊列(S<0.001)和特定的分層分析中顯著高估了腫瘤真實大小(表2)。然而,當分層分析僅限于腫瘤>4 cm的患者時,RTS 與 PTS 相比低估了腫瘤真實大小,在腫瘤>3 cm而≤4 cm的患者差異無統計學意義(P=0.734,表2)。在微乳頭狀生長為主的腺癌(MPA)/以實性生長為主的腺癌(SPA)或鱗狀細胞癌患者中,RTS和PTS之間未觀察到顯著差異。
RTS 和 PTS 之間的差異沒有隨著腫瘤真實大小的變化而改變,未觀察到明顯的模式(圖3)。
 圖3
Bland-Altman 圖用于評估估計的真實腫瘤大小與觀察到的差異之間的相關性
圖3
Bland-Altman 圖用于評估估計的真實腫瘤大小與觀察到的差異之間的相關性
影像學腫瘤大小(RTS)和病理學腫瘤大小(PTS)之間的平均差異在1.4 mm處用紅線表示
2.3 cT與pT分期差異
cT 與 pT 分期的一致率為 65.6%[加權Cohen κ =0.548,95%CI (0.519,0.577)](表3)。9.0%的患者臨床分期低估了病理分期,24.6%的患者臨床分期高估了病理分期(表3)。pT1 和 pT2~4 的準確率分別為 67.9%、49.4%。29.4%的患者臨床分期未能檢測到T4疾病。與此同時,有5例患者最初被分為cT4,但在手術后的評估中被降為T3。
在 logistic 回歸分析中,年齡、GGO、分葉、毛刺、pT 分期和組織學類型與 cT 分期的準確性無顯著相關,而男性及結節內存在空腔是導致 cT分期不準確的獨立危險因素(P=0.002;P< 0.001,表4)。
3 討論
目前,臨床(即影像學)和術后(即病理學)對腫瘤大小的評估之間的相關性仍然存在爭議。最大腫瘤平面上的微小測量差異很可能會改變患者的T分期,而臨床分期對于指導治療策略和預后評價具有重要意義。既往研究[7, 11-13]發現影像學上測量的腫瘤大小會普遍高估腫瘤真實大小。 Lim 等[11]報道,在252例切除的病理性T1或T2腺癌患者中,整體RTS顯著大于PTS(P<0.001)。CT測量反映的是膨脹肺內的腫瘤尺寸,而病理學測量的標本來自塌陷肺組織,這一因素可能導致腫瘤測量體積減小。然而,本研究通過分層分析發現在腫瘤>4 cm的患者中,RTS與PTS相比反而顯著低估了腫瘤大小,這一現象未在其他研究中被發現。我們認為,由于指導后續手術策略的壓力,影像科醫生在進行CT測量時可能偏向保守,特別是對于直徑較大的腫瘤。此外,直徑較大的腫瘤往往形狀更不規則,這可能會增加精確測量的難度。而既往研究未發現該結果的原因可能是納入的隊列例數不足,尤其是結節>4 cm的肺癌患者。本研究共納入1 880例患者,其中155例結節>4 cm,因此足以進行不同腫瘤大小的分層分析。
既往一些研究[9,14-16]報道了臨床分期不準確的情況。高估的臨床T分期可能導致原本可切除腫瘤患者無法接受有潛在治愈可能性的手術,對于腫瘤大小位于閾值邊緣的患者來說更為如此。反之,T分期低估可能會導致患者接受不完全手術切除的風險。在我們的研究中,高達29.4%的患者被發現有未評估到的T4疾病。其中1例被診斷為cT2a,4例診斷為cT3。如前所述,在T2b~4腫瘤患者中,與病理性的PTS相比,RTS低估了腫瘤真實大小,這可能部分解釋了為什么臨床分期沒有檢測到 T4 疾病。Navani 等[9]報道,72例患者最終被診斷為 pT4,而只有2例患者術前被正確分類為 T4。臨床和病理T分期之間的這種差異可能導致不同的治療策略和不完全切除。因此,迫切需要進一步研究提高臨床T分期準確性的方法和技術。本研究通過多因素logistic回歸分析發現肺癌結節內存在空腔是導致臨床T分期不準確的獨立危險因素。因此,影像學醫師應當細致、反復測量存在空腔的肺部結節以提高分期準確性。
綜上所述,RTS與PTS之間的相關性隨實際腫瘤大小而變化。肺癌臨床T分期的準確性仍不令人滿意。外科醫師以及影像學醫師應特別重視對較大直徑腫瘤以及內部存在空腔腫瘤的評估與測量,以避免不準確分期對臨床診治策略的影響。
利益沖突:無。
作者貢獻:周凱、鄧朝強負責數據錄入、數據整理、查閱文獻及文章撰寫;鄧朝強、張揚負責文章內容調整、語言修改、文章總體設想和構思。