引用本文: 劉哲魁, 韓曉帆, 王澤正, 馬文星, 段降龍. 胃癌根治性切除術后感染性并發癥的危險因素分析及預測模型的建立:一項回顧性隊列研究. 中國普外基礎與臨床雜志, 2024, 31(2): 218-224. doi: 10.7507/1007-9424.202309017 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
胃癌是一種常見的消化道惡性腫瘤。國家癌癥中心最新發布,2016年我國胃癌的發病率和死亡率均居全部惡性腫瘤的第3位[1],是嚴重影響人民健康的重要殺手。在胃癌的治療方式中,根治性手術是目前臨床上治療原發性胃癌的首選方案,然而術后較易發生一些以肺部感染為主的感染性并發癥,嚴重影響了患者的短期預后[2]。目前針對胃癌根治性切除術后感染性并發癥發生的預測模型較少,且以往研究集中于檢驗指標對感染性并發癥的影響,較少關注患者的既往史、個人史和手術相關因素。本研究回顧性分析了429例行胃癌根治性切除患者的臨床病理資料,旨在探討發生感染性并發癥的危險因素,并構建列線圖預測模型,以識別高風險患者,有利于臨床醫生及時采取干預措施,預防和改善感染性并發癥的發生與發展。
1 資料與方法
1.1 臨床資料
本研究納入標準:① 術后病理學檢查診斷為原發性胃癌;② 行根治性胃癌切除術;③ 術前未合并其他臟器感染;④ 臨床資料及術后隨訪資料完整。排除標準:① 術前行新輔助及其他方法治療;② 合并其他器官的腫瘤;③ 合并有嚴重的內科疾病;④ 侵犯鄰近臟器或發生遠處轉移。回顧性收集2018年1月至2020年12月期間陜西省人民醫院普外二科收治的429例行根治性胃癌切除術治療的原發性胃癌患者的臨床資料。年齡29~86歲、(62±10)歲;預后營養指數(prognostic nutritional index,PNI)26.30~61.50、44.93±5.99;腫瘤直徑0.5~12.0 cm,中位數為4.00(3.00,5.00)cm;手術時間2.09~11.20 h,中位數為5.25(4.30,6.20)h。其他臨床病理特征見表1。
所有手術均由陜西省人民醫院普外二科手術團隊完成,術者均為副主任醫師或主任醫師。根據術前對腫瘤直徑和部位的評估,依據日本胃癌治療指南,行開放或腹腔鏡輔助下胃癌根治性切除術,吻合方式均為食管-空腸Roux-en-Y吻合術,并肌層加固吻合口。常規留置導尿管,術后1 d內盡早拔除。對于導尿管拔除后出現排尿困難者,熱敷及輕柔按摩下腹部,或應用刺激膀胱收縮藥物,促使患者自行排尿。常規留置胃腸減壓管,在胃腸道功能恢復、肛門排氣后盡早拔除。圍手術期開展健康宣教,有吸煙習慣者,術前2周停止吸煙,通過練習深呼吸和咳嗽增加肺通氣量,排除呼吸道分泌物,以增強肺功能。
1.2 收集指標
收集患者的年齡、性別、近3個月體質量下降、吸煙史、飲酒史、高血壓史、糖尿病史、冠心病史、慢性阻塞性肺疾病史、既往腹部手術史、美國麻醉醫師協會健康狀況(American Society of Anesthesiologists physical status classification,ASA)分級、腫瘤直徑、分化程度、腫瘤TNM分期、手術方式、手術時間、術中出血量等一般臨床資料,同時收集患者術前血液檢查結果,包括術前血清白蛋白量、術前血紅蛋白量、術前中性粒細胞計數、術前淋巴細胞計數、術前單核細胞計數、術前血小板計數、術前癌胚抗原(carcinoembryonic antigen,CEA)、術前糖類抗原199(carbohydrate antigen199,CA199)等相關指標。
PNI值通過公式計算,PNI=術前血清白蛋白量(g/L)+5×術前淋巴細胞計數(109/L)。
1.3 并發癥定義
術后感染包括肺部感染、腹腔感染、切口感染、泌尿系感染等。診斷標準:患者術后30 d內出現的與手術相關的感染性并發癥。
1.3.1 肺部感染
診斷標準[3]為,胸部X線或CT檢查顯示新出現或進展性的浸潤影、實變影或磨玻璃影,加上下列3種臨床癥狀中的2種及以上:① 發熱,體溫>38.0 ℃;② 膿性氣道分泌物;③ 外周血白細胞計數>10×109/L或<4×109/L。
1.3.2 腹腔感染
除腹壁切口以外其他任何腹腔臟器或手術部位存在以下情況之一及以上者[4]:① 出現腹痛、腹膜刺激征或直腸刺激癥狀,伴有發熱(體溫>38.5 ℃)、外周血白細胞計數增高(>15×109/L)、C反應蛋白和(或)降鈣素原升高;② 經腹腔留置的引流管引流出的分泌物為膿性,或通過實驗室檢查、影像學檢查或二次手術后證實有腹腔內感染性病變;③ 有明確感染來源的吻合口漏、腹腔出血或盆腔膿腫等。
1.3.3 切口感染
診斷標準為滿足以下情況之一及以上者[5]:① 感染部位采樣送檢并做細菌培養,G+菌菌落數>104 CFU/mL,G–菌菌落數>105 CFU/mL為陽性;② 體溫升高,手術切口處表現為紅腫熱痛,有滲出物,切口為竇道,疼痛,活動受限;③ 分泌物細菌培養陽性。
1.3.4 泌尿系感染
診斷標準為滿足以下情況之一者[6]:① 無癥狀菌尿:未見典型泌尿系感染的臨床癥狀,尿培養菌落計數≥105 CFU/mL;② 下尿路感染:尿培養菌落計數≥103 CFU/mL或尿培養白細胞計數>10個/mm3,伴有排尿困難、尿頻尿急、恥骨上疼痛、血尿等典型癥狀,但無上尿路感染癥狀;③ 上尿路感染:尿培養菌落計數≥104 CFU/mL或尿培養白細胞計數>10個/mm3,伴發熱、腎區疼痛、乏力、寒戰等臨床癥狀。
1.4 統計學方法
應用IBM SPSS 26.0軟件和R軟件(4.2.1)對數據進行統計學分析。計數資料以例數描述且組間比較采用成組χ2檢驗;服從正態分布的計量資料采用均值±標準差( ±s)描述,服從偏態分布的計量資料以中位數(上、下四分位數)描述。分析胃癌根治術后感染性并發癥發生與其臨床病理特征的關系時,將單因素分析有統計學意義的因素或基于專業知識判斷可能有臨床意義的因素納入進行多因素非條件logistic回歸分析。通過R軟件(4.2.1)構建預測胃癌根治性切除術后感染性并發癥的列線圖,采用受試者工作特征(receiver operating characteristics,ROC)曲線下面積、校準曲線和決策曲線分析(decision curve analysis,DCA)評價模型的預測效果。采用Bootstrap法對模型進行內部驗證。檢驗水準α=0.05。
±s)描述,服從偏態分布的計量資料以中位數(上、下四分位數)描述。分析胃癌根治術后感染性并發癥發生與其臨床病理特征的關系時,將單因素分析有統計學意義的因素或基于專業知識判斷可能有臨床意義的因素納入進行多因素非條件logistic回歸分析。通過R軟件(4.2.1)構建預測胃癌根治性切除術后感染性并發癥的列線圖,采用受試者工作特征(receiver operating characteristics,ROC)曲線下面積、校準曲線和決策曲線分析(decision curve analysis,DCA)評價模型的預測效果。采用Bootstrap法對模型進行內部驗證。檢驗水準α=0.05。
2 結果
2.1 術后感染性并發癥情況
納入的429例胃癌患者中術后發生感染性并發癥86例(20.05%),分別是肺部感染53例、腹腔感染16例、切口感染7例、泌尿系感染10例。其中,3例患者死亡:1例因吻合口漏所致腹腔感染導致全身多器官功能衰竭死亡;1例因肺部感染導致呼吸功能衰竭死亡;1例因腹腔感染引發全身性炎癥反應綜合征,導致呼吸循環功能衰竭死亡。其余患者經抗感染及對癥治療后痊愈。
2.2 術后感染性并發癥相關影響因素的單因素分析
將可能引起胃癌根治性切除術后感染性并發癥的相關因素進行單因素分析,分析結果提示:患者年齡、飲酒史、高血壓史、ASA分級、手術方式、手術時間、術前淋巴細胞計數、術前血清白蛋白量和PNI與胃癌根治性切除術后感染性并發癥的發生有關(P<0.05),具體見表2。
2.3 術后感染性并發癥影響因素的多因素logistic回歸分析
由于PNI是基于術前淋巴細胞計數和術前血清白蛋白量計算而來,為避免多重共線性的問題,未將術前淋巴細胞計數和術前血清白蛋白量納入多因素分析。之后,以單因素分析中有統計學意義的因素或基于專業知識判斷可能有臨床意義的因素為自變量,以是否發生感染性并發癥為響應變量,將年齡、近3個月體質量下降、飲酒史、慢性阻塞性肺疾病史、高血壓史、ASA分級、手術方式、手術時間和PNI作為自變量納入多因素非條件logistic回歸分析,結果提示:低預后營養指數 [OR=0.951,95%CI(0.905,0.999),P=0.044]、手術時間長 [OR=1.274,95%CI(1.069,1.518),P=0.007]、ASA分級Ⅲ~Ⅳ [OR=9.607,95%CI(4.484,20.584),P<0.001]和飲酒史 [OR=3.116,95%CI(1.696,5.726),P<0.001]是感染性并發癥發生的危險因素,見表3。
2.4 構建預測胃癌根治性切除術后感染性并發癥的列線圖模型
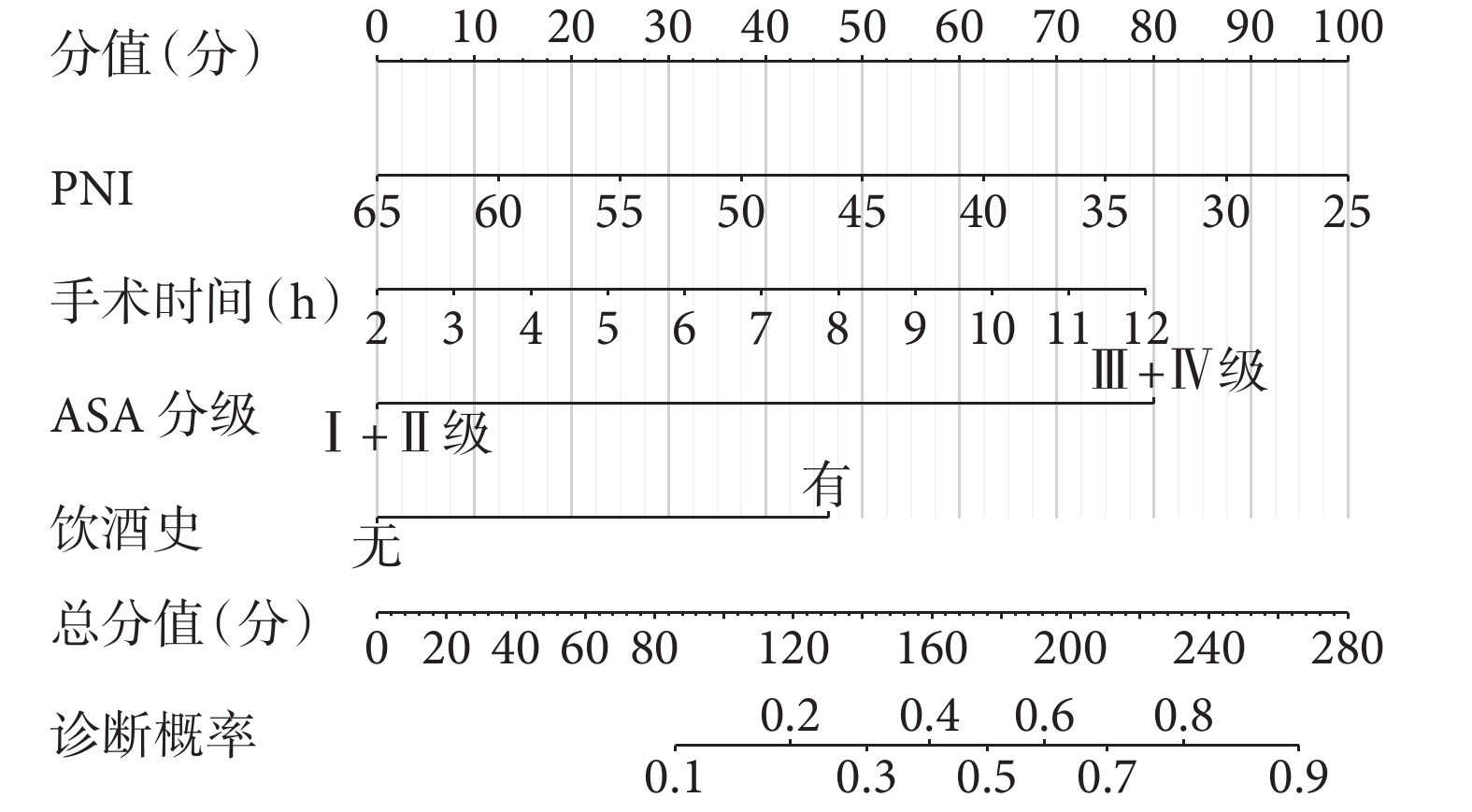
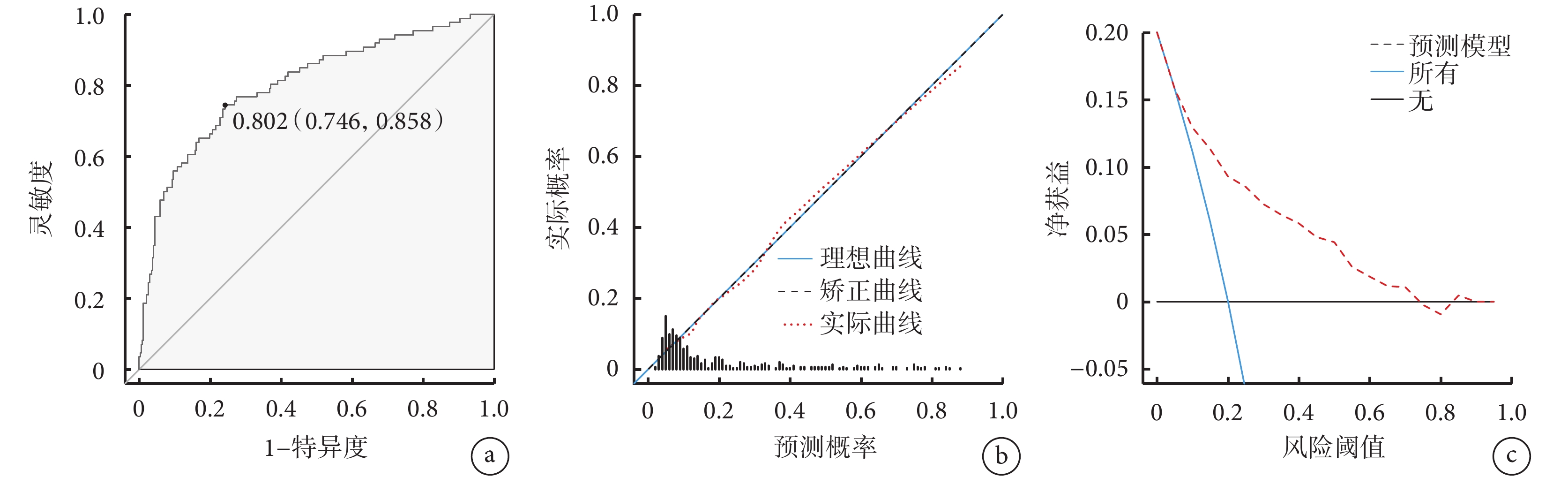
為了方便、直觀地將上述多因素結果應用于臨床實踐,本研究通過納入PNI、手術時間、ASA分級和飲酒史這幾項因素構建了預測胃癌根治性切除術后感染性并發癥的列線圖模型(圖1),以評估胃癌患者術后發生感染性并發癥的風險。該列線圖的ROC線下面積為0.802 [95%CI(0.746,0.858)],敏感度為 74.4%,特異度為 75.8%;校準曲線顯示列線圖預測的胃癌根治性切除術后感染性并發癥發生概率與實際結果具有良好的一致性;DCA顯示列線圖模型在較大的閾值范圍內可獲得臨床收益(圖2)。結果表明,該模型在預測胃癌根治性切除術后感染性并發癥方面具有較好的實用性。
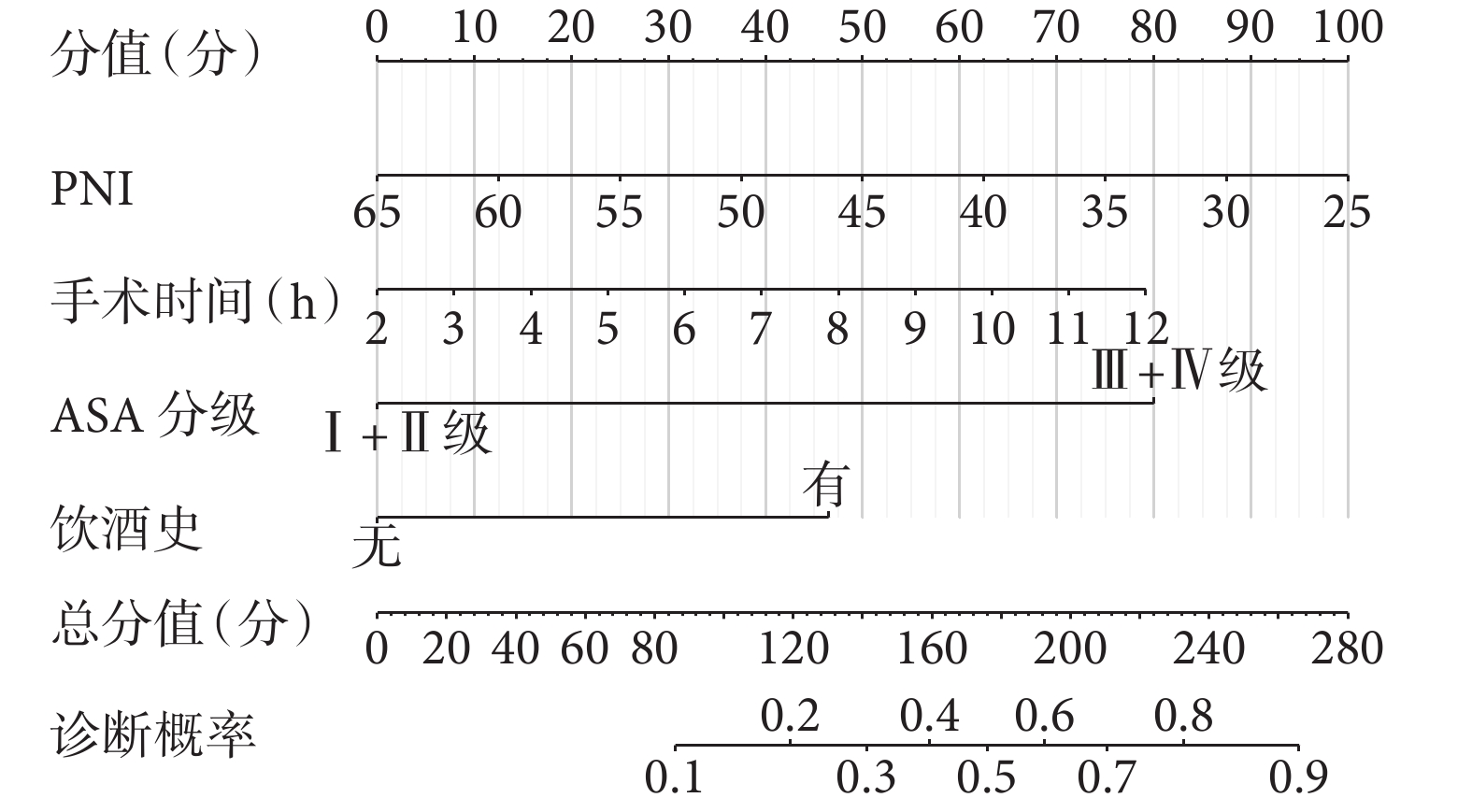 圖1
胃癌根治性切除術后發生感染性并發癥的風險預測列線圖模型
圖1
胃癌根治性切除術后發生感染性并發癥的風險預測列線圖模型
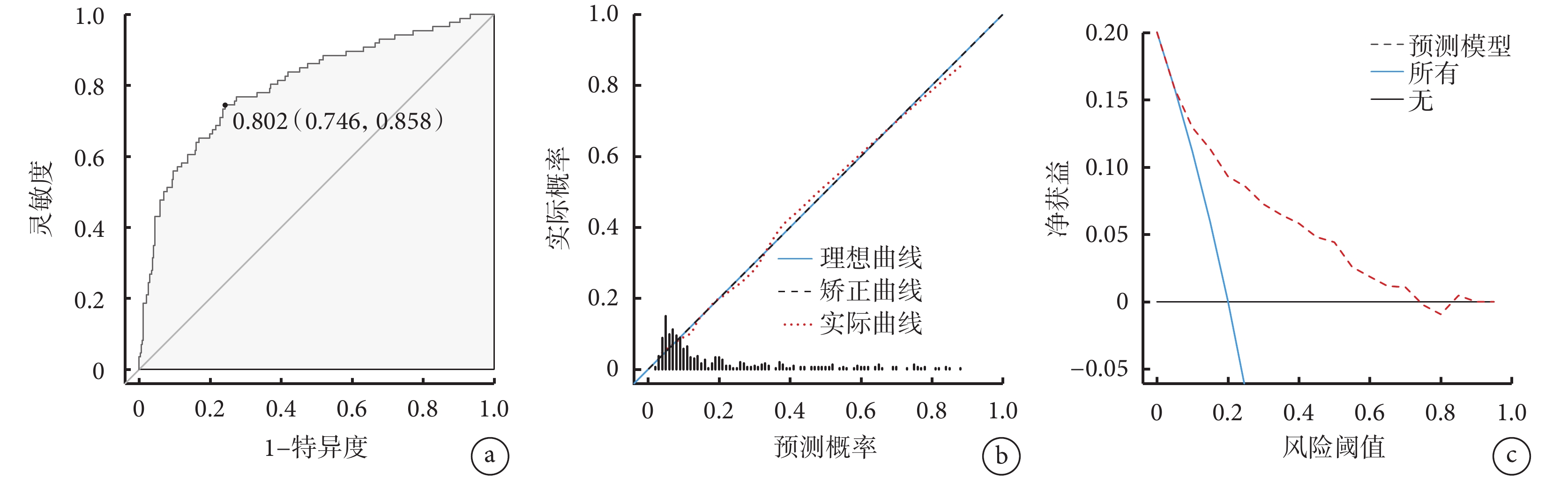 圖2
示列線圖驗證結果
圖2
示列線圖驗證結果
a: ROC曲線;b:校準曲線;c:DCA曲線
3 討論
外科手術仍然是胃癌治療的首選,隨著醫療技術的進步發展,患者的死亡率逐漸降低。然而,胃癌往往伴有區域淋巴結的轉移,根治手術需要進行腫瘤完整切除及淋巴結清掃[7],其操作復雜,時間較長,術后發生感染性并發癥的風險較高。本研究共收集了429例行根治性切除術的胃癌患者,其中86例出現術后感染性并發癥,發生率為20.05%。Martin等[8]的研究中胃癌根治性切除術后感染性并發癥的發生率為24.71%,本研究的術后感染性并發癥發生率稍低,考慮與不同手術團隊以及開展時間段的差異有關,另外本研究樣本量較小也可能導致結果出現一定的偏倚,未來還需要加大樣本量進一步驗證。影響患者術后感染性并發癥發生的因素很多,本研究多因素分析結果表明,PNI、手術時間、ASA分級及飲酒史是胃癌根治性切除術后感染性并發癥發生的影響因素(P<0.05),并依據上述結果建立了列線圖模型,模型預測性能良好,具有較好的實用性。
PNI由術前血清白蛋白水平和外周血淋巴細胞計數兩個重要的營養指標計算而成,是一項用于評估患者營養水平、免疫狀態、預測手術風險以及進行預后判斷的營養篩查工具[9]。白蛋白具有清除自由基、維持膠體滲透壓、改變毛細血管膜通透性、抗凝作用等一系列重要生理功能,在炎癥過程中白蛋白水平趨于下降,低白蛋白血癥通過促進肉芽腫形成和膠原合成來抑制先天免疫反應[10],并且低水平白蛋白對感染及其他術后并發癥的發生更加敏感[11]。淋巴細胞是免疫系統的重要組成部分,是先天性和適應性免疫反應的關鍵參與者。淋巴細胞計數下降后,細胞免疫、體液免疫受損,免疫應答、細胞毒作用、殺傷靶細胞功能降低,產生高親和力抗體減少,從而使感染的風險增大[12]。本研究發現,低水平PNI是胃癌根治性切除術后感染性并發癥的危險因素(OR=0.951,P=0.044)。低水平PNI增加了胃癌根治性切除術后感染性并發癥發生的風險,此結果與Xiao等[13]、Xishan等[14]的結果一致。鑒于此,臨床醫師應在術前充分評估患者營養狀況,對于術前低水平的PNI患者盡早予以調整,從而降低術后感染性并發癥的發生率。
本研究結果顯示,手術時間延長是胃癌根治性切除術后感染性并發癥的危險因素(OR=1.274,P=0.007)。Cheng等[15]研究發現,術后感染發生的可能性隨手術時間的延長而增大。與之類似,Wang等[16]和Shibasaki等[17]的研究表明,手術時間是胃癌根治性切除術后并發癥的影響因素,手術時間越長,術后并發癥發生率越高,并導致術后血清白蛋白和PNI顯著降低。臨床上,手術時間通常與手術復雜程度以及手術切除范圍有著密切關系,比如腫瘤分期晚、腹腔粘連、淋巴結清掃等往往需要更長的手術時間。然而手術時間越長,意味著術中出血量可能越多,導致患者術后貧血,進而影響術后營養和免疫狀況,使發生感染的風險升高。此外,由于手術時間延長伴隨麻醉時間相應延長,從而導致麻醉藥物對機體影響增加,進一步加劇術后感染的風險。因此,主刀醫師要在提高手術熟練度的同時精準評估患者病情,預想到術中可能出現的不同情況,充分做好術前準備,進而控制手術時間,減少術后并發癥的發生。
ASA根據手術患者的體格、全身情況和手術危險性進行分級,被廣泛應用于圍手術期的風險評估[18-20]。劉芯妤等[21]的研究表明,隨著ASA評分的升高,患者手術部位感染發生率逐漸增加。本研究發現,ASA分級(OR=9.607,P<0.001)是胃癌根治性切除術后并發癥發生的影響因素,ASA分級Ⅰ~Ⅱ級患者術后感染性并發癥的發生率小于ASA分級Ⅲ~Ⅳ級患者。可能原因是ASA分級高的患者基礎疾病重,耐受外科創傷的能力降低,心、腦等重要器官的功能下降,無法代償腫瘤或手術帶來的創傷,因此抗感染能力下降,導致術后發生感染性并發癥的風險更高。因此,對于ASA分級Ⅲ~Ⅳ級的患者,臨床醫師術前應積極關注患者全身狀況,針對某些基礎疾病,可以通過多學科會診的方式,及時評估并調整,以期降低術后感染性并發癥的發生風險。
與先前報道的飲酒為術后并發癥發生的高危因素的結論相同[22],本研究logistic多因素分析結果顯示飲酒史也是其危險因素(OR=3.116,P<0.001)。這可以通過免疫系統細胞成分的抑制和延遲型超敏反應的抑制來解釋[23]。對于手術患者,較差的延遲型超敏反應被手術創傷本身進一步抑制,導致術后免疫系統受損。Egholm等[24]的研究發現,術前戒酒可以在一定程度上逆轉飲酒史患者的病理生理過程,術前2周戒酒顯著改善延遲型超敏反應,4周戒酒能逆轉圍手術期出血時間的延長以及手術后的應激反應。因此,對于近期有飲酒史的患者鼓勵戒酒4周后再行胃癌根治性切除術。
在快速康復外科時代,臨床中需要建立一個直觀、便捷、準確的模型用于評估胃癌患者術后感染性并發癥的發生風險,根據結果及時采取干預措施以避免造成嚴重后果,這對于改善胃癌患者的短期預后至關重要。本研究通過整合PNI、手術時間、ASA分級及飲酒史構建的風險預測列線圖模型ROC線下面積為0.802 [95%CI(0.746,0.858)],敏感度為75.8%,特異度為74.4%;校準曲線顯示列線圖預測的胃癌根治性切除術后感染性并發癥發生概率與實際結果具有良好的一致性;DCA顯示列線圖模型在較大的閾值范圍內可獲得臨床收益。
綜上所述,在臨床實踐中,對于感染性并發癥風險較高的患者,應注意戒斷乙醇攝入;圍手術期觀察各項指標的變化,給予適當的營養支持;伴有高血壓、糖尿病、冠心病、慢性阻塞性肺疾病等基礎疾病患者,需控制血壓、血糖趨于穩定狀態并加強其心肺功能;同時術者要提升手術熟練程度以及與助手、器械護士和麻醉醫師的合作默契度,縮短手術時間,從而減少胃癌根治性切除術后感染性并發癥的發生。同時本研究存在一定的局限性:一方面,本研究為單中心回顧性研究,樣本量較少,在一定程度上影響了結果的準確性,有必要在未來的研究中開展多中心研究來驗證結果。另一方面,手術時間在術后獲得,雖然可以通過既往經驗結合術前檢查來評估手術復雜的程度,得到大致的手術時間,但還需要更深入的研究來增加一些相關變量,幫助臨床醫生量化胃癌患者根治性切除術后感染性并發癥的發生風險。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:劉哲魁、段降龍負責開題、課題設計;韓曉帆、王澤正及馬文星負責臨床資料匯總;劉哲魁、王澤正負責論文書寫;劉哲魁、段降龍負責文章的審核校對。
倫理聲明:本研究通過了陜西省人民醫院醫學倫理委員會的審批。
胃癌是一種常見的消化道惡性腫瘤。國家癌癥中心最新發布,2016年我國胃癌的發病率和死亡率均居全部惡性腫瘤的第3位[1],是嚴重影響人民健康的重要殺手。在胃癌的治療方式中,根治性手術是目前臨床上治療原發性胃癌的首選方案,然而術后較易發生一些以肺部感染為主的感染性并發癥,嚴重影響了患者的短期預后[2]。目前針對胃癌根治性切除術后感染性并發癥發生的預測模型較少,且以往研究集中于檢驗指標對感染性并發癥的影響,較少關注患者的既往史、個人史和手術相關因素。本研究回顧性分析了429例行胃癌根治性切除患者的臨床病理資料,旨在探討發生感染性并發癥的危險因素,并構建列線圖預測模型,以識別高風險患者,有利于臨床醫生及時采取干預措施,預防和改善感染性并發癥的發生與發展。
1 資料與方法
1.1 臨床資料
本研究納入標準:① 術后病理學檢查診斷為原發性胃癌;② 行根治性胃癌切除術;③ 術前未合并其他臟器感染;④ 臨床資料及術后隨訪資料完整。排除標準:① 術前行新輔助及其他方法治療;② 合并其他器官的腫瘤;③ 合并有嚴重的內科疾病;④ 侵犯鄰近臟器或發生遠處轉移。回顧性收集2018年1月至2020年12月期間陜西省人民醫院普外二科收治的429例行根治性胃癌切除術治療的原發性胃癌患者的臨床資料。年齡29~86歲、(62±10)歲;預后營養指數(prognostic nutritional index,PNI)26.30~61.50、44.93±5.99;腫瘤直徑0.5~12.0 cm,中位數為4.00(3.00,5.00)cm;手術時間2.09~11.20 h,中位數為5.25(4.30,6.20)h。其他臨床病理特征見表1。
所有手術均由陜西省人民醫院普外二科手術團隊完成,術者均為副主任醫師或主任醫師。根據術前對腫瘤直徑和部位的評估,依據日本胃癌治療指南,行開放或腹腔鏡輔助下胃癌根治性切除術,吻合方式均為食管-空腸Roux-en-Y吻合術,并肌層加固吻合口。常規留置導尿管,術后1 d內盡早拔除。對于導尿管拔除后出現排尿困難者,熱敷及輕柔按摩下腹部,或應用刺激膀胱收縮藥物,促使患者自行排尿。常規留置胃腸減壓管,在胃腸道功能恢復、肛門排氣后盡早拔除。圍手術期開展健康宣教,有吸煙習慣者,術前2周停止吸煙,通過練習深呼吸和咳嗽增加肺通氣量,排除呼吸道分泌物,以增強肺功能。
1.2 收集指標
收集患者的年齡、性別、近3個月體質量下降、吸煙史、飲酒史、高血壓史、糖尿病史、冠心病史、慢性阻塞性肺疾病史、既往腹部手術史、美國麻醉醫師協會健康狀況(American Society of Anesthesiologists physical status classification,ASA)分級、腫瘤直徑、分化程度、腫瘤TNM分期、手術方式、手術時間、術中出血量等一般臨床資料,同時收集患者術前血液檢查結果,包括術前血清白蛋白量、術前血紅蛋白量、術前中性粒細胞計數、術前淋巴細胞計數、術前單核細胞計數、術前血小板計數、術前癌胚抗原(carcinoembryonic antigen,CEA)、術前糖類抗原199(carbohydrate antigen199,CA199)等相關指標。
PNI值通過公式計算,PNI=術前血清白蛋白量(g/L)+5×術前淋巴細胞計數(109/L)。
1.3 并發癥定義
術后感染包括肺部感染、腹腔感染、切口感染、泌尿系感染等。診斷標準:患者術后30 d內出現的與手術相關的感染性并發癥。
1.3.1 肺部感染
診斷標準[3]為,胸部X線或CT檢查顯示新出現或進展性的浸潤影、實變影或磨玻璃影,加上下列3種臨床癥狀中的2種及以上:① 發熱,體溫>38.0 ℃;② 膿性氣道分泌物;③ 外周血白細胞計數>10×109/L或<4×109/L。
1.3.2 腹腔感染
除腹壁切口以外其他任何腹腔臟器或手術部位存在以下情況之一及以上者[4]:① 出現腹痛、腹膜刺激征或直腸刺激癥狀,伴有發熱(體溫>38.5 ℃)、外周血白細胞計數增高(>15×109/L)、C反應蛋白和(或)降鈣素原升高;② 經腹腔留置的引流管引流出的分泌物為膿性,或通過實驗室檢查、影像學檢查或二次手術后證實有腹腔內感染性病變;③ 有明確感染來源的吻合口漏、腹腔出血或盆腔膿腫等。
1.3.3 切口感染
診斷標準為滿足以下情況之一及以上者[5]:① 感染部位采樣送檢并做細菌培養,G+菌菌落數>104 CFU/mL,G–菌菌落數>105 CFU/mL為陽性;② 體溫升高,手術切口處表現為紅腫熱痛,有滲出物,切口為竇道,疼痛,活動受限;③ 分泌物細菌培養陽性。
1.3.4 泌尿系感染
診斷標準為滿足以下情況之一者[6]:① 無癥狀菌尿:未見典型泌尿系感染的臨床癥狀,尿培養菌落計數≥105 CFU/mL;② 下尿路感染:尿培養菌落計數≥103 CFU/mL或尿培養白細胞計數>10個/mm3,伴有排尿困難、尿頻尿急、恥骨上疼痛、血尿等典型癥狀,但無上尿路感染癥狀;③ 上尿路感染:尿培養菌落計數≥104 CFU/mL或尿培養白細胞計數>10個/mm3,伴發熱、腎區疼痛、乏力、寒戰等臨床癥狀。
1.4 統計學方法
應用IBM SPSS 26.0軟件和R軟件(4.2.1)對數據進行統計學分析。計數資料以例數描述且組間比較采用成組χ2檢驗;服從正態分布的計量資料采用均值±標準差( ±s)描述,服從偏態分布的計量資料以中位數(上、下四分位數)描述。分析胃癌根治術后感染性并發癥發生與其臨床病理特征的關系時,將單因素分析有統計學意義的因素或基于專業知識判斷可能有臨床意義的因素納入進行多因素非條件logistic回歸分析。通過R軟件(4.2.1)構建預測胃癌根治性切除術后感染性并發癥的列線圖,采用受試者工作特征(receiver operating characteristics,ROC)曲線下面積、校準曲線和決策曲線分析(decision curve analysis,DCA)評價模型的預測效果。采用Bootstrap法對模型進行內部驗證。檢驗水準α=0.05。
±s)描述,服從偏態分布的計量資料以中位數(上、下四分位數)描述。分析胃癌根治術后感染性并發癥發生與其臨床病理特征的關系時,將單因素分析有統計學意義的因素或基于專業知識判斷可能有臨床意義的因素納入進行多因素非條件logistic回歸分析。通過R軟件(4.2.1)構建預測胃癌根治性切除術后感染性并發癥的列線圖,采用受試者工作特征(receiver operating characteristics,ROC)曲線下面積、校準曲線和決策曲線分析(decision curve analysis,DCA)評價模型的預測效果。采用Bootstrap法對模型進行內部驗證。檢驗水準α=0.05。
2 結果
2.1 術后感染性并發癥情況
納入的429例胃癌患者中術后發生感染性并發癥86例(20.05%),分別是肺部感染53例、腹腔感染16例、切口感染7例、泌尿系感染10例。其中,3例患者死亡:1例因吻合口漏所致腹腔感染導致全身多器官功能衰竭死亡;1例因肺部感染導致呼吸功能衰竭死亡;1例因腹腔感染引發全身性炎癥反應綜合征,導致呼吸循環功能衰竭死亡。其余患者經抗感染及對癥治療后痊愈。
2.2 術后感染性并發癥相關影響因素的單因素分析
將可能引起胃癌根治性切除術后感染性并發癥的相關因素進行單因素分析,分析結果提示:患者年齡、飲酒史、高血壓史、ASA分級、手術方式、手術時間、術前淋巴細胞計數、術前血清白蛋白量和PNI與胃癌根治性切除術后感染性并發癥的發生有關(P<0.05),具體見表2。
2.3 術后感染性并發癥影響因素的多因素logistic回歸分析
由于PNI是基于術前淋巴細胞計數和術前血清白蛋白量計算而來,為避免多重共線性的問題,未將術前淋巴細胞計數和術前血清白蛋白量納入多因素分析。之后,以單因素分析中有統計學意義的因素或基于專業知識判斷可能有臨床意義的因素為自變量,以是否發生感染性并發癥為響應變量,將年齡、近3個月體質量下降、飲酒史、慢性阻塞性肺疾病史、高血壓史、ASA分級、手術方式、手術時間和PNI作為自變量納入多因素非條件logistic回歸分析,結果提示:低預后營養指數 [OR=0.951,95%CI(0.905,0.999),P=0.044]、手術時間長 [OR=1.274,95%CI(1.069,1.518),P=0.007]、ASA分級Ⅲ~Ⅳ [OR=9.607,95%CI(4.484,20.584),P<0.001]和飲酒史 [OR=3.116,95%CI(1.696,5.726),P<0.001]是感染性并發癥發生的危險因素,見表3。
2.4 構建預測胃癌根治性切除術后感染性并發癥的列線圖模型
為了方便、直觀地將上述多因素結果應用于臨床實踐,本研究通過納入PNI、手術時間、ASA分級和飲酒史這幾項因素構建了預測胃癌根治性切除術后感染性并發癥的列線圖模型(圖1),以評估胃癌患者術后發生感染性并發癥的風險。該列線圖的ROC線下面積為0.802 [95%CI(0.746,0.858)],敏感度為 74.4%,特異度為 75.8%;校準曲線顯示列線圖預測的胃癌根治性切除術后感染性并發癥發生概率與實際結果具有良好的一致性;DCA顯示列線圖模型在較大的閾值范圍內可獲得臨床收益(圖2)。結果表明,該模型在預測胃癌根治性切除術后感染性并發癥方面具有較好的實用性。
 圖1
胃癌根治性切除術后發生感染性并發癥的風險預測列線圖模型
圖1
胃癌根治性切除術后發生感染性并發癥的風險預測列線圖模型
 圖2
示列線圖驗證結果
圖2
示列線圖驗證結果
a: ROC曲線;b:校準曲線;c:DCA曲線
3 討論
外科手術仍然是胃癌治療的首選,隨著醫療技術的進步發展,患者的死亡率逐漸降低。然而,胃癌往往伴有區域淋巴結的轉移,根治手術需要進行腫瘤完整切除及淋巴結清掃[7],其操作復雜,時間較長,術后發生感染性并發癥的風險較高。本研究共收集了429例行根治性切除術的胃癌患者,其中86例出現術后感染性并發癥,發生率為20.05%。Martin等[8]的研究中胃癌根治性切除術后感染性并發癥的發生率為24.71%,本研究的術后感染性并發癥發生率稍低,考慮與不同手術團隊以及開展時間段的差異有關,另外本研究樣本量較小也可能導致結果出現一定的偏倚,未來還需要加大樣本量進一步驗證。影響患者術后感染性并發癥發生的因素很多,本研究多因素分析結果表明,PNI、手術時間、ASA分級及飲酒史是胃癌根治性切除術后感染性并發癥發生的影響因素(P<0.05),并依據上述結果建立了列線圖模型,模型預測性能良好,具有較好的實用性。
PNI由術前血清白蛋白水平和外周血淋巴細胞計數兩個重要的營養指標計算而成,是一項用于評估患者營養水平、免疫狀態、預測手術風險以及進行預后判斷的營養篩查工具[9]。白蛋白具有清除自由基、維持膠體滲透壓、改變毛細血管膜通透性、抗凝作用等一系列重要生理功能,在炎癥過程中白蛋白水平趨于下降,低白蛋白血癥通過促進肉芽腫形成和膠原合成來抑制先天免疫反應[10],并且低水平白蛋白對感染及其他術后并發癥的發生更加敏感[11]。淋巴細胞是免疫系統的重要組成部分,是先天性和適應性免疫反應的關鍵參與者。淋巴細胞計數下降后,細胞免疫、體液免疫受損,免疫應答、細胞毒作用、殺傷靶細胞功能降低,產生高親和力抗體減少,從而使感染的風險增大[12]。本研究發現,低水平PNI是胃癌根治性切除術后感染性并發癥的危險因素(OR=0.951,P=0.044)。低水平PNI增加了胃癌根治性切除術后感染性并發癥發生的風險,此結果與Xiao等[13]、Xishan等[14]的結果一致。鑒于此,臨床醫師應在術前充分評估患者營養狀況,對于術前低水平的PNI患者盡早予以調整,從而降低術后感染性并發癥的發生率。
本研究結果顯示,手術時間延長是胃癌根治性切除術后感染性并發癥的危險因素(OR=1.274,P=0.007)。Cheng等[15]研究發現,術后感染發生的可能性隨手術時間的延長而增大。與之類似,Wang等[16]和Shibasaki等[17]的研究表明,手術時間是胃癌根治性切除術后并發癥的影響因素,手術時間越長,術后并發癥發生率越高,并導致術后血清白蛋白和PNI顯著降低。臨床上,手術時間通常與手術復雜程度以及手術切除范圍有著密切關系,比如腫瘤分期晚、腹腔粘連、淋巴結清掃等往往需要更長的手術時間。然而手術時間越長,意味著術中出血量可能越多,導致患者術后貧血,進而影響術后營養和免疫狀況,使發生感染的風險升高。此外,由于手術時間延長伴隨麻醉時間相應延長,從而導致麻醉藥物對機體影響增加,進一步加劇術后感染的風險。因此,主刀醫師要在提高手術熟練度的同時精準評估患者病情,預想到術中可能出現的不同情況,充分做好術前準備,進而控制手術時間,減少術后并發癥的發生。
ASA根據手術患者的體格、全身情況和手術危險性進行分級,被廣泛應用于圍手術期的風險評估[18-20]。劉芯妤等[21]的研究表明,隨著ASA評分的升高,患者手術部位感染發生率逐漸增加。本研究發現,ASA分級(OR=9.607,P<0.001)是胃癌根治性切除術后并發癥發生的影響因素,ASA分級Ⅰ~Ⅱ級患者術后感染性并發癥的發生率小于ASA分級Ⅲ~Ⅳ級患者。可能原因是ASA分級高的患者基礎疾病重,耐受外科創傷的能力降低,心、腦等重要器官的功能下降,無法代償腫瘤或手術帶來的創傷,因此抗感染能力下降,導致術后發生感染性并發癥的風險更高。因此,對于ASA分級Ⅲ~Ⅳ級的患者,臨床醫師術前應積極關注患者全身狀況,針對某些基礎疾病,可以通過多學科會診的方式,及時評估并調整,以期降低術后感染性并發癥的發生風險。
與先前報道的飲酒為術后并發癥發生的高危因素的結論相同[22],本研究logistic多因素分析結果顯示飲酒史也是其危險因素(OR=3.116,P<0.001)。這可以通過免疫系統細胞成分的抑制和延遲型超敏反應的抑制來解釋[23]。對于手術患者,較差的延遲型超敏反應被手術創傷本身進一步抑制,導致術后免疫系統受損。Egholm等[24]的研究發現,術前戒酒可以在一定程度上逆轉飲酒史患者的病理生理過程,術前2周戒酒顯著改善延遲型超敏反應,4周戒酒能逆轉圍手術期出血時間的延長以及手術后的應激反應。因此,對于近期有飲酒史的患者鼓勵戒酒4周后再行胃癌根治性切除術。
在快速康復外科時代,臨床中需要建立一個直觀、便捷、準確的模型用于評估胃癌患者術后感染性并發癥的發生風險,根據結果及時采取干預措施以避免造成嚴重后果,這對于改善胃癌患者的短期預后至關重要。本研究通過整合PNI、手術時間、ASA分級及飲酒史構建的風險預測列線圖模型ROC線下面積為0.802 [95%CI(0.746,0.858)],敏感度為75.8%,特異度為74.4%;校準曲線顯示列線圖預測的胃癌根治性切除術后感染性并發癥發生概率與實際結果具有良好的一致性;DCA顯示列線圖模型在較大的閾值范圍內可獲得臨床收益。
綜上所述,在臨床實踐中,對于感染性并發癥風險較高的患者,應注意戒斷乙醇攝入;圍手術期觀察各項指標的變化,給予適當的營養支持;伴有高血壓、糖尿病、冠心病、慢性阻塞性肺疾病等基礎疾病患者,需控制血壓、血糖趨于穩定狀態并加強其心肺功能;同時術者要提升手術熟練程度以及與助手、器械護士和麻醉醫師的合作默契度,縮短手術時間,從而減少胃癌根治性切除術后感染性并發癥的發生。同時本研究存在一定的局限性:一方面,本研究為單中心回顧性研究,樣本量較少,在一定程度上影響了結果的準確性,有必要在未來的研究中開展多中心研究來驗證結果。另一方面,手術時間在術后獲得,雖然可以通過既往經驗結合術前檢查來評估手術復雜的程度,得到大致的手術時間,但還需要更深入的研究來增加一些相關變量,幫助臨床醫生量化胃癌患者根治性切除術后感染性并發癥的發生風險。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:劉哲魁、段降龍負責開題、課題設計;韓曉帆、王澤正及馬文星負責臨床資料匯總;劉哲魁、王澤正負責論文書寫;劉哲魁、段降龍負責文章的審核校對。
倫理聲明:本研究通過了陜西省人民醫院醫學倫理委員會的審批。