治療二尖瓣反流(mitral regurgitation,MR)的經導管緣對緣修復技術(transcatheter edge-to-edge repair,TEER)稱為M-TEER。其具有靶點精確、植入物少;原理簡單,容易經導管實現;醫學原理可靠,以不變應萬變的優勢;并且TEER相對于外科緣對緣修復(surgical edge-to-edge repair, SEER)更有術中實時評估療效和血流動力學的優勢。對于退行性二尖瓣反流患者,M-TEER應該追求更完美的手術效果,使M-TEER術后即刻MR 0~1+,而對于功能性二尖瓣反流,M-TEER允許中度殘余分流或者輕度壓差,不影響患者預后并且降低并發癥幾率。
引用本文: 潘文志, 龍愉良, 周達新, 葛均波. 經導管二尖瓣緣對緣修復:當前認識與策略原則. 中國胸心血管外科臨床雜志, 2024, 31(2): 181-185. doi: 10.7507/1007-4848.202311008 復制
版權信息: ?四川大學華西醫院華西期刊社《中國胸心血管外科臨床雜志》版權所有,未經授權不得轉載、改編
經導管緣對緣修復(transcatheter edge-to-edge repair,TEER)是繼經導管主動脈瓣置換(transcatheter aortic valve replacement,TAVR)之后結構性心臟病最熱門的技術,目前已經在全世界逐漸推廣,成為二尖瓣反流(mitral regurgitation,MR)及三尖瓣反流相對成熟的介入治療技術[1-4],其中用于治療MR的TEER技術稱為M-TEER。隨著器械的改進、研究進展及使用經驗的積累,業界對M-TEER的認識也逐漸加深。本文將從TEER技術的優劣性,外科緣對緣修復(surgical edge-to-edge repair,SEER)研究及其啟示,TEER治療退行性二尖瓣反流(degenerate mitral regurgitation,DMR)和功能性二尖瓣反流(functional mitral regurgitation,FMR)手術策略的側重角度等方面進行闡述。
1 經導管緣對緣修復技術的優劣
我們在國內首次定義M-TEER:其是一項基于SEER的經導管介入技術,采用二尖瓣夾合裝置,經股靜脈或心尖途徑植入,在超聲及X線引導下夾住MR區的前、后瓣葉并使之接合,使心臟收縮期時瓣葉之間間隙減少或消失,而舒張期時瓣口變成雙孔或多孔,從而減少或消除MR[5]。TEER按照手術路徑可以分為經股靜脈入路TEER和經心尖入路TEER,其鎖定裝置包括自鎖定、機械鎖定和閉合環鎖定3種[5-8]。
20多年來,10余種二尖瓣介入技術路線相繼進入研發及臨床試驗,但目前只有TEER真正成熟應用于臨床,被指南[1-2]推薦用于外科手術高風險或不能耐受外科手術的患者(對于合并主動脈瓣疾病患者推薦TAVR+TEER),說明TEER最具有優勢,是外科技術中最適合導管化的技術路線。早在1998年,文獻[9]報道SEER是非常適合導管化的外科二尖瓣治療技術。TEER的優點在于:(1)靶點精確、植入物少:二尖瓣夾子幾乎只作用于病變部位,沒有太多附屬結構,不會對心臟其他組織結構及功能形成干擾,這相對其他二尖瓣介入器械有明顯優勢。(2)原理簡單,容易經導管實現。SEER把病變瓣葉和對側瓣葉縫合,僅需要數個墊片縫合幾針即可完成。這種簡單方式使得該技術容易通過導管實現操作。同時,瓣葉所在心腔的空間相對開闊,器械在心房內進行調彎等容易實現。(3)醫學原理可靠,以不變應萬變。SEER一開始是在其他外科修復技術無效情況下作為后補技術。因此,無論是簡單病變還是復雜病變,均可使用SEER或TEER進行治療。
然而, SEER在目前實際臨床上卻較少應用,這是因為SEER或多或少會引起瓣口狹窄[10],而外科發明了一些更好的修復技術如腱索植入、瓣葉切除、瓣葉延長技術等,這些技術在有效治療反流同時不會引起瓣口狹窄,因此替代了SEER[11]。但這并不意味著SEER效果不好或者是SEER對復雜的病變沒效果,只能說是一個“優中選優”的結果。然而,TEER又不完全等同于SEER,甚至有超越SEER的可能。外科手術是在心臟停跳情況下進行,手術效果無法實時、真實地驗證,即使是使用術中注水試驗作為驗證手段,還是無法真正模擬復跳后心臟血流動力學情況。而TEER技術是在心臟跳動、實時超聲引導下進行,可以通過精細的反復調節夾合位置及深度,即刻驗證并優化手術效果,這一點是SEER無法比擬的。SEER的優勢在于可以聯合瓣環成形,保證其遠期效果[12]。然而,這是個雙刃劍,聯合瓣環成形勢必明顯減小瓣口面積(導致瓣口面積<1.5 cm2),這是外科修復不首選SEER的重要原因[12-13];而不聯合瓣環成形,可以保留更多瓣口面積,因此實踐中,TEER術后嚴重瓣膜狹窄情況非常少見[14-15]。另外,瓣環成形主要是在于預防房性功能性二尖瓣反流(atrial functional mitral regurgitation,AFMR)(指不合并左心室功能不全的心房顫動或左心室射血分數保留心力衰竭等相關的繼發性二尖瓣反流[16])發生,以及出現新的脫垂之后起緩沖保護作用,但這兩種情況可以通過管理心房顫動以及對新的脫垂干預來補救[17]。關于夾子周圍是否有瓣葉僵硬、微損傷而導致新的反流產生,已被多項病理學研究[18-20]否定。
2 外科緣對緣修復研究及其啟示
在一項單純SEER的研究 (沒有同期植入成形環)中[9],共納入81例患者,大部分患者為存在瓣膜及其附屬結構器質性病變的MR即DMR,經過4年隨訪,總體上,89.0%±3.9%患者無需再手術;術后殘余MR 0~1+患者,94.0%±5.8%患者無需再手術,術后遠期耐久性良好;而術后殘余MR 2+ 以上的,無需再手術率為67.0%±32.7%。研究[9]還顯示瓣環有鈣化者(n=32)二次手術概率高于瓣環無鈣化患者(n=49),說明單純SEER效果相較于SEER合并瓣環修復效果是欠佳的,尤其是對于有瓣環鈣化、風濕性瓣膜改變等的患者;12例交界區附近病變的患者無1例復發,這提示交界區TEER長期療效可能更好,并且對瓣口影響更小。
另外一項對139例DMR患者行SEER(均聯合放置成形環)的長期隨訪研究[12]顯示,第17年,患者免于復發(MR≤3+)的比率為80.2%±5.86%,免于再手術的概率為89.6%±2.74%。該結果顯示其遠期耐久性不亞于外科修復。多元回歸分析顯示,術后MR>1+是MR復發的最強預測因素(HR=7.4)。
一項對305例DMR行外科二尖瓣修復患者的長期年隨訪研究[21]顯示,10年時術后MR 0+級和1+級患者免于再手術的概率相近(94% vs. 90%),明顯高于MR 2+患者(56%)。有無成形環患者術后進展至中度以上MR有明顯差異[21]。這個研究是針對所有外科修復技術患者,其結論和另外一個對SEER長期隨訪研究一致,也是顯示術后即刻MR 0~1+,應用成形環,是長期良好效果預測因素[13];研究[21]同時也顯示,交界區患者SEER效果更好,中期隨訪幾乎無復發。
以上這些外科研究對于TEER策略的啟示:對于DMR患者,應該追求更完美的手術效果,使得術后即刻MR 0~1+;其次,應該選擇瓣環擴大不明顯患者,由于TEER不聯合瓣環成形術,可以預料到瓣環擴大明顯患者長期預后較差;非中央區的患者,特別是交界區患者,受到遠期瓣環擴大導致復發影響小,效果更好,并且對瓣口面積影響小,從長期預后看,反而是TEER合適人群,當然這些患者TEER手術難度是增加的。
3 退行性二尖瓣反流手術策略
Sugiura 等[22]將TEER術后反流復發歸納為4個機制,包括夾合裝置單邊脫落、瓣葉從夾合裝置部分滑出(夾合裝置尚未脫落)、瓣葉撕裂以及心臟功能性改變(瓣環擴大、心室擴大導致腱索拴系等)。筆者認為,長期來講,還可能包括新發瓣葉病變,如新發脫垂、腱索斷裂等[23],但這相對少見。另有研究[21]顯示,術后即刻MR≥2+是反流復發預測因素。這一點和前文所述外科結果一致;殘余分流≥2+對DMR患者TEER術后遠期預后有明顯影響,這點也被其他研究[24-26]證實。因此,對于DMR患者行TEER,應該追求更完美的即刻效果,使得術后即刻MR≤1+。
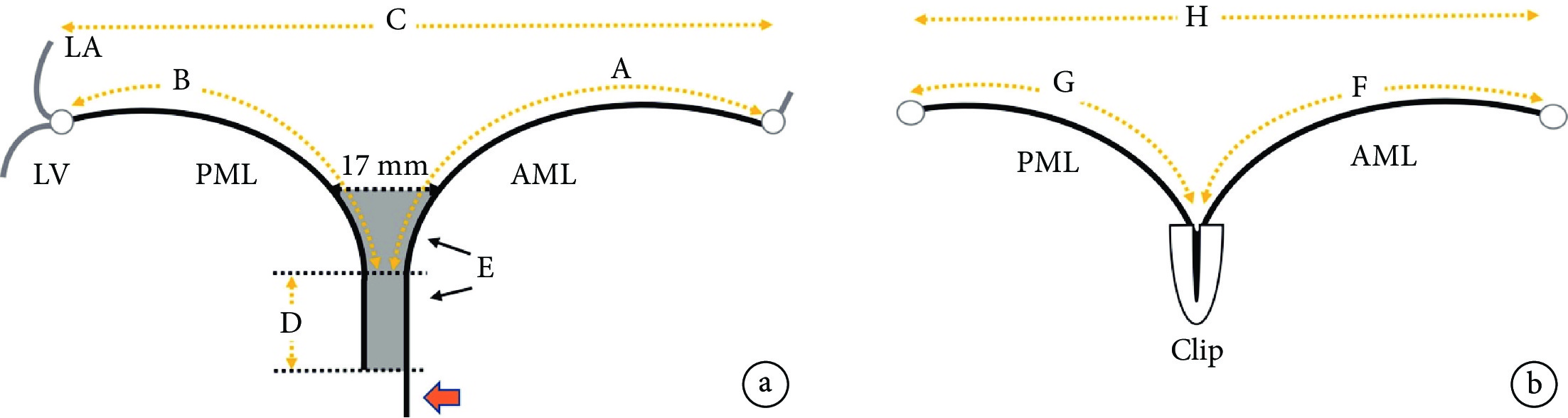
有研究者[25]提出了對合緣增強指數(augmentation in coaptation)的概念,對合增強指數= (A+B)–(G+F),實際上就是等于瓣葉被夾子額外夾進去的瓣葉長度總和(需要去掉17 mm的自然對合)(圖1)。此研究納入183例患者,大多數為DMR患者。研究[27]顯示,該指數是患者手術效果最強力預測因素[受試者工作特征曲線下面積(AUC)=0.9 ]。患者殘余分流0~1+,對合緣增強指數為7.3 mm;術后殘余分流≥2+,對合緣增強指數為3.0 mm。同時,術后即刻二尖瓣瓣環面積縮小也是即刻效果預測因素[27]。此研究提示,在不引起瓣葉撕裂的前提下,應該盡量多地夾合更多瓣葉,這樣可以增加夾子兩邊瓣葉的對合,同時一定程度縮小或者預防瓣環擴張,保證長期效果。這也是在DMR患者中,MitraClip XTR往往效果更好的原因。這也可能是TEER和SEER一個差別點,SEER術中無法反復調整對合量,并且是否可以達到TEER這樣高度的對合不得而知。實際上,世界上完成SEER手術量很少,僅有少數幾個醫生有相關經驗,如何提高SEER療效還沒被研究清楚;相反,如何提高TEER近遠期療效將在今后被全世界廣大醫生聯合充分研究清楚,TEER療效有望優于SEER。
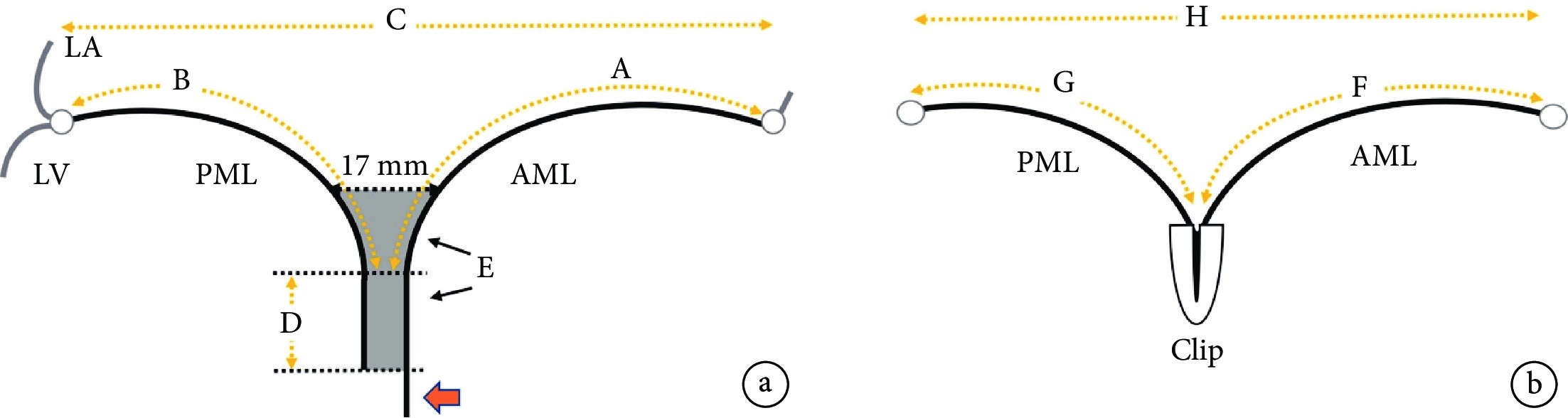 圖1
對合緣增強指數示意圖[27]
圖1
對合緣增強指數示意圖[27]
a:基線狀態參數;b:TEER術后參數;LA:左心房;LV:左心室;PML:二尖瓣后葉;AML:二尖瓣前葉;Clip:二尖瓣夾子;A:二尖瓣前葉減去前后瓣葉對合長度;B:二尖瓣后葉減去前后瓣葉對合長度;C:基線二尖瓣長軸長度;D:二尖瓣前后瓣葉對合長度;E:夾子可以夾合瓣葉的區域;F:TEER術后夾子以外的二尖瓣前葉長度;G:TEER術后夾子以外的二尖瓣后葉長度;H:TEER術后二尖瓣長軸長度;紅色箭頭:瓣葉超出對合部分;對合增強指數= (A+B)–(G+F)
對于DMR患者TEER術后產生的高跨瓣壓差(平均壓差≥5 mm Hg)是否引起患者心力衰竭導致再住院、影響患者運動能力,不同研究有差異,但總體上還是傾向于有影響。Koell等[28]的研究顯示,術后高跨瓣壓差患者6分鐘步行距離未改善,再住院發生率高,死亡率也有增高趨勢(P=0.09)。美國經導管心臟瓣膜介入治療注冊研究(TVT)20 000例DMR患者的隨訪研究顯示,TEER術后高跨瓣壓差對死亡率無影響,但對再住院有明顯影響,術后輕度或無MR但壓差5~10 mm Hg的患者再住院率高于術后中度MR患者,盡管兩者生存率無差異,但這提示術后高跨瓣壓差影響大于中度反流。然而,另外一項研究[29]結論不同,提示術后中度的殘余反流影響大于高跨瓣壓差。
綜上所述,筆者對于DMR患者的TEER手術策略建議為:(1)長驅直入:在不引起瓣葉撕裂、瓣膜狹窄情況下盡量多夾瓣葉,尤其是病變側的瓣葉,保證即刻及遠期效果;(2)斬草除根:盡量夾掉脫垂瓣葉,保證遠期效果,有時需要補充二夾;(3)盡善盡美:反復嘗試,盡量把反流減低到0~1+,保證遠期效果;(4)避免狹窄:術后高跨瓣壓差對患者預后有影響,應該盡量避免。
4 功能性二尖瓣反流手術策略
對于FMR(沒有瓣膜及其附屬結構器質性病變,而主要由心房心室擴張引起二尖瓣瓣環擴大導致MR)患者,在TEER策略上與DMR患者可能有較大區別。并且,外科手術在這方面經驗也較缺乏,無論是AFMR或者是室性功能性二尖瓣反流(ventricular functional mitral regurgitation,VFMR),目前瓣膜指南[1-2]僅把外科手術作為ⅡB類的推薦。研究[30]顯示,對于FMR患者,術后MR 1+與2+患者預后無差異,但明顯優于MR≥3+者。另外一項研[31]究顯示,FMR患者術后MR 1+與2+患者預后差異多見于左心不擴大、右心功能良好患者,對于左心已經擴大或者有心功能不良者兩者無差異。研究[28, 32]認為FMR術后高跨瓣壓差對患者的預后及癥狀均無影響。
綜上所述,建議FMR患者TEER手術策略:適可而止,不求完美,允許中度殘余分流,或者輕度壓差,這并不影響患者預后和癥狀,同時這個策略可以避免過多操作導致并發癥發生,并縮短手術時間。但AFMR這個特殊類型患者是否另有差別,目前還不得而知。其實,根據Frank-Staring機制,適當殘余分流可以保持一定左心室舒張末期壓力,防止術后低心排血量發生,從某種意義上對心臟功能低下者是個保護因素。
5 總結
M-TERR的原理來自于SEER技術,雖然SEER技術在外科少用,并不說明SEER技術無用,而是一種優中選優的結果。SEER技術靶點精確,對周圍組織干擾少,技術原理簡單,是一種最適合導管化的外科技術。TEER來源于SEER,但是在某些方面相對SEER有優勢,可以術中通過精確夾合、動態觀察提高效果,可以通過全世界大樣本臨床研究及器械改進提升技術,可能達到青出于藍而勝于藍。DMR患者TEER 手術策略為盡善盡美,盡量即刻MR≤1+,無顯著跨瓣壓差,消除病變瓣葉;而FMR患者則策略是不求完美,可容許一定的殘余分流及適當跨瓣壓差。
利益沖突:無。
作者貢獻:潘文志撰寫初稿、修改論文;龍愉良查資料,參與初稿撰寫;周達新與葛均波提出想法,修改論文。
經導管緣對緣修復(transcatheter edge-to-edge repair,TEER)是繼經導管主動脈瓣置換(transcatheter aortic valve replacement,TAVR)之后結構性心臟病最熱門的技術,目前已經在全世界逐漸推廣,成為二尖瓣反流(mitral regurgitation,MR)及三尖瓣反流相對成熟的介入治療技術[1-4],其中用于治療MR的TEER技術稱為M-TEER。隨著器械的改進、研究進展及使用經驗的積累,業界對M-TEER的認識也逐漸加深。本文將從TEER技術的優劣性,外科緣對緣修復(surgical edge-to-edge repair,SEER)研究及其啟示,TEER治療退行性二尖瓣反流(degenerate mitral regurgitation,DMR)和功能性二尖瓣反流(functional mitral regurgitation,FMR)手術策略的側重角度等方面進行闡述。
1 經導管緣對緣修復技術的優劣
我們在國內首次定義M-TEER:其是一項基于SEER的經導管介入技術,采用二尖瓣夾合裝置,經股靜脈或心尖途徑植入,在超聲及X線引導下夾住MR區的前、后瓣葉并使之接合,使心臟收縮期時瓣葉之間間隙減少或消失,而舒張期時瓣口變成雙孔或多孔,從而減少或消除MR[5]。TEER按照手術路徑可以分為經股靜脈入路TEER和經心尖入路TEER,其鎖定裝置包括自鎖定、機械鎖定和閉合環鎖定3種[5-8]。
20多年來,10余種二尖瓣介入技術路線相繼進入研發及臨床試驗,但目前只有TEER真正成熟應用于臨床,被指南[1-2]推薦用于外科手術高風險或不能耐受外科手術的患者(對于合并主動脈瓣疾病患者推薦TAVR+TEER),說明TEER最具有優勢,是外科技術中最適合導管化的技術路線。早在1998年,文獻[9]報道SEER是非常適合導管化的外科二尖瓣治療技術。TEER的優點在于:(1)靶點精確、植入物少:二尖瓣夾子幾乎只作用于病變部位,沒有太多附屬結構,不會對心臟其他組織結構及功能形成干擾,這相對其他二尖瓣介入器械有明顯優勢。(2)原理簡單,容易經導管實現。SEER把病變瓣葉和對側瓣葉縫合,僅需要數個墊片縫合幾針即可完成。這種簡單方式使得該技術容易通過導管實現操作。同時,瓣葉所在心腔的空間相對開闊,器械在心房內進行調彎等容易實現。(3)醫學原理可靠,以不變應萬變。SEER一開始是在其他外科修復技術無效情況下作為后補技術。因此,無論是簡單病變還是復雜病變,均可使用SEER或TEER進行治療。
然而, SEER在目前實際臨床上卻較少應用,這是因為SEER或多或少會引起瓣口狹窄[10],而外科發明了一些更好的修復技術如腱索植入、瓣葉切除、瓣葉延長技術等,這些技術在有效治療反流同時不會引起瓣口狹窄,因此替代了SEER[11]。但這并不意味著SEER效果不好或者是SEER對復雜的病變沒效果,只能說是一個“優中選優”的結果。然而,TEER又不完全等同于SEER,甚至有超越SEER的可能。外科手術是在心臟停跳情況下進行,手術效果無法實時、真實地驗證,即使是使用術中注水試驗作為驗證手段,還是無法真正模擬復跳后心臟血流動力學情況。而TEER技術是在心臟跳動、實時超聲引導下進行,可以通過精細的反復調節夾合位置及深度,即刻驗證并優化手術效果,這一點是SEER無法比擬的。SEER的優勢在于可以聯合瓣環成形,保證其遠期效果[12]。然而,這是個雙刃劍,聯合瓣環成形勢必明顯減小瓣口面積(導致瓣口面積<1.5 cm2),這是外科修復不首選SEER的重要原因[12-13];而不聯合瓣環成形,可以保留更多瓣口面積,因此實踐中,TEER術后嚴重瓣膜狹窄情況非常少見[14-15]。另外,瓣環成形主要是在于預防房性功能性二尖瓣反流(atrial functional mitral regurgitation,AFMR)(指不合并左心室功能不全的心房顫動或左心室射血分數保留心力衰竭等相關的繼發性二尖瓣反流[16])發生,以及出現新的脫垂之后起緩沖保護作用,但這兩種情況可以通過管理心房顫動以及對新的脫垂干預來補救[17]。關于夾子周圍是否有瓣葉僵硬、微損傷而導致新的反流產生,已被多項病理學研究[18-20]否定。
2 外科緣對緣修復研究及其啟示
在一項單純SEER的研究 (沒有同期植入成形環)中[9],共納入81例患者,大部分患者為存在瓣膜及其附屬結構器質性病變的MR即DMR,經過4年隨訪,總體上,89.0%±3.9%患者無需再手術;術后殘余MR 0~1+患者,94.0%±5.8%患者無需再手術,術后遠期耐久性良好;而術后殘余MR 2+ 以上的,無需再手術率為67.0%±32.7%。研究[9]還顯示瓣環有鈣化者(n=32)二次手術概率高于瓣環無鈣化患者(n=49),說明單純SEER效果相較于SEER合并瓣環修復效果是欠佳的,尤其是對于有瓣環鈣化、風濕性瓣膜改變等的患者;12例交界區附近病變的患者無1例復發,這提示交界區TEER長期療效可能更好,并且對瓣口影響更小。
另外一項對139例DMR患者行SEER(均聯合放置成形環)的長期隨訪研究[12]顯示,第17年,患者免于復發(MR≤3+)的比率為80.2%±5.86%,免于再手術的概率為89.6%±2.74%。該結果顯示其遠期耐久性不亞于外科修復。多元回歸分析顯示,術后MR>1+是MR復發的最強預測因素(HR=7.4)。
一項對305例DMR行外科二尖瓣修復患者的長期年隨訪研究[21]顯示,10年時術后MR 0+級和1+級患者免于再手術的概率相近(94% vs. 90%),明顯高于MR 2+患者(56%)。有無成形環患者術后進展至中度以上MR有明顯差異[21]。這個研究是針對所有外科修復技術患者,其結論和另外一個對SEER長期隨訪研究一致,也是顯示術后即刻MR 0~1+,應用成形環,是長期良好效果預測因素[13];研究[21]同時也顯示,交界區患者SEER效果更好,中期隨訪幾乎無復發。
以上這些外科研究對于TEER策略的啟示:對于DMR患者,應該追求更完美的手術效果,使得術后即刻MR 0~1+;其次,應該選擇瓣環擴大不明顯患者,由于TEER不聯合瓣環成形術,可以預料到瓣環擴大明顯患者長期預后較差;非中央區的患者,特別是交界區患者,受到遠期瓣環擴大導致復發影響小,效果更好,并且對瓣口面積影響小,從長期預后看,反而是TEER合適人群,當然這些患者TEER手術難度是增加的。
3 退行性二尖瓣反流手術策略
Sugiura 等[22]將TEER術后反流復發歸納為4個機制,包括夾合裝置單邊脫落、瓣葉從夾合裝置部分滑出(夾合裝置尚未脫落)、瓣葉撕裂以及心臟功能性改變(瓣環擴大、心室擴大導致腱索拴系等)。筆者認為,長期來講,還可能包括新發瓣葉病變,如新發脫垂、腱索斷裂等[23],但這相對少見。另有研究[21]顯示,術后即刻MR≥2+是反流復發預測因素。這一點和前文所述外科結果一致;殘余分流≥2+對DMR患者TEER術后遠期預后有明顯影響,這點也被其他研究[24-26]證實。因此,對于DMR患者行TEER,應該追求更完美的即刻效果,使得術后即刻MR≤1+。
有研究者[25]提出了對合緣增強指數(augmentation in coaptation)的概念,對合增強指數= (A+B)–(G+F),實際上就是等于瓣葉被夾子額外夾進去的瓣葉長度總和(需要去掉17 mm的自然對合)(圖1)。此研究納入183例患者,大多數為DMR患者。研究[27]顯示,該指數是患者手術效果最強力預測因素[受試者工作特征曲線下面積(AUC)=0.9 ]。患者殘余分流0~1+,對合緣增強指數為7.3 mm;術后殘余分流≥2+,對合緣增強指數為3.0 mm。同時,術后即刻二尖瓣瓣環面積縮小也是即刻效果預測因素[27]。此研究提示,在不引起瓣葉撕裂的前提下,應該盡量多地夾合更多瓣葉,這樣可以增加夾子兩邊瓣葉的對合,同時一定程度縮小或者預防瓣環擴張,保證長期效果。這也是在DMR患者中,MitraClip XTR往往效果更好的原因。這也可能是TEER和SEER一個差別點,SEER術中無法反復調整對合量,并且是否可以達到TEER這樣高度的對合不得而知。實際上,世界上完成SEER手術量很少,僅有少數幾個醫生有相關經驗,如何提高SEER療效還沒被研究清楚;相反,如何提高TEER近遠期療效將在今后被全世界廣大醫生聯合充分研究清楚,TEER療效有望優于SEER。
 圖1
對合緣增強指數示意圖[27]
圖1
對合緣增強指數示意圖[27]
a:基線狀態參數;b:TEER術后參數;LA:左心房;LV:左心室;PML:二尖瓣后葉;AML:二尖瓣前葉;Clip:二尖瓣夾子;A:二尖瓣前葉減去前后瓣葉對合長度;B:二尖瓣后葉減去前后瓣葉對合長度;C:基線二尖瓣長軸長度;D:二尖瓣前后瓣葉對合長度;E:夾子可以夾合瓣葉的區域;F:TEER術后夾子以外的二尖瓣前葉長度;G:TEER術后夾子以外的二尖瓣后葉長度;H:TEER術后二尖瓣長軸長度;紅色箭頭:瓣葉超出對合部分;對合增強指數= (A+B)–(G+F)
對于DMR患者TEER術后產生的高跨瓣壓差(平均壓差≥5 mm Hg)是否引起患者心力衰竭導致再住院、影響患者運動能力,不同研究有差異,但總體上還是傾向于有影響。Koell等[28]的研究顯示,術后高跨瓣壓差患者6分鐘步行距離未改善,再住院發生率高,死亡率也有增高趨勢(P=0.09)。美國經導管心臟瓣膜介入治療注冊研究(TVT)20 000例DMR患者的隨訪研究顯示,TEER術后高跨瓣壓差對死亡率無影響,但對再住院有明顯影響,術后輕度或無MR但壓差5~10 mm Hg的患者再住院率高于術后中度MR患者,盡管兩者生存率無差異,但這提示術后高跨瓣壓差影響大于中度反流。然而,另外一項研究[29]結論不同,提示術后中度的殘余反流影響大于高跨瓣壓差。
綜上所述,筆者對于DMR患者的TEER手術策略建議為:(1)長驅直入:在不引起瓣葉撕裂、瓣膜狹窄情況下盡量多夾瓣葉,尤其是病變側的瓣葉,保證即刻及遠期效果;(2)斬草除根:盡量夾掉脫垂瓣葉,保證遠期效果,有時需要補充二夾;(3)盡善盡美:反復嘗試,盡量把反流減低到0~1+,保證遠期效果;(4)避免狹窄:術后高跨瓣壓差對患者預后有影響,應該盡量避免。
4 功能性二尖瓣反流手術策略
對于FMR(沒有瓣膜及其附屬結構器質性病變,而主要由心房心室擴張引起二尖瓣瓣環擴大導致MR)患者,在TEER策略上與DMR患者可能有較大區別。并且,外科手術在這方面經驗也較缺乏,無論是AFMR或者是室性功能性二尖瓣反流(ventricular functional mitral regurgitation,VFMR),目前瓣膜指南[1-2]僅把外科手術作為ⅡB類的推薦。研究[30]顯示,對于FMR患者,術后MR 1+與2+患者預后無差異,但明顯優于MR≥3+者。另外一項研[31]究顯示,FMR患者術后MR 1+與2+患者預后差異多見于左心不擴大、右心功能良好患者,對于左心已經擴大或者有心功能不良者兩者無差異。研究[28, 32]認為FMR術后高跨瓣壓差對患者的預后及癥狀均無影響。
綜上所述,建議FMR患者TEER手術策略:適可而止,不求完美,允許中度殘余分流,或者輕度壓差,這并不影響患者預后和癥狀,同時這個策略可以避免過多操作導致并發癥發生,并縮短手術時間。但AFMR這個特殊類型患者是否另有差別,目前還不得而知。其實,根據Frank-Staring機制,適當殘余分流可以保持一定左心室舒張末期壓力,防止術后低心排血量發生,從某種意義上對心臟功能低下者是個保護因素。
5 總結
M-TERR的原理來自于SEER技術,雖然SEER技術在外科少用,并不說明SEER技術無用,而是一種優中選優的結果。SEER技術靶點精確,對周圍組織干擾少,技術原理簡單,是一種最適合導管化的外科技術。TEER來源于SEER,但是在某些方面相對SEER有優勢,可以術中通過精確夾合、動態觀察提高效果,可以通過全世界大樣本臨床研究及器械改進提升技術,可能達到青出于藍而勝于藍。DMR患者TEER 手術策略為盡善盡美,盡量即刻MR≤1+,無顯著跨瓣壓差,消除病變瓣葉;而FMR患者則策略是不求完美,可容許一定的殘余分流及適當跨瓣壓差。
利益沖突:無。
作者貢獻:潘文志撰寫初稿、修改論文;龍愉良查資料,參與初稿撰寫;周達新與葛均波提出想法,修改論文。