引用本文: 劉一人, 谷涌泉, 郭連瑞. 藥涂球囊在腎動脈型大動脈炎治療中的應用. 中國普外基礎與臨床雜志, 2024, 31(4): 439-443. doi: 10.7507/1007-9424.202308062 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
大動脈炎(Takayasu’s arteritis,TA)是一種少見的疾病,亞洲女性發病率高,嚴重威脅年輕女性的健康[1-2]。其發病由免疫因素和炎癥因素共同介導。TA是累及胸、腹主動脈及其分支的慢性進行性炎性疾病[3],主要累及左鎖骨下動脈(90%)、頸動脈(45%)、椎動脈(25%)、腎動脈(20%)、冠狀動脈(5%),還可以累及肺動脈[4]。腎動脈受累的TA在亞洲TA患者中占60%[5],常常導致嚴重的臟器缺血癥狀。治療方面,在內科保守治療效果不明顯的情況下,常需要外科的干預,目前外科治療主要以腔內治療(單純球囊血管成形術、支架植入)和開放性手術為主。開放性手術雖然長期效果肯定,但對患者創傷大、并發癥多,而腔內治療的長期效果不十分理想。在治療上需要尋求一種創傷小且長期效果好的治療方法。紫杉醇藥物涂層球囊(drug coated balloon,DCB)在治療動脈硬化性血管病變上有很好的長期療效,但紫杉醇作為免疫抑制劑,對由免疫因素導致的大動脈炎性血管狹窄治療的可行性及安全性鮮有報道。本研究旨在評價紫杉醇DCB對TA患者治療的有效性及安全性,為尋找新的TA治療方法提供參考。
1 資料與方法
1.1 臨床資料
回顧性分析首都醫科大學宣武醫院血管外科于2019年1月至2023年8月期間采用DCB治療的3例(3條血管)累及腎動脈的TA患者的臨床資料。患者自愿應用DCB治療(存在術后再復發的情況并且符合手術指征的患者可考慮應用DCB治療)。TA的診斷參考美國風濕病學會制定的診斷標準[6]:① 中青年且年齡≤40歲;② 累及下肢動脈會出現跛行;③ 累及上肢會出現動脈搏動減弱;④ 上肢病變通常收縮壓差>10 mmHg(1 mmHg=0.133 kPa);⑤ 病變血管可聞及雜音;⑥ 造影顯示病變動脈存在狹窄或閉塞,需除外其他病變導致的狹窄。符合3條者可診斷TA。
紫杉醇DCB應用的病例選擇標準:經過內科保守治療效果不明顯;在三聯降壓藥(鈣通道阻滯劑+血管緊張素轉換酶抑制劑/血管緊張素受體阻滯劑+利尿劑)應用的情況下仍然存在收縮壓≥140 mmHg或舒張壓≥90 mmHg;影像學資料證實腎動脈病變明顯(嚴重狹窄≥70%);疾病處于非活動期;患者一般情況良好可耐受手術;不適合開放手術的患者;無造影劑過敏。滿足以上全部條件可考慮紫杉醇DCB治療。
3例均為女性,年齡分別為14、29、47歲;均有高血壓病史,服用3~4種降壓藥物(苯磺酸氨氯地平、氯沙坦鉀、酒石酸美托洛爾和氫氯噻嗪),血壓控制不良,術前收縮壓分別為180、220和150 mmHg。術前血清肌酐(serum creatinine,SCr)分別53、64、55 μmol/L。經彩色多普勒超聲檢查均發現腎動脈嚴重狹窄(>70%),狹窄位于腎動脈起始段。根據癥狀(無發熱)、實驗室檢查(紅細胞沉降率和C反應蛋白正常)和影像學檢查(多普勒超聲未見明顯內膜水腫),判斷疾病均處于非活動期。其中2例患者既往接受了2次普通球囊成形術(plain old balloon angioplasty,POBA):1例患者于術后12個月和15個月再次出現腎動脈狹窄,另1例于術后5個月和8個月發生腎動脈再狹窄。最后1例患者于POBA術后10個月再次出現腎動脈狹窄。考慮到該3例患者術后再次出現再狹窄和患者不愿意進行支架植入,決定使用DCB治療。
1.2 術前準備
所有患者完善常規術前檢查,評估手術耐受程度,通過實驗室檢查及影像學檢查了解病情是否處于活動期,急性期患者至少應待病情穩定后再考慮手術治療。本組3例患者均處于非活動期,術前常規雙抗(阿司匹林100 mg/d,硫酸氫氯吡格雷75 mg/d)5 d。
1.3 手術方法
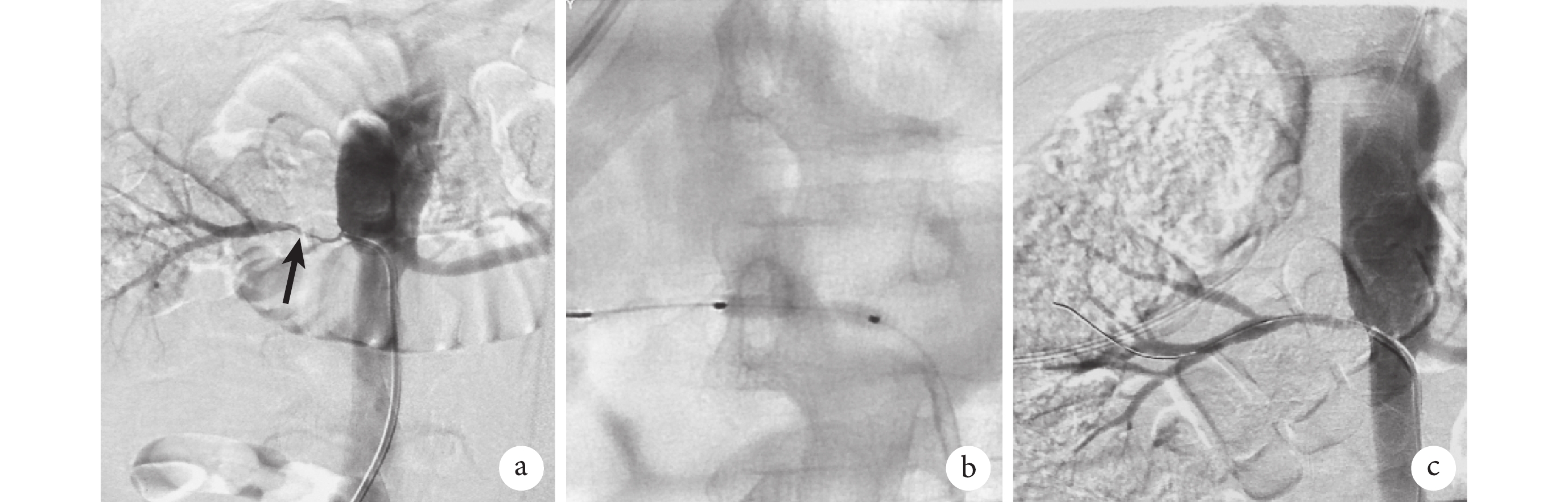
局部麻醉滿意后采用Seldinger技術逆行穿刺右股總動脈,置入8 Fr(Introducer Ⅱ,Terumo)動脈鞘,通過動脈鞘給予肝素(50 U/kg,華北制藥股份有限公司),根據手術時間每小時額外注射2 000 U肝素。豬尾導管腎動脈造影確定病變側腎動脈,發現單側腎動脈起始部重度狹窄而雙腎實質顯影正常,路圖下應用0.035 in(1 in=0.025 4 m)150 cm親水導絲導引 5 Fr Cobra導管(C1,庫克,布魯明頓,美國)超選入病變側腎動脈,經導管行血管造影,證實病變腎動脈重度狹窄。應用V18導絲(0.018 in、300 cm,Radifocus,Terumo,Tokyo,日本)選入病變腎動脈遠端段,經Guiding導管送至腎動脈開口處。再次行腎動脈血管造影確定病變部位并測量正常腎動脈直徑,3例病例分別沿著導絲進入普通球囊(分別為直徑4 mm、長20 mm;直徑4 mm、長20 mm;直徑4 mm、長30 mm)充分擴張狹窄處腎動脈,普通球囊擴張時間維持180 s,充氣壓力為8 atm(1 atm=101.325 kPa)。擴張后造影評估狹窄段<50%殘余狹窄,并且無限制血流的夾層、無腎動脈栓塞、無造影劑外溢,最后沿導絲分別進入直徑5.0 mm、長20 mm,直徑4.5 mm、長80 mm,直徑5.0 mm、長40 mm的紫杉醇DCB(先瑞達醫療科技控股有限公司)進行擴張,紫杉醇DCB的充氣時間為60 s,充氣壓力為6 atm,球囊長度充分覆蓋病變長度。術中所有病例的腎動脈血流通暢,未發現夾層及遠端栓塞,腎實質顯影良好,無造影劑外溢。最后以血管縫合器縫合右股動脈穿刺點,加壓包扎。手術過程見圖1。
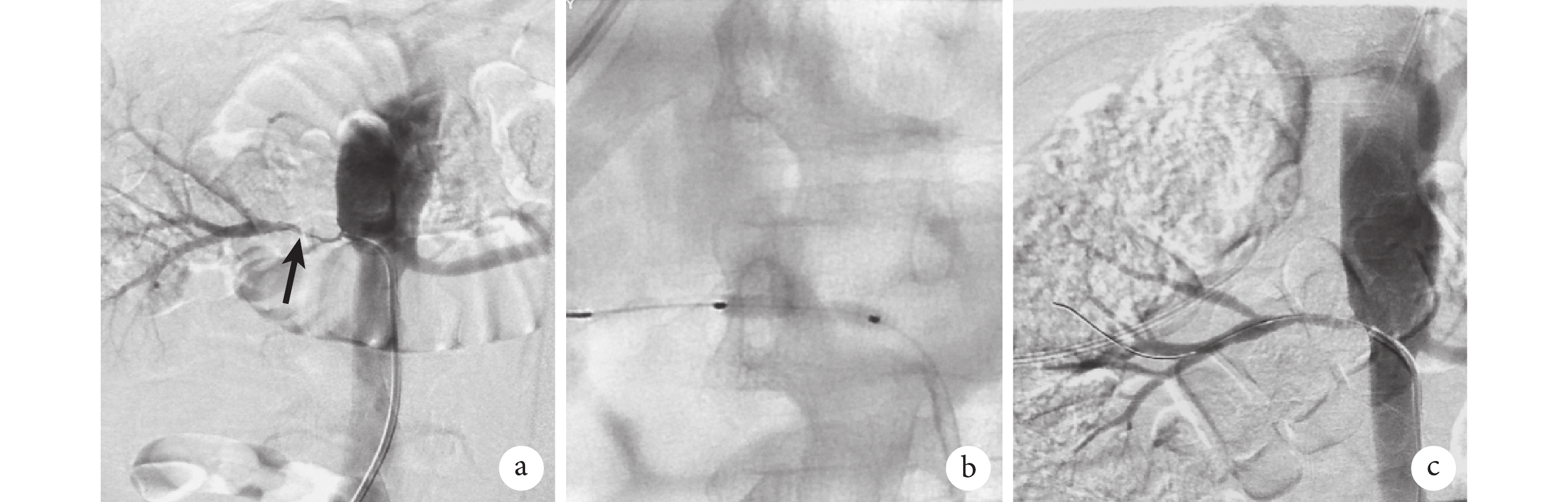 圖1
示腎動脈型TA的紫杉醇DCB治療
圖1
示腎動脈型TA的紫杉醇DCB治療
a:造影顯示腎動脈狹窄(黑箭);b:DCB球囊擴張;c:術后顯示血管通暢
1.4 術后處理
術后觀察肺部感染、穿刺點血腫、術后出血和血管通暢情況。術后主要給予抗血小板處理,給予口服阿司匹林 100 mg/d,氯吡格雷75 mg/d,規律口服3個月。此后,患者單純服用阿司匹林100 mg/d。術后復查腎動脈超聲,監測SCr和血壓變化。
1.5 觀察指標和隨訪
介入治療成功的標準為治療后腎動脈管腔殘余狹窄<30%[7],若超聲檢查狹窄>50%則為再狹窄。高血壓治療效果為患者治療后在不服用降壓藥物的情況下收縮壓<140 mmHg和舒張壓<90 mmHg則為治愈;患者在服用術前相同降壓藥物時收縮壓<140 mmHg或舒張壓<90 mmHg則為有所改善,如患者舒張壓下降15 mmHg也認為改善;血壓沒有變化則認為治療無效[8]。術后1、3、6個月門診復查超聲,以后每6個月復查超聲。
2 結果
2.1 手術及相關并發癥
本組3例患者介入治療均獲得成功,手術時間分別為40、42和41 min。未出現手術失敗及腎動脈血管破裂、栓塞或閉塞并發癥,未見穿刺點血腫、假性動脈瘤及術后出血情況,圍手術期未見肺部感染病例,患者術后未見急性腎功能不全、術后低血壓等并發癥。
2.2 觀察指標情況
3例患者分別獲訪17、38、40個月。3例患者通過介入治療后在藥物減少1~2種的情況下高血壓癥狀均得到改善,收縮壓分別由術前的180、220、150 mmHg降至術后第1天的116、120、110 mmHg,到隨訪結束時收縮壓分別為118、123和115 mmHg,3例患者高血壓治療效果均為改善。3例患者的SCr分別從術前的53、64、55 μmol/L變化至術后第2天的43、70、59 μmol/L,術后未出現SCr值明顯升高的情況,到隨訪結束分別為44、69、61 μmol/L;患者腎動脈收縮期峰值流速由術前的350、377、293 cm/s降至術后第1天的120、135、94 cm/s,到隨訪結束時分別為122、138、101 cm/s。
2.3 通暢率
3例患者均獲得手術成功,接受術后規律超聲隨訪。在長期隨訪中,3例患者的血管通暢性明顯改善,未發生臨床意義的血管再狹窄情況。
3 討論
3.1 TA的手術方式
TA在內科保守治療效果不佳的情況下,存在臟器的嚴重供血不足,常常需要外科干預[9]。目前主要有傳統的開放性手術及微創的腔內治療(單純球囊擴張及支架植入)[10]。外科治療一般于炎癥控制之后進行,患者應無發熱、全身酸痛等全身炎癥表現,紅細胞沉降率和C反應蛋白正常并需穩定在6個月以上、疾病處于穩定期時進行[11]。一般認為傳統的開放性手術的長期通暢率高[12-14],但圍手術期并發癥發生率高[15-16]且手術難度大[17]。往往在腔內治療存在技術上困難或不成功時,可以考慮開放手術。相比之下,血管內介入治療相對安全,并已顯示出良好的短期效果及治療的可重復性。腎動脈型TA的介入治療分球囊擴張和支架植入,球囊擴張不僅療效滿意而且可以重復操作。但球囊擴張的再狹窄率較高[18],其長期效果差的主要原因是球囊擴張可導致血管內壁受損,誘發或加重炎癥反應,導致管腔進一步狹窄;由于平滑肌細胞增殖、細胞外基質增多,造成新生內膜的形成。紫杉醇具有抑制內膜增生的作用,廣泛應用于外周血管的治療。筆者將紫杉醇DCB應用于TA的治療,收到很好的治療效果。
3.2 TA的術后效果
腎動脈型TA導致的腎動脈狹窄常常伴隨著腎型高血壓,通過介入治療大部分患者高血壓癥狀能得到改善,本組病例采用球囊擴張均獲得成功,未行支架植入術。支架植入作為補救性治療對患者高血壓的降低并沒有實質上幫助,這一研究結果在國外的研究中進行了報道。在Peng等[19]的研究中單純球囊擴張和支架植入在高血壓的有效性方面差異無明顯統計學意義,Kinjo等[20]的研究也得到了同樣的結果。腎動脈狹窄介入術后對SCr的改善情況一直存在爭議,大部分研究認為血流改變對SCr的影響很小。史振宇等[21]報道了23例腎動脈狹窄術后SCr的改變情況,在其隨訪過程中發現,SCr水平與術前比較差異無統計學意義。此外,介入治療后血管的長期通暢性一直是備受關注的話題,以往普通球囊血管成形術的1、3及5年通暢率分別為95.83%、91.67%和86.95%[22-23]。Peng等[19]通過研究證實單純球囊擴張術后 l、3、5 和 10 年累積通暢率分別為 90.1%、68.4%、61.6%和 49.3%。 如何提高血管術后的長期通暢性是醫生追求的目標,本研究可能為提高TA的長期通暢性提供新的方向。從研究結果看紫杉醇DCB效果令人滿意,這與紫杉醇的作用機制和TA的發病機制有關系。TA的發病普遍認為是由免疫因素和炎癥因素共同介導的[24-27]。在免疫因素方面,一般認為TA的發病機制與細胞介導的免疫反應有關。
3.3 TA的發病機制
過去20年的研究已明確細胞介導的自身免疫反應參與了TA患者血管壁細胞損傷的病理過程。TA患者的外周血CD4+/CD8+ 淋巴細胞比值升高,表達人類白細胞抗原的循環淋巴細胞數量增多。免疫組織化學顯示TA患者血管病變處浸潤的細胞主要為T亞群細胞、自然殺傷細胞、細胞毒性T淋巴細胞、輔助T淋巴細胞和巨噬細胞,提示這些活化的淋巴細胞參與了血管病變的發生發展。即使在疾病穩定期,大約有50%的TA患者處于慢性活動期[24]。在炎性因素方面,多種炎性因子參與了慢性炎性病變,在TA的發生及發展中扮演重要角色。白細胞介素(interleukin,IL)-6是由巨噬細胞、活化的單核細胞和T細胞分泌的前促炎細胞因子,可增強T細胞毒性、自然殺傷細胞活性、成纖維細胞增殖能力及誘導急性反應蛋白的合成。研究[24]發現,TA患者的血清IL-6濃度升高,并和疾病活動性相關,高表達的IL-6通過誘導病變血管處浸潤的單核細胞和(或)平滑肌細胞分泌基質金屬蛋白酶而導致動脈壁彈性纖維的破壞。腫瘤壞死因子α、干擾素γ、IL-2、IL-3、IL-4、IL-12和IL-18這些細胞因子參與TA的發病,擴大病變處血管的炎癥反應。
3.4 紫杉醇DCB用于TA的機制
在以往的動脈硬化性血管病變的治療中,紫杉醇DCB與單純球囊相比[28],紫杉醇球囊的晚期管腔丟失率顯著降低。紫杉醇作為抗腫瘤劑,是一種衍生的二萜類化合物,主要通過與微管蛋白結合,促進微管形成,使大量微管非正常地聚合,從而改變細胞骨架的平衡狀態,產生結構的畸變,導致其失去正常的功能,造成細胞分裂受阻于M期,可阻止細胞有絲分裂,然后誘導細胞凋亡(包括內皮細胞、平滑肌細胞、免疫細胞和炎癥細胞),可以用來治療血管狹窄,并抑制新生內膜及抑制血管平滑肌細胞的增殖。Perera等[29]認為,血管腔內治療結合免疫抑制治療方法是對大動脈炎性血管狹窄的一種很有前途的治療方案。疾病的活動性會導致病情的進一步發展,而紫杉醇誘導免疫細胞和炎癥細胞凋亡的藥理機制可用于對抗由免疫機制和炎癥反應引起的TA疾病的進展。在本研究中,病例均是由TA引起的腎動脈狹窄,均采用紫杉醇DCB血管成形治療,在隨訪過程中,通暢性良好,未發生血栓栓塞、腎功能受損等表現。良好的血管通暢性提示紫杉醇DCB治療可作為TA的一種替代方法,但本研究病例數少,觀察時間有限,對于該治療方法需大宗病例的長期隨訪結果。
總之,TA在亞洲發病高,后果嚴重,目前現有的治療方法效果有限。紫杉醇DCB不僅創傷小且長期效果好,可能會成為大動脈炎性血管病變的有效治療手段。本研究的意義在于探索了紫杉醇DCB治療TA血管病變的療效,通過隨訪分析了解紫杉醇DCB治療的安全性及有效性,為今后TA的介入治療提供新的治療方法,更為重要的意義在于能夠為患者帶來更多生存質量保證。但本研究為單中心數據,紫杉醇DCB在TA中的應用效果及風險需要長期觀察,還需大樣本隨機對照研究進一步探索。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:劉一人負責撰寫文章,郭連瑞和谷涌泉負責文章指導及手術指導。
倫理聲明:本研究已通過首都醫科大學宣武醫院倫理委員會的審核批準,批文編號為臨研審[2022]223號。
大動脈炎(Takayasu’s arteritis,TA)是一種少見的疾病,亞洲女性發病率高,嚴重威脅年輕女性的健康[1-2]。其發病由免疫因素和炎癥因素共同介導。TA是累及胸、腹主動脈及其分支的慢性進行性炎性疾病[3],主要累及左鎖骨下動脈(90%)、頸動脈(45%)、椎動脈(25%)、腎動脈(20%)、冠狀動脈(5%),還可以累及肺動脈[4]。腎動脈受累的TA在亞洲TA患者中占60%[5],常常導致嚴重的臟器缺血癥狀。治療方面,在內科保守治療效果不明顯的情況下,常需要外科的干預,目前外科治療主要以腔內治療(單純球囊血管成形術、支架植入)和開放性手術為主。開放性手術雖然長期效果肯定,但對患者創傷大、并發癥多,而腔內治療的長期效果不十分理想。在治療上需要尋求一種創傷小且長期效果好的治療方法。紫杉醇藥物涂層球囊(drug coated balloon,DCB)在治療動脈硬化性血管病變上有很好的長期療效,但紫杉醇作為免疫抑制劑,對由免疫因素導致的大動脈炎性血管狹窄治療的可行性及安全性鮮有報道。本研究旨在評價紫杉醇DCB對TA患者治療的有效性及安全性,為尋找新的TA治療方法提供參考。
1 資料與方法
1.1 臨床資料
回顧性分析首都醫科大學宣武醫院血管外科于2019年1月至2023年8月期間采用DCB治療的3例(3條血管)累及腎動脈的TA患者的臨床資料。患者自愿應用DCB治療(存在術后再復發的情況并且符合手術指征的患者可考慮應用DCB治療)。TA的診斷參考美國風濕病學會制定的診斷標準[6]:① 中青年且年齡≤40歲;② 累及下肢動脈會出現跛行;③ 累及上肢會出現動脈搏動減弱;④ 上肢病變通常收縮壓差>10 mmHg(1 mmHg=0.133 kPa);⑤ 病變血管可聞及雜音;⑥ 造影顯示病變動脈存在狹窄或閉塞,需除外其他病變導致的狹窄。符合3條者可診斷TA。
紫杉醇DCB應用的病例選擇標準:經過內科保守治療效果不明顯;在三聯降壓藥(鈣通道阻滯劑+血管緊張素轉換酶抑制劑/血管緊張素受體阻滯劑+利尿劑)應用的情況下仍然存在收縮壓≥140 mmHg或舒張壓≥90 mmHg;影像學資料證實腎動脈病變明顯(嚴重狹窄≥70%);疾病處于非活動期;患者一般情況良好可耐受手術;不適合開放手術的患者;無造影劑過敏。滿足以上全部條件可考慮紫杉醇DCB治療。
3例均為女性,年齡分別為14、29、47歲;均有高血壓病史,服用3~4種降壓藥物(苯磺酸氨氯地平、氯沙坦鉀、酒石酸美托洛爾和氫氯噻嗪),血壓控制不良,術前收縮壓分別為180、220和150 mmHg。術前血清肌酐(serum creatinine,SCr)分別53、64、55 μmol/L。經彩色多普勒超聲檢查均發現腎動脈嚴重狹窄(>70%),狹窄位于腎動脈起始段。根據癥狀(無發熱)、實驗室檢查(紅細胞沉降率和C反應蛋白正常)和影像學檢查(多普勒超聲未見明顯內膜水腫),判斷疾病均處于非活動期。其中2例患者既往接受了2次普通球囊成形術(plain old balloon angioplasty,POBA):1例患者于術后12個月和15個月再次出現腎動脈狹窄,另1例于術后5個月和8個月發生腎動脈再狹窄。最后1例患者于POBA術后10個月再次出現腎動脈狹窄。考慮到該3例患者術后再次出現再狹窄和患者不愿意進行支架植入,決定使用DCB治療。
1.2 術前準備
所有患者完善常規術前檢查,評估手術耐受程度,通過實驗室檢查及影像學檢查了解病情是否處于活動期,急性期患者至少應待病情穩定后再考慮手術治療。本組3例患者均處于非活動期,術前常規雙抗(阿司匹林100 mg/d,硫酸氫氯吡格雷75 mg/d)5 d。
1.3 手術方法
局部麻醉滿意后采用Seldinger技術逆行穿刺右股總動脈,置入8 Fr(Introducer Ⅱ,Terumo)動脈鞘,通過動脈鞘給予肝素(50 U/kg,華北制藥股份有限公司),根據手術時間每小時額外注射2 000 U肝素。豬尾導管腎動脈造影確定病變側腎動脈,發現單側腎動脈起始部重度狹窄而雙腎實質顯影正常,路圖下應用0.035 in(1 in=0.025 4 m)150 cm親水導絲導引 5 Fr Cobra導管(C1,庫克,布魯明頓,美國)超選入病變側腎動脈,經導管行血管造影,證實病變腎動脈重度狹窄。應用V18導絲(0.018 in、300 cm,Radifocus,Terumo,Tokyo,日本)選入病變腎動脈遠端段,經Guiding導管送至腎動脈開口處。再次行腎動脈血管造影確定病變部位并測量正常腎動脈直徑,3例病例分別沿著導絲進入普通球囊(分別為直徑4 mm、長20 mm;直徑4 mm、長20 mm;直徑4 mm、長30 mm)充分擴張狹窄處腎動脈,普通球囊擴張時間維持180 s,充氣壓力為8 atm(1 atm=101.325 kPa)。擴張后造影評估狹窄段<50%殘余狹窄,并且無限制血流的夾層、無腎動脈栓塞、無造影劑外溢,最后沿導絲分別進入直徑5.0 mm、長20 mm,直徑4.5 mm、長80 mm,直徑5.0 mm、長40 mm的紫杉醇DCB(先瑞達醫療科技控股有限公司)進行擴張,紫杉醇DCB的充氣時間為60 s,充氣壓力為6 atm,球囊長度充分覆蓋病變長度。術中所有病例的腎動脈血流通暢,未發現夾層及遠端栓塞,腎實質顯影良好,無造影劑外溢。最后以血管縫合器縫合右股動脈穿刺點,加壓包扎。手術過程見圖1。
 圖1
示腎動脈型TA的紫杉醇DCB治療
圖1
示腎動脈型TA的紫杉醇DCB治療
a:造影顯示腎動脈狹窄(黑箭);b:DCB球囊擴張;c:術后顯示血管通暢
1.4 術后處理
術后觀察肺部感染、穿刺點血腫、術后出血和血管通暢情況。術后主要給予抗血小板處理,給予口服阿司匹林 100 mg/d,氯吡格雷75 mg/d,規律口服3個月。此后,患者單純服用阿司匹林100 mg/d。術后復查腎動脈超聲,監測SCr和血壓變化。
1.5 觀察指標和隨訪
介入治療成功的標準為治療后腎動脈管腔殘余狹窄<30%[7],若超聲檢查狹窄>50%則為再狹窄。高血壓治療效果為患者治療后在不服用降壓藥物的情況下收縮壓<140 mmHg和舒張壓<90 mmHg則為治愈;患者在服用術前相同降壓藥物時收縮壓<140 mmHg或舒張壓<90 mmHg則為有所改善,如患者舒張壓下降15 mmHg也認為改善;血壓沒有變化則認為治療無效[8]。術后1、3、6個月門診復查超聲,以后每6個月復查超聲。
2 結果
2.1 手術及相關并發癥
本組3例患者介入治療均獲得成功,手術時間分別為40、42和41 min。未出現手術失敗及腎動脈血管破裂、栓塞或閉塞并發癥,未見穿刺點血腫、假性動脈瘤及術后出血情況,圍手術期未見肺部感染病例,患者術后未見急性腎功能不全、術后低血壓等并發癥。
2.2 觀察指標情況
3例患者分別獲訪17、38、40個月。3例患者通過介入治療后在藥物減少1~2種的情況下高血壓癥狀均得到改善,收縮壓分別由術前的180、220、150 mmHg降至術后第1天的116、120、110 mmHg,到隨訪結束時收縮壓分別為118、123和115 mmHg,3例患者高血壓治療效果均為改善。3例患者的SCr分別從術前的53、64、55 μmol/L變化至術后第2天的43、70、59 μmol/L,術后未出現SCr值明顯升高的情況,到隨訪結束分別為44、69、61 μmol/L;患者腎動脈收縮期峰值流速由術前的350、377、293 cm/s降至術后第1天的120、135、94 cm/s,到隨訪結束時分別為122、138、101 cm/s。
2.3 通暢率
3例患者均獲得手術成功,接受術后規律超聲隨訪。在長期隨訪中,3例患者的血管通暢性明顯改善,未發生臨床意義的血管再狹窄情況。
3 討論
3.1 TA的手術方式
TA在內科保守治療效果不佳的情況下,存在臟器的嚴重供血不足,常常需要外科干預[9]。目前主要有傳統的開放性手術及微創的腔內治療(單純球囊擴張及支架植入)[10]。外科治療一般于炎癥控制之后進行,患者應無發熱、全身酸痛等全身炎癥表現,紅細胞沉降率和C反應蛋白正常并需穩定在6個月以上、疾病處于穩定期時進行[11]。一般認為傳統的開放性手術的長期通暢率高[12-14],但圍手術期并發癥發生率高[15-16]且手術難度大[17]。往往在腔內治療存在技術上困難或不成功時,可以考慮開放手術。相比之下,血管內介入治療相對安全,并已顯示出良好的短期效果及治療的可重復性。腎動脈型TA的介入治療分球囊擴張和支架植入,球囊擴張不僅療效滿意而且可以重復操作。但球囊擴張的再狹窄率較高[18],其長期效果差的主要原因是球囊擴張可導致血管內壁受損,誘發或加重炎癥反應,導致管腔進一步狹窄;由于平滑肌細胞增殖、細胞外基質增多,造成新生內膜的形成。紫杉醇具有抑制內膜增生的作用,廣泛應用于外周血管的治療。筆者將紫杉醇DCB應用于TA的治療,收到很好的治療效果。
3.2 TA的術后效果
腎動脈型TA導致的腎動脈狹窄常常伴隨著腎型高血壓,通過介入治療大部分患者高血壓癥狀能得到改善,本組病例采用球囊擴張均獲得成功,未行支架植入術。支架植入作為補救性治療對患者高血壓的降低并沒有實質上幫助,這一研究結果在國外的研究中進行了報道。在Peng等[19]的研究中單純球囊擴張和支架植入在高血壓的有效性方面差異無明顯統計學意義,Kinjo等[20]的研究也得到了同樣的結果。腎動脈狹窄介入術后對SCr的改善情況一直存在爭議,大部分研究認為血流改變對SCr的影響很小。史振宇等[21]報道了23例腎動脈狹窄術后SCr的改變情況,在其隨訪過程中發現,SCr水平與術前比較差異無統計學意義。此外,介入治療后血管的長期通暢性一直是備受關注的話題,以往普通球囊血管成形術的1、3及5年通暢率分別為95.83%、91.67%和86.95%[22-23]。Peng等[19]通過研究證實單純球囊擴張術后 l、3、5 和 10 年累積通暢率分別為 90.1%、68.4%、61.6%和 49.3%。 如何提高血管術后的長期通暢性是醫生追求的目標,本研究可能為提高TA的長期通暢性提供新的方向。從研究結果看紫杉醇DCB效果令人滿意,這與紫杉醇的作用機制和TA的發病機制有關系。TA的發病普遍認為是由免疫因素和炎癥因素共同介導的[24-27]。在免疫因素方面,一般認為TA的發病機制與細胞介導的免疫反應有關。
3.3 TA的發病機制
過去20年的研究已明確細胞介導的自身免疫反應參與了TA患者血管壁細胞損傷的病理過程。TA患者的外周血CD4+/CD8+ 淋巴細胞比值升高,表達人類白細胞抗原的循環淋巴細胞數量增多。免疫組織化學顯示TA患者血管病變處浸潤的細胞主要為T亞群細胞、自然殺傷細胞、細胞毒性T淋巴細胞、輔助T淋巴細胞和巨噬細胞,提示這些活化的淋巴細胞參與了血管病變的發生發展。即使在疾病穩定期,大約有50%的TA患者處于慢性活動期[24]。在炎性因素方面,多種炎性因子參與了慢性炎性病變,在TA的發生及發展中扮演重要角色。白細胞介素(interleukin,IL)-6是由巨噬細胞、活化的單核細胞和T細胞分泌的前促炎細胞因子,可增強T細胞毒性、自然殺傷細胞活性、成纖維細胞增殖能力及誘導急性反應蛋白的合成。研究[24]發現,TA患者的血清IL-6濃度升高,并和疾病活動性相關,高表達的IL-6通過誘導病變血管處浸潤的單核細胞和(或)平滑肌細胞分泌基質金屬蛋白酶而導致動脈壁彈性纖維的破壞。腫瘤壞死因子α、干擾素γ、IL-2、IL-3、IL-4、IL-12和IL-18這些細胞因子參與TA的發病,擴大病變處血管的炎癥反應。
3.4 紫杉醇DCB用于TA的機制
在以往的動脈硬化性血管病變的治療中,紫杉醇DCB與單純球囊相比[28],紫杉醇球囊的晚期管腔丟失率顯著降低。紫杉醇作為抗腫瘤劑,是一種衍生的二萜類化合物,主要通過與微管蛋白結合,促進微管形成,使大量微管非正常地聚合,從而改變細胞骨架的平衡狀態,產生結構的畸變,導致其失去正常的功能,造成細胞分裂受阻于M期,可阻止細胞有絲分裂,然后誘導細胞凋亡(包括內皮細胞、平滑肌細胞、免疫細胞和炎癥細胞),可以用來治療血管狹窄,并抑制新生內膜及抑制血管平滑肌細胞的增殖。Perera等[29]認為,血管腔內治療結合免疫抑制治療方法是對大動脈炎性血管狹窄的一種很有前途的治療方案。疾病的活動性會導致病情的進一步發展,而紫杉醇誘導免疫細胞和炎癥細胞凋亡的藥理機制可用于對抗由免疫機制和炎癥反應引起的TA疾病的進展。在本研究中,病例均是由TA引起的腎動脈狹窄,均采用紫杉醇DCB血管成形治療,在隨訪過程中,通暢性良好,未發生血栓栓塞、腎功能受損等表現。良好的血管通暢性提示紫杉醇DCB治療可作為TA的一種替代方法,但本研究病例數少,觀察時間有限,對于該治療方法需大宗病例的長期隨訪結果。
總之,TA在亞洲發病高,后果嚴重,目前現有的治療方法效果有限。紫杉醇DCB不僅創傷小且長期效果好,可能會成為大動脈炎性血管病變的有效治療手段。本研究的意義在于探索了紫杉醇DCB治療TA血管病變的療效,通過隨訪分析了解紫杉醇DCB治療的安全性及有效性,為今后TA的介入治療提供新的治療方法,更為重要的意義在于能夠為患者帶來更多生存質量保證。但本研究為單中心數據,紫杉醇DCB在TA中的應用效果及風險需要長期觀察,還需大樣本隨機對照研究進一步探索。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:劉一人負責撰寫文章,郭連瑞和谷涌泉負責文章指導及手術指導。
倫理聲明:本研究已通過首都醫科大學宣武醫院倫理委員會的審核批準,批文編號為臨研審[2022]223號。