引用本文: 王源釗, 陳志堅, 黃集躍, 謝飛來, 陳永標, 王瑜. 老年肝臟未分化胚胎性肉瘤伴囊內出血1例報道. 中國普外基礎與臨床雜志, 2024, 31(1): 93-95. doi: 10.7507/1007-9424.202309030 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
1 病例資料
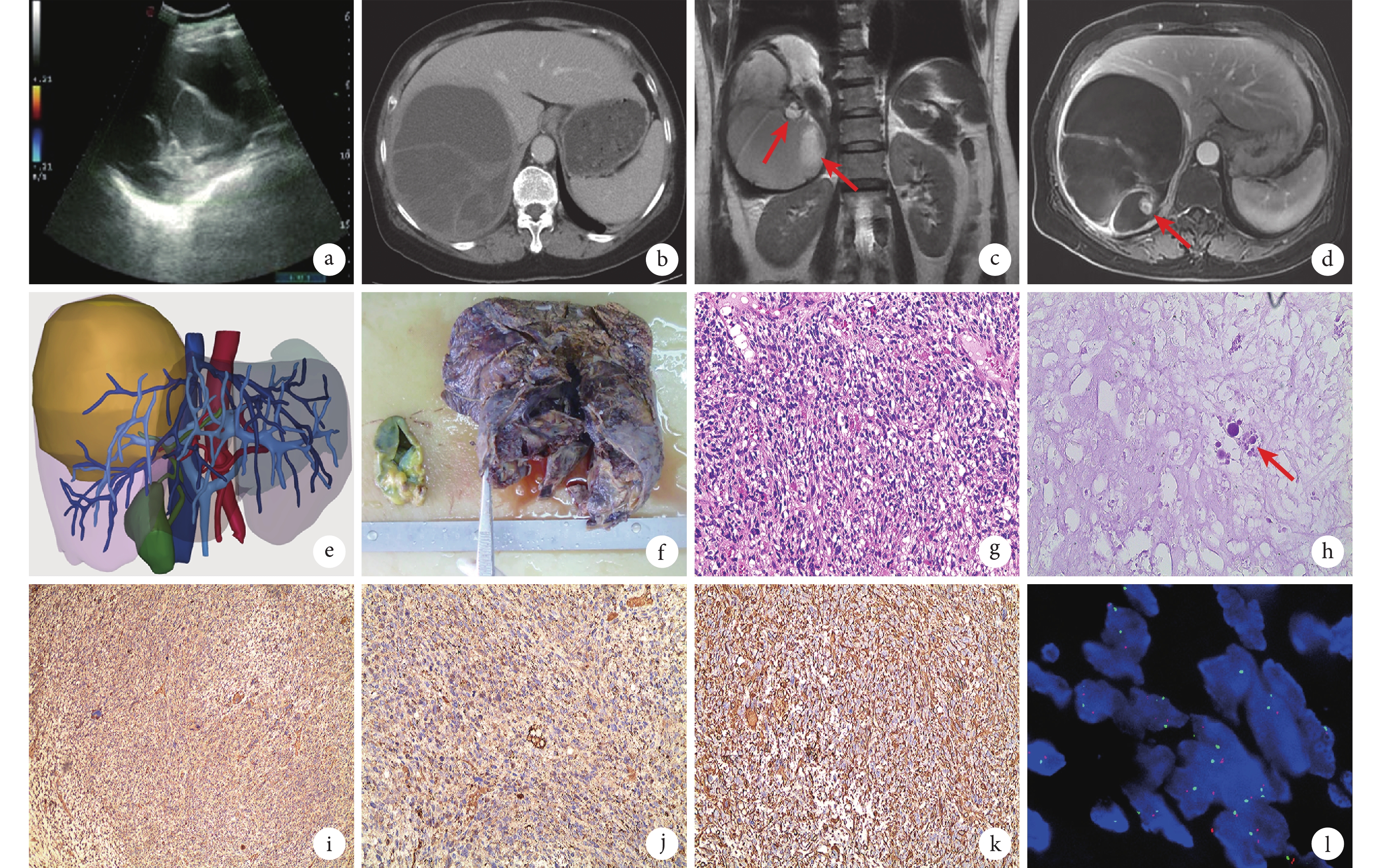
患者,女,63歲,以主訴“右上腹痛6 d余”來筆者所在醫院就診。患者于入院前6 d體力勞動后出現右季肋區劇烈疼痛,痛感向后背反射,難以忍受,伴惡心、腹脹,無寒戰、發熱,無胸悶、氣喘,無眼黃、皮膚黃,無便血、黑便等情況。就診于當地醫院急診科,行腹部超聲檢查提示右肝囊性腫物,內透聲欠佳,囊內多發分隔回聲,未見明顯血流信號(圖1a)。經解痙、止痛等對癥處理后癥狀無好轉,遂來筆者所在醫院就診。查體:腹軟,右上腹觸痛明顯,無反跳痛,肝區叩擊痛陽性。行上腹部增強CT檢查,見肝右葉類圓形低密度影,邊界清,約11.0 cm×12.5 cm×13.4 cm大,密度不均,CT值20~51 HU,病灶內見分隔及斑片狀稍高密度影,部分見液平,增強掃描囊性成分未見強化,分隔可見輕度強化,考慮肝囊腺瘤伴囊內出血可能(圖1b)。行上腹部增強MRI檢查,見右肝團塊狀異常信號影,T1WI呈混雜低信號,其內見斑片狀高信號影,DWI呈混雜稍高信號,T2WI呈混雜高信號,其內見多發稍低信號分隔影,亦可見液液平面(圖1c)。連續增強掃描見病灶邊緣、分隔及壁結節明顯強化,病灶中央未見明顯強化,考慮黏液性囊腺類腫瘤(圖1d)。血常規、肝腎功能、尿常規等均未見異常。糖類抗原(carbohydrate antigen,CA)125輕度升高(42.90 U/mL),甲胎蛋白、癌胚抗原和CA199均正常。初步診斷:肝右葉黏液性囊腺瘤伴囊內出血。術前行肝臟三維重建(圖1e),估算全肝體積為1 518 mL,標準肝體積為1 211 mL,腫瘤占位為1 313 mL,切除肝(右半肝)體積為1 844 mL,預計切除功能性肝體積為531 mL,殘余肝(肝S1、S2、S3、S4)體積為628 mL,殘余肝體積/標準肝體積為51.9%,遂決定行腹腔鏡下右半肝切除術。
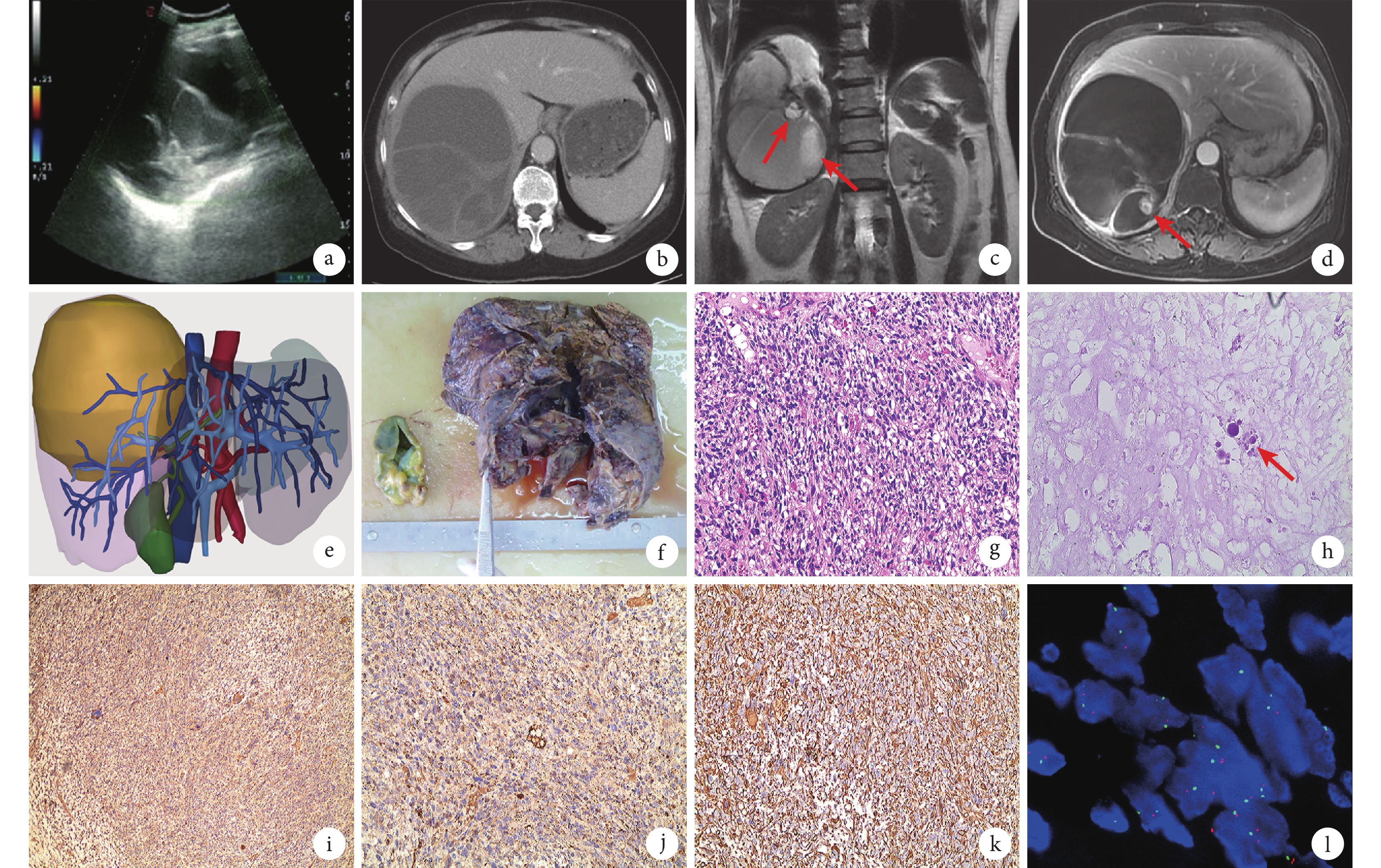 圖1
示患者術前影像學檢查及術后病理學檢查結果
圖1
示患者術前影像學檢查及術后病理學檢查結果
a:腹部超聲見右肝囊性腫物,囊內多發分隔回聲,未見明顯血流信號;b:CT增強掃描靜脈期腫瘤囊性成分未見強化,分隔可見輕度強化;c:T2WI冠狀位,囊內壁結節呈高信號(紅箭);d:T1WI門靜脈期增強序列,見病灶邊緣、分隔及壁結節明顯強化(紅箭);e:肝臟三維重建,黃色區域為腫瘤;f:手術切除大體標本;g:病理組織學改變(HE染色 ×100);h:未分化肉瘤巨細胞(紅箭),胞質內見染色陽性球形嗜酸性小體(過碘酸希夫染色 ×400);i~k:免疫組織化學染色(×100),α1-抗凝乳胰蛋白酶(++++,i)、α1-抗胰蛋白酶(+++,j)、波形蛋白(+++,k);l:雙微體同源基因2基因無擴增(熒光原位雜交法 ×1 000)
術中探查,見腫物位于肝右后方,與膈肌粘連致密。根據術中超聲定位,腫瘤位于肝中靜脈右側,切除過程中注意保護肝中靜脈。手術過程順利,腫瘤被完整切除,術中出血約300 mL。術后病理學檢查,大體(圖1f)觀:緊鄰離斷面見一約12 cm×11 cm×8 cm大囊性腫物,切面呈多房囊性,囊壁厚約0.3~0.5 cm,部分為實性區,面積5 cm×4 cm,切面灰紅色、質地軟,部分見出血。光鏡下見:瘤細胞呈梭形,多邊形或不規則形,排列松散,以黏液瘤基質為背景,考慮梭形細胞間葉源性腫瘤,手術切緣陰性(圖1g)。過碘酸希夫染色示胞質內染色陽性球形嗜酸性小體(圖1h)。免疫組織化學染色(圖1i~1k): CD31(+),CD34(+),Ki-67(40%熱點區),平滑肌肌動蛋白(++),波形蛋白(+++),肌間線蛋白(+),α1-抗胰蛋白酶(+++),磷脂酰肌醇聚糖-3(++),α1-抗凝乳胰蛋白酶(++++),胃腸間質瘤-1(++);肝細胞石蠟抗原1、細胞角蛋白、黑色素瘤相關抗原和CD21均為陰性。分子病理顯示雙微體同源基因2為陰性(圖1l)。病理結果符合肝臟未分化胚胎性肉瘤(undifferentiated embryonal sarcoma,UESL)診斷。患者術后第18天順利出院,術后規律行6周期輔助化療(IE方案:異環磷酰胺1.8 mg/m2+依托泊苷100 mg/m2)并密切隨訪。現已隨訪6個月未見腫瘤復發。
2 討論
肝臟UESL是一種高度惡性的肝臟間葉源性腫瘤,于1978年首次報道[1],主要在6~10歲兒童中發病,約占兒童肝臟惡性腫瘤的0.2%[2]。該病在成年人中十分罕見,有研究顯示近40年來國內外僅不到60例成人肝臟UESL病例報道[3],中位年齡約為25歲,男女比例近似1∶1.3,40歲以上患者僅10余例報道,最大年齡為86歲[4]。本例患者63歲,實屬罕見。肝臟UESL早期基本無癥狀,隨著腫瘤增大,瘤內出血現象多見,患者可急性出現右季肋區疼痛、納差等癥狀,全身炎癥指標如白細胞、C反應蛋白和血沉可升高,少數患者因腫瘤破裂而出現急腹癥表現[5-6],黃疸在肝臟UESL中并不常見[7]。目前尚無針對肝臟UESL的特異腫瘤標志物,多數病例報道中甲胎蛋白和癌胚抗原多在正常范圍,部分患者CA125及CA199有輕度升高[5, 8]。
肝臟UESL缺乏典型的影像學特征且實驗室檢查常無異常,臨床診斷困難,極易誤診為其他肝臟囊性病變,如肝囊腺瘤[7, 9]、肝膿腫[10]、肝包蟲病[11]、肝囊腫[5]、間葉性錯構瘤[6]、肝淋巴瘤[12]等。因腫瘤呈囊實性,不宜行穿刺活檢,術前診斷困難。影像學檢查雖不具備特征性表現,但存在一定規律。肝臟UESL內含黏液樣基質,在B超中表現為高回聲但在CT中為液性低密度,因此肝臟UESL在B超中通常表現為實性占優勢的混合回聲區[13],在CT中則多顯示囊變區明顯大于實性成分,且實性成分多位于腫瘤邊緣,出血灶于腫瘤內呈斑片狀分布[14],兩者檢查結果的異質性被認為是肝臟UESL較為特征性的影像學表現[8]。肝臟UESL在MRI T1加權成像顯示為混雜低信號多房性病變,在T2加權成像多呈囊實性混雜高信號影[6]。腫瘤內分隔和實性部分呈長T1和長T2混雜信號,DWI高信號,ADC值降低,通常表現為動脈期中度強化,門靜脈期及延遲期強化更明顯,并伴腫瘤血管影[9, 14]。此外,瘤內出血區域在T1加權圖像上為高信號而在T2加權圖像上為低信號[5]。本例患者右季肋區劇烈疼痛,CT顯示病灶斑片狀稍高信號影,部分見液平,MRI T2加權成像亦可見液液平面,均提示瘤內出血可能。應當注意的是,肝臟各類囊性腫瘤的最終確診有賴于術后病理學及免疫組化檢查,對于短期內快速增大的囊性腫瘤應警惕其惡性可能。
目前該病尚無規范化的治療方案,臨床預后較差,以往診斷后中位生存期不到1年[1],近年來,肝臟UESL患者的生存期有所改善,據報道5年總生存率為48.2%,而兒童為84.4%[15]。手術切除是目前肝臟UESL最主要且是唯一有可能治愈該疾病的治療方法,應根據腫瘤所處位置及大小決定手術方案[7]。肝臟UESL術中極易發生破裂,研究[8]顯示術中出現腫瘤包膜破裂者的平均生存時間僅10.5個月,預后明顯劣于腫瘤完整切除且術中未發生包膜破裂的患者,可能原因是腫瘤包膜破裂后囊液流入腹腔造成腹腔廣泛種植轉移。因此,術中精細解剖并避免腫瘤破裂是保證手術質量的關鍵,也是手術的難點,可選擇前入路右半肝切除術,以最大限度地避免腫瘤的搬動和擠壓,防止瘤體破裂[16]。
此外,有研究[17]報道手術聯合輔助化療較單純手術治療能有效改善腫瘤預后,患者1、3和5年總生存率(93% 比65%,80% 比40%,63% 比34%)明顯提高。術后輔助化療多參考橫紋肌肉瘤的化療方案,如長春新堿、放線菌素、環磷酰胺、異環磷酰胺、依托泊苷的聯合,可以有效防止腫瘤復發[18]。本病例選擇IE方案輔助化療6周期,患者耐受性良好,尚未見明顯腫瘤復發征象,但長期預后尚需進一步跟蹤隨訪。另外,對于腫瘤較大或多發轉移無法一期手術切除的病例,可采用介入栓塞治療或術前化療使腫瘤縮小以謀求手術機會[19]。也有文獻[20]報道,肝移植對于局部無法切除或手術后復發UESL亦有不錯的療效,可獲得較長無瘤存活期,移植術后腫瘤再次復發僅占7.1%。
綜上所述,老年肝臟UESL是一種十分罕見、術前診斷困難且極易誤診的肝臟惡性腫瘤。對于影像學上表現為肝巨大囊實性腫塊且囊內多分隔、壁結節,腫瘤包膜及分隔呈明顯強化的腫瘤應警惕肝臟UESL的可能。手術質量對于肝臟UESL患者的預后起到決定性作用,建議患者到經驗豐富的肝臟腫瘤外科中心進行治療。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:王源釗負責病例資料收集及論文撰寫;陳志堅、謝飛來和黃集躍負責圖片整理與文獻收集;陳永標和王瑜負責修改論文并最后定稿。
倫理聲明:本研究已通過聯勤保障部隊第九〇〇醫院生物醫學倫理審查委員會審批(批文編號:2023-044)。
1 病例資料
患者,女,63歲,以主訴“右上腹痛6 d余”來筆者所在醫院就診。患者于入院前6 d體力勞動后出現右季肋區劇烈疼痛,痛感向后背反射,難以忍受,伴惡心、腹脹,無寒戰、發熱,無胸悶、氣喘,無眼黃、皮膚黃,無便血、黑便等情況。就診于當地醫院急診科,行腹部超聲檢查提示右肝囊性腫物,內透聲欠佳,囊內多發分隔回聲,未見明顯血流信號(圖1a)。經解痙、止痛等對癥處理后癥狀無好轉,遂來筆者所在醫院就診。查體:腹軟,右上腹觸痛明顯,無反跳痛,肝區叩擊痛陽性。行上腹部增強CT檢查,見肝右葉類圓形低密度影,邊界清,約11.0 cm×12.5 cm×13.4 cm大,密度不均,CT值20~51 HU,病灶內見分隔及斑片狀稍高密度影,部分見液平,增強掃描囊性成分未見強化,分隔可見輕度強化,考慮肝囊腺瘤伴囊內出血可能(圖1b)。行上腹部增強MRI檢查,見右肝團塊狀異常信號影,T1WI呈混雜低信號,其內見斑片狀高信號影,DWI呈混雜稍高信號,T2WI呈混雜高信號,其內見多發稍低信號分隔影,亦可見液液平面(圖1c)。連續增強掃描見病灶邊緣、分隔及壁結節明顯強化,病灶中央未見明顯強化,考慮黏液性囊腺類腫瘤(圖1d)。血常規、肝腎功能、尿常規等均未見異常。糖類抗原(carbohydrate antigen,CA)125輕度升高(42.90 U/mL),甲胎蛋白、癌胚抗原和CA199均正常。初步診斷:肝右葉黏液性囊腺瘤伴囊內出血。術前行肝臟三維重建(圖1e),估算全肝體積為1 518 mL,標準肝體積為1 211 mL,腫瘤占位為1 313 mL,切除肝(右半肝)體積為1 844 mL,預計切除功能性肝體積為531 mL,殘余肝(肝S1、S2、S3、S4)體積為628 mL,殘余肝體積/標準肝體積為51.9%,遂決定行腹腔鏡下右半肝切除術。
 圖1
示患者術前影像學檢查及術后病理學檢查結果
圖1
示患者術前影像學檢查及術后病理學檢查結果
a:腹部超聲見右肝囊性腫物,囊內多發分隔回聲,未見明顯血流信號;b:CT增強掃描靜脈期腫瘤囊性成分未見強化,分隔可見輕度強化;c:T2WI冠狀位,囊內壁結節呈高信號(紅箭);d:T1WI門靜脈期增強序列,見病灶邊緣、分隔及壁結節明顯強化(紅箭);e:肝臟三維重建,黃色區域為腫瘤;f:手術切除大體標本;g:病理組織學改變(HE染色 ×100);h:未分化肉瘤巨細胞(紅箭),胞質內見染色陽性球形嗜酸性小體(過碘酸希夫染色 ×400);i~k:免疫組織化學染色(×100),α1-抗凝乳胰蛋白酶(++++,i)、α1-抗胰蛋白酶(+++,j)、波形蛋白(+++,k);l:雙微體同源基因2基因無擴增(熒光原位雜交法 ×1 000)
術中探查,見腫物位于肝右后方,與膈肌粘連致密。根據術中超聲定位,腫瘤位于肝中靜脈右側,切除過程中注意保護肝中靜脈。手術過程順利,腫瘤被完整切除,術中出血約300 mL。術后病理學檢查,大體(圖1f)觀:緊鄰離斷面見一約12 cm×11 cm×8 cm大囊性腫物,切面呈多房囊性,囊壁厚約0.3~0.5 cm,部分為實性區,面積5 cm×4 cm,切面灰紅色、質地軟,部分見出血。光鏡下見:瘤細胞呈梭形,多邊形或不規則形,排列松散,以黏液瘤基質為背景,考慮梭形細胞間葉源性腫瘤,手術切緣陰性(圖1g)。過碘酸希夫染色示胞質內染色陽性球形嗜酸性小體(圖1h)。免疫組織化學染色(圖1i~1k): CD31(+),CD34(+),Ki-67(40%熱點區),平滑肌肌動蛋白(++),波形蛋白(+++),肌間線蛋白(+),α1-抗胰蛋白酶(+++),磷脂酰肌醇聚糖-3(++),α1-抗凝乳胰蛋白酶(++++),胃腸間質瘤-1(++);肝細胞石蠟抗原1、細胞角蛋白、黑色素瘤相關抗原和CD21均為陰性。分子病理顯示雙微體同源基因2為陰性(圖1l)。病理結果符合肝臟未分化胚胎性肉瘤(undifferentiated embryonal sarcoma,UESL)診斷。患者術后第18天順利出院,術后規律行6周期輔助化療(IE方案:異環磷酰胺1.8 mg/m2+依托泊苷100 mg/m2)并密切隨訪。現已隨訪6個月未見腫瘤復發。
2 討論
肝臟UESL是一種高度惡性的肝臟間葉源性腫瘤,于1978年首次報道[1],主要在6~10歲兒童中發病,約占兒童肝臟惡性腫瘤的0.2%[2]。該病在成年人中十分罕見,有研究顯示近40年來國內外僅不到60例成人肝臟UESL病例報道[3],中位年齡約為25歲,男女比例近似1∶1.3,40歲以上患者僅10余例報道,最大年齡為86歲[4]。本例患者63歲,實屬罕見。肝臟UESL早期基本無癥狀,隨著腫瘤增大,瘤內出血現象多見,患者可急性出現右季肋區疼痛、納差等癥狀,全身炎癥指標如白細胞、C反應蛋白和血沉可升高,少數患者因腫瘤破裂而出現急腹癥表現[5-6],黃疸在肝臟UESL中并不常見[7]。目前尚無針對肝臟UESL的特異腫瘤標志物,多數病例報道中甲胎蛋白和癌胚抗原多在正常范圍,部分患者CA125及CA199有輕度升高[5, 8]。
肝臟UESL缺乏典型的影像學特征且實驗室檢查常無異常,臨床診斷困難,極易誤診為其他肝臟囊性病變,如肝囊腺瘤[7, 9]、肝膿腫[10]、肝包蟲病[11]、肝囊腫[5]、間葉性錯構瘤[6]、肝淋巴瘤[12]等。因腫瘤呈囊實性,不宜行穿刺活檢,術前診斷困難。影像學檢查雖不具備特征性表現,但存在一定規律。肝臟UESL內含黏液樣基質,在B超中表現為高回聲但在CT中為液性低密度,因此肝臟UESL在B超中通常表現為實性占優勢的混合回聲區[13],在CT中則多顯示囊變區明顯大于實性成分,且實性成分多位于腫瘤邊緣,出血灶于腫瘤內呈斑片狀分布[14],兩者檢查結果的異質性被認為是肝臟UESL較為特征性的影像學表現[8]。肝臟UESL在MRI T1加權成像顯示為混雜低信號多房性病變,在T2加權成像多呈囊實性混雜高信號影[6]。腫瘤內分隔和實性部分呈長T1和長T2混雜信號,DWI高信號,ADC值降低,通常表現為動脈期中度強化,門靜脈期及延遲期強化更明顯,并伴腫瘤血管影[9, 14]。此外,瘤內出血區域在T1加權圖像上為高信號而在T2加權圖像上為低信號[5]。本例患者右季肋區劇烈疼痛,CT顯示病灶斑片狀稍高信號影,部分見液平,MRI T2加權成像亦可見液液平面,均提示瘤內出血可能。應當注意的是,肝臟各類囊性腫瘤的最終確診有賴于術后病理學及免疫組化檢查,對于短期內快速增大的囊性腫瘤應警惕其惡性可能。
目前該病尚無規范化的治療方案,臨床預后較差,以往診斷后中位生存期不到1年[1],近年來,肝臟UESL患者的生存期有所改善,據報道5年總生存率為48.2%,而兒童為84.4%[15]。手術切除是目前肝臟UESL最主要且是唯一有可能治愈該疾病的治療方法,應根據腫瘤所處位置及大小決定手術方案[7]。肝臟UESL術中極易發生破裂,研究[8]顯示術中出現腫瘤包膜破裂者的平均生存時間僅10.5個月,預后明顯劣于腫瘤完整切除且術中未發生包膜破裂的患者,可能原因是腫瘤包膜破裂后囊液流入腹腔造成腹腔廣泛種植轉移。因此,術中精細解剖并避免腫瘤破裂是保證手術質量的關鍵,也是手術的難點,可選擇前入路右半肝切除術,以最大限度地避免腫瘤的搬動和擠壓,防止瘤體破裂[16]。
此外,有研究[17]報道手術聯合輔助化療較單純手術治療能有效改善腫瘤預后,患者1、3和5年總生存率(93% 比65%,80% 比40%,63% 比34%)明顯提高。術后輔助化療多參考橫紋肌肉瘤的化療方案,如長春新堿、放線菌素、環磷酰胺、異環磷酰胺、依托泊苷的聯合,可以有效防止腫瘤復發[18]。本病例選擇IE方案輔助化療6周期,患者耐受性良好,尚未見明顯腫瘤復發征象,但長期預后尚需進一步跟蹤隨訪。另外,對于腫瘤較大或多發轉移無法一期手術切除的病例,可采用介入栓塞治療或術前化療使腫瘤縮小以謀求手術機會[19]。也有文獻[20]報道,肝移植對于局部無法切除或手術后復發UESL亦有不錯的療效,可獲得較長無瘤存活期,移植術后腫瘤再次復發僅占7.1%。
綜上所述,老年肝臟UESL是一種十分罕見、術前診斷困難且極易誤診的肝臟惡性腫瘤。對于影像學上表現為肝巨大囊實性腫塊且囊內多分隔、壁結節,腫瘤包膜及分隔呈明顯強化的腫瘤應警惕肝臟UESL的可能。手術質量對于肝臟UESL患者的預后起到決定性作用,建議患者到經驗豐富的肝臟腫瘤外科中心進行治療。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:王源釗負責病例資料收集及論文撰寫;陳志堅、謝飛來和黃集躍負責圖片整理與文獻收集;陳永標和王瑜負責修改論文并最后定稿。
倫理聲明:本研究已通過聯勤保障部隊第九〇〇醫院生物醫學倫理審查委員會審批(批文編號:2023-044)。