引用本文: 汪宏翔, 徐杰, 王佳國, 游科, 劉作金. 經腸系膜上動脈右后入路聯合鉤突優先腹腔鏡胰十二指腸切除術的初步探索和體會. 中國普外基礎與臨床雜志, 2023, 30(11): 1289-1293. doi: 10.7507/1007-9424.202309032 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
胰十二指腸切除術是可切除胰腺癌、膽管下段癌、壺腹部周圍癌、十二指腸癌的標準手術方式[1-2]。此手術涉及到多器官聯合切除及消化道重建,包括胰腸吻合、膽腸吻合、胃腸吻合,手術難度大,對手術醫生的技術要求較高。近年來隨著腹腔鏡手術理論和技術的不斷進步,腹腔鏡下的胰十二指腸切除也能廣泛開展[3]。根據腫瘤的性質、部位、大小、血管侵犯等情況的不同,出現了不同的手術入路[4]。其中主要以靜脈入路及動脈優先入路較為常見[5],動脈入路分為:右后入路、左后側入路、結腸系膜下方入路、前方入路等[6-7]。由于胰腺鉤突解剖位置較深,周圍血管復雜多變,切除過程常導致出血及鉤突組織的殘留,因而鉤突的安全完整切除成為了本手術的難點。為此,有學者提出“鉤突優先”的理念,即優先解剖、離斷鉤突,達到胰腺鉤突及系膜無殘留[8]。
筆者所在中心將動脈入路和鉤突優先的理念相結合,提出一種“右后入路聯合鉤突優先”的腹腔鏡胰十二指腸切除術(laparoscopic pancreaticodu-odenectomy,LPD)入路方式,并應用于臨床實踐。其優勢在于:第一,優先判斷腫瘤是否侵犯動脈,以進一步評判腫瘤的可切除性;第二,優先處理鉤突系膜及供血的動脈,將標本去血管化,能夠更好地實現腫瘤R0切除的同時減少了出血;第三,胰腺頸部的后離斷,可以避免過早離斷胰腺導致胰液持續性流入腹腔引起腹腔污染;第四,對于存在來自于腸系膜上動脈(superior mesenteric artery,SMA)的變異右肝動脈的LPD病例中,此種手術入路可提前顯露變異的動脈,避免了異位血管損傷的概率。目前筆者所在中心已完成5例該入路方式的LPD手術,現結合此5例患者的手術主要流程及相關資料,對此入路方式進行分析總結。
1 資料與方法
1.1 本研究納入及排除標準
納入標準:① 病理或影像診斷為胰頭惡性腫瘤、膽管惡性腫瘤、壺腹周圍惡性腫瘤、十二指腸惡性腫瘤;② 患者全身狀況良好,經多學科評估心、肺、肝、腎功能可以耐受手術;③ 無肝臟及遠處轉移,無腹水等惡病質。排除標準:① 患者存在嚴重心肺功能障礙等不可耐受手術情況;② 慢性胰腺炎等疾病導致周圍粘連嚴重、無法行擴大的Kocher切口;③ 預期壽命較短。
1.2 臨床資料
回顧性收集2022年12月至2023年5月期間于重慶醫科大學附屬第二醫院(后文簡稱我院)肝膽外科接受SMA右后入路聯合鉤突優先的LPD手術的5例患者的臨床病例資料。所有患者術前均完善腹部增強CT、MR增強、超聲內鏡或組織病理活檢診斷為惡性腫瘤,無周圍血管侵犯及遠處轉移。術前血常規、肝腎功能、心肺功能檢查無絕對手術禁忌證。術前麻醉評估美國麻醉醫師協會(American Society of Anesthesiologists,ASA)分級Ⅰ~Ⅱ級。5例患者中,男3例,女2例;術前病理診斷為十二指腸乳頭癌2例,胰頭癌3例;腫瘤直徑均小于2 cm。本組5例患者術前均進行MDT討論,均適合行SMA右后入路聯合鉤突優先的LPD手術方式,進行術前風險溝通,患者及家屬均知情同意。
1.3 方法
以下以一59歲女性患者為例闡述具體方法(圖1),其余4例患者主要的方法與此例類似,根據具體情況進行調整。
 圖1
示一59歲女性患者的影像學資料
圖1
示一59歲女性患者的影像學資料
a:手術視頻(請掃碼觀看);b:上腹部CT增強動脈期,黃箭所指為腫瘤所在位置;c:上腹部CT增強門靜脈期,黃箭所指為腫瘤所在位置;d:上腹部CTA顯示右肝動脈發自腹腔干(celiac axis,CA)根部;RHA:肝右動脈(right hepatic artery);GDA:胃十二指腸動脈(gastroduodenal artery);LHA:肝左動脈(left hepatic artery);CHA:肝總動脈(common hepatic artery);SA:脾動脈(splenic artery)
1.3.1 患者的臨床病理資料
患者女,59歲,因“皮膚鞏膜黃染伴皮膚瘙癢15 d”入院。既往史及個人史無特殊。查體:皮膚、鞏膜明顯黃染,腹部平坦,全腹無明顯壓痛、反跳痛,無肌緊張,未觸及腹部包塊,肝、脾肋下未觸及,可觸及膽囊,無明顯觸痛,Murphy征陰性,腸鳴音正常,移動性濁音陰性。實驗室檢查:丙氨酸氨基轉移酶218 U/L(↑),天門冬氨酸氨基轉移酶130 U/L(↑),總膽紅素218.2 U/L(↑),直接膽紅素162.9 U/L(↑),白蛋白39.8 g/L(↓),前白蛋白199 mg/L。腫瘤標志物:糖類抗原–125 6.28 U/mL,糖類抗原-199 0.39 U/mL,組織多肽抗原199.8 U/L(↑),癌胚抗原4.21 ng/mL。影像學檢查:上腹部動脈計算機斷層掃描血管造影(computed tomography angiography,CTA)示壺腹部占位,考慮腫瘤性病變,致肝內膽管明顯擴張。術前病理活檢提示:壺腹部惡性腫瘤。
1.3.2 術前討論
組織我院多學科MDT討論結果:患者中年女性,結合患者影像學、腫瘤標志物及術前活檢,考慮壺腹部惡性腫瘤,未見遠處轉移,術前評估為可切除腫瘤。擬行經SMA右后入路聯合鉤突優先的LPD。
1.3.3 戳卡布局及體位
患者采用人字位,右側稍高,主刀站于患者右側,一助于左側,二助于患者雙腿間扶鏡,具體術中站位可隨時調整。采用5孔法戳卡布局,觀察孔位于臍下0.5 cm,右側肋緣下鎖骨中線與腋前線中點12 mm戳孔,右側鎖骨中線肋緣下方5 cm處12 mm戳孔,左側肋緣下鎖骨中線與腋前線中點12 mm戳孔,左側鎖骨中線肋緣下方5 cm處12 mm戳孔。根據具體情況可適當做出調整。
1.3.4 手術步驟
腹腔探查:腹腔未見遠處轉移。游離十二指腸。打開胃結腸韌帶,鈍性及銳性相結合繼續從左向右分離橫結腸系膜和胃系膜融合筋膜,沿著Toldt’s筋膜前間隙充分下降結腸肝區。順胰腺下緣顯露SMV主干,沿著主干走行向尾側分離顯露Henle干后離斷。進一步沿SMV右側向尾側游離下降橫結腸系膜,充分顯露十二指腸水平部。取Kocher切口,于下腔靜脈前間隙充分游離十二指腸水平部,顯露左腎靜脈(圖2a)。第一肝門淋巴結清掃。分離膽囊三角,顯露膽囊管及膽囊動脈,保留側雙重結扎,切除膽囊。懸吊肝臟,沿胰頸上緣第8組淋巴結下緣切開,顯露肝總動脈,彈性懸吊;沿肝總動脈向頭側走行清掃12a組淋巴結,顯露離斷胃右血管;顯露GDA,保留側予以4號線結扎,再予雙重夾閉后離斷。沿肝固有動脈、左右肝動脈、門靜脈主干清掃12a及12p組淋巴結至左右門靜脈分支;于左右肝管匯合部下方2 cm處離斷肝總管,保留側予以哈巴狗臨時夾閉肝總管。本病例存在變異的右肝動脈,來源于CA并走行于膽管后方。彈性懸吊門靜脈,完整清掃12組淋巴結;沿右肝動脈向足側清掃周圍淋巴結至CA,完整顯露右肝動脈。
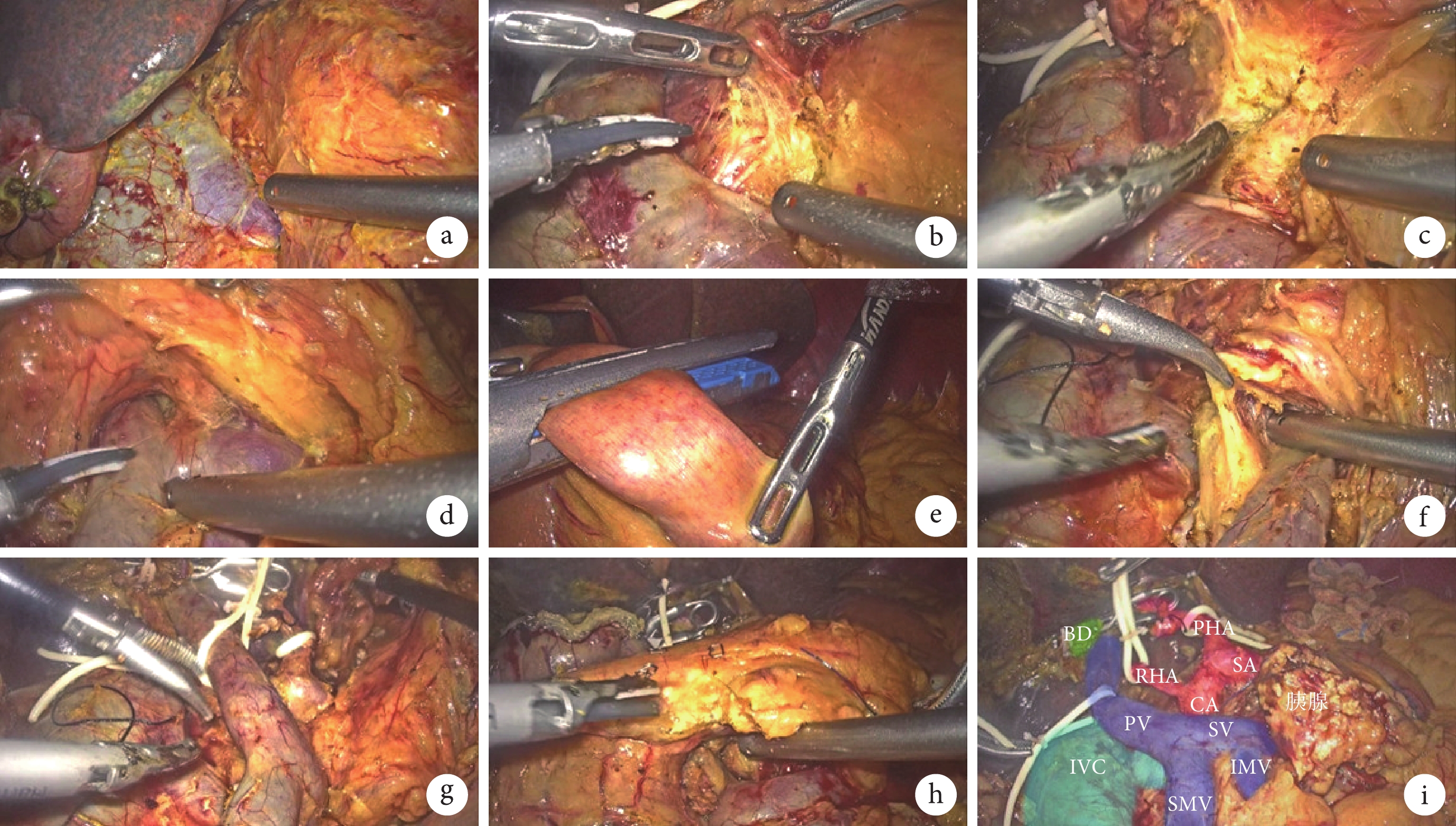
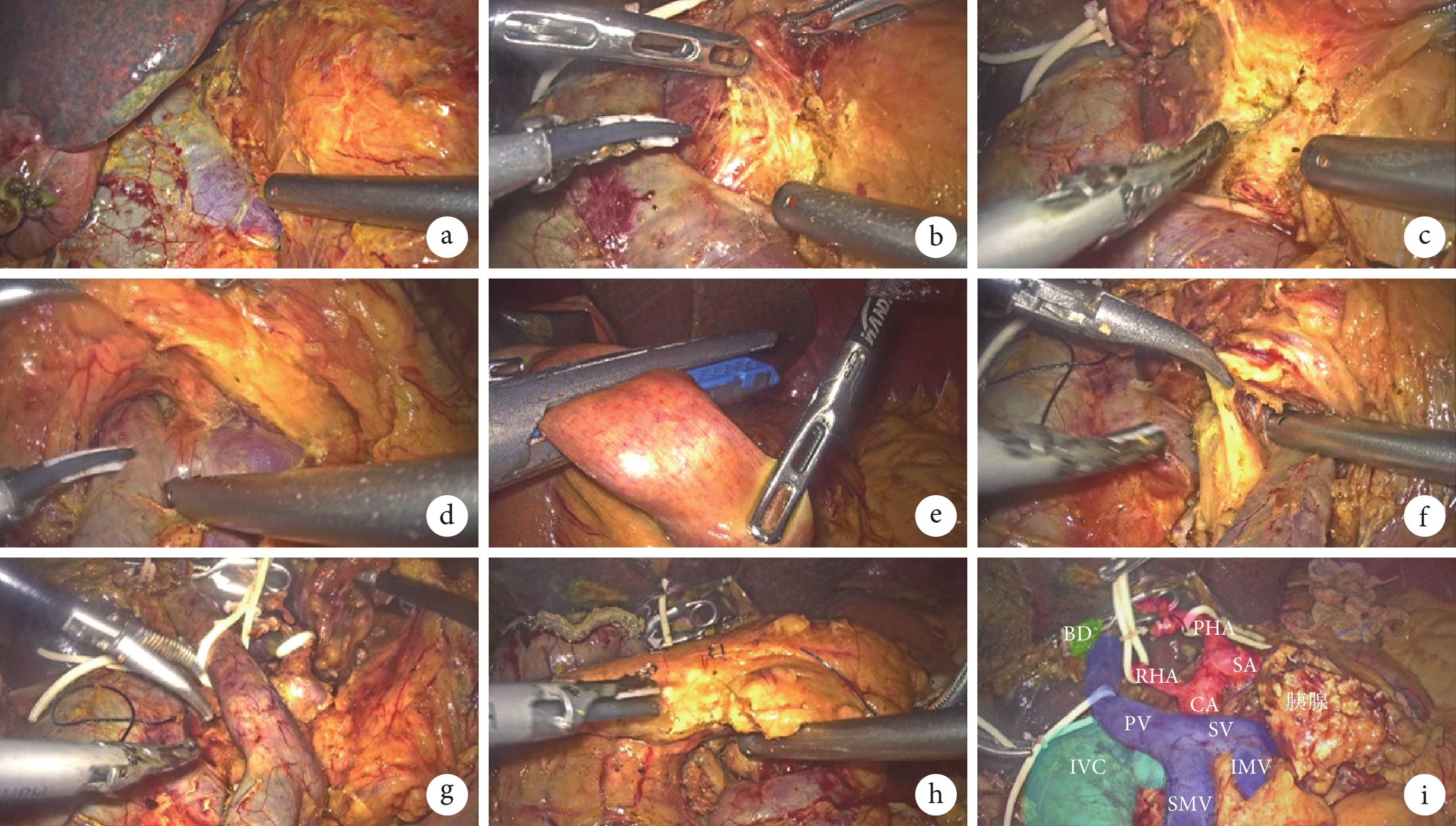 圖2
示手術關鍵步驟
圖2
示手術關鍵步驟
a:打開Kocher切口,顯露下腔靜脈和左腎靜脈;b:SMA右后方入路,探查SMA根部血管有無腫瘤侵犯;c:沿SMA主干走行由根部進行鉤突系膜的離斷;d:貫穿胰后隧道;e:距離屈氏韌帶15 cm處離斷空腸;f:沿SMA走行進行鉤突系膜離斷及供血動脈分支的處理;g:胰十二指腸標本完整去血管化;h:最后離斷胰腺;i:手術標本切除后畫面;BD:膽管(bile duct);PHA:肝固有動脈(proper hepatic artery);PV: 門靜脈(portal vein);SV:脾靜脈(splenic vein);IMV:腸系膜下靜脈( inferior mesenteric vein);IVC:下腔靜脈(inferior vena cava)
SMA右側入路下的鉤突先行切除:助手向左側提起胰頭和十二指腸,沿左腎靜脈與下腔靜脈夾角處進行16a2組淋巴結清掃;于SMA根部打開表面血管鞘,顯露SMA主干走行,向尾側走行清掃14a組淋巴結(圖2b);于SMA根部上方3 cm區域清除右側180° 神經鞘,顯露CA根部,清除SMA及CA根部海德堡三角區域的神經及淋巴組織。顯露清除CA主干上方走行的9組淋巴結(圖2c);然后繼續沿左側膈肌角走行清掃16a1組淋巴結;沿SMV主干走行貫穿胰后隧道,并適當向右側游離胰腺頸部(圖2d);打開左側“L”孔,距離屈氏韌帶遠端15 cm處離斷空腸,并將腸系膜根部后方牽拉至右側(圖2e);沿SMA走行方向頭側分別處理供血的動脈分支,即胰十二指腸下動脈(inferior pancreaticoduodenal artery,IPDA)和鉤突動脈,分別予以夾閉后離斷,直到完整解離SMA與胰腺標本(圖2f);沿SMV-門靜脈軸后方繼續完整清掃海德堡三角區淋巴結至CA;解離門靜脈系統與胰腺標本(圖2g)。離斷胰腺頸部,胰管予以剪刀銳性離斷(圖2h)。一次性切割閉合器離斷胃,以en-bloc切除標本并完成淋巴結清掃(圖2i)。將標本裝袋,延長觀察孔切口長約5 cm,取出標本。然后依次完成胰腸、膽腸和胃腸吻合。
2 結果
5例患者均成功完成SMA右后入路聯合鉤突優先的LPD手術,無中轉開腹,手術時間為(366±51)min,術中出血量為(140±42)mL,術后住院時間為(11±2)d。患者于術后第1天拔除胃管及導尿管,并可經口補充腸內營養制劑,并取腹腔引流液送檢評估是否存在胰瘺。術后病理回示均達到R0切除。病理學檢查:2例胰頭高分化導管腺癌,1例胰頭中-低分化導管腺癌,1例胰頭低分化導管腺癌,1例十二指腸乳頭中-低分化腺癌。術后患者均未出現胃腸瘺、膽汁漏,無明顯胃癱,2例患者出現生化瘺。5例患者術后隨訪時間為(7±2)個月,隨訪期間均未出現復發。5例患者的基本資料見表1。
3 討論
以SMV-門靜脈為中心的傳統入路是LPD最為基礎的入路。在靜脈入路中需早期離斷胰頸,可能導致不可切除腫瘤(SMA受累)無法早期發現而被迫采取R1甚至R2切除[6]。以SMA為中心的動脈入路可盡早判斷SMA、CA等重要動脈是否受侵,并能提前顯露變異的右肝動脈以避免副損傷[9]。因此,以SMA為中心的動脈入路行LPD已日趨廣泛。
胰腺鉤突解剖位置深在,由胰十二指腸下動脈與胰背動脈右支來源的鉤突動脈環同時供血,并形成豐富的交通支[10]。因此,鉤突的解剖分離歷來是LPD的難點,其核心點在于如何完整切除鉤突系膜及有效控制切除過程中的出血[11]。筆者團隊近期采用SMA右后入路聯合鉤突優先的入路方式,手術均順利完成,且取得了較為滿意的臨床療效。在此研究中,5例患者均采用SMA右后入路聯合鉤突優先的手術方式,術中出血量為(140±42)mL,手術時間為(366±51)min,術后住院時間為(11±2)d,與Shin等[12]、Nickel等[13]、楊帆等[14]的研究中報道的術中出血量、手術時間、術后住院時間等相近。本研究中出現的術后并發癥均為A級胰瘺,此類并發癥對臨床預后影響小,不會延長住院時間,說明此種右后入路聯合鉤突優先的手術入路是安全可行的。
右后入路聯合鉤突優先的手術入路通過顯露SMA根部及CA根部,具有以下優勢:首先,可在離斷胰腺前判斷有無動脈的侵犯,提高R0切除率,并顯露保護變異的來源于SMA或CA的變異右肝動脈,減少副損傷。其次,海德堡三角區淋巴結清掃不全及胰腺系膜的不完整切除是術后腫瘤復發的重要原因[15-16]。右后方入路不僅能輕松完成海德堡三角區域淋巴結的清掃,還能薄層化胰腺系膜[17-19],使得再由SMA足側向近心端方向進行的鉤突系膜離斷變得容易。本手術方式最后行胰腺及胃的離斷,此時胰頸部及胰頭部的血供已完全離斷,斷胰腺時出血量明顯減少。同時,還縮短了胰液對腹腔的污染時間。胃腸液、膽汁、胰液等消化液的污染,是術后腹腔感染及術后切口感染的獨立危險因素[19-20]。而腹腔感染會對術后B/C級胰瘺的發生有不良影響,同時嚴重的腹腔內感染會提高患者的死亡率[21-22]。
不過SMA右后入路需要行擴大的Kocher切口,同時助手需將擬切除標本向左上方牽拉暴露,根據腫瘤“no-touch原則”,對于直徑較大的腫瘤,有擠壓腫瘤增加種植轉移的風險[23]。據此,筆者認為較小的腫瘤可能才適合此入路方式,術者應根據腫瘤的具體情況及自己對SMA不同角度解剖的熟悉理解程度去制定個體化的手術入路來完成手術[24-25]。
總之,經SMA右后入路聯合鉤突優先的LPD是一種安全、可行的手術入路,尤其適用于直徑≤2 cm的可切除腫瘤。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:劉作金作為主要研究者,參與設計研究;王佳國、游科收集并處理數據;汪宏翔撰寫論文初稿;徐杰進行論文的修改及視頻剪輯。所有作者都閱讀并批準了最終稿件。
倫理聲明:本研究已通過重慶醫科大學的倫理審核批準。
胰十二指腸切除術是可切除胰腺癌、膽管下段癌、壺腹部周圍癌、十二指腸癌的標準手術方式[1-2]。此手術涉及到多器官聯合切除及消化道重建,包括胰腸吻合、膽腸吻合、胃腸吻合,手術難度大,對手術醫生的技術要求較高。近年來隨著腹腔鏡手術理論和技術的不斷進步,腹腔鏡下的胰十二指腸切除也能廣泛開展[3]。根據腫瘤的性質、部位、大小、血管侵犯等情況的不同,出現了不同的手術入路[4]。其中主要以靜脈入路及動脈優先入路較為常見[5],動脈入路分為:右后入路、左后側入路、結腸系膜下方入路、前方入路等[6-7]。由于胰腺鉤突解剖位置較深,周圍血管復雜多變,切除過程常導致出血及鉤突組織的殘留,因而鉤突的安全完整切除成為了本手術的難點。為此,有學者提出“鉤突優先”的理念,即優先解剖、離斷鉤突,達到胰腺鉤突及系膜無殘留[8]。
筆者所在中心將動脈入路和鉤突優先的理念相結合,提出一種“右后入路聯合鉤突優先”的腹腔鏡胰十二指腸切除術(laparoscopic pancreaticodu-odenectomy,LPD)入路方式,并應用于臨床實踐。其優勢在于:第一,優先判斷腫瘤是否侵犯動脈,以進一步評判腫瘤的可切除性;第二,優先處理鉤突系膜及供血的動脈,將標本去血管化,能夠更好地實現腫瘤R0切除的同時減少了出血;第三,胰腺頸部的后離斷,可以避免過早離斷胰腺導致胰液持續性流入腹腔引起腹腔污染;第四,對于存在來自于腸系膜上動脈(superior mesenteric artery,SMA)的變異右肝動脈的LPD病例中,此種手術入路可提前顯露變異的動脈,避免了異位血管損傷的概率。目前筆者所在中心已完成5例該入路方式的LPD手術,現結合此5例患者的手術主要流程及相關資料,對此入路方式進行分析總結。
1 資料與方法
1.1 本研究納入及排除標準
納入標準:① 病理或影像診斷為胰頭惡性腫瘤、膽管惡性腫瘤、壺腹周圍惡性腫瘤、十二指腸惡性腫瘤;② 患者全身狀況良好,經多學科評估心、肺、肝、腎功能可以耐受手術;③ 無肝臟及遠處轉移,無腹水等惡病質。排除標準:① 患者存在嚴重心肺功能障礙等不可耐受手術情況;② 慢性胰腺炎等疾病導致周圍粘連嚴重、無法行擴大的Kocher切口;③ 預期壽命較短。
1.2 臨床資料
回顧性收集2022年12月至2023年5月期間于重慶醫科大學附屬第二醫院(后文簡稱我院)肝膽外科接受SMA右后入路聯合鉤突優先的LPD手術的5例患者的臨床病例資料。所有患者術前均完善腹部增強CT、MR增強、超聲內鏡或組織病理活檢診斷為惡性腫瘤,無周圍血管侵犯及遠處轉移。術前血常規、肝腎功能、心肺功能檢查無絕對手術禁忌證。術前麻醉評估美國麻醉醫師協會(American Society of Anesthesiologists,ASA)分級Ⅰ~Ⅱ級。5例患者中,男3例,女2例;術前病理診斷為十二指腸乳頭癌2例,胰頭癌3例;腫瘤直徑均小于2 cm。本組5例患者術前均進行MDT討論,均適合行SMA右后入路聯合鉤突優先的LPD手術方式,進行術前風險溝通,患者及家屬均知情同意。
1.3 方法
以下以一59歲女性患者為例闡述具體方法(圖1),其余4例患者主要的方法與此例類似,根據具體情況進行調整。
 圖1
示一59歲女性患者的影像學資料
圖1
示一59歲女性患者的影像學資料
a:手術視頻(請掃碼觀看);b:上腹部CT增強動脈期,黃箭所指為腫瘤所在位置;c:上腹部CT增強門靜脈期,黃箭所指為腫瘤所在位置;d:上腹部CTA顯示右肝動脈發自腹腔干(celiac axis,CA)根部;RHA:肝右動脈(right hepatic artery);GDA:胃十二指腸動脈(gastroduodenal artery);LHA:肝左動脈(left hepatic artery);CHA:肝總動脈(common hepatic artery);SA:脾動脈(splenic artery)
1.3.1 患者的臨床病理資料
患者女,59歲,因“皮膚鞏膜黃染伴皮膚瘙癢15 d”入院。既往史及個人史無特殊。查體:皮膚、鞏膜明顯黃染,腹部平坦,全腹無明顯壓痛、反跳痛,無肌緊張,未觸及腹部包塊,肝、脾肋下未觸及,可觸及膽囊,無明顯觸痛,Murphy征陰性,腸鳴音正常,移動性濁音陰性。實驗室檢查:丙氨酸氨基轉移酶218 U/L(↑),天門冬氨酸氨基轉移酶130 U/L(↑),總膽紅素218.2 U/L(↑),直接膽紅素162.9 U/L(↑),白蛋白39.8 g/L(↓),前白蛋白199 mg/L。腫瘤標志物:糖類抗原–125 6.28 U/mL,糖類抗原-199 0.39 U/mL,組織多肽抗原199.8 U/L(↑),癌胚抗原4.21 ng/mL。影像學檢查:上腹部動脈計算機斷層掃描血管造影(computed tomography angiography,CTA)示壺腹部占位,考慮腫瘤性病變,致肝內膽管明顯擴張。術前病理活檢提示:壺腹部惡性腫瘤。
1.3.2 術前討論
組織我院多學科MDT討論結果:患者中年女性,結合患者影像學、腫瘤標志物及術前活檢,考慮壺腹部惡性腫瘤,未見遠處轉移,術前評估為可切除腫瘤。擬行經SMA右后入路聯合鉤突優先的LPD。
1.3.3 戳卡布局及體位
患者采用人字位,右側稍高,主刀站于患者右側,一助于左側,二助于患者雙腿間扶鏡,具體術中站位可隨時調整。采用5孔法戳卡布局,觀察孔位于臍下0.5 cm,右側肋緣下鎖骨中線與腋前線中點12 mm戳孔,右側鎖骨中線肋緣下方5 cm處12 mm戳孔,左側肋緣下鎖骨中線與腋前線中點12 mm戳孔,左側鎖骨中線肋緣下方5 cm處12 mm戳孔。根據具體情況可適當做出調整。
1.3.4 手術步驟
腹腔探查:腹腔未見遠處轉移。游離十二指腸。打開胃結腸韌帶,鈍性及銳性相結合繼續從左向右分離橫結腸系膜和胃系膜融合筋膜,沿著Toldt’s筋膜前間隙充分下降結腸肝區。順胰腺下緣顯露SMV主干,沿著主干走行向尾側分離顯露Henle干后離斷。進一步沿SMV右側向尾側游離下降橫結腸系膜,充分顯露十二指腸水平部。取Kocher切口,于下腔靜脈前間隙充分游離十二指腸水平部,顯露左腎靜脈(圖2a)。第一肝門淋巴結清掃。分離膽囊三角,顯露膽囊管及膽囊動脈,保留側雙重結扎,切除膽囊。懸吊肝臟,沿胰頸上緣第8組淋巴結下緣切開,顯露肝總動脈,彈性懸吊;沿肝總動脈向頭側走行清掃12a組淋巴結,顯露離斷胃右血管;顯露GDA,保留側予以4號線結扎,再予雙重夾閉后離斷。沿肝固有動脈、左右肝動脈、門靜脈主干清掃12a及12p組淋巴結至左右門靜脈分支;于左右肝管匯合部下方2 cm處離斷肝總管,保留側予以哈巴狗臨時夾閉肝總管。本病例存在變異的右肝動脈,來源于CA并走行于膽管后方。彈性懸吊門靜脈,完整清掃12組淋巴結;沿右肝動脈向足側清掃周圍淋巴結至CA,完整顯露右肝動脈。
 圖2
示手術關鍵步驟
圖2
示手術關鍵步驟
a:打開Kocher切口,顯露下腔靜脈和左腎靜脈;b:SMA右后方入路,探查SMA根部血管有無腫瘤侵犯;c:沿SMA主干走行由根部進行鉤突系膜的離斷;d:貫穿胰后隧道;e:距離屈氏韌帶15 cm處離斷空腸;f:沿SMA走行進行鉤突系膜離斷及供血動脈分支的處理;g:胰十二指腸標本完整去血管化;h:最后離斷胰腺;i:手術標本切除后畫面;BD:膽管(bile duct);PHA:肝固有動脈(proper hepatic artery);PV: 門靜脈(portal vein);SV:脾靜脈(splenic vein);IMV:腸系膜下靜脈( inferior mesenteric vein);IVC:下腔靜脈(inferior vena cava)
SMA右側入路下的鉤突先行切除:助手向左側提起胰頭和十二指腸,沿左腎靜脈與下腔靜脈夾角處進行16a2組淋巴結清掃;于SMA根部打開表面血管鞘,顯露SMA主干走行,向尾側走行清掃14a組淋巴結(圖2b);于SMA根部上方3 cm區域清除右側180° 神經鞘,顯露CA根部,清除SMA及CA根部海德堡三角區域的神經及淋巴組織。顯露清除CA主干上方走行的9組淋巴結(圖2c);然后繼續沿左側膈肌角走行清掃16a1組淋巴結;沿SMV主干走行貫穿胰后隧道,并適當向右側游離胰腺頸部(圖2d);打開左側“L”孔,距離屈氏韌帶遠端15 cm處離斷空腸,并將腸系膜根部后方牽拉至右側(圖2e);沿SMA走行方向頭側分別處理供血的動脈分支,即胰十二指腸下動脈(inferior pancreaticoduodenal artery,IPDA)和鉤突動脈,分別予以夾閉后離斷,直到完整解離SMA與胰腺標本(圖2f);沿SMV-門靜脈軸后方繼續完整清掃海德堡三角區淋巴結至CA;解離門靜脈系統與胰腺標本(圖2g)。離斷胰腺頸部,胰管予以剪刀銳性離斷(圖2h)。一次性切割閉合器離斷胃,以en-bloc切除標本并完成淋巴結清掃(圖2i)。將標本裝袋,延長觀察孔切口長約5 cm,取出標本。然后依次完成胰腸、膽腸和胃腸吻合。
2 結果
5例患者均成功完成SMA右后入路聯合鉤突優先的LPD手術,無中轉開腹,手術時間為(366±51)min,術中出血量為(140±42)mL,術后住院時間為(11±2)d。患者于術后第1天拔除胃管及導尿管,并可經口補充腸內營養制劑,并取腹腔引流液送檢評估是否存在胰瘺。術后病理回示均達到R0切除。病理學檢查:2例胰頭高分化導管腺癌,1例胰頭中-低分化導管腺癌,1例胰頭低分化導管腺癌,1例十二指腸乳頭中-低分化腺癌。術后患者均未出現胃腸瘺、膽汁漏,無明顯胃癱,2例患者出現生化瘺。5例患者術后隨訪時間為(7±2)個月,隨訪期間均未出現復發。5例患者的基本資料見表1。
3 討論
以SMV-門靜脈為中心的傳統入路是LPD最為基礎的入路。在靜脈入路中需早期離斷胰頸,可能導致不可切除腫瘤(SMA受累)無法早期發現而被迫采取R1甚至R2切除[6]。以SMA為中心的動脈入路可盡早判斷SMA、CA等重要動脈是否受侵,并能提前顯露變異的右肝動脈以避免副損傷[9]。因此,以SMA為中心的動脈入路行LPD已日趨廣泛。
胰腺鉤突解剖位置深在,由胰十二指腸下動脈與胰背動脈右支來源的鉤突動脈環同時供血,并形成豐富的交通支[10]。因此,鉤突的解剖分離歷來是LPD的難點,其核心點在于如何完整切除鉤突系膜及有效控制切除過程中的出血[11]。筆者團隊近期采用SMA右后入路聯合鉤突優先的入路方式,手術均順利完成,且取得了較為滿意的臨床療效。在此研究中,5例患者均采用SMA右后入路聯合鉤突優先的手術方式,術中出血量為(140±42)mL,手術時間為(366±51)min,術后住院時間為(11±2)d,與Shin等[12]、Nickel等[13]、楊帆等[14]的研究中報道的術中出血量、手術時間、術后住院時間等相近。本研究中出現的術后并發癥均為A級胰瘺,此類并發癥對臨床預后影響小,不會延長住院時間,說明此種右后入路聯合鉤突優先的手術入路是安全可行的。
右后入路聯合鉤突優先的手術入路通過顯露SMA根部及CA根部,具有以下優勢:首先,可在離斷胰腺前判斷有無動脈的侵犯,提高R0切除率,并顯露保護變異的來源于SMA或CA的變異右肝動脈,減少副損傷。其次,海德堡三角區淋巴結清掃不全及胰腺系膜的不完整切除是術后腫瘤復發的重要原因[15-16]。右后方入路不僅能輕松完成海德堡三角區域淋巴結的清掃,還能薄層化胰腺系膜[17-19],使得再由SMA足側向近心端方向進行的鉤突系膜離斷變得容易。本手術方式最后行胰腺及胃的離斷,此時胰頸部及胰頭部的血供已完全離斷,斷胰腺時出血量明顯減少。同時,還縮短了胰液對腹腔的污染時間。胃腸液、膽汁、胰液等消化液的污染,是術后腹腔感染及術后切口感染的獨立危險因素[19-20]。而腹腔感染會對術后B/C級胰瘺的發生有不良影響,同時嚴重的腹腔內感染會提高患者的死亡率[21-22]。
不過SMA右后入路需要行擴大的Kocher切口,同時助手需將擬切除標本向左上方牽拉暴露,根據腫瘤“no-touch原則”,對于直徑較大的腫瘤,有擠壓腫瘤增加種植轉移的風險[23]。據此,筆者認為較小的腫瘤可能才適合此入路方式,術者應根據腫瘤的具體情況及自己對SMA不同角度解剖的熟悉理解程度去制定個體化的手術入路來完成手術[24-25]。
總之,經SMA右后入路聯合鉤突優先的LPD是一種安全、可行的手術入路,尤其適用于直徑≤2 cm的可切除腫瘤。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:劉作金作為主要研究者,參與設計研究;王佳國、游科收集并處理數據;汪宏翔撰寫論文初稿;徐杰進行論文的修改及視頻剪輯。所有作者都閱讀并批準了最終稿件。
倫理聲明:本研究已通過重慶醫科大學的倫理審核批準。