胰腺肝樣腺癌是發生于胰腺的罕見腫瘤,惡性程度高,預后差。筆者展示1例胰腺肝樣腺癌的CT及MR的影像學表現,并回顧相關文獻,簡要概述該疾病的潛在病理生理機制、影像學診斷及鑒別診斷,以加深臨床及影像科醫生對于胰腺肝樣腺癌的認識。
引用本文: 李星, 謝鑫, 呂粟, 李崢艷. 1例胰腺肝樣腺癌的CT及MR影像學表現及相關文獻復習. 中國普外基礎與臨床雜志, 2024, 31(3): 297-300. doi: 10.7507/1007-9424.202310017 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
胰腺肝樣腺癌(hepatoid adenocarcinoma,HAC)是胰腺罕見的惡性腫瘤,早期易侵襲血管,伴有肝臟、肺、腎上腺等區域轉移[1]。胰腺HAC影像學表現多樣化,術前診斷及鑒別診斷困難,常誤診為胰腺癌、胰腺神經內分泌癌、胰腺實性假乳頭狀瘤等。現報道1例胰腺HAC患者,展示該病例的CT及MR的影像學表現,并回顧既往文獻報道的該病影像學表現,以提高臨床及影像科醫生對胰腺HAC的認識與診斷水平。
1 患者基本信息
患者,男,70歲,因“發現胰腺占位2個月”收入四川大學華西醫院(下文簡稱我院)。入院前2個月因體檢于當地醫院行腹部彩色多普勒血流成像(簡稱彩超)檢查發現胰腺占位,未予特殊處理。患者為求進一步診治就診于我院。患者20年前左側腹股溝疝行手術治療;3年前右側耳膜穿孔行手術治療;診斷高血壓5年,長期口服苯磺酸氨氯地平降壓;診斷2型糖尿病3年,未正規檢測血糖及治療。收入我院后行相關檢查,異常指標如下:甲胎蛋白(alpha fetoprotein,AFP)稀釋定量1 917 μg/L,顯著高于正常值;乙肝表面抗體陽性(定量>36.5 U/L)、乙肝e抗體陽性(0.325 U/L)以及乙肝核心抗體陽性(0.01 U/L),均高于正常值;尿素9.9 mmol/L、甘油三酯2.30 mmol/L、糖化血紅蛋白6.5%、甲狀腺球蛋白0.06 μg/L、抗甲狀腺球蛋白抗體4 000 U/mL和抗甲狀腺過氧化物酶抗體107 U/mL,高于正常值;紅細胞計數4.22×1012/L、肌酐61 mmol/L和術前纖維蛋白原1.90 g/L低于正常值;其余血常規、肝腎功能、乙肝病毒DNA定量、丙型肝炎抗體以及熱休克蛋白90α定量未見異常。腫瘤標志物異常凝血酶原、糖類抗原(carbohydrate antigen,CA)199以及癌胚抗原陰性。于我院行腹部平掃及增強CT和MR檢查。
2 CT及MR影像學表現
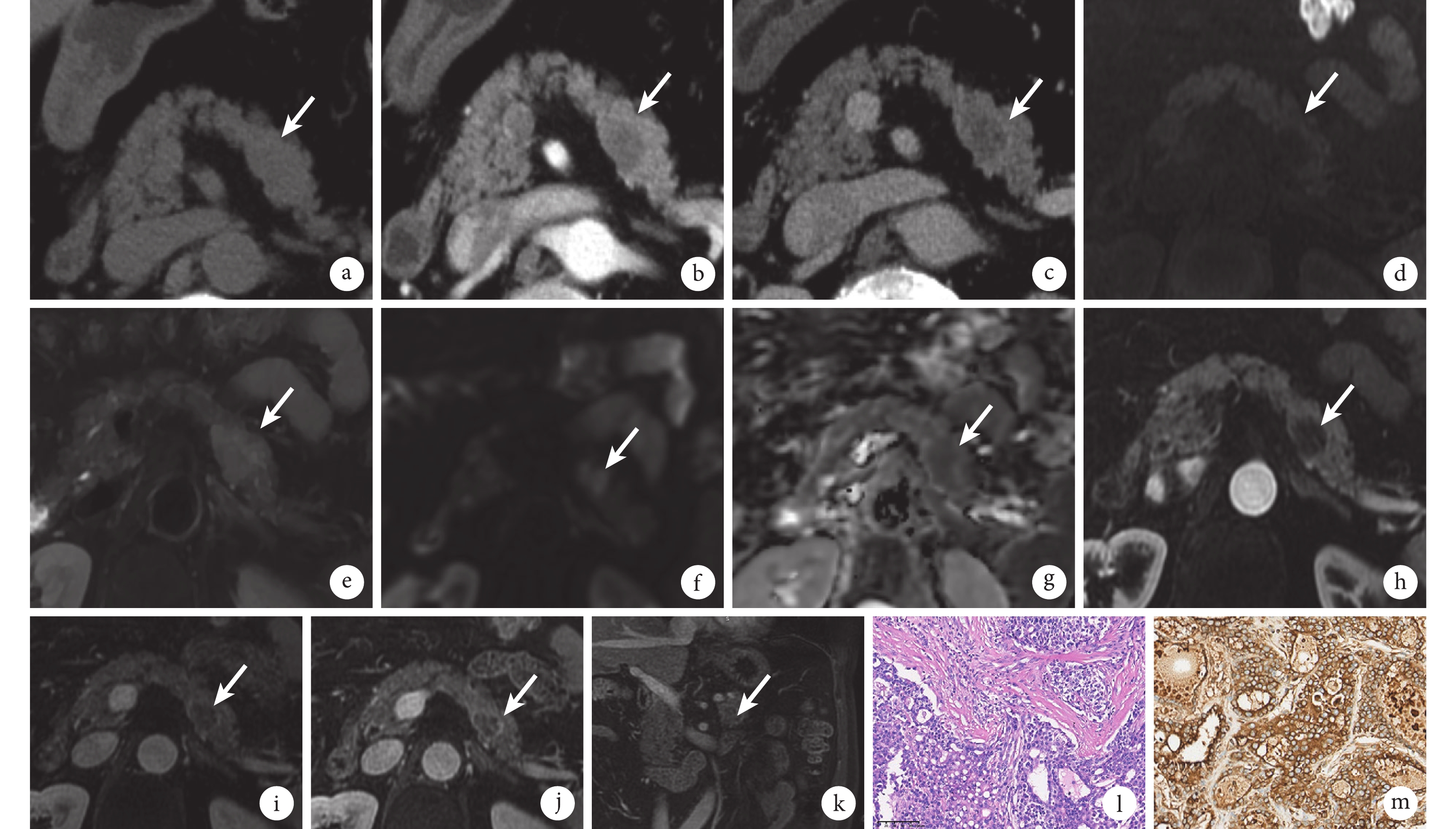
腹部CT平掃見胰腺體部稍低密度結節影,邊界欠清楚,形態不規則(圖1a);增強掃描結節動脈期呈輕度強化(圖1b),門靜脈期呈持續強化(圖1c)。腹部MR檢查平掃見胰腺體部結節T1加權成像(weighted imaging,WI)呈稍低信號(圖1d),T2WI呈稍高信號(圖1e),T1反相位與T1同相位病灶信號未見明顯變化,高b值(b=1000)彌散加權成像(diffusion weighted imaging,DWI)病灶呈高信號(圖1f),表觀彌散系數(apparent diffusion coefficient,ADC)呈低信號(圖1g);增強掃描動脈期(圖1h)、門靜脈期(圖1i)和延遲期(圖1j和1k)示結節呈持續性輕度不均勻強化,周邊似見環形強化包膜,主胰管顯示,未見明顯擴張,周圍未見增大淋巴結顯示。本例患者為老年男性,有乙肝病毒感染病史,實驗室檢查提示AFP明顯增高,結合影像學表現,影像診斷考慮腫瘤病變,HAC可能性大。
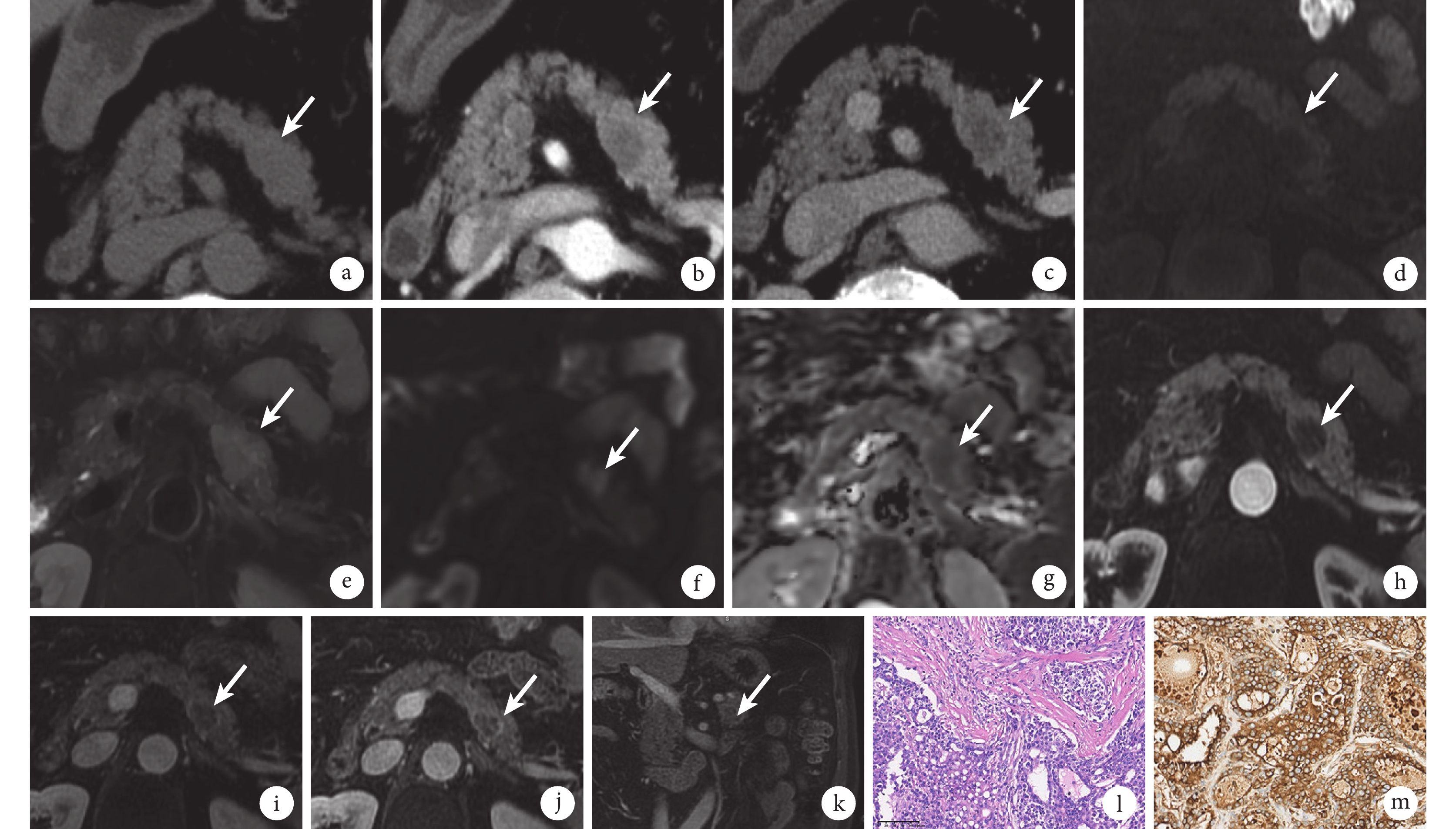 圖1
示患者上腹部CT和MR檢查結果、手術切除標本的病理學檢查和免疫組織化學染色結果
圖1
示患者上腹部CT和MR檢查結果、手術切除標本的病理學檢查和免疫組織化學染色結果
a~c:上腹部CT掃描軸位圖像,平掃見胰腺體部稍低密度結節(a,白箭所指處);增強掃描示動脈期(b)及門靜脈期(c)輕度強化(白箭所指處)。d~k:上腹部MR軸位及冠狀位圖像,平掃見胰腺體部結節T1WI呈稍低信號(d,白箭所指處);T2WI呈稍高信號(e,白箭所指處); b=1 000時,DWI呈高信號(f,白箭所指處);ADC呈低信號(g,白箭所指處);增強掃描動脈期(h)、門靜脈期(i)和延遲期(軸位j、冠狀位k)呈漸進性輕度不均勻強化,周邊似見環形強化包膜(白箭所指處); l:光鏡下見腫瘤細胞呈索狀、片狀排列(HE ×200)。m:免疫組織化學染色AFP陽性(EnVision法 ×200)
3 手術及病理學檢查結果
患者入我院后行腹腔鏡胰腺體尾部切除、脾臟切除術、大網膜病損切除及脾靜脈修補術。術中見胰腺體尾部一腫物,突出胰腺組織表面,與周圍組織粘連緊密,周圍未見明顯腫大淋巴結。切除標本大體觀見距胰腺斷端2.3 cm處,胰腺切面有一大小約2.6 cm×2.5 cm×1.7 cm不規則腫塊,與周圍組織分界欠清楚,腫物切面呈灰黃色,實性,質中,局灶見出血。鏡下見腫瘤細胞呈索狀、片狀排列(圖1l)。免疫組織化學染色結果示AFP(圖1m)、肝細胞石蠟抗原1(hepatocyte paraffin-1,Hep Par-1)、磷脂酰肌醇蛋白聚糖3(glypican-3,GPC3)、細胞角蛋白19、廣譜角蛋白以及Rb基因陽性;Spalt樣轉錄因子4(spalt like transcription factor 4,SALL4)、生長抑素受體2型、DPC4以及p53基因部分陽性;Ki67陽性率約30%;癌胚抗原、鈣黏蛋白E、突觸素、嗜鉻素A、黏蛋白-1、胰島素、胰高血糖素、生長抑素、胃泌素、CD56/10、細胞角蛋白7、ATRX以及β-連環蛋白均陰性。特殊染色:PAS染色陽性,AB染色陰性。結合免疫組織化學染色結果,病理診斷考慮HAC。
4 討論
胰腺HAC是一種原發于肝外并在形態學和免疫組織化學上具有肝細胞癌特征的腫瘤。HAC可原發在全身各個器官,如胃腸道、肺、腎、胰腺、腎上腺等器官,并且伴有腫瘤標志物AFP升高[2]。HAC惡性程度高,侵襲性強,早期易侵犯血管、出現肝臟及周圍淋巴結轉移,預后差。胰腺HAC多見于中老年,男性多見,臨床主要表現為上腹痛、嘔吐、體質量減輕等,當病變位于胰頭時,患者可出現黃疸、腹痛;當病變位于胰腺體尾部時,患者可沒有癥狀。胰腺與肝臟共同起源于內胚層和原始前腸,在胚胎發育過程中,胰腺可能保留了潛在產生AFP的能力,或者腫瘤細胞分化為肝細胞和腸黏膜細胞,進而導致了胰腺HAC的形成[3]。手術完整切除并輔助放化療是胰腺HAC的主要治療手段,病灶不可完整切除、肝臟轉移以及淋巴結轉移是預后不良的高危因素。
組織病理學是診斷胰腺HAC的金標準。腫瘤通常表現為肝樣分化區,伴或不伴有腺癌樣分化區。肝樣分化區腫瘤表現為實性、實性小梁狀或者巢狀結構。典型的腫瘤細胞為立方形或者多面體形,具有明顯的細胞膜,嗜酸性的細胞質,細胞核明顯,有1~2個核仁,間質表現為豐富的血管和血竇[4-5]。 AFP、Hep Par-1、GPC3以及SALL4對HAC的診斷效能高[6]。AFP、SALL4和GCP3的免疫組織化學染色陽性顯示肝樣成分強染色,提示肝樣和腸黏蛋白表型分化[7]。本例患者表現出AFP、Hep Par-1以及GPC3陽性,SALL4部分陽性,結合組織病理學符合HAC的診斷。
胰腺HAC的影像學表現多變,胰腺HAC病變可發生于胰腺頭頸部,也可發生于體尾部。病灶大小不一,多表現為巨大軟組織腫塊,可見壞死及囊變,腫瘤血管較匱乏,病灶增強掃描呈輕中度不均勻強化,可見環形強化包膜,易侵及血管,晚期可合并肝臟轉移、腹腔及腹膜后淋巴結轉移、腹膜轉移,部分患者可合并門靜脈癌栓形成[8]。值得注意的是,有研究者[9]發現胃HAC的肝轉移瘤表現為肝臟持續強化的結節或腫塊。
胰腺HAC需要與原發或繼發于胰腺的實性腫瘤相鑒別,如轉移瘤、胰腺導管腺癌、胰腺神經內分泌腫瘤以及實性假乳頭狀瘤[10]。① 胰腺轉移瘤:胰腺轉移瘤有原發腫瘤病史,如肺癌、乳腺癌、腎癌、惡性黑色素瘤、胃腸道來源的惡性腫瘤等;胰腺轉移瘤可單發,也可彌漫分布;CT掃描呈等或略低密度,小病灶表現出均勻強化,較大病灶中心可見無強化區,胰頭部轉移瘤可引起膽總管及胰管擴張。② 胰腺導管腺癌:中老年人多見,男性多于女性,臨床表現為上腹部疼痛,體質量減輕,食欲減退和黃疸;實驗室指標提示癌胚抗原及CA199升高;胰腺導管癌為乏血供腫瘤,影像學表現為低密度結節或腫塊,病灶增強掃描呈輕中度強化;胰腺導管腺癌可累及血管,早期發生淋巴結及血行轉移,發生在胰頭部的病灶可出現主胰管及膽總管擴張,稱為“雙管征” 。③ 胰腺神經內分泌腫瘤:中老年人多見,根據是否有功能分為功能性及無功能性,突觸素和嗜鉻素A是其重要的腫瘤標志物;病灶為富血供,腫瘤增強掃描動脈期多呈明顯強化,腫瘤較大時可表現為環形強化,伴有囊變壞死。④ 胰腺實性假乳頭狀瘤:好發于青年女性,臨床多無癥狀,胰腺體尾部多見,腫瘤多為單發,體積較大;病灶增強掃描實性部分呈漸進性強化,多有包膜,較少引起膽管及胰管擴張。
5 總結
胰腺HAC罕見,侵襲性強,易早期轉移。本病例表現為胰腺體部的軟組織結節,邊界欠清晰,形態不規則,結節增強掃描呈持續性輕度不均勻強化,MRI彌散序列提示結節彌散受限。在術前提出胰腺HAC的準確診斷十分困難。在排除了胰腺轉移瘤、胰腺導管腺癌及胰腺神經內分泌腫瘤后,結合臨床表現、實驗室AFP水平增高以及影像學表現,應考慮該病的可能。結合PET/CT檢查有助于疾病的分期以及后續診療方案的制定。手術切除并輔助放化療是該病的主要治療手段,組織病理結合免疫組織化學檢查是診斷胰腺HAC的金標準[11]。影像學對胰腺HAC的診斷以及預后評估具有重要價值。目前國內外對胰腺HAC的影像學表現認識不足,仍需積累病例,進一步總結影像學征象,為今后臨床診斷以及治療方案決策提供依據。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:李星查閱文獻、撰寫及修改論文;李星、謝鑫收集病理圖片;李崢艷審閱及修改論文;呂粟審閱論文。
倫理聲明:本研究通過了四川大學華西醫院生物醫學倫理審查委員會的審批,批文編號:2022年審(1487)號。
胰腺肝樣腺癌(hepatoid adenocarcinoma,HAC)是胰腺罕見的惡性腫瘤,早期易侵襲血管,伴有肝臟、肺、腎上腺等區域轉移[1]。胰腺HAC影像學表現多樣化,術前診斷及鑒別診斷困難,常誤診為胰腺癌、胰腺神經內分泌癌、胰腺實性假乳頭狀瘤等。現報道1例胰腺HAC患者,展示該病例的CT及MR的影像學表現,并回顧既往文獻報道的該病影像學表現,以提高臨床及影像科醫生對胰腺HAC的認識與診斷水平。
1 患者基本信息
患者,男,70歲,因“發現胰腺占位2個月”收入四川大學華西醫院(下文簡稱我院)。入院前2個月因體檢于當地醫院行腹部彩色多普勒血流成像(簡稱彩超)檢查發現胰腺占位,未予特殊處理。患者為求進一步診治就診于我院。患者20年前左側腹股溝疝行手術治療;3年前右側耳膜穿孔行手術治療;診斷高血壓5年,長期口服苯磺酸氨氯地平降壓;診斷2型糖尿病3年,未正規檢測血糖及治療。收入我院后行相關檢查,異常指標如下:甲胎蛋白(alpha fetoprotein,AFP)稀釋定量1 917 μg/L,顯著高于正常值;乙肝表面抗體陽性(定量>36.5 U/L)、乙肝e抗體陽性(0.325 U/L)以及乙肝核心抗體陽性(0.01 U/L),均高于正常值;尿素9.9 mmol/L、甘油三酯2.30 mmol/L、糖化血紅蛋白6.5%、甲狀腺球蛋白0.06 μg/L、抗甲狀腺球蛋白抗體4 000 U/mL和抗甲狀腺過氧化物酶抗體107 U/mL,高于正常值;紅細胞計數4.22×1012/L、肌酐61 mmol/L和術前纖維蛋白原1.90 g/L低于正常值;其余血常規、肝腎功能、乙肝病毒DNA定量、丙型肝炎抗體以及熱休克蛋白90α定量未見異常。腫瘤標志物異常凝血酶原、糖類抗原(carbohydrate antigen,CA)199以及癌胚抗原陰性。于我院行腹部平掃及增強CT和MR檢查。
2 CT及MR影像學表現
腹部CT平掃見胰腺體部稍低密度結節影,邊界欠清楚,形態不規則(圖1a);增強掃描結節動脈期呈輕度強化(圖1b),門靜脈期呈持續強化(圖1c)。腹部MR檢查平掃見胰腺體部結節T1加權成像(weighted imaging,WI)呈稍低信號(圖1d),T2WI呈稍高信號(圖1e),T1反相位與T1同相位病灶信號未見明顯變化,高b值(b=1000)彌散加權成像(diffusion weighted imaging,DWI)病灶呈高信號(圖1f),表觀彌散系數(apparent diffusion coefficient,ADC)呈低信號(圖1g);增強掃描動脈期(圖1h)、門靜脈期(圖1i)和延遲期(圖1j和1k)示結節呈持續性輕度不均勻強化,周邊似見環形強化包膜,主胰管顯示,未見明顯擴張,周圍未見增大淋巴結顯示。本例患者為老年男性,有乙肝病毒感染病史,實驗室檢查提示AFP明顯增高,結合影像學表現,影像診斷考慮腫瘤病變,HAC可能性大。
 圖1
示患者上腹部CT和MR檢查結果、手術切除標本的病理學檢查和免疫組織化學染色結果
圖1
示患者上腹部CT和MR檢查結果、手術切除標本的病理學檢查和免疫組織化學染色結果
a~c:上腹部CT掃描軸位圖像,平掃見胰腺體部稍低密度結節(a,白箭所指處);增強掃描示動脈期(b)及門靜脈期(c)輕度強化(白箭所指處)。d~k:上腹部MR軸位及冠狀位圖像,平掃見胰腺體部結節T1WI呈稍低信號(d,白箭所指處);T2WI呈稍高信號(e,白箭所指處); b=1 000時,DWI呈高信號(f,白箭所指處);ADC呈低信號(g,白箭所指處);增強掃描動脈期(h)、門靜脈期(i)和延遲期(軸位j、冠狀位k)呈漸進性輕度不均勻強化,周邊似見環形強化包膜(白箭所指處); l:光鏡下見腫瘤細胞呈索狀、片狀排列(HE ×200)。m:免疫組織化學染色AFP陽性(EnVision法 ×200)
3 手術及病理學檢查結果
患者入我院后行腹腔鏡胰腺體尾部切除、脾臟切除術、大網膜病損切除及脾靜脈修補術。術中見胰腺體尾部一腫物,突出胰腺組織表面,與周圍組織粘連緊密,周圍未見明顯腫大淋巴結。切除標本大體觀見距胰腺斷端2.3 cm處,胰腺切面有一大小約2.6 cm×2.5 cm×1.7 cm不規則腫塊,與周圍組織分界欠清楚,腫物切面呈灰黃色,實性,質中,局灶見出血。鏡下見腫瘤細胞呈索狀、片狀排列(圖1l)。免疫組織化學染色結果示AFP(圖1m)、肝細胞石蠟抗原1(hepatocyte paraffin-1,Hep Par-1)、磷脂酰肌醇蛋白聚糖3(glypican-3,GPC3)、細胞角蛋白19、廣譜角蛋白以及Rb基因陽性;Spalt樣轉錄因子4(spalt like transcription factor 4,SALL4)、生長抑素受體2型、DPC4以及p53基因部分陽性;Ki67陽性率約30%;癌胚抗原、鈣黏蛋白E、突觸素、嗜鉻素A、黏蛋白-1、胰島素、胰高血糖素、生長抑素、胃泌素、CD56/10、細胞角蛋白7、ATRX以及β-連環蛋白均陰性。特殊染色:PAS染色陽性,AB染色陰性。結合免疫組織化學染色結果,病理診斷考慮HAC。
4 討論
胰腺HAC是一種原發于肝外并在形態學和免疫組織化學上具有肝細胞癌特征的腫瘤。HAC可原發在全身各個器官,如胃腸道、肺、腎、胰腺、腎上腺等器官,并且伴有腫瘤標志物AFP升高[2]。HAC惡性程度高,侵襲性強,早期易侵犯血管、出現肝臟及周圍淋巴結轉移,預后差。胰腺HAC多見于中老年,男性多見,臨床主要表現為上腹痛、嘔吐、體質量減輕等,當病變位于胰頭時,患者可出現黃疸、腹痛;當病變位于胰腺體尾部時,患者可沒有癥狀。胰腺與肝臟共同起源于內胚層和原始前腸,在胚胎發育過程中,胰腺可能保留了潛在產生AFP的能力,或者腫瘤細胞分化為肝細胞和腸黏膜細胞,進而導致了胰腺HAC的形成[3]。手術完整切除并輔助放化療是胰腺HAC的主要治療手段,病灶不可完整切除、肝臟轉移以及淋巴結轉移是預后不良的高危因素。
組織病理學是診斷胰腺HAC的金標準。腫瘤通常表現為肝樣分化區,伴或不伴有腺癌樣分化區。肝樣分化區腫瘤表現為實性、實性小梁狀或者巢狀結構。典型的腫瘤細胞為立方形或者多面體形,具有明顯的細胞膜,嗜酸性的細胞質,細胞核明顯,有1~2個核仁,間質表現為豐富的血管和血竇[4-5]。 AFP、Hep Par-1、GPC3以及SALL4對HAC的診斷效能高[6]。AFP、SALL4和GCP3的免疫組織化學染色陽性顯示肝樣成分強染色,提示肝樣和腸黏蛋白表型分化[7]。本例患者表現出AFP、Hep Par-1以及GPC3陽性,SALL4部分陽性,結合組織病理學符合HAC的診斷。
胰腺HAC的影像學表現多變,胰腺HAC病變可發生于胰腺頭頸部,也可發生于體尾部。病灶大小不一,多表現為巨大軟組織腫塊,可見壞死及囊變,腫瘤血管較匱乏,病灶增強掃描呈輕中度不均勻強化,可見環形強化包膜,易侵及血管,晚期可合并肝臟轉移、腹腔及腹膜后淋巴結轉移、腹膜轉移,部分患者可合并門靜脈癌栓形成[8]。值得注意的是,有研究者[9]發現胃HAC的肝轉移瘤表現為肝臟持續強化的結節或腫塊。
胰腺HAC需要與原發或繼發于胰腺的實性腫瘤相鑒別,如轉移瘤、胰腺導管腺癌、胰腺神經內分泌腫瘤以及實性假乳頭狀瘤[10]。① 胰腺轉移瘤:胰腺轉移瘤有原發腫瘤病史,如肺癌、乳腺癌、腎癌、惡性黑色素瘤、胃腸道來源的惡性腫瘤等;胰腺轉移瘤可單發,也可彌漫分布;CT掃描呈等或略低密度,小病灶表現出均勻強化,較大病灶中心可見無強化區,胰頭部轉移瘤可引起膽總管及胰管擴張。② 胰腺導管腺癌:中老年人多見,男性多于女性,臨床表現為上腹部疼痛,體質量減輕,食欲減退和黃疸;實驗室指標提示癌胚抗原及CA199升高;胰腺導管癌為乏血供腫瘤,影像學表現為低密度結節或腫塊,病灶增強掃描呈輕中度強化;胰腺導管腺癌可累及血管,早期發生淋巴結及血行轉移,發生在胰頭部的病灶可出現主胰管及膽總管擴張,稱為“雙管征” 。③ 胰腺神經內分泌腫瘤:中老年人多見,根據是否有功能分為功能性及無功能性,突觸素和嗜鉻素A是其重要的腫瘤標志物;病灶為富血供,腫瘤增強掃描動脈期多呈明顯強化,腫瘤較大時可表現為環形強化,伴有囊變壞死。④ 胰腺實性假乳頭狀瘤:好發于青年女性,臨床多無癥狀,胰腺體尾部多見,腫瘤多為單發,體積較大;病灶增強掃描實性部分呈漸進性強化,多有包膜,較少引起膽管及胰管擴張。
5 總結
胰腺HAC罕見,侵襲性強,易早期轉移。本病例表現為胰腺體部的軟組織結節,邊界欠清晰,形態不規則,結節增強掃描呈持續性輕度不均勻強化,MRI彌散序列提示結節彌散受限。在術前提出胰腺HAC的準確診斷十分困難。在排除了胰腺轉移瘤、胰腺導管腺癌及胰腺神經內分泌腫瘤后,結合臨床表現、實驗室AFP水平增高以及影像學表現,應考慮該病的可能。結合PET/CT檢查有助于疾病的分期以及后續診療方案的制定。手術切除并輔助放化療是該病的主要治療手段,組織病理結合免疫組織化學檢查是診斷胰腺HAC的金標準[11]。影像學對胰腺HAC的診斷以及預后評估具有重要價值。目前國內外對胰腺HAC的影像學表現認識不足,仍需積累病例,進一步總結影像學征象,為今后臨床診斷以及治療方案決策提供依據。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:李星查閱文獻、撰寫及修改論文;李星、謝鑫收集病理圖片;李崢艷審閱及修改論文;呂粟審閱論文。
倫理聲明:本研究通過了四川大學華西醫院生物醫學倫理審查委員會的審批,批文編號:2022年審(1487)號。