引用本文: 徐宇航, 薛棟, 劉暢, 黃文博, 徐晨曦, 趙偉, 孫祺. 十二指腸神經內分泌瘤伴肝臟與淋巴結轉移的轉錄組學差異分析. 中國普外基礎與臨床雜志, 2024, 31(3): 309-314. doi: 10.7507/1007-9424.202311039 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
神經內分泌瘤(neuroendocrine tumor,NET)是一種起源于神經內分泌細胞的罕見腫瘤,通常將發生于胃、十二指腸及胰腺的NET統稱為胃腸胰NET,它可產生一系列多肽激素,根據能否分泌激素以及產生相應的臨床癥狀分為功能性和非功能性兩種類型[1-2]。近幾年NET的檢出率逐年升高,美國國家癌癥研究所SEER數據庫的統計數據顯示,2000–2012年期間胃腸胰NET的患病率約為3.56/10萬人且呈現逐漸上升趨勢,占所有NET的65%~75%,是其最常見類型,其中發生于十二指腸的NET十分罕見[3-4]。與同位置的腺癌相比,胃腸胰NET的惡性程度較低,易發生早期轉移,約50%的新診斷患者會發生遠處轉移[5]。肝臟是胃腸胰NET較為多見的轉移部位,65%~95%的患者于診斷時已經發生肝臟轉移[6]。十二指腸NET同時伴肝轉移及淋巴結轉移的患者鮮有文獻報道。西安交通大學第一附屬醫院(簡稱 “我院” )普通外科收治了1例十二指腸NET同時伴肝臟和淋巴結轉移患者,本研究對該例患者的組織樣本進行RNA測序分析,從轉錄組學角度探究可能參與十二指腸NET遠處轉移及影響器官轉移特異性的潛在轉移機制以及探索可能參與腫瘤轉移的潛在基因與作用靶點,對預防十二指腸NET患者的遠處轉移及改善患者的預后具有重要意義。
1 資料與方法
1.1 組織獲取
獲取2021年我院普通外科收治的1例十二指腸NET同時伴肝臟和淋巴結轉移并行胰十二指腸切除+轉移灶切除患者的癌旁十二指腸上皮組織 [以下簡稱“正常組織(normal tissue,NT)” ] 及轉移灶組織標本,干冰運輸,–80 ℃保存。術前與患者及其家屬溝通并簽署標本留取知情同意書,同時經我院醫學倫理委員會審批通過。
1.2 轉錄組測序
送檢標本包括NT、十二指腸NET組織(duodenal NET tissue,DUO)、肝轉移組織(hepatic metastasis tissue,HM)和淋巴結轉移組織(lymph node metastasis tissue,LM)。使用Trizol試劑盒分別提取NT、HM、LM及DUO的總RNA后用NanoPhotometer?分光光度計檢測樣品純度,同時用Agilent2100 RNA Nano6000 Assay Kit檢測RNA樣品的完整性和濃度。檢測樣品合格后純化mRNA并構建文庫,使用Agilent2100生物分析儀對文庫進行質檢,質量合格后由北京安諾優達基因科技有限公司基于 Illumina平臺通過PE150測序策略進行測序。
1.3 測序數據過濾
Illumina平臺測序得到原始下機序列(Raw Reads)后,對Raw Reads進行過濾。數據處理步驟如下:① 去除接頭污染的Reads;② 去除低質量的Reads;③ 去除含無法確定的堿基數目(N)比例 >5%的Reads。過濾后獲到高質量的序列(Clean Reads),經質控合格后基于Clean Reads進行數據比對分析和轉錄組深層分析。
1.4 差異表達基因(differentially expressed genes,DEGs)分析
通過DEseq2進行DEGs分析,其篩選主要以差異倍數(fold change,FC)以及q值(矯正后P值)為參考,其標準為 |log2FC| ≥1和q<0.05。
1.5 富集分析
對DEGs進行基因本體論(gene ontology,GO)數據庫的富集分析,分別描述基因參與的生物過程、細胞組分及分子功能。使用京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)數據庫對DEGs進行通路富集分析,該數據庫可對蛋白質交互網絡在各種細胞活動過程中的作用做出預測。
1.6 統計學方法
采用R軟件進行統計學分析。符合正態分布的計量資料以均數±標準差(x±s)描述,多組間比較采用ANOVA單因素方差分析,2組間比較采用獨立樣本比較的t檢驗,檢驗水準α=0.05。
2 結果
2.1 患者的基本情況
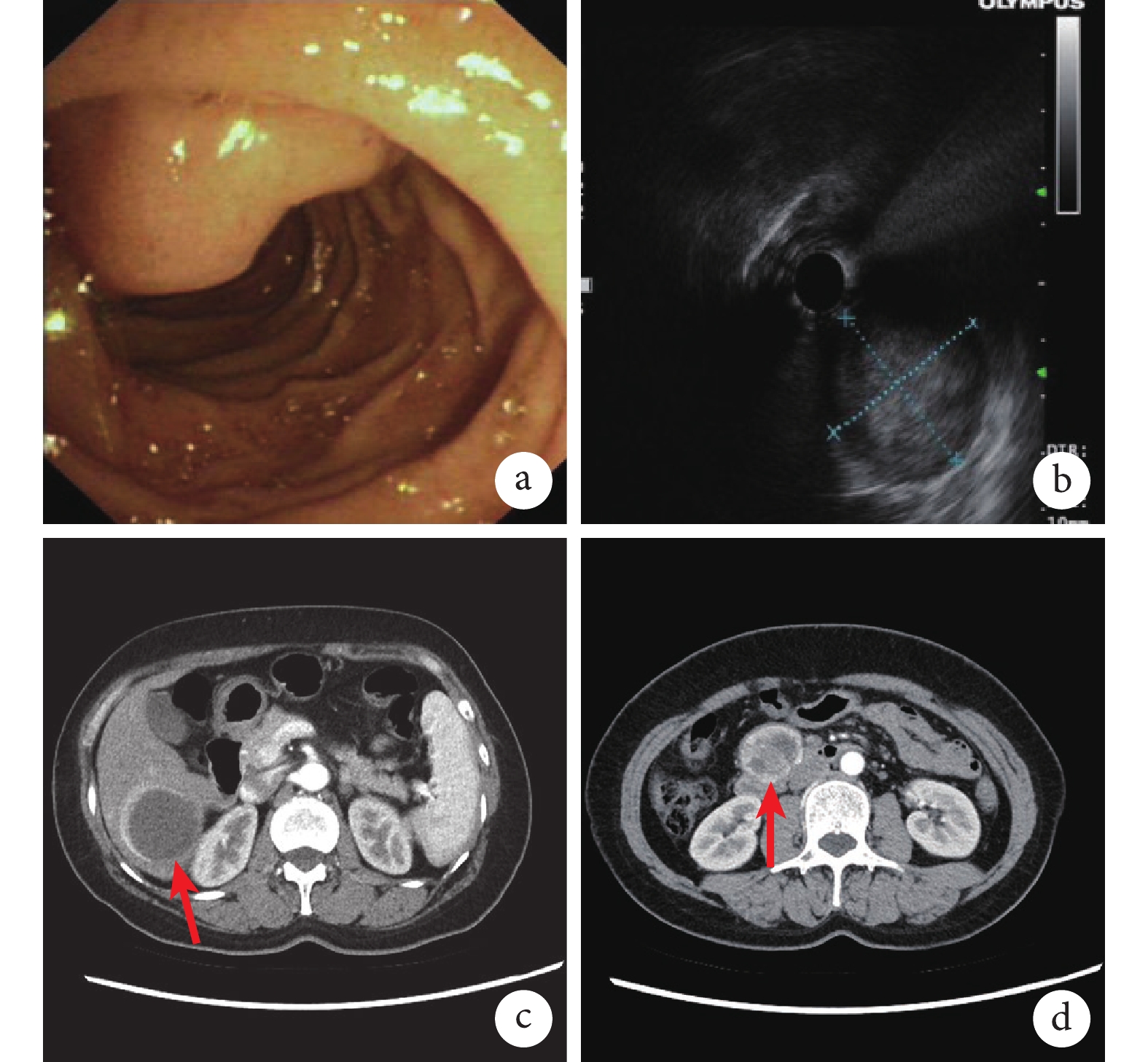
患者,女,44歲。術前胃鏡檢查見十二指腸降部乳頭上方一隆起性病變,表面光滑,頂部凹陷粗糙糜爛、潰瘍形成(圖1a)。超聲檢查見隆起處呈低回聲團塊樣改變,病變處十二指腸壁5層結構消失,壁外見低回聲實性團塊,團塊似起源于十二指腸壁固有肌層,截面大小約3.4 cm×3.3 cm,內部回聲欠均勻,有病變浸及全層的可能(圖1b)。全腹部增強CT檢查顯示肝右葉第6段類圓形、環形強化腫塊(圖1c),腹膜后稍大淋巴結(圖1d),考慮肝臟和腹膜后淋巴結轉移。取組織活檢病理檢查提示:十二指腸小塊黏膜內上皮樣細胞腫瘤浸潤,結合免疫組織化學染色提示NET(G1)。遂行胰十二指腸切除+轉移灶切除術。術中待組織切除后剖開,留取癌旁十二指腸上皮組織、原發灶及轉移灶組織標本。
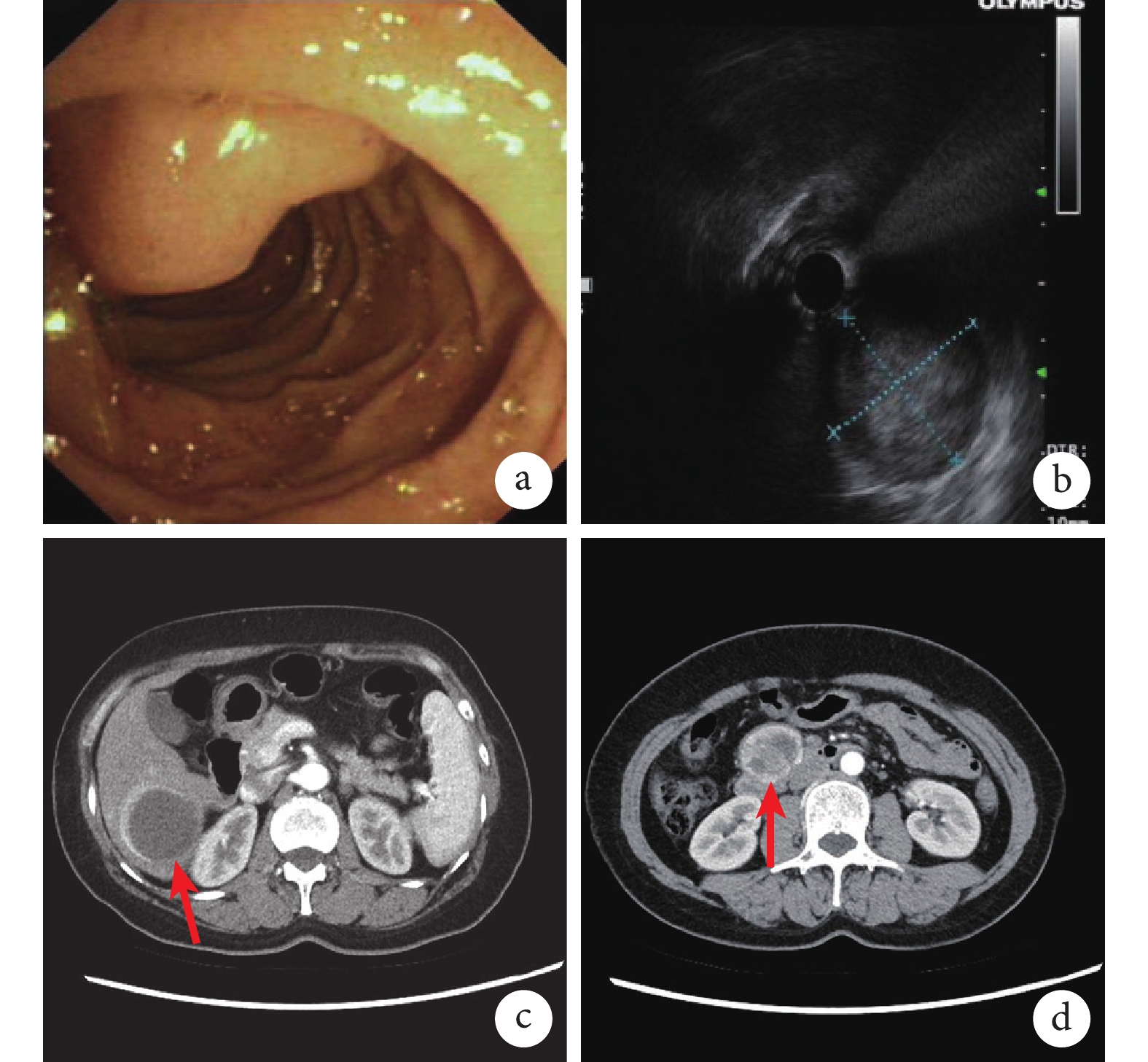 圖1
示患者術前胃鏡、超聲及CT檢查結果
圖1
示患者術前胃鏡、超聲及CT檢查結果
a:胃鏡下病灶;b:超聲下病灶;c、d:CT見肝臟環形強化腫塊(c,紅箭所指)及腹膜后腫大淋巴結(d,紅箭所指)
2.2 DEGs分析結果
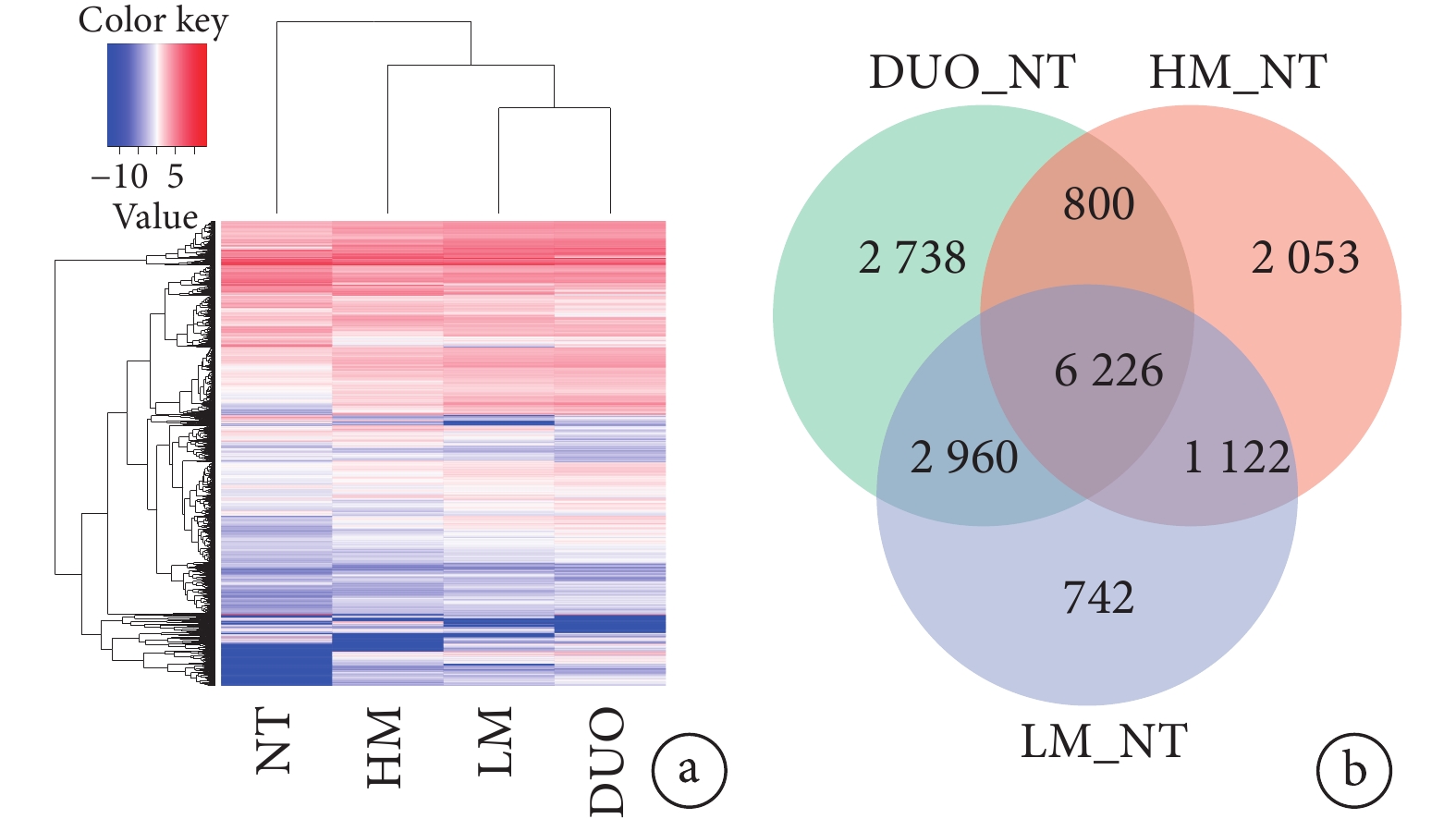
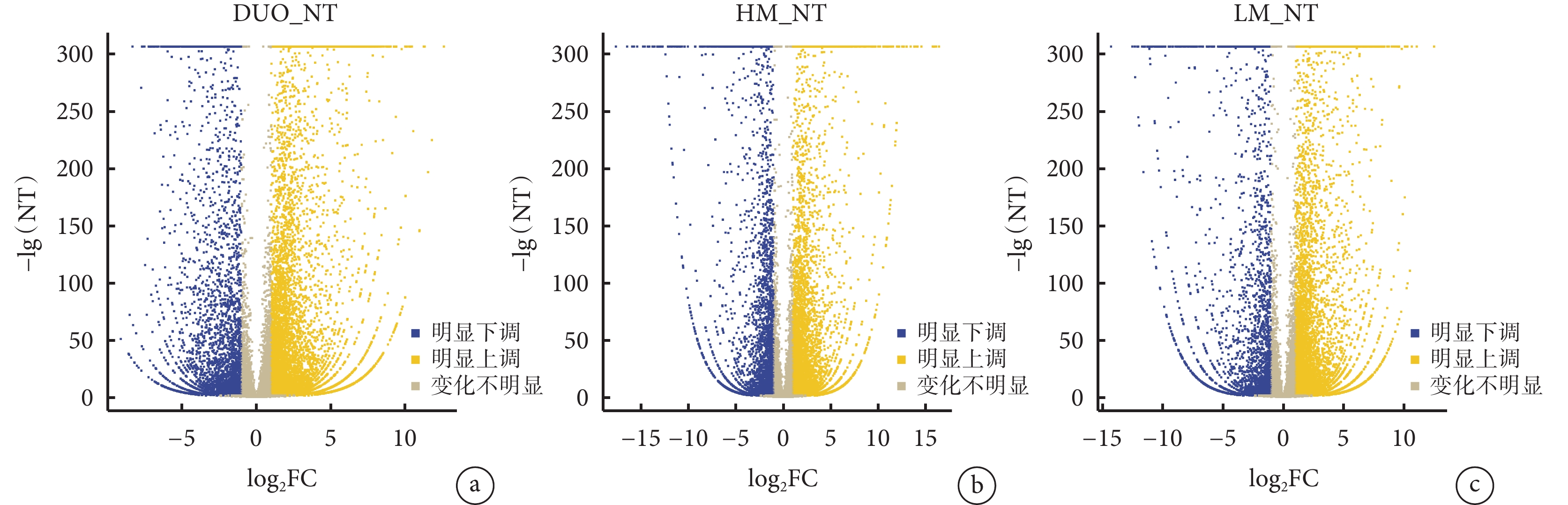
DUO、HM、LM和NT樣本中DEGs的熱圖見圖2a。對DUO、HM和LM中基因表達量分別與NT比較(分別表示為DUO_NT、HM_NT、LM_NT)后繪制的所有DEGs韋恩圖見圖2b,從圖2b中可見,在DUO_NT中DEGs共12 724個、HM_NT中共10 201個、LM_NT中共11 050個,在這3種組織中共表達DEGs共6 226個,其中僅在DUO_NT中表達的DEGs有2 738個、HM_NT中2 053個、LM_NT中742個。在DUO、HM和LM中DEGs表達的火山圖見圖3a~3c,其中在DUO_NT中上調基因8 716個、下調基因4 008個,HM_NT中上調基因6 390個、下調基因3 811個,LM_NT中上調基因7 904個、下調基因3 146個。根據篩選出的DEGs在HM_NT和LM_NT中的FC前5位的基因分別是ORM1、C4BPA、AHSG、C9和LBP以及ABHD12B、AC100850.1、HOXC9、AC083967.1和HOXC8,見表1。
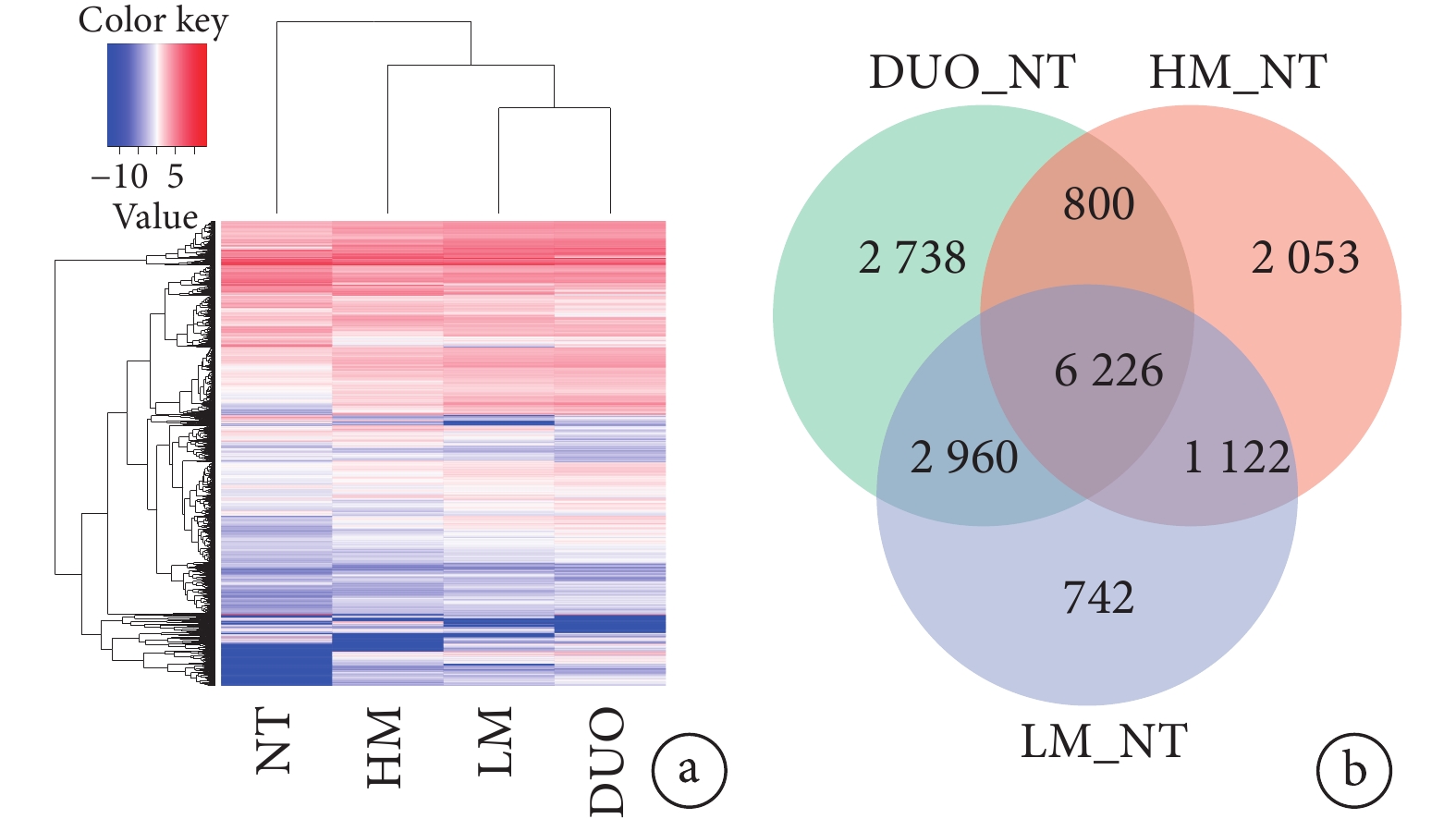 圖2
示DUO、HM、LM和NT樣本中DEGs的熱圖(a)及DUO_NT、HM_NT和LM_NT中所有DEGs的韋恩圖(b)
圖2
示DUO、HM、LM和NT樣本中DEGs的熱圖(a)及DUO_NT、HM_NT和LM_NT中所有DEGs的韋恩圖(b)
2.3 DUO、HM與LM中DEGs的GO富集分析結果
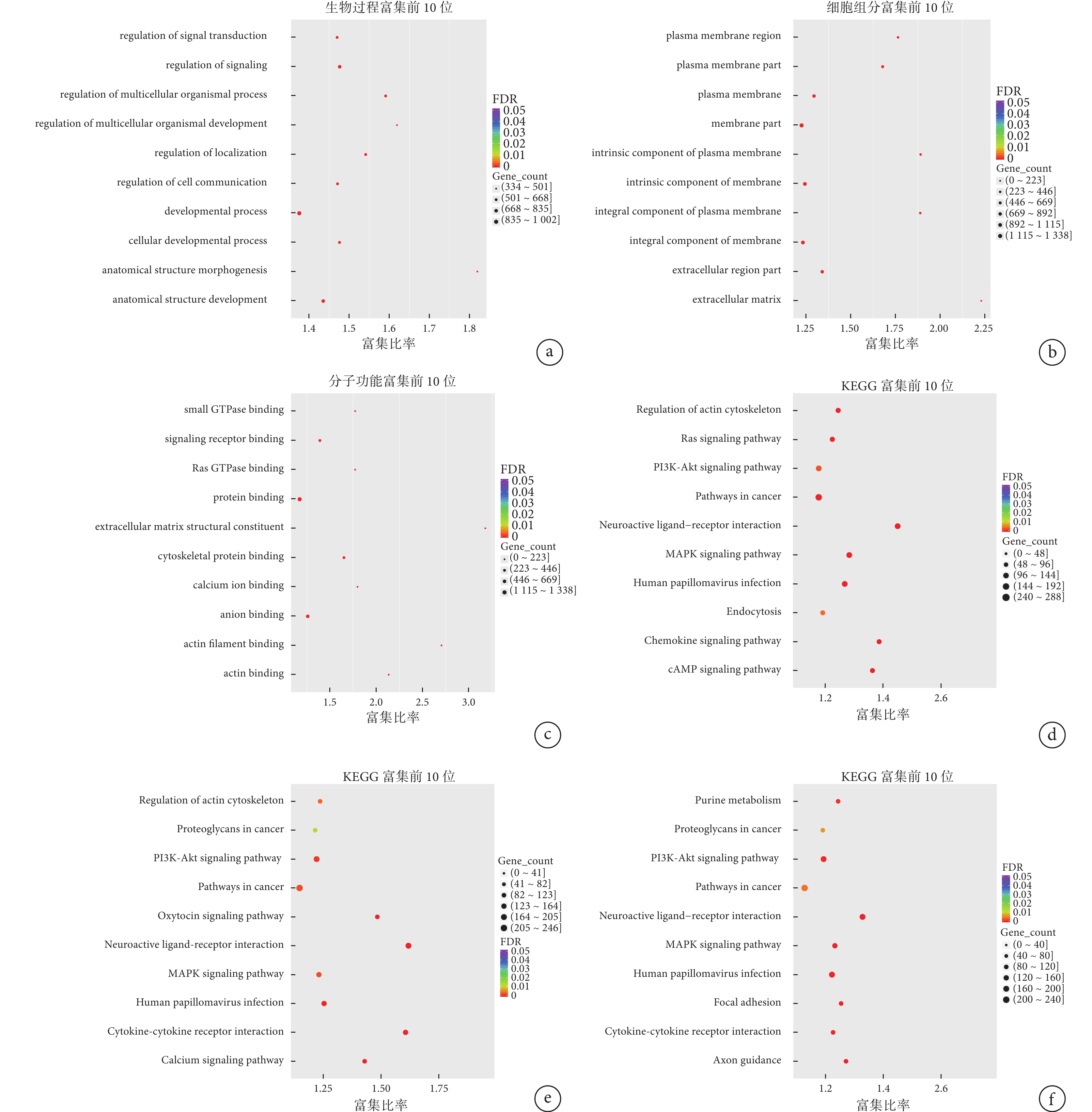
對本研究篩選出分別只在DUO、HM和LM中表達的DEGs進行GO功能富集分析發現,前10位的富集分析結果,在生物過程部分見圖4a,主要富集于生物發展過程(developmental process)、解剖結構發展(anatomical structure development)、信號轉導調節(regulation of signal transduction)等;在細胞組分見圖4b,主要富集于膜部分(membrane part)、膜整體組件(integral component of membrane)、膜固有成分(integral component of plasma membrane)等;在分子功能部分見圖4c,主要富集于蛋白結合(protein binding)、陰離子結合(anion binding)等。
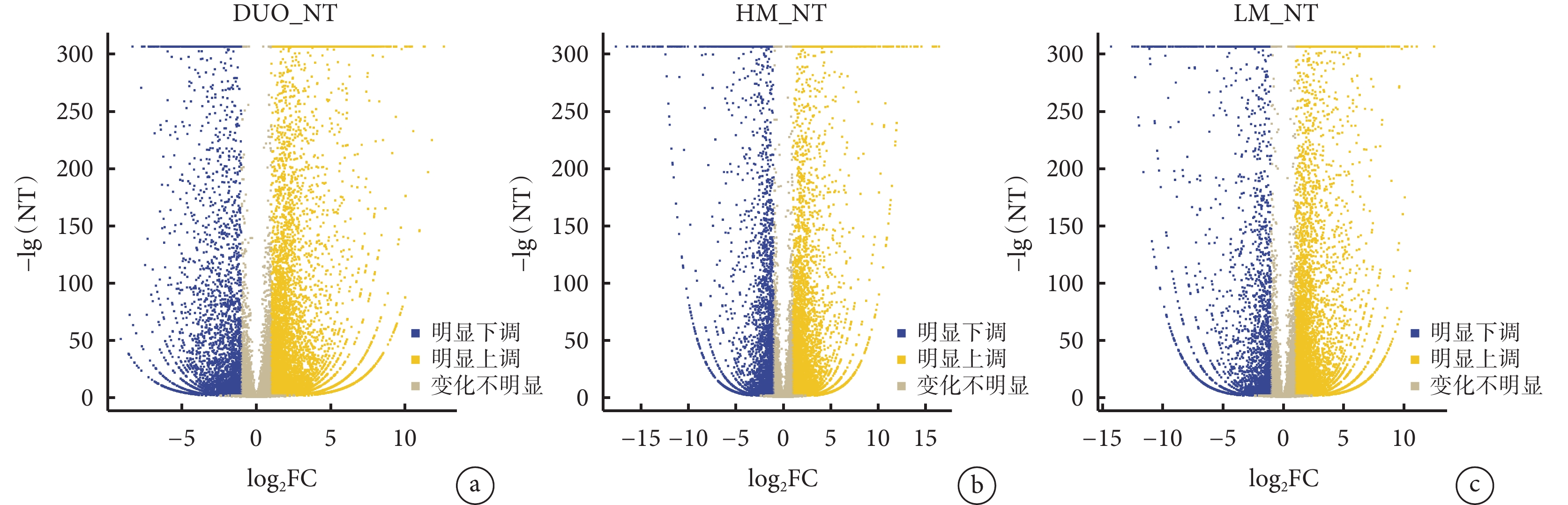 圖3
示DUO_NT(a)、HM_NT(b)與LM_NT(c)中DEGs的火山圖
圖3
示DUO_NT(a)、HM_NT(b)與LM_NT(c)中DEGs的火山圖
2.4 DUO、HM與LM中DEGs的KEGG富集分析結果
利用KEGG數據庫分析DUO、HM和LM中的DEGs富集的信號通路,預測它在各類信號活動中的作用。DUO與NT相比,DEGs主要涉及于168個代謝通路(補充材料圖1a),其中最為富集的是癌癥通路(pathways in cancer),之后是人乳頭狀瘤病毒(human papillomavirus,HPV)感染、磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又名Akt)信號通路、絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信號通路和神經活性配體-受體相互作用(neuroactive ligand-receptor interaction),見圖4d。HM與NT相比,差異表達基因主要涉及于131個代謝通路(補充材料圖1b),其中最為富集的是癌癥通路(pathways in cancer),其次是神經活性配體-受體相互作用(neuroactive ligand-receptor interaction)和PI3K/Akt信號通路,見圖4e。LM與NT相比,差異基因主要涉及于126個代謝通路(補充材料圖1c),其中最為富集的癌癥通路(pathways in cancer),之后是PI3K/Akt信號通路、神經活性配體-受體相互作用(neuroactive ligand-receptor interaction)和HPV感染,見圖4f。
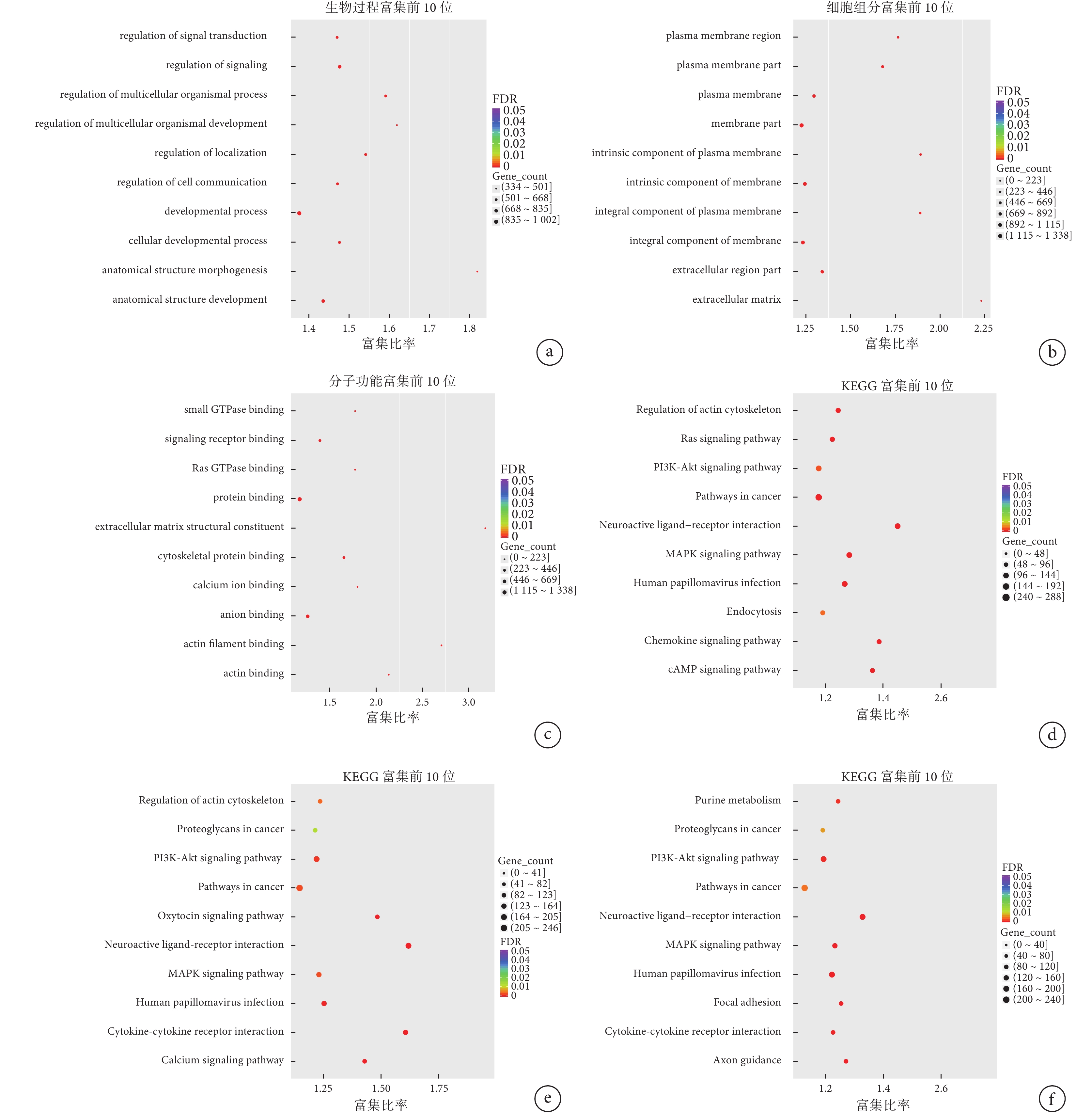 圖4
示DUO、HM及LM中DEGs的GO(分別為a~c)和KEGG(分別為d~f)富集分析結果
圖4
示DUO、HM及LM中DEGs的GO(分別為a~c)和KEGG(分別為d~f)富集分析結果
3 討論
胃腸胰NET患者發生遠處轉移是降低其生存率的主要原因之一,尤其是發生多發性遠處轉移。因此,研究患者多發性遠處轉移灶和不同病灶之間的基因表達差異有助于尋找影響胃腸胰NET侵襲性和腫瘤特異性轉移的潛在靶點,可能對抑制腫瘤的遠處轉移有潛在價值。
本研究對1例十二指腸NET同時伴發肝臟和淋巴結轉移患者的原發病灶及其兩處轉移灶組織進行RNA測序分析。① DEGs分析結果發現,本研究篩選出了僅在HM和LM中顯著表達的DEGs,其FC在HM中前5位者分別是ORM1、C4BPA、AHSG、C9和LBP,在LM中前5位者分別是ABHD12B、AC100850.1、HOXC9、AC083967.1和HOXC8。根據目前的相關研究,其中ORM1、HOXC8和HOXC9基因被報道與腫瘤的進展、轉移及預后有關,其他基因的研究報道較少。ORM1基因,又名α1-酸性糖蛋白基因(α1-acid glycoprotein,α1-AGP),它在正常生理狀態下的人體血清中含量較少,但在病理條件如感染、炎癥和腫瘤中的濃度會顯著增加,主要由肝臟產生,部分腫瘤組織也分泌。有研究者報道在多種腫瘤如肝癌[16]和子宮內膜癌[17]的血清中表達上調;本研究也發現,ORM1基因在原發灶和轉移灶中的表達均較癌旁組織中增高,與文獻報道的結論相似。同源盒基因(homobox、HOX)是調節人體正常發育的重要調節因子,可調控細胞增殖、分化、凋亡、活動、血管生成等,它在編碼進化上具有保守性轉錄因子的重要作用,可以確保細胞分化的平衡[18-19]。HOXC9和HOXC8作為HOX家族成員,在許多類型的腫瘤如乳腺癌、結直腸癌中表現出異常表達,與癌癥的發生、發展及遷移有密切聯系,而且異常高表達者預后也較差[20-30]。結果提示,這些基因可能成為抑制十二指腸NET增殖與遷移的新靶點。② 通過KEGG富集分析發現,該患者病灶組織中顯著表達的DEGs主要富集于PI3K/Akt信號通路、MAPK信號通路、癌癥通路、神經活性配體-受體相互作用和HPV感染。在細胞生物學中,PI3K/Akt信號通路扮演著調控多種細胞功能的重要角色,在多種腫瘤發展過程中呈現異常激活狀態,并與癌細胞遷移、黏附、腫瘤血管生成以及細胞質基質的降解緊密關聯[7],這種現象可以歸結于PI3K/Akt通路相關信號分子經歷自身磷酸化過程,從而對下游靶蛋白活性(如caspase-9、雷帕霉素的機制靶點等)起到激活或降低的作用,以調控腫瘤細胞的生長、遷移、凋亡等生物學行為[8]。MAPK存在于人體中參與調控多種生理過程,包括細胞增殖、分化、凋亡、炎癥反應、血管發育等[9-10]。研究[11-13]表明,細胞外信號調節激酶、c-Jun氨基末端激酶和p38激酶是MAPK的常見亞類,而MAPK系統的紊亂可能擾亂其正常的生理過程,并頻繁參與腫瘤的發生、發展和耐藥性,因此將它視為癌癥治療有希望的靶點。HPV感染與癌癥發展密切相關。在HPV感染陽性率升高的情況下,惡性腫瘤患者的生存期縮短,并與淋巴結轉移和腫瘤的惡性程度有密切關系;HPV感染后,它可以對黏膜上皮細胞造成損傷,同時轉錄產生E6和E7蛋白,E6蛋白能夠促使p53的降解,而E7蛋白能夠與視網膜母細胞瘤蛋白特異性結合,從而阻礙p53和視網膜母細胞瘤蛋白的抗癌作用,導致腫瘤細胞異常增殖,最終發展成癌癥;此外,HPV感染還使得細胞從G1期轉變到S期,導致腫瘤細胞的生長周期縮短,增殖速度加快,且惡性程度增加[14-15]。
總之,本研究對1例十二指腸NET多發轉移患者的組織進行了RNA測序,篩選出了在轉移灶中的DEGs,并且發現DEGs主要富集于MAPK通路以及PI3K/Akt通路;進一步篩選出了分別只在HM和LN中表達且FC前5位的DEGs,其中部分基因(如ORM1、HOXC8和HOXC9)已在其他腫瘤中被證實與腫瘤的侵襲和轉移有關,雖然在十二指腸NET中尚未得到確認,但是這些基因有可能在調控十二指腸NET的轉移過程中扮演著重要角色。今后將進一步驗證這些基因靶點在十二指腸NET轉移中的作用,同時探究它們在治療中的潛在價值,以期預防十二指腸NET的轉移并改善患者的預后。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:孫祺和趙偉指導和修改文稿;徐宇航負責樣本采集、分析并撰寫文稿;薛棟、劉暢、黃文博及徐晨曦參與數據分析與相關討論及修改。
倫理聲明:本研究通過了西安交通大學醫學院第一附屬醫院醫學倫理委員會審批[批文編號:2022倫審科字第(451)號]。
神經內分泌瘤(neuroendocrine tumor,NET)是一種起源于神經內分泌細胞的罕見腫瘤,通常將發生于胃、十二指腸及胰腺的NET統稱為胃腸胰NET,它可產生一系列多肽激素,根據能否分泌激素以及產生相應的臨床癥狀分為功能性和非功能性兩種類型[1-2]。近幾年NET的檢出率逐年升高,美國國家癌癥研究所SEER數據庫的統計數據顯示,2000–2012年期間胃腸胰NET的患病率約為3.56/10萬人且呈現逐漸上升趨勢,占所有NET的65%~75%,是其最常見類型,其中發生于十二指腸的NET十分罕見[3-4]。與同位置的腺癌相比,胃腸胰NET的惡性程度較低,易發生早期轉移,約50%的新診斷患者會發生遠處轉移[5]。肝臟是胃腸胰NET較為多見的轉移部位,65%~95%的患者于診斷時已經發生肝臟轉移[6]。十二指腸NET同時伴肝轉移及淋巴結轉移的患者鮮有文獻報道。西安交通大學第一附屬醫院(簡稱 “我院” )普通外科收治了1例十二指腸NET同時伴肝臟和淋巴結轉移患者,本研究對該例患者的組織樣本進行RNA測序分析,從轉錄組學角度探究可能參與十二指腸NET遠處轉移及影響器官轉移特異性的潛在轉移機制以及探索可能參與腫瘤轉移的潛在基因與作用靶點,對預防十二指腸NET患者的遠處轉移及改善患者的預后具有重要意義。
1 資料與方法
1.1 組織獲取
獲取2021年我院普通外科收治的1例十二指腸NET同時伴肝臟和淋巴結轉移并行胰十二指腸切除+轉移灶切除患者的癌旁十二指腸上皮組織 [以下簡稱“正常組織(normal tissue,NT)” ] 及轉移灶組織標本,干冰運輸,–80 ℃保存。術前與患者及其家屬溝通并簽署標本留取知情同意書,同時經我院醫學倫理委員會審批通過。
1.2 轉錄組測序
送檢標本包括NT、十二指腸NET組織(duodenal NET tissue,DUO)、肝轉移組織(hepatic metastasis tissue,HM)和淋巴結轉移組織(lymph node metastasis tissue,LM)。使用Trizol試劑盒分別提取NT、HM、LM及DUO的總RNA后用NanoPhotometer?分光光度計檢測樣品純度,同時用Agilent2100 RNA Nano6000 Assay Kit檢測RNA樣品的完整性和濃度。檢測樣品合格后純化mRNA并構建文庫,使用Agilent2100生物分析儀對文庫進行質檢,質量合格后由北京安諾優達基因科技有限公司基于 Illumina平臺通過PE150測序策略進行測序。
1.3 測序數據過濾
Illumina平臺測序得到原始下機序列(Raw Reads)后,對Raw Reads進行過濾。數據處理步驟如下:① 去除接頭污染的Reads;② 去除低質量的Reads;③ 去除含無法確定的堿基數目(N)比例 >5%的Reads。過濾后獲到高質量的序列(Clean Reads),經質控合格后基于Clean Reads進行數據比對分析和轉錄組深層分析。
1.4 差異表達基因(differentially expressed genes,DEGs)分析
通過DEseq2進行DEGs分析,其篩選主要以差異倍數(fold change,FC)以及q值(矯正后P值)為參考,其標準為 |log2FC| ≥1和q<0.05。
1.5 富集分析
對DEGs進行基因本體論(gene ontology,GO)數據庫的富集分析,分別描述基因參與的生物過程、細胞組分及分子功能。使用京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)數據庫對DEGs進行通路富集分析,該數據庫可對蛋白質交互網絡在各種細胞活動過程中的作用做出預測。
1.6 統計學方法
采用R軟件進行統計學分析。符合正態分布的計量資料以均數±標準差(x±s)描述,多組間比較采用ANOVA單因素方差分析,2組間比較采用獨立樣本比較的t檢驗,檢驗水準α=0.05。
2 結果
2.1 患者的基本情況
患者,女,44歲。術前胃鏡檢查見十二指腸降部乳頭上方一隆起性病變,表面光滑,頂部凹陷粗糙糜爛、潰瘍形成(圖1a)。超聲檢查見隆起處呈低回聲團塊樣改變,病變處十二指腸壁5層結構消失,壁外見低回聲實性團塊,團塊似起源于十二指腸壁固有肌層,截面大小約3.4 cm×3.3 cm,內部回聲欠均勻,有病變浸及全層的可能(圖1b)。全腹部增強CT檢查顯示肝右葉第6段類圓形、環形強化腫塊(圖1c),腹膜后稍大淋巴結(圖1d),考慮肝臟和腹膜后淋巴結轉移。取組織活檢病理檢查提示:十二指腸小塊黏膜內上皮樣細胞腫瘤浸潤,結合免疫組織化學染色提示NET(G1)。遂行胰十二指腸切除+轉移灶切除術。術中待組織切除后剖開,留取癌旁十二指腸上皮組織、原發灶及轉移灶組織標本。
 圖1
示患者術前胃鏡、超聲及CT檢查結果
圖1
示患者術前胃鏡、超聲及CT檢查結果
a:胃鏡下病灶;b:超聲下病灶;c、d:CT見肝臟環形強化腫塊(c,紅箭所指)及腹膜后腫大淋巴結(d,紅箭所指)
2.2 DEGs分析結果
DUO、HM、LM和NT樣本中DEGs的熱圖見圖2a。對DUO、HM和LM中基因表達量分別與NT比較(分別表示為DUO_NT、HM_NT、LM_NT)后繪制的所有DEGs韋恩圖見圖2b,從圖2b中可見,在DUO_NT中DEGs共12 724個、HM_NT中共10 201個、LM_NT中共11 050個,在這3種組織中共表達DEGs共6 226個,其中僅在DUO_NT中表達的DEGs有2 738個、HM_NT中2 053個、LM_NT中742個。在DUO、HM和LM中DEGs表達的火山圖見圖3a~3c,其中在DUO_NT中上調基因8 716個、下調基因4 008個,HM_NT中上調基因6 390個、下調基因3 811個,LM_NT中上調基因7 904個、下調基因3 146個。根據篩選出的DEGs在HM_NT和LM_NT中的FC前5位的基因分別是ORM1、C4BPA、AHSG、C9和LBP以及ABHD12B、AC100850.1、HOXC9、AC083967.1和HOXC8,見表1。
 圖2
示DUO、HM、LM和NT樣本中DEGs的熱圖(a)及DUO_NT、HM_NT和LM_NT中所有DEGs的韋恩圖(b)
圖2
示DUO、HM、LM和NT樣本中DEGs的熱圖(a)及DUO_NT、HM_NT和LM_NT中所有DEGs的韋恩圖(b)
2.3 DUO、HM與LM中DEGs的GO富集分析結果
對本研究篩選出分別只在DUO、HM和LM中表達的DEGs進行GO功能富集分析發現,前10位的富集分析結果,在生物過程部分見圖4a,主要富集于生物發展過程(developmental process)、解剖結構發展(anatomical structure development)、信號轉導調節(regulation of signal transduction)等;在細胞組分見圖4b,主要富集于膜部分(membrane part)、膜整體組件(integral component of membrane)、膜固有成分(integral component of plasma membrane)等;在分子功能部分見圖4c,主要富集于蛋白結合(protein binding)、陰離子結合(anion binding)等。
 圖3
示DUO_NT(a)、HM_NT(b)與LM_NT(c)中DEGs的火山圖
圖3
示DUO_NT(a)、HM_NT(b)與LM_NT(c)中DEGs的火山圖
2.4 DUO、HM與LM中DEGs的KEGG富集分析結果
利用KEGG數據庫分析DUO、HM和LM中的DEGs富集的信號通路,預測它在各類信號活動中的作用。DUO與NT相比,DEGs主要涉及于168個代謝通路(補充材料圖1a),其中最為富集的是癌癥通路(pathways in cancer),之后是人乳頭狀瘤病毒(human papillomavirus,HPV)感染、磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又名Akt)信號通路、絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信號通路和神經活性配體-受體相互作用(neuroactive ligand-receptor interaction),見圖4d。HM與NT相比,差異表達基因主要涉及于131個代謝通路(補充材料圖1b),其中最為富集的是癌癥通路(pathways in cancer),其次是神經活性配體-受體相互作用(neuroactive ligand-receptor interaction)和PI3K/Akt信號通路,見圖4e。LM與NT相比,差異基因主要涉及于126個代謝通路(補充材料圖1c),其中最為富集的癌癥通路(pathways in cancer),之后是PI3K/Akt信號通路、神經活性配體-受體相互作用(neuroactive ligand-receptor interaction)和HPV感染,見圖4f。
 圖4
示DUO、HM及LM中DEGs的GO(分別為a~c)和KEGG(分別為d~f)富集分析結果
圖4
示DUO、HM及LM中DEGs的GO(分別為a~c)和KEGG(分別為d~f)富集分析結果
3 討論
胃腸胰NET患者發生遠處轉移是降低其生存率的主要原因之一,尤其是發生多發性遠處轉移。因此,研究患者多發性遠處轉移灶和不同病灶之間的基因表達差異有助于尋找影響胃腸胰NET侵襲性和腫瘤特異性轉移的潛在靶點,可能對抑制腫瘤的遠處轉移有潛在價值。
本研究對1例十二指腸NET同時伴發肝臟和淋巴結轉移患者的原發病灶及其兩處轉移灶組織進行RNA測序分析。① DEGs分析結果發現,本研究篩選出了僅在HM和LM中顯著表達的DEGs,其FC在HM中前5位者分別是ORM1、C4BPA、AHSG、C9和LBP,在LM中前5位者分別是ABHD12B、AC100850.1、HOXC9、AC083967.1和HOXC8。根據目前的相關研究,其中ORM1、HOXC8和HOXC9基因被報道與腫瘤的進展、轉移及預后有關,其他基因的研究報道較少。ORM1基因,又名α1-酸性糖蛋白基因(α1-acid glycoprotein,α1-AGP),它在正常生理狀態下的人體血清中含量較少,但在病理條件如感染、炎癥和腫瘤中的濃度會顯著增加,主要由肝臟產生,部分腫瘤組織也分泌。有研究者報道在多種腫瘤如肝癌[16]和子宮內膜癌[17]的血清中表達上調;本研究也發現,ORM1基因在原發灶和轉移灶中的表達均較癌旁組織中增高,與文獻報道的結論相似。同源盒基因(homobox、HOX)是調節人體正常發育的重要調節因子,可調控細胞增殖、分化、凋亡、活動、血管生成等,它在編碼進化上具有保守性轉錄因子的重要作用,可以確保細胞分化的平衡[18-19]。HOXC9和HOXC8作為HOX家族成員,在許多類型的腫瘤如乳腺癌、結直腸癌中表現出異常表達,與癌癥的發生、發展及遷移有密切聯系,而且異常高表達者預后也較差[20-30]。結果提示,這些基因可能成為抑制十二指腸NET增殖與遷移的新靶點。② 通過KEGG富集分析發現,該患者病灶組織中顯著表達的DEGs主要富集于PI3K/Akt信號通路、MAPK信號通路、癌癥通路、神經活性配體-受體相互作用和HPV感染。在細胞生物學中,PI3K/Akt信號通路扮演著調控多種細胞功能的重要角色,在多種腫瘤發展過程中呈現異常激活狀態,并與癌細胞遷移、黏附、腫瘤血管生成以及細胞質基質的降解緊密關聯[7],這種現象可以歸結于PI3K/Akt通路相關信號分子經歷自身磷酸化過程,從而對下游靶蛋白活性(如caspase-9、雷帕霉素的機制靶點等)起到激活或降低的作用,以調控腫瘤細胞的生長、遷移、凋亡等生物學行為[8]。MAPK存在于人體中參與調控多種生理過程,包括細胞增殖、分化、凋亡、炎癥反應、血管發育等[9-10]。研究[11-13]表明,細胞外信號調節激酶、c-Jun氨基末端激酶和p38激酶是MAPK的常見亞類,而MAPK系統的紊亂可能擾亂其正常的生理過程,并頻繁參與腫瘤的發生、發展和耐藥性,因此將它視為癌癥治療有希望的靶點。HPV感染與癌癥發展密切相關。在HPV感染陽性率升高的情況下,惡性腫瘤患者的生存期縮短,并與淋巴結轉移和腫瘤的惡性程度有密切關系;HPV感染后,它可以對黏膜上皮細胞造成損傷,同時轉錄產生E6和E7蛋白,E6蛋白能夠促使p53的降解,而E7蛋白能夠與視網膜母細胞瘤蛋白特異性結合,從而阻礙p53和視網膜母細胞瘤蛋白的抗癌作用,導致腫瘤細胞異常增殖,最終發展成癌癥;此外,HPV感染還使得細胞從G1期轉變到S期,導致腫瘤細胞的生長周期縮短,增殖速度加快,且惡性程度增加[14-15]。
總之,本研究對1例十二指腸NET多發轉移患者的組織進行了RNA測序,篩選出了在轉移灶中的DEGs,并且發現DEGs主要富集于MAPK通路以及PI3K/Akt通路;進一步篩選出了分別只在HM和LN中表達且FC前5位的DEGs,其中部分基因(如ORM1、HOXC8和HOXC9)已在其他腫瘤中被證實與腫瘤的侵襲和轉移有關,雖然在十二指腸NET中尚未得到確認,但是這些基因有可能在調控十二指腸NET的轉移過程中扮演著重要角色。今后將進一步驗證這些基因靶點在十二指腸NET轉移中的作用,同時探究它們在治療中的潛在價值,以期預防十二指腸NET的轉移并改善患者的預后。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:孫祺和趙偉指導和修改文稿;徐宇航負責樣本采集、分析并撰寫文稿;薛棟、劉暢、黃文博及徐晨曦參與數據分析與相關討論及修改。
倫理聲明:本研究通過了西安交通大學醫學院第一附屬醫院醫學倫理委員會審批[批文編號:2022倫審科字第(451)號]。