引用本文: 王君, 姜路, 熊芹, 駱洪浩. 甲狀腺良性結節射頻消融術后結節體積的動態變化及對結節再生的預測價值. 中國普外基礎與臨床雜志, 2024, 31(4): 460-468. doi: 10.7507/1007-9424.202311049 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
甲狀腺結節是一種相對常見的臨床疾病,發病率高達65%[1]。其發病率與年齡、性別、碘攝入量不足等有關,尤其是與年齡有關。在大多數情況下,甲狀腺結節沒有癥狀,常在器械檢查中偶然診斷出來。較少的情況下,甲狀腺結節的診斷是由于頸部可觸及結節或相關癥狀或甲狀腺功能亢進[2]。雖然大多數甲狀腺結節屬于良性病變,然而當結節體積增大至一定程度,產生壓迫癥狀,或因其外觀影響個體美觀,以及存在惡性轉化的疑慮時,則需要采取適當的治療措施。近年來,射頻消融術(radio frequency ablation,RFA)被證明是治療甲狀腺良惡性腫瘤的一種有效、安全的方法,其中經峽道入路和消融技術的并發癥少[3]。雖然RFA可以達到令人滿意的體積縮小率和癥狀和(或)外觀改善效果,但既往研究報道良性腫瘤的復發率為5.6%,且所有復發病例均出現在初次治療時未能完全消融的結節邊緣[4]。研究[5]顯示,完整的結節邊緣消融對預防結節的再生具有關鍵作用。因此,本研究旨在分析甲狀腺良性腫瘤在RFA后結節體積的動態變化,并分析結節再生的危險因素及其預測價值,旨在為臨床醫生診療甲狀腺良性結節的過程中提供決策參考。
1 資料與方法
1.1 研究對象
納入標準:① 年齡在18歲以上;② 診斷為甲狀腺結節并經過超聲檢查、細針穿刺活檢等方式明確為良性結節[6];③ 首次接受RFA治療;④ 無明顯甲狀腺功能亢進或甲狀腺功能減低癥狀。排除標準:① 孕婦或哺乳期婦女;② 有活動性感染或全身性疾病;③ 已經接受過其他RFA治療或手術治療的病例;④ 存在惡性腫瘤病史或懷疑為惡性結節;⑤ 甲狀腺功能異常;⑥ 無法進行超聲監測或無法配合隨訪的患者。
回顧性收集2019年6月至2021年6月期間于岳池縣人民醫院行RFA治療的165例甲狀腺良性結節患者,結節體積5~30 mL,中位數為15 mL。根據入院時結節體積的中位數分為小結節體積組(≤15 mL,n=116)和大結節體積組(>15 mL,n=49)。
1.2 方法
1.2.1 RFA
RFA手術由1位有10年以上經驗的放射科醫師在門診超聲引導下完成。患者采取仰臥位,頸部充分伸直。在穿刺部位和甲狀腺周圍使用2%鹽酸利多卡因溶液進行局部麻醉,根據超聲檢查指南選擇適合腫瘤大小和周圍關鍵結構的電極尖端尺寸。手術使用內置冷卻電極和射頻器。在手術中采用經峽部入路和移動鏡頭技術,為防止出血,使用多普勒超聲觀察入路沿線血管。電極插入甲狀腺結節的最深處和最遠的部分,當結節的所有視野均變為短暫的高回聲區時確定消融終止。術后住院觀察1~2 h,確定術后定期隨訪計劃。
1.2.2 術后評估
① 術后1、3、6、12、24個月進行臨床評估和超聲檢查。采用以下公式計算每個結節的體積:V=πabc/6 [其中V為體積(mL),a為最大直徑(cm),b和c為兩個垂直直徑(cm)]。體積縮小率(volume reduction rate,VRR)為超聲成像評估的體積縮小百分比,計算公式為:[(初始體積–最終體積)×100%]/初始體積,體積單位為mL[7]。② 評估RFA的療效和再生率,將結節的總體積(total volume,Vt)分為消融部分(ablation volume,Va)和重要部分(vital volume,Vv),Vv=Vt–Va。初始消融率(initial ablation rate,IAR)是衡量RFA術后消融量的指標[8],IAR為消融體積(Va)與總體積(Vt)的比值(以mL表示體積),計算公式為:IAR=(Va/Vt)×100%,本研究IAR測定時點為術后24個月。再生定義為隨訪1、3、6、12、24個月時超聲檢查Vt較既往報告的最小Vt增加50%以上[9]。
1.3 觀察指標
一般臨床資料,包括性別、年齡、文化程度、結節數量、結節位置、結節類型、射頻功率、消融時間、總能量、手術時間、術中出血量、住院時間等。消融術前均要求患者在問卷上評估結節相關癥狀,問卷包括5種臨床癥狀(壓迫、咳嗽、吞咽困難、聲音改變和疼痛;范圍為0~5分,總分為0~25分)。由醫師進行美容分級評分(0分,未見或可觸及腫塊;1分,不可見但可觸及腫塊;2分,只吞咽時可見;3分,一個容易看到的腫塊)[10]。
實驗室檢查指標:于術前及術后12 h采集患者6 mL外周靜脈血,以4 000 r/min離心(離心半徑10 cm),常規離心15~20 min,取上層清液。實驗室檢查指標及檢測方法見表1。實驗室檢查所用到的試劑盒均購自上海酶聯生物科技有限公司,操作按試劑盒說明書進行。
1.4 統計學方法
應用SPSS 25.0軟件和R version 4.3.0軟件對數據進行統計學分析。用例數和百分比(%)描述計數資料,應用成組χ2檢驗對組間差異進行比較;用均數±標準差( ±s)表示計量資料,統計方法采用成組t檢驗,不符合正態分布的計量資料采用Mann-Whitney U檢驗。對符合正態分布且滿足方差齊性的重復測量療效指標進行分析,若滿足Mauchly球形假設檢驗則采用重復測量資料的方差分析,若不符合球形假設檢驗,則行Greenhouse-Geisser法校正。使用R 4.3.0軟件的“rms”軟件包制作列線圖,用Bootstrap法對原始數據重采樣1 000次進行內部驗證,利用校準曲線平均絕對誤差(mean absolute error,MAE)來評價模型的校準度,通過受試者工作特征(Receiver operating characteristics,ROC)曲線下面積(area under the curve,AUC)分析該預測模型的區分度。檢驗水準α=0.05。
±s)表示計量資料,統計方法采用成組t檢驗,不符合正態分布的計量資料采用Mann-Whitney U檢驗。對符合正態分布且滿足方差齊性的重復測量療效指標進行分析,若滿足Mauchly球形假設檢驗則采用重復測量資料的方差分析,若不符合球形假設檢驗,則行Greenhouse-Geisser法校正。使用R 4.3.0軟件的“rms”軟件包制作列線圖,用Bootstrap法對原始數據重采樣1 000次進行內部驗證,利用校準曲線平均絕對誤差(mean absolute error,MAE)來評價模型的校準度,通過受試者工作特征(Receiver operating characteristics,ROC)曲線下面積(area under the curve,AUC)分析該預測模型的區分度。檢驗水準α=0.05。
2 結果
2.1 2組患者的臨床病理特征比較
小結節組共有137個結節,大結節組共有66個結節。2組患者的年齡、性別、文化程度、結節類型比較差異無統計學意義(P>0.05),但結節位置、術前美容評分、術前癥狀評分、射頻功率、消融時間、總能量、手術時間、術中出血量和住院時間比較差異均具有統計學意義(P<0.05),小結節體積組的單側結節占比更高,且術前美容評分、術前癥狀評分、射頻功率、消融時間、總能量、手術時間、術中出血量和住院時間均較低(短),見表2。
2組手術前后實驗室指標(TSH、FT4、FT3、MDA、SOD、GSH-Px和CAT)差值比較差異均具有統計學意義(P<0.05),小結節體積組術后的TSH、FT3、CAT改變值大于大結節體積組(P<0.05),FT4、MDA、SOD、GSH-Px改變值小于大結節體積組(P<0.05),見表3。
2.2 RFA術后結節體積的動態變化
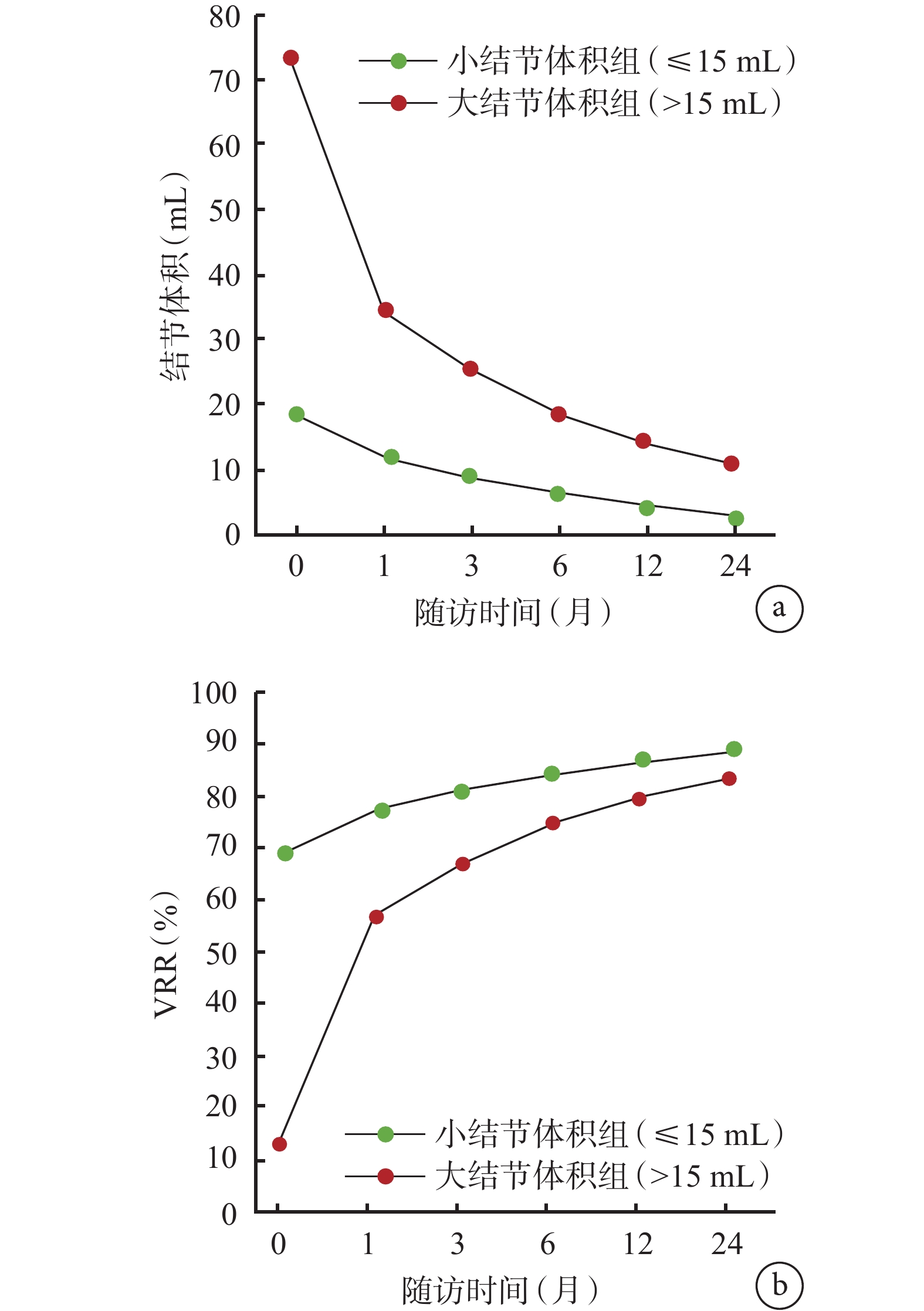
2組患者在RFA術后1、3、6、12、24個月結節體積依次減小,VRR依次增大;小結節體積組的結節體積及VRR變化均優于大結節體積組,見圖1。RFA治療前后的超聲圖像見圖2。
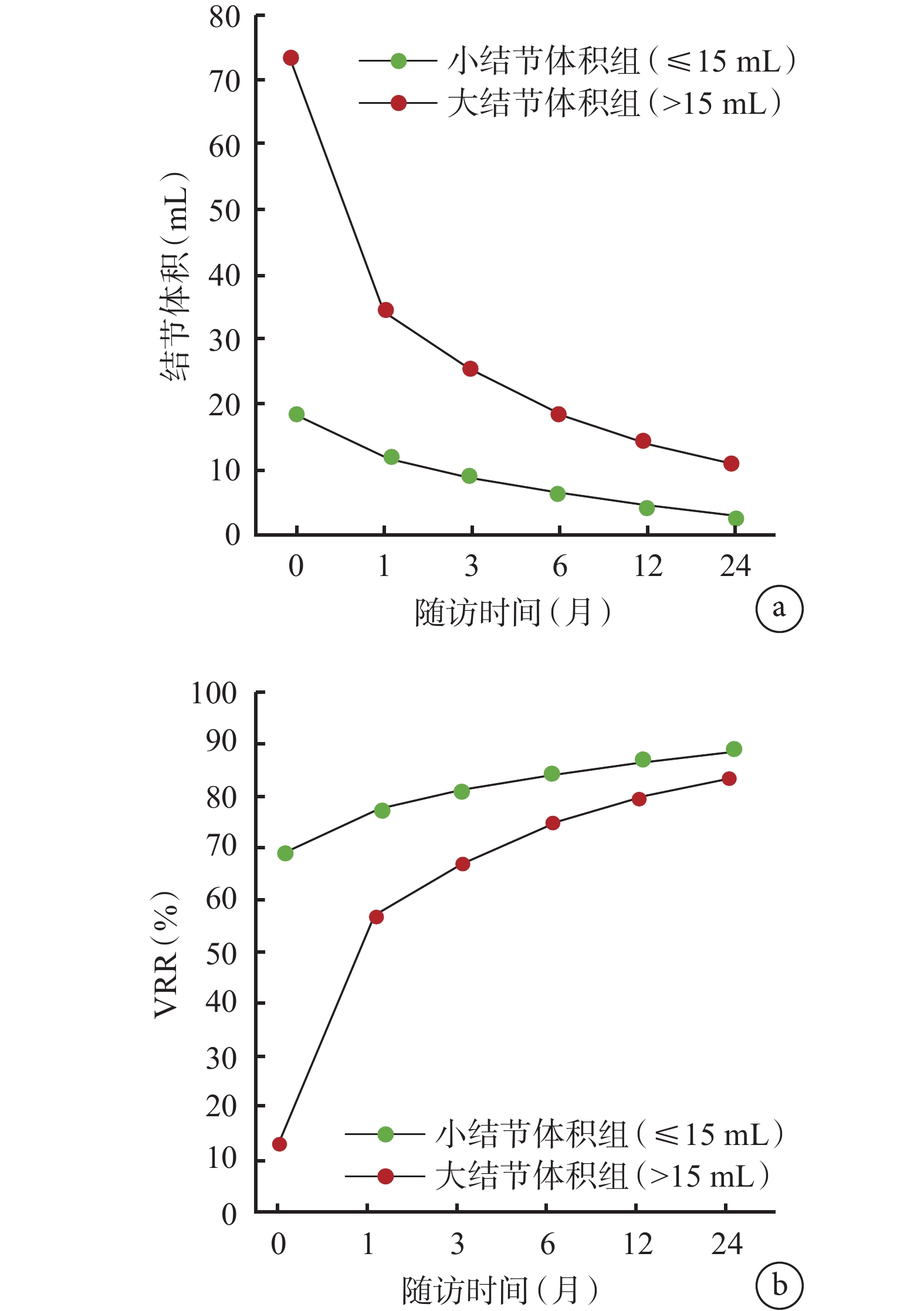 圖1
示2組患者術后各時點的結節體積(a)和VRR(b)的變化
圖1
示2組患者術后各時點的結節體積(a)和VRR(b)的變化
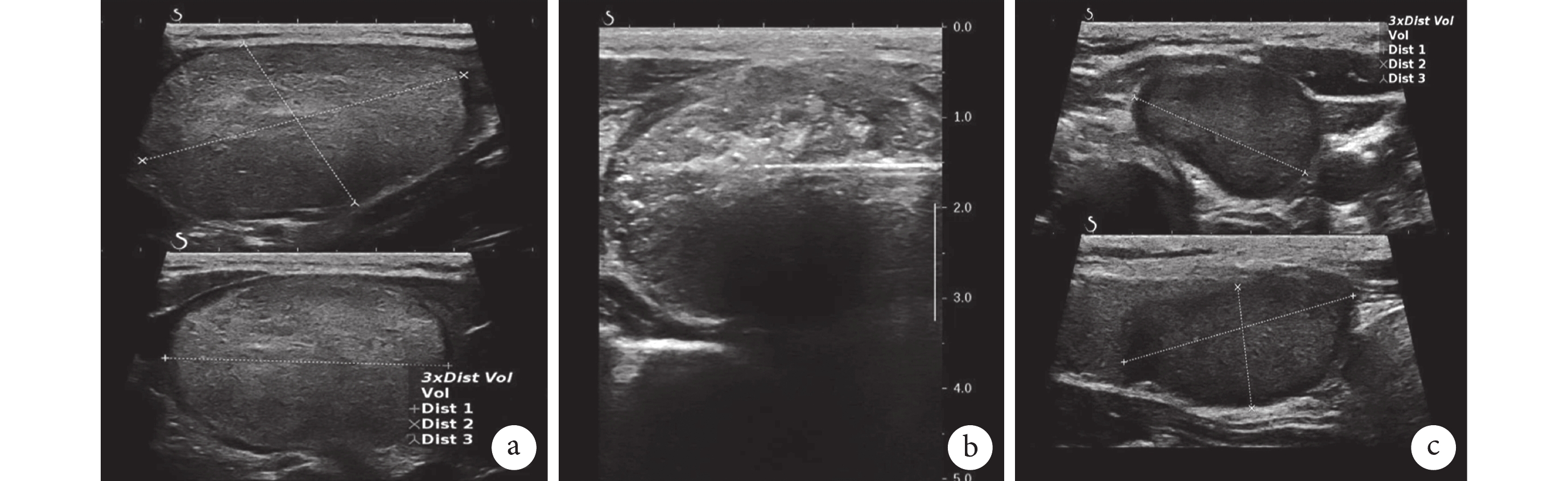 圖2
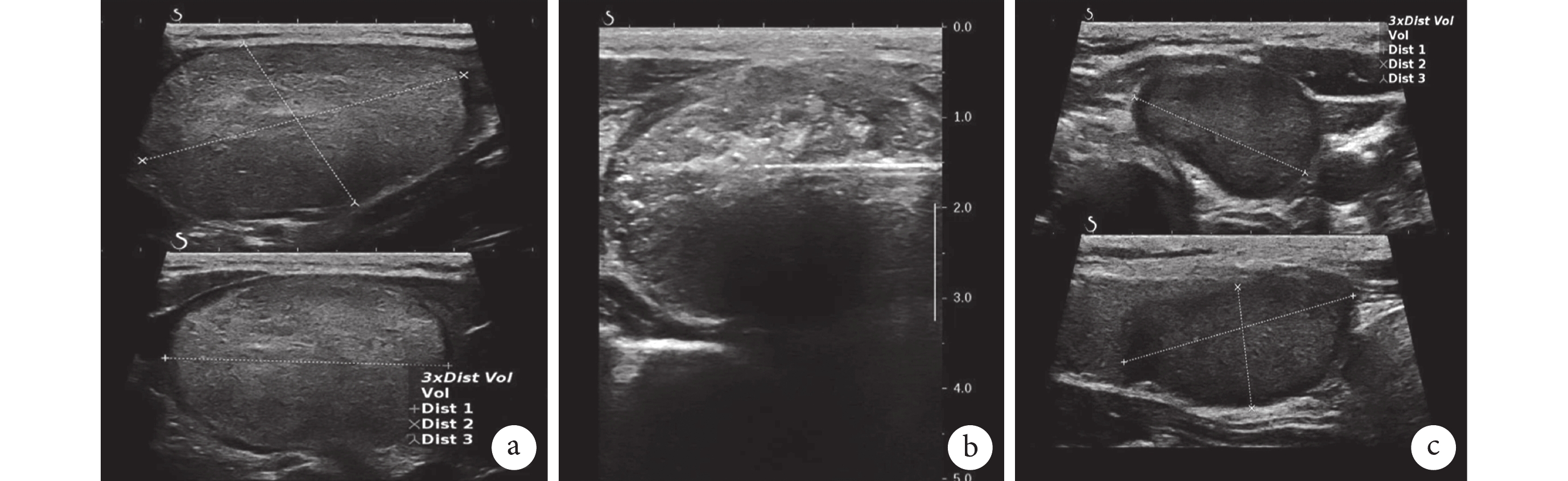
示大結節體積組甲狀腺良性結節RFA治療前后的超聲圖
圖2
示大結節體積組甲狀腺良性結節RFA治療前后的超聲圖
a:RFA治療前的甲狀腺良性結節體積為23.25 mL;b:RFA治療時甲狀腺良性結節體積為5.36 mL;c:RFA治療后12個月隨訪見結節體積為3.15 mL
2.3 2組患者的治療效果指標比較
2組患者術后再生各4例,其超聲圖像見補充材料1和2。2組患者術后各時點(1、3、6、12、24個月)的結節體積、術后1個月的VRR、再生時間和IAR比較差異均具有統計學意義(P<0.05);大結節組術后1、3、6、12、24個月的結節體積更大、術后1個月的VRR更高、再生時間更短、殘余結節數更多,且IAR較低。但2組患者的結節再生情況,術后3、6、12、24個月的VRR,以及術后并發癥發生率比較差異無統計學意義(P>0.05),見表4。
2.4 初始體積、血管密度及結節位于臨界結構附近情況與甲狀腺良性結節患者術后結節再生的關聯性
將初始體積和血管密度逐層劃分(Q1~Q5表示指標從低到高的5分位數),并納入結節位于臨界結構附近情況建立Cox比例風險回歸模型,同時逐步排除存在共線性效應的混雜因素,以消除混雜因素對預后的影響。
在未經調整的Cox比例風險模型(未校正模型)及模型1~4中,初始體積、血管密度及結節位于臨界結構附近情況與患者術后結節再生風險增加相關(P<0.001)。在最終模型即模型5中,隨著初始體積、血管密度的升高,其關聯效應值也相應增高,趨勢性檢驗差異均有統計學意義(P趨勢<0.05);結節位于臨界結構附近者再生風險增高(OR=1.76,P<0.001),見表5。
2.5 預測患者術后結節再生的列線圖構建及驗證
選擇模型5中的初始體積、血管密度及結節位于臨界結構附近情況因素建立列線圖模型,則可得出對應指標的賦分結果以預測術后結節再生風險。例如某患者初始體積對應賦值為100分,血管密度對應賦值為45分,結節位于臨界結構附近對應賦值為30分,總分175分,其發生結節再生風險為88.6%(圖3)。
 圖3
示構建的預測患者術后結節再生的列線圖模型
圖3
示構建的預測患者術后結節再生的列線圖模型
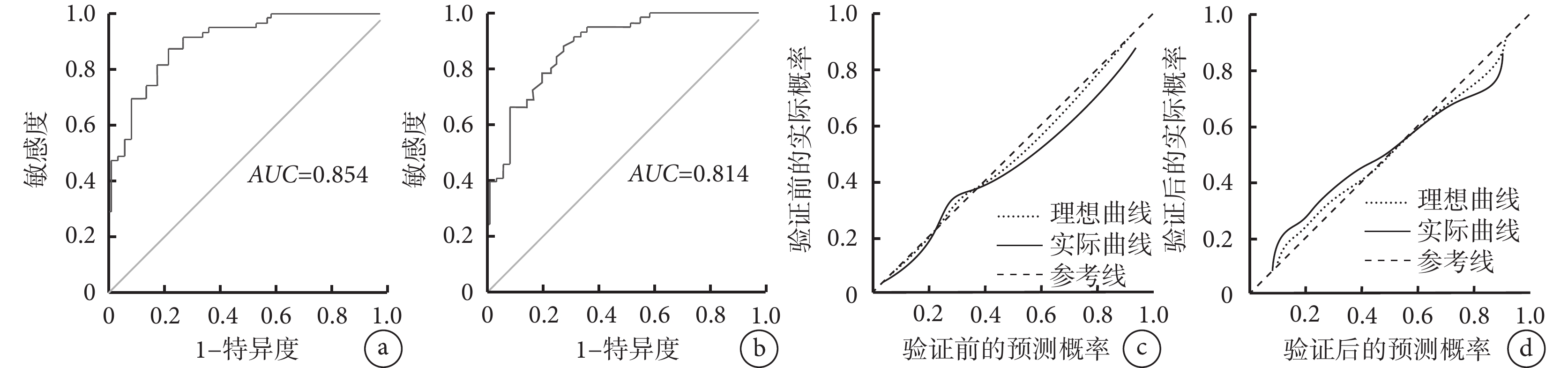
以模型預測的風險值為檢驗變量,患者實際預后情況為狀態變量,驗證前后ROC曲線的AUC分別為0.854 [95%CI(0.758,0.918)] 和0.814[95%CI(0.754,0.907)],提示該模型的區分度較好(表6和圖4)。驗證前后校準曲線的預測概率與參考概率擬合度均較好,平均絕對誤差分別為 0.023和0.026,提示該模型的準確度較高(圖4)。
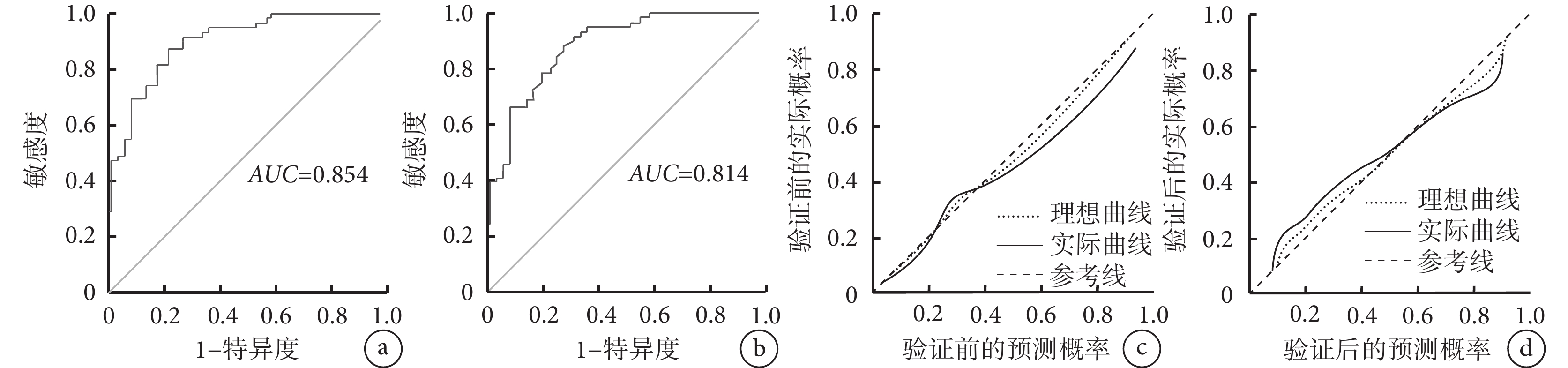 圖4
示列線圖模型驗證前后的ROC曲線及校準曲線
圖4
示列線圖模型驗證前后的ROC曲線及校準曲線
a、b:列線圖模型驗證前(a)、后(b)的ROC曲線;c、d:列線圖模型驗證前(c)、后(d)的校準曲線
3 討論
大部分甲狀腺結節是良性的,但一些患者仍然面臨著手術切除的困境[11]。RFA作為一種新興的非手術治療方法,已經在臨床實踐中得到廣泛應用[12]。為了更好地評估甲狀腺良性結節行RFA治療的治療效果,本研究探討了RFA術后結節體積的動態變化,并探討這些變化在臨床實踐中的意義。
甲狀腺結節因其多樣性和分布不均的特點,加之結節位置的不同,可能會對RFA的治療效果以及患者的康復情況產生影響[13]。甲狀腺結節行RFA能夠顯著改善患者的外觀和癥狀,提高其生活質量。RFA作為一種非手術治療方法,具有較低的切口和較小的創傷,能夠減少患者的術后瘢痕和不適程度。在本研究中,小結節體積組的單側結節占比更高,且術前美容評分、術前癥狀評分、射頻功率、消融時間、總能量、手術時間、術中出血量和住院時間均較低(短)。較高的射頻功率和總能量通常需要更長的消融時間和手術時間,也與不同患者的病理特點和結節的大小、形狀有關。對于較大、較復雜的結節,通常需要更高的射頻功率和能量來實現完全消融[14]。RFA對甲狀腺結節的治療通常能夠顯著減少術中出血量,并且可以實現更快的康復,縮短住院時間。治療后TSH、FT4、FT3、MDA、SOD、GSH-Px、CAT這些指標反映了甲狀腺功能和氧化應激狀態的改變[15]。這些指標的改變提示了甲狀腺良性結節患者在接受RFA后,甲狀腺功能有所恢復,表現為TSH、FT4和FT3水平的正常化;同時患者體內氧化應激狀態也在調整,表現為MDA 水平的增加和抗氧化酶(SOD、GSH-Px、CAT)活性的降低。這表明RFA治療有助于減輕患者的氧化應激反應,促進甲狀腺功能的恢復。
本研究發現在甲狀腺良性結節患者中,RFA后1、3、6、12和24個月,2組患者的結節體積逐漸減小,而VRR逐漸增大。與大結節體積組(>15 mL)相比,小結節體積組(≤15 mL)顯示出更顯著的結節體積減小和VRR增大效果。除了結節體積的變化,筆者還觀察了RFA后各個隨訪期的治療結局:2組患者的術后1、3、6、12、24個月的結節體積,術后1個月的VRR,再生時間和IAR比較差異均具有統計學意義,大結節組術后1、3、6、12、24個月的結節體積更大、術后1個月的VRR更高、再生時間更短、殘余結節數更多,且IAR較低。這與不同結節體積組織間的結構特點和組織密度有關[16]。本研究結果提示,在甲狀腺良性結節患者中,RFA對結節體積的減小和VRR的增加具有顯著效果,尤其對于小體積的結節,其治療效果更好。
此外,本研究探索了不同因素對甲狀腺良性結節患者術后結節再生的影響。控制性別、年齡、文化程度、結節數量等因素后,初始結節體積、血管密度以及結節位于臨界結構附近與結節再生存在關聯,是甲狀腺良性結節術后結節再生的影響因素,初始結節體積越大、血管密度越高,結節位于臨界結構附近,術后結節再生的風險高。結節初始體積已被公認為再生的重要因素[17]。較大的結節內部血管分布更為豐富,RFA時難以完全破壞所有血管,導致結節再生。此外,大體積結節往往伴隨著更多的甲狀腺組織受損,修復過程中可能出現異常增生,進一步增加了復發的風險。因此,對于初始體積較大的結節,醫生在制定治療方案時應更加謹慎,可能需要考慮多次消融或結合其他治療手段,以提高治療效果。臨床上可能很難通過一次療程消融大結節的所有結節邊緣,導致治療不完全和隨后的再生。結節位置是與再生相關的另一個因素[18]。由于頸部相對較窄,包含許多關鍵結構,因此當結節靠近關鍵結構時,并發癥可能是不可避免的。Yan等[19]的研究發現,甲狀腺結節中的脈管系統可引起散熱器效應,從而降低消融效果并誘導再生。因此,對于位于臨界結構附近的結節,醫生在手術時應格外小心,避免對周圍組織造成損傷。對于具有較大初始結節體積、高血管密度和位于臨界結構附近的患者,需要進行更密切的隨訪,并可能需要采取額外的措施來監測和控制結節再生。在趨勢性檢驗中,初始結節體積和血管密度均具有統計學意義。為了更準確地預測結節再生風險,本研究基于初始體積、血管密度及結節位于臨界結構附近情況因素建立了列線圖模型,驗證前后ROC曲線的AUC值分別為0.854和0.814,表明該模型具有較高的區分度;同時,校準曲線驗證結果顯示模型的預測概率與參考概率擬合度良好,平均絕對誤差為0.023,驗證了模型的高準確度。
總之,RFA在不同大小的單個甲狀腺良性結節中實現了臨床相關的體積減小,且持續至少2年;初始結節體積大、血管密度大以及結節位于臨界結構附近是甲狀腺良性結節患者術后結節再生的危險因素。未來研究可在此基礎上進一步拓展和深化,以期為患者帶來更加精準和有效的治療策略。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:王君、姜路和熊芹收集并整理數據;王君撰寫文章;駱洪浩審查研究的合理性并修改文章。
倫理聲明:本研究經岳池縣人民醫院醫學倫理委員會審批通過(批文編號:YC20465P)。
甲狀腺結節是一種相對常見的臨床疾病,發病率高達65%[1]。其發病率與年齡、性別、碘攝入量不足等有關,尤其是與年齡有關。在大多數情況下,甲狀腺結節沒有癥狀,常在器械檢查中偶然診斷出來。較少的情況下,甲狀腺結節的診斷是由于頸部可觸及結節或相關癥狀或甲狀腺功能亢進[2]。雖然大多數甲狀腺結節屬于良性病變,然而當結節體積增大至一定程度,產生壓迫癥狀,或因其外觀影響個體美觀,以及存在惡性轉化的疑慮時,則需要采取適當的治療措施。近年來,射頻消融術(radio frequency ablation,RFA)被證明是治療甲狀腺良惡性腫瘤的一種有效、安全的方法,其中經峽道入路和消融技術的并發癥少[3]。雖然RFA可以達到令人滿意的體積縮小率和癥狀和(或)外觀改善效果,但既往研究報道良性腫瘤的復發率為5.6%,且所有復發病例均出現在初次治療時未能完全消融的結節邊緣[4]。研究[5]顯示,完整的結節邊緣消融對預防結節的再生具有關鍵作用。因此,本研究旨在分析甲狀腺良性腫瘤在RFA后結節體積的動態變化,并分析結節再生的危險因素及其預測價值,旨在為臨床醫生診療甲狀腺良性結節的過程中提供決策參考。
1 資料與方法
1.1 研究對象
納入標準:① 年齡在18歲以上;② 診斷為甲狀腺結節并經過超聲檢查、細針穿刺活檢等方式明確為良性結節[6];③ 首次接受RFA治療;④ 無明顯甲狀腺功能亢進或甲狀腺功能減低癥狀。排除標準:① 孕婦或哺乳期婦女;② 有活動性感染或全身性疾病;③ 已經接受過其他RFA治療或手術治療的病例;④ 存在惡性腫瘤病史或懷疑為惡性結節;⑤ 甲狀腺功能異常;⑥ 無法進行超聲監測或無法配合隨訪的患者。
回顧性收集2019年6月至2021年6月期間于岳池縣人民醫院行RFA治療的165例甲狀腺良性結節患者,結節體積5~30 mL,中位數為15 mL。根據入院時結節體積的中位數分為小結節體積組(≤15 mL,n=116)和大結節體積組(>15 mL,n=49)。
1.2 方法
1.2.1 RFA
RFA手術由1位有10年以上經驗的放射科醫師在門診超聲引導下完成。患者采取仰臥位,頸部充分伸直。在穿刺部位和甲狀腺周圍使用2%鹽酸利多卡因溶液進行局部麻醉,根據超聲檢查指南選擇適合腫瘤大小和周圍關鍵結構的電極尖端尺寸。手術使用內置冷卻電極和射頻器。在手術中采用經峽部入路和移動鏡頭技術,為防止出血,使用多普勒超聲觀察入路沿線血管。電極插入甲狀腺結節的最深處和最遠的部分,當結節的所有視野均變為短暫的高回聲區時確定消融終止。術后住院觀察1~2 h,確定術后定期隨訪計劃。
1.2.2 術后評估
① 術后1、3、6、12、24個月進行臨床評估和超聲檢查。采用以下公式計算每個結節的體積:V=πabc/6 [其中V為體積(mL),a為最大直徑(cm),b和c為兩個垂直直徑(cm)]。體積縮小率(volume reduction rate,VRR)為超聲成像評估的體積縮小百分比,計算公式為:[(初始體積–最終體積)×100%]/初始體積,體積單位為mL[7]。② 評估RFA的療效和再生率,將結節的總體積(total volume,Vt)分為消融部分(ablation volume,Va)和重要部分(vital volume,Vv),Vv=Vt–Va。初始消融率(initial ablation rate,IAR)是衡量RFA術后消融量的指標[8],IAR為消融體積(Va)與總體積(Vt)的比值(以mL表示體積),計算公式為:IAR=(Va/Vt)×100%,本研究IAR測定時點為術后24個月。再生定義為隨訪1、3、6、12、24個月時超聲檢查Vt較既往報告的最小Vt增加50%以上[9]。
1.3 觀察指標
一般臨床資料,包括性別、年齡、文化程度、結節數量、結節位置、結節類型、射頻功率、消融時間、總能量、手術時間、術中出血量、住院時間等。消融術前均要求患者在問卷上評估結節相關癥狀,問卷包括5種臨床癥狀(壓迫、咳嗽、吞咽困難、聲音改變和疼痛;范圍為0~5分,總分為0~25分)。由醫師進行美容分級評分(0分,未見或可觸及腫塊;1分,不可見但可觸及腫塊;2分,只吞咽時可見;3分,一個容易看到的腫塊)[10]。
實驗室檢查指標:于術前及術后12 h采集患者6 mL外周靜脈血,以4 000 r/min離心(離心半徑10 cm),常規離心15~20 min,取上層清液。實驗室檢查指標及檢測方法見表1。實驗室檢查所用到的試劑盒均購自上海酶聯生物科技有限公司,操作按試劑盒說明書進行。
1.4 統計學方法
應用SPSS 25.0軟件和R version 4.3.0軟件對數據進行統計學分析。用例數和百分比(%)描述計數資料,應用成組χ2檢驗對組間差異進行比較;用均數±標準差( ±s)表示計量資料,統計方法采用成組t檢驗,不符合正態分布的計量資料采用Mann-Whitney U檢驗。對符合正態分布且滿足方差齊性的重復測量療效指標進行分析,若滿足Mauchly球形假設檢驗則采用重復測量資料的方差分析,若不符合球形假設檢驗,則行Greenhouse-Geisser法校正。使用R 4.3.0軟件的“rms”軟件包制作列線圖,用Bootstrap法對原始數據重采樣1 000次進行內部驗證,利用校準曲線平均絕對誤差(mean absolute error,MAE)來評價模型的校準度,通過受試者工作特征(Receiver operating characteristics,ROC)曲線下面積(area under the curve,AUC)分析該預測模型的區分度。檢驗水準α=0.05。
±s)表示計量資料,統計方法采用成組t檢驗,不符合正態分布的計量資料采用Mann-Whitney U檢驗。對符合正態分布且滿足方差齊性的重復測量療效指標進行分析,若滿足Mauchly球形假設檢驗則采用重復測量資料的方差分析,若不符合球形假設檢驗,則行Greenhouse-Geisser法校正。使用R 4.3.0軟件的“rms”軟件包制作列線圖,用Bootstrap法對原始數據重采樣1 000次進行內部驗證,利用校準曲線平均絕對誤差(mean absolute error,MAE)來評價模型的校準度,通過受試者工作特征(Receiver operating characteristics,ROC)曲線下面積(area under the curve,AUC)分析該預測模型的區分度。檢驗水準α=0.05。
2 結果
2.1 2組患者的臨床病理特征比較
小結節組共有137個結節,大結節組共有66個結節。2組患者的年齡、性別、文化程度、結節類型比較差異無統計學意義(P>0.05),但結節位置、術前美容評分、術前癥狀評分、射頻功率、消融時間、總能量、手術時間、術中出血量和住院時間比較差異均具有統計學意義(P<0.05),小結節體積組的單側結節占比更高,且術前美容評分、術前癥狀評分、射頻功率、消融時間、總能量、手術時間、術中出血量和住院時間均較低(短),見表2。
2組手術前后實驗室指標(TSH、FT4、FT3、MDA、SOD、GSH-Px和CAT)差值比較差異均具有統計學意義(P<0.05),小結節體積組術后的TSH、FT3、CAT改變值大于大結節體積組(P<0.05),FT4、MDA、SOD、GSH-Px改變值小于大結節體積組(P<0.05),見表3。
2.2 RFA術后結節體積的動態變化
2組患者在RFA術后1、3、6、12、24個月結節體積依次減小,VRR依次增大;小結節體積組的結節體積及VRR變化均優于大結節體積組,見圖1。RFA治療前后的超聲圖像見圖2。
 圖1
示2組患者術后各時點的結節體積(a)和VRR(b)的變化
圖1
示2組患者術后各時點的結節體積(a)和VRR(b)的變化
 圖2
示大結節體積組甲狀腺良性結節RFA治療前后的超聲圖
圖2
示大結節體積組甲狀腺良性結節RFA治療前后的超聲圖
a:RFA治療前的甲狀腺良性結節體積為23.25 mL;b:RFA治療時甲狀腺良性結節體積為5.36 mL;c:RFA治療后12個月隨訪見結節體積為3.15 mL
2.3 2組患者的治療效果指標比較
2組患者術后再生各4例,其超聲圖像見補充材料1和2。2組患者術后各時點(1、3、6、12、24個月)的結節體積、術后1個月的VRR、再生時間和IAR比較差異均具有統計學意義(P<0.05);大結節組術后1、3、6、12、24個月的結節體積更大、術后1個月的VRR更高、再生時間更短、殘余結節數更多,且IAR較低。但2組患者的結節再生情況,術后3、6、12、24個月的VRR,以及術后并發癥發生率比較差異無統計學意義(P>0.05),見表4。
2.4 初始體積、血管密度及結節位于臨界結構附近情況與甲狀腺良性結節患者術后結節再生的關聯性
將初始體積和血管密度逐層劃分(Q1~Q5表示指標從低到高的5分位數),并納入結節位于臨界結構附近情況建立Cox比例風險回歸模型,同時逐步排除存在共線性效應的混雜因素,以消除混雜因素對預后的影響。
在未經調整的Cox比例風險模型(未校正模型)及模型1~4中,初始體積、血管密度及結節位于臨界結構附近情況與患者術后結節再生風險增加相關(P<0.001)。在最終模型即模型5中,隨著初始體積、血管密度的升高,其關聯效應值也相應增高,趨勢性檢驗差異均有統計學意義(P趨勢<0.05);結節位于臨界結構附近者再生風險增高(OR=1.76,P<0.001),見表5。
2.5 預測患者術后結節再生的列線圖構建及驗證
選擇模型5中的初始體積、血管密度及結節位于臨界結構附近情況因素建立列線圖模型,則可得出對應指標的賦分結果以預測術后結節再生風險。例如某患者初始體積對應賦值為100分,血管密度對應賦值為45分,結節位于臨界結構附近對應賦值為30分,總分175分,其發生結節再生風險為88.6%(圖3)。
 圖3
示構建的預測患者術后結節再生的列線圖模型
圖3
示構建的預測患者術后結節再生的列線圖模型
以模型預測的風險值為檢驗變量,患者實際預后情況為狀態變量,驗證前后ROC曲線的AUC分別為0.854 [95%CI(0.758,0.918)] 和0.814[95%CI(0.754,0.907)],提示該模型的區分度較好(表6和圖4)。驗證前后校準曲線的預測概率與參考概率擬合度均較好,平均絕對誤差分別為 0.023和0.026,提示該模型的準確度較高(圖4)。
 圖4
示列線圖模型驗證前后的ROC曲線及校準曲線
圖4
示列線圖模型驗證前后的ROC曲線及校準曲線
a、b:列線圖模型驗證前(a)、后(b)的ROC曲線;c、d:列線圖模型驗證前(c)、后(d)的校準曲線
3 討論
大部分甲狀腺結節是良性的,但一些患者仍然面臨著手術切除的困境[11]。RFA作為一種新興的非手術治療方法,已經在臨床實踐中得到廣泛應用[12]。為了更好地評估甲狀腺良性結節行RFA治療的治療效果,本研究探討了RFA術后結節體積的動態變化,并探討這些變化在臨床實踐中的意義。
甲狀腺結節因其多樣性和分布不均的特點,加之結節位置的不同,可能會對RFA的治療效果以及患者的康復情況產生影響[13]。甲狀腺結節行RFA能夠顯著改善患者的外觀和癥狀,提高其生活質量。RFA作為一種非手術治療方法,具有較低的切口和較小的創傷,能夠減少患者的術后瘢痕和不適程度。在本研究中,小結節體積組的單側結節占比更高,且術前美容評分、術前癥狀評分、射頻功率、消融時間、總能量、手術時間、術中出血量和住院時間均較低(短)。較高的射頻功率和總能量通常需要更長的消融時間和手術時間,也與不同患者的病理特點和結節的大小、形狀有關。對于較大、較復雜的結節,通常需要更高的射頻功率和能量來實現完全消融[14]。RFA對甲狀腺結節的治療通常能夠顯著減少術中出血量,并且可以實現更快的康復,縮短住院時間。治療后TSH、FT4、FT3、MDA、SOD、GSH-Px、CAT這些指標反映了甲狀腺功能和氧化應激狀態的改變[15]。這些指標的改變提示了甲狀腺良性結節患者在接受RFA后,甲狀腺功能有所恢復,表現為TSH、FT4和FT3水平的正常化;同時患者體內氧化應激狀態也在調整,表現為MDA 水平的增加和抗氧化酶(SOD、GSH-Px、CAT)活性的降低。這表明RFA治療有助于減輕患者的氧化應激反應,促進甲狀腺功能的恢復。
本研究發現在甲狀腺良性結節患者中,RFA后1、3、6、12和24個月,2組患者的結節體積逐漸減小,而VRR逐漸增大。與大結節體積組(>15 mL)相比,小結節體積組(≤15 mL)顯示出更顯著的結節體積減小和VRR增大效果。除了結節體積的變化,筆者還觀察了RFA后各個隨訪期的治療結局:2組患者的術后1、3、6、12、24個月的結節體積,術后1個月的VRR,再生時間和IAR比較差異均具有統計學意義,大結節組術后1、3、6、12、24個月的結節體積更大、術后1個月的VRR更高、再生時間更短、殘余結節數更多,且IAR較低。這與不同結節體積組織間的結構特點和組織密度有關[16]。本研究結果提示,在甲狀腺良性結節患者中,RFA對結節體積的減小和VRR的增加具有顯著效果,尤其對于小體積的結節,其治療效果更好。
此外,本研究探索了不同因素對甲狀腺良性結節患者術后結節再生的影響。控制性別、年齡、文化程度、結節數量等因素后,初始結節體積、血管密度以及結節位于臨界結構附近與結節再生存在關聯,是甲狀腺良性結節術后結節再生的影響因素,初始結節體積越大、血管密度越高,結節位于臨界結構附近,術后結節再生的風險高。結節初始體積已被公認為再生的重要因素[17]。較大的結節內部血管分布更為豐富,RFA時難以完全破壞所有血管,導致結節再生。此外,大體積結節往往伴隨著更多的甲狀腺組織受損,修復過程中可能出現異常增生,進一步增加了復發的風險。因此,對于初始體積較大的結節,醫生在制定治療方案時應更加謹慎,可能需要考慮多次消融或結合其他治療手段,以提高治療效果。臨床上可能很難通過一次療程消融大結節的所有結節邊緣,導致治療不完全和隨后的再生。結節位置是與再生相關的另一個因素[18]。由于頸部相對較窄,包含許多關鍵結構,因此當結節靠近關鍵結構時,并發癥可能是不可避免的。Yan等[19]的研究發現,甲狀腺結節中的脈管系統可引起散熱器效應,從而降低消融效果并誘導再生。因此,對于位于臨界結構附近的結節,醫生在手術時應格外小心,避免對周圍組織造成損傷。對于具有較大初始結節體積、高血管密度和位于臨界結構附近的患者,需要進行更密切的隨訪,并可能需要采取額外的措施來監測和控制結節再生。在趨勢性檢驗中,初始結節體積和血管密度均具有統計學意義。為了更準確地預測結節再生風險,本研究基于初始體積、血管密度及結節位于臨界結構附近情況因素建立了列線圖模型,驗證前后ROC曲線的AUC值分別為0.854和0.814,表明該模型具有較高的區分度;同時,校準曲線驗證結果顯示模型的預測概率與參考概率擬合度良好,平均絕對誤差為0.023,驗證了模型的高準確度。
總之,RFA在不同大小的單個甲狀腺良性結節中實現了臨床相關的體積減小,且持續至少2年;初始結節體積大、血管密度大以及結節位于臨界結構附近是甲狀腺良性結節患者術后結節再生的危險因素。未來研究可在此基礎上進一步拓展和深化,以期為患者帶來更加精準和有效的治療策略。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:王君、姜路和熊芹收集并整理數據;王君撰寫文章;駱洪浩審查研究的合理性并修改文章。
倫理聲明:本研究經岳池縣人民醫院醫學倫理委員會審批通過(批文編號:YC20465P)。