引用本文: 張海寶, 王朝樣, 林浩, 巨家華, 楊熊飛, 楊偉林, 俞永江. 原發性胃腸間質瘤術后無復發生存危險因素分析及其預測模型建立:歷史性隊列研究. 中國普外基礎與臨床雜志, 2024, 31(5): 585-592. doi: 10.7507/1007-9424.202311053 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
胃腸間質瘤(gastrointestinal stromal tumor,GIST)是胃腸道最常見的間葉源性腫瘤,由胃腸道Cajal間質細胞分化而來,約占所有肉瘤的18%[1-3]。目前,完整手術切除是原發局限性GIST患者獲得治愈性生存的主要治療方式[4],且隨著伊馬替尼為代表的酪氨酸激酶抑制劑(tyrosine kinase inhibitors,TKIs)的使用,GIST患者的無進展生存和總生存情況均得到顯著改善,因此在臨床實踐中多采取包括手術、介入、化學藥物治療等綜合模式[5-6]。然而即使接受完整手術切除,仍有50%~90%的GIST患者在術后出現復發或轉移[7],而且由于TKIs治療的個體差異性、不可避免的耐藥性、長期服用藥物的不良反應等問題均可使復發風險提高[8-9],嚴重影響患者預后。由于GIST的異質性及缺乏預后相關的有力標志物,評估其復發風險仍具有挑戰性,且現有的美國國立衛生研究院(National Institutes of Health,NIH)分類系統、美國軍事病理研究所標準[2]、美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)分級標準等[10]對于GIST患者術后復發評估的總體精準度有限。因此,鑒定和精準評估GIST患者術后無復發生存期(relapse-free survival,RFS)的相關危險因素及進行危險分類并建立術后RFS預測評估系統具有重要意義。列線圖預測模型通過量化患者病理和臨床特征并將相關變量整合在一起以預測腫瘤患者術后的預后情況,是預測腫瘤患者疾病風險和預后常見的統計學模型[11]。本研究通過分析影響GIST患者術后RFS的危險因素,并以此構建預測模型并預測GIST患者術后RFS情況,以期在預防GIST患者術后復發和降低術后復發風險方面為臨床醫師提供參考。
1 資料與方法
1.1 研究對象
回顧性收集2011年1月至2020年12月期間蘭州大學第一醫院和甘肅省人民醫院收治的原發性GIST患者的臨床病理資料。患者納入標準:① 術前實驗室檢查、術中和術后資料及隨訪資料完整者;② 術后病理檢查結果證實為GIST;③ 術前未行TKIs治療。排除標準:① 年齡<10歲或>80歲;② 合并其他類型腫瘤。本研究獲得了蘭州大學第一醫院醫學倫理委員會(批文編號:LDYYLL2023-484)及甘肅省人民醫院醫學倫理委員會(批文編號:2023-698)的審批且均免除了患者知情同意。
1.2 研究變量選擇和隨訪方法
選擇以下可能的影響因素(表1)進行研究:年齡、性別、體質量指數(body mass index,BMI)和血型;術前是否存在消化道出血及圍術期有無輸血;術前纖維蛋白原(fibrinogen,Fib)、血小板/淋巴細胞比率(platelet to lymphocyte ratio,PLR)、中細粒細胞/淋巴細胞比率(neutrophil to lymphocyte ratio,NLR)及Onodera預后營養指數[12](Onodera prognostic nutritional index,OPNI),OPNI的計算公式為“OPNI=血清白蛋白(g/L)+5×外周血淋巴細胞計數(×109/L)”;手術方式及淋巴結檢出數目;腫瘤位置、腫瘤大小(指腫瘤最大直徑)、是否轉移、分化程度及AJCC TNM分期[13];組織學類型、有絲分裂率、Ki-67指數、CD34表達及危險度分級[14];靶向藥物治療時間。其中PLR、NLR和OPNI最佳截斷值采用X-tile軟件進行確定。所有患者均通過病案系統及電話進行隨訪,隨訪內容主要為患者生存及復發狀況、接受TKIs輔助治療時間情況等。研究的主要結局為GIST患者術后RFS,其定義為:自GIST患者初次手術到首次復發或任何原因死亡的持續時間。
1.3 統計學方法
采用IBM SPSS R27.0、Rstudio 4.3.0和X-tile軟件進行統計學分析。符合正態分布的計量資料采用均數±標準差(x±s)描述且組間比較均采用獨立樣本比較的t檢驗,偏態分布的計量資料采用中位數(median,M)和四分位間距(interquartile range,IQR)描述且采用Mann-Whitney U檢驗;計數資料采用頻數描述且組間比較采用連續校正χ2檢驗或Pearson χ2檢驗。檢驗水準 α=0.05。
本研究納入的GIST患者按7∶3比例隨機分為訓練集和驗證集。采用單因素和多因素Cox回歸分析影響GIST患者術后RFS的風險因素,將單因素分析有統計學意義(P<0.05)的因素或結合臨床有意義的因素納入進行多因素Cox回歸分析。采用R軟件中boot、caret、ggplot2、pROC、rms、rmda等程序包繪制列線圖模型,采用受試者操作特征(receiver operating characteristic,ROC)曲線下面積(area under ROC curve,AUC)、一致性指數及校準曲線評價模型的預測效能,模型的臨床效用分析采用決策曲線分析(decision curve analysis,DCA)。
2 結果
2.1 納入患者的基本情況
本研究最終納入454例患者(表1),其中訓練集317例、驗證集137例,除性別、血型及Ki-67指數(P<0.05)外,訓練集和驗證集患者的其他基線資料比較差異無統計學意義(P>0.05)。
2.2 影響GIST患者術后RFS的單因素及多因素Cox回歸分析結果
單因素分析結果顯示,患者的血型、圍術期輸血、Fib、PLR、手術方式、淋巴結檢出數目、腫瘤位置、腫瘤大小、分化程度、AJCC TNM分期、組織學類型、有絲分裂率、Ki-67指數、CD34表達、危險度分級及靶向藥物治療時間與GIST患者術后RFS有關(P<0.05),見表2;進一步對這些因素進行多因素Cox回歸分析結果顯示,腫瘤位置為其他部位(主要包括食管、十二指腸及后腹膜,相對于胃部)、腫瘤大小>5 cm(相對于≤2 cm)、分化程度為較差或未分化(相對于分化良好)、有絲分裂率≤5/50 HPF(相對于>5/50 HPF)、CD34表達 [(–),相對于表達(+)]、手術方式為消融術(相對于單純切除術)、淋巴結檢出數目≥4枚(相對于0枚)及靶向藥物治療時間≤3個月(相對于12~36個月)是影響GIST患者術后RFS的危險因素(P<0.05),見表3。
2.3 列線圖模型的建立、驗證及臨床應用價值
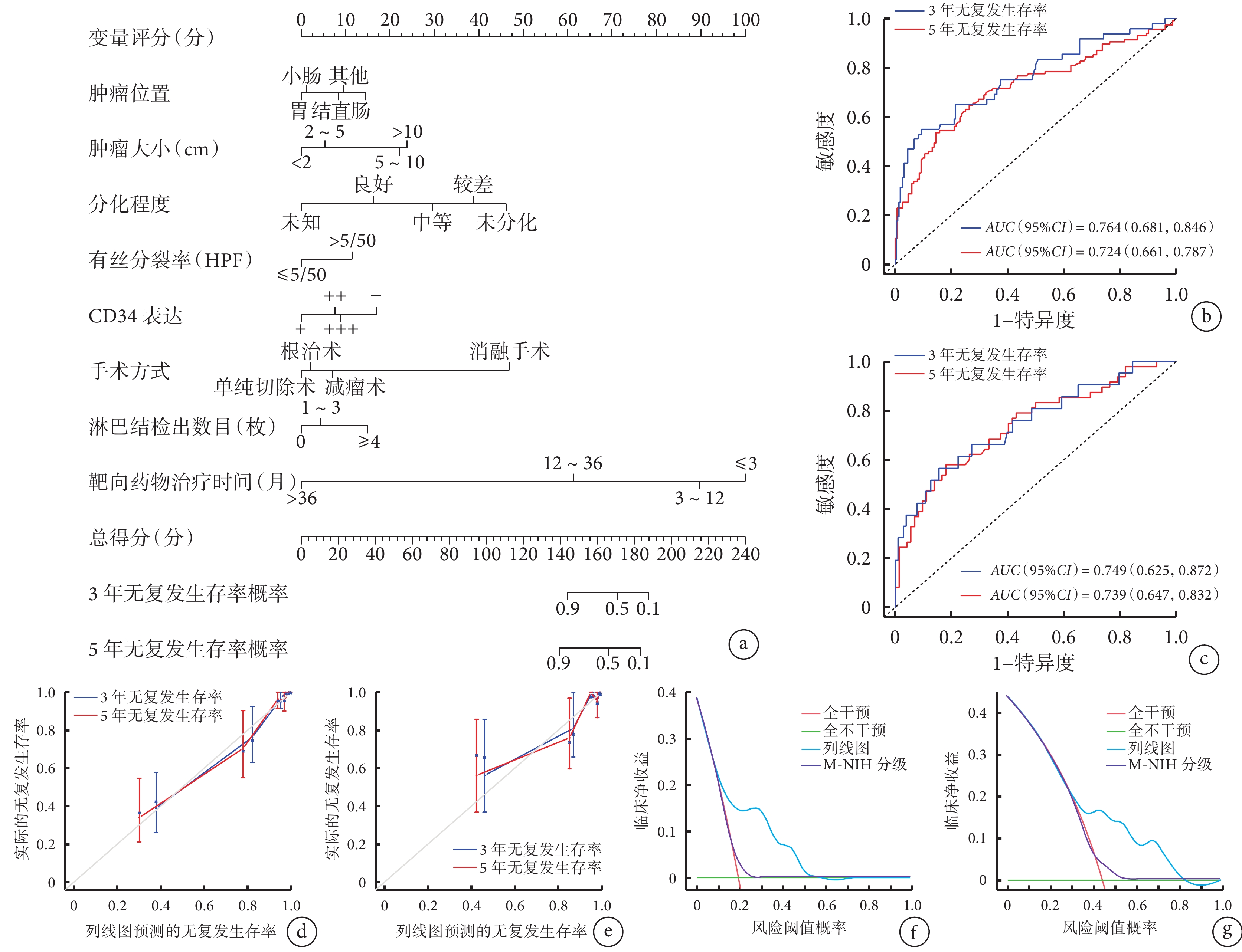
根據多因素Cox回歸分析篩選出的風險因素(其中由于AJCC TNM分期包括腫瘤位置、腫瘤大小及有絲分裂率,故列線圖模型構建中不再納入此變量)構建列線圖模型預測GIST患者術后3年和5年無復發生存率概率,結果見圖1a。
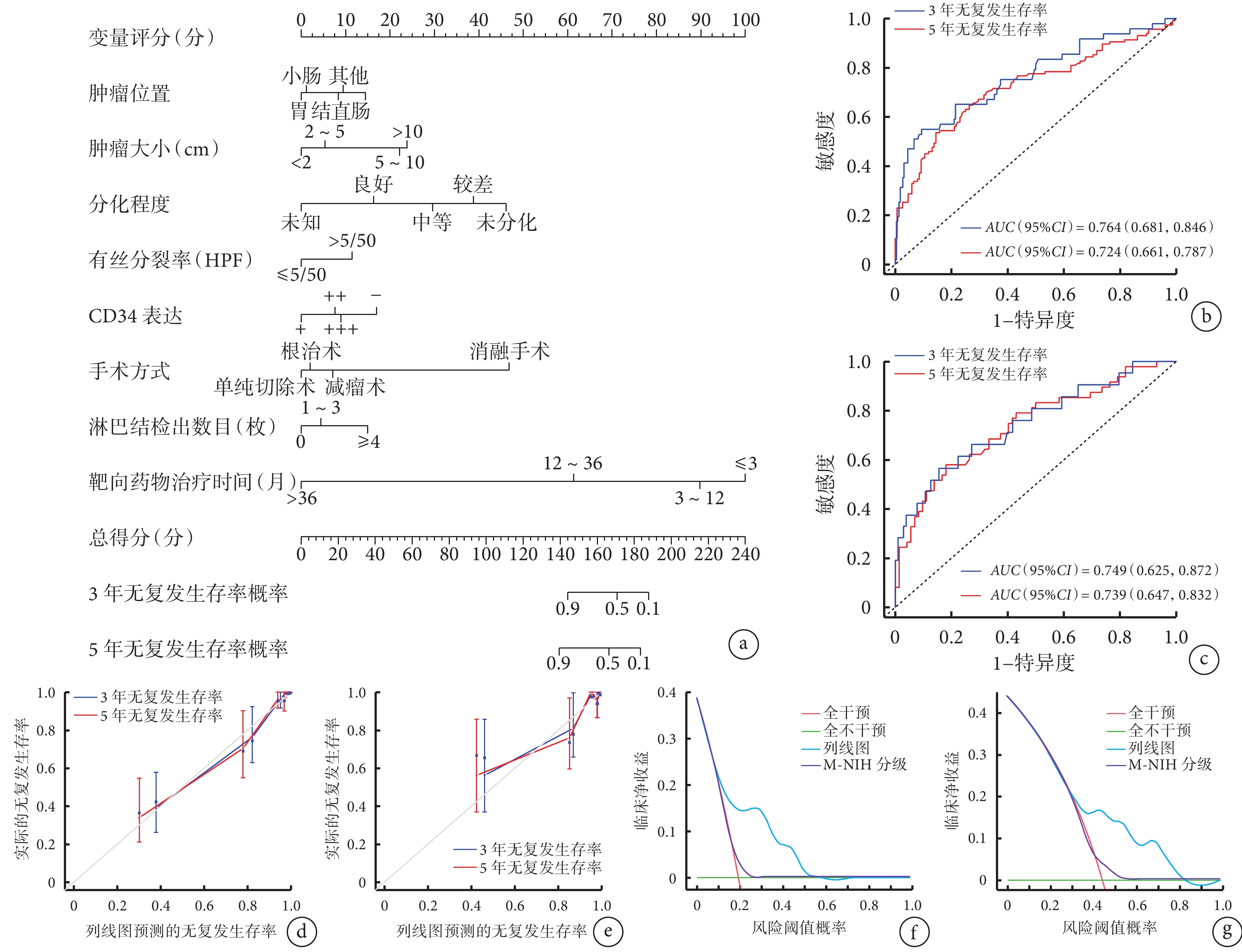 圖1
示預測GIST患者術后RFS的列線圖模型及驗證結果
圖1
示預測GIST患者術后RFS的列線圖模型及驗證結果
a:列線圖模型;b、c:列線圖區分訓練集(b)和驗證集(c)術后無復發生存的ROC曲線;d、e:列線圖預測訓練集(d)和驗證集(e)3年和5年無復發生存率與實際情況比較的校準曲線;f、g:列線圖和M-NIH分級標準用于判斷3年(f)、5年(g)無復發生存率的臨床實用價值
在訓練集和驗證集中GIST患者術后無復發生存率列線圖預測模型的一致性指數(95%CI)分別為0.731(0.679,0.783)及0.685(0.647,0.722);ROC曲線顯示,GIST術后患者3、5年無復發生存率的AUC值(95%CI)在訓練集中分別為 0.764(0.681,0.846)和 0.724(0.661,0.787)、在驗證集中分別為 0.749(0.625,0.872)和 0.739(0.647,0.832),見圖1b、1c。
通過Bootstrap抽樣1 000次對模型進行驗證并繪制校準曲線,從曲線圖上看,在訓練集中列線圖的預測點大致均勻分布在校準線的兩側,偏離不是特別大,一致性尚可(圖1d),而在驗證集中偏離較大,一致性稍差(圖1e)。
在訓練集中,采用DCA評估列線圖預測模型的臨床效用,結果顯示閾值概率范圍為0.19~0.57時列線圖預測GIST術后3年無復發生存率具有較高的凈收益(圖1f),閾值概率范圍為0.44~0.83時模型預測GIST術后5年無復發生存率具有較高的凈收益(圖1g),且在相應的閾值概率范圍內列線圖均比M-NIH分級系統的凈收益高。
3 討論
原發性GIST的標準治療是進行完整手術切除并確保切緣陰性(R0),然而即使接受手術治療后仍有約50%的患者在術后5年內出現腫瘤復發[14]。雖然伊馬替尼等TKIs的使用對于GIST患者的臨床結局有了改善[15],但約14%的GIST患者在最初即對TKIs具有抗藥性,高達50%的患者在接受TKIs治療2年后出現耐藥[16],從而促進術后腫瘤復發。因此,鑒定和精準評估GIST患者預后相關危險因素對術后復發的影響至關重要。
本研究的結果顯示,GIST患者腫瘤位于其他部位(主要包括十二指腸、食管、后腹膜等)、腫瘤大小>5 cm、腫瘤分化程度較差及未分化、有絲分裂率>5/50 HPF、CD34表達陰性與更短的RFS相關(P<0.05),而行單純切除術(相對于消融術)、淋巴結未檢出(相對于檢出淋巴結≥4枚)及靶向藥物治療12~36個月的患者具有更長的RFS(P<0.05),與文獻[17-18]報道的結果相似;同樣傳統的美國軍事病理研究所標準及M-NIH風險分層標準均提示,腫瘤直徑<2 cm、有絲分裂率≤5/50 HPF及胃來源的GIST具有較低的危險度。分析其原因,直徑越大的GIST突變負荷越高、手術切除的難度增大及TKIs治療效果受限,其他部位GIST常規檢查難以發現或手術效果有限,而有絲分裂率高提示GIST生長較快且惡性程度高,這些危險因素均顯著影響患者術后RFS[19]。目前有研究[20]表明,腫瘤分化程度對治療后病理轉歸有較大影響,在伊馬替尼治療過程中可能發生去分化,因此形態學和免疫表型會發生改變,表明可能激活了由c-kit非依賴性致癌機制驅動的變化途徑。在本研究中發現,GIST分化程度較差 [RR(95%CI)=10.220(3.195,32.713)]或未分化 [RR(95%CI)=11.740(3.919,35.181)]患者術后復發更早。CD34表達作為預測GIST術后RFS的危險因素較少見,它作為一種高度糖基化的細胞表面抗原,廣泛表達于人類造血干/祖細胞表面[21],它可能與Cajal細胞在不同部位的分化有關[22],而且CD34的表達情況具有明顯的部位傾向性,CD34陽性多見于胃,而腸道GIST中約1/3患者CD34表達陰性[23],位于小腸的GIST預后較差[24]是否與CD34的表達相關有待進一步研究證實。本研究還發現,相對于單純切除術,雖然根治術和減瘤術并未體現出改善患者術后RFS的優勢 [RR(95%CI)=1.432(0.419,4.891);RR(95%CI)=1.126(0.354,3.578)],而采用消融術后可明顯增加術后RFS縮短的概率 [RR(95%CI)=9.765(9.279,1 027.703)],這可能與GIST的異質性和術后較高的腫瘤負荷相關。雖然可手術的GIST在理想情況下都需要R0切除,但即便是R1切除術也不影響生存結果[25],且當顯微鏡下呈現切緣陽性時也不需要再次切除,因此對于絕大多數GIST患者可能不需要采用比較激進的根治術。
有文獻[26]報道,GIST合并消化道出血是影響患者預后的獨立危險因素,消化道出血患者的生存期比無消化道出血患者更差,但在本研究中未發現有無消化道出血對于GIST患者術后RFS有統計學意義,這是否是因為回顧性研究中的樣本偏倚引起還需要進一步驗證。
GIST淋巴結轉移較為罕見,故一般在手術切除后不常規行淋巴結清掃[27],然而在本研究中發現淋巴結檢出數目與GIST術后RFS有關,即檢出數目4枚及以上者術后復發時間縮短的概率增大 [RR(95%CI)=28.800(3.297,251.525)],這與Bamboat等[28]的研究結果基本一致。
盡管TKIs在GIST患者全程化治療中可能產生耐藥性,但有研究[29-30]結果顯示,伊馬替尼輔助治療可有效延長GIST患者術后RFS,對于高度復發風險的GIST,術后伊馬替尼輔助治療3年和2年后的3年無復發生存率分別為86.6%和60.1%,這與本研究中12~36個月的TKIs治療相較于治療時間≤3個月者可延長GIST患者術后RFS概率的結果一致,術后較短時間TKIs治療并可能無法有效抑制c-kit或血小板源性生長因子受體α的突變。值得注意的是,TKIs輔助治療的決策應綜合考慮患者的腫瘤位置、危險分級、腫瘤是否破裂以及術后康復狀況且依賴于準確的基因檢測結果。
除了以上單個風險因素,本研究結合這些風險因素構建了列線圖預測模型,它對GIST患者術后無復發生存的區分度中等,臨床實用性良好。一項基于核分裂象和腫瘤位置構建的風險模型評分評估為低、中和高風險GIST患者的5年無復發生存率分別為76.7%、47.5%和8.4%[31];另一項整合C反應蛋白/白蛋白比率和NIH風險分類構建的預測模型可以提高GIST患者的預后預測性能[32],然而在本研究中未發現PLR、NLR指標與GIST患者術后的FRS有關。在臨床實踐中,常采用DCA來直觀顯示模型在臨床應用中的實用性[33]。本研究中,從DCA可以看出,在訓練集中預測GIST患者術后3年及5年無復發生存率分別在閾值概率0.19~0.57及0.44~0.83范圍內均表現出較高的凈收益,且在這些范圍內優于M-NIH分級系統,提示本模型具有一定的臨床實用性。因此,本研究構建的列線圖預測模型在臨床實踐中可為GIST患者術后復發評估、制定診療和隨訪計劃提供參考,幫助醫師及時識別高復發風險的潛在患者并實施個體化、全程化的診療管理模式。
總之,本研究基于真實世界臨床生存隨訪數據篩選出了影響GIST患者術后RFS的風險因素并以此構建了列線圖預測模型,它在一定程度上可協助臨床醫師預測GIST患者術后的復發及生存情況,以便制定更有效的治療與隨訪方案。本研究在進行多因素分析時發現,AJCC TNM分期Ⅵ期患者相對于Ⅰ期患者是保護因素,這與臨床常識有悖,可能是由于樣本量太小或時間跨度太長在病例選擇方面存在偏倚,原因值得進一步分析;同時也需要關注到本研究的不足:① 該列線圖預測模型未經外部數據驗證,因此模型的魯棒性和普適性有待更真實估計;② 本研究主要結局指標采用電話隨訪獲取,可能存在樣本偏倚、失訪偏差及真正的復發或生存情況誤差,且相關危險因素間的不均衡也可能產生混雜偏倚;③ 部分研究對象僅通過電話隨訪而缺乏具體影像學檢查結果作為術后復發的有力證據,后續可結合影像組學和基因突變譜進一步進行綜合性研究。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:張海寶設計并實施研究及撰寫論文;王朝樣和林浩采集和分析數據;巨家華整合圖表并核對參考文獻;楊熊飛、楊偉林及俞永江指導、審閱和修改文章。
倫理聲明:本研究獲得了蘭州大學第一醫院醫學倫理委員會(批文編號:LDYYLL2023-484)及甘肅省人民醫院醫學倫理委員會(批文編號:2023-698)審批通過。
胃腸間質瘤(gastrointestinal stromal tumor,GIST)是胃腸道最常見的間葉源性腫瘤,由胃腸道Cajal間質細胞分化而來,約占所有肉瘤的18%[1-3]。目前,完整手術切除是原發局限性GIST患者獲得治愈性生存的主要治療方式[4],且隨著伊馬替尼為代表的酪氨酸激酶抑制劑(tyrosine kinase inhibitors,TKIs)的使用,GIST患者的無進展生存和總生存情況均得到顯著改善,因此在臨床實踐中多采取包括手術、介入、化學藥物治療等綜合模式[5-6]。然而即使接受完整手術切除,仍有50%~90%的GIST患者在術后出現復發或轉移[7],而且由于TKIs治療的個體差異性、不可避免的耐藥性、長期服用藥物的不良反應等問題均可使復發風險提高[8-9],嚴重影響患者預后。由于GIST的異質性及缺乏預后相關的有力標志物,評估其復發風險仍具有挑戰性,且現有的美國國立衛生研究院(National Institutes of Health,NIH)分類系統、美國軍事病理研究所標準[2]、美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)分級標準等[10]對于GIST患者術后復發評估的總體精準度有限。因此,鑒定和精準評估GIST患者術后無復發生存期(relapse-free survival,RFS)的相關危險因素及進行危險分類并建立術后RFS預測評估系統具有重要意義。列線圖預測模型通過量化患者病理和臨床特征并將相關變量整合在一起以預測腫瘤患者術后的預后情況,是預測腫瘤患者疾病風險和預后常見的統計學模型[11]。本研究通過分析影響GIST患者術后RFS的危險因素,并以此構建預測模型并預測GIST患者術后RFS情況,以期在預防GIST患者術后復發和降低術后復發風險方面為臨床醫師提供參考。
1 資料與方法
1.1 研究對象
回顧性收集2011年1月至2020年12月期間蘭州大學第一醫院和甘肅省人民醫院收治的原發性GIST患者的臨床病理資料。患者納入標準:① 術前實驗室檢查、術中和術后資料及隨訪資料完整者;② 術后病理檢查結果證實為GIST;③ 術前未行TKIs治療。排除標準:① 年齡<10歲或>80歲;② 合并其他類型腫瘤。本研究獲得了蘭州大學第一醫院醫學倫理委員會(批文編號:LDYYLL2023-484)及甘肅省人民醫院醫學倫理委員會(批文編號:2023-698)的審批且均免除了患者知情同意。
1.2 研究變量選擇和隨訪方法
選擇以下可能的影響因素(表1)進行研究:年齡、性別、體質量指數(body mass index,BMI)和血型;術前是否存在消化道出血及圍術期有無輸血;術前纖維蛋白原(fibrinogen,Fib)、血小板/淋巴細胞比率(platelet to lymphocyte ratio,PLR)、中細粒細胞/淋巴細胞比率(neutrophil to lymphocyte ratio,NLR)及Onodera預后營養指數[12](Onodera prognostic nutritional index,OPNI),OPNI的計算公式為“OPNI=血清白蛋白(g/L)+5×外周血淋巴細胞計數(×109/L)”;手術方式及淋巴結檢出數目;腫瘤位置、腫瘤大小(指腫瘤最大直徑)、是否轉移、分化程度及AJCC TNM分期[13];組織學類型、有絲分裂率、Ki-67指數、CD34表達及危險度分級[14];靶向藥物治療時間。其中PLR、NLR和OPNI最佳截斷值采用X-tile軟件進行確定。所有患者均通過病案系統及電話進行隨訪,隨訪內容主要為患者生存及復發狀況、接受TKIs輔助治療時間情況等。研究的主要結局為GIST患者術后RFS,其定義為:自GIST患者初次手術到首次復發或任何原因死亡的持續時間。
1.3 統計學方法
采用IBM SPSS R27.0、Rstudio 4.3.0和X-tile軟件進行統計學分析。符合正態分布的計量資料采用均數±標準差(x±s)描述且組間比較均采用獨立樣本比較的t檢驗,偏態分布的計量資料采用中位數(median,M)和四分位間距(interquartile range,IQR)描述且采用Mann-Whitney U檢驗;計數資料采用頻數描述且組間比較采用連續校正χ2檢驗或Pearson χ2檢驗。檢驗水準 α=0.05。
本研究納入的GIST患者按7∶3比例隨機分為訓練集和驗證集。采用單因素和多因素Cox回歸分析影響GIST患者術后RFS的風險因素,將單因素分析有統計學意義(P<0.05)的因素或結合臨床有意義的因素納入進行多因素Cox回歸分析。采用R軟件中boot、caret、ggplot2、pROC、rms、rmda等程序包繪制列線圖模型,采用受試者操作特征(receiver operating characteristic,ROC)曲線下面積(area under ROC curve,AUC)、一致性指數及校準曲線評價模型的預測效能,模型的臨床效用分析采用決策曲線分析(decision curve analysis,DCA)。
2 結果
2.1 納入患者的基本情況
本研究最終納入454例患者(表1),其中訓練集317例、驗證集137例,除性別、血型及Ki-67指數(P<0.05)外,訓練集和驗證集患者的其他基線資料比較差異無統計學意義(P>0.05)。
2.2 影響GIST患者術后RFS的單因素及多因素Cox回歸分析結果
單因素分析結果顯示,患者的血型、圍術期輸血、Fib、PLR、手術方式、淋巴結檢出數目、腫瘤位置、腫瘤大小、分化程度、AJCC TNM分期、組織學類型、有絲分裂率、Ki-67指數、CD34表達、危險度分級及靶向藥物治療時間與GIST患者術后RFS有關(P<0.05),見表2;進一步對這些因素進行多因素Cox回歸分析結果顯示,腫瘤位置為其他部位(主要包括食管、十二指腸及后腹膜,相對于胃部)、腫瘤大小>5 cm(相對于≤2 cm)、分化程度為較差或未分化(相對于分化良好)、有絲分裂率≤5/50 HPF(相對于>5/50 HPF)、CD34表達 [(–),相對于表達(+)]、手術方式為消融術(相對于單純切除術)、淋巴結檢出數目≥4枚(相對于0枚)及靶向藥物治療時間≤3個月(相對于12~36個月)是影響GIST患者術后RFS的危險因素(P<0.05),見表3。
2.3 列線圖模型的建立、驗證及臨床應用價值
根據多因素Cox回歸分析篩選出的風險因素(其中由于AJCC TNM分期包括腫瘤位置、腫瘤大小及有絲分裂率,故列線圖模型構建中不再納入此變量)構建列線圖模型預測GIST患者術后3年和5年無復發生存率概率,結果見圖1a。
 圖1
示預測GIST患者術后RFS的列線圖模型及驗證結果
圖1
示預測GIST患者術后RFS的列線圖模型及驗證結果
a:列線圖模型;b、c:列線圖區分訓練集(b)和驗證集(c)術后無復發生存的ROC曲線;d、e:列線圖預測訓練集(d)和驗證集(e)3年和5年無復發生存率與實際情況比較的校準曲線;f、g:列線圖和M-NIH分級標準用于判斷3年(f)、5年(g)無復發生存率的臨床實用價值
在訓練集和驗證集中GIST患者術后無復發生存率列線圖預測模型的一致性指數(95%CI)分別為0.731(0.679,0.783)及0.685(0.647,0.722);ROC曲線顯示,GIST術后患者3、5年無復發生存率的AUC值(95%CI)在訓練集中分別為 0.764(0.681,0.846)和 0.724(0.661,0.787)、在驗證集中分別為 0.749(0.625,0.872)和 0.739(0.647,0.832),見圖1b、1c。
通過Bootstrap抽樣1 000次對模型進行驗證并繪制校準曲線,從曲線圖上看,在訓練集中列線圖的預測點大致均勻分布在校準線的兩側,偏離不是特別大,一致性尚可(圖1d),而在驗證集中偏離較大,一致性稍差(圖1e)。
在訓練集中,采用DCA評估列線圖預測模型的臨床效用,結果顯示閾值概率范圍為0.19~0.57時列線圖預測GIST術后3年無復發生存率具有較高的凈收益(圖1f),閾值概率范圍為0.44~0.83時模型預測GIST術后5年無復發生存率具有較高的凈收益(圖1g),且在相應的閾值概率范圍內列線圖均比M-NIH分級系統的凈收益高。
3 討論
原發性GIST的標準治療是進行完整手術切除并確保切緣陰性(R0),然而即使接受手術治療后仍有約50%的患者在術后5年內出現腫瘤復發[14]。雖然伊馬替尼等TKIs的使用對于GIST患者的臨床結局有了改善[15],但約14%的GIST患者在最初即對TKIs具有抗藥性,高達50%的患者在接受TKIs治療2年后出現耐藥[16],從而促進術后腫瘤復發。因此,鑒定和精準評估GIST患者預后相關危險因素對術后復發的影響至關重要。
本研究的結果顯示,GIST患者腫瘤位于其他部位(主要包括十二指腸、食管、后腹膜等)、腫瘤大小>5 cm、腫瘤分化程度較差及未分化、有絲分裂率>5/50 HPF、CD34表達陰性與更短的RFS相關(P<0.05),而行單純切除術(相對于消融術)、淋巴結未檢出(相對于檢出淋巴結≥4枚)及靶向藥物治療12~36個月的患者具有更長的RFS(P<0.05),與文獻[17-18]報道的結果相似;同樣傳統的美國軍事病理研究所標準及M-NIH風險分層標準均提示,腫瘤直徑<2 cm、有絲分裂率≤5/50 HPF及胃來源的GIST具有較低的危險度。分析其原因,直徑越大的GIST突變負荷越高、手術切除的難度增大及TKIs治療效果受限,其他部位GIST常規檢查難以發現或手術效果有限,而有絲分裂率高提示GIST生長較快且惡性程度高,這些危險因素均顯著影響患者術后RFS[19]。目前有研究[20]表明,腫瘤分化程度對治療后病理轉歸有較大影響,在伊馬替尼治療過程中可能發生去分化,因此形態學和免疫表型會發生改變,表明可能激活了由c-kit非依賴性致癌機制驅動的變化途徑。在本研究中發現,GIST分化程度較差 [RR(95%CI)=10.220(3.195,32.713)]或未分化 [RR(95%CI)=11.740(3.919,35.181)]患者術后復發更早。CD34表達作為預測GIST術后RFS的危險因素較少見,它作為一種高度糖基化的細胞表面抗原,廣泛表達于人類造血干/祖細胞表面[21],它可能與Cajal細胞在不同部位的分化有關[22],而且CD34的表達情況具有明顯的部位傾向性,CD34陽性多見于胃,而腸道GIST中約1/3患者CD34表達陰性[23],位于小腸的GIST預后較差[24]是否與CD34的表達相關有待進一步研究證實。本研究還發現,相對于單純切除術,雖然根治術和減瘤術并未體現出改善患者術后RFS的優勢 [RR(95%CI)=1.432(0.419,4.891);RR(95%CI)=1.126(0.354,3.578)],而采用消融術后可明顯增加術后RFS縮短的概率 [RR(95%CI)=9.765(9.279,1 027.703)],這可能與GIST的異質性和術后較高的腫瘤負荷相關。雖然可手術的GIST在理想情況下都需要R0切除,但即便是R1切除術也不影響生存結果[25],且當顯微鏡下呈現切緣陽性時也不需要再次切除,因此對于絕大多數GIST患者可能不需要采用比較激進的根治術。
有文獻[26]報道,GIST合并消化道出血是影響患者預后的獨立危險因素,消化道出血患者的生存期比無消化道出血患者更差,但在本研究中未發現有無消化道出血對于GIST患者術后RFS有統計學意義,這是否是因為回顧性研究中的樣本偏倚引起還需要進一步驗證。
GIST淋巴結轉移較為罕見,故一般在手術切除后不常規行淋巴結清掃[27],然而在本研究中發現淋巴結檢出數目與GIST術后RFS有關,即檢出數目4枚及以上者術后復發時間縮短的概率增大 [RR(95%CI)=28.800(3.297,251.525)],這與Bamboat等[28]的研究結果基本一致。
盡管TKIs在GIST患者全程化治療中可能產生耐藥性,但有研究[29-30]結果顯示,伊馬替尼輔助治療可有效延長GIST患者術后RFS,對于高度復發風險的GIST,術后伊馬替尼輔助治療3年和2年后的3年無復發生存率分別為86.6%和60.1%,這與本研究中12~36個月的TKIs治療相較于治療時間≤3個月者可延長GIST患者術后RFS概率的結果一致,術后較短時間TKIs治療并可能無法有效抑制c-kit或血小板源性生長因子受體α的突變。值得注意的是,TKIs輔助治療的決策應綜合考慮患者的腫瘤位置、危險分級、腫瘤是否破裂以及術后康復狀況且依賴于準確的基因檢測結果。
除了以上單個風險因素,本研究結合這些風險因素構建了列線圖預測模型,它對GIST患者術后無復發生存的區分度中等,臨床實用性良好。一項基于核分裂象和腫瘤位置構建的風險模型評分評估為低、中和高風險GIST患者的5年無復發生存率分別為76.7%、47.5%和8.4%[31];另一項整合C反應蛋白/白蛋白比率和NIH風險分類構建的預測模型可以提高GIST患者的預后預測性能[32],然而在本研究中未發現PLR、NLR指標與GIST患者術后的FRS有關。在臨床實踐中,常采用DCA來直觀顯示模型在臨床應用中的實用性[33]。本研究中,從DCA可以看出,在訓練集中預測GIST患者術后3年及5年無復發生存率分別在閾值概率0.19~0.57及0.44~0.83范圍內均表現出較高的凈收益,且在這些范圍內優于M-NIH分級系統,提示本模型具有一定的臨床實用性。因此,本研究構建的列線圖預測模型在臨床實踐中可為GIST患者術后復發評估、制定診療和隨訪計劃提供參考,幫助醫師及時識別高復發風險的潛在患者并實施個體化、全程化的診療管理模式。
總之,本研究基于真實世界臨床生存隨訪數據篩選出了影響GIST患者術后RFS的風險因素并以此構建了列線圖預測模型,它在一定程度上可協助臨床醫師預測GIST患者術后的復發及生存情況,以便制定更有效的治療與隨訪方案。本研究在進行多因素分析時發現,AJCC TNM分期Ⅵ期患者相對于Ⅰ期患者是保護因素,這與臨床常識有悖,可能是由于樣本量太小或時間跨度太長在病例選擇方面存在偏倚,原因值得進一步分析;同時也需要關注到本研究的不足:① 該列線圖預測模型未經外部數據驗證,因此模型的魯棒性和普適性有待更真實估計;② 本研究主要結局指標采用電話隨訪獲取,可能存在樣本偏倚、失訪偏差及真正的復發或生存情況誤差,且相關危險因素間的不均衡也可能產生混雜偏倚;③ 部分研究對象僅通過電話隨訪而缺乏具體影像學檢查結果作為術后復發的有力證據,后續可結合影像組學和基因突變譜進一步進行綜合性研究。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:張海寶設計并實施研究及撰寫論文;王朝樣和林浩采集和分析數據;巨家華整合圖表并核對參考文獻;楊熊飛、楊偉林及俞永江指導、審閱和修改文章。
倫理聲明:本研究獲得了蘭州大學第一醫院醫學倫理委員會(批文編號:LDYYLL2023-484)及甘肅省人民醫院醫學倫理委員會(批文編號:2023-698)審批通過。