引用本文: 吳詠姿, 劉詩雨, 張瀟穎, 李燕妮, 蔡文浩, 劉婷婷, 夏慶, 黃偉. IL-17A基因敲除對急性胰腺炎模型小鼠嚴重程度的影響. 中國普外基礎與臨床雜志, 2024, 31(2): 161-168. doi: 10.7507/1007-9424.202312019 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
急性胰腺炎(acute pancreatitis,AP)是臨床常見的急腹癥,主要特征為胰腺組織炎癥,約有20%的AP患者進展為重癥急性胰腺炎(severe acute pancreatitis,SAP),可出現感染性胰腺壞死及多器官功能衰竭,病死率高達20%~40%[1-2]。目前AP重癥化的分子機制及關鍵靶點尚不清楚,是制約其臨床療效的重要因素之一。在AP發展過程中,59%的AP患者出現腸道屏障損傷,腸黏膜通透性增加,腸道菌群易位,腸道內容物、細菌、內毒素等經血管、淋巴管等途徑進入循環,放大炎癥反應,繼而導致或加重多器官功能衰竭及全身炎癥反應綜合征,甚至死亡[3-6]。因此,腸道屏障受損可能促進了AP進展,引起不良結局。
白細胞介素-17(interleukin-17,IL-17)是一種促炎因子,包括6個家族成員(IL-17A~IL-17F),由輔助性T細胞(T helper cell,Th)17、γδT細胞及自然殺傷細胞分泌,對先天及適應性免疫反應的調節至關重要[7]。在正常腸上皮組織中,IL-17A通過保持上皮細胞的緊密連接及促進糖基化黏蛋白、抗菌蛋白的產生,參與維持腸道結構完整性及屏障功能,防止腸道細菌入侵[8-9]。但在急性炎癥中,IL-17A能夠上調細胞因子及趨化因子轉錄,引起炎癥級聯反應[10]。在AP中,IL-17A可作用于腺泡細胞、胰腺星狀細胞、免疫細胞以及與其他細胞因子相互作用,引起炎癥級聯反應,加重胰腺壞死,并導致其他相關并發癥[11]。在腸道中,IL-17A促進腸道炎癥反應,破壞腸道黏膜屏障及微循環,導致腸道微生物易位,進一步加重胰腺損傷[12-13]。因此,靶向調控IL-17A及其受體有可能阻斷AP炎癥級聯反應,改善腸道屏障損傷,減輕AP嚴重程度。
現有研究[14]表明,通過調控Th1/Th17分化,減少IL-17A、IL-17F等細胞因子的分泌,可減輕精氨酸誘導的AP小鼠的腸道損傷,并改善AP嚴重程度。此外,抑制IL-17A可減輕SAP相關的肺損傷[15]。因此,IL-17A可能是AP治療的潛在靶點。本研究使用IL-17A基因敲除小鼠進行實驗,構建雨蛙素(cerulein,CER)誘導的輕癥AP動物模型(CER-AP)和牛磺膽酸鈉(sodium taurocholate,NaTC)誘導的重癥AP動物模型(NaTC-AP)[16],探討IL-17A基因敲除對AP胰腺及腸道屏障損傷的影響。
1 材料與方法
1.1 實驗動物及分組
IL-17A全身性基因敲除(generic IL-17A gene knockout,IL-17AKO)小鼠及其同窩野生型(wild-type,WT)小鼠購自Cyagen賽業生物公司(中國成都),SPF級,共33只,為C57BL/6J背景,6~8周齡,20~26 g,雌鼠23只,雄鼠10只。在CER-AP實驗中,小鼠隨機分為3組,每組5只(均為雌鼠),分別為WT對照組、WT模型組和IL-17AKO模型組。WT模型組和IL-17AKO模型組小鼠腹腔注射CER 7次 [50 μg/(kg·h)],WT對照組小鼠腹腔注射生理鹽水7次 [50 μg/(kg·h)]。在NaTC-AP實驗中,小鼠分為4組,其中WT小鼠隨機分為2組,假手術組3只(2只雄鼠,1只雌鼠),模型組6只(3只雄鼠,3只雌鼠);IL-17AKO小鼠隨機分為2組,假手術組3只(2只雄鼠,1只雌鼠),模型組6只(3只雄鼠,3只雌鼠);假手術組小鼠只行開關腹手術,模型組小鼠經逆行胰膽管泵入50 μL的3.5% NaTC生理鹽水溶液建模。
1.2 主要試劑
CER購自英國TOCRIS公司,淀粉酶和脂肪酶檢測試劑盒購自南京建成生物工程研究所,NaTC購自美國Sigma公司,阿利新藍-過碘酸-雪夫染色(alcian blue-periodic acid-schiff’s reagent,AB-PAS)試劑盒購自北京索萊寶科技有限公司,熒光標記的雙花扁豆凝集素染料(dolichos biflorus agglutinin,DBA)購自美國Vector Laboratories公司,直接熒光細菌原位雜交檢測試劑盒購自廣州市外顯子生物技術有限公司。
1.3 方法
1.3.1 AP誘導
CER-AP:小鼠腹腔注射CER(50 μg/kg),每間隔1小時注射1次,連續注射7次,誘導輕度AP,于第1次注射后12 h處死,取小鼠血清檢測淀粉酶、脂肪酶及白細胞介素-6(interleukin-6,IL-6)水平,取胰腺組織進行蘇木精-伊紅(HE)染色。
NaTC-AP:小鼠麻醉、夾閉膽總管后,經十二指腸大乳頭逆行胰膽管泵入50 μL的3.5% NaTC生理鹽水溶液,速度為5 μL/min,誘導重癥AP模型。于造模后24 h處死小鼠,取小鼠血清檢測淀粉酶、脂肪酶及IL-6水平,取胰腺組織進行HE染色,取腸道組織進行AB-PAS染色、DBA染色及熒光細菌原位雜交。
1.3.2 血清淀粉酶檢測
依照試劑盒說明書進行檢測。使用ddH2O將血清樣本稀釋后,向96孔板中加入25 μL淀粉酶底物緩沖液及5 μL稀釋后的血清樣本,37 ℃孵育7.5 min,再加入25 μL 0.01 mol/L碘-碘化鉀溶液和150 μL ddH2O,空白孔不加入樣本。使用酶標儀于660 nm處檢測吸光度,再根據公式計算酶活力。
1.3.3 血清脂肪酶檢測
依照試劑盒說明書進行檢測。向96孔板中加入200 μL脂肪酶底物緩沖液和5 μL待測血清樣本,對照孔加入5 μL生理鹽水,于37 ℃孵育,分別于30 s及10 min檢測420 nm處的吸光度,再根據公式計算酶活力。
1.3.4 胰腺組織HE染色
小鼠胰腺組織使用4%多聚甲醛溶液固定后,進行脫水、滲透及包埋,切成5 μm厚度的石蠟切片。每只小鼠隨機選取1張切片進行染色。石蠟切片置于烘箱中,65 ℃烘烤2 h,使用二甲苯、無水乙醇進行脫蠟,然后用蘇木精、伊紅進行染色,最后室溫晾干,中性樹膠封片。顯微鏡下觀察,按照評分標準,從水腫、炎癥和壞死3個維度進行全片評分,三者之和為病理總分[17]。
1.3.5 腸道AB-PAS染色
石蠟切片脫蠟;滴加阿利新藍染色液染15 min,蒸餾水洗3次;滴加氧化劑氧化5 min,蒸餾水洗2次;滴加Schiff染色液染15 min,蒸餾水洗2次,乙醇脫水封片。顯微鏡下觀察。
1.3.6 腸道DBA染色
石蠟切片脫蠟,滴加DBA,室溫孵育2 h,PBS漂洗3次,封片劑封片。熒光顯微鏡下觀察,對全片進行采圖,使用Image J分析每張圖的DBA平均熒光強度,計算其平均值。
1.3.7 腸道熒光細菌原位雜交
石蠟切片脫蠟,根據說明書處理樣本,滴加封閉液,恒溫箱55 ℃封閉2 h。吸去封閉液,滴加探針,37 ℃雜交24 h。用洗滌緩沖液清洗后,乙醇脫水,室溫干燥,最后滴加4′ , 6-二脒基-2-苯基吲哚染料(4′ , 6-diamidino-2-phenylindole,DAPI),蓋上蓋玻片,暗處靜置15 min。熒光顯微鏡下觀察。
1.4 統計學方法
使用GraphPad Prism 8.0.1軟件進行統計分析及作圖。計量資料以均數±標準差( ±s)表示,符合正態分布且方差齊的組間比較采用方差分析(多組間)和獨立樣本比較的t檢驗(2組間),不符合正態分布或方差不齊則采用非參數檢驗。檢驗水準α=0.05。
±s)表示,符合正態分布且方差齊的組間比較采用方差分析(多組間)和獨立樣本比較的t檢驗(2組間),不符合正態分布或方差不齊則采用非參數檢驗。檢驗水準α=0.05。
2 結果
在CER-AP實驗中,造模小鼠在造模后12 h內未發生死亡,15只小鼠均順利取材。在NaTC-AP實驗中,18只小鼠在手術后24 h內未發生死亡及術后并發癥,均順利取材。
2.1 IL-17A基因敲除對CER-AP小鼠血清淀粉酶、脂肪酶及IL-6水平的影響
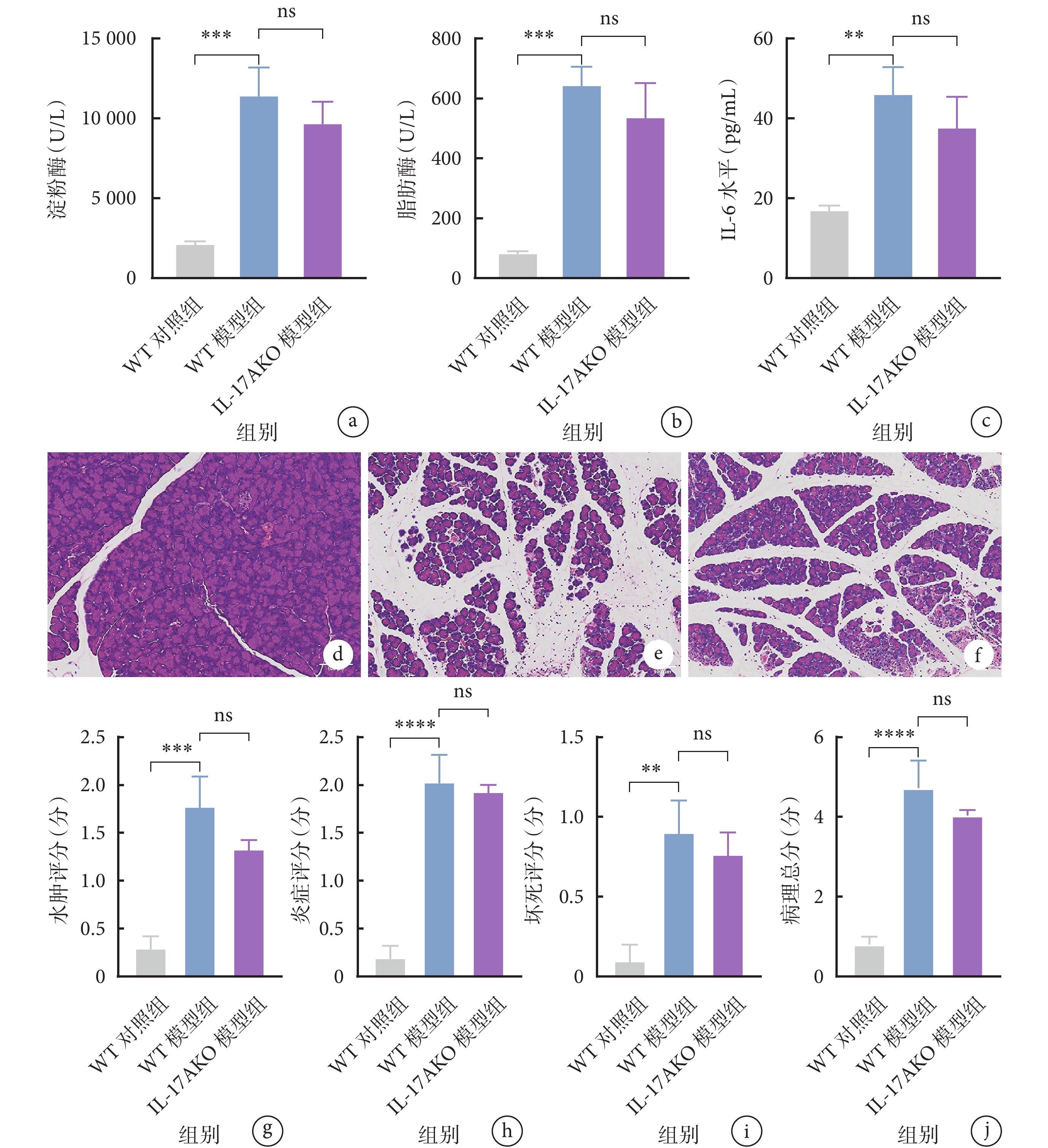
與WT對照組小鼠相比,WT模型組小鼠的血清淀粉酶、脂肪酶及IL-6水平均升高(P<0.05),表明模型構建成功。然而,與WT模型組小鼠相比,IL-17AKO模型組小鼠的血清淀粉酶、脂肪酶和IL-6水平的差異均無統計學意義(P>0.05)。見圖1a~1c。
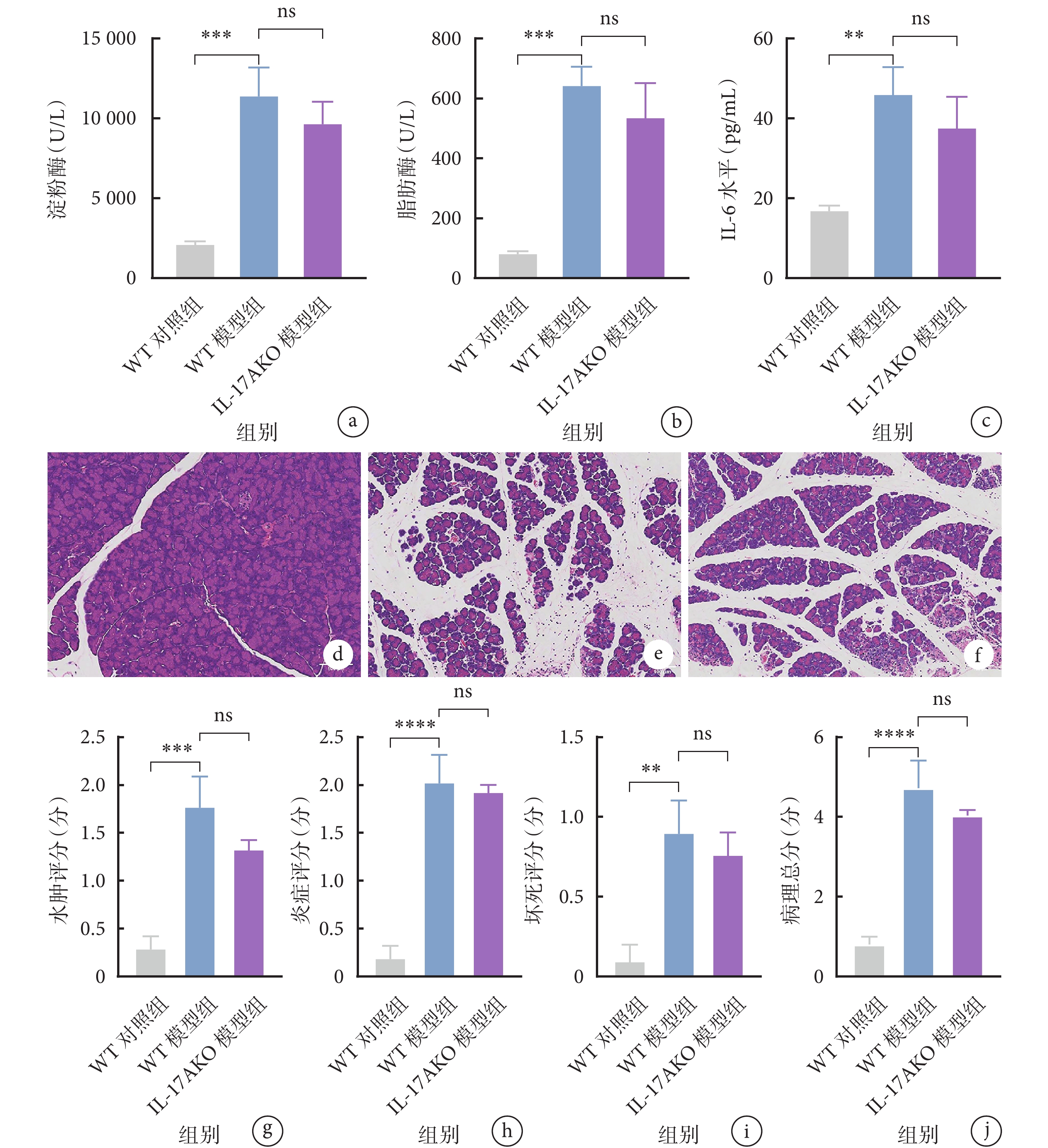 圖1
示CER-AP模型小鼠的血清學指標和胰腺組織病理結果
圖1
示CER-AP模型小鼠的血清學指標和胰腺組織病理結果
a~c:WT對照組、WT模型組和IL-17AKO模型組的淀粉酶(a)、脂肪酶(b)和IL-6(c)水平比較;d~f:WT對照組(d)、WT模型組(e)和IL-17AKO模型組(f)小鼠胰腺組織的病理圖片(HE ×100);g~j:3組小鼠胰腺組織的水腫評分(g)、炎癥評分(h)、壞死評分(i)及病理總分(j)結果;**
2.2 IL-17A基因敲除對CER-AP小鼠胰腺組織病理的影響
胰腺組織的HE染色結果顯示,與WT對照組小鼠相比,WT模型組小鼠的胰腺出現彌漫的葉間隙增寬,伴有腺泡細胞破壞,大量免疫細胞浸潤以及胰腺實質局灶性壞死(圖1d~1e),表明造模后胰腺組織存在病理損傷。與WT模型組小鼠比較,IL-17A基因敲除不能減輕CER-AP小鼠的胰腺組織損傷(圖1f)。同樣,從水腫、炎癥、壞死3個方面對胰腺病理損傷進行評分,結果顯示與WT模型組比較,IL-17AKO模型組小鼠的胰腺水腫、炎癥、壞死評分,以及病理總分的差異均無統計學意義(P>0.05),見圖1g~1j。
2.3 IL-17A基因敲除對NaTC-AP小鼠血清淀粉酶、脂肪酶及IL-6水平的影響
與假手術組WT小鼠比較,模型組WT小鼠的血清淀粉酶、脂肪酶和IL-6水平升高,表明NaTC-AP模型構建成功;與假手術組WT小鼠比較,假手術組IL-17AKO小鼠的血清淀粉酶和脂肪酶有降低趨勢,但IL-6水平升高。與模型組WT小鼠比較,模型組IL-17AKO小鼠的血清淀粉酶和脂肪酶水平的差異無統計學差異(P>0.05),但IL-6水平升高(P<0.05)。見表1。
2.4 IL-17A基因敲除對NaTC-AP小鼠胰腺組織病理的影響
胰腺組織的HE染色結果顯示,假手術組WT小鼠與假手術組IL-17AKO小鼠的胰腺組織無明顯差異;與假手術組WT小鼠相比,模型組WT小鼠的胰腺組織出現胰腺小葉間隙增寬、大量免疫細胞浸潤以及胰腺組織大面積壞死,表明造模后胰腺組織損傷嚴重(圖2)。與模型組WT小鼠相比,模型組IL-17AKO小鼠的胰腺組織差異不大,提示IL-17A基因敲除并不能減輕NaTC-AP小鼠的胰腺組織損傷(圖2)。
 圖2
示NaTC-AP模型小鼠胰腺組織的病理結果(HE ×100)
圖2
示NaTC-AP模型小鼠胰腺組織的病理結果(HE ×100)
從水腫、炎癥和壞死3個方面對胰腺病理損傷進行評分,結果顯示:與假手術組WT小鼠比較,假手術組IL-17AKO小鼠的水腫、炎癥和壞死評分,以及病理總分無明顯變化;與假手術組WT小鼠比較,模型組WT小鼠的水腫、炎癥和壞死評分,以及病理總分均較高。與模型組WT小鼠比較,模型組IL-17AKO小鼠的水腫、炎癥和壞死評分,以及病理總分無明顯變化(P>0.05)。見表1。
2.5 IL-17A基因敲除對NaTC-AP小鼠腸道屏障的影響
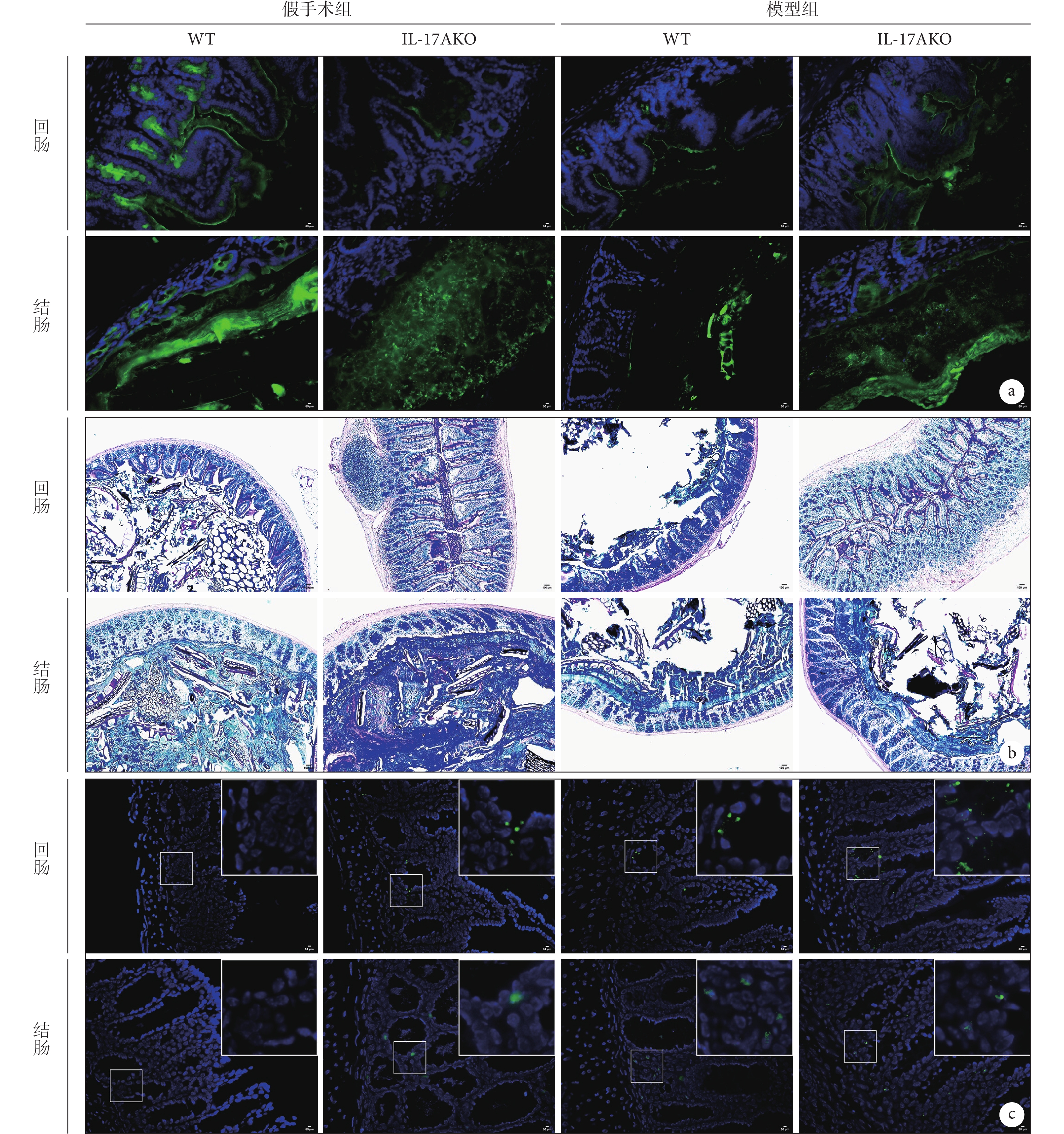
通過對回腸、結腸進行DBA染色、AB-PAS染色及細菌熒光原位雜交,結果發現:與假手術組WT小鼠相比,假手術組IL-17AKO小鼠回腸、結腸組織中糖基化黏蛋白表達降低、黏液層結構紊亂及細菌侵襲增加,表明IL-17AKO小鼠存在腸道屏障損傷(圖3、表1)。與假手術組WT小鼠相比,模型組WT小鼠回腸、結腸組織中糖基化黏蛋白表達降低、黏液層結構紊亂以及細菌侵襲增加,表明SAP小鼠存在腸道屏障損傷(圖3、表1)。與模型組WT小鼠相比,模型組IL-17AKO小鼠結腸、回腸組織中糖基化黏蛋白、黏液層結構以及細菌侵襲情況均無顯著差異(圖3、表1)。
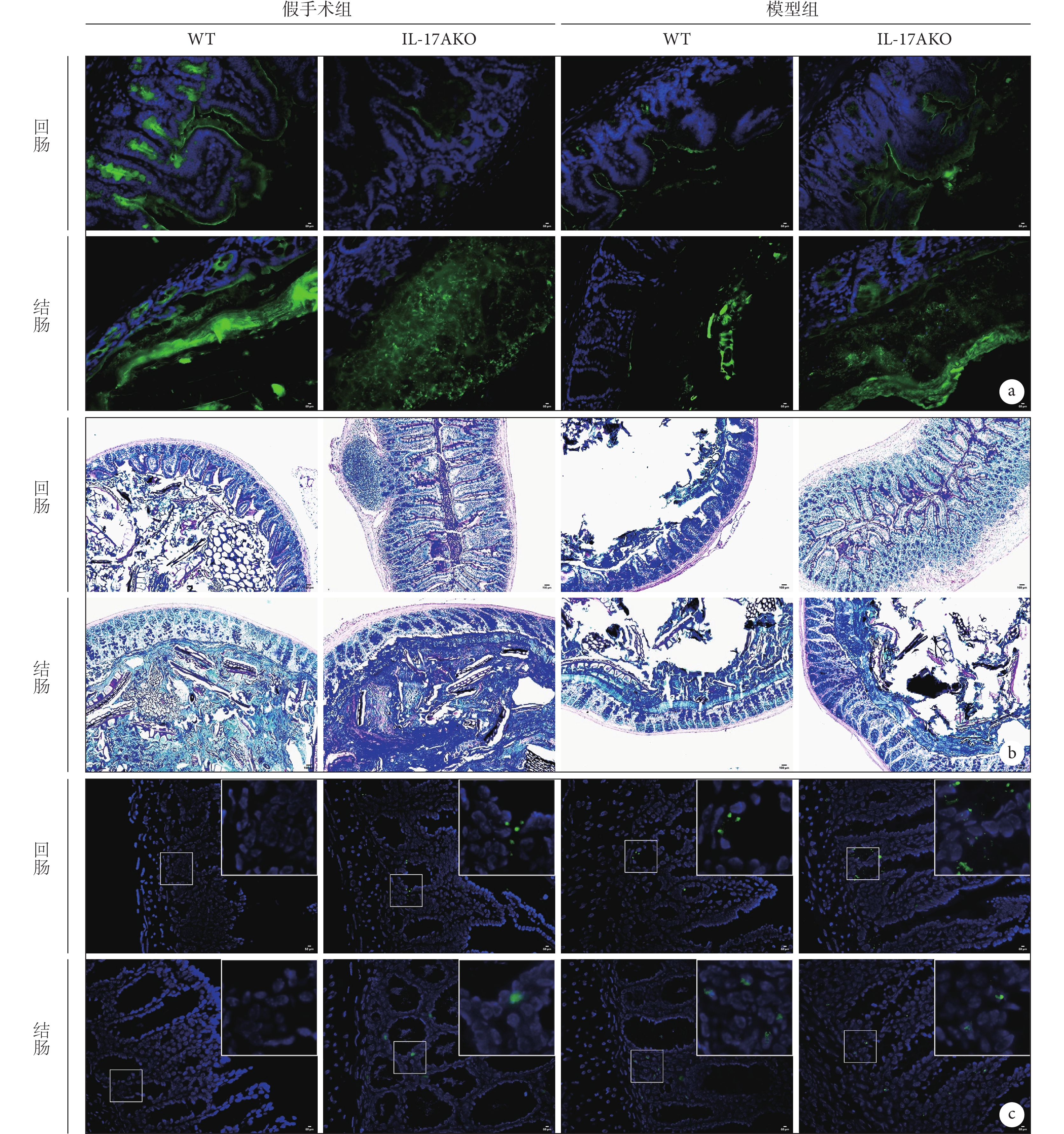 圖3
示NaTC-AP模型小鼠的回腸及結腸染色和熒光細菌原位雜交結果
圖3
示NaTC-AP模型小鼠的回腸及結腸染色和熒光細菌原位雜交結果
a:DBA染色( ×200);b:AB-PAS染色( ×100);c:熒光細菌原位雜交( ×200)
3 討論
AP是常見的急腹癥,臨床表現為急性持續上腹部疼痛,伴腹脹、惡心、嘔吐等癥狀,其發病率逐年攀升,給社會造成較大的經濟負擔[18]。腸道是AP發展過程中受損的遠端器官之一,腸道屏障受損后,釋放大量細胞因子及炎癥介質,對其他器官造成二次打擊[19]。臨床研究[20]表明,出現結腸并發癥的SAP患者,其器官功能衰竭的發生率可升高2倍,且手術次數增加、住院時間延長,預后較差。本研究使用CER-AP模型[16]探究了IL-17AKO對輕癥AP胰腺損傷的影響,也進一步使用NaTC-AP模型[16]探究了IL-A7AKO對SAP胰腺及腸道損傷的影響。結果顯示,SAP可累及腸道,出現腸道損傷,細菌侵襲增加,與臨床表現一致。因此,在臨床治療中,需重視改善AP期間的腸道功能。
腸道屏障由物理屏障、化學屏障、免疫屏障及微生物屏障組成,能夠有效防止外源細菌及腸道共生菌入侵[21]。腸道黏液層是腸道防御的第一道防線。糖基化黏蛋白由杯狀細胞分泌,覆蓋在腸上皮細胞表面,發揮物理隔離作用,能夠有效防止外源細菌、腸道共生菌、內毒素等透過腸黏膜進入血液[22]。此外,腸上皮細胞緊密連接也參與維持腸上皮細胞結構完整性和生物學功能,防止腸腔內的細菌、抗原等物質進入腸固有層,同時促進營養物質的轉運[23]。在SAP中,腸道屏障出現嚴重的損傷,腸上皮細胞緊密連接蛋白表達降低,腸上皮細胞結構破壞,杯狀細胞功能障礙、黏液減少,腸道菌群紊亂,細菌移位發生[24]。在本研究中,WT-NaTC模型小鼠腸道黏液層結構紊亂,糖基化黏蛋白表達降低,腸道屏障明顯被破壞,進一步導致細菌侵襲增加。在生理情況下,IL-17可促進糖基化黏蛋白的產生,對維持腸道黏膜屏障功能有重要作用[9, 25-26]。本研究使用IL-17AKO小鼠進行研究,發現IL-17AKO小鼠在造模前腸道屏障已經出現損傷,細菌侵襲增加,且出現全身炎癥反應,說明IL-17A缺乏可導致腸道屏障受損,引起炎癥反應。但在疾病狀態下,IL-17分泌增加,可作用于腸上皮細胞和調控Th細胞導致腸壁水腫,破壞腸黏膜屏障[27]。除此之外,IL-17可通過調節緊密連接蛋白的表達,改變腸道通透性[28]。因此,IL-17可能具有雙重調節作用,即在生理情況下可起保護作用,但在病理情況可加重病情進展。
IL-17主要通過核因子κB激活劑1誘導K63連接的泛素化酶啟動信號轉導,從而激活絲裂原活化蛋白激酶、CCAAT增強子結合蛋白β和核因子κB通路,觸發下游基因的轉錄激活,增加促炎細胞因子、趨化因子、抗菌肽等合成發揮促炎功能[29]。在AP中,血清IL-17水平與AP嚴重程度相關,是SAP并發癥的獨立危險因素[30-31]。IL-17信號過度激活促進了炎癥反應,加重AP嚴重程度[32]。以往研究[11]表明,IL-17是AP重癥化的潛在靶點,抑制IL-17信號通路或調控Th細胞分泌IL-17可以減輕AP嚴重程度。但本研究通過使用IL-17AKO小鼠進行研究,發現與模型組WT小鼠相比,IL-17AKO對NaTC-AP模型小鼠的腸道損傷無保護作用,也不能降低CER-AP和NaTC-AP小鼠的血清淀粉酶、脂肪酶及IL-6水平,對胰腺病理水腫、炎癥及壞死均無改善作用。究其原因,可能是由于缺乏IL-17A,影響了IL-17A相關通路的病理生理功能,造成IL-17AKO小鼠細胞因子水平異常升高、腸道屏障受損,回腸、結腸組織中糖基化黏蛋白顯著減少,黏液層結構紊亂,細菌侵襲增加,從而無法對AP產生保護作用。因此,在IL-17抑制劑用于AP臨床試驗前,應進一步研究免疫細胞、腸道屏障功能和腸道微生物組分之間的相互作用。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:吳詠姿、劉詩雨、張瀟穎和李燕妮完成實驗操作及數據分析,吳詠姿完成論文撰寫,蔡文浩和劉婷婷進行實驗設計,夏慶和黃偉指導文章寫作,黃偉提供經費支持。
倫理聲明:本研究已通過四川大學華西臨床醫學院/華西醫院實驗動物倫理委員會的審核批準(批文編號:20231205002)。
急性胰腺炎(acute pancreatitis,AP)是臨床常見的急腹癥,主要特征為胰腺組織炎癥,約有20%的AP患者進展為重癥急性胰腺炎(severe acute pancreatitis,SAP),可出現感染性胰腺壞死及多器官功能衰竭,病死率高達20%~40%[1-2]。目前AP重癥化的分子機制及關鍵靶點尚不清楚,是制約其臨床療效的重要因素之一。在AP發展過程中,59%的AP患者出現腸道屏障損傷,腸黏膜通透性增加,腸道菌群易位,腸道內容物、細菌、內毒素等經血管、淋巴管等途徑進入循環,放大炎癥反應,繼而導致或加重多器官功能衰竭及全身炎癥反應綜合征,甚至死亡[3-6]。因此,腸道屏障受損可能促進了AP進展,引起不良結局。
白細胞介素-17(interleukin-17,IL-17)是一種促炎因子,包括6個家族成員(IL-17A~IL-17F),由輔助性T細胞(T helper cell,Th)17、γδT細胞及自然殺傷細胞分泌,對先天及適應性免疫反應的調節至關重要[7]。在正常腸上皮組織中,IL-17A通過保持上皮細胞的緊密連接及促進糖基化黏蛋白、抗菌蛋白的產生,參與維持腸道結構完整性及屏障功能,防止腸道細菌入侵[8-9]。但在急性炎癥中,IL-17A能夠上調細胞因子及趨化因子轉錄,引起炎癥級聯反應[10]。在AP中,IL-17A可作用于腺泡細胞、胰腺星狀細胞、免疫細胞以及與其他細胞因子相互作用,引起炎癥級聯反應,加重胰腺壞死,并導致其他相關并發癥[11]。在腸道中,IL-17A促進腸道炎癥反應,破壞腸道黏膜屏障及微循環,導致腸道微生物易位,進一步加重胰腺損傷[12-13]。因此,靶向調控IL-17A及其受體有可能阻斷AP炎癥級聯反應,改善腸道屏障損傷,減輕AP嚴重程度。
現有研究[14]表明,通過調控Th1/Th17分化,減少IL-17A、IL-17F等細胞因子的分泌,可減輕精氨酸誘導的AP小鼠的腸道損傷,并改善AP嚴重程度。此外,抑制IL-17A可減輕SAP相關的肺損傷[15]。因此,IL-17A可能是AP治療的潛在靶點。本研究使用IL-17A基因敲除小鼠進行實驗,構建雨蛙素(cerulein,CER)誘導的輕癥AP動物模型(CER-AP)和牛磺膽酸鈉(sodium taurocholate,NaTC)誘導的重癥AP動物模型(NaTC-AP)[16],探討IL-17A基因敲除對AP胰腺及腸道屏障損傷的影響。
1 材料與方法
1.1 實驗動物及分組
IL-17A全身性基因敲除(generic IL-17A gene knockout,IL-17AKO)小鼠及其同窩野生型(wild-type,WT)小鼠購自Cyagen賽業生物公司(中國成都),SPF級,共33只,為C57BL/6J背景,6~8周齡,20~26 g,雌鼠23只,雄鼠10只。在CER-AP實驗中,小鼠隨機分為3組,每組5只(均為雌鼠),分別為WT對照組、WT模型組和IL-17AKO模型組。WT模型組和IL-17AKO模型組小鼠腹腔注射CER 7次 [50 μg/(kg·h)],WT對照組小鼠腹腔注射生理鹽水7次 [50 μg/(kg·h)]。在NaTC-AP實驗中,小鼠分為4組,其中WT小鼠隨機分為2組,假手術組3只(2只雄鼠,1只雌鼠),模型組6只(3只雄鼠,3只雌鼠);IL-17AKO小鼠隨機分為2組,假手術組3只(2只雄鼠,1只雌鼠),模型組6只(3只雄鼠,3只雌鼠);假手術組小鼠只行開關腹手術,模型組小鼠經逆行胰膽管泵入50 μL的3.5% NaTC生理鹽水溶液建模。
1.2 主要試劑
CER購自英國TOCRIS公司,淀粉酶和脂肪酶檢測試劑盒購自南京建成生物工程研究所,NaTC購自美國Sigma公司,阿利新藍-過碘酸-雪夫染色(alcian blue-periodic acid-schiff’s reagent,AB-PAS)試劑盒購自北京索萊寶科技有限公司,熒光標記的雙花扁豆凝集素染料(dolichos biflorus agglutinin,DBA)購自美國Vector Laboratories公司,直接熒光細菌原位雜交檢測試劑盒購自廣州市外顯子生物技術有限公司。
1.3 方法
1.3.1 AP誘導
CER-AP:小鼠腹腔注射CER(50 μg/kg),每間隔1小時注射1次,連續注射7次,誘導輕度AP,于第1次注射后12 h處死,取小鼠血清檢測淀粉酶、脂肪酶及白細胞介素-6(interleukin-6,IL-6)水平,取胰腺組織進行蘇木精-伊紅(HE)染色。
NaTC-AP:小鼠麻醉、夾閉膽總管后,經十二指腸大乳頭逆行胰膽管泵入50 μL的3.5% NaTC生理鹽水溶液,速度為5 μL/min,誘導重癥AP模型。于造模后24 h處死小鼠,取小鼠血清檢測淀粉酶、脂肪酶及IL-6水平,取胰腺組織進行HE染色,取腸道組織進行AB-PAS染色、DBA染色及熒光細菌原位雜交。
1.3.2 血清淀粉酶檢測
依照試劑盒說明書進行檢測。使用ddH2O將血清樣本稀釋后,向96孔板中加入25 μL淀粉酶底物緩沖液及5 μL稀釋后的血清樣本,37 ℃孵育7.5 min,再加入25 μL 0.01 mol/L碘-碘化鉀溶液和150 μL ddH2O,空白孔不加入樣本。使用酶標儀于660 nm處檢測吸光度,再根據公式計算酶活力。
1.3.3 血清脂肪酶檢測
依照試劑盒說明書進行檢測。向96孔板中加入200 μL脂肪酶底物緩沖液和5 μL待測血清樣本,對照孔加入5 μL生理鹽水,于37 ℃孵育,分別于30 s及10 min檢測420 nm處的吸光度,再根據公式計算酶活力。
1.3.4 胰腺組織HE染色
小鼠胰腺組織使用4%多聚甲醛溶液固定后,進行脫水、滲透及包埋,切成5 μm厚度的石蠟切片。每只小鼠隨機選取1張切片進行染色。石蠟切片置于烘箱中,65 ℃烘烤2 h,使用二甲苯、無水乙醇進行脫蠟,然后用蘇木精、伊紅進行染色,最后室溫晾干,中性樹膠封片。顯微鏡下觀察,按照評分標準,從水腫、炎癥和壞死3個維度進行全片評分,三者之和為病理總分[17]。
1.3.5 腸道AB-PAS染色
石蠟切片脫蠟;滴加阿利新藍染色液染15 min,蒸餾水洗3次;滴加氧化劑氧化5 min,蒸餾水洗2次;滴加Schiff染色液染15 min,蒸餾水洗2次,乙醇脫水封片。顯微鏡下觀察。
1.3.6 腸道DBA染色
石蠟切片脫蠟,滴加DBA,室溫孵育2 h,PBS漂洗3次,封片劑封片。熒光顯微鏡下觀察,對全片進行采圖,使用Image J分析每張圖的DBA平均熒光強度,計算其平均值。
1.3.7 腸道熒光細菌原位雜交
石蠟切片脫蠟,根據說明書處理樣本,滴加封閉液,恒溫箱55 ℃封閉2 h。吸去封閉液,滴加探針,37 ℃雜交24 h。用洗滌緩沖液清洗后,乙醇脫水,室溫干燥,最后滴加4′ , 6-二脒基-2-苯基吲哚染料(4′ , 6-diamidino-2-phenylindole,DAPI),蓋上蓋玻片,暗處靜置15 min。熒光顯微鏡下觀察。
1.4 統計學方法
使用GraphPad Prism 8.0.1軟件進行統計分析及作圖。計量資料以均數±標準差( ±s)表示,符合正態分布且方差齊的組間比較采用方差分析(多組間)和獨立樣本比較的t檢驗(2組間),不符合正態分布或方差不齊則采用非參數檢驗。檢驗水準α=0.05。
±s)表示,符合正態分布且方差齊的組間比較采用方差分析(多組間)和獨立樣本比較的t檢驗(2組間),不符合正態分布或方差不齊則采用非參數檢驗。檢驗水準α=0.05。
2 結果
在CER-AP實驗中,造模小鼠在造模后12 h內未發生死亡,15只小鼠均順利取材。在NaTC-AP實驗中,18只小鼠在手術后24 h內未發生死亡及術后并發癥,均順利取材。
2.1 IL-17A基因敲除對CER-AP小鼠血清淀粉酶、脂肪酶及IL-6水平的影響
與WT對照組小鼠相比,WT模型組小鼠的血清淀粉酶、脂肪酶及IL-6水平均升高(P<0.05),表明模型構建成功。然而,與WT模型組小鼠相比,IL-17AKO模型組小鼠的血清淀粉酶、脂肪酶和IL-6水平的差異均無統計學意義(P>0.05)。見圖1a~1c。
 圖1
示CER-AP模型小鼠的血清學指標和胰腺組織病理結果
圖1
示CER-AP模型小鼠的血清學指標和胰腺組織病理結果
a~c:WT對照組、WT模型組和IL-17AKO模型組的淀粉酶(a)、脂肪酶(b)和IL-6(c)水平比較;d~f:WT對照組(d)、WT模型組(e)和IL-17AKO模型組(f)小鼠胰腺組織的病理圖片(HE ×100);g~j:3組小鼠胰腺組織的水腫評分(g)、炎癥評分(h)、壞死評分(i)及病理總分(j)結果;**
2.2 IL-17A基因敲除對CER-AP小鼠胰腺組織病理的影響
胰腺組織的HE染色結果顯示,與WT對照組小鼠相比,WT模型組小鼠的胰腺出現彌漫的葉間隙增寬,伴有腺泡細胞破壞,大量免疫細胞浸潤以及胰腺實質局灶性壞死(圖1d~1e),表明造模后胰腺組織存在病理損傷。與WT模型組小鼠比較,IL-17A基因敲除不能減輕CER-AP小鼠的胰腺組織損傷(圖1f)。同樣,從水腫、炎癥、壞死3個方面對胰腺病理損傷進行評分,結果顯示與WT模型組比較,IL-17AKO模型組小鼠的胰腺水腫、炎癥、壞死評分,以及病理總分的差異均無統計學意義(P>0.05),見圖1g~1j。
2.3 IL-17A基因敲除對NaTC-AP小鼠血清淀粉酶、脂肪酶及IL-6水平的影響
與假手術組WT小鼠比較,模型組WT小鼠的血清淀粉酶、脂肪酶和IL-6水平升高,表明NaTC-AP模型構建成功;與假手術組WT小鼠比較,假手術組IL-17AKO小鼠的血清淀粉酶和脂肪酶有降低趨勢,但IL-6水平升高。與模型組WT小鼠比較,模型組IL-17AKO小鼠的血清淀粉酶和脂肪酶水平的差異無統計學差異(P>0.05),但IL-6水平升高(P<0.05)。見表1。
2.4 IL-17A基因敲除對NaTC-AP小鼠胰腺組織病理的影響
胰腺組織的HE染色結果顯示,假手術組WT小鼠與假手術組IL-17AKO小鼠的胰腺組織無明顯差異;與假手術組WT小鼠相比,模型組WT小鼠的胰腺組織出現胰腺小葉間隙增寬、大量免疫細胞浸潤以及胰腺組織大面積壞死,表明造模后胰腺組織損傷嚴重(圖2)。與模型組WT小鼠相比,模型組IL-17AKO小鼠的胰腺組織差異不大,提示IL-17A基因敲除并不能減輕NaTC-AP小鼠的胰腺組織損傷(圖2)。
 圖2
示NaTC-AP模型小鼠胰腺組織的病理結果(HE ×100)
圖2
示NaTC-AP模型小鼠胰腺組織的病理結果(HE ×100)
從水腫、炎癥和壞死3個方面對胰腺病理損傷進行評分,結果顯示:與假手術組WT小鼠比較,假手術組IL-17AKO小鼠的水腫、炎癥和壞死評分,以及病理總分無明顯變化;與假手術組WT小鼠比較,模型組WT小鼠的水腫、炎癥和壞死評分,以及病理總分均較高。與模型組WT小鼠比較,模型組IL-17AKO小鼠的水腫、炎癥和壞死評分,以及病理總分無明顯變化(P>0.05)。見表1。
2.5 IL-17A基因敲除對NaTC-AP小鼠腸道屏障的影響
通過對回腸、結腸進行DBA染色、AB-PAS染色及細菌熒光原位雜交,結果發現:與假手術組WT小鼠相比,假手術組IL-17AKO小鼠回腸、結腸組織中糖基化黏蛋白表達降低、黏液層結構紊亂及細菌侵襲增加,表明IL-17AKO小鼠存在腸道屏障損傷(圖3、表1)。與假手術組WT小鼠相比,模型組WT小鼠回腸、結腸組織中糖基化黏蛋白表達降低、黏液層結構紊亂以及細菌侵襲增加,表明SAP小鼠存在腸道屏障損傷(圖3、表1)。與模型組WT小鼠相比,模型組IL-17AKO小鼠結腸、回腸組織中糖基化黏蛋白、黏液層結構以及細菌侵襲情況均無顯著差異(圖3、表1)。
 圖3
示NaTC-AP模型小鼠的回腸及結腸染色和熒光細菌原位雜交結果
圖3
示NaTC-AP模型小鼠的回腸及結腸染色和熒光細菌原位雜交結果
a:DBA染色( ×200);b:AB-PAS染色( ×100);c:熒光細菌原位雜交( ×200)
3 討論
AP是常見的急腹癥,臨床表現為急性持續上腹部疼痛,伴腹脹、惡心、嘔吐等癥狀,其發病率逐年攀升,給社會造成較大的經濟負擔[18]。腸道是AP發展過程中受損的遠端器官之一,腸道屏障受損后,釋放大量細胞因子及炎癥介質,對其他器官造成二次打擊[19]。臨床研究[20]表明,出現結腸并發癥的SAP患者,其器官功能衰竭的發生率可升高2倍,且手術次數增加、住院時間延長,預后較差。本研究使用CER-AP模型[16]探究了IL-17AKO對輕癥AP胰腺損傷的影響,也進一步使用NaTC-AP模型[16]探究了IL-A7AKO對SAP胰腺及腸道損傷的影響。結果顯示,SAP可累及腸道,出現腸道損傷,細菌侵襲增加,與臨床表現一致。因此,在臨床治療中,需重視改善AP期間的腸道功能。
腸道屏障由物理屏障、化學屏障、免疫屏障及微生物屏障組成,能夠有效防止外源細菌及腸道共生菌入侵[21]。腸道黏液層是腸道防御的第一道防線。糖基化黏蛋白由杯狀細胞分泌,覆蓋在腸上皮細胞表面,發揮物理隔離作用,能夠有效防止外源細菌、腸道共生菌、內毒素等透過腸黏膜進入血液[22]。此外,腸上皮細胞緊密連接也參與維持腸上皮細胞結構完整性和生物學功能,防止腸腔內的細菌、抗原等物質進入腸固有層,同時促進營養物質的轉運[23]。在SAP中,腸道屏障出現嚴重的損傷,腸上皮細胞緊密連接蛋白表達降低,腸上皮細胞結構破壞,杯狀細胞功能障礙、黏液減少,腸道菌群紊亂,細菌移位發生[24]。在本研究中,WT-NaTC模型小鼠腸道黏液層結構紊亂,糖基化黏蛋白表達降低,腸道屏障明顯被破壞,進一步導致細菌侵襲增加。在生理情況下,IL-17可促進糖基化黏蛋白的產生,對維持腸道黏膜屏障功能有重要作用[9, 25-26]。本研究使用IL-17AKO小鼠進行研究,發現IL-17AKO小鼠在造模前腸道屏障已經出現損傷,細菌侵襲增加,且出現全身炎癥反應,說明IL-17A缺乏可導致腸道屏障受損,引起炎癥反應。但在疾病狀態下,IL-17分泌增加,可作用于腸上皮細胞和調控Th細胞導致腸壁水腫,破壞腸黏膜屏障[27]。除此之外,IL-17可通過調節緊密連接蛋白的表達,改變腸道通透性[28]。因此,IL-17可能具有雙重調節作用,即在生理情況下可起保護作用,但在病理情況可加重病情進展。
IL-17主要通過核因子κB激活劑1誘導K63連接的泛素化酶啟動信號轉導,從而激活絲裂原活化蛋白激酶、CCAAT增強子結合蛋白β和核因子κB通路,觸發下游基因的轉錄激活,增加促炎細胞因子、趨化因子、抗菌肽等合成發揮促炎功能[29]。在AP中,血清IL-17水平與AP嚴重程度相關,是SAP并發癥的獨立危險因素[30-31]。IL-17信號過度激活促進了炎癥反應,加重AP嚴重程度[32]。以往研究[11]表明,IL-17是AP重癥化的潛在靶點,抑制IL-17信號通路或調控Th細胞分泌IL-17可以減輕AP嚴重程度。但本研究通過使用IL-17AKO小鼠進行研究,發現與模型組WT小鼠相比,IL-17AKO對NaTC-AP模型小鼠的腸道損傷無保護作用,也不能降低CER-AP和NaTC-AP小鼠的血清淀粉酶、脂肪酶及IL-6水平,對胰腺病理水腫、炎癥及壞死均無改善作用。究其原因,可能是由于缺乏IL-17A,影響了IL-17A相關通路的病理生理功能,造成IL-17AKO小鼠細胞因子水平異常升高、腸道屏障受損,回腸、結腸組織中糖基化黏蛋白顯著減少,黏液層結構紊亂,細菌侵襲增加,從而無法對AP產生保護作用。因此,在IL-17抑制劑用于AP臨床試驗前,應進一步研究免疫細胞、腸道屏障功能和腸道微生物組分之間的相互作用。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:吳詠姿、劉詩雨、張瀟穎和李燕妮完成實驗操作及數據分析,吳詠姿完成論文撰寫,蔡文浩和劉婷婷進行實驗設計,夏慶和黃偉指導文章寫作,黃偉提供經費支持。
倫理聲明:本研究已通過四川大學華西臨床醫學院/華西醫院實驗動物倫理委員會的審核批準(批文編號:20231205002)。