引用本文: 陳康權, 張森, 劉曉光, 袁國佳, 陳念平. 肝臟原發性Rosai-Dorfman病:1例報道并文獻復習. 中國普外基礎與臨床雜志, 2024, 31(8): 981-985. doi: 10.7507/1007-9424.202312091 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
Rosai-Dorfman(RD)病是一種罕見的非朗格漢斯細胞組織細胞增多癥,于1965年由Destombes[1]首次報道,1969年由Rosai和Dorfman[2]改稱為“竇組織細胞增生伴巨大淋巴結病”。2016年在關于組織細胞增多癥修訂分類中將皮膚RD病劃分為“C”組,將家族性、經典、結節外、腫瘤相關、免疫疾病性RD病等劃分為“R”組[3]。2023年第5版世界衛生組織血液淋巴腫瘤分類(淋巴腫瘤)[4]中已將RD病放到組織細胞/巨噬細胞腫瘤章節,首次將它作為一類真正的腫瘤性病變。目前國內外陸續有關于經典RD病、結節外RD病等相關病例報道,而肝臟原發性RD病僅檢索到2例。現結合廣東醫科大學附屬醫院(簡稱“我院”)2023年收治的1例肝臟原發性RD病患者的臨床病理資料,對其臨床特點、病理特征、診治及預后進行總結,旨在加強對肝臟原發性RD病的認識。
1 臨床資料
1.1 病例資料
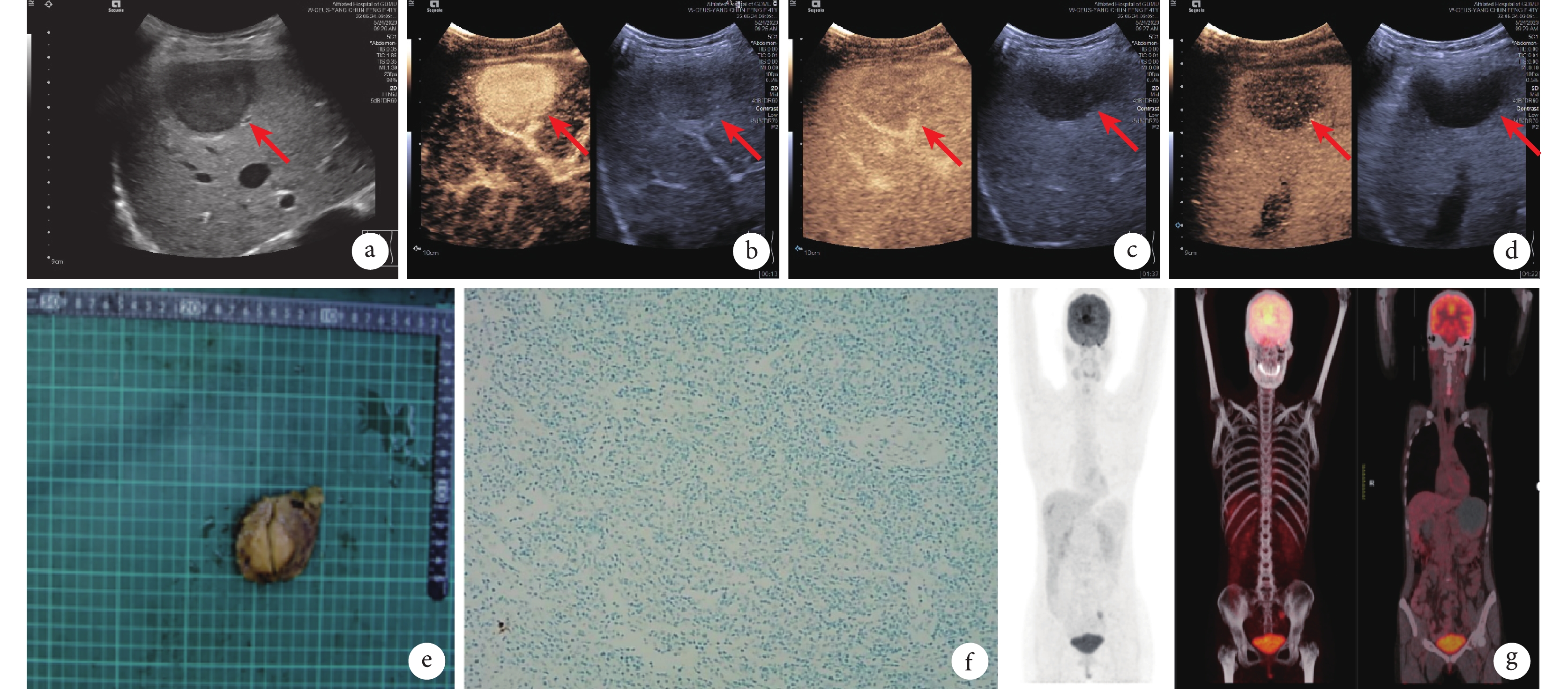
患者,女,41歲。因“反復右上腹疼痛2+ 個月”收入我院。患者于2個月前無明顯誘因反復右上腹疼痛、呈間歇性悶痛,可自行緩解。為求進一步診治而就診于我院。查體未見明顯陽性體征。既往史:有慢性病毒性乙型肝炎(簡稱“乙肝”)5年余,規律抗病毒治療。實驗室檢查:血常規、凝血功能、肝功能、腫瘤標志物均正常,乙肝表面抗體陽性、丙型肝炎抗體陰性,乙肝DNA定量1.06×103 U/mL。肝功能Child-Pugh評分分級A級(5分)。胸相正側位X線平片檢查提示:雙肺紋理增粗。肝臟超聲造影檢查示:肝內回聲分布均勻,肝第6/7段交界處包膜下可見低回聲結節(圖1a),約3.9 cm×3.9 cm×3.0 cm大小,邊界清;超聲造影注入2.0 mL造影劑后觀察到肝第6/7段交界處包膜下病變,動脈期呈高增強(圖1b),門靜脈期呈稍低增強(圖1c),延遲期呈低增強(圖1d)。考慮肝癌可能,擬行手術切除。完善術前準備并排除手術相關禁忌證后在全身麻醉下行腹腔鏡下肝右后葉部分切除術。術中見腫瘤約4.0 cm×4.0 cm×3.7 cm大小,呈圓形,邊界清,包膜完整,質地硬,切面呈灰白色(圖1e)。術后組織病理學蘇木精-伊紅(haematoxylin and eosin,HE)染色檢查:(右肝腫物)鏡下見病變呈結節狀,內見大量淋巴細胞和漿細胞,并可見胞質嗜酸、胞核稍大的梭形細胞,考慮為淋巴造血系統病變;免疫組織化學(immunohistochemistry,IHC)染色:人類皰疹病毒4型(–)、細胞角蛋白(–)、CD20(+)、CD3(+)、CD138(部分+)、CD23(–)、CD4(部分+)、CD8(部分+)、CD68(部分+)。術后第1個月時于廣州金域醫學檢驗中心行組織病理學HE染色檢查:鏡下可見體積較大的組織細胞,胞漿豐富,并找到淋巴細胞伸入現象,背景為大量多克隆的漿細胞(圖1f),免疫球蛋白(immunoglobulin,Ig)G4/IgG<40%;IHC染色結果:CD68(+)、CD163(+)、S-100(+)、cyclinD1(+)、八聚體結合轉錄因子-2(+)、CD61(散在+)、CD235a(–)、人類皰疹病毒-8(–)、生長抑素受體-2(散在+)、間變性淋巴瘤激酶(–)、髓過氧化物酶(–)、末端脫氧核糖核酸轉移酶(–);淋巴瘤基因IgH、IgK、IgL重排克隆性檢測結果均陰性,T細胞受體基因β、γ和δ重排克隆性檢測結果均陰性。術后第1個月于我院行PET-CT檢查(圖1g),結果見:肝右后葉部分切除術后;全身未見高攝取病灶,未見殘余腫瘤灶。符合原發性肝臟RD病的診斷。術后隨訪至第7個月時未見復發。
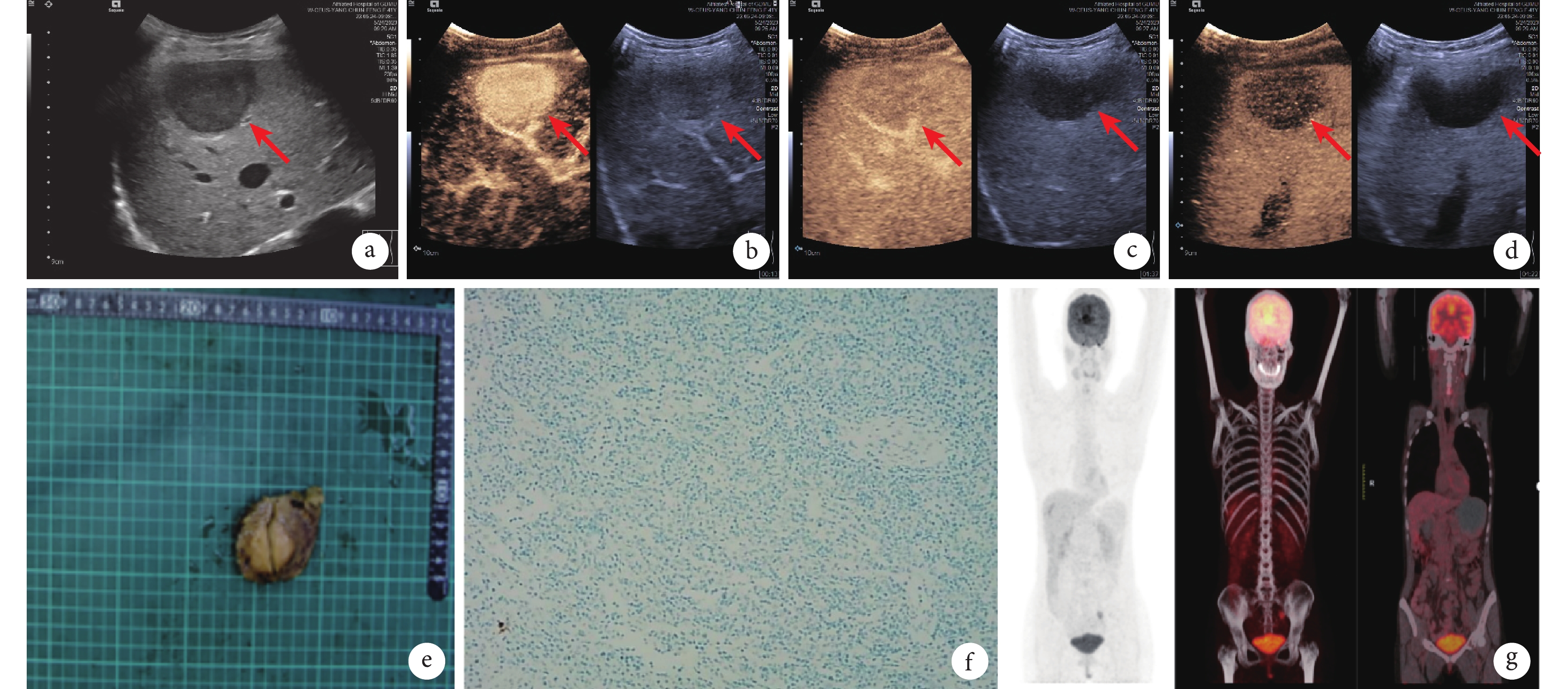 圖1
示術前肝臟超聲造影檢查結果、術后腫瘤大體標本、組織病理學及PET-CT檢查結果
圖1
示術前肝臟超聲造影檢查結果、術后腫瘤大體標本、組織病理學及PET-CT檢查結果
a:二維灰階超聲圖像見低回聲結節(箭頭所示);b~d:超聲造影示動脈期呈高增強(b,箭頭所示)、門靜脈期呈稍低增強(c,箭頭所示)、延遲期呈低增強(d,箭頭所示);e:術后腫瘤切面呈灰白色;f:術后腫瘤的病理學改變(HE ×400) ;g:術后第1個月時復查PET-CT檢查全身未見高攝取病灶
1.2 文獻資料
筆者對5個數據庫(Embase、PubMed、中國生物醫學文獻、CNKI和重慶維普)進行了系統的文獻檢索,通過標題、摘要及全文篩選,僅獲得2例肝臟原發性RD病的報道,其特征見表1。
2 討論
2.1 RD病的發病情況
RD病好發于兒童及青少年,平均發病年齡為20.6歲,男女患者比為1.4∶1。臨床表現多為雙側頸部淋巴結無痛性腫大,可累及身體的任何部位。RD病根據病變累及范圍分為3種類型,即淋巴結型、結外型和混合型(淋巴結和結外均受累)[7]。淋巴結型RD病表現為雙側大面積無痛性頸部淋巴結腫大,伴有發熱、體質量減輕和盜汗,可累及腋窩、腹股溝和縱隔淋巴結[8];結外型RD病發病率超過40%,受累部位包括皮膚(10%)、鼻腔(11%)、骨(5%~10%)、眼眶組織(11%)和中樞神經系統(5%,主要是硬腦膜),而累及肝臟罕見,只有結外病變不伴淋巴結受累的患者不足20%[9],其中常見部位是頭頸部。本病例屬于罕見的單純肝臟受累RD病,檢索國內外文獻僅檢索到2例肝臟原發性RD病,缺乏特異性體征和癥狀,容易被誤診為肝細胞癌、肝轉移瘤等肝臟惡性腫瘤。
2.2 RD病的病因及發病機制
RD病是一種罕見的非遺傳疾病,其發病機制可能包括感染原因、免疫缺陷、自身免疫性疾病和腫瘤形成過程。有研究者[10-11]在發病機制研究中發現了Epstein-Barr 病毒、人類皰疹病毒6、多瘤病毒等;然而也有研究者[12]報道在行病毒有關檢測時結果為陰性。RD病可能與免疫疾病有關,有研究者分別報道了伴有人類免疫缺陷病毒的RD病患者[13]及與IgG4相關RD病[14]。RD病細胞是多克隆、反應性和非腫瘤性的,但有研究者[15-17]報道突變相關病案,如BRAFV600E、RAS或MAP2K1突變,提示一些病例具有潛在的克隆發病機制。結合文獻分析本例患者,有數年慢性乙肝,就肝癌診斷與發病來說其乙肝病史較短,是需鑒別及考慮的因素之一,切片病理提示IgG4/IgG<40%,符合RD病發病機制及病變可能。筆者認為,肝臟之所以會發生RD病,不僅因為患者本身合并有乙肝等高危因素,而且肝臟本身是免疫器官之一,肝臟中的非實質細胞約占肝臟細胞總量的20%~40%,包括肝竇內皮細胞、枯否細胞、肝星狀細胞、樹突狀細胞、調節性T細胞、肝臟固有淋巴細胞等,它們與肝臟實質細胞相互作用,共同促進了易于誘導耐受的肝臟免疫環境的形成,這可能是肝臟發生RD病的原因之一,其中甲胎蛋白結果陰性也可證實這一點,值得深思。
2.3 診斷與鑒別診斷
2.3.1 影像學鑒別點
① 肝臟超聲造影檢查RD病表現為低回聲結節,邊界清,形態規則,回聲均勻,內部及周邊可見豐富血流信號,肝內動脈流速較快。病灶造影下動脈期呈高增強,門靜脈期呈稍低增強,延遲期呈低增強且呈現出“快進快出”的類似肝細胞癌的影像學特征。動脈期高增強、門靜脈期或延遲期低增強是肝細胞癌典型的“快進快退”模式,其原因是肝細胞癌供血方式主要來源于肝動脈,造影劑通過肝動脈快速進入腫瘤組織迅速顯影,而正常肝實質主要由門靜脈供血,造影劑需經過肝腸循環后才能到達門靜脈而使肝組織顯影,故到達肝臟時間較晚, 因此,與周圍肝實質相比,腫瘤呈現出動脈期快速增強表現,當動脈供血為主的腫瘤組織內造影劑快速退出時,正常肝組織此時以門靜脈供血方式持續增強,因此和病灶周圍肝實質比較,腫瘤內的回聲強度相對較低,從而表現為門靜脈期或延遲期低增強。RD病在超聲造影上與肝細胞癌的鑒別點無特異性,但可明確RD病同樣主要是由肝動脈供血,也是臨床上不可或缺的檢查之一。② CT檢查RD病無特異性,對診斷幫助較小。上腹部CT平掃顯示為邊界模糊、密度欠均勻的類圓形結節[5-6],而在增強掃描時病灶可呈動脈期病灶明顯強化[5],也可僅有類似肝轉移瘤的環形強化[6]。遺憾的是,目前所檢索到的病例報道中多以CT檢查為主,目前仍缺乏對肝臟RD病的上腹部MR的詳細臨床資料。③ MR掃描結外型RD病病灶信號多不均勻,T1加權成像以等低信號為主,少數為高信號,T2加權成像以等高信號為主,增強掃描均勻或邊緣強化,擴散加權成像彌散受限,PET-CT葡萄糖攝取明顯增高[18-19]。本病例術前考慮為原發性肝癌,超聲造影評估與CT在腫瘤的診斷上意義相似,因此沒有再做MR評估,值得思考。雖然合理使用CT、MR等檢查手段可發現深在的部位或難以觸診的異常淋巴結,還可幫助臨床醫生發現微小浸潤病灶,并且PET-CT掃描已被證明有助于鑒別結外疾病[11],準確評估病變累及、播散程度[20],但它對診斷的意義不大。
2.3.2 組織病理學鑒別點
目前RD病的診斷仍依賴于組織病理學檢查結果。結合國內外文獻分析,RD病的病理學及分子學特征為:RD病大體病理表現為圓形、卵圓形的腫物,切面呈灰白色或灰紅色,質地中等。淋巴結型RD病早期在光鏡下可見多數淋巴結結構基本存在,內有淋巴濾泡,擴張的淋巴竇內組織細胞增生,晚期鏡下可見淋巴結結構消失,組織細胞呈彌漫性浸潤,皮質中存在大量活化的B細胞和成熟漿細胞,它與蒼白的組織細胞呈現明暗交替的外觀;結外型和混合型與淋巴結型鏡下病變類似,病變周圍可見更多的膠原纖維。RD病最具特征性的病理表現是淋巴細胞吞噬或淋巴細胞伸入現象—活的淋巴細胞位于完整組織細胞的胞質中,漿細胞、中性粒細胞和紅細胞也可位于這一胞質中,具有重要的診斷學意義。但并不是所有RD病都具有這種病理表現,Gazia等[6]報道的病例在病理中并沒有這種表現,而筆者和鄧斐文等[5]報道的病例病理中則是找到了這種淋巴細胞伸入現象,可見這也是肝臟原發性RD病容易誤診的一大原因。但這種淋巴細胞伸入現象并非RD病的特異性病理學表現,一些良性和惡性疾病如自身免疫性溶血性貧血、骨髓炎/癌、成神經細胞瘤、多發性骨髓瘤、白血病和惡性淋巴瘤也可出現這種現象[21]。IHC染色發現,RD病組織中S-100、八聚體結合轉錄因子-2、cyclinD1、CD68、CD163等標志物常呈不同程度的陽性,常缺乏CD1a和CD207/langerin表達。本病例IHC染色結果與此基本一致。
2.3.3 臨床鑒別點
根據肝臟原發性RD病部位和影像學表現,需與肝臟良惡性腫瘤鑒別。① 肝細胞癌。肝細胞癌一般有肝炎、肝硬化相關病史,甲胎蛋白常為陽性,鏡下表現腫瘤細胞呈小梁狀、實性巢狀、假腺樣或腺泡狀排列,瘤細胞間可見豐富的血竇樣腔隙,IHC染色見Hepatocyte、arginase、Glypican3常呈陽性(Glypican3在低分化癌中陽性率高,在高分化癌中陽性率低),Ki-67表達偏高,當病灶腫瘤較大時常合并壞死,超聲造影、CT、MR等影像學檢查可發現腫塊回聲不均勻,而肝臟RD病肝內壞死較少見。雖然不同分化程度的肝細胞癌在肝臟超聲造影檢查下動脈期均表現為高增強,但分化程度越高的肝細胞癌,門靜脈供血越多,門靜脈期及延遲期可表現為等增強,不伴廓清,可與肝臟RD病區分;而低分化肝細胞癌則與RD病類似,呈動脈期高增強,門靜脈期稍低增強,延遲期低增強的典型“快進快出”影像學征象,因此鑒別診斷需結合臨床資料。② 肝內膽管細胞癌。因肝內膽管細胞癌外周主要由富血供的腫瘤細胞和間質血管組成,而中央主要為乏血供的纖維壞死組織,肝臟超聲造影多表現為動脈期周邊環狀或結節狀高增強伴早期迅速廓清的不一樣的“快進快出”,其廓清時間比肝臟RD病更短、程度更顯著,這些特征可與RD病相鑒別。③ 肝腺瘤。本病生育期女性患者多見,男女比約1∶10,國外患者多有口服避孕藥物史,且部分患者停藥后肝腺瘤可自然消退,國內患者多無口服避孕藥物史,通常無淋巴結腫大,鏡下表現由分化好的肝細胞構成,與正常肝細胞極其相似,腫瘤標志物無顯著升高;在影像學檢查上,肝腺瘤在肝臟超聲造影上以等或略低密度影為主,增強掃描動脈期明顯強化,門靜脈期及延遲期強化程度相對下降,其造影模式與肝細胞癌、RD病類似,鑒別相對困難,臨床上同樣易被誤診為惡性腫瘤而進行手術切除,而對于<5 cm的肝腺瘤一般僅建議定期復查。因此對于肝臟原發性RD病,肝腺瘤的鑒別診斷同樣重要。在MRI上,可見特征性“環礁征”,即病變周圍的T2高信號帶(如環礁)和與周圍肝實質相比呈等信號的中心(如圍繞的海域),在病變中心可見 T2加權成像高信號的小結節(如小島嶼);由于肝腺瘤顯著彌漫的脂肪變性、糖原及腫瘤出血,其細胞內脂肪變性在反相位上信號彌漫減低,可作為肝腺瘤與肝細胞癌、RD病的重要鑒別診斷點。在本例中,雖然患者無長期口服避孕藥物等相關病史,但也應完善上腹部MRI及肝臟穿刺明確病因(患者拒絕,并強烈要求行手術切除)。因此臨床上RD病的鑒別診斷重點并不僅僅有肝細胞癌,肝腺瘤同樣需引起重視。④ 肝轉移瘤。本病一般以原發臟器腫瘤的表現和癥狀為主,患者可有乏力、厭食、體質量下降等表現,原發腫瘤相關的血清腫瘤標志物常明顯增高,如癌胚抗原、CA19-9等,可行PET-CT尋找原發灶。肝轉移瘤的影像學常表現為多發圓形或類圓形低密度影,MRI平掃T1加權成像病灶均為低信號,T2加權成像信號變化較多,最常見的表現是呈中等度高信號或中等度高信號中央伴有更高信號區;動脈期、門靜脈期及延時期多呈環形強化,但強化程度一般小于肝實質,表現為牛眼征、靶征。肝轉移瘤的超聲造影表現:若轉移灶乏血供,則呈環形增強,表現為“甜甜圈征”,若轉移灶富血供,則呈均勻高增強,相比RD病,肝轉移瘤的“快進快出”更為提前,表現為“更快進、更快出”, 這可能由肝轉移瘤供血血管較RD病少導致;退出時,往往從中央開始,隨后周邊逐漸退出,呈“黑洞征”,此可以成為鑒別肝臟RD病的重點。
可見,無論是肝腫瘤還是RD病本身,存在著本質的不同。從肝臟腫瘤本身進行比較,原發腫瘤大部分都會存在甲胎蛋白的進行性升高及本身的早期無癥狀、晚期較大腫瘤負荷;肝臟轉移瘤,可以追溯其原發灶,甲胎蛋白一般是陰性。對于RD病,它屬于免疫血液系統疾病,在淋巴免疫系統等少見,更罕見于其他器官。與肝腫瘤相比,RD病本身還是存在可以進行鑒別的特點,甲胎蛋白在肝臟RD病中陰性且病灶單發。一般肝腫瘤隨著腫瘤負荷變大,癥狀逐漸出現,肝臟RD病的癥狀出現較早,相比之下其他伴隨癥狀較少,進行PET-CT檢查可證實判斷。
2.4 治療及預后
RD病的治療并未達成共識,通常認為淋巴結受累者只需觀察,可自行消退[8]。對于結外型RD病,在有癥狀或重要器官受累時建議積極治療[22-23],包括手術切除,長春新堿、甲氨蝶呤等免疫調節劑,糖皮質激素等治療,其中糖皮質激素是全身治療的一線選擇。對于孤立性病變或有限數量的病變以及浸潤進展病灶造成重要器官壓迫或出現明顯臨床癥狀體征者,采用手術切除或手術減瘤是有效選擇[24-26]。根治性手術是結外型RD病的一線治療方案,而且它對治療后進展或復發患者的治療效果也較好[26] 。對于原發性肝臟RD病,術前易誤診為肝惡性腫瘤,文獻報道的2例患者術前均有腹痛等不適癥狀,嚴重影響生活質量而行手術切除,術后隨訪時間分別為2和3+個月,本例患者隨訪時間為 7個月,這3例患者術后均未見腫瘤復發。
總之,肝臟原發性RD病臨床罕見、診斷困難,容易誤診,術后需密切隨訪,發現可疑復發征象時需進一步檢查,不排除再次手術探查并切除可能。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:陳念平負責課題設計和資料分析;陳康權和張森收集數據、撰寫文章及修改文章;劉曉光和袁國佳擬定寫作思路;陳念平和劉曉光指導撰寫文章并最后定稿。
倫理聲明:本研究得到了廣東醫科大學附屬醫院臨床科研倫理委員會的批準(批文編號:PJKT2024-048)。所有參與患者均獲得了書面知情同意。
Rosai-Dorfman(RD)病是一種罕見的非朗格漢斯細胞組織細胞增多癥,于1965年由Destombes[1]首次報道,1969年由Rosai和Dorfman[2]改稱為“竇組織細胞增生伴巨大淋巴結病”。2016年在關于組織細胞增多癥修訂分類中將皮膚RD病劃分為“C”組,將家族性、經典、結節外、腫瘤相關、免疫疾病性RD病等劃分為“R”組[3]。2023年第5版世界衛生組織血液淋巴腫瘤分類(淋巴腫瘤)[4]中已將RD病放到組織細胞/巨噬細胞腫瘤章節,首次將它作為一類真正的腫瘤性病變。目前國內外陸續有關于經典RD病、結節外RD病等相關病例報道,而肝臟原發性RD病僅檢索到2例。現結合廣東醫科大學附屬醫院(簡稱“我院”)2023年收治的1例肝臟原發性RD病患者的臨床病理資料,對其臨床特點、病理特征、診治及預后進行總結,旨在加強對肝臟原發性RD病的認識。
1 臨床資料
1.1 病例資料
患者,女,41歲。因“反復右上腹疼痛2+ 個月”收入我院。患者于2個月前無明顯誘因反復右上腹疼痛、呈間歇性悶痛,可自行緩解。為求進一步診治而就診于我院。查體未見明顯陽性體征。既往史:有慢性病毒性乙型肝炎(簡稱“乙肝”)5年余,規律抗病毒治療。實驗室檢查:血常規、凝血功能、肝功能、腫瘤標志物均正常,乙肝表面抗體陽性、丙型肝炎抗體陰性,乙肝DNA定量1.06×103 U/mL。肝功能Child-Pugh評分分級A級(5分)。胸相正側位X線平片檢查提示:雙肺紋理增粗。肝臟超聲造影檢查示:肝內回聲分布均勻,肝第6/7段交界處包膜下可見低回聲結節(圖1a),約3.9 cm×3.9 cm×3.0 cm大小,邊界清;超聲造影注入2.0 mL造影劑后觀察到肝第6/7段交界處包膜下病變,動脈期呈高增強(圖1b),門靜脈期呈稍低增強(圖1c),延遲期呈低增強(圖1d)。考慮肝癌可能,擬行手術切除。完善術前準備并排除手術相關禁忌證后在全身麻醉下行腹腔鏡下肝右后葉部分切除術。術中見腫瘤約4.0 cm×4.0 cm×3.7 cm大小,呈圓形,邊界清,包膜完整,質地硬,切面呈灰白色(圖1e)。術后組織病理學蘇木精-伊紅(haematoxylin and eosin,HE)染色檢查:(右肝腫物)鏡下見病變呈結節狀,內見大量淋巴細胞和漿細胞,并可見胞質嗜酸、胞核稍大的梭形細胞,考慮為淋巴造血系統病變;免疫組織化學(immunohistochemistry,IHC)染色:人類皰疹病毒4型(–)、細胞角蛋白(–)、CD20(+)、CD3(+)、CD138(部分+)、CD23(–)、CD4(部分+)、CD8(部分+)、CD68(部分+)。術后第1個月時于廣州金域醫學檢驗中心行組織病理學HE染色檢查:鏡下可見體積較大的組織細胞,胞漿豐富,并找到淋巴細胞伸入現象,背景為大量多克隆的漿細胞(圖1f),免疫球蛋白(immunoglobulin,Ig)G4/IgG<40%;IHC染色結果:CD68(+)、CD163(+)、S-100(+)、cyclinD1(+)、八聚體結合轉錄因子-2(+)、CD61(散在+)、CD235a(–)、人類皰疹病毒-8(–)、生長抑素受體-2(散在+)、間變性淋巴瘤激酶(–)、髓過氧化物酶(–)、末端脫氧核糖核酸轉移酶(–);淋巴瘤基因IgH、IgK、IgL重排克隆性檢測結果均陰性,T細胞受體基因β、γ和δ重排克隆性檢測結果均陰性。術后第1個月于我院行PET-CT檢查(圖1g),結果見:肝右后葉部分切除術后;全身未見高攝取病灶,未見殘余腫瘤灶。符合原發性肝臟RD病的診斷。術后隨訪至第7個月時未見復發。
 圖1
示術前肝臟超聲造影檢查結果、術后腫瘤大體標本、組織病理學及PET-CT檢查結果
圖1
示術前肝臟超聲造影檢查結果、術后腫瘤大體標本、組織病理學及PET-CT檢查結果
a:二維灰階超聲圖像見低回聲結節(箭頭所示);b~d:超聲造影示動脈期呈高增強(b,箭頭所示)、門靜脈期呈稍低增強(c,箭頭所示)、延遲期呈低增強(d,箭頭所示);e:術后腫瘤切面呈灰白色;f:術后腫瘤的病理學改變(HE ×400) ;g:術后第1個月時復查PET-CT檢查全身未見高攝取病灶
1.2 文獻資料
筆者對5個數據庫(Embase、PubMed、中國生物醫學文獻、CNKI和重慶維普)進行了系統的文獻檢索,通過標題、摘要及全文篩選,僅獲得2例肝臟原發性RD病的報道,其特征見表1。
2 討論
2.1 RD病的發病情況
RD病好發于兒童及青少年,平均發病年齡為20.6歲,男女患者比為1.4∶1。臨床表現多為雙側頸部淋巴結無痛性腫大,可累及身體的任何部位。RD病根據病變累及范圍分為3種類型,即淋巴結型、結外型和混合型(淋巴結和結外均受累)[7]。淋巴結型RD病表現為雙側大面積無痛性頸部淋巴結腫大,伴有發熱、體質量減輕和盜汗,可累及腋窩、腹股溝和縱隔淋巴結[8];結外型RD病發病率超過40%,受累部位包括皮膚(10%)、鼻腔(11%)、骨(5%~10%)、眼眶組織(11%)和中樞神經系統(5%,主要是硬腦膜),而累及肝臟罕見,只有結外病變不伴淋巴結受累的患者不足20%[9],其中常見部位是頭頸部。本病例屬于罕見的單純肝臟受累RD病,檢索國內外文獻僅檢索到2例肝臟原發性RD病,缺乏特異性體征和癥狀,容易被誤診為肝細胞癌、肝轉移瘤等肝臟惡性腫瘤。
2.2 RD病的病因及發病機制
RD病是一種罕見的非遺傳疾病,其發病機制可能包括感染原因、免疫缺陷、自身免疫性疾病和腫瘤形成過程。有研究者[10-11]在發病機制研究中發現了Epstein-Barr 病毒、人類皰疹病毒6、多瘤病毒等;然而也有研究者[12]報道在行病毒有關檢測時結果為陰性。RD病可能與免疫疾病有關,有研究者分別報道了伴有人類免疫缺陷病毒的RD病患者[13]及與IgG4相關RD病[14]。RD病細胞是多克隆、反應性和非腫瘤性的,但有研究者[15-17]報道突變相關病案,如BRAFV600E、RAS或MAP2K1突變,提示一些病例具有潛在的克隆發病機制。結合文獻分析本例患者,有數年慢性乙肝,就肝癌診斷與發病來說其乙肝病史較短,是需鑒別及考慮的因素之一,切片病理提示IgG4/IgG<40%,符合RD病發病機制及病變可能。筆者認為,肝臟之所以會發生RD病,不僅因為患者本身合并有乙肝等高危因素,而且肝臟本身是免疫器官之一,肝臟中的非實質細胞約占肝臟細胞總量的20%~40%,包括肝竇內皮細胞、枯否細胞、肝星狀細胞、樹突狀細胞、調節性T細胞、肝臟固有淋巴細胞等,它們與肝臟實質細胞相互作用,共同促進了易于誘導耐受的肝臟免疫環境的形成,這可能是肝臟發生RD病的原因之一,其中甲胎蛋白結果陰性也可證實這一點,值得深思。
2.3 診斷與鑒別診斷
2.3.1 影像學鑒別點
① 肝臟超聲造影檢查RD病表現為低回聲結節,邊界清,形態規則,回聲均勻,內部及周邊可見豐富血流信號,肝內動脈流速較快。病灶造影下動脈期呈高增強,門靜脈期呈稍低增強,延遲期呈低增強且呈現出“快進快出”的類似肝細胞癌的影像學特征。動脈期高增強、門靜脈期或延遲期低增強是肝細胞癌典型的“快進快退”模式,其原因是肝細胞癌供血方式主要來源于肝動脈,造影劑通過肝動脈快速進入腫瘤組織迅速顯影,而正常肝實質主要由門靜脈供血,造影劑需經過肝腸循環后才能到達門靜脈而使肝組織顯影,故到達肝臟時間較晚, 因此,與周圍肝實質相比,腫瘤呈現出動脈期快速增強表現,當動脈供血為主的腫瘤組織內造影劑快速退出時,正常肝組織此時以門靜脈供血方式持續增強,因此和病灶周圍肝實質比較,腫瘤內的回聲強度相對較低,從而表現為門靜脈期或延遲期低增強。RD病在超聲造影上與肝細胞癌的鑒別點無特異性,但可明確RD病同樣主要是由肝動脈供血,也是臨床上不可或缺的檢查之一。② CT檢查RD病無特異性,對診斷幫助較小。上腹部CT平掃顯示為邊界模糊、密度欠均勻的類圓形結節[5-6],而在增強掃描時病灶可呈動脈期病灶明顯強化[5],也可僅有類似肝轉移瘤的環形強化[6]。遺憾的是,目前所檢索到的病例報道中多以CT檢查為主,目前仍缺乏對肝臟RD病的上腹部MR的詳細臨床資料。③ MR掃描結外型RD病病灶信號多不均勻,T1加權成像以等低信號為主,少數為高信號,T2加權成像以等高信號為主,增強掃描均勻或邊緣強化,擴散加權成像彌散受限,PET-CT葡萄糖攝取明顯增高[18-19]。本病例術前考慮為原發性肝癌,超聲造影評估與CT在腫瘤的診斷上意義相似,因此沒有再做MR評估,值得思考。雖然合理使用CT、MR等檢查手段可發現深在的部位或難以觸診的異常淋巴結,還可幫助臨床醫生發現微小浸潤病灶,并且PET-CT掃描已被證明有助于鑒別結外疾病[11],準確評估病變累及、播散程度[20],但它對診斷的意義不大。
2.3.2 組織病理學鑒別點
目前RD病的診斷仍依賴于組織病理學檢查結果。結合國內外文獻分析,RD病的病理學及分子學特征為:RD病大體病理表現為圓形、卵圓形的腫物,切面呈灰白色或灰紅色,質地中等。淋巴結型RD病早期在光鏡下可見多數淋巴結結構基本存在,內有淋巴濾泡,擴張的淋巴竇內組織細胞增生,晚期鏡下可見淋巴結結構消失,組織細胞呈彌漫性浸潤,皮質中存在大量活化的B細胞和成熟漿細胞,它與蒼白的組織細胞呈現明暗交替的外觀;結外型和混合型與淋巴結型鏡下病變類似,病變周圍可見更多的膠原纖維。RD病最具特征性的病理表現是淋巴細胞吞噬或淋巴細胞伸入現象—活的淋巴細胞位于完整組織細胞的胞質中,漿細胞、中性粒細胞和紅細胞也可位于這一胞質中,具有重要的診斷學意義。但并不是所有RD病都具有這種病理表現,Gazia等[6]報道的病例在病理中并沒有這種表現,而筆者和鄧斐文等[5]報道的病例病理中則是找到了這種淋巴細胞伸入現象,可見這也是肝臟原發性RD病容易誤診的一大原因。但這種淋巴細胞伸入現象并非RD病的特異性病理學表現,一些良性和惡性疾病如自身免疫性溶血性貧血、骨髓炎/癌、成神經細胞瘤、多發性骨髓瘤、白血病和惡性淋巴瘤也可出現這種現象[21]。IHC染色發現,RD病組織中S-100、八聚體結合轉錄因子-2、cyclinD1、CD68、CD163等標志物常呈不同程度的陽性,常缺乏CD1a和CD207/langerin表達。本病例IHC染色結果與此基本一致。
2.3.3 臨床鑒別點
根據肝臟原發性RD病部位和影像學表現,需與肝臟良惡性腫瘤鑒別。① 肝細胞癌。肝細胞癌一般有肝炎、肝硬化相關病史,甲胎蛋白常為陽性,鏡下表現腫瘤細胞呈小梁狀、實性巢狀、假腺樣或腺泡狀排列,瘤細胞間可見豐富的血竇樣腔隙,IHC染色見Hepatocyte、arginase、Glypican3常呈陽性(Glypican3在低分化癌中陽性率高,在高分化癌中陽性率低),Ki-67表達偏高,當病灶腫瘤較大時常合并壞死,超聲造影、CT、MR等影像學檢查可發現腫塊回聲不均勻,而肝臟RD病肝內壞死較少見。雖然不同分化程度的肝細胞癌在肝臟超聲造影檢查下動脈期均表現為高增強,但分化程度越高的肝細胞癌,門靜脈供血越多,門靜脈期及延遲期可表現為等增強,不伴廓清,可與肝臟RD病區分;而低分化肝細胞癌則與RD病類似,呈動脈期高增強,門靜脈期稍低增強,延遲期低增強的典型“快進快出”影像學征象,因此鑒別診斷需結合臨床資料。② 肝內膽管細胞癌。因肝內膽管細胞癌外周主要由富血供的腫瘤細胞和間質血管組成,而中央主要為乏血供的纖維壞死組織,肝臟超聲造影多表現為動脈期周邊環狀或結節狀高增強伴早期迅速廓清的不一樣的“快進快出”,其廓清時間比肝臟RD病更短、程度更顯著,這些特征可與RD病相鑒別。③ 肝腺瘤。本病生育期女性患者多見,男女比約1∶10,國外患者多有口服避孕藥物史,且部分患者停藥后肝腺瘤可自然消退,國內患者多無口服避孕藥物史,通常無淋巴結腫大,鏡下表現由分化好的肝細胞構成,與正常肝細胞極其相似,腫瘤標志物無顯著升高;在影像學檢查上,肝腺瘤在肝臟超聲造影上以等或略低密度影為主,增強掃描動脈期明顯強化,門靜脈期及延遲期強化程度相對下降,其造影模式與肝細胞癌、RD病類似,鑒別相對困難,臨床上同樣易被誤診為惡性腫瘤而進行手術切除,而對于<5 cm的肝腺瘤一般僅建議定期復查。因此對于肝臟原發性RD病,肝腺瘤的鑒別診斷同樣重要。在MRI上,可見特征性“環礁征”,即病變周圍的T2高信號帶(如環礁)和與周圍肝實質相比呈等信號的中心(如圍繞的海域),在病變中心可見 T2加權成像高信號的小結節(如小島嶼);由于肝腺瘤顯著彌漫的脂肪變性、糖原及腫瘤出血,其細胞內脂肪變性在反相位上信號彌漫減低,可作為肝腺瘤與肝細胞癌、RD病的重要鑒別診斷點。在本例中,雖然患者無長期口服避孕藥物等相關病史,但也應完善上腹部MRI及肝臟穿刺明確病因(患者拒絕,并強烈要求行手術切除)。因此臨床上RD病的鑒別診斷重點并不僅僅有肝細胞癌,肝腺瘤同樣需引起重視。④ 肝轉移瘤。本病一般以原發臟器腫瘤的表現和癥狀為主,患者可有乏力、厭食、體質量下降等表現,原發腫瘤相關的血清腫瘤標志物常明顯增高,如癌胚抗原、CA19-9等,可行PET-CT尋找原發灶。肝轉移瘤的影像學常表現為多發圓形或類圓形低密度影,MRI平掃T1加權成像病灶均為低信號,T2加權成像信號變化較多,最常見的表現是呈中等度高信號或中等度高信號中央伴有更高信號區;動脈期、門靜脈期及延時期多呈環形強化,但強化程度一般小于肝實質,表現為牛眼征、靶征。肝轉移瘤的超聲造影表現:若轉移灶乏血供,則呈環形增強,表現為“甜甜圈征”,若轉移灶富血供,則呈均勻高增強,相比RD病,肝轉移瘤的“快進快出”更為提前,表現為“更快進、更快出”, 這可能由肝轉移瘤供血血管較RD病少導致;退出時,往往從中央開始,隨后周邊逐漸退出,呈“黑洞征”,此可以成為鑒別肝臟RD病的重點。
可見,無論是肝腫瘤還是RD病本身,存在著本質的不同。從肝臟腫瘤本身進行比較,原發腫瘤大部分都會存在甲胎蛋白的進行性升高及本身的早期無癥狀、晚期較大腫瘤負荷;肝臟轉移瘤,可以追溯其原發灶,甲胎蛋白一般是陰性。對于RD病,它屬于免疫血液系統疾病,在淋巴免疫系統等少見,更罕見于其他器官。與肝腫瘤相比,RD病本身還是存在可以進行鑒別的特點,甲胎蛋白在肝臟RD病中陰性且病灶單發。一般肝腫瘤隨著腫瘤負荷變大,癥狀逐漸出現,肝臟RD病的癥狀出現較早,相比之下其他伴隨癥狀較少,進行PET-CT檢查可證實判斷。
2.4 治療及預后
RD病的治療并未達成共識,通常認為淋巴結受累者只需觀察,可自行消退[8]。對于結外型RD病,在有癥狀或重要器官受累時建議積極治療[22-23],包括手術切除,長春新堿、甲氨蝶呤等免疫調節劑,糖皮質激素等治療,其中糖皮質激素是全身治療的一線選擇。對于孤立性病變或有限數量的病變以及浸潤進展病灶造成重要器官壓迫或出現明顯臨床癥狀體征者,采用手術切除或手術減瘤是有效選擇[24-26]。根治性手術是結外型RD病的一線治療方案,而且它對治療后進展或復發患者的治療效果也較好[26] 。對于原發性肝臟RD病,術前易誤診為肝惡性腫瘤,文獻報道的2例患者術前均有腹痛等不適癥狀,嚴重影響生活質量而行手術切除,術后隨訪時間分別為2和3+個月,本例患者隨訪時間為 7個月,這3例患者術后均未見腫瘤復發。
總之,肝臟原發性RD病臨床罕見、診斷困難,容易誤診,術后需密切隨訪,發現可疑復發征象時需進一步檢查,不排除再次手術探查并切除可能。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:陳念平負責課題設計和資料分析;陳康權和張森收集數據、撰寫文章及修改文章;劉曉光和袁國佳擬定寫作思路;陳念平和劉曉光指導撰寫文章并最后定稿。
倫理聲明:本研究得到了廣東醫科大學附屬醫院臨床科研倫理委員會的批準(批文編號:PJKT2024-048)。所有參與患者均獲得了書面知情同意。