自1982年,全直腸系膜切除術(total mesorectal excision,TME)理念被提出并開展后,直腸癌術后局部復發率顯著下降,遠期生存率提升,因此TME已成為中低位直腸癌手術的金標準。然而,TME術中盆腔自主神經損傷導致的術后排尿及性功能障礙發生率居高不下,亟需探明解決。筆者團隊多年來經過解剖學、組織學、生理學等系統研究,證實TME術中在鄧氏筋膜前方游離直腸前壁,并切除部分鄧氏筋膜是神經損傷的根源;相反,TME術中在鄧氏筋膜后方游離并完整保留鄧氏筋膜是可行且必要的,并通過解剖學研究,首次發現鄧氏筋膜術中標記線—衛氏線,率先提出了衛氏線引導的保留鄧氏筋膜直腸癌根治術(innovative TME,iTME)。通過開展多中心臨床研究,證實與傳統TME手術相比,iTME患者術后排尿及性功能障礙率顯著下降,且腫瘤學指標無差異,提示對特定分期的中低位男性直腸癌患者,iTME手術是更優的選擇。本文系統性回顧了iTME的研究歷程及實施標準,并對iTME的應用現狀及未來作一總結展望。
引用本文: 方佳峰, 衛洪波. 衛氏線引導的保留鄧氏筋膜直腸癌根治術(iTME)的實施標準及應用現狀. 中國普外基礎與臨床雜志, 2024, 31(5): 518-522. doi: 10.7507/1007-9424.202401077 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
1982年,結直腸癌外科領域泰斗,英國的Heald教授根據解剖學、影像學及病理學研究進展,提出了全直腸系膜切除術(total mesorectal excision,TME)治療中低位直腸癌的理念[1]。TME顯著降低了直腸癌術后盆腔局部復發率,提高了遠期生存率,這一具有里程碑意義的手術也在近半世紀里成為中低位直腸癌手術的金標準。然而,關于TME的手術入路與層面存在很大爭議,爭議的焦點主要集中于直腸前壁,準確地說在于鄧氏筋膜切除與否。傳統TME手術要求在鄧氏筋膜前方切開從而進入直腸前方手術層面,于精囊腺水平切除部分鄧氏筋膜,這一手術入路被廣為采納應用。然而,鄧氏筋膜前方存在雙側神經血管束(neurovascular bundles,NVB)及其分支,在前方游離極易損傷神經,導致術后排尿及性功能障礙[2-3]。筆者團隊經過多年解剖學[4-5]、組織學[6]、電生理學[7]等系統研究,證實在鄧氏筋膜后方進行直腸前壁游離的可行性及必要性;進一步,基于解剖學研究,首次發現了鄧氏筋膜術中標記線—衛氏線,率先提出衛氏線引導的保留鄧氏筋膜直腸癌根治術(innovative TME,iTME)[8]。通過開展多中心臨床研究(ClinicalTrial.gov ID:NCT02435758),證實與傳統TME手術相比,iTME患者術后有更好的排尿及性功能[9],且腫瘤學指標無差異[10],提示對特定分期的中低位男性直腸癌患者,iTME手術是更優的選擇。筆者擬對iTME的實施標準及應用現狀作一系統性回顧與總結。
1 TME的歷史意義及局限性
Heald教授通過解剖學、病理學及影像學研究,證實直腸系膜內存在的微小癌灶是導致腫瘤復發的重要因素,因此,其于1982年提出TME這一具有劃時代意義的理念及術式[1],并被廣泛應用于中低位直腸癌患者,顯著降低了直腸癌術后盆腔復發率,提高了遠期生存率,取得了顯著的成果[11]。然而,隨著直腸癌患者TME術后整體生存率的提高,另一個突出存在的臨床問題出現了,即因術中盆腔自主神經損傷導致的術后排尿及性功能障礙,發生率可高達50%以上[12-13],顯著影響患者術后的生活質量。因此,在TME提出僅1年以后,日本學者土屋周二(TSUCHIYA Shuji)便提出了保留盆腔自主神經(pelvic autonomic nerve preservation,PANP)的直腸癌根治術。然而,傳統的TME結合PANP手術仍無法完全避免神經損傷及術后泌尿生殖功能障礙,引發了學術界關于TME手術層面是否存在錯誤的思考。
英國學者Lindsey將直腸手術層面分為3種入路,分別為系膜外側平面入路、系膜平面入路及貼近直腸平面入路,Lindsey教授建議對于腫瘤無外侵的患者,應當選擇系膜平面入路,即于鄧氏筋膜后方操作[2]。然而,“TME之父”Heald教授卻有相反的觀點。2004年,Heald教授撰文描述了TME手術層面,并稱之為神圣平面(holy plane),其在文中指出,對于直腸前方層面的解剖,因鄧氏筋膜后方不存在手術層面,故應在鄧氏筋膜前方施行TME手術;同時為避免損傷鄧氏筋膜前方的雙側神經血管束NVB[14],應倒“U”型切除鄧氏筋膜以保護雙側NVB,從而達到功能保護作用。這一理念得到了國內外大多數學者的認同。然而,很多臨床及基礎研究均證實,即使倒“U”型切除鄧氏筋膜,位于鄧氏筋膜前方的雙側NVB,特別是其交通支,仍容易不慎損傷,導致術后排尿及性功能障礙發生率居高不下[2, 6-7, 15]。
2 TME術中保留鄧氏筋膜的意義
1836年,法國學者Charles-Pierre Denonvilliers通過尸體解剖發現,在直腸與男性精囊腺之間存在一層類似肉膜樣的膜,并將其命名為“Denonvilliers’ fascia”,國內則翻譯為鄧氏筋膜或狄氏筋膜。鄧氏筋膜的解剖分層存在爭議,早期研究認為鄧氏筋膜存在兩層結構,近年來,更多學者認為男性鄧氏筋膜可能是多層結構,表現為中間厚實緊密、兩側疏松,其側方形成不規則的“Y”型結構,并包繞保護雙側NVB。Ghareeb等[16]認為男性鄧氏筋膜分為3層,NVB從第2及第3層的2點及10點方向穿出,而第1層則作為保護層覆蓋神經。
筆者團隊多年來對鄧氏筋膜的解剖、組織及生理功能進行了系統研究。解剖學及影像學研究發現盆筋膜與Gerota筋膜相延續,而鄧氏筋膜在盆腔前外側約2點、10點處與盆筋膜相延續構成完整筒狀結構,包繞內層由直腸固有筋膜封套的直腸系膜。因此,在盆筋膜、鄧氏筋膜與直腸固有筋膜兩層結構的間隙進行分離,并保持兩層筋膜的完整性,對于保證腫瘤根治性和保護排尿及性功能至關重要[4]。此外,筆者團隊將直腸癌TME手術標本進行組織學檢測,發現術中切除的部分鄧氏筋膜的2點及10點方向,鄧氏筋膜標本中含有較多神經纖維組織,且高表達與性功能相關的神經元型一氧化氮合酶[6]。進一步,在直腸癌術中使用神經電刺激儀刺激盆腔自主神經,通過監測膀胱壓力變化,以實時辨認并保護神經[7]。發現在刺激鄧氏筋膜表面時,膀胱壓力變化明顯;而切除鄧氏筋膜后,刺激前列腺、精囊腺等鄧氏筋膜前方組織時,膀胱壓力無明顯變化,提示切除部分鄧氏筋膜可能已經導致NVB或分支神經損傷。
因此,隨著近年來對鄧氏筋膜解剖、組胚、功能等多方面的研究進展,鄧氏筋膜對神經及泌尿生殖功能保護的重要意義已經得到證實[17-18]。傳統TME手術要求在鄧氏筋膜前方游離,并切除部分鄧氏筋膜,顯然會不同程度損傷鄧氏筋膜前方的盆腔自主神經,從而導致術后排尿及性功能障礙。
3 iTME的研究歷程
基于TME術后居高不下的排尿及性功能障礙發生率,TME手術的正確層面亟需探索及修正。為避免術中盆腔神經,特別是雙側NVB損傷,在鄧氏筋膜后方施行手術,并完整保留鄧氏筋膜,有望解決直腸癌術后排尿及性功能障礙高發的臨床難題[19]。筆者及國外學者通過尸體解剖研究均發現,鄧氏筋膜緊貼前方的前列腺及精囊腺(男性)走行并融合,在前列腺尖部遠離前列腺,而其與直腸之間其實存在疏松網狀結構,有天然的解剖層面[3, 5, 20]。因此,理論上在鄧氏筋膜后方施行手術是可行的。然而,在早期探索中,包括筆者團隊在內,確實發現進入鄧氏筋膜后方手術從而完整保留鄧氏筋膜,技術上存在困難,成功率并不穩定。
直腸前方游離通常有兩種手術入路:第一種,是在腹膜反折上方1~1.5 cm切開。這種手術入路有助于更好地顯露盆腔直腸前方結構,尤其是肥胖或骨盆狹窄的患者,因此應用最為廣泛;第二種,是在腹膜反折的最低點切開。筆者團隊發現,第一種方法進行直腸前方游離,極難順利進入鄧氏筋膜后方層面及完整保留鄧氏筋膜。相反,在腹膜反折最低點切開,進入鄧氏筋膜后方手術平面的成功率有所提高。然而,即使隨著手術例數及經驗的增加,第二種手術入路對鄧氏筋膜完整保存的成功率并沒有進一步提高,這讓筆者團隊感到困惑及不解。
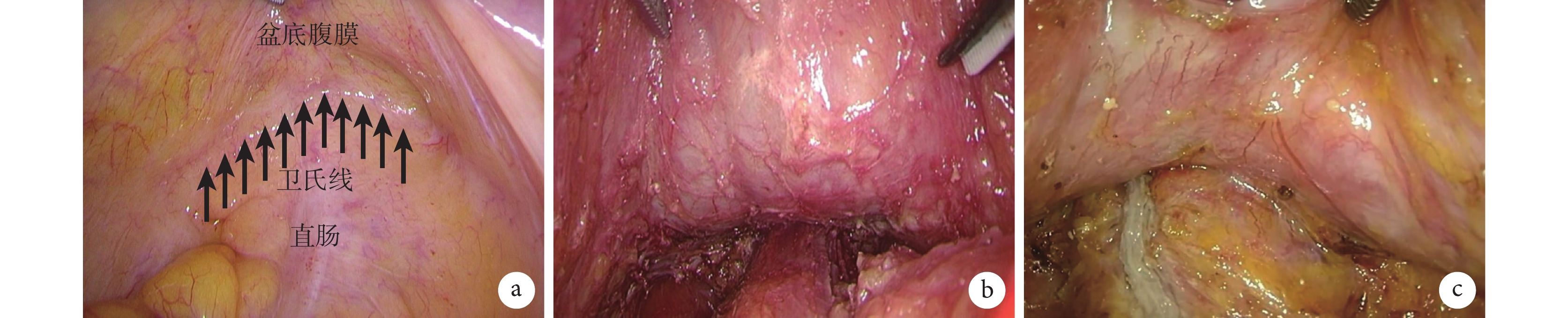
為此,筆者團隊復盤了大量手術錄像,發現在腹膜反折最低點,有一條白色增厚的標記線[21],見圖1a。雖然不同患者的標記線形態有所不同,有些更為致密增厚,有些較淺薄,但恒定存在。進一步,筆者團隊進行了尸體解剖學研究,發現鄧氏筋膜起源于腹膜反折最低點,并形成致密線狀結構,向下延伸至會陰體,因此,該標記線可以作為鄧氏筋膜術中的標記線[22]。因為術中牽拉直腸等操作,腹膜反折最低點容易出現位置變換,這也是在最低點切開并不能保證進入鄧氏筋膜后方的原因。相反,鄧氏筋膜標記線是恒定存在的,不以牽引而改變位置。因此,只要在術中以該標記線為手術層面指引,在標記線下方切開,即可順利進入鄧氏筋膜后方,從而完整保留鄧氏筋膜;而對于不適合保留鄧氏筋膜的患者,應在該標記線上方1~1.5 cm切開腹膜反折,則會天然進入鄧氏筋膜前方[23]。這一鄧氏筋膜標記線,亦被命名為衛氏線,已成為開展iTME手術的核心指引標記。以衛氏線為引導,沿衛氏線下方切開即可順利進入鄧氏筋膜后方,施行完整保留鄧氏筋膜的直腸癌根治術iTME。
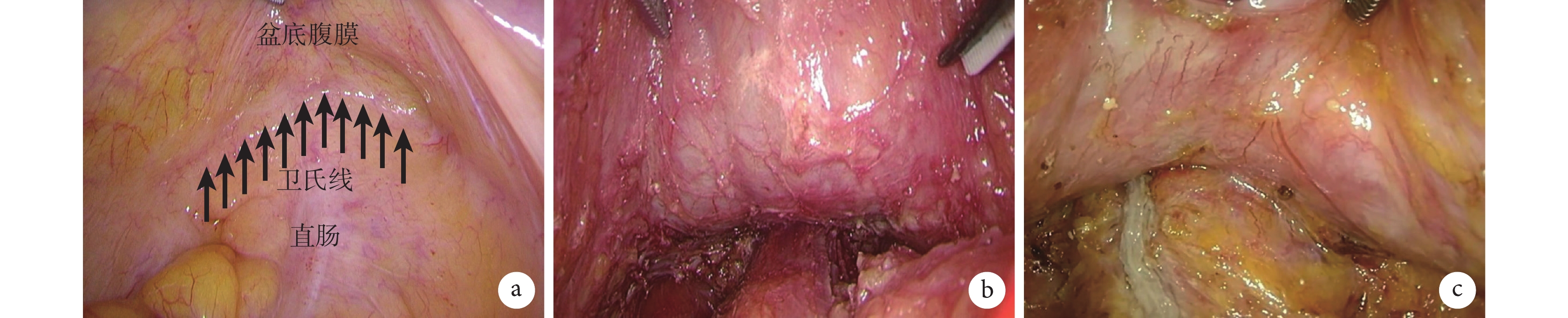 圖1
示鄧氏筋膜術中標記線衛氏線及鄧氏筋膜完整保留的手術圖片
圖1
示鄧氏筋膜術中標記線衛氏線及鄧氏筋膜完整保留的手術圖片
a:鄧氏筋膜術中標記線—衛氏線;b:男性患者鄧氏筋膜完整保留的手術圖片;c:女性患者鄧氏筋膜完整保留的手術圖片
在理論上及實踐中均證實了iTME的可行性后,筆者開展了對比TME與iTME對中低位直腸癌患者神經功能保護及腫瘤根治度的多中心前瞻性隨機對照研究(PUF-01)。共有10余家國內大型醫院加入研究,納入了262例T1~4(前壁為T1~2)N0~2M0期男性中低位直腸癌患者,隨機分為接受傳統TME手術組(切除部分鄧氏筋膜)及iTME手術組(完整保留鄧氏筋膜)。結果表明,iTME患者術后2周排尿功能障礙率明顯降低(6.8% vs. 25.4%,P=0.003),勃起功能和射精功能障礙率也明顯下降(12.5% vs. 34.2%,P=0.023;10.0% vs. 29.4%,P=0.034)[9];而平均51.9個月的隨訪結果顯示,iTME與TME兩組患者的3年總體生存率(94.1% vs. 89.7%)、3年無瘤生存率(87.5% vs. 85.6%)、總復發率(15.6% vs. 15.0%)等腫瘤學指標差異均無統計學意義[10]。這一多中心隨機對照研究結果在實踐中證實了iTME對中低位直腸癌患者術后排尿及性功能保護的優效性,且并未影響腫瘤根治度,提示iTME應該成為特定分期及部位的中低位直腸癌患者的首選。
4 iTME的實施標準
4.1 iTME的適應證與禁忌證
首先,應該明確的是,iTME并不適用于所有直腸癌患者。根據《保留鄧氏筋膜全直腸系膜切除術(iTME)中國專家共識(2021 版)》[24]推薦,iTME的手術適應證為腫瘤下緣距肛緣<12 cm,T1~4(前壁腫瘤為T1~2期)N0~2M0期(AJCC第7版TNM分期);而由于目前尚缺乏直接的腫瘤學安全性證據,前壁T3期腫瘤或者可疑突破腸壁肌層以及可疑腫瘤侵犯鄧氏筋膜的患者,為iTME的手術禁忌證。
4.2 iTME手術操作流程
iTME與傳統TME手術的區別主要在于直腸前壁的解剖,其他手術步驟無區別。根據中低位直腸癌TME手術的操作流程,非直腸前壁部分游離如下:助手牽拉提起乙狀結腸?直腸系膜,在骶骨岬水平切開腹膜進入直腸后間隙,向頭側沿Toldt間隙分離,注意保持Gerota筋膜完整性;在腸系膜下動脈根部分離,根據腫瘤分期決定是否清掃第253組淋巴結,同時將腸系膜下動脈(inferior mesenteric artery,IMA)根部周圍纖維結締組織推開,在距離IMA根部0.5~1.0 cm處結扎IMA,以避免損傷腸系膜下叢;腸系膜下靜脈(inferior mesenteric vein,IMV)的結扎部位目前沒有定論,可以根據腫瘤分期,決定是否高位結扎IMV亦或平行于IMA水平結扎。處理根部血管后,繼續拓展Toldt間隙,沿左側結腸旁溝打開側腹膜,直至乙狀結腸?上段直腸系膜游離完畢。助手將直腸及其系膜牽向腹側,沿直腸后間隙銳性分離,保持腹下神經前筋膜完整性,以保護雙側腹下神經;向縱深切開骶骨?直腸筋膜,直至肛提肌水平或腫瘤下緣2 cm以上水平;向兩側沿直腸固有筋膜逐漸拓展直腸后間隙,至直腸側方緊貼直腸固有筋膜離斷,注意避免過度牽拉或過于靠近外側盆壁分離,避免下腹下神經叢和盆內臟神經損傷。
最后進行直腸前壁游離:沿衛氏線下方切開進入鄧氏筋膜后方,即直腸前間隙,在良好張力下可見鄧氏筋膜與直腸固有筋膜之間的疏松間隙,沿該間隙進行小口銳性分離,并向兩側拓展,從而與后方及側方分離的間隙相貫通。在男性中可隱約見到精囊腺和前列腺輪廓,但若見到串珠狀或葡萄狀精囊腺,說明已誤入鄧氏筋膜前方間隙,此時鄧氏筋膜已被部分切除;在女性亦可見到陰道后壁表面薄層膜狀結構,牽拉時該筋膜與陰道壁之間存在滑動。鄧氏筋膜完整保留的標志是在精囊腺和前列腺、或陰道后壁表面見到完整膜狀結構(圖1b和圖1c)。
5 iTME的應用現狀及未來
PUF-01多中心臨床研究在國內10余家醫療機構開展并順利完成。目前該研究成果已證實,與傳統TME手術相比,iTME具有更好的泌尿生殖功能保護作用,且不影響腫瘤根治效果,可成為特定分期及部位的男性中低位直腸癌患者的首選術式。目前iTME理念及手術已在國內多家醫療單位廣泛開展應用[25]。然而,目前iTME的適應證仍有很大的拓展空間。首先,與男性相比,女性患者泌尿生殖功能的客觀評估指標較少,評估難度相對更高,且女性鄧氏筋膜結構更具多樣性,特別是多胎分娩史女性,因此iTME是否同樣對女性中低位直腸癌患者具有優效的神經及功能保護作用,需要進一步研究探討。其次,考慮到放療可能對盆腔神經及泌尿生殖功能潛在的負性影響,PUF-01研究中并未納入新輔助放化療的直腸癌患者。對于這些患者,iTME是否同樣技術上可行,且具有功能保護的優勢,仍有待后續臨床研究證實。最后,我們同樣期待國外學者開展iTME相關臨床研究,以進一步明確并推廣iTME的適應性。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:方佳峰負責文章撰寫,衛洪波負責思路設計及文章審核。
1982年,結直腸癌外科領域泰斗,英國的Heald教授根據解剖學、影像學及病理學研究進展,提出了全直腸系膜切除術(total mesorectal excision,TME)治療中低位直腸癌的理念[1]。TME顯著降低了直腸癌術后盆腔局部復發率,提高了遠期生存率,這一具有里程碑意義的手術也在近半世紀里成為中低位直腸癌手術的金標準。然而,關于TME的手術入路與層面存在很大爭議,爭議的焦點主要集中于直腸前壁,準確地說在于鄧氏筋膜切除與否。傳統TME手術要求在鄧氏筋膜前方切開從而進入直腸前方手術層面,于精囊腺水平切除部分鄧氏筋膜,這一手術入路被廣為采納應用。然而,鄧氏筋膜前方存在雙側神經血管束(neurovascular bundles,NVB)及其分支,在前方游離極易損傷神經,導致術后排尿及性功能障礙[2-3]。筆者團隊經過多年解剖學[4-5]、組織學[6]、電生理學[7]等系統研究,證實在鄧氏筋膜后方進行直腸前壁游離的可行性及必要性;進一步,基于解剖學研究,首次發現了鄧氏筋膜術中標記線—衛氏線,率先提出衛氏線引導的保留鄧氏筋膜直腸癌根治術(innovative TME,iTME)[8]。通過開展多中心臨床研究(ClinicalTrial.gov ID:NCT02435758),證實與傳統TME手術相比,iTME患者術后有更好的排尿及性功能[9],且腫瘤學指標無差異[10],提示對特定分期的中低位男性直腸癌患者,iTME手術是更優的選擇。筆者擬對iTME的實施標準及應用現狀作一系統性回顧與總結。
1 TME的歷史意義及局限性
Heald教授通過解剖學、病理學及影像學研究,證實直腸系膜內存在的微小癌灶是導致腫瘤復發的重要因素,因此,其于1982年提出TME這一具有劃時代意義的理念及術式[1],并被廣泛應用于中低位直腸癌患者,顯著降低了直腸癌術后盆腔復發率,提高了遠期生存率,取得了顯著的成果[11]。然而,隨著直腸癌患者TME術后整體生存率的提高,另一個突出存在的臨床問題出現了,即因術中盆腔自主神經損傷導致的術后排尿及性功能障礙,發生率可高達50%以上[12-13],顯著影響患者術后的生活質量。因此,在TME提出僅1年以后,日本學者土屋周二(TSUCHIYA Shuji)便提出了保留盆腔自主神經(pelvic autonomic nerve preservation,PANP)的直腸癌根治術。然而,傳統的TME結合PANP手術仍無法完全避免神經損傷及術后泌尿生殖功能障礙,引發了學術界關于TME手術層面是否存在錯誤的思考。
英國學者Lindsey將直腸手術層面分為3種入路,分別為系膜外側平面入路、系膜平面入路及貼近直腸平面入路,Lindsey教授建議對于腫瘤無外侵的患者,應當選擇系膜平面入路,即于鄧氏筋膜后方操作[2]。然而,“TME之父”Heald教授卻有相反的觀點。2004年,Heald教授撰文描述了TME手術層面,并稱之為神圣平面(holy plane),其在文中指出,對于直腸前方層面的解剖,因鄧氏筋膜后方不存在手術層面,故應在鄧氏筋膜前方施行TME手術;同時為避免損傷鄧氏筋膜前方的雙側神經血管束NVB[14],應倒“U”型切除鄧氏筋膜以保護雙側NVB,從而達到功能保護作用。這一理念得到了國內外大多數學者的認同。然而,很多臨床及基礎研究均證實,即使倒“U”型切除鄧氏筋膜,位于鄧氏筋膜前方的雙側NVB,特別是其交通支,仍容易不慎損傷,導致術后排尿及性功能障礙發生率居高不下[2, 6-7, 15]。
2 TME術中保留鄧氏筋膜的意義
1836年,法國學者Charles-Pierre Denonvilliers通過尸體解剖發現,在直腸與男性精囊腺之間存在一層類似肉膜樣的膜,并將其命名為“Denonvilliers’ fascia”,國內則翻譯為鄧氏筋膜或狄氏筋膜。鄧氏筋膜的解剖分層存在爭議,早期研究認為鄧氏筋膜存在兩層結構,近年來,更多學者認為男性鄧氏筋膜可能是多層結構,表現為中間厚實緊密、兩側疏松,其側方形成不規則的“Y”型結構,并包繞保護雙側NVB。Ghareeb等[16]認為男性鄧氏筋膜分為3層,NVB從第2及第3層的2點及10點方向穿出,而第1層則作為保護層覆蓋神經。
筆者團隊多年來對鄧氏筋膜的解剖、組織及生理功能進行了系統研究。解剖學及影像學研究發現盆筋膜與Gerota筋膜相延續,而鄧氏筋膜在盆腔前外側約2點、10點處與盆筋膜相延續構成完整筒狀結構,包繞內層由直腸固有筋膜封套的直腸系膜。因此,在盆筋膜、鄧氏筋膜與直腸固有筋膜兩層結構的間隙進行分離,并保持兩層筋膜的完整性,對于保證腫瘤根治性和保護排尿及性功能至關重要[4]。此外,筆者團隊將直腸癌TME手術標本進行組織學檢測,發現術中切除的部分鄧氏筋膜的2點及10點方向,鄧氏筋膜標本中含有較多神經纖維組織,且高表達與性功能相關的神經元型一氧化氮合酶[6]。進一步,在直腸癌術中使用神經電刺激儀刺激盆腔自主神經,通過監測膀胱壓力變化,以實時辨認并保護神經[7]。發現在刺激鄧氏筋膜表面時,膀胱壓力變化明顯;而切除鄧氏筋膜后,刺激前列腺、精囊腺等鄧氏筋膜前方組織時,膀胱壓力無明顯變化,提示切除部分鄧氏筋膜可能已經導致NVB或分支神經損傷。
因此,隨著近年來對鄧氏筋膜解剖、組胚、功能等多方面的研究進展,鄧氏筋膜對神經及泌尿生殖功能保護的重要意義已經得到證實[17-18]。傳統TME手術要求在鄧氏筋膜前方游離,并切除部分鄧氏筋膜,顯然會不同程度損傷鄧氏筋膜前方的盆腔自主神經,從而導致術后排尿及性功能障礙。
3 iTME的研究歷程
基于TME術后居高不下的排尿及性功能障礙發生率,TME手術的正確層面亟需探索及修正。為避免術中盆腔神經,特別是雙側NVB損傷,在鄧氏筋膜后方施行手術,并完整保留鄧氏筋膜,有望解決直腸癌術后排尿及性功能障礙高發的臨床難題[19]。筆者及國外學者通過尸體解剖研究均發現,鄧氏筋膜緊貼前方的前列腺及精囊腺(男性)走行并融合,在前列腺尖部遠離前列腺,而其與直腸之間其實存在疏松網狀結構,有天然的解剖層面[3, 5, 20]。因此,理論上在鄧氏筋膜后方施行手術是可行的。然而,在早期探索中,包括筆者團隊在內,確實發現進入鄧氏筋膜后方手術從而完整保留鄧氏筋膜,技術上存在困難,成功率并不穩定。
直腸前方游離通常有兩種手術入路:第一種,是在腹膜反折上方1~1.5 cm切開。這種手術入路有助于更好地顯露盆腔直腸前方結構,尤其是肥胖或骨盆狹窄的患者,因此應用最為廣泛;第二種,是在腹膜反折的最低點切開。筆者團隊發現,第一種方法進行直腸前方游離,極難順利進入鄧氏筋膜后方層面及完整保留鄧氏筋膜。相反,在腹膜反折最低點切開,進入鄧氏筋膜后方手術平面的成功率有所提高。然而,即使隨著手術例數及經驗的增加,第二種手術入路對鄧氏筋膜完整保存的成功率并沒有進一步提高,這讓筆者團隊感到困惑及不解。
為此,筆者團隊復盤了大量手術錄像,發現在腹膜反折最低點,有一條白色增厚的標記線[21],見圖1a。雖然不同患者的標記線形態有所不同,有些更為致密增厚,有些較淺薄,但恒定存在。進一步,筆者團隊進行了尸體解剖學研究,發現鄧氏筋膜起源于腹膜反折最低點,并形成致密線狀結構,向下延伸至會陰體,因此,該標記線可以作為鄧氏筋膜術中的標記線[22]。因為術中牽拉直腸等操作,腹膜反折最低點容易出現位置變換,這也是在最低點切開并不能保證進入鄧氏筋膜后方的原因。相反,鄧氏筋膜標記線是恒定存在的,不以牽引而改變位置。因此,只要在術中以該標記線為手術層面指引,在標記線下方切開,即可順利進入鄧氏筋膜后方,從而完整保留鄧氏筋膜;而對于不適合保留鄧氏筋膜的患者,應在該標記線上方1~1.5 cm切開腹膜反折,則會天然進入鄧氏筋膜前方[23]。這一鄧氏筋膜標記線,亦被命名為衛氏線,已成為開展iTME手術的核心指引標記。以衛氏線為引導,沿衛氏線下方切開即可順利進入鄧氏筋膜后方,施行完整保留鄧氏筋膜的直腸癌根治術iTME。
 圖1
示鄧氏筋膜術中標記線衛氏線及鄧氏筋膜完整保留的手術圖片
圖1
示鄧氏筋膜術中標記線衛氏線及鄧氏筋膜完整保留的手術圖片
a:鄧氏筋膜術中標記線—衛氏線;b:男性患者鄧氏筋膜完整保留的手術圖片;c:女性患者鄧氏筋膜完整保留的手術圖片
在理論上及實踐中均證實了iTME的可行性后,筆者開展了對比TME與iTME對中低位直腸癌患者神經功能保護及腫瘤根治度的多中心前瞻性隨機對照研究(PUF-01)。共有10余家國內大型醫院加入研究,納入了262例T1~4(前壁為T1~2)N0~2M0期男性中低位直腸癌患者,隨機分為接受傳統TME手術組(切除部分鄧氏筋膜)及iTME手術組(完整保留鄧氏筋膜)。結果表明,iTME患者術后2周排尿功能障礙率明顯降低(6.8% vs. 25.4%,P=0.003),勃起功能和射精功能障礙率也明顯下降(12.5% vs. 34.2%,P=0.023;10.0% vs. 29.4%,P=0.034)[9];而平均51.9個月的隨訪結果顯示,iTME與TME兩組患者的3年總體生存率(94.1% vs. 89.7%)、3年無瘤生存率(87.5% vs. 85.6%)、總復發率(15.6% vs. 15.0%)等腫瘤學指標差異均無統計學意義[10]。這一多中心隨機對照研究結果在實踐中證實了iTME對中低位直腸癌患者術后排尿及性功能保護的優效性,且并未影響腫瘤根治度,提示iTME應該成為特定分期及部位的中低位直腸癌患者的首選。
4 iTME的實施標準
4.1 iTME的適應證與禁忌證
首先,應該明確的是,iTME并不適用于所有直腸癌患者。根據《保留鄧氏筋膜全直腸系膜切除術(iTME)中國專家共識(2021 版)》[24]推薦,iTME的手術適應證為腫瘤下緣距肛緣<12 cm,T1~4(前壁腫瘤為T1~2期)N0~2M0期(AJCC第7版TNM分期);而由于目前尚缺乏直接的腫瘤學安全性證據,前壁T3期腫瘤或者可疑突破腸壁肌層以及可疑腫瘤侵犯鄧氏筋膜的患者,為iTME的手術禁忌證。
4.2 iTME手術操作流程
iTME與傳統TME手術的區別主要在于直腸前壁的解剖,其他手術步驟無區別。根據中低位直腸癌TME手術的操作流程,非直腸前壁部分游離如下:助手牽拉提起乙狀結腸?直腸系膜,在骶骨岬水平切開腹膜進入直腸后間隙,向頭側沿Toldt間隙分離,注意保持Gerota筋膜完整性;在腸系膜下動脈根部分離,根據腫瘤分期決定是否清掃第253組淋巴結,同時將腸系膜下動脈(inferior mesenteric artery,IMA)根部周圍纖維結締組織推開,在距離IMA根部0.5~1.0 cm處結扎IMA,以避免損傷腸系膜下叢;腸系膜下靜脈(inferior mesenteric vein,IMV)的結扎部位目前沒有定論,可以根據腫瘤分期,決定是否高位結扎IMV亦或平行于IMA水平結扎。處理根部血管后,繼續拓展Toldt間隙,沿左側結腸旁溝打開側腹膜,直至乙狀結腸?上段直腸系膜游離完畢。助手將直腸及其系膜牽向腹側,沿直腸后間隙銳性分離,保持腹下神經前筋膜完整性,以保護雙側腹下神經;向縱深切開骶骨?直腸筋膜,直至肛提肌水平或腫瘤下緣2 cm以上水平;向兩側沿直腸固有筋膜逐漸拓展直腸后間隙,至直腸側方緊貼直腸固有筋膜離斷,注意避免過度牽拉或過于靠近外側盆壁分離,避免下腹下神經叢和盆內臟神經損傷。
最后進行直腸前壁游離:沿衛氏線下方切開進入鄧氏筋膜后方,即直腸前間隙,在良好張力下可見鄧氏筋膜與直腸固有筋膜之間的疏松間隙,沿該間隙進行小口銳性分離,并向兩側拓展,從而與后方及側方分離的間隙相貫通。在男性中可隱約見到精囊腺和前列腺輪廓,但若見到串珠狀或葡萄狀精囊腺,說明已誤入鄧氏筋膜前方間隙,此時鄧氏筋膜已被部分切除;在女性亦可見到陰道后壁表面薄層膜狀結構,牽拉時該筋膜與陰道壁之間存在滑動。鄧氏筋膜完整保留的標志是在精囊腺和前列腺、或陰道后壁表面見到完整膜狀結構(圖1b和圖1c)。
5 iTME的應用現狀及未來
PUF-01多中心臨床研究在國內10余家醫療機構開展并順利完成。目前該研究成果已證實,與傳統TME手術相比,iTME具有更好的泌尿生殖功能保護作用,且不影響腫瘤根治效果,可成為特定分期及部位的男性中低位直腸癌患者的首選術式。目前iTME理念及手術已在國內多家醫療單位廣泛開展應用[25]。然而,目前iTME的適應證仍有很大的拓展空間。首先,與男性相比,女性患者泌尿生殖功能的客觀評估指標較少,評估難度相對更高,且女性鄧氏筋膜結構更具多樣性,特別是多胎分娩史女性,因此iTME是否同樣對女性中低位直腸癌患者具有優效的神經及功能保護作用,需要進一步研究探討。其次,考慮到放療可能對盆腔神經及泌尿生殖功能潛在的負性影響,PUF-01研究中并未納入新輔助放化療的直腸癌患者。對于這些患者,iTME是否同樣技術上可行,且具有功能保護的優勢,仍有待后續臨床研究證實。最后,我們同樣期待國外學者開展iTME相關臨床研究,以進一步明確并推廣iTME的適應性。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:方佳峰負責文章撰寫,衛洪波負責思路設計及文章審核。