引用本文: 楊洋, 鄭兆陽, 陳鵬, 馮曦, 魏永剛, 楊烈, 周總光. 結直腸癌伴同時性肝轉移行腹腔鏡同步切除手術的療效:回顧性隊列研究. 中國普外基礎與臨床雜志, 2024, 31(5): 547-554. doi: 10.7507/1007-9424.202402020 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
結直腸癌(colorectal cancer,CRC)是全球第3大常見的癌癥和第2大癌癥死亡疾病[1]。結直腸癌肝轉移(colorectal cancer liver metastasis,CRLM)嚴重影響患者的生存預后,有15%~25%的患者在確診CRC時即伴有同時性肝轉移(synchronous colorectal cancer liver metastasis,SCRLM)。絕大多數肝轉移灶初始無法獲得根治性(R0)切除,但其中一部分經治療后可以轉化為可切除或達到無瘤狀態(no evidence of disease,NED)。文獻[2-3]報道,肝轉移灶完全切除(R0)或達到NED后患者的中位生存期可從未經任何治療的6.9個月延長至35個月,5年生存率可達30%~57%。因此,手術完整切除原發灶和肝轉移灶是患者可獲得長期生存的最佳方案。
目前,SCRLM的手術方式可采用原發灶和肝轉移灶的一期同步切除(以下簡稱同步切除)或二期分階段切除(以下簡稱分期切除)。分期切除方案的單次手術時間相對短,術中、術后并發癥風險可能相對降低,但是需承受兩次麻醉手術的風險和費用,術后殘存病灶可能因機體免疫力下降出現進展。研究[4-7]顯示,與分期切除相比,同步切除術中總體出血量減少、住院時間縮短,且總體并發癥發生率、長期腫瘤學結果相當。此外,同步切除避免了需再次手術切除肝轉移灶或原發灶,降低術后殘存病灶進展導致手術機會喪失的風險;同時也避免了分期切除總住院時間長、治療費用高、患者及家屬身心負擔大等情況。與傳統開腹同步切除相比,腹腔鏡同步切除具有更良好的視野,可避免過長的手術切口,且可以共用穿刺孔兼顧2個不同部位的手術,避免了手術切口難以取舍的尷尬,最大限度地減少了手術創傷[8]。但由于腹腔鏡同步切除技術難度大,對患者的全身狀況、醫療團隊的技術和圍手術期管理水平要求更高,其安全性和腫瘤學有效性尚缺乏足夠的前瞻性臨床研究數據支持。現有回顧性研究[9]顯示,腔鏡組在術中出血和住院時間方面優于開腹組,但在圍手術期并發癥(Ⅲ/Ⅳ級)、R0切除率、長期腫瘤學及生存結果方面并未觀察到明顯優勢。因此,需要更多高質量的臨床研究對腔鏡同步切除的安全性和有效性進行論證。
四川大學華西醫院胃腸外科自2015年開始,基于CRC多學科協作診療(multi?disciplinary treatment,MDT)平臺,與肝臟外科團隊密切合作,開展了SCRLM的腹腔鏡同步切除手術。本研究基于單中心數據庫,對接受腹腔鏡同步切除手術的SCRLM患者的圍手術期情況、術后并發癥和生存狀況進行分析,旨在探討此種手術策略的安全性和近遠期療效。
1 資料與方法
1.1 納入與排除標準
回顧性收集2015年3月至2021年12月期間于四川大學華西醫院胃腸外科病房接受腹腔鏡同步切除手術的SCRLM患者的臨床資料。納入標準:接受腹腔鏡同步切除CRC原發灶及肝轉移灶;術后病理診斷為結直腸腺癌伴肝轉移;有完整的病歷資料及隨訪記錄。排除標準:常規探查后原發灶無法完全切除;中轉開腹;原發灶發生出血、梗阻、穿孔等行急診手術;CRC根治術后發生的異時性肝轉移或CRLM復發;術后病理診斷為原發性肝癌;存在不可處理的肝外轉移灶或合并其他未治愈的惡性腫瘤;病歷及隨訪資料不完整。
1.2 診斷及治療原則
確診CRC后,常規行胸部薄層CT掃描、全腹/盆腔增強CT,中低位直腸癌常規行直腸薄層核磁共振、經直腸超聲造影。對CT提示肝轉移灶的患者,加行上腹部MRI增強掃描和肝臟超聲造影,有條件的患者另外加行肝臟MRI增強掃描,以提高診斷準確率并評估可切除性。部分患者行正電子發射計算機斷層掃描(PET/CT)檢查評估腫瘤全身轉移情況。
當前NCCN國際指南(National Comprehensive Cancer Network)已經明確指出,對于肝轉移灶,手術切除是優先于射頻消融(radiofrequency ablation,RFA)的方式,故術中能夠實現手術完整切除的病灶,筆者團隊均采用手術切除。但若當肝轉移灶位置深在且病灶體積小(<2 cm)、或是預計肝切除術后殘肝容積不足、肝內散在多發轉移,或是患者全身狀況無法承受手術切除所帶來的風險時,則考慮行局部RFA治療。此外,對于僅依靠肝切除術無法達到NED的患者,若殘肝的轉移灶數量不超過3個且最大直徑<3 cm,筆者團隊計劃先切除部分較大的肝轉移灶,對剩余直徑<3 cm的病灶進行RFA,以達到NED,提高5年生存率[2, 10-12]。
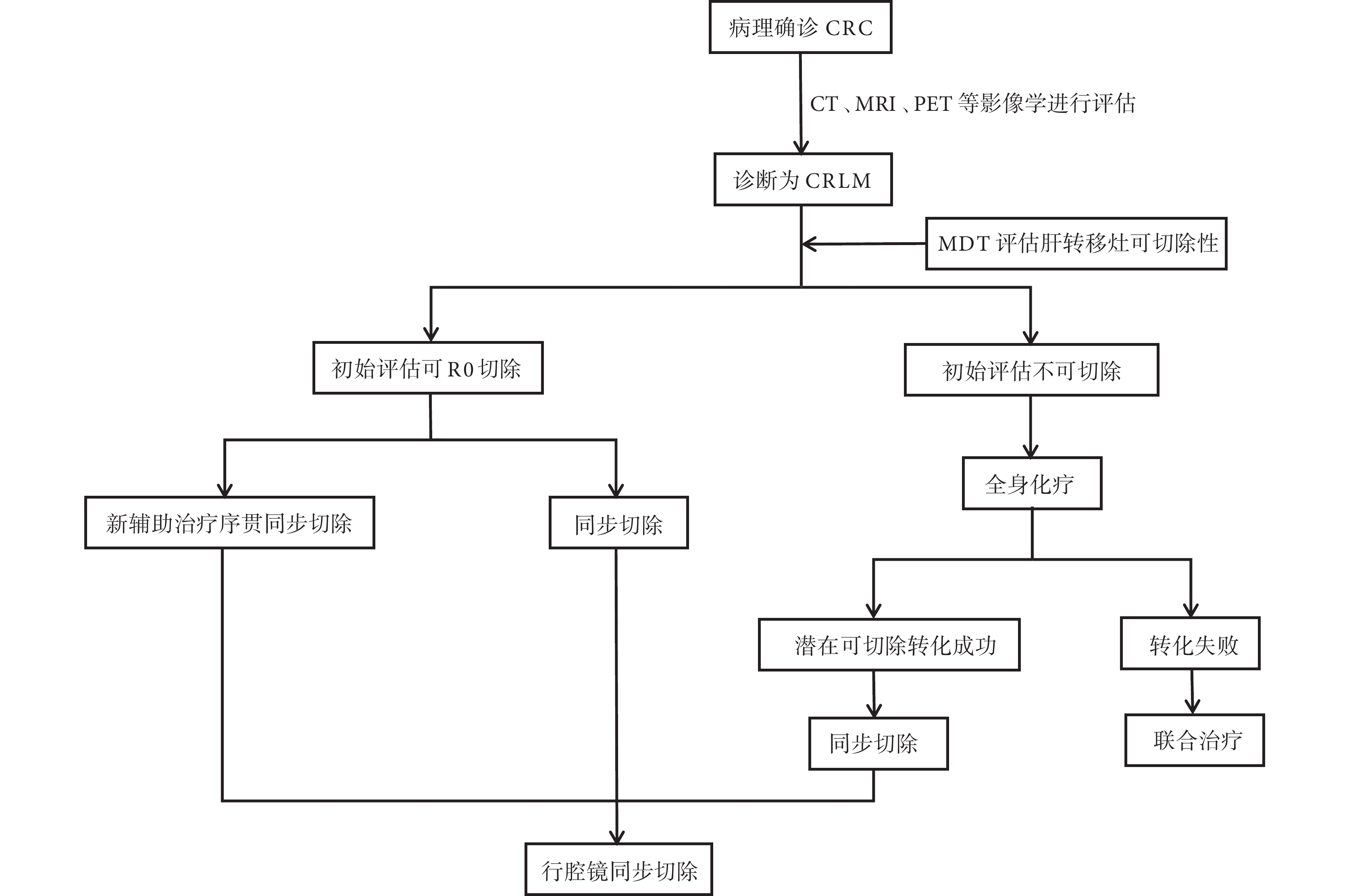
據此,本研究將納入的患者分為初始評估可切除和不可切除2組。對肝轉移灶初始評估可切除且原發灶無出血、梗阻、穿孔的患者,除轉移灶在技術上切除容易且無不良預后因素 [臨床危險評分(clinical risk score,CRS)<3分]外,均行術前新輔助治療序貫同步切除。對肝轉移灶初始評估不可切除的患者,行全身化療(聯合或不聯合靶向藥物)后再次評估可切除性,若潛在可切除轉化成功者,行同步切除;若轉化失敗,則依據患者的可耐受程度進行聯合治療[2]。見圖1。
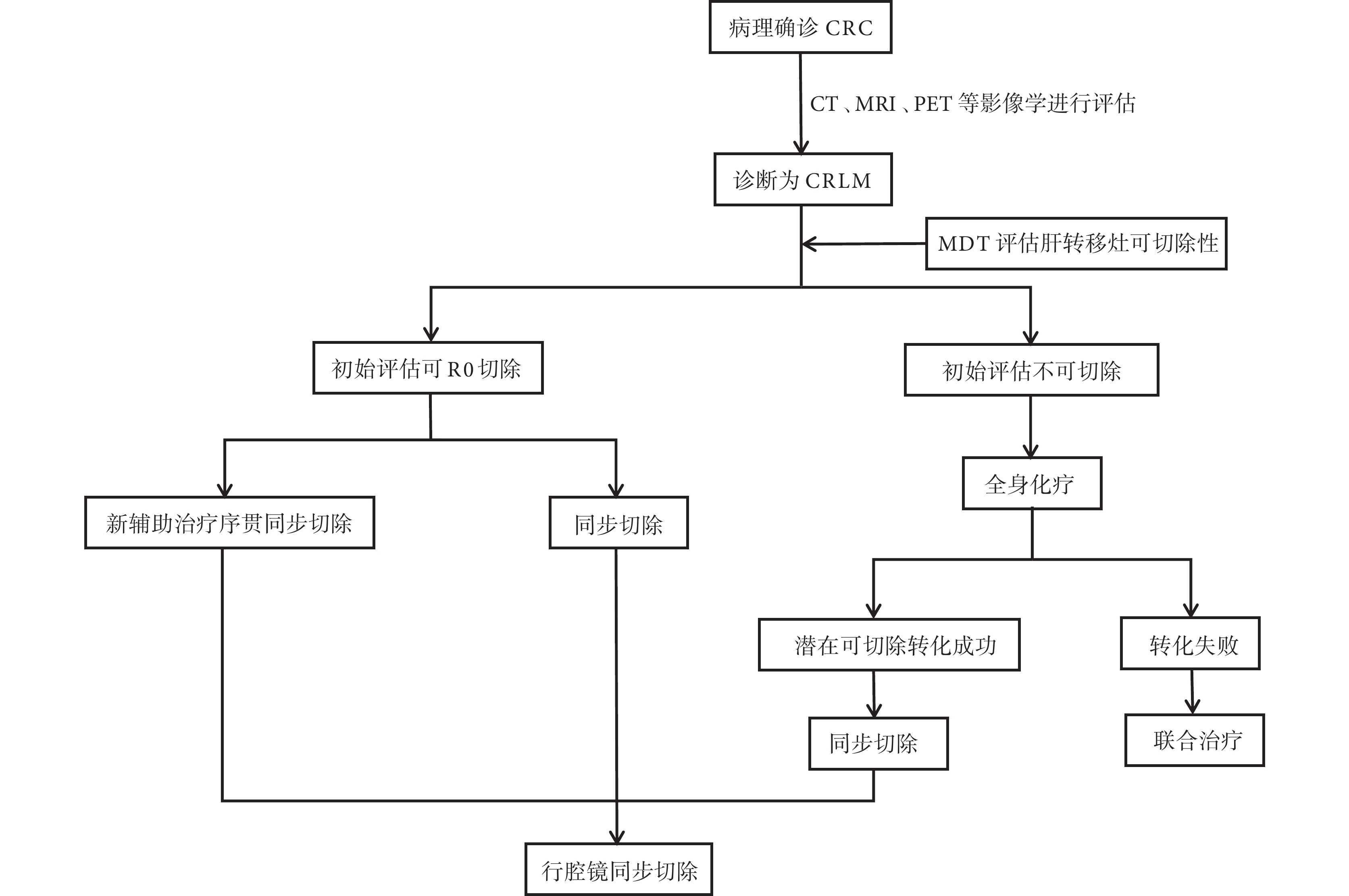 圖1
示診斷及治療流程圖
圖1
示診斷及治療流程圖
1.3 手術方式
所有計劃行腔鏡同步切除的患者均由具備豐富腹腔鏡手術經驗的胃腸外科醫師和肝臟外科醫師協作完成手術。因肝臟腫瘤切除術中常采取肝門阻斷以減少術中出血,當門靜脈被阻斷后將影響胃腸道靜脈血回流,故本團隊選擇優先行肝臟手術,以盡量避免入肝血流阻斷對腸道吻合口的影響。腹腔鏡肝臟切除術通常采用5孔法,術中常規行腔鏡超聲探查肝臟,以明確病灶情況和肝內重要管道的結構位置。對于某些肝轉移灶解剖位置不佳、手術切除難度較大或預估殘肝體積不足者,采用腹腔鏡肝切除聯合術中RFA的手術方案,以爭取實現NED。腹腔鏡CRC根治術通常采用5孔法,可與腔鏡肝切除術共用部分穿刺孔,并根據需要另增加穿刺孔。根據不同手術階段變化體位,并遵循腫瘤根治原則[13]。
1.4 結局指標
觀察隨訪患者的圍手術期情況、術后30 d并發癥及生存狀況。圍手術期情況:記錄CRC原發灶和肝轉移灶的手術方式、手術時間、術中失血量、術中輸血情況、首次排氣及首次進食時間、術后疼痛評分、術后住院時間;術后30 d并發癥:包括乳糜漏、切口感染、腹腔感染、吻合口漏、膽漏、胸腔積液、肺部感染等;生存狀況:以電話或門診等方式進行隨訪,記錄術后第1、2、3年的無瘤生存(disease free survival,DFS)率和總體生存(overall survival,OS)率,并以CRS評分將患者分為高危組(3~5分)和低危組(0~2分),分別對比2組患者中接受新輔助治療和未接受新輔助治療患者的DFS和OS狀況。
1.5 統計學方法
采用SPSS 26.0軟件包進行統計分析。符合正態分布的計量資料以均數±標準差( ±s)表示,采用成組t或t’檢驗進行組間比較;不符合正態分布的以中位數(上下四分位數)、[M(P25,P75)]表示,采用成組秩和檢驗進行組間比較;計數資料以例(%)表示,采用成組χ2檢驗或Fisher確切概率法進行組間比較;采用Kaplan-Meier法繪制生存曲線,采用log-rank檢驗進行生存分析。檢驗水準α=0.05。
±s)表示,采用成組t或t’檢驗進行組間比較;不符合正態分布的以中位數(上下四分位數)、[M(P25,P75)]表示,采用成組秩和檢驗進行組間比較;計數資料以例(%)表示,采用成組χ2檢驗或Fisher確切概率法進行組間比較;采用Kaplan-Meier法繪制生存曲線,采用log-rank檢驗進行生存分析。檢驗水準α=0.05。
2 結果
2.1 病例資料
共有36例患者滿足標準納入分析,其中男26例(72.2%),女10例(27.8%);年齡25~81歲、(57.4±13.9)歲;BMI 17.0~28.7 kg/m2、(22.9±2.7)kg/m2;美國麻醉醫師協會(American Society of Anesthesiologists,ASA)評分:Ⅱ級28例(77.8%),Ⅲ級8例(22.2%);術前CEA:2.0~50.7 ng/mL、(9.8±1.9)ng/mL。原發灶位置:右半結腸5例(13.9%),左半結腸10例(27.8%),直腸20例(55.6%),多原位癌1例(2.8%)。術后病理結果:原發灶最大徑1.5~8.0 cm、(3.6±1.7)cm;pT1~2期3例(8.3%),pT3~4期32例(88.9%),還有1例(2.8%)行新輔助治療后原發灶未見癌殘留,考慮治療后改變(pT0);pN0期16例(44.4%),pN1~2期20例(55.6%);術中清掃淋巴結6~48枚/例、(16.7±9.7)枚/例;肝轉移灶單發18例(50.0%),多發單葉7例(19.4%),多發雙葉11例(30.6%);肝轉移灶最大徑0.3~4.0 cm、(1.7±1.1)cm。R0切除率為100%。26例(72.2%)術前行新輔助治療,其中5例(13.9%)聯合分子靶向藥物。
2.2 術中情況
36例患者均全程在腹腔鏡下完成原發灶和肝轉移灶的同步切除。5例(13.9%)行右半結腸切除術,4例(11.1%)行左半結腸切除術,7例(19.4%)行乙狀結腸切除術,20例(55.6%)行直腸癌根治術[12例低位前切除、1例超低位前切除、1例經括約肌間切除]。28例(77.8%)行非解剖性肝切除(包括楔形切除3例、局部切除25例),8例(22.2%)行解剖性肝切除 [包括4例左外葉(Ⅱ+Ⅲ段)切除、2例尾狀葉(Ⅰ段)切除、1例中葉切除(Ⅳ+Ⅴ+Ⅷ段)和1例左內葉(Ⅳ段)+右后葉(Ⅵ+Ⅶ段)切除]。另有2例患者同時行腹腔鏡膽囊切除術。所有患者均接受肝臟病灶切除或肝臟病灶切除+術中RFA),且均達到NED。手術時間191~491 min、(328.9±85.8)min;術中失血量20~600 mL、100(50,150)mL,其中4例(11.1%)術中輸血。
2.3 術后恢復情況
36例患者的首次排氣時間1~4 d、(2.9±0.8)d,首次進食時間2~6 d、(3.2±1.0)d,術后1~3 d平均視覺模擬量表(visual analogue scale,VAS)評分1.1~2.3分、(1.9±0.3)分,術后住院時間4~23 d、(6.8±4.3)d。5例(13.9%)術后30 d內發生并發癥,其中1例(2.8%)術后5 d發生切口感染,1例(2.8%)于術后第3天出現少量胸腔積液,另有1例(2.8%)術后4 d發生腹腔感染,3例(8.3%)術后6 d發生腹腔乳糜漏,以上并發癥均經保守治療后痊愈。術后30 d內無嚴重并發癥(Clavien-Dindo并發癥Ⅲ/Ⅳ級)發生,無死亡病例。
2.4 生存狀況
對36例患者進行術后隨訪,隨訪時間2.1~61.9個月,中位隨訪24.7個月。15例(41.7%)出現復發轉移征象,其中10例(27.8%)肝轉移復發,并有5例(13.9%)行二次甚至多次肝切除;2例(5.6%)肺轉移,均行輔助放化療;1例(2.8%)右側附件轉移,行輔助化療;2例(5.6%)多發淋巴結轉移,1例(2.8%)于術后第13個月因腫瘤全身廣泛轉移死亡,另1例行輔助化療。術后1、2、3年DFS率分別為89.8%、55.0%、29.2%,1、2、3年OS率分別為100%、100%、87.5%。
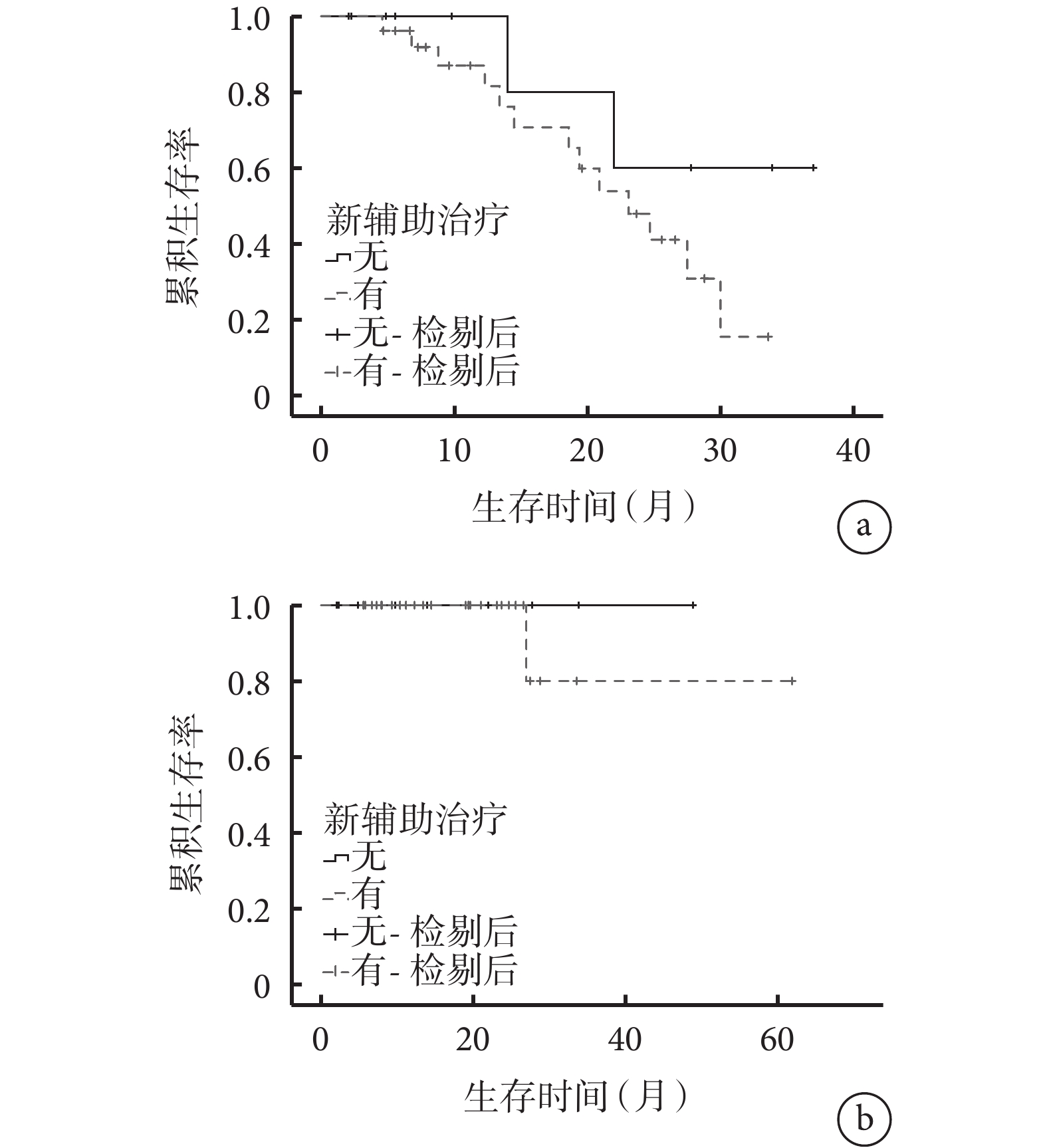
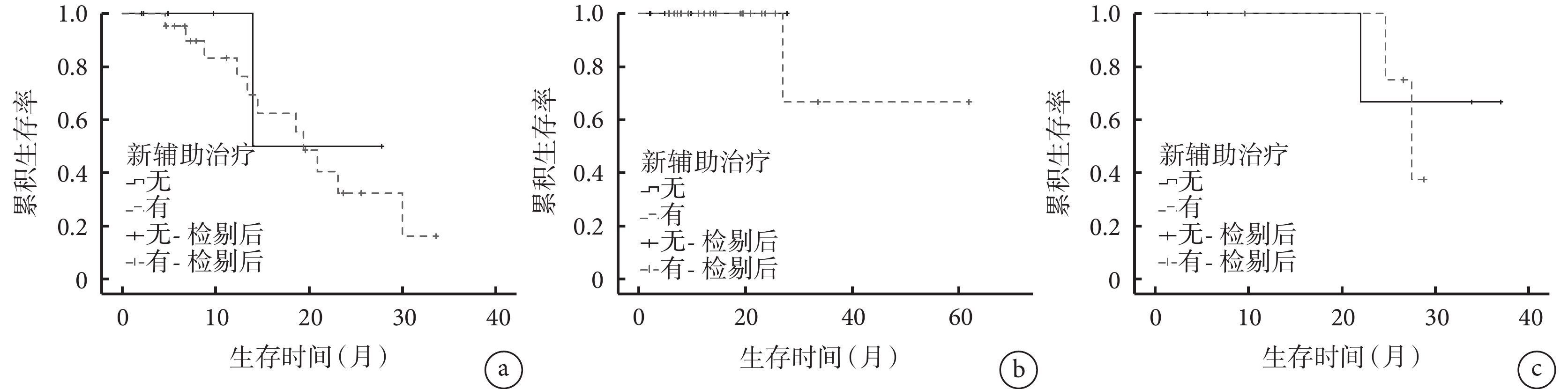
以是否行新輔助治療將患者分為新輔助治療組(n=26)和未行新輔助治療組(n=10),并進行亞組分析。結果顯示,2組的基線資料比較差異均無統計學意義(P>0.05),見補充材料1,新輔助治療組中13例(50.0%)出現復發轉移征象,死亡1例(3.8%);未行新輔助治療組中2例(20.0%)出現復發轉移征象,無死亡病例。2組的DFS(χ2=1.675,P=0.196)和OS(χ2=0.600,P=0.439)比較差異均無統計學意義(圖2)。以CRS進行風險分層,低風險組(n=27)中21例接受新輔助治療,6例未接受新輔助治療,二者的DFS(χ2=0.237,P=0.627)和OS(χ2=0.333,P=0.564)比較差異無統計學意義;高風險組(n=9)中5例接受新輔助治療,4例未接受新輔助治療,二者的DFS比較差異無統計學意義(χ2=0.096,P=0.757),見圖3,此組患者中無死亡病例。
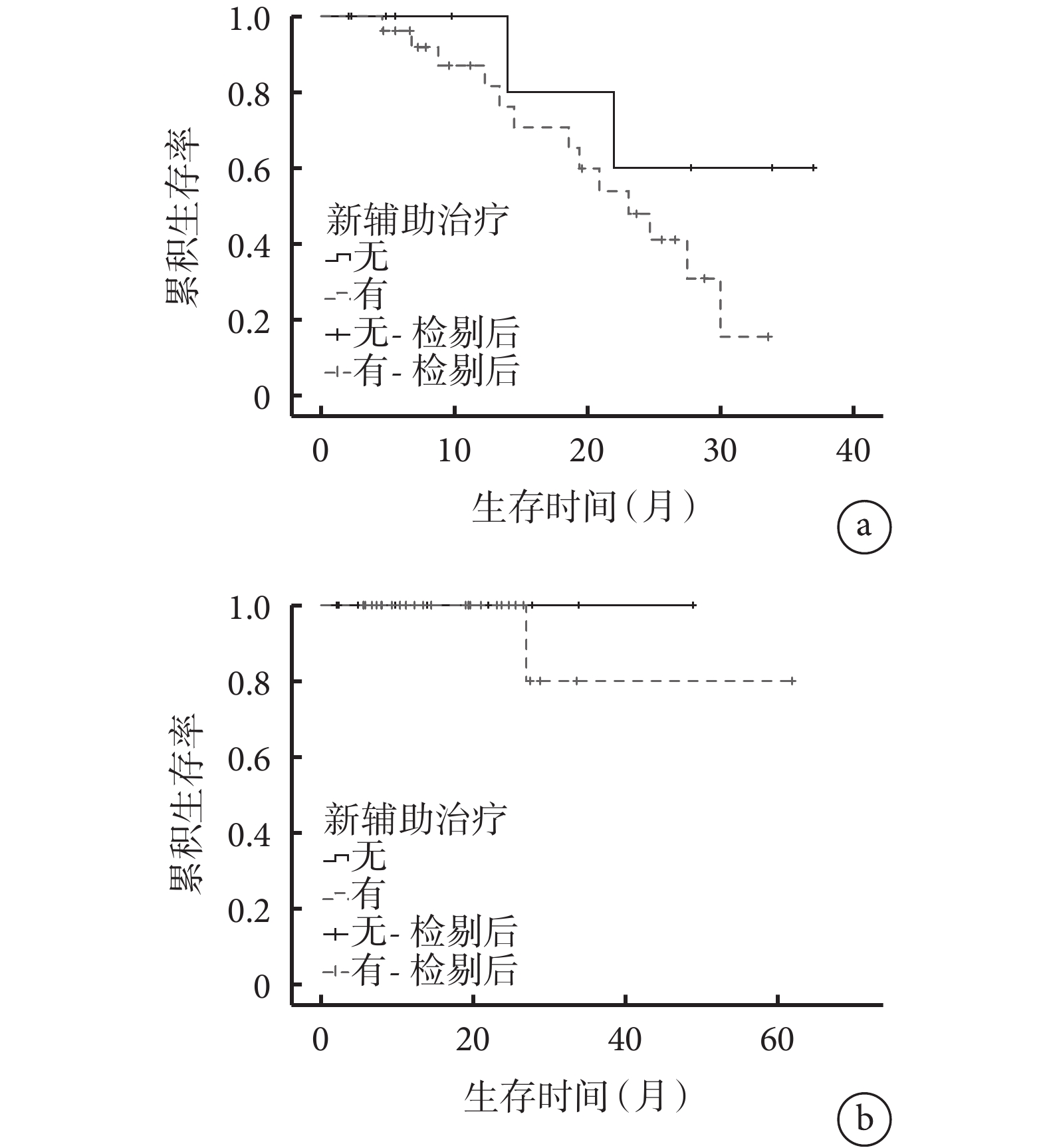 圖2
示新輔助治療組和未行新輔助治療組患者的DFS(a)和OS(b)曲線
圖2
示新輔助治療組和未行新輔助治療組患者的DFS(a)和OS(b)曲線
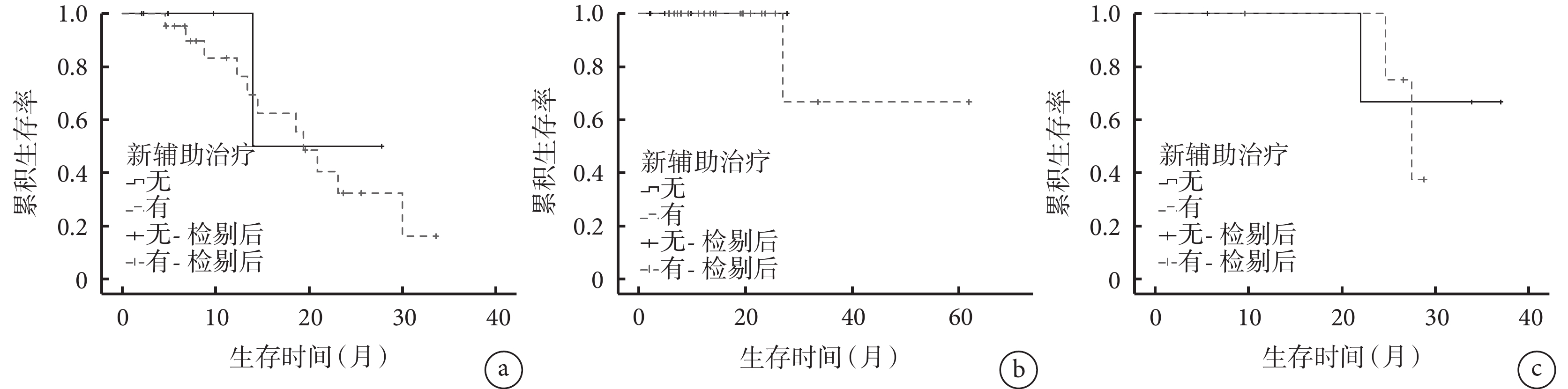 圖3
示CRS低、高風險患者接受新輔助治療和未行新輔助治療的DFS和OS曲線
圖3
示CRS低、高風險患者接受新輔助治療和未行新輔助治療的DFS和OS曲線
a:CRS低風險患者接受新輔助治療和未行新輔助治療的DFS曲線;b:CRS低風險患者接受新輔助治療和未行新輔助治療的OS曲線;c:CRS高風險患者接受新輔助治療和未行新輔助治療的DFS曲線
3 討論
3.1 新輔助治療在可切除CRLM中的可行性
相較于CRC異時性肝轉移(metachronous liver metastases),SCRLM的生物學特性更高危、預后更差[14]。當前指南[2]推薦所有CRLM患者接受MDT協作診療,根據術前評估,確定個體化的治療目標和綜合治療方案。由于達到NED后,患者的生存期明顯延長,故對肝轉移灶初始評估潛在可切除的患者,應積極予以轉化治療后再行手術切除,以爭取NED為目標。而對肝轉移灶初始評估可R0切除的患者,是否接受術前新輔助治療仍無統一標準。目前比較認同的是按CRS評分進行復發風險分層,評分越高,術后復發率越高,新輔助化療獲益越大[2, 10, 15]。研究[16-17]顯示,與直接手術相比,術前新輔助治療可改善初始可切除CRLM患者的DFS,但2組OS未見顯著差異。一項多中心觀察性研究[18]指出,術前行FOLFOX新輔助化療方案并不能顯著提高可切除CRLM患者的DFS。Ayez等[19]報道,對于高風險患者(CRS 3~5分),新輔助化療組的OS顯著優于直接手術組;而對于低風險患者(CRS 0~2分),2組OS的差異無統計學意義。因此,需進行更多高質量的前瞻性試驗,以評估新輔助治療在可切除CRLM患者中的作用。
3.2 同步或分期手術治療CRLM
目前,手術完全切除肝轉移灶仍是治療CRLM的金標準,因此符合條件的患者均應適時接受手術治療。NCCN指南指出,對于同時性肝轉移,可以同期或分期切除原發灶和肝轉移灶,然而,對于兩種手術策略的選擇標準和優劣尚無定論。Lillemoe等[20]對兩種手術策略進行綜述后指出,與分期手術相比,接受同步切除的患者病灶通常更容易處理,如較小或較少的肝轉移灶,且原發灶大多位于右半結腸;此外,同步切除策略延長手術時間、常需過長和(或)多個切口、手術創傷大,可能使圍手術期并發癥風險增加。多學科國際指南推薦同步切除用于治療可通過手術達到CRC原發灶和肝轉移灶R0切除的SCRLM[14]。中國結直腸癌肝轉移診斷和綜合治療指南(2023)[2]指出,對肝轉移灶小且多位于周邊或局限于半肝,肝切除量<60%,肝門部淋巴結、腹腔或其他遠處轉移均可手術切除的患者建議同步切除。作為首個比較SCRLM同步切除和分期切除的RCT試驗—METASYNC研究[21]表明,2組患者術中及術后并發癥發生率均未見顯著差異,但同步切除組術后2年OS有延長趨勢,支持對于初始可切除SCRLM患者采用同步切除。需注意的是,肝優先模式的分期手術并未在此研究中提出,因此無法判斷其與同步切除的優劣。Gavriilidis等[22]將32項回顧性研究進行薈萃分析后發現,分期切除(腸優先模式或肝優先模式)和同步切除這3種手術策略在嚴重并發癥(Ⅲ/Ⅳ級)和5年OS方面差異均無統計學意義。一項基于LiverMetSurvey數據庫的研究認為,手術策略的選擇應以肝轉移灶的腫瘤負荷作為參考,對于多發雙葉的SCRLM,肝轉移灶的腫瘤負荷更大,此時肝優先模式的分期手術較其他兩種手術策略有著更可觀的長期預后,據此Giuliante等[23]建議將此種術式作為多發雙葉SCRLM患者的標準術式。可見,對于分期切除(腸優先模式或肝優先模式)和同步切除的腫瘤學療效及選擇標準尚未形成共識,亟需高質量臨床研究提供證據。
3.3 腹腔鏡或開腹手術治療CRLM
目前,NCCN指南已推薦腹腔鏡結腸癌根治術可常規開展,腹腔鏡直腸癌根治術可由具有足夠腔鏡經驗的術者或在臨床研究中實施[24-25]。由于肝臟的解剖學特征較復雜,且較難翻動、顯露等,因此腹腔鏡肝切除術(laparoscopic hepatectomy,LH),尤其是腹腔鏡解剖性肝切除術(anatomic laparoscopic hepatectomy,ALH)需要較長的學習曲線,其安全性和腫瘤學療效尚存爭議,限制了其普及。因此,腔鏡同步切除的爭議主要在于腹腔鏡肝轉移灶切除的技術難度和腫瘤學療效。研究[26-27]顯示,對CRLM行LH,患者的無復發生存(recurrence free survival,RFS)、DFS、5年OS率與開腹肝切除術相當,甚至在3年OS率上表現更好。近期的一項薈萃研究[28]表明,相比開腹同步切除,SCRLM行腔鏡同步切除的RFS更優,但研究者指出更低的RFS可能是由選擇偏倚所致,因為符合腹腔鏡手術條件的患者肝轉移灶數目通常較開腹手術少,而肝轉移灶數目≥5個是CRLM的陽性預后因素,反映了更晚期的系統性疾病;并且接受開腹手術的患者恢復慢,更晚開始進行術后輔助化療,復發風險可能更高。據此,Morarasu等[28]指出,腔鏡同步切除對于部分SCRLM患者來說是一種安全可行的術式。以上研究可得,盡管腔鏡同步切除的學習曲線更長,但腹腔鏡手術的優勢使其能夠將腹內臟器損傷風險降到最低,進而減少術中出血、加快患者康復、縮短住院時間、降低并發癥發生率等。因此,若能保證CRC原發灶實現R0切除,就應充分評估肝轉移灶情況和SCRLM患者的全身狀況,對于技術成熟的單位,腔鏡同步切除可成為優選的術式。
3.4 RFA在CRLM中的應用
RFA是初始評估不可切除CRLM的一種重要治療手段,通常應用于術中,與肝切除術聯合,作為CRLM的一站式手術策略[29]。然而,對于初始評估可切除的CRLM,RFA的作用仍存在爭議。目前RFA主要用于治療單個且直徑<3 cm的可切除CRLM,以替代手術切除。一項基于傾向性匹配得分的回顧性研究[29]顯示,對于可切除的CRLM,手術切除+RFA的治療策略或許是一種比單純肝切除術更好的方式,因為此種方法可避免大范圍的肝切除,術后肝功能不全發生率較低、術后住院時間顯著縮短,且腫瘤學結果相當。當前我國最新指南建議同步切除時,若患者預期術后殘余肝臟體積過小,可先切除部分較大的肝轉移灶,對剩余直徑<3 cm的轉移病灶進行RFA[2, 10]。此外,由于CRLM行肝轉移灶切除后仍有較高的復發風險,常需再次手術切除復發病灶,以延長生存期,因此目前多采用保留實質的肝切除術(parenchyma-sparing hepatectomy,PSH),以盡可能保留正常肝實質和肝內主要管道。OSLO-COMET RCT試驗[30]表明,對采用PSH的CRLM患者來說,腹腔鏡組較開腹組住院時間更短、術后并發癥更少;術后隨訪4個月,2組的費用相同,但腹腔鏡組的質量調整壽命年增加了0.011年,故研究者認為腹腔鏡組的經濟效益更優。因此,本團隊基于現有臨床研究和相關指南,采取手術切除+RFA的聯合方案。其優勢在于:避免大范圍切肝,減少輸血需求、降低術后肝功能衰竭風險;達到PSH的目標,為后期肝切除提供基礎;更有效提高NED率,改善術后長期生存[29, 31]。
3.5 本團隊研究結果及結論
最終納入本研究的患者共36例。其中,接受新輔助化療聯合或不聯合分子靶向藥物者26例,未接受新輔助化療者10例,2組術后DFS和OS相當。按CRS評分分層,低風險組(n=27)中接受新輔助治療21例,未接受新輔助治療6例,術后隨訪未觀察到二者的DFS和OS的差異存在統計學意義。高風險組(n=9)中接受新輔助治療5例,未接受新輔助治療4例,術后隨訪二者的DFS差異無統計學意義,且此組中無患者死亡。本組病例支持低風險患者行新輔助化療不能獲益的文獻報道結果;局限于有限的病例數,高風險患者行新輔助化療未顯示出優勢,但筆者認為新輔助治療應作為高風險患者的常規治療,主要基于以下考慮:新輔助化療可作為評價化療方案敏感度的依據,指導術后化療方案的選擇;新輔助化療殺滅潛在的微轉移灶,可能更利于患者獲得遠期的生存獲益。此外,對于CRLM可達到NED的患者,筆者團隊總體傾向均需新輔助治療,即便為低風險患者。NCCN指南目前指出,對于直腸癌伴肝轉移患者,均需要進行新輔助治療;對于結腸癌伴可切除肝轉移患者,盡管指南推薦可先行新輔助化療,也可以先手術,但是結合國內外文獻,大多數學者支持新輔助化療后手術,筆者團隊對此也持支持意見。對于以下情況的CRLM,即肝轉移灶較小(2~3 cm以下)、術前評估為3個及以下并局限于同一肝段,筆者團隊優先手術治療,因為風險度低,且化療后病灶極可能消失,導致術中無法找到病灶。
基于PSH的優勢,筆者團隊對大部分(77.8%)患者實施非解剖性肝切除,另部分(22.2%)未滿足PSH條件的患者則實施解剖性肝切除,同時積極聯合術中RFA,以爭取NED。術后30 d內最常見的并發癥為腹腔乳糜漏(8.3%),切口感染、腹腔感染、胸腔積液各有1例(2.8%),均通過保守治療后痊愈,未出現膽漏、吻合口漏、術后肝功能衰竭等嚴重并發癥。術后總并發癥發生率為13.9%,與文獻報道同步切除手術的并發癥發生率22.3%(7.1%~50%)[28]相比,本研究結果顯示,同期腔鏡下切除短期療效滿意,具有可靠的安全性。
本組病例術后中位隨訪24.7個月(2.1~61.9)個月,術后1、2、3年的DFS率分別為89.8%、55.0%、29.2%,1、2、3年OS率分別為100%、100%、87.5%。Ozair等[27]的薈萃分析表明,對于接受微創同步或分期切除的CRLM 患者,在RCT研究中,術后第1、3年的DFS率分別為69.8%、33.1%,而在觀察性研究中,該數據分別為64.6%、33.3%;在RCT研究中,術后第1、3的OS率分別為94.0%、72.9%,而在觀察性研究中,該數據分別為92.1%、67.2%。一項在SCRLM患者中比較開腹與腔鏡同步切除的研究[32]的腫瘤學結果顯示,腔鏡組術后第1、3年的DFS率分別為56%、35%,術后第1、3年的OS率分別為100%、73%,且與開腹組相比差異無統計學意義。與既往文獻報道同步切除的數據相比,本研究結果顯示,腔鏡同步切除具有滿意的腫瘤學療效。
本研究中總體復發率為41.7%,最常見的部位為肝臟(27.8%);另有2例(5.6%)肺轉移,2例(5.6%)多發淋巴結轉移和1例(2.8%)右側附件轉移;只有1例(2.8%)患者術后約1年因腫瘤全身轉移死亡。本研究結果顯示,同時性肝轉移術后復發主要在肝臟和其他遠處器官,原發灶復發風險低,提示對于同時性肝轉移的治療策略的制定應以肝臟和遠處轉移的復發風險評估作為主要的指標。
4 小結
綜上,本研究結果顯示,對于經過篩選、符合腹腔鏡手術條件的SCRLM患者來說,腔鏡同步切除是一種安全可行的手術策略,并可使患者獲得滿意的生存獲益。但由于本研究樣本量較小,未來亟需更多高質量的臨床研究,以進一步證實此種手術策略的安全性與可行性。此外,基于腔鏡同步切除較高的技術難度,建議在有足夠腔鏡肝切除和腔鏡CRC手術積累的團隊開展。
四川大學華西醫院胃腸外科CRC MDT團隊對于SCRLM的腹腔鏡同步切除的策略和技術,基于現有指南、臨床證據,結合臨床實踐,總結了以下要點:圍手術期患者的安全是整個手術計劃的首要考慮因素,需根據患者的基礎身體情況,原發病灶手術風險及肝臟繼發病灶術后風險來共同判斷預測患者術后可能出現的并發癥及患者的耐受能力,術前由胃腸及肝臟外科醫生共同討論各自專業的手術風險并共同評估患者的手術耐受力,原則上不制定超過患者耐受極限的治療方案,充分保證患者術后順利恢復;同期切除理論上能在更短的時間內降低患者體內的腫瘤負荷,根據筆者團隊的經驗,在能夠保證患者安全的情況下優先推薦同期腹腔鏡切除;對于肝臟內存在散發的病灶初期未立即手術治療的患者,由于肝內病灶對化療治療有效將使其體積縮小,筆者團隊建議在化療期間密切關注肝內病灶體積的變化情況,若肝內某個病灶體積縮小到1.5 cm以下甚至更小,術中尋找該病灶的難度將明顯升高,MDT在制定患者手術時機時應當適當提前,以利于在手術中盡量找到所有的病灶;手術前充分利用多種影像學手段以明確肝內病灶,充分結合不同檢查手段的優勢;同期切除手術優先行肝臟手術,以盡量避免入肝血流阻斷對腸道吻合口的影響;術中常規使用術中超聲幫助尋找肝內腫瘤,術前常規對患者注入小劑量吲哚菁綠以便術中利用熒光尋找腫瘤。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:楊洋進行臨床資料收集、數據分析;鄭兆陽協助數據收集、數據分析并撰寫稿件;陳鵬協助數據收集及數據分析;馮曦和魏永剛指導稿件修改;楊烈負責研究方案設計、研究過程管理和稿件的修改;周總光提供研究思路和修改稿件。
倫理聲明:本研究已通過四川大學華西醫院生物醫學倫理審查委員會批準[批文編號:2024年審(561)號)]。
結直腸癌(colorectal cancer,CRC)是全球第3大常見的癌癥和第2大癌癥死亡疾病[1]。結直腸癌肝轉移(colorectal cancer liver metastasis,CRLM)嚴重影響患者的生存預后,有15%~25%的患者在確診CRC時即伴有同時性肝轉移(synchronous colorectal cancer liver metastasis,SCRLM)。絕大多數肝轉移灶初始無法獲得根治性(R0)切除,但其中一部分經治療后可以轉化為可切除或達到無瘤狀態(no evidence of disease,NED)。文獻[2-3]報道,肝轉移灶完全切除(R0)或達到NED后患者的中位生存期可從未經任何治療的6.9個月延長至35個月,5年生存率可達30%~57%。因此,手術完整切除原發灶和肝轉移灶是患者可獲得長期生存的最佳方案。
目前,SCRLM的手術方式可采用原發灶和肝轉移灶的一期同步切除(以下簡稱同步切除)或二期分階段切除(以下簡稱分期切除)。分期切除方案的單次手術時間相對短,術中、術后并發癥風險可能相對降低,但是需承受兩次麻醉手術的風險和費用,術后殘存病灶可能因機體免疫力下降出現進展。研究[4-7]顯示,與分期切除相比,同步切除術中總體出血量減少、住院時間縮短,且總體并發癥發生率、長期腫瘤學結果相當。此外,同步切除避免了需再次手術切除肝轉移灶或原發灶,降低術后殘存病灶進展導致手術機會喪失的風險;同時也避免了分期切除總住院時間長、治療費用高、患者及家屬身心負擔大等情況。與傳統開腹同步切除相比,腹腔鏡同步切除具有更良好的視野,可避免過長的手術切口,且可以共用穿刺孔兼顧2個不同部位的手術,避免了手術切口難以取舍的尷尬,最大限度地減少了手術創傷[8]。但由于腹腔鏡同步切除技術難度大,對患者的全身狀況、醫療團隊的技術和圍手術期管理水平要求更高,其安全性和腫瘤學有效性尚缺乏足夠的前瞻性臨床研究數據支持。現有回顧性研究[9]顯示,腔鏡組在術中出血和住院時間方面優于開腹組,但在圍手術期并發癥(Ⅲ/Ⅳ級)、R0切除率、長期腫瘤學及生存結果方面并未觀察到明顯優勢。因此,需要更多高質量的臨床研究對腔鏡同步切除的安全性和有效性進行論證。
四川大學華西醫院胃腸外科自2015年開始,基于CRC多學科協作診療(multi?disciplinary treatment,MDT)平臺,與肝臟外科團隊密切合作,開展了SCRLM的腹腔鏡同步切除手術。本研究基于單中心數據庫,對接受腹腔鏡同步切除手術的SCRLM患者的圍手術期情況、術后并發癥和生存狀況進行分析,旨在探討此種手術策略的安全性和近遠期療效。
1 資料與方法
1.1 納入與排除標準
回顧性收集2015年3月至2021年12月期間于四川大學華西醫院胃腸外科病房接受腹腔鏡同步切除手術的SCRLM患者的臨床資料。納入標準:接受腹腔鏡同步切除CRC原發灶及肝轉移灶;術后病理診斷為結直腸腺癌伴肝轉移;有完整的病歷資料及隨訪記錄。排除標準:常規探查后原發灶無法完全切除;中轉開腹;原發灶發生出血、梗阻、穿孔等行急診手術;CRC根治術后發生的異時性肝轉移或CRLM復發;術后病理診斷為原發性肝癌;存在不可處理的肝外轉移灶或合并其他未治愈的惡性腫瘤;病歷及隨訪資料不完整。
1.2 診斷及治療原則
確診CRC后,常規行胸部薄層CT掃描、全腹/盆腔增強CT,中低位直腸癌常規行直腸薄層核磁共振、經直腸超聲造影。對CT提示肝轉移灶的患者,加行上腹部MRI增強掃描和肝臟超聲造影,有條件的患者另外加行肝臟MRI增強掃描,以提高診斷準確率并評估可切除性。部分患者行正電子發射計算機斷層掃描(PET/CT)檢查評估腫瘤全身轉移情況。
當前NCCN國際指南(National Comprehensive Cancer Network)已經明確指出,對于肝轉移灶,手術切除是優先于射頻消融(radiofrequency ablation,RFA)的方式,故術中能夠實現手術完整切除的病灶,筆者團隊均采用手術切除。但若當肝轉移灶位置深在且病灶體積小(<2 cm)、或是預計肝切除術后殘肝容積不足、肝內散在多發轉移,或是患者全身狀況無法承受手術切除所帶來的風險時,則考慮行局部RFA治療。此外,對于僅依靠肝切除術無法達到NED的患者,若殘肝的轉移灶數量不超過3個且最大直徑<3 cm,筆者團隊計劃先切除部分較大的肝轉移灶,對剩余直徑<3 cm的病灶進行RFA,以達到NED,提高5年生存率[2, 10-12]。
據此,本研究將納入的患者分為初始評估可切除和不可切除2組。對肝轉移灶初始評估可切除且原發灶無出血、梗阻、穿孔的患者,除轉移灶在技術上切除容易且無不良預后因素 [臨床危險評分(clinical risk score,CRS)<3分]外,均行術前新輔助治療序貫同步切除。對肝轉移灶初始評估不可切除的患者,行全身化療(聯合或不聯合靶向藥物)后再次評估可切除性,若潛在可切除轉化成功者,行同步切除;若轉化失敗,則依據患者的可耐受程度進行聯合治療[2]。見圖1。
 圖1
示診斷及治療流程圖
圖1
示診斷及治療流程圖
1.3 手術方式
所有計劃行腔鏡同步切除的患者均由具備豐富腹腔鏡手術經驗的胃腸外科醫師和肝臟外科醫師協作完成手術。因肝臟腫瘤切除術中常采取肝門阻斷以減少術中出血,當門靜脈被阻斷后將影響胃腸道靜脈血回流,故本團隊選擇優先行肝臟手術,以盡量避免入肝血流阻斷對腸道吻合口的影響。腹腔鏡肝臟切除術通常采用5孔法,術中常規行腔鏡超聲探查肝臟,以明確病灶情況和肝內重要管道的結構位置。對于某些肝轉移灶解剖位置不佳、手術切除難度較大或預估殘肝體積不足者,采用腹腔鏡肝切除聯合術中RFA的手術方案,以爭取實現NED。腹腔鏡CRC根治術通常采用5孔法,可與腔鏡肝切除術共用部分穿刺孔,并根據需要另增加穿刺孔。根據不同手術階段變化體位,并遵循腫瘤根治原則[13]。
1.4 結局指標
觀察隨訪患者的圍手術期情況、術后30 d并發癥及生存狀況。圍手術期情況:記錄CRC原發灶和肝轉移灶的手術方式、手術時間、術中失血量、術中輸血情況、首次排氣及首次進食時間、術后疼痛評分、術后住院時間;術后30 d并發癥:包括乳糜漏、切口感染、腹腔感染、吻合口漏、膽漏、胸腔積液、肺部感染等;生存狀況:以電話或門診等方式進行隨訪,記錄術后第1、2、3年的無瘤生存(disease free survival,DFS)率和總體生存(overall survival,OS)率,并以CRS評分將患者分為高危組(3~5分)和低危組(0~2分),分別對比2組患者中接受新輔助治療和未接受新輔助治療患者的DFS和OS狀況。
1.5 統計學方法
采用SPSS 26.0軟件包進行統計分析。符合正態分布的計量資料以均數±標準差( ±s)表示,采用成組t或t’檢驗進行組間比較;不符合正態分布的以中位數(上下四分位數)、[M(P25,P75)]表示,采用成組秩和檢驗進行組間比較;計數資料以例(%)表示,采用成組χ2檢驗或Fisher確切概率法進行組間比較;采用Kaplan-Meier法繪制生存曲線,采用log-rank檢驗進行生存分析。檢驗水準α=0.05。
±s)表示,采用成組t或t’檢驗進行組間比較;不符合正態分布的以中位數(上下四分位數)、[M(P25,P75)]表示,采用成組秩和檢驗進行組間比較;計數資料以例(%)表示,采用成組χ2檢驗或Fisher確切概率法進行組間比較;采用Kaplan-Meier法繪制生存曲線,采用log-rank檢驗進行生存分析。檢驗水準α=0.05。
2 結果
2.1 病例資料
共有36例患者滿足標準納入分析,其中男26例(72.2%),女10例(27.8%);年齡25~81歲、(57.4±13.9)歲;BMI 17.0~28.7 kg/m2、(22.9±2.7)kg/m2;美國麻醉醫師協會(American Society of Anesthesiologists,ASA)評分:Ⅱ級28例(77.8%),Ⅲ級8例(22.2%);術前CEA:2.0~50.7 ng/mL、(9.8±1.9)ng/mL。原發灶位置:右半結腸5例(13.9%),左半結腸10例(27.8%),直腸20例(55.6%),多原位癌1例(2.8%)。術后病理結果:原發灶最大徑1.5~8.0 cm、(3.6±1.7)cm;pT1~2期3例(8.3%),pT3~4期32例(88.9%),還有1例(2.8%)行新輔助治療后原發灶未見癌殘留,考慮治療后改變(pT0);pN0期16例(44.4%),pN1~2期20例(55.6%);術中清掃淋巴結6~48枚/例、(16.7±9.7)枚/例;肝轉移灶單發18例(50.0%),多發單葉7例(19.4%),多發雙葉11例(30.6%);肝轉移灶最大徑0.3~4.0 cm、(1.7±1.1)cm。R0切除率為100%。26例(72.2%)術前行新輔助治療,其中5例(13.9%)聯合分子靶向藥物。
2.2 術中情況
36例患者均全程在腹腔鏡下完成原發灶和肝轉移灶的同步切除。5例(13.9%)行右半結腸切除術,4例(11.1%)行左半結腸切除術,7例(19.4%)行乙狀結腸切除術,20例(55.6%)行直腸癌根治術[12例低位前切除、1例超低位前切除、1例經括約肌間切除]。28例(77.8%)行非解剖性肝切除(包括楔形切除3例、局部切除25例),8例(22.2%)行解剖性肝切除 [包括4例左外葉(Ⅱ+Ⅲ段)切除、2例尾狀葉(Ⅰ段)切除、1例中葉切除(Ⅳ+Ⅴ+Ⅷ段)和1例左內葉(Ⅳ段)+右后葉(Ⅵ+Ⅶ段)切除]。另有2例患者同時行腹腔鏡膽囊切除術。所有患者均接受肝臟病灶切除或肝臟病灶切除+術中RFA),且均達到NED。手術時間191~491 min、(328.9±85.8)min;術中失血量20~600 mL、100(50,150)mL,其中4例(11.1%)術中輸血。
2.3 術后恢復情況
36例患者的首次排氣時間1~4 d、(2.9±0.8)d,首次進食時間2~6 d、(3.2±1.0)d,術后1~3 d平均視覺模擬量表(visual analogue scale,VAS)評分1.1~2.3分、(1.9±0.3)分,術后住院時間4~23 d、(6.8±4.3)d。5例(13.9%)術后30 d內發生并發癥,其中1例(2.8%)術后5 d發生切口感染,1例(2.8%)于術后第3天出現少量胸腔積液,另有1例(2.8%)術后4 d發生腹腔感染,3例(8.3%)術后6 d發生腹腔乳糜漏,以上并發癥均經保守治療后痊愈。術后30 d內無嚴重并發癥(Clavien-Dindo并發癥Ⅲ/Ⅳ級)發生,無死亡病例。
2.4 生存狀況
對36例患者進行術后隨訪,隨訪時間2.1~61.9個月,中位隨訪24.7個月。15例(41.7%)出現復發轉移征象,其中10例(27.8%)肝轉移復發,并有5例(13.9%)行二次甚至多次肝切除;2例(5.6%)肺轉移,均行輔助放化療;1例(2.8%)右側附件轉移,行輔助化療;2例(5.6%)多發淋巴結轉移,1例(2.8%)于術后第13個月因腫瘤全身廣泛轉移死亡,另1例行輔助化療。術后1、2、3年DFS率分別為89.8%、55.0%、29.2%,1、2、3年OS率分別為100%、100%、87.5%。
以是否行新輔助治療將患者分為新輔助治療組(n=26)和未行新輔助治療組(n=10),并進行亞組分析。結果顯示,2組的基線資料比較差異均無統計學意義(P>0.05),見補充材料1,新輔助治療組中13例(50.0%)出現復發轉移征象,死亡1例(3.8%);未行新輔助治療組中2例(20.0%)出現復發轉移征象,無死亡病例。2組的DFS(χ2=1.675,P=0.196)和OS(χ2=0.600,P=0.439)比較差異均無統計學意義(圖2)。以CRS進行風險分層,低風險組(n=27)中21例接受新輔助治療,6例未接受新輔助治療,二者的DFS(χ2=0.237,P=0.627)和OS(χ2=0.333,P=0.564)比較差異無統計學意義;高風險組(n=9)中5例接受新輔助治療,4例未接受新輔助治療,二者的DFS比較差異無統計學意義(χ2=0.096,P=0.757),見圖3,此組患者中無死亡病例。
 圖2
示新輔助治療組和未行新輔助治療組患者的DFS(a)和OS(b)曲線
圖2
示新輔助治療組和未行新輔助治療組患者的DFS(a)和OS(b)曲線
 圖3
示CRS低、高風險患者接受新輔助治療和未行新輔助治療的DFS和OS曲線
圖3
示CRS低、高風險患者接受新輔助治療和未行新輔助治療的DFS和OS曲線
a:CRS低風險患者接受新輔助治療和未行新輔助治療的DFS曲線;b:CRS低風險患者接受新輔助治療和未行新輔助治療的OS曲線;c:CRS高風險患者接受新輔助治療和未行新輔助治療的DFS曲線
3 討論
3.1 新輔助治療在可切除CRLM中的可行性
相較于CRC異時性肝轉移(metachronous liver metastases),SCRLM的生物學特性更高危、預后更差[14]。當前指南[2]推薦所有CRLM患者接受MDT協作診療,根據術前評估,確定個體化的治療目標和綜合治療方案。由于達到NED后,患者的生存期明顯延長,故對肝轉移灶初始評估潛在可切除的患者,應積極予以轉化治療后再行手術切除,以爭取NED為目標。而對肝轉移灶初始評估可R0切除的患者,是否接受術前新輔助治療仍無統一標準。目前比較認同的是按CRS評分進行復發風險分層,評分越高,術后復發率越高,新輔助化療獲益越大[2, 10, 15]。研究[16-17]顯示,與直接手術相比,術前新輔助治療可改善初始可切除CRLM患者的DFS,但2組OS未見顯著差異。一項多中心觀察性研究[18]指出,術前行FOLFOX新輔助化療方案并不能顯著提高可切除CRLM患者的DFS。Ayez等[19]報道,對于高風險患者(CRS 3~5分),新輔助化療組的OS顯著優于直接手術組;而對于低風險患者(CRS 0~2分),2組OS的差異無統計學意義。因此,需進行更多高質量的前瞻性試驗,以評估新輔助治療在可切除CRLM患者中的作用。
3.2 同步或分期手術治療CRLM
目前,手術完全切除肝轉移灶仍是治療CRLM的金標準,因此符合條件的患者均應適時接受手術治療。NCCN指南指出,對于同時性肝轉移,可以同期或分期切除原發灶和肝轉移灶,然而,對于兩種手術策略的選擇標準和優劣尚無定論。Lillemoe等[20]對兩種手術策略進行綜述后指出,與分期手術相比,接受同步切除的患者病灶通常更容易處理,如較小或較少的肝轉移灶,且原發灶大多位于右半結腸;此外,同步切除策略延長手術時間、常需過長和(或)多個切口、手術創傷大,可能使圍手術期并發癥風險增加。多學科國際指南推薦同步切除用于治療可通過手術達到CRC原發灶和肝轉移灶R0切除的SCRLM[14]。中國結直腸癌肝轉移診斷和綜合治療指南(2023)[2]指出,對肝轉移灶小且多位于周邊或局限于半肝,肝切除量<60%,肝門部淋巴結、腹腔或其他遠處轉移均可手術切除的患者建議同步切除。作為首個比較SCRLM同步切除和分期切除的RCT試驗—METASYNC研究[21]表明,2組患者術中及術后并發癥發生率均未見顯著差異,但同步切除組術后2年OS有延長趨勢,支持對于初始可切除SCRLM患者采用同步切除。需注意的是,肝優先模式的分期手術并未在此研究中提出,因此無法判斷其與同步切除的優劣。Gavriilidis等[22]將32項回顧性研究進行薈萃分析后發現,分期切除(腸優先模式或肝優先模式)和同步切除這3種手術策略在嚴重并發癥(Ⅲ/Ⅳ級)和5年OS方面差異均無統計學意義。一項基于LiverMetSurvey數據庫的研究認為,手術策略的選擇應以肝轉移灶的腫瘤負荷作為參考,對于多發雙葉的SCRLM,肝轉移灶的腫瘤負荷更大,此時肝優先模式的分期手術較其他兩種手術策略有著更可觀的長期預后,據此Giuliante等[23]建議將此種術式作為多發雙葉SCRLM患者的標準術式。可見,對于分期切除(腸優先模式或肝優先模式)和同步切除的腫瘤學療效及選擇標準尚未形成共識,亟需高質量臨床研究提供證據。
3.3 腹腔鏡或開腹手術治療CRLM
目前,NCCN指南已推薦腹腔鏡結腸癌根治術可常規開展,腹腔鏡直腸癌根治術可由具有足夠腔鏡經驗的術者或在臨床研究中實施[24-25]。由于肝臟的解剖學特征較復雜,且較難翻動、顯露等,因此腹腔鏡肝切除術(laparoscopic hepatectomy,LH),尤其是腹腔鏡解剖性肝切除術(anatomic laparoscopic hepatectomy,ALH)需要較長的學習曲線,其安全性和腫瘤學療效尚存爭議,限制了其普及。因此,腔鏡同步切除的爭議主要在于腹腔鏡肝轉移灶切除的技術難度和腫瘤學療效。研究[26-27]顯示,對CRLM行LH,患者的無復發生存(recurrence free survival,RFS)、DFS、5年OS率與開腹肝切除術相當,甚至在3年OS率上表現更好。近期的一項薈萃研究[28]表明,相比開腹同步切除,SCRLM行腔鏡同步切除的RFS更優,但研究者指出更低的RFS可能是由選擇偏倚所致,因為符合腹腔鏡手術條件的患者肝轉移灶數目通常較開腹手術少,而肝轉移灶數目≥5個是CRLM的陽性預后因素,反映了更晚期的系統性疾病;并且接受開腹手術的患者恢復慢,更晚開始進行術后輔助化療,復發風險可能更高。據此,Morarasu等[28]指出,腔鏡同步切除對于部分SCRLM患者來說是一種安全可行的術式。以上研究可得,盡管腔鏡同步切除的學習曲線更長,但腹腔鏡手術的優勢使其能夠將腹內臟器損傷風險降到最低,進而減少術中出血、加快患者康復、縮短住院時間、降低并發癥發生率等。因此,若能保證CRC原發灶實現R0切除,就應充分評估肝轉移灶情況和SCRLM患者的全身狀況,對于技術成熟的單位,腔鏡同步切除可成為優選的術式。
3.4 RFA在CRLM中的應用
RFA是初始評估不可切除CRLM的一種重要治療手段,通常應用于術中,與肝切除術聯合,作為CRLM的一站式手術策略[29]。然而,對于初始評估可切除的CRLM,RFA的作用仍存在爭議。目前RFA主要用于治療單個且直徑<3 cm的可切除CRLM,以替代手術切除。一項基于傾向性匹配得分的回顧性研究[29]顯示,對于可切除的CRLM,手術切除+RFA的治療策略或許是一種比單純肝切除術更好的方式,因為此種方法可避免大范圍的肝切除,術后肝功能不全發生率較低、術后住院時間顯著縮短,且腫瘤學結果相當。當前我國最新指南建議同步切除時,若患者預期術后殘余肝臟體積過小,可先切除部分較大的肝轉移灶,對剩余直徑<3 cm的轉移病灶進行RFA[2, 10]。此外,由于CRLM行肝轉移灶切除后仍有較高的復發風險,常需再次手術切除復發病灶,以延長生存期,因此目前多采用保留實質的肝切除術(parenchyma-sparing hepatectomy,PSH),以盡可能保留正常肝實質和肝內主要管道。OSLO-COMET RCT試驗[30]表明,對采用PSH的CRLM患者來說,腹腔鏡組較開腹組住院時間更短、術后并發癥更少;術后隨訪4個月,2組的費用相同,但腹腔鏡組的質量調整壽命年增加了0.011年,故研究者認為腹腔鏡組的經濟效益更優。因此,本團隊基于現有臨床研究和相關指南,采取手術切除+RFA的聯合方案。其優勢在于:避免大范圍切肝,減少輸血需求、降低術后肝功能衰竭風險;達到PSH的目標,為后期肝切除提供基礎;更有效提高NED率,改善術后長期生存[29, 31]。
3.5 本團隊研究結果及結論
最終納入本研究的患者共36例。其中,接受新輔助化療聯合或不聯合分子靶向藥物者26例,未接受新輔助化療者10例,2組術后DFS和OS相當。按CRS評分分層,低風險組(n=27)中接受新輔助治療21例,未接受新輔助治療6例,術后隨訪未觀察到二者的DFS和OS的差異存在統計學意義。高風險組(n=9)中接受新輔助治療5例,未接受新輔助治療4例,術后隨訪二者的DFS差異無統計學意義,且此組中無患者死亡。本組病例支持低風險患者行新輔助化療不能獲益的文獻報道結果;局限于有限的病例數,高風險患者行新輔助化療未顯示出優勢,但筆者認為新輔助治療應作為高風險患者的常規治療,主要基于以下考慮:新輔助化療可作為評價化療方案敏感度的依據,指導術后化療方案的選擇;新輔助化療殺滅潛在的微轉移灶,可能更利于患者獲得遠期的生存獲益。此外,對于CRLM可達到NED的患者,筆者團隊總體傾向均需新輔助治療,即便為低風險患者。NCCN指南目前指出,對于直腸癌伴肝轉移患者,均需要進行新輔助治療;對于結腸癌伴可切除肝轉移患者,盡管指南推薦可先行新輔助化療,也可以先手術,但是結合國內外文獻,大多數學者支持新輔助化療后手術,筆者團隊對此也持支持意見。對于以下情況的CRLM,即肝轉移灶較小(2~3 cm以下)、術前評估為3個及以下并局限于同一肝段,筆者團隊優先手術治療,因為風險度低,且化療后病灶極可能消失,導致術中無法找到病灶。
基于PSH的優勢,筆者團隊對大部分(77.8%)患者實施非解剖性肝切除,另部分(22.2%)未滿足PSH條件的患者則實施解剖性肝切除,同時積極聯合術中RFA,以爭取NED。術后30 d內最常見的并發癥為腹腔乳糜漏(8.3%),切口感染、腹腔感染、胸腔積液各有1例(2.8%),均通過保守治療后痊愈,未出現膽漏、吻合口漏、術后肝功能衰竭等嚴重并發癥。術后總并發癥發生率為13.9%,與文獻報道同步切除手術的并發癥發生率22.3%(7.1%~50%)[28]相比,本研究結果顯示,同期腔鏡下切除短期療效滿意,具有可靠的安全性。
本組病例術后中位隨訪24.7個月(2.1~61.9)個月,術后1、2、3年的DFS率分別為89.8%、55.0%、29.2%,1、2、3年OS率分別為100%、100%、87.5%。Ozair等[27]的薈萃分析表明,對于接受微創同步或分期切除的CRLM 患者,在RCT研究中,術后第1、3年的DFS率分別為69.8%、33.1%,而在觀察性研究中,該數據分別為64.6%、33.3%;在RCT研究中,術后第1、3的OS率分別為94.0%、72.9%,而在觀察性研究中,該數據分別為92.1%、67.2%。一項在SCRLM患者中比較開腹與腔鏡同步切除的研究[32]的腫瘤學結果顯示,腔鏡組術后第1、3年的DFS率分別為56%、35%,術后第1、3年的OS率分別為100%、73%,且與開腹組相比差異無統計學意義。與既往文獻報道同步切除的數據相比,本研究結果顯示,腔鏡同步切除具有滿意的腫瘤學療效。
本研究中總體復發率為41.7%,最常見的部位為肝臟(27.8%);另有2例(5.6%)肺轉移,2例(5.6%)多發淋巴結轉移和1例(2.8%)右側附件轉移;只有1例(2.8%)患者術后約1年因腫瘤全身轉移死亡。本研究結果顯示,同時性肝轉移術后復發主要在肝臟和其他遠處器官,原發灶復發風險低,提示對于同時性肝轉移的治療策略的制定應以肝臟和遠處轉移的復發風險評估作為主要的指標。
4 小結
綜上,本研究結果顯示,對于經過篩選、符合腹腔鏡手術條件的SCRLM患者來說,腔鏡同步切除是一種安全可行的手術策略,并可使患者獲得滿意的生存獲益。但由于本研究樣本量較小,未來亟需更多高質量的臨床研究,以進一步證實此種手術策略的安全性與可行性。此外,基于腔鏡同步切除較高的技術難度,建議在有足夠腔鏡肝切除和腔鏡CRC手術積累的團隊開展。
四川大學華西醫院胃腸外科CRC MDT團隊對于SCRLM的腹腔鏡同步切除的策略和技術,基于現有指南、臨床證據,結合臨床實踐,總結了以下要點:圍手術期患者的安全是整個手術計劃的首要考慮因素,需根據患者的基礎身體情況,原發病灶手術風險及肝臟繼發病灶術后風險來共同判斷預測患者術后可能出現的并發癥及患者的耐受能力,術前由胃腸及肝臟外科醫生共同討論各自專業的手術風險并共同評估患者的手術耐受力,原則上不制定超過患者耐受極限的治療方案,充分保證患者術后順利恢復;同期切除理論上能在更短的時間內降低患者體內的腫瘤負荷,根據筆者團隊的經驗,在能夠保證患者安全的情況下優先推薦同期腹腔鏡切除;對于肝臟內存在散發的病灶初期未立即手術治療的患者,由于肝內病灶對化療治療有效將使其體積縮小,筆者團隊建議在化療期間密切關注肝內病灶體積的變化情況,若肝內某個病灶體積縮小到1.5 cm以下甚至更小,術中尋找該病灶的難度將明顯升高,MDT在制定患者手術時機時應當適當提前,以利于在手術中盡量找到所有的病灶;手術前充分利用多種影像學手段以明確肝內病灶,充分結合不同檢查手段的優勢;同期切除手術優先行肝臟手術,以盡量避免入肝血流阻斷對腸道吻合口的影響;術中常規使用術中超聲幫助尋找肝內腫瘤,術前常規對患者注入小劑量吲哚菁綠以便術中利用熒光尋找腫瘤。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:楊洋進行臨床資料收集、數據分析;鄭兆陽協助數據收集、數據分析并撰寫稿件;陳鵬協助數據收集及數據分析;馮曦和魏永剛指導稿件修改;楊烈負責研究方案設計、研究過程管理和稿件的修改;周總光提供研究思路和修改稿件。
倫理聲明:本研究已通過四川大學華西醫院生物醫學倫理審查委員會批準[批文編號:2024年審(561)號)]。