引用本文: 涂升金, 張雯迪, 劉健博, 殷晉, 汪曉東, 李立, 楊烈. 新輔助治療聯合經內外括約肌間切除術治療低位/超低位直腸癌的長期效果. 中國普外基礎與臨床雜志, 2024, 31(5): 538-546. doi: 10.7507/1007-9424.202404058 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
結直腸癌(colorectal cancer,CRC)是全球第3大常見癌癥,死亡率位居第2;2022年全球新增CRC 192萬例,死亡90.2萬例,且發病率呈逐年上升趨勢,而我國半數以上為直腸癌,其中又以中低位直腸癌最為多見[1-3]。由于直腸癌早期難以發現,多數患者初診時已為中晚期,新輔助治療是Ⅱ、Ⅲ期中低位直腸癌治療的必要手段,可在一定程度上實現減瘤降期和病理完全緩解,為實現保肛手術提供機會,同時降低腫瘤局部復發率[4-6]。
低位/超低位直腸癌的保肛手術一直是值得關注的臨床問題之一。20世紀90年代初,經內外括約肌間切除術(intersphincteric resection,ISR)的出現為低位直腸癌,尤其是極低位直腸癌的保肛手術提供了新的技術手段,手術能否保住患者的肛門現已不再單純取決于腫瘤距肛門的距離,若患者肛門外括約肌尚未受到腫瘤侵犯,則能增加保留肛門的可能性,且已有較多研究[7-10]表明該術式也可獲得較好的療效。新輔助治療聯合ISR手術技術在治療低位直腸癌患者后,可以達到的長期效果是值得研究的關鍵點。本研究擬利用單中心的直腸癌真實世界數據,探究新輔助治療聯合ISR治療直腸癌的長期效果。
1 資料與方法
1.1 數據獲取方式和條件
本研究通過對四川大學華西醫院2024年3月21日更新的腸癌數據庫(Database from Colorectal Cancer,DACCA)進行數據提取,開展回顧性研究。
本研究數據提取的時間范圍和病種是:2009年1月至2020年12月期間收治的直腸癌患者的臨床資料。其中,納入標準:① 病理性質為直腸癌或惡性黑色素瘤,腫瘤部位為低位/超低位;② 術前行新輔助放化療或單純新輔助化療;③ 行開腹或腹腔鏡ISR手術;④ 本研究所需臨床指標完整。排除標準:① 聯合其他臟器切除;② 姑息性腫瘤切除。
1.2 收集指標
本研究納入的數據參數及觀察指標包括以下幾個方面。① 基線資料:患者性別、年齡、BMI、糖尿病、高血壓、貧血、低蛋白血癥等。② 腫瘤特征:病理性質、最長直徑、緣距(腫瘤下緣距齒狀線距離)、ypTNM分期、環周切緣(circumferential resection margin,CRM)、病理高危因素等。③ 手術指標:手術時間、R0切除、預防性造口等。④ 遠期療效指標:術后生存期(overall survival,OS)和特異性疾病生存期(disease specific survival,DSS),以及3年和5年OS、DSS率。⑤ 術后并發癥:傷口裂開、造口脫垂、造口梗阻、肺部感染、炎性腸梗阻、肛周感染、早發型吻合口漏、吻合口出血、下肢深靜脈血栓、術區出血、術區感染、尿潴留、遲發型吻合口漏、吻合口狹窄、直腸陰道瘺、切口疝等。其中吻合口漏根據國際直腸癌研究組(International Study Group of Rectal Cancer,ISREC)的定義,是指腸壁吻合口處缺損而導致腸腔內外發生的異常交通。根據吻合口漏發生的時間可分為早發型(術后30 d以內)和遲發型(術后30 d以上)。病理高危因素詳見DACCA中的定義[11]。
1.3 治療
1.3.1 新輔助治療
① 新輔助化療:根據中國臨床腫瘤學會(Chinese Society of Clinical Oncology,CSCO)CRC診療指南,按照FOLFOX或CAPEOX方案進行術前新輔助化療。② 新輔助放化療:長程或短程放療聯合奧沙利鉑或卡培他濱片同步化療,連續治療4個療程,常規在放療后的6~8周進行手術。
1.3.2 手術方法
所有納入的直腸癌患者均采用開放或腹腔鏡下手術,包括經腹或經肛入路的ISR手術。手術技術方式參照四川大學華西醫院李立教授的《結直腸癌外科應用技術的規范與創新(十五)》[12]。
1.4 預后指標定義及患者分組
OS定義為從手術日至隨訪終止日因任何原因死亡所持續的時間,單位為月;DSS定義為從手術日至隨訪終止日因直腸癌死亡所持續的時間,單位為月。
本研究對納入研究的低位/超低位直腸癌患者進行分層分析,采用了以下3類不同的分組方式:根據不同的ISR手術方式分為經肛ISR、部分ISR、次全ISR、完全ISR,根據新輔助治療方案分為單純化療組和放化療組,根據不同ypTNM分期分為0、Ⅰ、Ⅱ、Ⅲ、Ⅳ期組,比較不同分組之間的總體、3年及5年OS、DSS率。
1.5 數據清洗方式
本研究從DACCA數據庫提取數據后,利用Tableau Prep Builder(Tableau Software,seattle,WA,USA)進行數據清洗,完成不良數據刪除或矯正、數據結構化一致以及數據去重和歸類。
1.6 數據分析目標
通過本研究分析新輔助治療聯合ISR治療低位/超低位直腸癌的長期效果,以及不同的ISR術式、新輔助治療方案、ypTNM分期對OS和DSS的影響,為低位/超低位腸癌患者選擇更好的治療方案提供臨床依據。
1.7 統計學方法
本研究采用SPSS 29.0(NCSS LLC., Kaysville, U.T., USA)軟件進行統計學分析,正態分布的計量資料以均數±標準差( ±s)表示,非正態分布的定量資料以中位數(median,M)和上下四分位數(P25,P75)表示,計數資料以例(%)表示。采用Kaplan-Meier法繪制生存曲線,并采用log-rank或Tarone-ware檢驗進行生存曲線的比較。采用Cox比例風險回歸模型進行單因素和多因素生存分析。檢驗水準α=0.05。
±s)表示,非正態分布的定量資料以中位數(median,M)和上下四分位數(P25,P75)表示,計數資料以例(%)表示。采用Kaplan-Meier法繪制生存曲線,并采用log-rank或Tarone-ware檢驗進行生存曲線的比較。采用Cox比例風險回歸模型進行單因素和多因素生存分析。檢驗水準α=0.05。
2 結果
2.1 數據篩選結果
通過數據清洗后,共納入944例直腸癌患者數據進行分析,其中男578例(61.2%),女366例(38.8%);年齡20~87歲、(58±12)歲,其中青年組(<35歲)38例(4.1%),中年組(35~59歲)444例(47.0%),老年組(≥60歲)462例(48.9%);BMI 14.52~37.46 kg/m2、(23.07±3.29)kg/m2,其中偏瘦(<18.5 kg/m2)58例(6.1%),正常(18.5~24.9 kg/m2)620例(65.7%),超重(25.0~29.9 kg/m2)204例(21.6%),肥胖(≥30.0 kg/m2)24例(2.5%),未知38例(4.1%);糖尿病194例(20.6%),高血壓308例(32.6%),貧血243例(25.7%),低蛋白血癥59例(6.3%);腫瘤與齒狀線的距離-1~13 cm、2.5(1.0,4.0)cm,其中<2.5 cm 467例(49.5%),≥2.5 cm 475例(50.3%),未知2例(0.2%);腫瘤最長直徑0.5~6.0 cm、(3.4±1.2)cm,其中<3.0 cm 199(21.1%),≥3.0 cm 454例(48.1%),未知291例(30.8%);CRM+ 296例(31.4%);腫瘤性質為腺癌712例(75.4%),黏液腺癌161例(17.1%),非腺癌42例(4.4%)[其中印戒細胞癌25例(2.6%),神經內分泌癌9例(1.0%),鱗狀細胞癌6例(0.6%),惡性黑色素瘤2例(0.2%)],未知29例(3.1%);R0切除439例(46.5%),非R0切除378例(40.0%),未知127例(13.5%);根據不同術式分組,經肛ISR組28例(3.0%),部分ISR組606例(64.2%),次全ISR組242例(25.6%),完全ISR組68例(7.2%);單純化療組309例(32.7%),放化療組635例(67.3%);ypTNM分期0期36例(3.8%)、Ⅰ期152例(16.1%),Ⅱ期281例(29.8%),Ⅲ期350例(37.1%),Ⅳ期125例(13.2%)。
2.2 新輔助治療聯合ISR手術的長期生存預后
本研究944例患者獲訪,隨訪時間0.2~167.1個月、53.1(26.9,83.7)個月;中位OS為142.7個月,DSS生存時間相對較長無法獲得中位DSS;3年OS和DSS率分別為89.2%、90.4%,5年OS和DSS率分別為83.9%、85.4%。
2.2.1 不同ISR術式的預后比較
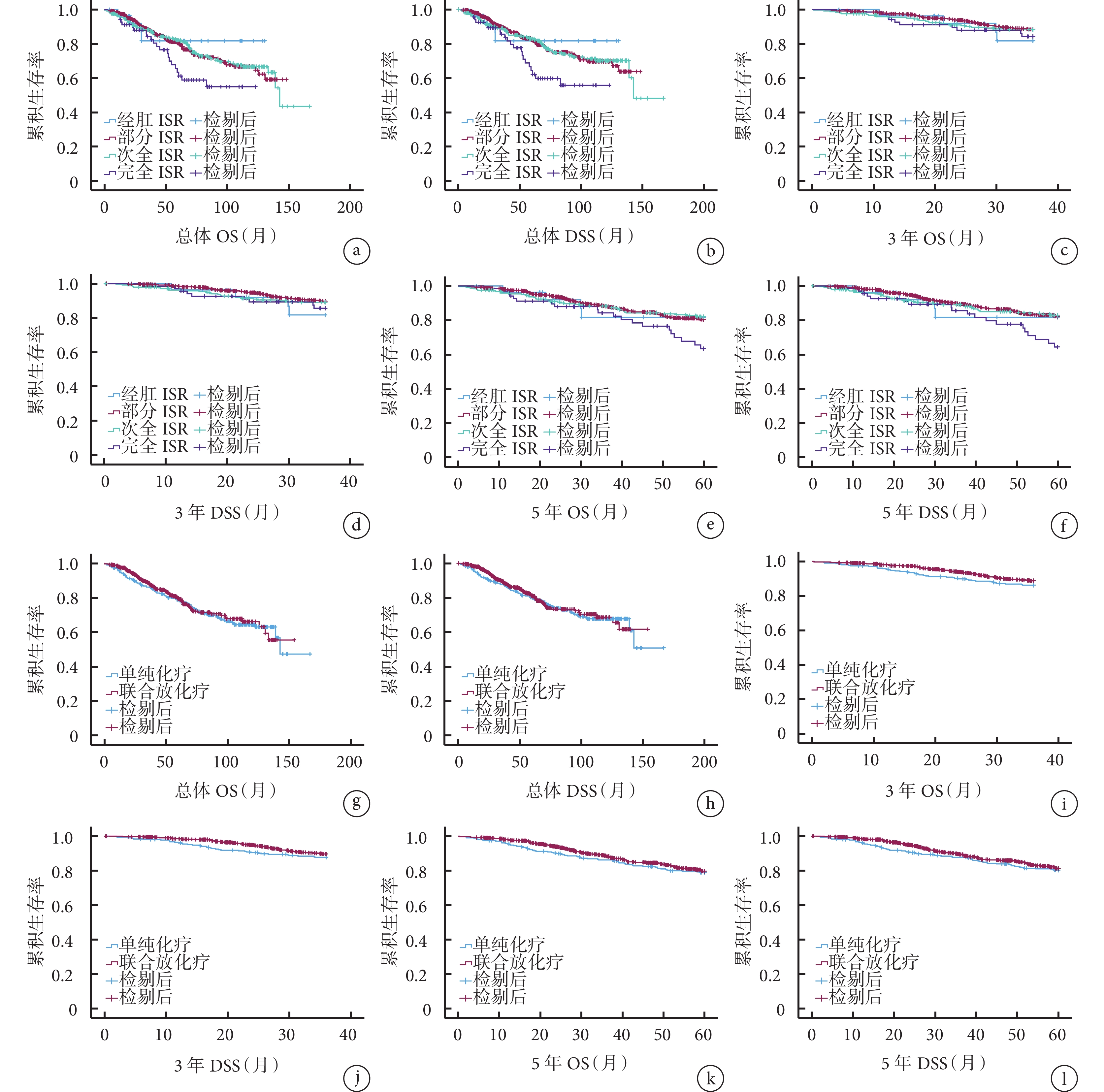
不同ISR組患者的總體、3年、5年OS和DSS比較差異均無統計學意義(P>0.05),見圖1a~1f。
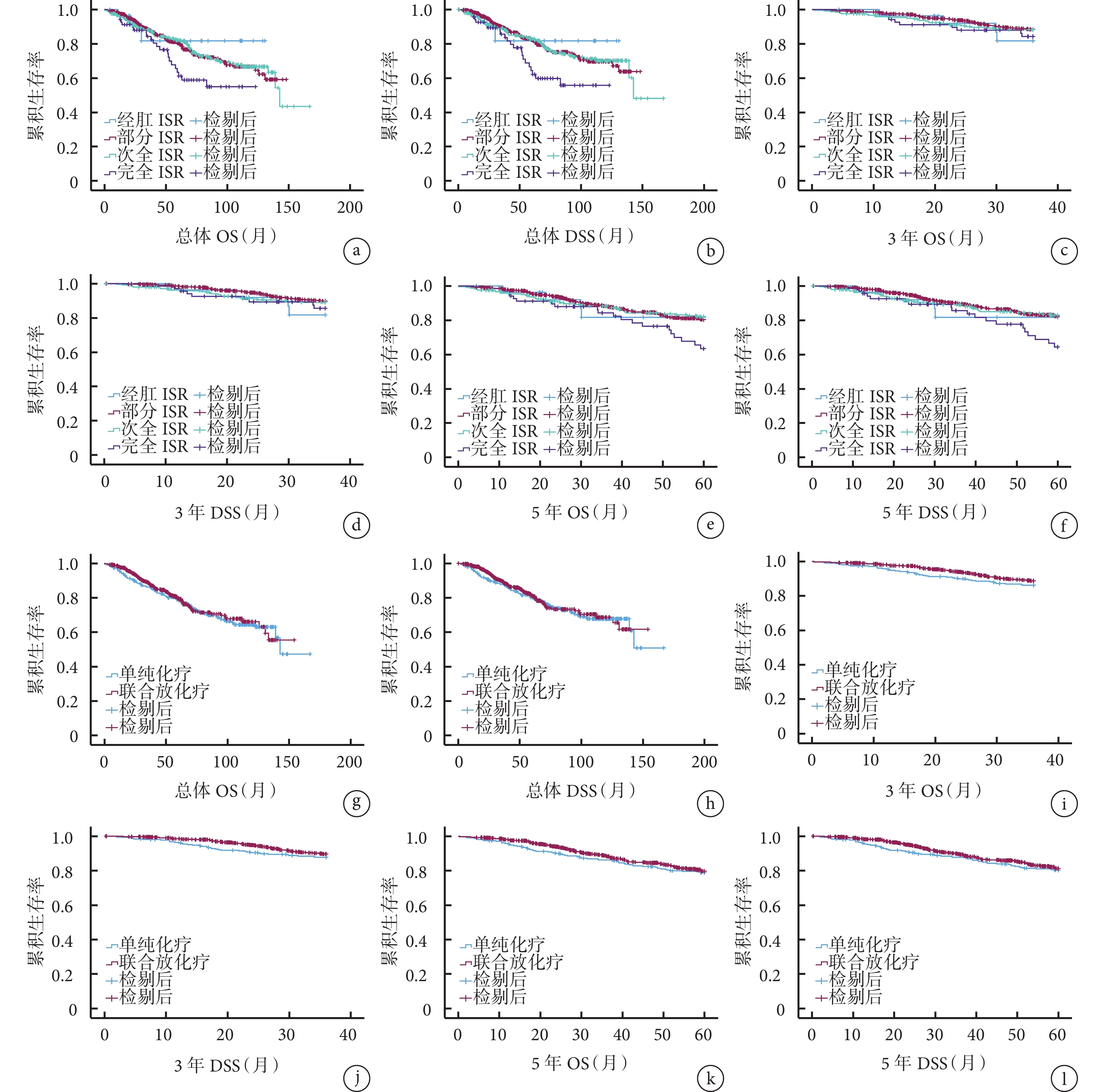 圖1
示不同ISR術式、新輔助治療方案組患者的總體、3年、5年OS和DSS曲線
圖1
示不同ISR術式、新輔助治療方案組患者的總體、3年、5年OS和DSS曲線
a、b:不同ISR術式患者的總體OS(a)和DSS(b)曲線;c、d:不同ISR術式患者的3年OS(c)和DSS(d)曲線、e、f:不同ISR術式患者的5年OS(e)和DSS(f)曲線;g、h:不同新輔助治療方案患者的總體OS(g)和DSS(h)曲線;i、j:不同新輔助治療方案患者的3年OS(i)和DSS(j)曲線、k、l:不同新輔助治療方案患者的5年OS(k)和DSS(l)曲線
2.2.2 不同新輔助治療方案的預后比較
單純化療組和放化療組患者的總體、3年、5年OS和DSS比較差異均無統計學意義(P>0.05),見圖1g~1l。
2.2.3 不同ypTNM分期的預后比較
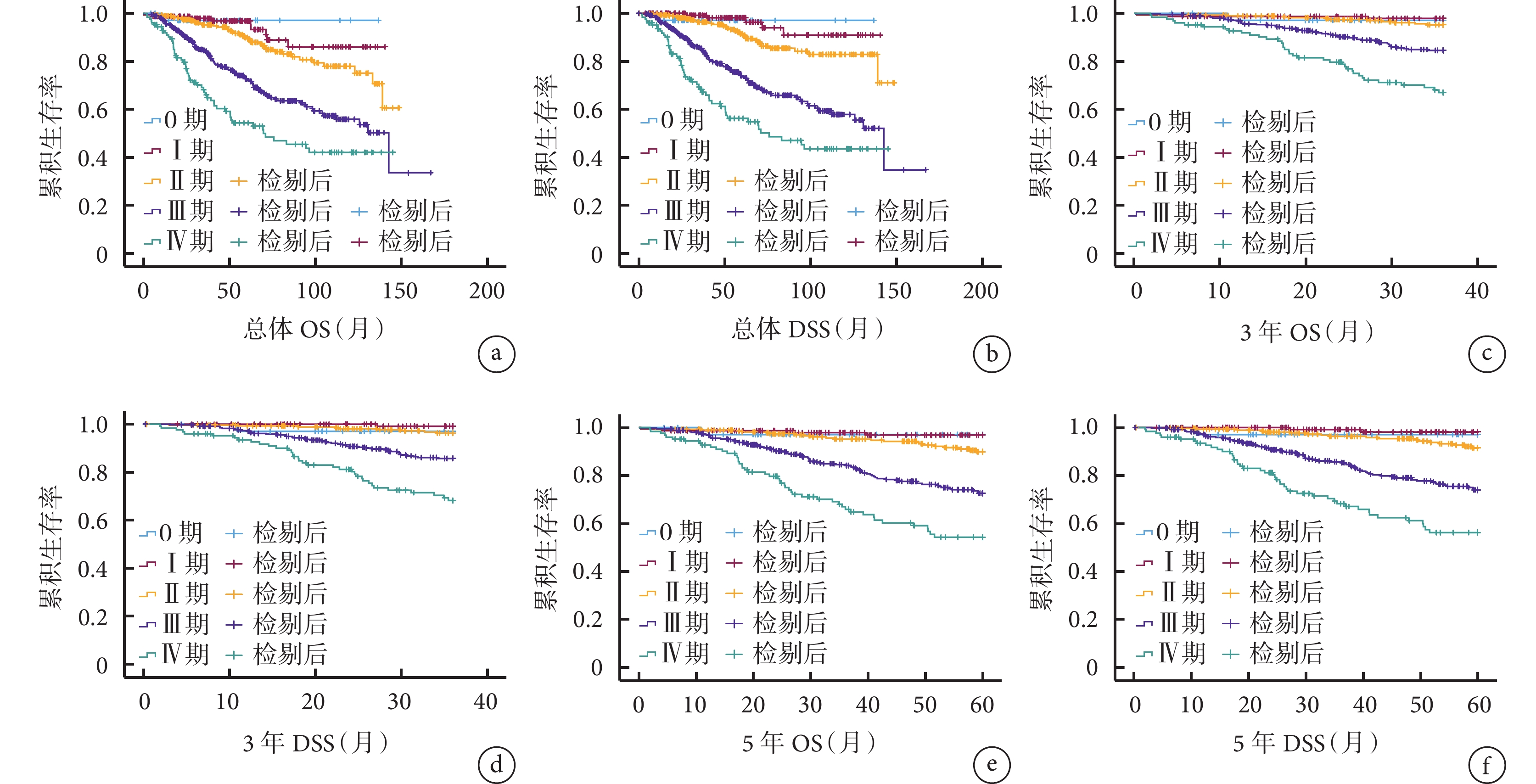
不同ypTNM分期患者的總體、3年、5年OS和DSS比較差異均存在統計學意義(P<0.001),其中ypTNM分期為0~Ⅱ期直腸癌患者的OS及DSS優于ypTNM分期為Ⅲ~Ⅳ期直腸癌患者,見圖2。
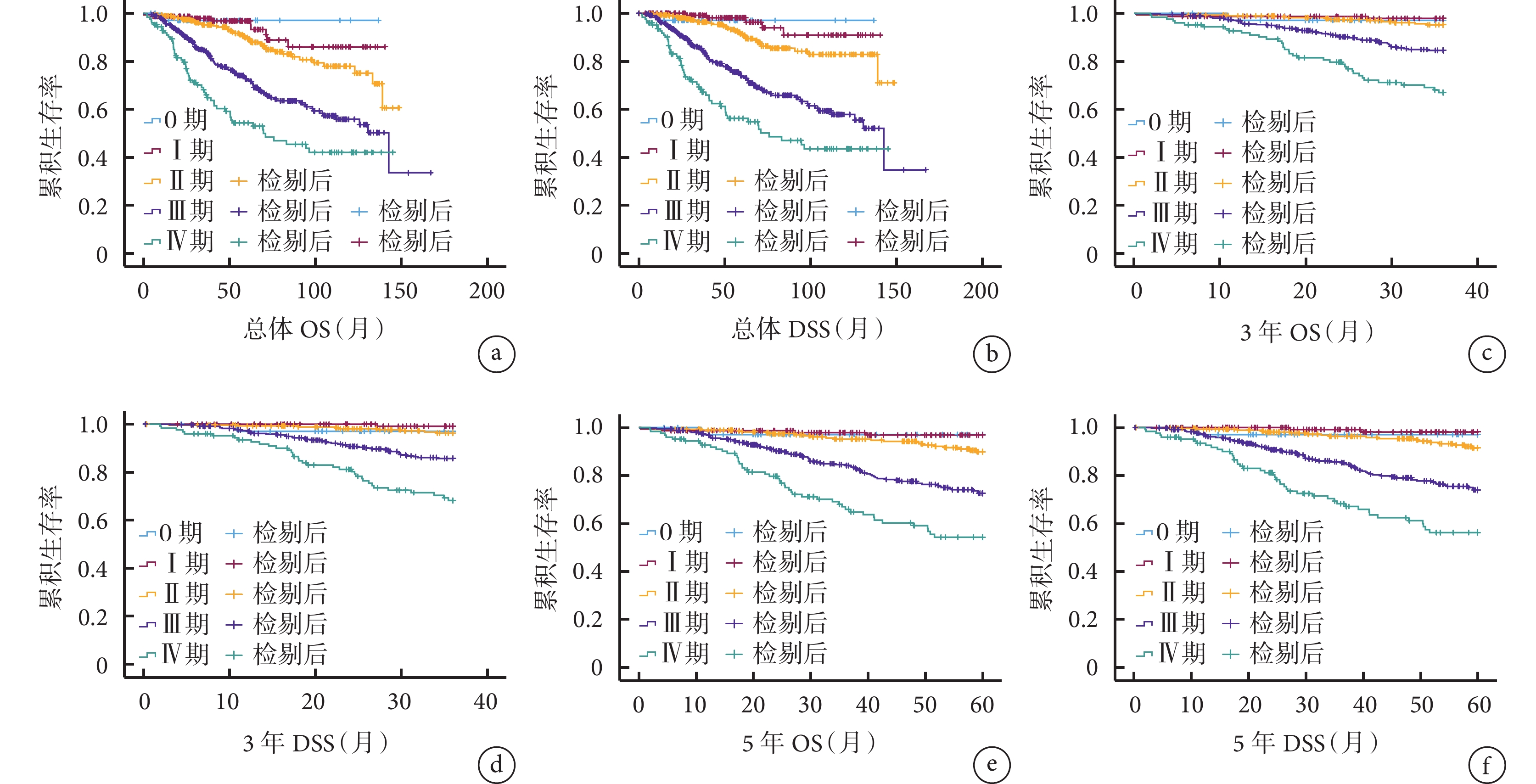 圖2
示不同ypTNM分期患者的總體、3年、5年OS和DSS曲線
圖2
示不同ypTNM分期患者的總體、3年、5年OS和DSS曲線
a、b:總體OS(a)和DSS(b)曲線;c、d:3年OS(c)和DSS(d)曲線、e、f:5年OS(e)和DSS(f)曲線
2.3 OS和DSS的影響因素分析
2.3.1 OS的影響因素分析
單因素Cox比例風險回歸分析結果顯示,性別、腫瘤最長直徑、病理為非腺癌、ypTNM分期、CRM+、病理高危因素、R0切除、手術時間與OS相關(P<0.05)。進一步采用多因素Cox比例風險回歸分析結果顯示,BMI [相對于偏瘦,正常:HR=0.241,95%CI(0.082,0.708),P=0.010;超重:HR=0.189,95%CI(0.049,0.727),P=0.015;肥胖:HR=0.072,95%CI(0.006,0.881),P=0.039]、ypTNM分期 [HR=2.453,95%CI(1.631,3.691),P<0.001)、R0切除 [HR=0.431,95%CI(0.193,0.960),P=0.039]是OS的影響因素。見表1和表2。
2.3.2 DSS的影響因素分析
采用單因素Cox比例風險回歸分析結果(表3)顯示,性別、腫瘤最長直徑、病理為非腺癌、ypTNM分期、CRM+、病理高危因素、R0切除、手術時間與DSS相關(P<0.05)。進一步采用多因素Cox比例風險回歸分析結果(表4)顯示,BMI [相對于偏瘦,正常:HR=0.190,95%CI(0.061,0.590),P=0.004;超重:HR=0.103,95%CI(0.023,0.468),P=0.003;肥胖:HR=0.051,95%CI(0.004,0.670),P=0.024]、ypTNM分期 [HR=2.521,95%CI(1.616,3.931),P<0.001)、R0切除 [HR=0.380,95%CI(0.159,0.906),P=0.029]是DSS的影響因素。
2.4 新輔助治療聯合ISR手術的術后并發癥情況
新輔助治療聯合ISR手術的直腸癌患者,術后總體并發癥發生率較低,其中術后30 d以內發生并發癥60例(6.4%),術后30 d至術后半年發生并發癥71例(7.5%),術后半年以上發生并發癥31例(3.3%)。術后30 d并發癥中,早發型吻合口漏23例(2.4%),傷口出血、肛周感染、吻合口出血、術區感染各7例(0.7%),尿潴留、血行感染、炎性腸梗阻各4例(0.4%),造口梗阻3例(0.3%),肺部感染2例(0.2%),傷口裂開、直腸陰道瘺、術區出血、下肢深靜脈血栓、造口脫垂各1例(0.1%)。術后30 d至術后半年并發癥中,造口梗阻20例(2.1%),肛周感染13例(1.4%),遲發型吻合口漏11例(1.2%),直腸陰道瘺7例(0.7%),吻合口狹窄5例(0.5%),小腸梗阻、造口脫垂各4例(0.4%),深靜脈血栓、尿潴留各3例(0.3%),造口旁疝、造口出血各1例(0.1%)。
3 討論
我國直腸癌患者的腫瘤部位以中低位為主,因此這些患者的保肛手術實施一直是外科醫生關心的話題之一。由于我國直腸癌患者臨床就診時多為中晚期,手術前有進行新輔助治療的必要。因此,對低位/超低位直腸癌,尤其是極低位直腸癌在新輔助治療后開展保肛手術的效果和風險是醫生和患者共同關心的臨床問題。新輔助治療可以帶來腫瘤的減瘤降期效果,降低腫瘤的局部復發率,提高手術切除率,增加保肛率,延長患者無病生存時間[4, 13]。但是新輔助治療也會造成一些治療相關的不良事件,特別是新輔助放療所導致的組織水腫和纖維化改變,增加手術難度,術后并發癥如吻合口漏、吻合口狹窄、大小便失禁、性功能障礙等發生率增加[14-16]。與此同時,ISR手術作為極低位直腸癌的重要技術手段,在提高直腸癌患者功能性保肛手術的同時,也可能帶來肛門功能不佳、肛周感染、吻合口愈合緩慢等多種不良事件。因此,對于低位/超低位直腸癌患者,ISR術前接受新輔助治療是否會增加患者的風險,是否會帶來更好的近遠期療效,值得探討。
本研究的主要目的是探索新輔助治療聯合ISR手術后患者的長期效果,分析結果表明,本組所有患者都完成了新輔助治療聯合ISR手術,長期預后結果中,3年OS率和DSS率分別為89.2%、90.4%,5年OS率和DSS率分別為83.9%、85.4%。這一結果與國內主要的低位/超低位直腸癌研究中報道的結果相近[17-18],可以初步說明新輔助治療聯合ISR手術治療低位/超低位直腸癌患者有較好的長期臨床效果。但是因為本研究是對新輔助治療聯合ISR手術患者的分層研究,還未通過病例對照研究或者隨機對照研究的方式進行論證,這也是本團隊下一步將深入研究分析的話題。
ISR的類型和手術具體操作過程有關,為了兼顧ISR術后生存預后和肛門功能預后,ISR手術既要保證足夠的安全切緣,又要盡可能地保留肛門內括約肌,腫瘤的位置及大小決定了ISR術式,通常來說,腫瘤局部情況越嚴重,ISR過程中需要切除內括約肌的范圍也會更寬。本研究比較了不同ISR類型患者的預后,結果發現,不同ISR手術患者的OS和DSS比較差異無統計學意義。國內韓元圣等[19]的研究結果顯示,不同ISR術式患者的3年無病生存期(disease free survival,DFS)的差異有統計學意義(χ2=7.302,P=0.024),部分ISR術式高于其他ISR術式,該研究納入了95例患者,其中部分患者行新輔助放化療,與本研究在設計上存在差異,可能是導致不同結果的原因。同時,本研究結果還提示,經肛-ISR的手術方式可以達到比較滿意的保肛效果,又具有其他ISR術式同樣良好的遠期腫瘤效果,因此,經肛-ISR術式可能是一個更優的手術方案。
多項研究已經證明新輔助放療具有較高的腫瘤局部控制率,但在遠期結局上存在一定爭議[20]。本研究結果顯示不同新輔助治療方案之間的OS和DSS比較差異沒有統計學意義。國內孫祺等[21]的研究顯示,相對于單純新輔助化療,新輔助放化療對直腸腫瘤的退縮反應更好,但2種治療方案在OS和DFS方面的差異無統計學意義。國外一項多中心隨機對照試驗研究[5]對直腸癌患者接受術前新輔助放療與術后放化療的長期預后進行比較,結果顯示術前新輔助放療并不能改善延長患者的OS,試驗共納入1 350例患者(每組675例),2組之間的OS差異沒有統計學意義(P=0.40),與本研究結果相符。術前新輔助放療的目的是縮小腫瘤體積及降低腫瘤分期,為實現保肛創造條件,但不能改善遠期效果,同時也有增加手術風險的可能。因此,低位/超低位直腸癌患者術前新輔助治療是否需要聯合術前放療,可以根據患者實際需要情況而決定。由于本研究中新輔助放療的患者相對有限,還不能體現新輔助放療帶來的影響。因此,設計前瞻性研究對照新輔助放療聯合ISR手術是有價值的研究方向之一。
ISR目前是極低位直腸癌的重要保肛技術,術中切除范圍擴展至括約肌間隙或者更寬,其目的是更好的根治切除效果,降低切緣陽性概率,真正做到安全的極限保肛[22]。據報道,ISR的5年局部復發率較低位前切除術及腹會陰聯合切除術無明顯差異[23],可以作為極低位直腸癌選擇保肛手術的重要依據。Sakr等[24]的研究表明,超低位前切除術(ULAR)組和ISR手術組的3年OS率分別為91.4%和91.7%,3年DFS率分別為79%和79.2%,與本研究的結果相近。因此,ISR手術具有較好的腫瘤學效果。
本研究中,為進一步評估ISR的類型及新輔助治療方案是否是最終影響長期預后效果的影響因素之一,進行了多因素分析。結果發現BMI、ypTNM分期、R0切除是OS和DSS的影響因素。本研究結果表明,新輔助治療方案以及ISR類型都不是最終決定患者OS和DSS的影響因素,最重要的影響因素仍舊是術后ypTNM分期。
與此同時,本研究也對新輔助治療聯合和ISR手術患者的術后并發癥進行了統計。結果發現術后30 d以內并發癥發生率為6.4%,術后30 d至半年內發生率為7.5%,半年以上發生率為3.3%。其中吻合口漏的發生率最高,但也僅為3.6%(術后早發型吻合口漏為2.4%,遲發型吻合口漏為1.2%)。國內研究中,類似患者的吻合口漏發生率為7.6%~12.87%[14, 25-28],單從數據上直觀評價,新輔助治療聯合ISR具有較高的安全性。
總之,在低位/超低位直腸癌患者的綜合治療中,采用新輔助治療聯合ISR手術可獲得較為穩定、良好的遠期腫瘤學療效,且術后并發癥的發生率不高,是可以選擇的手段之一。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:涂升金主要負責數據統計和描述、結果制圖、文章撰寫;張雯迪、劉健博主要負責大綱梳理、文章修改;殷晉主要負責數據描述、校對修正及數據審查;汪曉東主要負責提供文章數據源及文章修改;李立、楊烈主要負責文章指導。
倫理聲明:本研究已經獲得四川大學華西醫院生物醫學倫理審查委員會審批 [批文編號:2023年審(669)號]。
結直腸癌(colorectal cancer,CRC)是全球第3大常見癌癥,死亡率位居第2;2022年全球新增CRC 192萬例,死亡90.2萬例,且發病率呈逐年上升趨勢,而我國半數以上為直腸癌,其中又以中低位直腸癌最為多見[1-3]。由于直腸癌早期難以發現,多數患者初診時已為中晚期,新輔助治療是Ⅱ、Ⅲ期中低位直腸癌治療的必要手段,可在一定程度上實現減瘤降期和病理完全緩解,為實現保肛手術提供機會,同時降低腫瘤局部復發率[4-6]。
低位/超低位直腸癌的保肛手術一直是值得關注的臨床問題之一。20世紀90年代初,經內外括約肌間切除術(intersphincteric resection,ISR)的出現為低位直腸癌,尤其是極低位直腸癌的保肛手術提供了新的技術手段,手術能否保住患者的肛門現已不再單純取決于腫瘤距肛門的距離,若患者肛門外括約肌尚未受到腫瘤侵犯,則能增加保留肛門的可能性,且已有較多研究[7-10]表明該術式也可獲得較好的療效。新輔助治療聯合ISR手術技術在治療低位直腸癌患者后,可以達到的長期效果是值得研究的關鍵點。本研究擬利用單中心的直腸癌真實世界數據,探究新輔助治療聯合ISR治療直腸癌的長期效果。
1 資料與方法
1.1 數據獲取方式和條件
本研究通過對四川大學華西醫院2024年3月21日更新的腸癌數據庫(Database from Colorectal Cancer,DACCA)進行數據提取,開展回顧性研究。
本研究數據提取的時間范圍和病種是:2009年1月至2020年12月期間收治的直腸癌患者的臨床資料。其中,納入標準:① 病理性質為直腸癌或惡性黑色素瘤,腫瘤部位為低位/超低位;② 術前行新輔助放化療或單純新輔助化療;③ 行開腹或腹腔鏡ISR手術;④ 本研究所需臨床指標完整。排除標準:① 聯合其他臟器切除;② 姑息性腫瘤切除。
1.2 收集指標
本研究納入的數據參數及觀察指標包括以下幾個方面。① 基線資料:患者性別、年齡、BMI、糖尿病、高血壓、貧血、低蛋白血癥等。② 腫瘤特征:病理性質、最長直徑、緣距(腫瘤下緣距齒狀線距離)、ypTNM分期、環周切緣(circumferential resection margin,CRM)、病理高危因素等。③ 手術指標:手術時間、R0切除、預防性造口等。④ 遠期療效指標:術后生存期(overall survival,OS)和特異性疾病生存期(disease specific survival,DSS),以及3年和5年OS、DSS率。⑤ 術后并發癥:傷口裂開、造口脫垂、造口梗阻、肺部感染、炎性腸梗阻、肛周感染、早發型吻合口漏、吻合口出血、下肢深靜脈血栓、術區出血、術區感染、尿潴留、遲發型吻合口漏、吻合口狹窄、直腸陰道瘺、切口疝等。其中吻合口漏根據國際直腸癌研究組(International Study Group of Rectal Cancer,ISREC)的定義,是指腸壁吻合口處缺損而導致腸腔內外發生的異常交通。根據吻合口漏發生的時間可分為早發型(術后30 d以內)和遲發型(術后30 d以上)。病理高危因素詳見DACCA中的定義[11]。
1.3 治療
1.3.1 新輔助治療
① 新輔助化療:根據中國臨床腫瘤學會(Chinese Society of Clinical Oncology,CSCO)CRC診療指南,按照FOLFOX或CAPEOX方案進行術前新輔助化療。② 新輔助放化療:長程或短程放療聯合奧沙利鉑或卡培他濱片同步化療,連續治療4個療程,常規在放療后的6~8周進行手術。
1.3.2 手術方法
所有納入的直腸癌患者均采用開放或腹腔鏡下手術,包括經腹或經肛入路的ISR手術。手術技術方式參照四川大學華西醫院李立教授的《結直腸癌外科應用技術的規范與創新(十五)》[12]。
1.4 預后指標定義及患者分組
OS定義為從手術日至隨訪終止日因任何原因死亡所持續的時間,單位為月;DSS定義為從手術日至隨訪終止日因直腸癌死亡所持續的時間,單位為月。
本研究對納入研究的低位/超低位直腸癌患者進行分層分析,采用了以下3類不同的分組方式:根據不同的ISR手術方式分為經肛ISR、部分ISR、次全ISR、完全ISR,根據新輔助治療方案分為單純化療組和放化療組,根據不同ypTNM分期分為0、Ⅰ、Ⅱ、Ⅲ、Ⅳ期組,比較不同分組之間的總體、3年及5年OS、DSS率。
1.5 數據清洗方式
本研究從DACCA數據庫提取數據后,利用Tableau Prep Builder(Tableau Software,seattle,WA,USA)進行數據清洗,完成不良數據刪除或矯正、數據結構化一致以及數據去重和歸類。
1.6 數據分析目標
通過本研究分析新輔助治療聯合ISR治療低位/超低位直腸癌的長期效果,以及不同的ISR術式、新輔助治療方案、ypTNM分期對OS和DSS的影響,為低位/超低位腸癌患者選擇更好的治療方案提供臨床依據。
1.7 統計學方法
本研究采用SPSS 29.0(NCSS LLC., Kaysville, U.T., USA)軟件進行統計學分析,正態分布的計量資料以均數±標準差( ±s)表示,非正態分布的定量資料以中位數(median,M)和上下四分位數(P25,P75)表示,計數資料以例(%)表示。采用Kaplan-Meier法繪制生存曲線,并采用log-rank或Tarone-ware檢驗進行生存曲線的比較。采用Cox比例風險回歸模型進行單因素和多因素生存分析。檢驗水準α=0.05。
±s)表示,非正態分布的定量資料以中位數(median,M)和上下四分位數(P25,P75)表示,計數資料以例(%)表示。采用Kaplan-Meier法繪制生存曲線,并采用log-rank或Tarone-ware檢驗進行生存曲線的比較。采用Cox比例風險回歸模型進行單因素和多因素生存分析。檢驗水準α=0.05。
2 結果
2.1 數據篩選結果
通過數據清洗后,共納入944例直腸癌患者數據進行分析,其中男578例(61.2%),女366例(38.8%);年齡20~87歲、(58±12)歲,其中青年組(<35歲)38例(4.1%),中年組(35~59歲)444例(47.0%),老年組(≥60歲)462例(48.9%);BMI 14.52~37.46 kg/m2、(23.07±3.29)kg/m2,其中偏瘦(<18.5 kg/m2)58例(6.1%),正常(18.5~24.9 kg/m2)620例(65.7%),超重(25.0~29.9 kg/m2)204例(21.6%),肥胖(≥30.0 kg/m2)24例(2.5%),未知38例(4.1%);糖尿病194例(20.6%),高血壓308例(32.6%),貧血243例(25.7%),低蛋白血癥59例(6.3%);腫瘤與齒狀線的距離-1~13 cm、2.5(1.0,4.0)cm,其中<2.5 cm 467例(49.5%),≥2.5 cm 475例(50.3%),未知2例(0.2%);腫瘤最長直徑0.5~6.0 cm、(3.4±1.2)cm,其中<3.0 cm 199(21.1%),≥3.0 cm 454例(48.1%),未知291例(30.8%);CRM+ 296例(31.4%);腫瘤性質為腺癌712例(75.4%),黏液腺癌161例(17.1%),非腺癌42例(4.4%)[其中印戒細胞癌25例(2.6%),神經內分泌癌9例(1.0%),鱗狀細胞癌6例(0.6%),惡性黑色素瘤2例(0.2%)],未知29例(3.1%);R0切除439例(46.5%),非R0切除378例(40.0%),未知127例(13.5%);根據不同術式分組,經肛ISR組28例(3.0%),部分ISR組606例(64.2%),次全ISR組242例(25.6%),完全ISR組68例(7.2%);單純化療組309例(32.7%),放化療組635例(67.3%);ypTNM分期0期36例(3.8%)、Ⅰ期152例(16.1%),Ⅱ期281例(29.8%),Ⅲ期350例(37.1%),Ⅳ期125例(13.2%)。
2.2 新輔助治療聯合ISR手術的長期生存預后
本研究944例患者獲訪,隨訪時間0.2~167.1個月、53.1(26.9,83.7)個月;中位OS為142.7個月,DSS生存時間相對較長無法獲得中位DSS;3年OS和DSS率分別為89.2%、90.4%,5年OS和DSS率分別為83.9%、85.4%。
2.2.1 不同ISR術式的預后比較
不同ISR組患者的總體、3年、5年OS和DSS比較差異均無統計學意義(P>0.05),見圖1a~1f。
 圖1
示不同ISR術式、新輔助治療方案組患者的總體、3年、5年OS和DSS曲線
圖1
示不同ISR術式、新輔助治療方案組患者的總體、3年、5年OS和DSS曲線
a、b:不同ISR術式患者的總體OS(a)和DSS(b)曲線;c、d:不同ISR術式患者的3年OS(c)和DSS(d)曲線、e、f:不同ISR術式患者的5年OS(e)和DSS(f)曲線;g、h:不同新輔助治療方案患者的總體OS(g)和DSS(h)曲線;i、j:不同新輔助治療方案患者的3年OS(i)和DSS(j)曲線、k、l:不同新輔助治療方案患者的5年OS(k)和DSS(l)曲線
2.2.2 不同新輔助治療方案的預后比較
單純化療組和放化療組患者的總體、3年、5年OS和DSS比較差異均無統計學意義(P>0.05),見圖1g~1l。
2.2.3 不同ypTNM分期的預后比較
不同ypTNM分期患者的總體、3年、5年OS和DSS比較差異均存在統計學意義(P<0.001),其中ypTNM分期為0~Ⅱ期直腸癌患者的OS及DSS優于ypTNM分期為Ⅲ~Ⅳ期直腸癌患者,見圖2。
 圖2
示不同ypTNM分期患者的總體、3年、5年OS和DSS曲線
圖2
示不同ypTNM分期患者的總體、3年、5年OS和DSS曲線
a、b:總體OS(a)和DSS(b)曲線;c、d:3年OS(c)和DSS(d)曲線、e、f:5年OS(e)和DSS(f)曲線
2.3 OS和DSS的影響因素分析
2.3.1 OS的影響因素分析
單因素Cox比例風險回歸分析結果顯示,性別、腫瘤最長直徑、病理為非腺癌、ypTNM分期、CRM+、病理高危因素、R0切除、手術時間與OS相關(P<0.05)。進一步采用多因素Cox比例風險回歸分析結果顯示,BMI [相對于偏瘦,正常:HR=0.241,95%CI(0.082,0.708),P=0.010;超重:HR=0.189,95%CI(0.049,0.727),P=0.015;肥胖:HR=0.072,95%CI(0.006,0.881),P=0.039]、ypTNM分期 [HR=2.453,95%CI(1.631,3.691),P<0.001)、R0切除 [HR=0.431,95%CI(0.193,0.960),P=0.039]是OS的影響因素。見表1和表2。
2.3.2 DSS的影響因素分析
采用單因素Cox比例風險回歸分析結果(表3)顯示,性別、腫瘤最長直徑、病理為非腺癌、ypTNM分期、CRM+、病理高危因素、R0切除、手術時間與DSS相關(P<0.05)。進一步采用多因素Cox比例風險回歸分析結果(表4)顯示,BMI [相對于偏瘦,正常:HR=0.190,95%CI(0.061,0.590),P=0.004;超重:HR=0.103,95%CI(0.023,0.468),P=0.003;肥胖:HR=0.051,95%CI(0.004,0.670),P=0.024]、ypTNM分期 [HR=2.521,95%CI(1.616,3.931),P<0.001)、R0切除 [HR=0.380,95%CI(0.159,0.906),P=0.029]是DSS的影響因素。
2.4 新輔助治療聯合ISR手術的術后并發癥情況
新輔助治療聯合ISR手術的直腸癌患者,術后總體并發癥發生率較低,其中術后30 d以內發生并發癥60例(6.4%),術后30 d至術后半年發生并發癥71例(7.5%),術后半年以上發生并發癥31例(3.3%)。術后30 d并發癥中,早發型吻合口漏23例(2.4%),傷口出血、肛周感染、吻合口出血、術區感染各7例(0.7%),尿潴留、血行感染、炎性腸梗阻各4例(0.4%),造口梗阻3例(0.3%),肺部感染2例(0.2%),傷口裂開、直腸陰道瘺、術區出血、下肢深靜脈血栓、造口脫垂各1例(0.1%)。術后30 d至術后半年并發癥中,造口梗阻20例(2.1%),肛周感染13例(1.4%),遲發型吻合口漏11例(1.2%),直腸陰道瘺7例(0.7%),吻合口狹窄5例(0.5%),小腸梗阻、造口脫垂各4例(0.4%),深靜脈血栓、尿潴留各3例(0.3%),造口旁疝、造口出血各1例(0.1%)。
3 討論
我國直腸癌患者的腫瘤部位以中低位為主,因此這些患者的保肛手術實施一直是外科醫生關心的話題之一。由于我國直腸癌患者臨床就診時多為中晚期,手術前有進行新輔助治療的必要。因此,對低位/超低位直腸癌,尤其是極低位直腸癌在新輔助治療后開展保肛手術的效果和風險是醫生和患者共同關心的臨床問題。新輔助治療可以帶來腫瘤的減瘤降期效果,降低腫瘤的局部復發率,提高手術切除率,增加保肛率,延長患者無病生存時間[4, 13]。但是新輔助治療也會造成一些治療相關的不良事件,特別是新輔助放療所導致的組織水腫和纖維化改變,增加手術難度,術后并發癥如吻合口漏、吻合口狹窄、大小便失禁、性功能障礙等發生率增加[14-16]。與此同時,ISR手術作為極低位直腸癌的重要技術手段,在提高直腸癌患者功能性保肛手術的同時,也可能帶來肛門功能不佳、肛周感染、吻合口愈合緩慢等多種不良事件。因此,對于低位/超低位直腸癌患者,ISR術前接受新輔助治療是否會增加患者的風險,是否會帶來更好的近遠期療效,值得探討。
本研究的主要目的是探索新輔助治療聯合ISR手術后患者的長期效果,分析結果表明,本組所有患者都完成了新輔助治療聯合ISR手術,長期預后結果中,3年OS率和DSS率分別為89.2%、90.4%,5年OS率和DSS率分別為83.9%、85.4%。這一結果與國內主要的低位/超低位直腸癌研究中報道的結果相近[17-18],可以初步說明新輔助治療聯合ISR手術治療低位/超低位直腸癌患者有較好的長期臨床效果。但是因為本研究是對新輔助治療聯合ISR手術患者的分層研究,還未通過病例對照研究或者隨機對照研究的方式進行論證,這也是本團隊下一步將深入研究分析的話題。
ISR的類型和手術具體操作過程有關,為了兼顧ISR術后生存預后和肛門功能預后,ISR手術既要保證足夠的安全切緣,又要盡可能地保留肛門內括約肌,腫瘤的位置及大小決定了ISR術式,通常來說,腫瘤局部情況越嚴重,ISR過程中需要切除內括約肌的范圍也會更寬。本研究比較了不同ISR類型患者的預后,結果發現,不同ISR手術患者的OS和DSS比較差異無統計學意義。國內韓元圣等[19]的研究結果顯示,不同ISR術式患者的3年無病生存期(disease free survival,DFS)的差異有統計學意義(χ2=7.302,P=0.024),部分ISR術式高于其他ISR術式,該研究納入了95例患者,其中部分患者行新輔助放化療,與本研究在設計上存在差異,可能是導致不同結果的原因。同時,本研究結果還提示,經肛-ISR的手術方式可以達到比較滿意的保肛效果,又具有其他ISR術式同樣良好的遠期腫瘤效果,因此,經肛-ISR術式可能是一個更優的手術方案。
多項研究已經證明新輔助放療具有較高的腫瘤局部控制率,但在遠期結局上存在一定爭議[20]。本研究結果顯示不同新輔助治療方案之間的OS和DSS比較差異沒有統計學意義。國內孫祺等[21]的研究顯示,相對于單純新輔助化療,新輔助放化療對直腸腫瘤的退縮反應更好,但2種治療方案在OS和DFS方面的差異無統計學意義。國外一項多中心隨機對照試驗研究[5]對直腸癌患者接受術前新輔助放療與術后放化療的長期預后進行比較,結果顯示術前新輔助放療并不能改善延長患者的OS,試驗共納入1 350例患者(每組675例),2組之間的OS差異沒有統計學意義(P=0.40),與本研究結果相符。術前新輔助放療的目的是縮小腫瘤體積及降低腫瘤分期,為實現保肛創造條件,但不能改善遠期效果,同時也有增加手術風險的可能。因此,低位/超低位直腸癌患者術前新輔助治療是否需要聯合術前放療,可以根據患者實際需要情況而決定。由于本研究中新輔助放療的患者相對有限,還不能體現新輔助放療帶來的影響。因此,設計前瞻性研究對照新輔助放療聯合ISR手術是有價值的研究方向之一。
ISR目前是極低位直腸癌的重要保肛技術,術中切除范圍擴展至括約肌間隙或者更寬,其目的是更好的根治切除效果,降低切緣陽性概率,真正做到安全的極限保肛[22]。據報道,ISR的5年局部復發率較低位前切除術及腹會陰聯合切除術無明顯差異[23],可以作為極低位直腸癌選擇保肛手術的重要依據。Sakr等[24]的研究表明,超低位前切除術(ULAR)組和ISR手術組的3年OS率分別為91.4%和91.7%,3年DFS率分別為79%和79.2%,與本研究的結果相近。因此,ISR手術具有較好的腫瘤學效果。
本研究中,為進一步評估ISR的類型及新輔助治療方案是否是最終影響長期預后效果的影響因素之一,進行了多因素分析。結果發現BMI、ypTNM分期、R0切除是OS和DSS的影響因素。本研究結果表明,新輔助治療方案以及ISR類型都不是最終決定患者OS和DSS的影響因素,最重要的影響因素仍舊是術后ypTNM分期。
與此同時,本研究也對新輔助治療聯合和ISR手術患者的術后并發癥進行了統計。結果發現術后30 d以內并發癥發生率為6.4%,術后30 d至半年內發生率為7.5%,半年以上發生率為3.3%。其中吻合口漏的發生率最高,但也僅為3.6%(術后早發型吻合口漏為2.4%,遲發型吻合口漏為1.2%)。國內研究中,類似患者的吻合口漏發生率為7.6%~12.87%[14, 25-28],單從數據上直觀評價,新輔助治療聯合ISR具有較高的安全性。
總之,在低位/超低位直腸癌患者的綜合治療中,采用新輔助治療聯合ISR手術可獲得較為穩定、良好的遠期腫瘤學療效,且術后并發癥的發生率不高,是可以選擇的手段之一。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,我們沒有相互競爭的利益。
作者貢獻聲明:涂升金主要負責數據統計和描述、結果制圖、文章撰寫;張雯迪、劉健博主要負責大綱梳理、文章修改;殷晉主要負責數據描述、校對修正及數據審查;汪曉東主要負責提供文章數據源及文章修改;李立、楊烈主要負責文章指導。
倫理聲明:本研究已經獲得四川大學華西醫院生物醫學倫理審查委員會審批 [批文編號:2023年審(669)號]。