引用本文: 高夢臻, 李卓峰, 侯義振, 董勝利. 術前PIV和HALP與結直腸癌病理特征的相關性及對微衛星狀態的預測價值. 中國普外基礎與臨床雜志, 2024, 31(9): 1119-1124. doi: 10.7507/1007-9424.202404050 復制
版權信息: ?四川大學華西醫院華西期刊社《中國普外基礎與臨床雜志》版權所有,未經授權不得轉載、改編
結直腸癌是世界上最常見的惡性腫瘤之一,其死亡率在全球癌癥相關死亡率中排名第2[1],主要的治療方法為外科手術,根據腫瘤特征進行新輔助治療、化學治療、免疫治療和靶向治療也是必不可少的部分,充分了解機體炎癥、營養和腫瘤免疫狀態,有助于改善患者總體生存結局[2]。
基于免疫檢查點抑制劑(immune checkpoint inhibitors,ICI)的免疫治療已成為多種癌癥的主要治療方式,微衛星不穩定性(microsatellite instability,MSI)則是應用ICI的重要“靶點” [3],盡早地明確腫瘤微衛星狀態有助于臨床醫師制定最佳治療策略。術前泛免疫炎癥值(pan-immune-inflammation value,PIV)和術前血紅蛋白、白蛋白、淋巴細胞及血小板評分(hemoglobin,albumin,lymphocyte and platelet score,HALP)作為非侵入性的、有效的和極具成本效益的腫瘤預后生物標志物[4],有助于術前評估并改善免疫營養缺乏患者的預后[5],但兩者與腫瘤臨床病理特征的相關性還需要進一步研究。本研究旨在探討術前HALP和PIV與結直腸癌臨床病理特征及微衛星狀態的相關性,更好地評估診斷時機體的免疫炎癥、營養狀態,以有助于協同制定臨床治療方案。
1 資料與方法
1.1 研究對象
回顧性分析2021年5月至2024年2月期間于山西醫科大學第二醫院行結直腸癌根治術的156例患者的臨床資料。本研究通過了山西醫科大學第二醫院倫理委員會的審批同意,批文編號:[2024] YX第236號。
1.2 納入與排除標準
納入標準:① 行結直腸癌根治術;② 術后病理診斷為結腸或直腸惡性腫瘤;③ 化驗、臨床病理資料完整;④ 原發性結直腸癌,術前未進行新輔助放化療。排除標準:① 術前行新輔助放化療;② 存在免疫或血液系統疾病,長期服用影響實驗室檢驗結果的藥物;③ 臨床資料不完整;④ 既往有其他惡性腫瘤病史。
1.3 HALP和PIV計算方法
HALP(分)=血紅蛋白(g/L)×白蛋白(g/L)×淋巴細胞計數(×109/L)/血小板計數(×109/L),PIV=[中性粒細胞計數(×109/L)×血小板計數(×109/L)×單核細胞計數(×109/L)]/淋巴細胞計數(×109/L)。
1.4 研究對象分組
根據計算出的HALP及PIV,再以兩指標計算值的中位數將患者分為相應的高HALP組/低HALP組和高PIV組/低PIV組。HALP的中位數為30.42分,≥30.42分為高HALP組,<30.42分為低HALP組,2組各78例。PIV的中位數為252.29,≥252.29為高PIV組,<252.29為低PIV組,2組各78例。再根據微衛星穩定性檢測結果將患者分為微衛星穩定(microsatellite standard,MSS)組(n=138)和微衛星高度不穩定(microsatellite instability-high,MSI-H)組(n=17),微衛星檢測結果缺失1例。
1.5 資料收集
① 一般資料:包括年齡、性別和體質量指數(body mass index,BMI);② 術前1周實驗室檢查資料:包括血紅蛋白、外周血淋巴細胞計數、中性粒細胞計數、單核細胞計數、血小板計數及血清白蛋白水平;③ 病理資料:包括腫瘤位置、腫瘤最大徑、大體類型、組織學分型、分化程度、浸潤深度、淋巴結轉移、脈管侵犯、神經侵犯、遠處轉移、TNM分期及微衛星狀態。
1.6 統計學方法
采用SPSS 27.0軟件統計分析處理數據。計量資料的正態性檢驗采用Kolmogorov-Smirnov 檢驗,符合正態分布的計量資料以均數±標準差( ±s)表示,運用Student’s t檢驗進行分析;偏態分布資料則以中位數(M)和上下四分位數(P25,P75)表示,運用非參數檢驗進行分析。定性資料以例數(%)表示,分類變量組間比較采用χ2檢驗、連續校正卡方或Fisher精確概率法進行分析,等級資料組間比較采用Wilcoxon秩和檢驗。采用Spearman分析HALP與PIV的相關性;根據受試者工作特征(receiver operating characteristic,ROC)曲線下面積(area under curve, AUC)及最佳截斷值,分析HALP和PIV對結直腸癌微衛星狀態的預測價值。檢驗水準α=0.05。
±s)表示,運用Student’s t檢驗進行分析;偏態分布資料則以中位數(M)和上下四分位數(P25,P75)表示,運用非參數檢驗進行分析。定性資料以例數(%)表示,分類變量組間比較采用χ2檢驗、連續校正卡方或Fisher精確概率法進行分析,等級資料組間比較采用Wilcoxon秩和檢驗。采用Spearman分析HALP與PIV的相關性;根據受試者工作特征(receiver operating characteristic,ROC)曲線下面積(area under curve, AUC)及最佳截斷值,分析HALP和PIV對結直腸癌微衛星狀態的預測價值。檢驗水準α=0.05。
2 結果
2.1 高PIV組和低PIV組以及高HALP組和低HALP組患者臨床病理資料比較結果
本研究共納入研究對象156例,年齡為(64.52±11.97)歲, BMI為(22.9±3.1)kg/m2,其中男性80例(51.28%),女性76例(48.72%);HALP為30.42(19.75,44.20)分,PIV為252.29(138.87,484.40),腫瘤位置位于左側結腸者27例(17.31%),位于直腸78例(50.00%),右側結腸51例(32.69%)。
相關性分析結果顯示,HALP評分與PIV存在弱的負相關關系(rs=–0.476 8,P<0.001)。高PIV組和低PIV組患者在腫瘤直徑、腫瘤部位、微衛星狀態、HALP和T分期方面的差異具有統計學意義(P<0.05),高PIV多見于右側結腸癌和MSI-H患者,且腫瘤較大、T分期高;其他臨床病理資料方面的差異無統計學意義(P>0.05)。高HALP組和低HALP組患者在性別、BMI、PIV、腫瘤直徑、腫瘤部位、微衛星狀態及T分期方面的差異具有統計學意義(P<0.05),低HALP多見于女性、右側結腸癌及MSI-H患者,且BMI較低、腫瘤較大、T分期高;其他臨床病理資料方面的差異無統計學意義(P>0.05)。具體見表1。
2.2 MSS組和MSI-H組患者的HALP和PIV結果
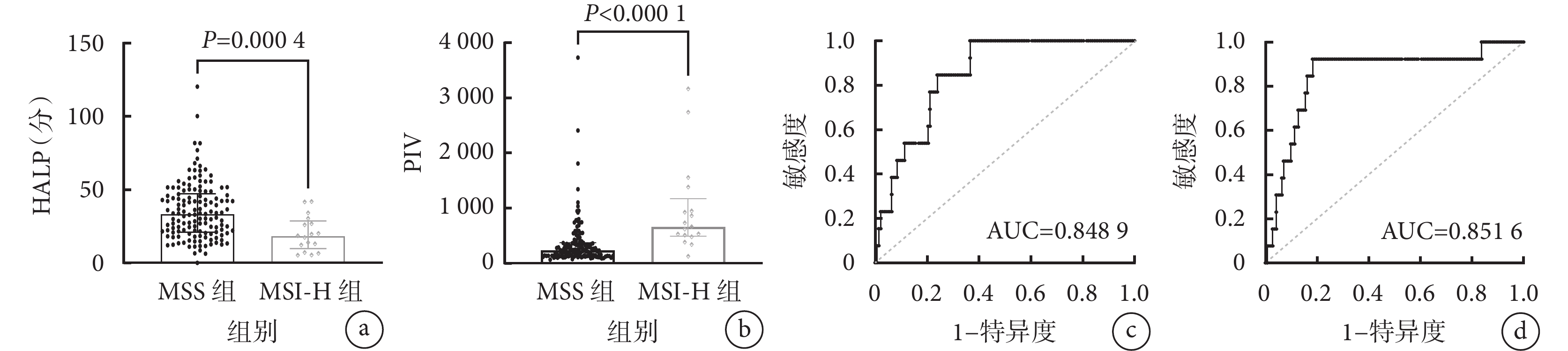
2組患者的HALP和PIV差異均有統計學意義(P<0.05),MSI-H的患者易出現低HALP和高PIV。具體見圖1a和1b。
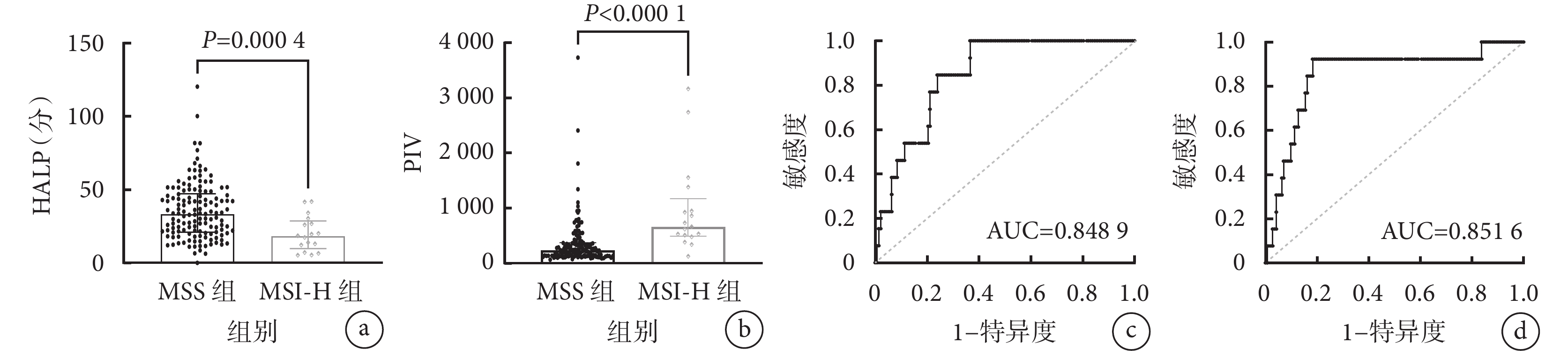 圖1
示MSS組和MSI-H組患者HALP(a)及PIV(b)的比較結果以及HALP(c)和PIV(d)預測MSI-H的ROC曲線
圖1
示MSS組和MSI-H組患者HALP(a)及PIV(b)的比較結果以及HALP(c)和PIV(d)預測MSI-H的ROC曲線
2.3 HALP和PIV對MSI-H的預測價值分析結果
繪制ROC曲線分析HALP和PIV對結直腸癌患者MSI-H的預測價值。 結果顯示: 術前HALP預測結直腸癌患者微衛星狀態為MSI-H的AUC為0.848 9 [95%CI為(0.771 1,0.926 6)],約登指數的最大值為0.634,最佳臨界值為26.84分,其敏感度為1.000,特異度為0.634。 PIV預測結直腸癌患者MSI-H的AUC為0.851 6 [95%CI為(0.733 8,0.969 4)],約登指數的最大值為0.742,PIV的最佳臨界值為507.04,其敏感度為0.923,特異度為0.817。具體見圖1c和1d。
3 討論
3.1 HALP和PIV與結直腸癌
機體的營養狀態和免疫炎癥反應與結直腸癌的發生發展緊密相關[6]。癌癥相關炎癥在許多惡性腫瘤中普遍存在,與腫瘤特征(如增殖、侵襲、轉移)有關,也在一定程度上抑制治療反應,影響生存結果[7]。腫瘤相關炎癥細胞的變化顯示了腫瘤的炎癥反應程度,較明顯的炎癥反應通常表明預后較差[8]。炎癥可以通過誘導免疫抑制來影響腫瘤微環境,而免疫抑制個體的腫瘤發展風險往往會增加[9]。免疫作為防御癌癥的主力軍,是目前癌癥研究領域的重點,免疫療法也逐漸成為癌癥的重要治療方法[10]。
免疫炎癥生物標志物(immune-inflammatorybiomarkers,IIBs)可以反映宿主炎癥和免疫狀態之間的平衡,包括中性粒細胞與淋巴細胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板與淋巴細胞比值(platelet-to-lymphocyteratio,PLR)和單核細胞與淋巴細胞比值(monocyte-to-lymphocyteratio,MLR),MLR、PLR和NLR作為常用的外周血免疫炎性指標,已被證實與結直腸癌[11]、子宮內膜癌[12]、胃癌[13]、肝細胞癌[14]等多種惡性腫瘤的臨床病理特征及預后相關。 2020年Fucà等[15]整合了NLR、血小板計數和單核細胞計數開發出一種新型IIBs即PIV,可作為轉移性結直腸癌、食管癌[16]或乳腺癌[17]患者生存結局的強預測因子。Zhao等[18]研究發現,高PIV組右半結腸癌較多,且腫瘤大,這與本研究結果相同;此外還發現高PIV組患者T分期晚、CEA及CA-125更高、更易出現低蛋白血癥。本研究未進行腫瘤標志物及白蛋白的相關分析,關于腫瘤分期等特征還需要更進一步的大樣本研究。Yang等[19]進行的一項meta分析發現,PIV在不同腫瘤中的臨界值異質性顯著,但總的來說,高PIV組患者的總體生存期較短。
2015年Chen等[20]基于術前血紅蛋白、白蛋白、淋巴細胞和血小板的數值建立了HALP評分,發現其在胃癌預后中顯示出強大的預測能力,并與腫瘤直徑、T分期等臨床病理特征顯著相關,是評估人體免疫和營養狀態的綜合性指標,在結腸癌[21]、胃癌[22]、膽管癌[23]、肝細胞癌[24]等多種惡性腫瘤展現出其對總生存期、無進展生存期、無復發生存期等結局的預測能力,在一定程度上還能預測機體對免疫療法的反應[25]。Leetanaporn等[26]研究表明,低HALP的子宮內膜癌患者往往年齡較小、BMI較低、腫瘤較大且浸潤程度更深。 楊立民等[27]通過回顧性分析163例結直腸癌患者的臨床資料,得出腫瘤直徑 ≥5 cm、術前癌胚抗原 ≥5 μg/L、漿膜及以外浸潤、淋巴結轉移和脈管侵犯患者的HALP降低。與PIV相同,盡管在多種惡性腫瘤中的臨界值范圍不同,但低HALP患者總體腫瘤較大、預后較差。
本研究通過對156例結直腸癌患者的臨床病理資料進行分析得出,高PIV患者腫瘤較大、T分期高,低HALP多見于女性,其BMI較低、腫瘤較大、T分期更高,表現為營養缺乏、免疫力差、腫瘤較大,這與既往研究結果無差異。同時,本研究還發現,HALP和PIV與腫瘤部位密切相關,低HALP及高PIV多發生于右側結腸癌,這可能是一個新的進展。通過計算術前HALP和PIV有助于臨床醫師評估腫瘤患者的免疫炎癥狀態,全面地制定治療方案,但兩者與腫瘤分期、分化程度等病理特征的關系仍需要進行大樣本量的研究;此外,低HALP、高PIV是否與結直腸癌的發生相關,這一問題需要后續與正常人群進行對照研究。
3.2 MSI與結直腸癌
近年來,免疫療法在結直腸癌治療中的重要性日漸顯現,其生物標志物主要包括微衛星不穩定性(microsatellite instability,MSI)、程序性死亡配體-1(programmed cell death-ligand1,PD-L1)和腫瘤突變負荷(tumor mutation burden,TMB)。MSI-H是由于DNA錯配修復缺陷(deficient mismatch repair,dMMR)引起的,在結直腸癌中占5%,MSI已被確定為診斷和治療結直腸癌獨特且關鍵的生物標志物。MSI-H的結直腸癌患者生存率顯著優于MSS的患者[28],這得益于ICI在實體瘤的有效使用。該類患者的TMB高、程序性死亡受體1(programmed death-1,PD-1)/PD-L1表達增強,表現出強烈的淋巴細胞激活和炎癥性腫瘤微環境,抑制轉移潛力,并因此對ICI具有高度反應性,ICI單藥治療或聯合化療應用在dMMR/MSI-H結直腸癌治療方面可有效延長患者的生存期[29],針對這一部分優勢人群有助于改善預后,提高患者遠期生存質量。
目前微衛星檢測方法包括聚合酶鏈式反應、二代測序和免疫組化,高昂的檢測成本和有限的資源是阻礙MSI檢測在結直腸癌患者中廣泛應用的關鍵因素。Zhao等[30]對2 279例結直腸癌患者進行了回顧性研究,將血清CA72-4和癌胚抗原與患者年齡、組織學類型、腫瘤大小、腫瘤位置、分化程度、淋巴結轉移和周圍神經浸潤相結合,預測結直腸癌患者的MSI-H/dMMR狀態,AUC為0.849。本研究結果表明,MSI-H患者易出現低HALP、高PIV, HALP和PIV均對MSI-H具有一定的預測價值,并且PIV的單項預測價值高于Zhao等的多項指標聯合預測,AUC為0.851 6。因此我們認為,對于組織標本難以獲得、MSI檢測有困難的患者或許可以通過計算HALP和PIV來評估微衛星狀態,進而指導進一步的治療。考慮到微衛星不穩定性發生率低,且本研究中MSI-H的患者僅17例,在一定程度上影響研究結論,未來需要進行更大樣本量的研究來驗證。
4 結論
低HALP和高PIV多見于右側結腸癌、MSI-H的患者,患者的營養免疫狀況差,炎癥較重,并且腫瘤更大,浸潤程度更深,并且對MSI-H具有預測價值,在一定程度上能夠協助制定臨床治療方案。但由于單中心回顧性研究的局限性,未來還需要進一步的研究確定HALP和PIV預測MSI-H 的預測界值。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,不存在利益沖突。
作者貢獻聲明:高夢臻負責收集、整理和分析數據并撰寫論文;李卓峰負責修改論文框架及研究項目管理;侯義振核對數據并對文章內容作初步審閱;董勝利指導研究方向、審閱文章并提出修改意見。
倫理聲明:本研究通過了山西醫科大學第二醫院倫理委員會醫學研究倫理審批,批文編號:[2024]YX第236號。
結直腸癌是世界上最常見的惡性腫瘤之一,其死亡率在全球癌癥相關死亡率中排名第2[1],主要的治療方法為外科手術,根據腫瘤特征進行新輔助治療、化學治療、免疫治療和靶向治療也是必不可少的部分,充分了解機體炎癥、營養和腫瘤免疫狀態,有助于改善患者總體生存結局[2]。
基于免疫檢查點抑制劑(immune checkpoint inhibitors,ICI)的免疫治療已成為多種癌癥的主要治療方式,微衛星不穩定性(microsatellite instability,MSI)則是應用ICI的重要“靶點” [3],盡早地明確腫瘤微衛星狀態有助于臨床醫師制定最佳治療策略。術前泛免疫炎癥值(pan-immune-inflammation value,PIV)和術前血紅蛋白、白蛋白、淋巴細胞及血小板評分(hemoglobin,albumin,lymphocyte and platelet score,HALP)作為非侵入性的、有效的和極具成本效益的腫瘤預后生物標志物[4],有助于術前評估并改善免疫營養缺乏患者的預后[5],但兩者與腫瘤臨床病理特征的相關性還需要進一步研究。本研究旨在探討術前HALP和PIV與結直腸癌臨床病理特征及微衛星狀態的相關性,更好地評估診斷時機體的免疫炎癥、營養狀態,以有助于協同制定臨床治療方案。
1 資料與方法
1.1 研究對象
回顧性分析2021年5月至2024年2月期間于山西醫科大學第二醫院行結直腸癌根治術的156例患者的臨床資料。本研究通過了山西醫科大學第二醫院倫理委員會的審批同意,批文編號:[2024] YX第236號。
1.2 納入與排除標準
納入標準:① 行結直腸癌根治術;② 術后病理診斷為結腸或直腸惡性腫瘤;③ 化驗、臨床病理資料完整;④ 原發性結直腸癌,術前未進行新輔助放化療。排除標準:① 術前行新輔助放化療;② 存在免疫或血液系統疾病,長期服用影響實驗室檢驗結果的藥物;③ 臨床資料不完整;④ 既往有其他惡性腫瘤病史。
1.3 HALP和PIV計算方法
HALP(分)=血紅蛋白(g/L)×白蛋白(g/L)×淋巴細胞計數(×109/L)/血小板計數(×109/L),PIV=[中性粒細胞計數(×109/L)×血小板計數(×109/L)×單核細胞計數(×109/L)]/淋巴細胞計數(×109/L)。
1.4 研究對象分組
根據計算出的HALP及PIV,再以兩指標計算值的中位數將患者分為相應的高HALP組/低HALP組和高PIV組/低PIV組。HALP的中位數為30.42分,≥30.42分為高HALP組,<30.42分為低HALP組,2組各78例。PIV的中位數為252.29,≥252.29為高PIV組,<252.29為低PIV組,2組各78例。再根據微衛星穩定性檢測結果將患者分為微衛星穩定(microsatellite standard,MSS)組(n=138)和微衛星高度不穩定(microsatellite instability-high,MSI-H)組(n=17),微衛星檢測結果缺失1例。
1.5 資料收集
① 一般資料:包括年齡、性別和體質量指數(body mass index,BMI);② 術前1周實驗室檢查資料:包括血紅蛋白、外周血淋巴細胞計數、中性粒細胞計數、單核細胞計數、血小板計數及血清白蛋白水平;③ 病理資料:包括腫瘤位置、腫瘤最大徑、大體類型、組織學分型、分化程度、浸潤深度、淋巴結轉移、脈管侵犯、神經侵犯、遠處轉移、TNM分期及微衛星狀態。
1.6 統計學方法
采用SPSS 27.0軟件統計分析處理數據。計量資料的正態性檢驗采用Kolmogorov-Smirnov 檢驗,符合正態分布的計量資料以均數±標準差( ±s)表示,運用Student’s t檢驗進行分析;偏態分布資料則以中位數(M)和上下四分位數(P25,P75)表示,運用非參數檢驗進行分析。定性資料以例數(%)表示,分類變量組間比較采用χ2檢驗、連續校正卡方或Fisher精確概率法進行分析,等級資料組間比較采用Wilcoxon秩和檢驗。采用Spearman分析HALP與PIV的相關性;根據受試者工作特征(receiver operating characteristic,ROC)曲線下面積(area under curve, AUC)及最佳截斷值,分析HALP和PIV對結直腸癌微衛星狀態的預測價值。檢驗水準α=0.05。
±s)表示,運用Student’s t檢驗進行分析;偏態分布資料則以中位數(M)和上下四分位數(P25,P75)表示,運用非參數檢驗進行分析。定性資料以例數(%)表示,分類變量組間比較采用χ2檢驗、連續校正卡方或Fisher精確概率法進行分析,等級資料組間比較采用Wilcoxon秩和檢驗。采用Spearman分析HALP與PIV的相關性;根據受試者工作特征(receiver operating characteristic,ROC)曲線下面積(area under curve, AUC)及最佳截斷值,分析HALP和PIV對結直腸癌微衛星狀態的預測價值。檢驗水準α=0.05。
2 結果
2.1 高PIV組和低PIV組以及高HALP組和低HALP組患者臨床病理資料比較結果
本研究共納入研究對象156例,年齡為(64.52±11.97)歲, BMI為(22.9±3.1)kg/m2,其中男性80例(51.28%),女性76例(48.72%);HALP為30.42(19.75,44.20)分,PIV為252.29(138.87,484.40),腫瘤位置位于左側結腸者27例(17.31%),位于直腸78例(50.00%),右側結腸51例(32.69%)。
相關性分析結果顯示,HALP評分與PIV存在弱的負相關關系(rs=–0.476 8,P<0.001)。高PIV組和低PIV組患者在腫瘤直徑、腫瘤部位、微衛星狀態、HALP和T分期方面的差異具有統計學意義(P<0.05),高PIV多見于右側結腸癌和MSI-H患者,且腫瘤較大、T分期高;其他臨床病理資料方面的差異無統計學意義(P>0.05)。高HALP組和低HALP組患者在性別、BMI、PIV、腫瘤直徑、腫瘤部位、微衛星狀態及T分期方面的差異具有統計學意義(P<0.05),低HALP多見于女性、右側結腸癌及MSI-H患者,且BMI較低、腫瘤較大、T分期高;其他臨床病理資料方面的差異無統計學意義(P>0.05)。具體見表1。
2.2 MSS組和MSI-H組患者的HALP和PIV結果
2組患者的HALP和PIV差異均有統計學意義(P<0.05),MSI-H的患者易出現低HALP和高PIV。具體見圖1a和1b。
 圖1
示MSS組和MSI-H組患者HALP(a)及PIV(b)的比較結果以及HALP(c)和PIV(d)預測MSI-H的ROC曲線
圖1
示MSS組和MSI-H組患者HALP(a)及PIV(b)的比較結果以及HALP(c)和PIV(d)預測MSI-H的ROC曲線
2.3 HALP和PIV對MSI-H的預測價值分析結果
繪制ROC曲線分析HALP和PIV對結直腸癌患者MSI-H的預測價值。 結果顯示: 術前HALP預測結直腸癌患者微衛星狀態為MSI-H的AUC為0.848 9 [95%CI為(0.771 1,0.926 6)],約登指數的最大值為0.634,最佳臨界值為26.84分,其敏感度為1.000,特異度為0.634。 PIV預測結直腸癌患者MSI-H的AUC為0.851 6 [95%CI為(0.733 8,0.969 4)],約登指數的最大值為0.742,PIV的最佳臨界值為507.04,其敏感度為0.923,特異度為0.817。具體見圖1c和1d。
3 討論
3.1 HALP和PIV與結直腸癌
機體的營養狀態和免疫炎癥反應與結直腸癌的發生發展緊密相關[6]。癌癥相關炎癥在許多惡性腫瘤中普遍存在,與腫瘤特征(如增殖、侵襲、轉移)有關,也在一定程度上抑制治療反應,影響生存結果[7]。腫瘤相關炎癥細胞的變化顯示了腫瘤的炎癥反應程度,較明顯的炎癥反應通常表明預后較差[8]。炎癥可以通過誘導免疫抑制來影響腫瘤微環境,而免疫抑制個體的腫瘤發展風險往往會增加[9]。免疫作為防御癌癥的主力軍,是目前癌癥研究領域的重點,免疫療法也逐漸成為癌癥的重要治療方法[10]。
免疫炎癥生物標志物(immune-inflammatorybiomarkers,IIBs)可以反映宿主炎癥和免疫狀態之間的平衡,包括中性粒細胞與淋巴細胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板與淋巴細胞比值(platelet-to-lymphocyteratio,PLR)和單核細胞與淋巴細胞比值(monocyte-to-lymphocyteratio,MLR),MLR、PLR和NLR作為常用的外周血免疫炎性指標,已被證實與結直腸癌[11]、子宮內膜癌[12]、胃癌[13]、肝細胞癌[14]等多種惡性腫瘤的臨床病理特征及預后相關。 2020年Fucà等[15]整合了NLR、血小板計數和單核細胞計數開發出一種新型IIBs即PIV,可作為轉移性結直腸癌、食管癌[16]或乳腺癌[17]患者生存結局的強預測因子。Zhao等[18]研究發現,高PIV組右半結腸癌較多,且腫瘤大,這與本研究結果相同;此外還發現高PIV組患者T分期晚、CEA及CA-125更高、更易出現低蛋白血癥。本研究未進行腫瘤標志物及白蛋白的相關分析,關于腫瘤分期等特征還需要更進一步的大樣本研究。Yang等[19]進行的一項meta分析發現,PIV在不同腫瘤中的臨界值異質性顯著,但總的來說,高PIV組患者的總體生存期較短。
2015年Chen等[20]基于術前血紅蛋白、白蛋白、淋巴細胞和血小板的數值建立了HALP評分,發現其在胃癌預后中顯示出強大的預測能力,并與腫瘤直徑、T分期等臨床病理特征顯著相關,是評估人體免疫和營養狀態的綜合性指標,在結腸癌[21]、胃癌[22]、膽管癌[23]、肝細胞癌[24]等多種惡性腫瘤展現出其對總生存期、無進展生存期、無復發生存期等結局的預測能力,在一定程度上還能預測機體對免疫療法的反應[25]。Leetanaporn等[26]研究表明,低HALP的子宮內膜癌患者往往年齡較小、BMI較低、腫瘤較大且浸潤程度更深。 楊立民等[27]通過回顧性分析163例結直腸癌患者的臨床資料,得出腫瘤直徑 ≥5 cm、術前癌胚抗原 ≥5 μg/L、漿膜及以外浸潤、淋巴結轉移和脈管侵犯患者的HALP降低。與PIV相同,盡管在多種惡性腫瘤中的臨界值范圍不同,但低HALP患者總體腫瘤較大、預后較差。
本研究通過對156例結直腸癌患者的臨床病理資料進行分析得出,高PIV患者腫瘤較大、T分期高,低HALP多見于女性,其BMI較低、腫瘤較大、T分期更高,表現為營養缺乏、免疫力差、腫瘤較大,這與既往研究結果無差異。同時,本研究還發現,HALP和PIV與腫瘤部位密切相關,低HALP及高PIV多發生于右側結腸癌,這可能是一個新的進展。通過計算術前HALP和PIV有助于臨床醫師評估腫瘤患者的免疫炎癥狀態,全面地制定治療方案,但兩者與腫瘤分期、分化程度等病理特征的關系仍需要進行大樣本量的研究;此外,低HALP、高PIV是否與結直腸癌的發生相關,這一問題需要后續與正常人群進行對照研究。
3.2 MSI與結直腸癌
近年來,免疫療法在結直腸癌治療中的重要性日漸顯現,其生物標志物主要包括微衛星不穩定性(microsatellite instability,MSI)、程序性死亡配體-1(programmed cell death-ligand1,PD-L1)和腫瘤突變負荷(tumor mutation burden,TMB)。MSI-H是由于DNA錯配修復缺陷(deficient mismatch repair,dMMR)引起的,在結直腸癌中占5%,MSI已被確定為診斷和治療結直腸癌獨特且關鍵的生物標志物。MSI-H的結直腸癌患者生存率顯著優于MSS的患者[28],這得益于ICI在實體瘤的有效使用。該類患者的TMB高、程序性死亡受體1(programmed death-1,PD-1)/PD-L1表達增強,表現出強烈的淋巴細胞激活和炎癥性腫瘤微環境,抑制轉移潛力,并因此對ICI具有高度反應性,ICI單藥治療或聯合化療應用在dMMR/MSI-H結直腸癌治療方面可有效延長患者的生存期[29],針對這一部分優勢人群有助于改善預后,提高患者遠期生存質量。
目前微衛星檢測方法包括聚合酶鏈式反應、二代測序和免疫組化,高昂的檢測成本和有限的資源是阻礙MSI檢測在結直腸癌患者中廣泛應用的關鍵因素。Zhao等[30]對2 279例結直腸癌患者進行了回顧性研究,將血清CA72-4和癌胚抗原與患者年齡、組織學類型、腫瘤大小、腫瘤位置、分化程度、淋巴結轉移和周圍神經浸潤相結合,預測結直腸癌患者的MSI-H/dMMR狀態,AUC為0.849。本研究結果表明,MSI-H患者易出現低HALP、高PIV, HALP和PIV均對MSI-H具有一定的預測價值,并且PIV的單項預測價值高于Zhao等的多項指標聯合預測,AUC為0.851 6。因此我們認為,對于組織標本難以獲得、MSI檢測有困難的患者或許可以通過計算HALP和PIV來評估微衛星狀態,進而指導進一步的治療。考慮到微衛星不穩定性發生率低,且本研究中MSI-H的患者僅17例,在一定程度上影響研究結論,未來需要進行更大樣本量的研究來驗證。
4 結論
低HALP和高PIV多見于右側結腸癌、MSI-H的患者,患者的營養免疫狀況差,炎癥較重,并且腫瘤更大,浸潤程度更深,并且對MSI-H具有預測價值,在一定程度上能夠協助制定臨床治療方案。但由于單中心回顧性研究的局限性,未來還需要進一步的研究確定HALP和PIV預測MSI-H 的預測界值。
重要聲明
利益沖突聲明:本文全體作者閱讀并理解了《中國普外基礎與臨床雜志》的政策聲明,不存在利益沖突。
作者貢獻聲明:高夢臻負責收集、整理和分析數據并撰寫論文;李卓峰負責修改論文框架及研究項目管理;侯義振核對數據并對文章內容作初步審閱;董勝利指導研究方向、審閱文章并提出修改意見。
倫理聲明:本研究通過了山西醫科大學第二醫院倫理委員會醫學研究倫理審批,批文編號:[2024]YX第236號。