引用本文: 單霞, 印青青, 史玉婷, 費凡, 萬兵, 張秀偉. GNRI在穩定期老年慢性阻塞性肺疾病患者營養篩查中的應用分析. 中國呼吸與危重監護雜志, 2023, 22(10): 692-696. doi: 10.7507/1671-6205.202212018 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
慢性阻塞性肺疾病(簡稱慢阻肺)患者經常合并營養不良,營養不良的篩查是慢阻肺患者病情評估的重要部分。國內外對于慢阻肺患者營養不良的診斷標準及營養風險篩查方法始終未能統一,尚無評價的金標準,有研究報道慢阻肺患者營養不良發生率在20.0%~71.5%[1-3]。體重指數(body mass index,BMI)、血清白蛋白水平是常用于臨床的營養篩查方法,但是指標單一,不能反映患者的整體營養狀況。營養不良通用篩查工具(Malnutrition Universal Screening Tool,MUST)適用于絕大部分住院患者和門診患者的營養風險篩查,研究表明MUST是慢阻肺患者營養不良篩查的有效工具[4-5]。老年營養風險指數(Geriatric Nutritional Risk Index,GNRI)是Bouillanne等[6]提出的針對老年患者的新型營養篩查工具。有研究表明GNRI可用于非小細胞肺癌、心功能不全等患者的營養篩查[7-8]。目前GNRI用于慢阻肺患者營養篩查的研究較少,本研究擬用GNRI對門診老年慢阻肺患者進行營養篩查,以MUST作為參照診斷標準,對其能效進行評估,為GNRI在臨床合理應用提供依據。
1 資料與方法
1.1 臨床資料
本研究為橫斷面比較研究。選取2021年4月—2022年4月在南京醫科大學附屬江寧醫院門診就診的老年慢阻肺患者105例為研究對象,男78例,女27例。納入標準:① 年齡>65歲;② 新診斷或既往診斷的慢阻肺患者,診斷符合《慢性阻塞性肺疾病診治指南(2021年修訂版)》;③ 病情處于穩定期;④ 患者資料完整。排除標準:① 哮喘、支氣管擴張、塵肺等慢阻肺以外的慢性呼吸系統疾病;② 3個月內有慢阻肺急性加重史、近1個月有新發感染性疾病;③ 除慢阻肺外的其他慢性病導致近期不能進食; ④ 肝腎疾病、糖尿病、甲狀腺病變、惡性腫瘤等對營養狀況有影響的患者;⑤ 長期臥床不能下床走路、不能配合完成肺功能者。所有患者均自愿參與本研究并簽署知情同意書。
1.2 方法
1.2.1 營養風險篩查方法
使用MUST及GNRI進行營養風險篩查。MUST有3個獨立評分標準:① BMI;② 近3~6個月體重丟失;③ 急性疾病影響。總分為三部分相加, 0分為低營養風險; 1分為中等營養風險;≥2 分為高營養風險。本研究將MUST評分≥1分判斷為營養不良。GNRI根據身高(cm)、體重(kg)、理想體重(kg)、血清白蛋白(g/L)等參數計算GNRI。GNRI=1.489×白蛋白+ 41.7×[體重/理想體重]。GNRI營養篩查分為4個等級:GNRI<82為高營養風險;82≤GNRI<92為中營養風險;92≤GNRI≤98為低營養風險、GNRI>98時無營養風險。本研究以GNRI 92為界點分為高GNRI組(營養正常組),低GNRI組(營養不良組)。
1.2.2 各項指標的界定
BMI<18.5 kg/m2判定患者營養不良;當天或次日清晨空腹抽取靜脈血,血清白蛋白小于35 g/L認為患者營養不良。使用改良英國醫學研究委員會呼吸困難問卷(modified medical research council dyspnea scale,mMRC)進行呼吸困難評分。0級:劇烈活動時出現呼吸困難;1級:平地快步行走或爬緩坡時出現呼吸困難;2級:由于呼吸困難,平地行走時要比同齡人慢或需要停下來休息;3級: 平地行走100 m左右或數分鐘即需要停下來喘氣;4級:因嚴重呼吸困難而不能離開家,或是在穿衣脫衣時即出現呼吸困難。
1.2.3 肺功能檢查
采用Master screen?PFT肺功能儀(德國Jaeger公司)進行測定。由專業技師依據美國胸科協會/歐洲呼吸協會指南中的測試方法進行測定,主要測定參數包括:用力肺活量(forced vital capacity,FVC)、第1秒用力呼氣容積(forced expiratory volume in one second,FEV1)、第一秒用力呼氣容積占用力肺活量百分比(FEV1/FVC)。常規肺功能各參數占預計值百分比用%pred表示。
1.2.4 6分鐘步行距離
在 30 m長的室內走廊,囑患者在6分鐘內以盡可能快的速度沿著筆直的路線行走,當覺得氣短時可減慢速度或停下來休息,一旦感覺病情允許則繼續行走,實時記錄患者血壓、心率、脈氧飽和度(pulse oxygen saturation,SpO2)并記錄患者6 min內行走的最長距離,即為6分鐘步行距離(6-minute walk distance,6MWD)。
1.3 統計學方法
采用SPSS 27.0統計軟件,正態分布計量資料以均數±標準差( ±s)表示,組間比較采用獨立樣本t檢驗;計數資料以例數表示,組間比較采用χ2檢驗。相關性分析采用Spearman檢驗或Pearson檢驗。應用Graphpad Prism9.4繪制線性回歸圖。約登指數由敏感性加上特異性減去1計算得出。診斷方法一致性檢驗使用Kappa檢驗,Kappa≥0.75為一致性較好;0.4≤Kappa<0.75為一致性中等;Kappa<0.4為一致性很差。P<0.05為差異有統計學意義。
±s)表示,組間比較采用獨立樣本t檢驗;計數資料以例數表示,組間比較采用χ2檢驗。相關性分析采用Spearman檢驗或Pearson檢驗。應用Graphpad Prism9.4繪制線性回歸圖。約登指數由敏感性加上特異性減去1計算得出。診斷方法一致性檢驗使用Kappa檢驗,Kappa≥0.75為一致性較好;0.4≤Kappa<0.75為一致性中等;Kappa<0.4為一致性很差。P<0.05為差異有統計學意義。
2 結果
2.1 基本情況
105例老年門診慢阻肺患者入組本研究,年齡66~90歲,平均年齡(73.1±5.5)歲;男78例,女27例。根據GOLD分組標準,A組患者25例(23.8%),B組患者26例(24.8%),C組20例(19.0%),D組患者34例(42.4%)。營養正常組有59例,其中無風險33例,低風險26例;營養不良組共46例,其中中風險39例,高風險7例)。各組患者的營養不良率見表1, D組患者中營養不良率達61.8%,其次分別為C組(45.0%),B組(34.6%)和A組(28.0%)。
2.2 兩組的基線特征及相關參數的比較
營養正常組和營養不良組患者性別、年齡、吸煙史、C反應蛋白、FEV1/FVC%pred、靜息時SpO2、mMRC評分均無顯著差異(P>0.05),兩組患者BMI、血清白蛋白、FEV1%pred、6MWD、過去一年急性加重次數均有顯著差異(P<0.05)。結果見表2。
2.3 四種不同營養篩查方法結果的比較
用BMI、血清白蛋白、MUST、GNRI四種營養篩查方法對門診老年慢阻肺患者營養篩查,營養不良率分別為32.4%、25.7%、41.9%、43.8%。GNRI的營養不良診斷率高于其他三種方法。結果見表3。
2.4 篩查工具效能比較
以MUST為判斷標準,評估BMI、血清白蛋白和GNRI對慢阻肺營養不良的篩查效能,GNRI的敏感性81.8%,特異性83.6%,準確度82.9%,Kappa值0.60,具有較好的診斷效能。結果見表4。
2.5 GNRI和相關的指標進行相關性分析
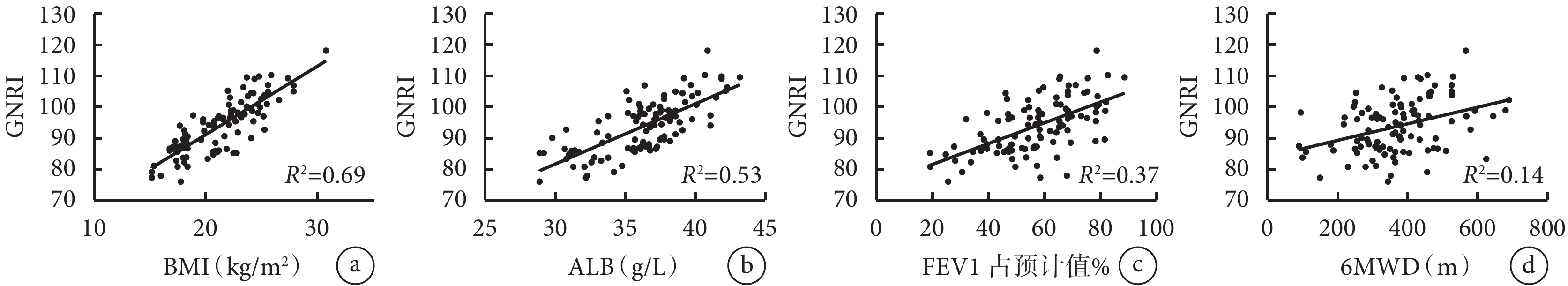
GNRI與BMI、血清白蛋白、FEV1%pred、6MWD、過去一年急性加重次數顯著相關,與FEV1/FVC%pred、C反應蛋白、靜息時SpO2、mMRC無明顯相關性。結果見表5和圖1。
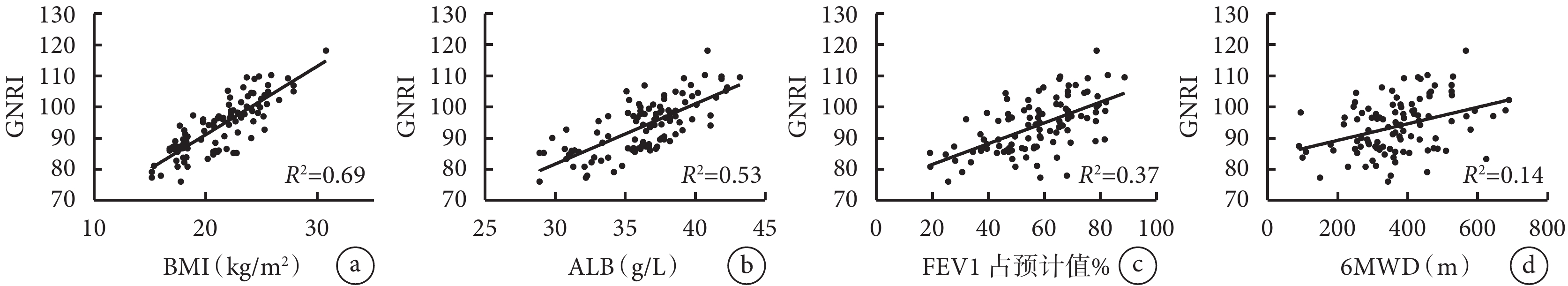 圖1
GNRI與BMI、血清白蛋白、FEV1%pred、6MWD之間的線性回歸圖
圖1
GNRI與BMI、血清白蛋白、FEV1%pred、6MWD之間的線性回歸圖
a. BMI;b. 血清白蛋白;c. FEV1%pred;d. 6MWD。
3 討論
體重減輕是慢阻肺患者較常見的表現,常常和全身性炎癥相關,伴隨呼吸肌肉能量消耗,引起呼吸困難、活動受限,嚴重影響生活質量。營養不良是慢阻肺患者住院時間延長、再次住院次數增多、病死率升高的危險因素[9]。評估慢阻肺患者營養狀況,及時發現慢阻肺患者營養不良風險并進行營養支持十分重要。
作為一種新型營養評價指標,GNRI根據患者當前體重、理想體重和血清白蛋白水平計算得出。已有研究表明GNRI與老年重癥社區獲得性肺炎、惡性腫瘤、心功能不全的預后相關[7-8, 10-12],是識別營養不良的簡單有效工具。
目前關于GNRI在慢阻肺營養篩查中的研究甚少,Matsumura等[13]對63例老年男性慢阻肺患者(包含住院和門診)研究發現營養不良組6MWD低于營養正常組。與BMI相比,GNRI與慢阻肺患者運動耐量的關系更密切,表明低GNRI可能是慢阻肺患者低運動耐量的預測指標。本研究中GNRI與6MWD呈正相關,營養不良組的6MWD為(324.2±105.4)m,較營養正常組的(409.0±118.0)m低85 m,證實營養不良組患者的運動耐量更差。本研究中營養不良組的6MWD高于Matsumura等[13]的(211.1±125.3)m,可能與本研究入組的均為門診慢阻肺患者,相對住院患者病情較輕有關。
本研究用GNRI作為營養篩查工具,老年門診慢阻肺患者營養不良率為43.8%,高于BMI、血清白蛋白、MUST等其他三種篩查工具。MUST已被證實是慢阻肺患者營養不良篩查的有效工具[4-5],因其評估條目較少、評估時間較短,適用于絕大部分住院患者和門診患者。本研究以MUST為診斷標準,評估了GNRI的診斷效能,發現GNRI有較高的特異性及敏感性。因MUST評估條目主要來源于BMI,且和BMI營養不良的診斷界值一樣,1分及以上考慮為營養不良,而此時BMI按照界值也判斷為營養不良,故當以MUST為診斷標準時,BMI的特異性為1,但敏感性稍低。MUST的評價條目主要基于BMI,而GNRI綜合了BMI和血清白蛋白等人體成分和實驗室檢查成分,故相比于BMI、血清白蛋白、MUST,GNRI更能反映患者的整體營養情況。并且GNRI與老年患者的營養相關并發癥和死亡的關系比單獨的BMI和血清白蛋白水平更密切相關[14],為較理想的營養篩查工具。
慢阻肺患者伴隨肺功能下降,營養不良常使呼吸肌功能受損甚至呼吸肌肉萎縮加重肺通氣功能受損,并導致FEV1比值下降速率加快[15]。本研究發現低GNRI患者FEV1%pred明顯低于高GNRI患者,GNRI與FEV1%pred呈正相關,表明營養不良者肺功能損害更明顯。但目前尚不能明確是營養狀態惡化導致肺功能下降還是肺功能下降進一步導致營養不良。營養不良是慢阻肺急性加重的重要影響因素,BMI是穩定期慢阻肺急性加重的危險因素[16],高士媛等[17]研究發現營養篩查工具精簡微型營養評價量表(Mini nutritional assessment short form,MNA-SF)是穩定期慢阻肺急性加重風險的獨立預測因子。本研究結果同樣表明GNRI與慢阻肺急性加重密切相關,營養不良患者過去一年的急性加重頻次更多,因此對合并營養風險的慢阻肺患者應盡早營養干預,改善患者的營養狀態能夠減少患者急性加重次數、降低住院和死亡風險。
我們將研究對象按GOLD分組分為ABCD四組,D組患者中營養不良率達61.8%,其次分別為C組(45.0%),B組(34.6%)和A組(28.0%)。每組的營養不良發生率都較高,特別是在D組,這種趨勢可能是由多種病理因素造成的,包括急性加重頻率增加,肺功能狀態惡化,疾病長期進展,慢性氧化應激,炎癥刺激,骨骼肌蛋白消耗增加,晚期慢阻肺導致的肺功能減退及食物攝入減少導致能量攝入不足等。這些患者在營養干預和肺康復方面值得特別關注。
除MUST外,還有其他的慢阻肺患者營養篩查工具,如MNA-SF[17]、身體組成評價法(Body Composition Assessment,BCA)[18]、微型營養評價法(Mini Nutritional Assessment,MNA)[19]、主觀全面評定法(Subjective global assessment,SGA)[20]等。GNRI比MNA-SF、BCA和MNA更簡便、耗時更短、更易于使用,而且由于血清白蛋白水平在許多醫療機構能夠常規進行,并且基于血清白蛋白和BMI值的GNRI并不像SGA那樣基于主觀判斷,因此更適合于門診患者的營養篩查。
綜上所述,老年慢阻肺患者營養不良患病率較高,GNRI可用于老年門診慢阻肺患者的營養篩查,其操作簡單方便且相對準確,可推廣開展并擴大到對住院患者與GNRI篩查的效能評估。
利益沖突:本研究不涉及任何利益沖突。
慢性阻塞性肺疾病(簡稱慢阻肺)患者經常合并營養不良,營養不良的篩查是慢阻肺患者病情評估的重要部分。國內外對于慢阻肺患者營養不良的診斷標準及營養風險篩查方法始終未能統一,尚無評價的金標準,有研究報道慢阻肺患者營養不良發生率在20.0%~71.5%[1-3]。體重指數(body mass index,BMI)、血清白蛋白水平是常用于臨床的營養篩查方法,但是指標單一,不能反映患者的整體營養狀況。營養不良通用篩查工具(Malnutrition Universal Screening Tool,MUST)適用于絕大部分住院患者和門診患者的營養風險篩查,研究表明MUST是慢阻肺患者營養不良篩查的有效工具[4-5]。老年營養風險指數(Geriatric Nutritional Risk Index,GNRI)是Bouillanne等[6]提出的針對老年患者的新型營養篩查工具。有研究表明GNRI可用于非小細胞肺癌、心功能不全等患者的營養篩查[7-8]。目前GNRI用于慢阻肺患者營養篩查的研究較少,本研究擬用GNRI對門診老年慢阻肺患者進行營養篩查,以MUST作為參照診斷標準,對其能效進行評估,為GNRI在臨床合理應用提供依據。
1 資料與方法
1.1 臨床資料
本研究為橫斷面比較研究。選取2021年4月—2022年4月在南京醫科大學附屬江寧醫院門診就診的老年慢阻肺患者105例為研究對象,男78例,女27例。納入標準:① 年齡>65歲;② 新診斷或既往診斷的慢阻肺患者,診斷符合《慢性阻塞性肺疾病診治指南(2021年修訂版)》;③ 病情處于穩定期;④ 患者資料完整。排除標準:① 哮喘、支氣管擴張、塵肺等慢阻肺以外的慢性呼吸系統疾病;② 3個月內有慢阻肺急性加重史、近1個月有新發感染性疾病;③ 除慢阻肺外的其他慢性病導致近期不能進食; ④ 肝腎疾病、糖尿病、甲狀腺病變、惡性腫瘤等對營養狀況有影響的患者;⑤ 長期臥床不能下床走路、不能配合完成肺功能者。所有患者均自愿參與本研究并簽署知情同意書。
1.2 方法
1.2.1 營養風險篩查方法
使用MUST及GNRI進行營養風險篩查。MUST有3個獨立評分標準:① BMI;② 近3~6個月體重丟失;③ 急性疾病影響。總分為三部分相加, 0分為低營養風險; 1分為中等營養風險;≥2 分為高營養風險。本研究將MUST評分≥1分判斷為營養不良。GNRI根據身高(cm)、體重(kg)、理想體重(kg)、血清白蛋白(g/L)等參數計算GNRI。GNRI=1.489×白蛋白+ 41.7×[體重/理想體重]。GNRI營養篩查分為4個等級:GNRI<82為高營養風險;82≤GNRI<92為中營養風險;92≤GNRI≤98為低營養風險、GNRI>98時無營養風險。本研究以GNRI 92為界點分為高GNRI組(營養正常組),低GNRI組(營養不良組)。
1.2.2 各項指標的界定
BMI<18.5 kg/m2判定患者營養不良;當天或次日清晨空腹抽取靜脈血,血清白蛋白小于35 g/L認為患者營養不良。使用改良英國醫學研究委員會呼吸困難問卷(modified medical research council dyspnea scale,mMRC)進行呼吸困難評分。0級:劇烈活動時出現呼吸困難;1級:平地快步行走或爬緩坡時出現呼吸困難;2級:由于呼吸困難,平地行走時要比同齡人慢或需要停下來休息;3級: 平地行走100 m左右或數分鐘即需要停下來喘氣;4級:因嚴重呼吸困難而不能離開家,或是在穿衣脫衣時即出現呼吸困難。
1.2.3 肺功能檢查
采用Master screen?PFT肺功能儀(德國Jaeger公司)進行測定。由專業技師依據美國胸科協會/歐洲呼吸協會指南中的測試方法進行測定,主要測定參數包括:用力肺活量(forced vital capacity,FVC)、第1秒用力呼氣容積(forced expiratory volume in one second,FEV1)、第一秒用力呼氣容積占用力肺活量百分比(FEV1/FVC)。常規肺功能各參數占預計值百分比用%pred表示。
1.2.4 6分鐘步行距離
在 30 m長的室內走廊,囑患者在6分鐘內以盡可能快的速度沿著筆直的路線行走,當覺得氣短時可減慢速度或停下來休息,一旦感覺病情允許則繼續行走,實時記錄患者血壓、心率、脈氧飽和度(pulse oxygen saturation,SpO2)并記錄患者6 min內行走的最長距離,即為6分鐘步行距離(6-minute walk distance,6MWD)。
1.3 統計學方法
采用SPSS 27.0統計軟件,正態分布計量資料以均數±標準差( ±s)表示,組間比較采用獨立樣本t檢驗;計數資料以例數表示,組間比較采用χ2檢驗。相關性分析采用Spearman檢驗或Pearson檢驗。應用Graphpad Prism9.4繪制線性回歸圖。約登指數由敏感性加上特異性減去1計算得出。診斷方法一致性檢驗使用Kappa檢驗,Kappa≥0.75為一致性較好;0.4≤Kappa<0.75為一致性中等;Kappa<0.4為一致性很差。P<0.05為差異有統計學意義。
±s)表示,組間比較采用獨立樣本t檢驗;計數資料以例數表示,組間比較采用χ2檢驗。相關性分析采用Spearman檢驗或Pearson檢驗。應用Graphpad Prism9.4繪制線性回歸圖。約登指數由敏感性加上特異性減去1計算得出。診斷方法一致性檢驗使用Kappa檢驗,Kappa≥0.75為一致性較好;0.4≤Kappa<0.75為一致性中等;Kappa<0.4為一致性很差。P<0.05為差異有統計學意義。
2 結果
2.1 基本情況
105例老年門診慢阻肺患者入組本研究,年齡66~90歲,平均年齡(73.1±5.5)歲;男78例,女27例。根據GOLD分組標準,A組患者25例(23.8%),B組患者26例(24.8%),C組20例(19.0%),D組患者34例(42.4%)。營養正常組有59例,其中無風險33例,低風險26例;營養不良組共46例,其中中風險39例,高風險7例)。各組患者的營養不良率見表1, D組患者中營養不良率達61.8%,其次分別為C組(45.0%),B組(34.6%)和A組(28.0%)。
2.2 兩組的基線特征及相關參數的比較
營養正常組和營養不良組患者性別、年齡、吸煙史、C反應蛋白、FEV1/FVC%pred、靜息時SpO2、mMRC評分均無顯著差異(P>0.05),兩組患者BMI、血清白蛋白、FEV1%pred、6MWD、過去一年急性加重次數均有顯著差異(P<0.05)。結果見表2。
2.3 四種不同營養篩查方法結果的比較
用BMI、血清白蛋白、MUST、GNRI四種營養篩查方法對門診老年慢阻肺患者營養篩查,營養不良率分別為32.4%、25.7%、41.9%、43.8%。GNRI的營養不良診斷率高于其他三種方法。結果見表3。
2.4 篩查工具效能比較
以MUST為判斷標準,評估BMI、血清白蛋白和GNRI對慢阻肺營養不良的篩查效能,GNRI的敏感性81.8%,特異性83.6%,準確度82.9%,Kappa值0.60,具有較好的診斷效能。結果見表4。
2.5 GNRI和相關的指標進行相關性分析
GNRI與BMI、血清白蛋白、FEV1%pred、6MWD、過去一年急性加重次數顯著相關,與FEV1/FVC%pred、C反應蛋白、靜息時SpO2、mMRC無明顯相關性。結果見表5和圖1。
 圖1
GNRI與BMI、血清白蛋白、FEV1%pred、6MWD之間的線性回歸圖
圖1
GNRI與BMI、血清白蛋白、FEV1%pred、6MWD之間的線性回歸圖
a. BMI;b. 血清白蛋白;c. FEV1%pred;d. 6MWD。
3 討論
體重減輕是慢阻肺患者較常見的表現,常常和全身性炎癥相關,伴隨呼吸肌肉能量消耗,引起呼吸困難、活動受限,嚴重影響生活質量。營養不良是慢阻肺患者住院時間延長、再次住院次數增多、病死率升高的危險因素[9]。評估慢阻肺患者營養狀況,及時發現慢阻肺患者營養不良風險并進行營養支持十分重要。
作為一種新型營養評價指標,GNRI根據患者當前體重、理想體重和血清白蛋白水平計算得出。已有研究表明GNRI與老年重癥社區獲得性肺炎、惡性腫瘤、心功能不全的預后相關[7-8, 10-12],是識別營養不良的簡單有效工具。
目前關于GNRI在慢阻肺營養篩查中的研究甚少,Matsumura等[13]對63例老年男性慢阻肺患者(包含住院和門診)研究發現營養不良組6MWD低于營養正常組。與BMI相比,GNRI與慢阻肺患者運動耐量的關系更密切,表明低GNRI可能是慢阻肺患者低運動耐量的預測指標。本研究中GNRI與6MWD呈正相關,營養不良組的6MWD為(324.2±105.4)m,較營養正常組的(409.0±118.0)m低85 m,證實營養不良組患者的運動耐量更差。本研究中營養不良組的6MWD高于Matsumura等[13]的(211.1±125.3)m,可能與本研究入組的均為門診慢阻肺患者,相對住院患者病情較輕有關。
本研究用GNRI作為營養篩查工具,老年門診慢阻肺患者營養不良率為43.8%,高于BMI、血清白蛋白、MUST等其他三種篩查工具。MUST已被證實是慢阻肺患者營養不良篩查的有效工具[4-5],因其評估條目較少、評估時間較短,適用于絕大部分住院患者和門診患者。本研究以MUST為診斷標準,評估了GNRI的診斷效能,發現GNRI有較高的特異性及敏感性。因MUST評估條目主要來源于BMI,且和BMI營養不良的診斷界值一樣,1分及以上考慮為營養不良,而此時BMI按照界值也判斷為營養不良,故當以MUST為診斷標準時,BMI的特異性為1,但敏感性稍低。MUST的評價條目主要基于BMI,而GNRI綜合了BMI和血清白蛋白等人體成分和實驗室檢查成分,故相比于BMI、血清白蛋白、MUST,GNRI更能反映患者的整體營養情況。并且GNRI與老年患者的營養相關并發癥和死亡的關系比單獨的BMI和血清白蛋白水平更密切相關[14],為較理想的營養篩查工具。
慢阻肺患者伴隨肺功能下降,營養不良常使呼吸肌功能受損甚至呼吸肌肉萎縮加重肺通氣功能受損,并導致FEV1比值下降速率加快[15]。本研究發現低GNRI患者FEV1%pred明顯低于高GNRI患者,GNRI與FEV1%pred呈正相關,表明營養不良者肺功能損害更明顯。但目前尚不能明確是營養狀態惡化導致肺功能下降還是肺功能下降進一步導致營養不良。營養不良是慢阻肺急性加重的重要影響因素,BMI是穩定期慢阻肺急性加重的危險因素[16],高士媛等[17]研究發現營養篩查工具精簡微型營養評價量表(Mini nutritional assessment short form,MNA-SF)是穩定期慢阻肺急性加重風險的獨立預測因子。本研究結果同樣表明GNRI與慢阻肺急性加重密切相關,營養不良患者過去一年的急性加重頻次更多,因此對合并營養風險的慢阻肺患者應盡早營養干預,改善患者的營養狀態能夠減少患者急性加重次數、降低住院和死亡風險。
我們將研究對象按GOLD分組分為ABCD四組,D組患者中營養不良率達61.8%,其次分別為C組(45.0%),B組(34.6%)和A組(28.0%)。每組的營養不良發生率都較高,特別是在D組,這種趨勢可能是由多種病理因素造成的,包括急性加重頻率增加,肺功能狀態惡化,疾病長期進展,慢性氧化應激,炎癥刺激,骨骼肌蛋白消耗增加,晚期慢阻肺導致的肺功能減退及食物攝入減少導致能量攝入不足等。這些患者在營養干預和肺康復方面值得特別關注。
除MUST外,還有其他的慢阻肺患者營養篩查工具,如MNA-SF[17]、身體組成評價法(Body Composition Assessment,BCA)[18]、微型營養評價法(Mini Nutritional Assessment,MNA)[19]、主觀全面評定法(Subjective global assessment,SGA)[20]等。GNRI比MNA-SF、BCA和MNA更簡便、耗時更短、更易于使用,而且由于血清白蛋白水平在許多醫療機構能夠常規進行,并且基于血清白蛋白和BMI值的GNRI并不像SGA那樣基于主觀判斷,因此更適合于門診患者的營養篩查。
綜上所述,老年慢阻肺患者營養不良患病率較高,GNRI可用于老年門診慢阻肺患者的營養篩查,其操作簡單方便且相對準確,可推廣開展并擴大到對住院患者與GNRI篩查的效能評估。
利益沖突:本研究不涉及任何利益沖突。