引用本文: 李曉東, 李甜, 邸興偉, 胡占升, 郝春艷, 付海燕, 姜華茂. 基于機械能與跨肺壓導向的肺復張策略對急性呼吸窘迫綜合征患者預后的評估. 中國呼吸與危重監護雜志, 2023, 22(10): 697-701. doi: 10.7507/1671-6205.202307006 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)以彌漫性肺泡毛細血管膜或肺泡損傷為本質進而引起呼吸衰竭等多病因臨床表現,機械通氣主要保證ARDS患者氧合的同時防止呼吸機相關性肺損傷(ventilator-induced lung injury,VILI)的發生,從而為肺部愈合爭取時間。肺復張策略(recruitment maneuver,RM)滴定最佳呼氣末正壓(best positive end-expiratory pressure,Best PEEP)用來防止肺單位重復打開或關閉造成的肺泡表面活性物質損傷[1]。ARDS患者由于肺通氣面積減小和大量的肺實變,在使用過高PEEP期間可能加重應力、放大機械損傷顯著增加VILI的風險。機械能(mechanical power,MP)表示機械通氣單位時間內向呼吸系統傳遞的能量,即將VILI歸因于從呼吸機到患者的能量轉換率[2]。MP可更全面地反映肺組織對力學的變化,更重要的是考慮到了單位時間內給與壓力的累積效應。本研究著眼于改善ARDS患者的預后,評估MP和跨肺壓的持續變化對ARDS患者在RM期間滴定Best PEEP產生的潛在影響。
1 資料與方法
1.1 臨床資料
選擇2021年9月—2023年3月,在錦州醫科大學附屬第一醫院重癥監護病房(intensive care unit,ICU)均建立人工氣道行機械通氣治療的ARDS患者。
1.1.1 納入標準
符合2012年柏林定義的中重度ARDS診斷標準[3],年齡>18歲,氧合指數(P/F)≤200 mm Hg(1 mm Hg=0.133 kPa),均首次進入ICU治療,機械通氣上機時間至少72 h,均取得醫院倫理委員會批準(倫理審批號:202107)且取得患者及家屬的知情同意。
1.1.2 排除標準
血氣胸、支氣管胸膜瘺、急性肺栓塞、妊娠、體重指數(boty mass index,BMI)超過30 kg/m2、RM期間出現嚴重血流動力學異常,出凝血功能障礙和局部損傷風險如食道靜脈曲張、顱底骨折患者。
1.2 方法
1.2.1 呼吸機參數及MP測定
患者在試驗期間予2%丙泊酚鎮靜治療,以不發生人機對抗為原則。以肺保護通氣策略為基本準則,調節呼吸機為壓控通氣模式,初始壓力為12~15 cm H2O(1 cm H2O=0.098 kPa),潮氣量達到6 mL/kg,呼吸頻率15~20次/min,PEEP-FiO2表格法設置初始PEEP和吸入氧濃度。使用邁瑞SV-800呼吸機監測MP,利用壓力–容積曲線校正RM 30 min及2 h MP大小,測量三次,取均值。
1.2.2 跨肺壓及Best PEEP滴定
患者入ICU后經鼻腔放置食道測壓管,首先利用鼻尖–耳垂–劍突法初步評估置管深度,置管深度約為50 cm;其次,用注射器予食道測壓管球囊充氣,先注射8 mL空氣,隨即回抽3 mL,充氣后氣囊處于“半飽”狀態,并按壓患者腹部,確認導管氣囊位置,此作為試驗的關鍵步驟,因為理想的氣囊充盈容積既不會過度擴張食道壁又可以傳遞周圍壓力[4];最后,在緩慢回撤食道測壓管的同時,觀察呼吸機食道壓波形出現心跳切跡,當波形出現綠色,按住呼吸機呼氣末屏氣鍵,確認觀察食道壓跟氣道壓變化幅度是否一致,兩者變化幅度控制在20%以內,即處于食道測壓管預期放置的合適位置。利用PEEP遞增法實施RM,同時上調5 cm H2O的基礎吸氣壓力和PEEP,通氣2 min后監測MP和跨肺壓,保證吸氣末跨肺壓≤25 cm H2O,峰壓不超過40 cm H2O。RM后每3 min降低2 cm H2O PEEP,若MP顯著下降至RM最大MP的40%時,繼續下調PEEP直至呼氣末跨肺壓為0~5 cm H2O停止去復張操作,再次實施RM將PEEP設置為MP顯著下降前上一壓力水平,即為Best PEEP[5]。
1.2.3 分組
根據28 d病死率分為存活組和死亡組,監測不同結局兩組RM 30 min及2 h各臨床指標的變化趨勢。
1.3 統計學處理
采用SPSS 20.0統計軟件。計量資料采用t檢驗或Mann-Whitey U 檢驗,用均數±標準差( ±s)或中位數(四分位數)表示,計數資料采用χ2檢驗;采用Pearson相關性分析30 min、2 h MP與跨肺壓的相關性;采用受試者工作特征(receiver operating characteristic,ROC)曲線分析RM 2 h MP與跨肺壓對ARDS患者28 d病死率預測價值,P<0.05表示差異有統計學意義。
±s)或中位數(四分位數)表示,計數資料采用χ2檢驗;采用Pearson相關性分析30 min、2 h MP與跨肺壓的相關性;采用受試者工作特征(receiver operating characteristic,ROC)曲線分析RM 2 h MP與跨肺壓對ARDS患者28 d病死率預測價值,P<0.05表示差異有統計學意義。
2 結果
2.1 患者一般臨床資料
共篩選89例患者,其中9例患者RM過程出現循環功能障礙、3例中途死亡被排除,最終納入77例樣本,存活組48例,死亡組29例。兩組患者在年齡、性別、BMI、APACHEⅡ評分、SOFA評分、ARDS病因(呼吸衰竭、膿毒癥、重癥胰腺炎、重癥肺炎、其他)等基線資料均衡,差異均無統計學意義(均P>0.05),具有可比性。結果見表1。
2.2 不同結局兩組RM 30 min及2 h各臨床指標的變化趨勢
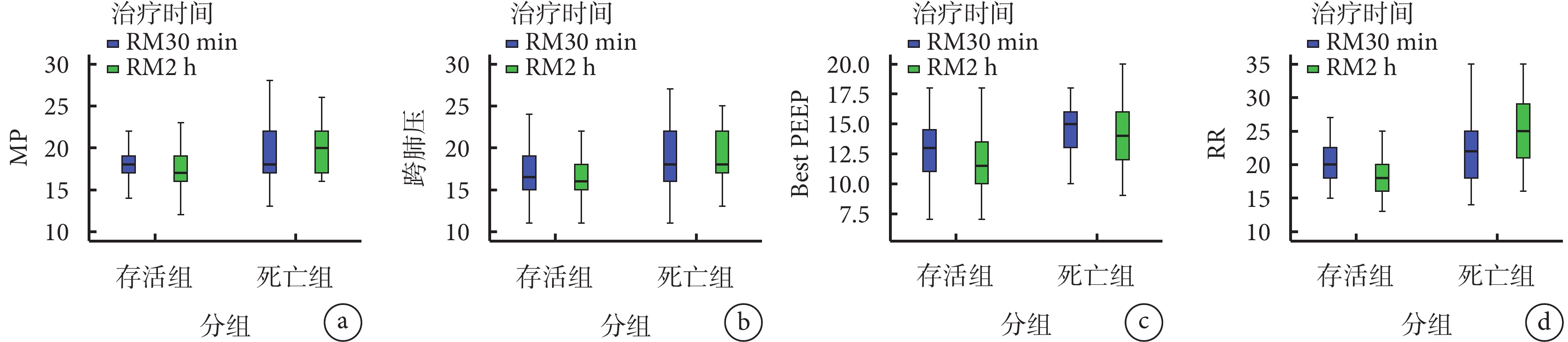
RM30 min及2 h時存活組MP和跨肺壓均顯著下降,死亡組MP和跨肺壓呈現顯著上升趨勢(均P<0.05);在RM 30 min及2 h Best PEEP、RR比較,存活組均低于死亡組(均P<0.05)。結果見圖1。
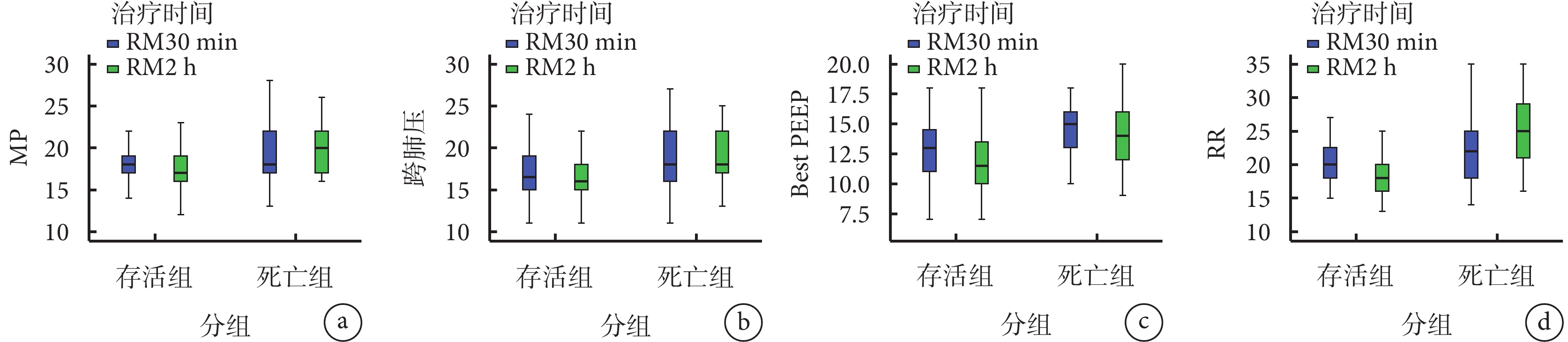 圖1
不同結局兩組RM30 min及2 h 各臨床指標的變化趨勢
圖1
不同結局兩組RM30 min及2 h 各臨床指標的變化趨勢
MP為機械能,Best PEEP為最佳呼氣末正壓,RR為呼吸頻率。
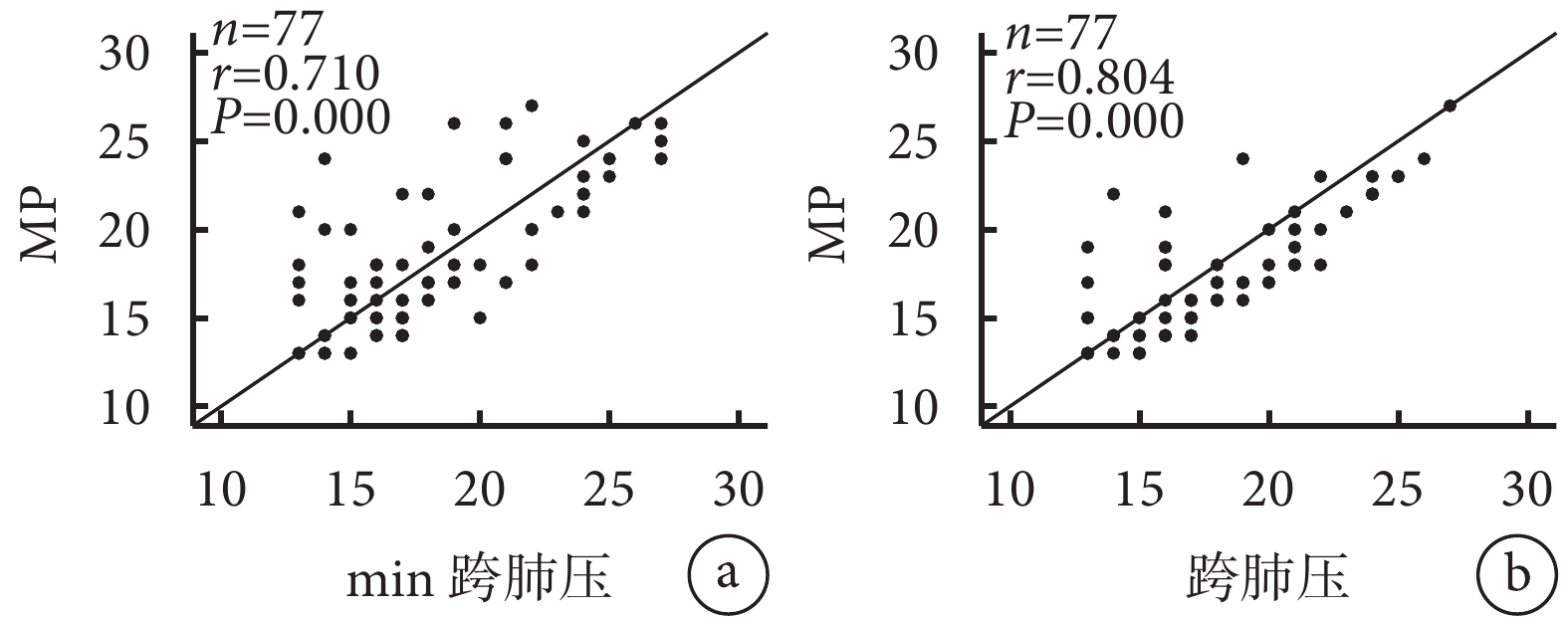
2.3 ARDS患者RM 30 min及2 h MP與跨肺壓的相關性
Pearson相關分析結果顯示RM 30 min及2 h MP與跨肺壓存在顯著相關性(r值分別為0.710和0.804,均P<0.05)。詳見圖2。
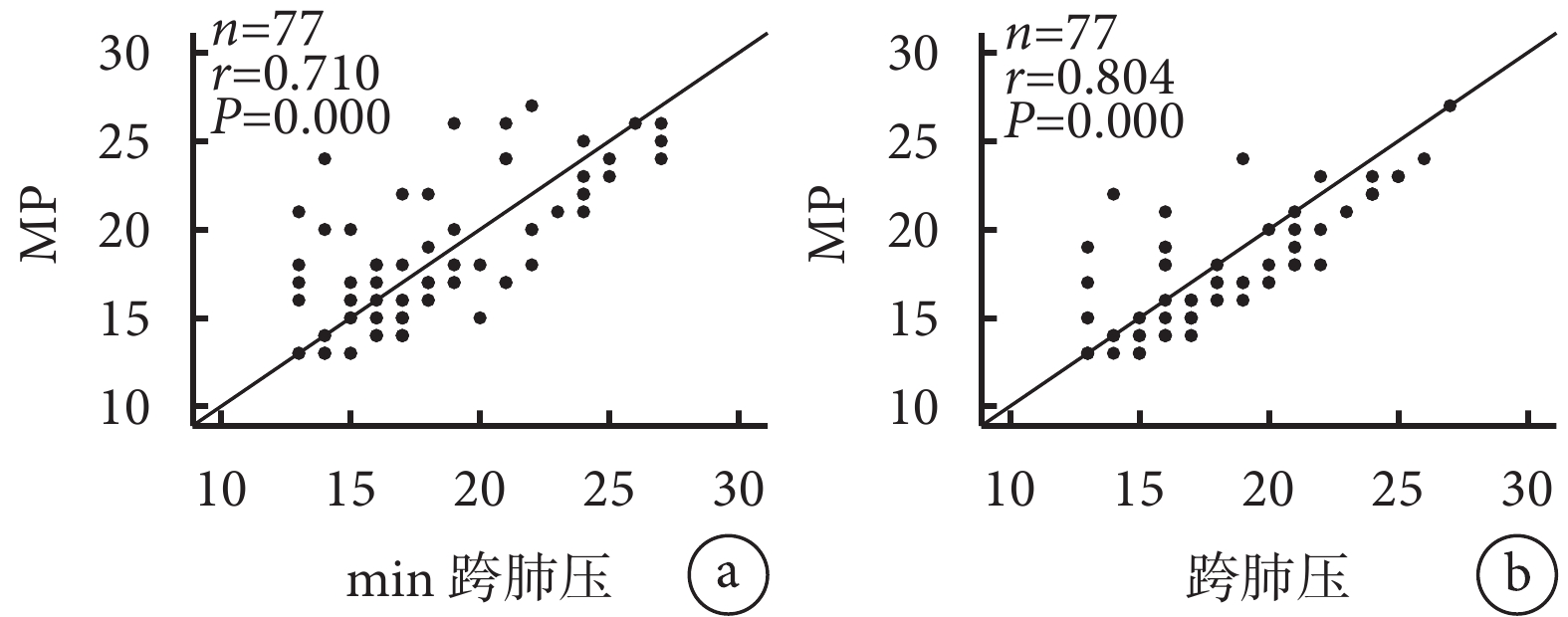 圖2
ARDS患者RM 30 min及2 h MP與跨肺壓的相關性
圖2
ARDS患者RM 30 min及2 h MP與跨肺壓的相關性
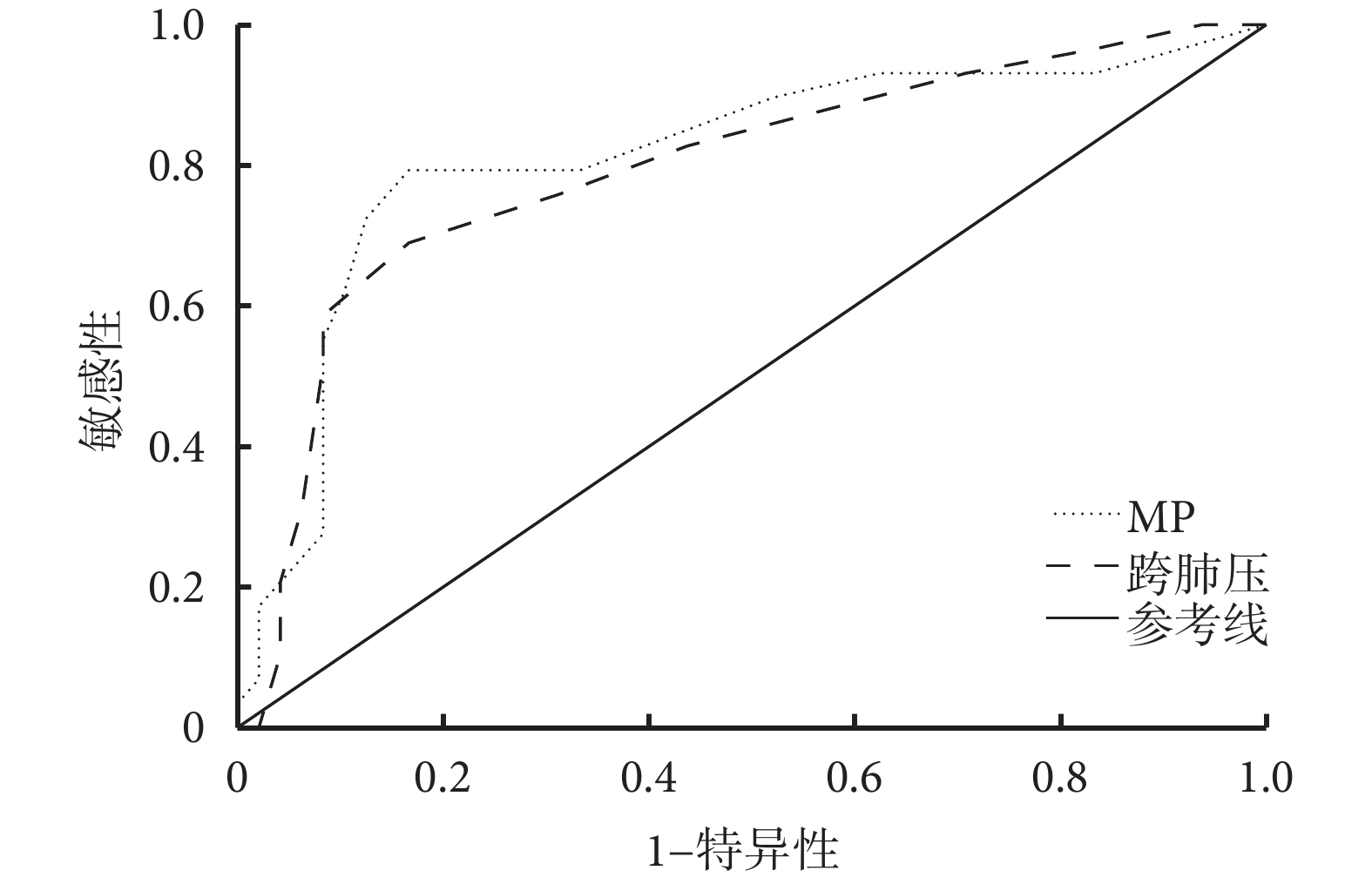
2.4 RM 2 h MP與跨肺壓對ARDS患者28 d病死率預測價值
MP與跨肺壓的ROC曲線下面積(AUC)分別為0.812和0.795;95%CI分別為0.704~0.920和0.687~0.903(均P<0.05);敏感性分別為86.95%和82.5%;特異性分別為76.67%和59.4%;陽性預測值分別為0.851和0.688;陰性預測值分別為0.793和0.759;最佳截斷值分別為15.5和17.5。表明RM 2 h MP和跨肺壓對ARDS患者28 d病死率具有良好的預測價值。詳見圖3。
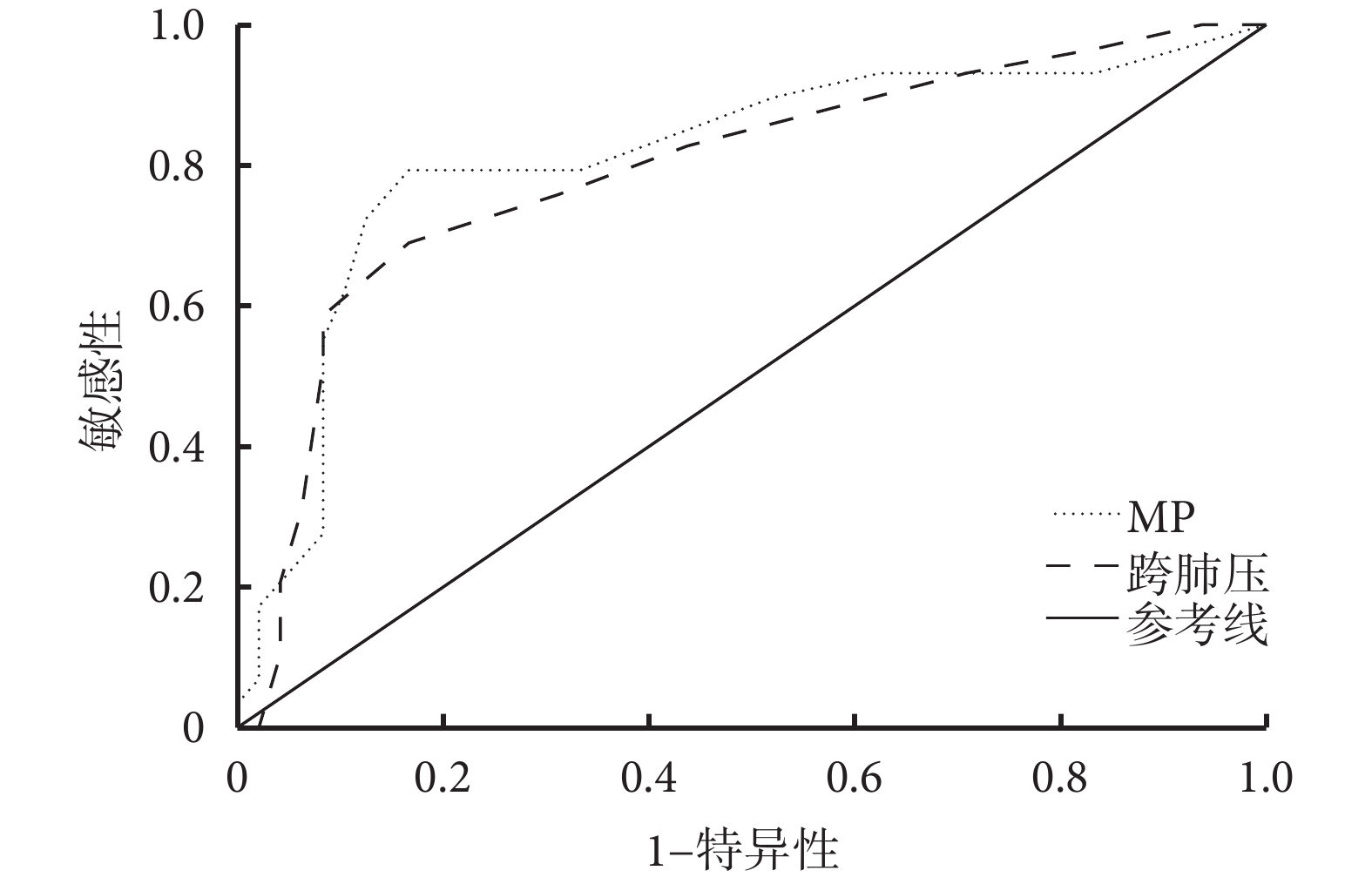 圖3
RM 2 h MP與跨肺壓對ARDS患者28 d病死率預測價值的ROC曲線
圖3
RM 2 h MP與跨肺壓對ARDS患者28 d病死率預測價值的ROC曲線
3 討論
ARDS因其基礎的病生特點而易發生VILI,不穩定肺泡的周期性開放被認為可能是導致VILI的病生機制[6]。臨床上制定多種降低VILI的機械通氣策略防治肺損傷,其中RM是在機械通氣過程中間斷地給予高于常規的平均氣道壓力并維持一定時間,通過最小的壓力實現肺泡復張,使肺功能顯著改善,而PEEP是RM的重要設定參數,但對于確定患者Best PEEP水平的標準方法仍未達成共識[7]。目前提出將肺損傷歸因于從呼吸機到患者的能量轉換率即MP,MP更加全面的評估了ARDS機械通氣過程中肺臟和呼吸機之間生物力學作用[8]。由于ARDS個體差異、類型及肺力學不同,食道測壓法對于ARDS患者機械通氣策略的個性化顯得尤為重要,通過食道壓估計跨肺泡壓力可用于評估胸壁和肺對整個呼吸系統壓力的梯度變化,從而進一步優化肺力學和氧合[9]。因此,本研究監測MP及跨肺壓力等臨床指標進一步指導床邊RM策略的實施。
本研究旨在分析基于MP與跨肺壓導向的RM對ARDS患者的預后評估價值,圖1顯示RM 30 min及2 h 存活組MP和跨肺壓均顯著下降,死亡組MP和跨肺壓呈現顯著上升趨勢(均P<0.05);表明在RM兩個時間點后隨著疾病不同的發展方向,存活組患者的有效肺通氣面積和肺損傷的發生率均優于ARDS死亡患者,原因在于:在減輕正常肺區過度膨脹的基礎上,往往會造成部分肺區的塌陷,死亡組患者重力依賴區域肺組織塌陷的比例可能更大[10],對于陷閉和實變的肺區,即使Best PEEP也不能完全復張此類肺組織,吸氣時肺內氣體會從非重力依賴區向重力依賴區轉移,進而導致重力依賴區出現潮汐性肺泡開放和塌陷,使肺損傷的風險上升,增加了局部剪切傷,引起跨肺壓升高,還可能帶來正常肺區的過度膨脹和大量的炎癥介質釋放,導致VILI成比例增加,在RM早期維持這些順應性相對較差的肺泡通氣時勢必需要更高的肺泡應力和機械做功,即造成MP增高[11]。本研究顯示,RM 30 min及2 h Best PEEP比較死亡組均高于存活組,死亡組相對于存活組肺泡反復打開和塌陷的幾率可能更高,應力顯著放大。此外,死亡組可通氣區域面積減小增加了肺應變,如果此時給予PEEP不夠高,肺泡再次塌陷,潮氣量將被分配在通氣量較小比例的肺組織,從而導致膨脹性肺損傷[12],因此,Best PEEP在設定時應考慮對VILI的潛在影響,具體取決于維持開放的肺泡與過度擴張肺泡之間的凈平衡。近年來,患者自發性肺損傷(P-SILI)在ARDS肺保護通氣策略中愈加受到關注,患者自身RR增快伴有輔助呼吸肌肉收縮是最直接反映患者存在高呼吸驅動的指標之一,人機不同步不僅使呼吸肌負荷加重,還會增加肺泡擴張和肺損傷的風險[13]。在圖1中存活組RR在RM 30 min及2 h均低于死亡組(均P<0.05);表明嚴重肺損傷患者通常需要更高的呼吸驅動力,強烈的吸氣努力導致胸膜腔負壓進一步增大,同時增加壓力水平會使跨肺壓力變化分布不均勻,出現壓力疊加效應,甚至可能通過多種機制加重肺損傷[14]。
本研究Pearson相關分析結果顯示,ARDS患者在RM兩個時間點的 MP與跨肺壓均存在顯著相關性;說明基于二者實施的RM通過調整氣道壓力和傳遞到肺部的能量負荷可能促進肺部愈合并減輕肺部進一步損傷,兩者均在VILI發生發展中可能具有重要作用。值得注意的是,使用食道壓作為胸腔壓力變化的估計值,在一定程度上可量化輸送到肺部總MP的比例,隨著在RM過程中增加跨肺壓力引起MP損傷導致更嚴重的全身并發癥,例如水潴留和血流動力學變化。圖3顯示MP與跨肺壓的ROC曲線下面積均大于0.7;反映了MP和跨肺壓或可成為早期評估ARDS病情嚴重程度的指標之一,表明MP和跨肺壓對ARDS患者28 d病死率具有良好的預測價值。
綜上所述,基于MP與跨肺壓導向的RM對ARDS患者的預后提供了相對全面的臨床依據。需要強調的是,ARDS患者的病因及疾病的不同階段,肺的可復張性是不同的。因此,并不能根據某一點的呼吸力學測定就決定患者的預后,ARDS患者的治療和死亡率仍存在很大差異。本研究的樣本量較少,需要優化和結合其他指標探索對ARDS死亡率的影響,并為臨床治療中的合理決策提供信息。
利益沖突:本研究不涉及任何利益沖突。
急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)以彌漫性肺泡毛細血管膜或肺泡損傷為本質進而引起呼吸衰竭等多病因臨床表現,機械通氣主要保證ARDS患者氧合的同時防止呼吸機相關性肺損傷(ventilator-induced lung injury,VILI)的發生,從而為肺部愈合爭取時間。肺復張策略(recruitment maneuver,RM)滴定最佳呼氣末正壓(best positive end-expiratory pressure,Best PEEP)用來防止肺單位重復打開或關閉造成的肺泡表面活性物質損傷[1]。ARDS患者由于肺通氣面積減小和大量的肺實變,在使用過高PEEP期間可能加重應力、放大機械損傷顯著增加VILI的風險。機械能(mechanical power,MP)表示機械通氣單位時間內向呼吸系統傳遞的能量,即將VILI歸因于從呼吸機到患者的能量轉換率[2]。MP可更全面地反映肺組織對力學的變化,更重要的是考慮到了單位時間內給與壓力的累積效應。本研究著眼于改善ARDS患者的預后,評估MP和跨肺壓的持續變化對ARDS患者在RM期間滴定Best PEEP產生的潛在影響。
1 資料與方法
1.1 臨床資料
選擇2021年9月—2023年3月,在錦州醫科大學附屬第一醫院重癥監護病房(intensive care unit,ICU)均建立人工氣道行機械通氣治療的ARDS患者。
1.1.1 納入標準
符合2012年柏林定義的中重度ARDS診斷標準[3],年齡>18歲,氧合指數(P/F)≤200 mm Hg(1 mm Hg=0.133 kPa),均首次進入ICU治療,機械通氣上機時間至少72 h,均取得醫院倫理委員會批準(倫理審批號:202107)且取得患者及家屬的知情同意。
1.1.2 排除標準
血氣胸、支氣管胸膜瘺、急性肺栓塞、妊娠、體重指數(boty mass index,BMI)超過30 kg/m2、RM期間出現嚴重血流動力學異常,出凝血功能障礙和局部損傷風險如食道靜脈曲張、顱底骨折患者。
1.2 方法
1.2.1 呼吸機參數及MP測定
患者在試驗期間予2%丙泊酚鎮靜治療,以不發生人機對抗為原則。以肺保護通氣策略為基本準則,調節呼吸機為壓控通氣模式,初始壓力為12~15 cm H2O(1 cm H2O=0.098 kPa),潮氣量達到6 mL/kg,呼吸頻率15~20次/min,PEEP-FiO2表格法設置初始PEEP和吸入氧濃度。使用邁瑞SV-800呼吸機監測MP,利用壓力–容積曲線校正RM 30 min及2 h MP大小,測量三次,取均值。
1.2.2 跨肺壓及Best PEEP滴定
患者入ICU后經鼻腔放置食道測壓管,首先利用鼻尖–耳垂–劍突法初步評估置管深度,置管深度約為50 cm;其次,用注射器予食道測壓管球囊充氣,先注射8 mL空氣,隨即回抽3 mL,充氣后氣囊處于“半飽”狀態,并按壓患者腹部,確認導管氣囊位置,此作為試驗的關鍵步驟,因為理想的氣囊充盈容積既不會過度擴張食道壁又可以傳遞周圍壓力[4];最后,在緩慢回撤食道測壓管的同時,觀察呼吸機食道壓波形出現心跳切跡,當波形出現綠色,按住呼吸機呼氣末屏氣鍵,確認觀察食道壓跟氣道壓變化幅度是否一致,兩者變化幅度控制在20%以內,即處于食道測壓管預期放置的合適位置。利用PEEP遞增法實施RM,同時上調5 cm H2O的基礎吸氣壓力和PEEP,通氣2 min后監測MP和跨肺壓,保證吸氣末跨肺壓≤25 cm H2O,峰壓不超過40 cm H2O。RM后每3 min降低2 cm H2O PEEP,若MP顯著下降至RM最大MP的40%時,繼續下調PEEP直至呼氣末跨肺壓為0~5 cm H2O停止去復張操作,再次實施RM將PEEP設置為MP顯著下降前上一壓力水平,即為Best PEEP[5]。
1.2.3 分組
根據28 d病死率分為存活組和死亡組,監測不同結局兩組RM 30 min及2 h各臨床指標的變化趨勢。
1.3 統計學處理
采用SPSS 20.0統計軟件。計量資料采用t檢驗或Mann-Whitey U 檢驗,用均數±標準差( ±s)或中位數(四分位數)表示,計數資料采用χ2檢驗;采用Pearson相關性分析30 min、2 h MP與跨肺壓的相關性;采用受試者工作特征(receiver operating characteristic,ROC)曲線分析RM 2 h MP與跨肺壓對ARDS患者28 d病死率預測價值,P<0.05表示差異有統計學意義。
±s)或中位數(四分位數)表示,計數資料采用χ2檢驗;采用Pearson相關性分析30 min、2 h MP與跨肺壓的相關性;采用受試者工作特征(receiver operating characteristic,ROC)曲線分析RM 2 h MP與跨肺壓對ARDS患者28 d病死率預測價值,P<0.05表示差異有統計學意義。
2 結果
2.1 患者一般臨床資料
共篩選89例患者,其中9例患者RM過程出現循環功能障礙、3例中途死亡被排除,最終納入77例樣本,存活組48例,死亡組29例。兩組患者在年齡、性別、BMI、APACHEⅡ評分、SOFA評分、ARDS病因(呼吸衰竭、膿毒癥、重癥胰腺炎、重癥肺炎、其他)等基線資料均衡,差異均無統計學意義(均P>0.05),具有可比性。結果見表1。
2.2 不同結局兩組RM 30 min及2 h各臨床指標的變化趨勢
RM30 min及2 h時存活組MP和跨肺壓均顯著下降,死亡組MP和跨肺壓呈現顯著上升趨勢(均P<0.05);在RM 30 min及2 h Best PEEP、RR比較,存活組均低于死亡組(均P<0.05)。結果見圖1。
 圖1
不同結局兩組RM30 min及2 h 各臨床指標的變化趨勢
圖1
不同結局兩組RM30 min及2 h 各臨床指標的變化趨勢
MP為機械能,Best PEEP為最佳呼氣末正壓,RR為呼吸頻率。
2.3 ARDS患者RM 30 min及2 h MP與跨肺壓的相關性
Pearson相關分析結果顯示RM 30 min及2 h MP與跨肺壓存在顯著相關性(r值分別為0.710和0.804,均P<0.05)。詳見圖2。
 圖2
ARDS患者RM 30 min及2 h MP與跨肺壓的相關性
圖2
ARDS患者RM 30 min及2 h MP與跨肺壓的相關性
2.4 RM 2 h MP與跨肺壓對ARDS患者28 d病死率預測價值
MP與跨肺壓的ROC曲線下面積(AUC)分別為0.812和0.795;95%CI分別為0.704~0.920和0.687~0.903(均P<0.05);敏感性分別為86.95%和82.5%;特異性分別為76.67%和59.4%;陽性預測值分別為0.851和0.688;陰性預測值分別為0.793和0.759;最佳截斷值分別為15.5和17.5。表明RM 2 h MP和跨肺壓對ARDS患者28 d病死率具有良好的預測價值。詳見圖3。
 圖3
RM 2 h MP與跨肺壓對ARDS患者28 d病死率預測價值的ROC曲線
圖3
RM 2 h MP與跨肺壓對ARDS患者28 d病死率預測價值的ROC曲線
3 討論
ARDS因其基礎的病生特點而易發生VILI,不穩定肺泡的周期性開放被認為可能是導致VILI的病生機制[6]。臨床上制定多種降低VILI的機械通氣策略防治肺損傷,其中RM是在機械通氣過程中間斷地給予高于常規的平均氣道壓力并維持一定時間,通過最小的壓力實現肺泡復張,使肺功能顯著改善,而PEEP是RM的重要設定參數,但對于確定患者Best PEEP水平的標準方法仍未達成共識[7]。目前提出將肺損傷歸因于從呼吸機到患者的能量轉換率即MP,MP更加全面的評估了ARDS機械通氣過程中肺臟和呼吸機之間生物力學作用[8]。由于ARDS個體差異、類型及肺力學不同,食道測壓法對于ARDS患者機械通氣策略的個性化顯得尤為重要,通過食道壓估計跨肺泡壓力可用于評估胸壁和肺對整個呼吸系統壓力的梯度變化,從而進一步優化肺力學和氧合[9]。因此,本研究監測MP及跨肺壓力等臨床指標進一步指導床邊RM策略的實施。
本研究旨在分析基于MP與跨肺壓導向的RM對ARDS患者的預后評估價值,圖1顯示RM 30 min及2 h 存活組MP和跨肺壓均顯著下降,死亡組MP和跨肺壓呈現顯著上升趨勢(均P<0.05);表明在RM兩個時間點后隨著疾病不同的發展方向,存活組患者的有效肺通氣面積和肺損傷的發生率均優于ARDS死亡患者,原因在于:在減輕正常肺區過度膨脹的基礎上,往往會造成部分肺區的塌陷,死亡組患者重力依賴區域肺組織塌陷的比例可能更大[10],對于陷閉和實變的肺區,即使Best PEEP也不能完全復張此類肺組織,吸氣時肺內氣體會從非重力依賴區向重力依賴區轉移,進而導致重力依賴區出現潮汐性肺泡開放和塌陷,使肺損傷的風險上升,增加了局部剪切傷,引起跨肺壓升高,還可能帶來正常肺區的過度膨脹和大量的炎癥介質釋放,導致VILI成比例增加,在RM早期維持這些順應性相對較差的肺泡通氣時勢必需要更高的肺泡應力和機械做功,即造成MP增高[11]。本研究顯示,RM 30 min及2 h Best PEEP比較死亡組均高于存活組,死亡組相對于存活組肺泡反復打開和塌陷的幾率可能更高,應力顯著放大。此外,死亡組可通氣區域面積減小增加了肺應變,如果此時給予PEEP不夠高,肺泡再次塌陷,潮氣量將被分配在通氣量較小比例的肺組織,從而導致膨脹性肺損傷[12],因此,Best PEEP在設定時應考慮對VILI的潛在影響,具體取決于維持開放的肺泡與過度擴張肺泡之間的凈平衡。近年來,患者自發性肺損傷(P-SILI)在ARDS肺保護通氣策略中愈加受到關注,患者自身RR增快伴有輔助呼吸肌肉收縮是最直接反映患者存在高呼吸驅動的指標之一,人機不同步不僅使呼吸肌負荷加重,還會增加肺泡擴張和肺損傷的風險[13]。在圖1中存活組RR在RM 30 min及2 h均低于死亡組(均P<0.05);表明嚴重肺損傷患者通常需要更高的呼吸驅動力,強烈的吸氣努力導致胸膜腔負壓進一步增大,同時增加壓力水平會使跨肺壓力變化分布不均勻,出現壓力疊加效應,甚至可能通過多種機制加重肺損傷[14]。
本研究Pearson相關分析結果顯示,ARDS患者在RM兩個時間點的 MP與跨肺壓均存在顯著相關性;說明基于二者實施的RM通過調整氣道壓力和傳遞到肺部的能量負荷可能促進肺部愈合并減輕肺部進一步損傷,兩者均在VILI發生發展中可能具有重要作用。值得注意的是,使用食道壓作為胸腔壓力變化的估計值,在一定程度上可量化輸送到肺部總MP的比例,隨著在RM過程中增加跨肺壓力引起MP損傷導致更嚴重的全身并發癥,例如水潴留和血流動力學變化。圖3顯示MP與跨肺壓的ROC曲線下面積均大于0.7;反映了MP和跨肺壓或可成為早期評估ARDS病情嚴重程度的指標之一,表明MP和跨肺壓對ARDS患者28 d病死率具有良好的預測價值。
綜上所述,基于MP與跨肺壓導向的RM對ARDS患者的預后提供了相對全面的臨床依據。需要強調的是,ARDS患者的病因及疾病的不同階段,肺的可復張性是不同的。因此,并不能根據某一點的呼吸力學測定就決定患者的預后,ARDS患者的治療和死亡率仍存在很大差異。本研究的樣本量較少,需要優化和結合其他指標探索對ARDS死亡率的影響,并為臨床治療中的合理決策提供信息。
利益沖突:本研究不涉及任何利益沖突。