引用本文: 李萌, 張令軒, 宋歌, 高福生. 蝦青素對支氣管哮喘大鼠氣道炎癥及氣道重構的影響. 中國呼吸與危重監護雜志, 2024, 23(8): 575-582. doi: 10.7507/1671-6205.202309016 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
支氣管哮喘(簡稱哮喘)是一種常見的慢性呼吸系統疾病,其發病率呈逐年增高的趨勢,全世界3億多人患有哮喘,中國約有
AST即3,3’-二羥基-4,4’-二酮基-β,β’胡蘿卜素,是一種具有抗炎、抗氧化作用的脂溶性類胡蘿卜素,在神經系統疾病等多種疾病的發生和發展中發揮重要作用[4-7]。近年來,氧化應激在支氣管哮喘發生發展中的作用日益引起人們的重視。但到目前為止,AST對支氣管哮喘氣道炎癥和氣道重構的影響,國內外均少見報道。為此,我們用卵清蛋白(ovalbumin,OVA)致敏和激發建立大鼠支氣管哮喘模型,并給予蝦青素灌胃處理,觀察AST對大鼠氣道炎癥及氣道重構的影響。
1 材料和方法
1.1 材料
1.1.1 實驗動物
健康雄性Wistar大鼠50只(購自濟南朋悅實驗動物繁育有限公司),5~6周齡,平均體重140~180 g,清潔級,動物生產許可證號:SCXK(魯)
1.1.2 主要儀器及試劑
包埋機(武漢俊杰電子有限公司),顯微鏡(尼康儀器有限公司),病理切片機(德國Leica公司),高速冷凍離心機(美國ThermoFisher公司),酶標儀(南京德鐵實驗設備有限公司),PCR儀(美國BIORAD公司),OVA干粉(上海麥克林生化科技有限公司),氫氧化鋁(西隴科學股份有限公司),蝦青素(Solarbio),4%多聚甲醛(biosharp),RNA提取試劑TRIzol(VICMED),1-溴-3-氯丙烷(上海麥克林生化科技有限公司),小鼠抗大鼠MUC5AC單抗(美國Neomarker公司),大鼠IL-5、IL-13、總IgE、TGF-β、MDA、SOD ELISA測定試劑盒(上海酶聯生物),RT-PCR試劑盒(AG和TaKaRa),霧化器(boy037G6000型,德國Pari公司)。
1.2 方法
1.2.1 動物分組
50只雄性Wistar大鼠按隨機數字表法分為5組(n=10)。生理鹽水致敏+生理鹽水激發組(對照組):應用生理鹽水致敏大鼠,生理鹽水霧化吸入2周;支氣管哮喘組(哮喘組):OVA致敏大鼠和反復霧化吸入2周制備支氣管哮喘大鼠模型;為了探討蝦青素處理是否有劑量依賴性,又將蝦青素分為三組不同劑量組,支氣管哮喘+蝦青素5 mg/kg灌胃處理組(AST 5 mg/kg組)、支氣管哮喘+蝦青素10 mg/kg灌胃處理組(AST 10 mg/kg組)、支氣管哮喘+蝦青素50 mg/kg灌胃處理組(AST 50 mg/kg組):三組支氣管哮喘大鼠分別給予相應劑量的蝦青素灌胃處理10 d。各組大鼠于末次OVA或生理鹽水激發24 h后處死。
1.2.2 建立支氣管哮喘模型
參考Palmans等[8]的方法建立大鼠支氣管哮喘模型。于第1 d、第8 d用新鮮配置的OVA 1 mg+氫氧化鋁100 mg+生理鹽水1 ml混懸液,在大鼠兩側腹股溝、腹、前足趾,共4點做皮下注射,每點0.2 ml,腹腔注射0.2 ml。從第15 d至第29 d,連續2周,將大鼠放于自制有機玻璃箱(50 cm×27 cm×25 cm)內,連接霧化器,以1%OVA生理鹽水溶液(1g OVA溶于100 ml 0.9%氯化鈉)進行霧化吸入,每周3次,每次30 min。對照組以生理鹽水代替OVA致敏和激發。
1.2.3 蝦青素處理
按照Hwang等[9]的研究方法,在OVA激發前給予AST組每只大鼠2 ml蝦青素生理鹽水混懸液(含5 mg/kg、10 mg/kg、50 mg/kg蝦青素)灌胃,從第15 d至第24 d,連續10 d;對照組和哮喘組用2 ml生理鹽水進行灌胃處理。
1.2.4 肺組織的獲取
各組大鼠在末次OVA或生理鹽水激發24 h后,用5%水合氯醛將大鼠麻醉,剖開胸腔,心臟穿刺取血,
1.2.5 ELISA測定BALF IL-5、IL-13、IFN-γ、TGF-β、MDA、SOD及血清總IgE水平
–80 ℃冰箱取出BALF上清液,室溫孵育20 min,操作步驟按ELISA試劑盒說明書進行。用酶標儀在450nm波長測定各孔累積光密度(integrated optical density,IOD)值。
1.2.6 大鼠肺組織切片HE染色
取出用4%多聚甲醛浸泡的肺組織,置于室溫靜置10 min,石蠟包埋固定后,切取5μm厚切片,在HE染色切片上隨機選取直徑500~
1.2.7 肺組織PAS染色
石蠟包埋肺組織,切片機切取5 μm 厚的肺組織切片,按照PAS染色試劑盒說明進行染色。在 PAS染色切片上,測量氣道上皮表面與基底膜間區域的總面積及被PAS染成玫瑰紅色的面積,以PAS染色面積占該區域總面積的百分比表示杯狀細胞增生程度。
1.2.8 肺組織Masson染色
常規石蠟包埋、切片,按照Masson染色試劑盒說明進行染色。在Masson染色切片上,測量氣道上皮基底膜下20 μm區域內被染成藍色的非細胞部分的面積和該區域的總面積,以被染成藍色部分的面積占該區域總面積的百分比表示上皮下膠原纖維沉積的程度。
1.2.9 大鼠肺組織中MUC5AC mRNA檢測
–80 ℃冰箱取出肺組織,于液氮中研磨約30 mg,溶解到1 mL Trizol試劑中,依次加入1/5體積的1-溴-3-氯丙烷、異丙醇、80%乙醇(現用現配)后提取RNA,分別測定各組RNA 濃度,根據RNA 濃度加樣,利用試劑盒說明進行逆轉錄得到互補DNA(complementary deoxyribonucleic acid,cDNA)。MUC5AC mRNA上游引物:5’- GGGCAGCGCTACAGTTTCAG-3’,下游引物:5’-TCAGTGACAACACGAAAGGC-3’,擴增片段100堿基對(base pair,100bp);內參甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)mRNA上游引物:5’-TCCTGTGGCATCCATGAAACT-3’,下游引物:5’-GAAGCACTTGCGGTGCACGAT-3’,擴增片段185bp。根據RT-PCR試劑盒說明進行操作,10 μL體系進行定量 PCR,得到各組mRNA 表達水平及溶解曲線。將得到CT值,用2-ΔΔCT法求出數值,利用Prism 8軟件作圖并分析數據。
1.2.10 大鼠肺組織MUC5AC免疫組織化學染色
甲醛固定的右肺下葉石蠟包埋,制作5 μm組織切片,脫蠟入水,小鼠抗大鼠MUC5AC單抗,4 ℃孵育過夜,用PBS進行1∶200稀釋一抗,用PBS進行1∶2 000稀釋二抗,孵育1.5 h后,抗生物素蛋白鏈菌素-生物素復合物(strept avidin-biotin complex,SABC)法染色,蘇木精復染,以PBS代替一抗為陰性對照。每只大鼠直徑在500~
1.3 統計學處理
數據以均數±標準差(x± s)表示。多組間比較采用單因素方差分析(one-way ANOVA),單因素方差分析后組間兩兩比較采用Tukey-Kramer檢驗。P<0.05為差異有統計學意義。所有統計分析均使用GraphPad Prism 8.0進行。
2 結 果
2.1 各組大鼠BALF上清液細胞因子水平
哮喘組BALF上清液中IL-5、IL-13、TGF-β水平均高于對照組(P<0.01或P<0.001);灌胃5 mg/kg、10 mg/kg、50 mg/kg AST后,BALF上清液中IL-5、IL-13、TGF-β水平進行性降低,呈劑量依賴性(P<0.05或P<0.01);哮喘組IFN-γ水平低于對照組(P<0.001),AST灌胃處理后IFN-γ水平高于哮喘組(P<0.05或P<0.01),而AST灌胃處理的3組水平無差別(P>0.05)。結果見表1。
2.2 各組大鼠BALF中氧化/抗氧化細胞因子水平
與對照組比較,哮喘組大鼠BALF中MDA水平升高,SOD水平降低(P<0.001);與哮喘組比較,哮喘大鼠經5 mg/kg、10 mg/kg、50 mg/kg AST灌胃處理后,BALF中MDA水平降低,SOD水平升高(P<0.05或P<0.01)。結果見表2。
2.3 各組大鼠血清中總IgE水平
哮喘組大鼠血清總IgE水平高于對照組(P<0.001);哮喘大鼠經5 mg/kg、10 mg/kg、50 mg/kg AST灌胃處理后,血清總IgE水平降低(P<0.05或P<0.01),三組均低于哮喘組;而AST組之間無差別(P>0.05)。結果見表3。
2.4 各組大鼠氣道上皮炎癥細胞浸潤及上皮細胞脫落程度
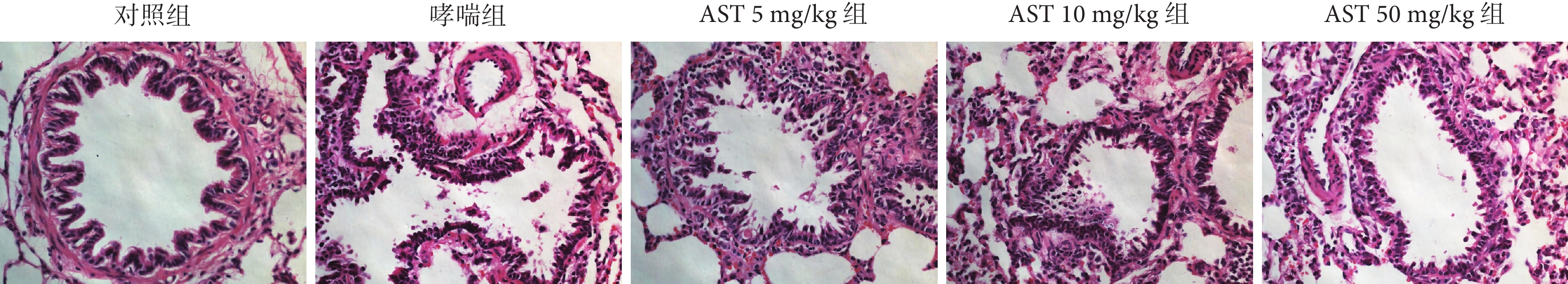
與對照組比較,哮喘組大鼠氣道可見炎癥細胞浸潤和散在的上皮細胞損傷脫落(P<0.001);與哮喘組比較,AST灌胃處理后大鼠氣道炎癥細胞浸潤、上皮細胞脫落程度減輕(P<0.01或P<0.001);而AST不同劑量處理之間無差別(P>0.05)。結果見表4,圖1。
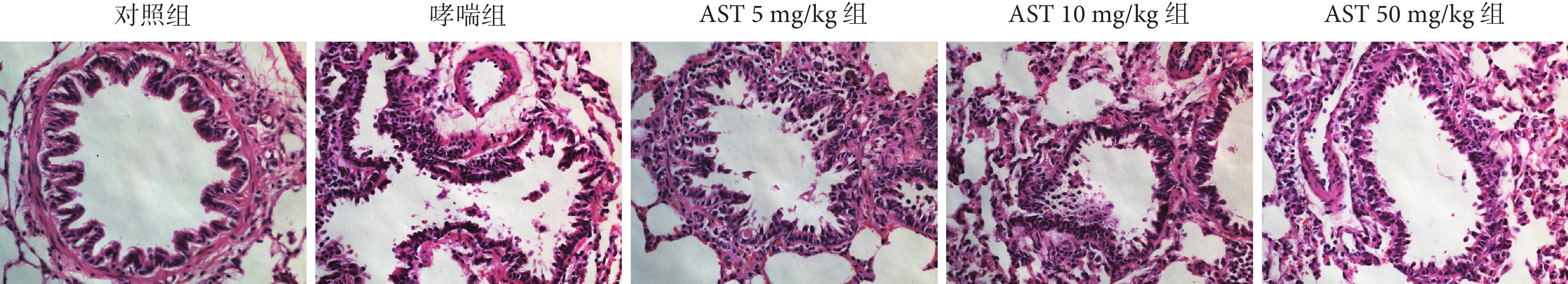 圖1
各組大鼠的氣道炎癥浸潤和上皮細胞脫落病理學觀察(HE ×400)
圖1
各組大鼠的氣道炎癥浸潤和上皮細胞脫落病理學觀察(HE ×400)
2.5 各組大鼠氣道上皮杯狀細胞增生程度
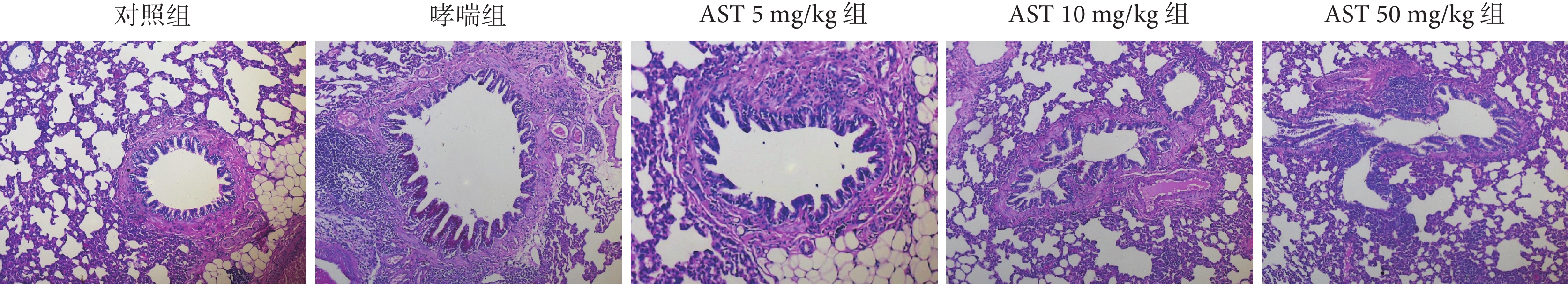
哮喘組大鼠氣道上皮可見杯狀細胞增生,對照組大鼠無氣道上皮杯狀細胞增生(P<0.001);與哮喘組比較,AST灌胃處理組大鼠氣道上皮杯狀細胞數量減少(P<0.05或P<0.01或P<0.001);而AST 不同劑量之間無顯著差異(P>0.05)。結果見表5、圖2。
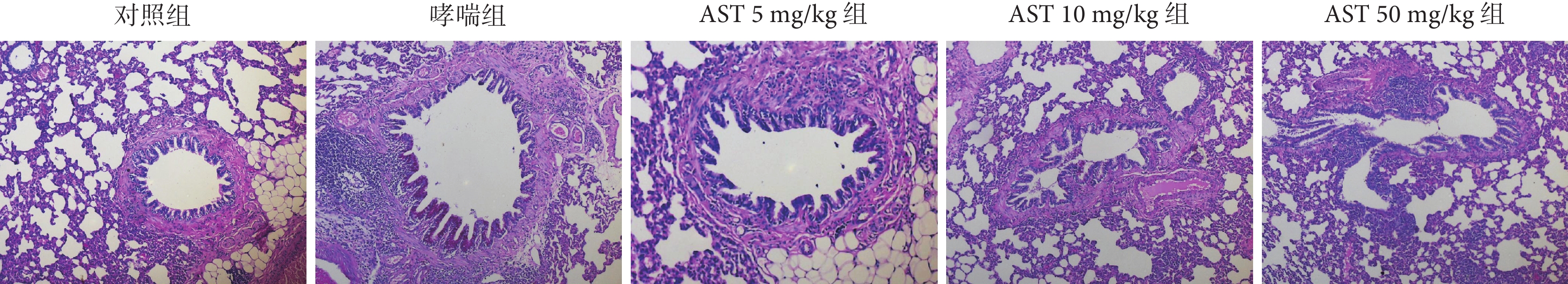 圖2
各組大鼠氣道上皮杯狀細胞增生病理學觀察(PAS ×200 )
圖2
各組大鼠氣道上皮杯狀細胞增生病理學觀察(PAS ×200 )
2.6 各組大鼠氣道上皮下膠原纖維沉積程度
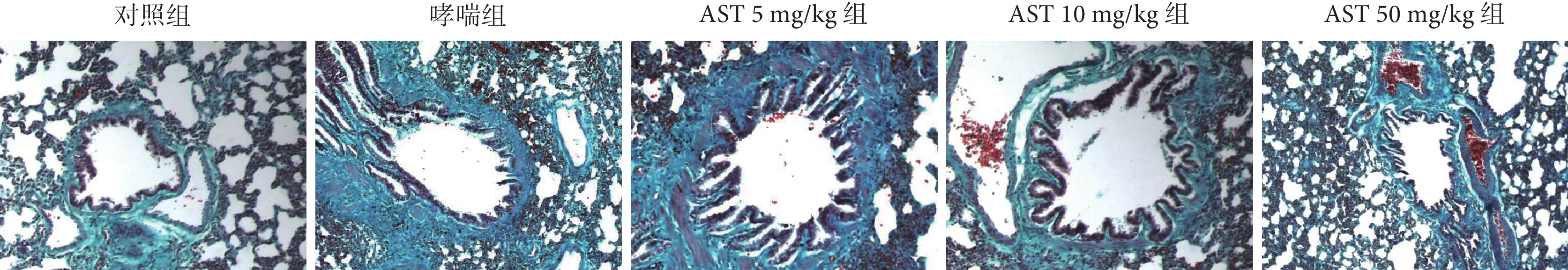
哮喘組大鼠氣道上皮下有膠原纖維沉積,對照組大鼠氣道上皮下未見有膠原纖維沉積(P<0.001);與哮喘組比較,AST灌胃處理后氣道上皮下膠原纖維沉積程度減輕(P<0.01或P<0.001);而AST 處理組之間氣道上皮下膠原纖維沉積程度無差異(P>0.05)。結果見表5、圖3。
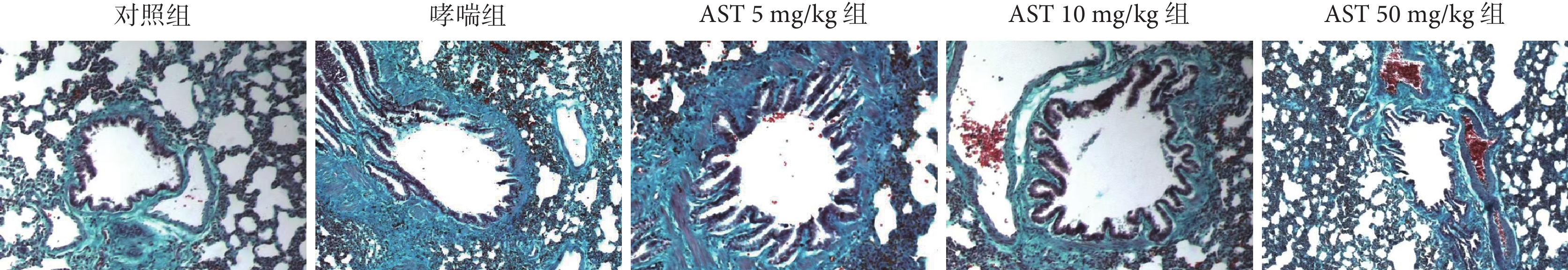 圖3
各組大鼠氣道上皮下膠原纖維沉積病理學觀察(Masson ×200)
圖3
各組大鼠氣道上皮下膠原纖維沉積病理學觀察(Masson ×200)
2.7 各組大鼠肺組織MUC5AC mRNA的表達
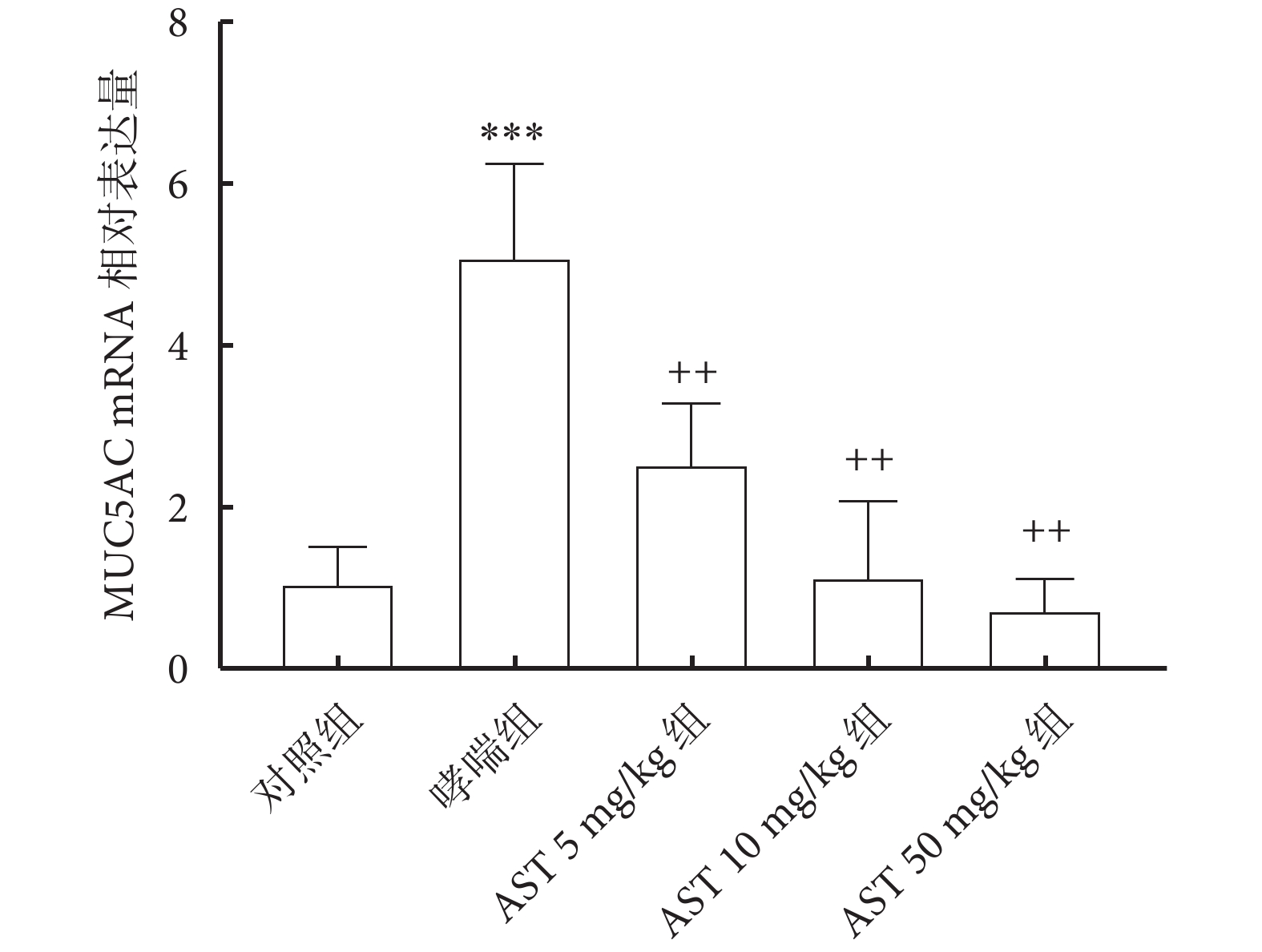
哮喘組大鼠肺組織中MUC5AC mRNA表達比對照組顯著升高(P<0.001);與哮喘組比較,AST灌胃處理組MUC5AC mRNA表達降低(P<0.01);而AST灌胃處理組之間MUC5AC mRNA表達差異無統計學意義(P>0.05)。結果圖4。
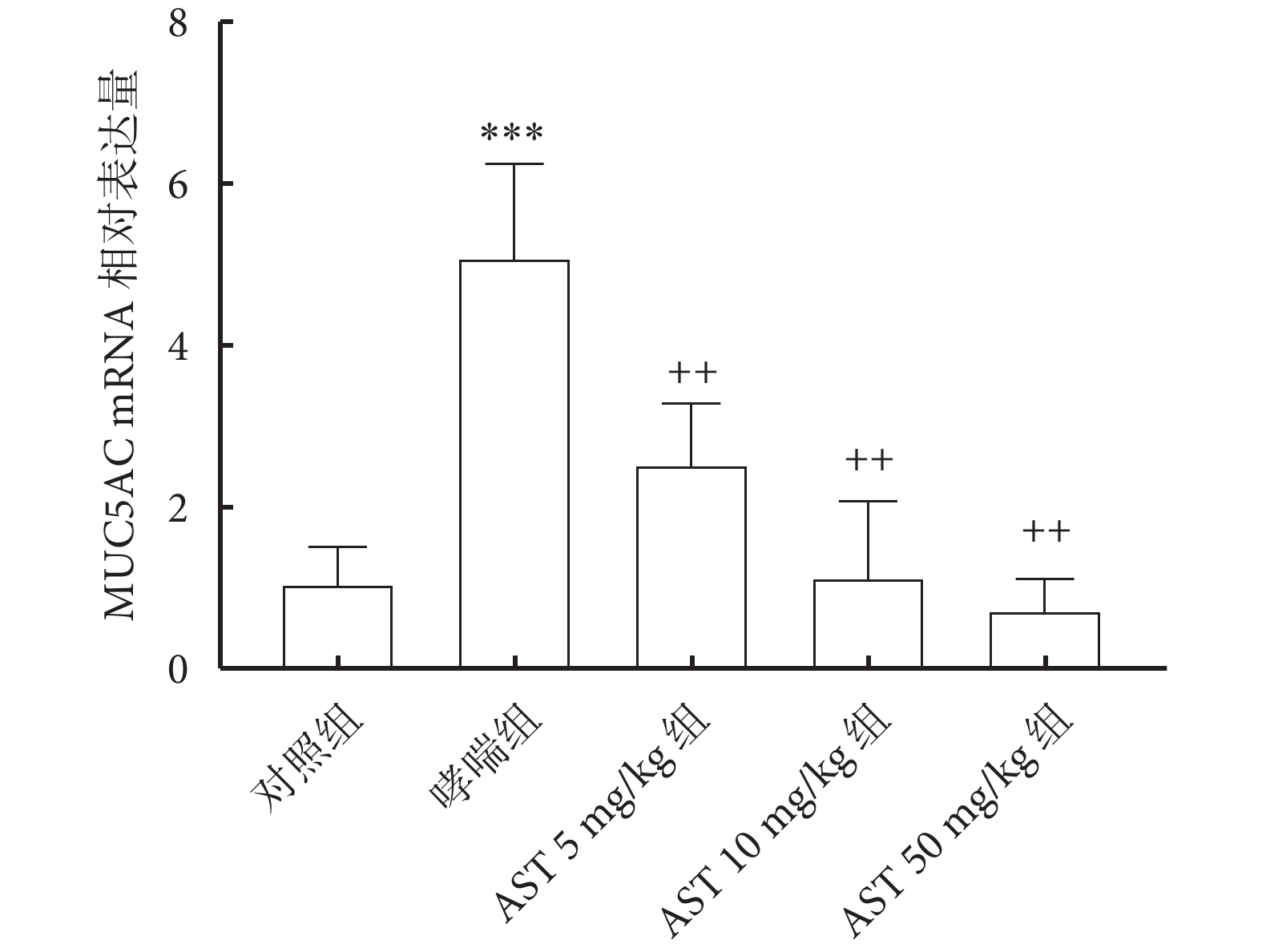 圖4
各組大鼠肺組織的MUC5AC mRNA表達水平(n =10,x± s)
圖4
各組大鼠肺組織的MUC5AC mRNA表達水平(n =10,x± s)
注:與對照組比較,***
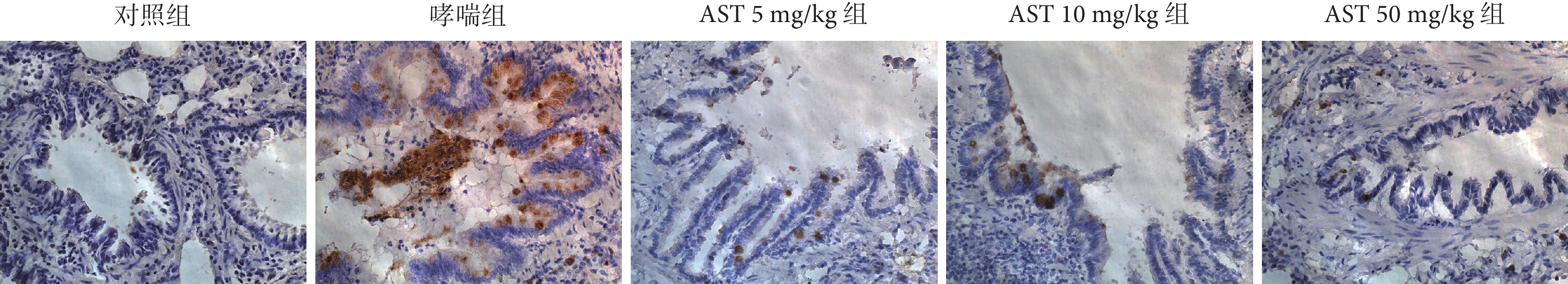
2.8 各組大鼠氣道上皮MUC5AC的表達
與對照組比較,哮喘組大鼠的氣道上皮MUC5AC蛋白表達水平升高(P<0.001);AST處理組與哮喘組比較,大鼠氣道周圍MUC5AC蛋白表達水平降低(P<0.01);不同劑量AST處理組MUC5AC表達無差異(P>0.05)結果見表6、圖5。
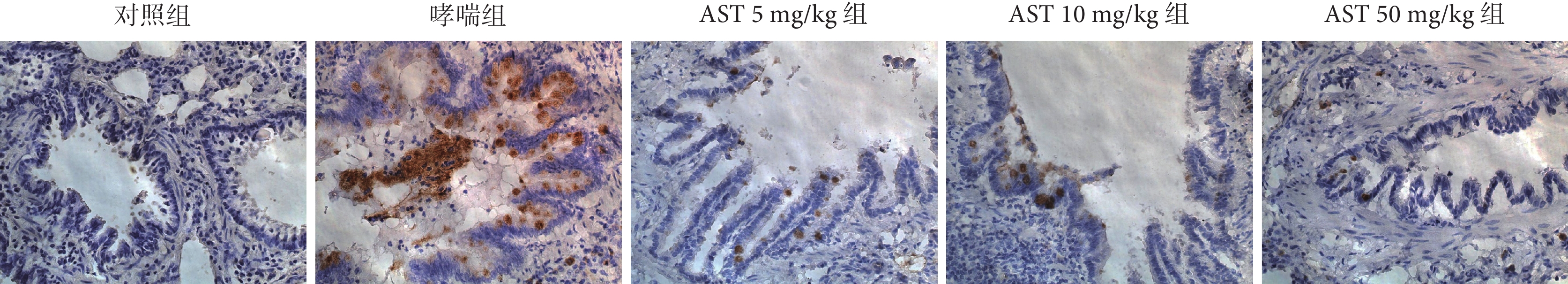 圖5
各組大鼠氣道上皮細胞MUC5AC的表達(SABC ×200)
圖5
各組大鼠氣道上皮細胞MUC5AC的表達(SABC ×200)
3 討論
氧化應激是指活性氧產生能力與抗氧化防御能力之間的失衡,這種失衡與哮喘氣道慢性炎癥有關[10]。研究表明[11],哮喘患者血漿氧化應激標志物MDA、高級氧化蛋白產物(advanced oxidation protein products,AOPP)含量升高,SOD活性降低,抗氧化劑谷胱甘肽(glutathione,r-glutamyl cysteingl+glycine,GSH)水平降低,GSH的消耗可能與抑制輔助性T細胞1型(t-helper cell 1,Th1)相關細胞因子和促進輔助性T細胞2型(t-helper cell 2,Th2)相關細胞因子的產生有關,提示氧化應激在哮喘的發生和發展中具有重要作用。
AST是一種天然的抗氧化劑,其主要機制是通過抑制細胞因子和趨化因子活性調節免疫反應,大量證據支持AST對心血管疾病、糖尿病、神經退行性疾病、癌癥和肥胖引起的氧化損傷有一定保護作用[12]。盡管目前導致哮喘的分子機制尚不清楚,但氧化和炎癥介質被發現在這一過程中扮演了重要角色。為此,本研究通過分析蝦青素對哮喘大鼠的影響,初步闡明其發揮抗炎作用的潛在機制。
聚集在氣道上皮炎癥細胞會產生大量活性氧,而活性氧刺激組胺釋放,導致內皮細胞損傷脫落,破壞β-腎上腺素能受體的功能,從而加重氣道炎癥和重構。MDA的表達反映了全身脂質過氧化的程度,通常與SOD的測定相結合。SOD是一種重要的抗氧化酶和氧化應激標志物,在清除自由基、防止細胞損傷、促進氧化和抗氧化平衡等方面發揮著重要作用,SOD的活性可反應氧自由基對肺損傷的程度[13]。本研究表明蝦青素可以降低哮喘大鼠肺組織中MDA的含量,升高SOD的活性,說明蝦青素可以調節哮喘大鼠的氧化應激水平。
支氣管哮喘是由多種炎性細胞如T淋巴細胞、 巨噬細胞等和細胞組分共同參與介導的氣道慢性炎癥性疾病[14]。當外源性變應原進入機體后,被抗原提呈細胞內吞并將過敏原呈遞給Th2細胞,活化的Th2細胞產生IL-4、IL-5、 IL-13等細胞因子[15],這些細胞因子在哮喘氣道炎癥和重構中起重要的調控作用,而具有促纖維化活性的TGF-β與氣道重構密切相關[16]。其中,IL-4、 IL-13可激活B淋巴細胞合成特異性IgE,抗原與抗體結合后激活肥大細胞、嗜堿性粒細胞等炎癥細胞并使其釋放多種活性物質。IL-5誘導嗜酸性粒細胞在氣道上皮內聚集、活化和成熟,導致嗜酸性粒細胞炎癥[17],抗IL-5治療是治療高嗜酸性粒細胞綜合征患者的有效方法之一。IL-13主要是由CD4+Th2 細胞產生,活化的單核細胞、B細胞、CD8+細胞等在一定條件下也能分泌IL-13[18]。作為主要的Th2細胞因子之一,IL-13在哮喘等變應性疾病中發揮重要調控作用,IL-4和IL-13可以通過IL-4受體上調黏蛋白的表達,是促進杯狀細胞增生、組織重構和支氣管痙攣的主要細胞因子[19]。IL-13可促進哮喘氣道炎癥、黏液過度分泌、氣道高反應性(airway hyper reactivity,AHR)和IgE的合成[20]。Th1細胞分泌的IFN-γ在Th1分化中起重要作用,IFN-γ主要通過抑制CD4+ T細胞的浸潤、減少Th2細胞因子(IL-4和IL-5)的產生、抑制IgE的合成,減輕過敏性氣道炎癥抑制嗜酸性粒細胞的聚集[21-22]。本研究表明蝦青素可以降低哮喘大鼠肺組織中IL-5、IL-13和IgE水平,提高IFN-γ水平,說明蝦青素可以減輕哮喘大鼠的氣道炎癥。
氣道重構是哮喘的重要病理特征,包括上皮細胞脫落、杯狀細胞增生、上皮下膠原蛋白沉積和纖維化、新生血管生成、氣道平滑肌細胞肥大和增生等病理改變[23]。在呼吸道黏膜表面覆蓋著由杯狀細胞和黏膜下腺體分泌的黏液,其中杯狀細胞是主要的分泌細胞[24],其分泌的黏液是由水、離子、蛋白、糖蛋白及脂質等組成的混合物。黏液的主要成分是黏蛋白,對氣道的局部防御至關重要[25]。在哮喘患者和哮喘動物模型中氣道黏液的過度分泌是主要的病理學特征之一[26]。過度分泌的黏液可以阻塞氣道,使氣道阻力增加,加重氣道高反應性,是哮喘患者發病和死亡的主要原因之一[27]。哮喘患者氣道分泌的黏蛋白主要是MUC5AC,主要由氣道上皮杯狀細胞分泌。研究發現,IL-13可促進杯狀細胞增生,上調MUC5AC的表達[28]。Khalfaoui等[29]發現哮喘患者氣道上皮組織樣本中MUC5AC表達量顯著高于對照組。Siddiqui等發現[28],miR-141可調節IL-13,促進氣道上皮杯狀細胞增生,MUC5AC基因和蛋白表達,促進氣道重塑。而miR-145可抑制表皮生長因子受體(epidermal growth factor receptor,EGFR)的激活,下調MUC5AC表達,減輕氣道重構[30]。本實驗中,經過AST處理, IL-13水平降低,同時氣道MUC5AC表達降低,提示兩者有一定相關性,IL-13在上調MUC5AC中起一定作用,AST可下調哮喘大鼠肺中MUC5AC的表達,抑制杯狀細胞增生,減少氣道黏液分泌,降低氣道周圍膠原纖維的沉積,減輕氣道重構。
Hwang等[9]通過動物實驗證明,AST可抑制OVA誘導的哮喘小鼠肺部炎癥細胞的浸潤、黏液的過度分泌和肺纖維化。在本研究中,我們也得到了同樣的結果。綜合以上,我們初步判斷AST可通過緩解氧化應激水平,減輕OVA誘導的哮喘大鼠氣道炎癥,可能與抑制Th2細胞因子(IL-5和IL-13)的釋放,調節Th1/Th2失衡,降低血清IgE水平有關。AST還可下調MUC5AC表達,抑制杯狀細胞增生,減少氣道黏液高分泌,降低氣道周圍膠原纖維的沉積,減輕氣道重構。此外,為了探討三組不同劑量的AST處理組之間有無差異,經過研究發現,不同劑量AST處理對哮喘大鼠氣道炎癥及氣道重構無劑量依賴性,提示小劑量的AST對哮喘氣道炎癥和氣道重構起一定保護作用。因此,抗氧化治療可能是未來支氣管哮喘防治的有效靶點之一,其確切的機制還有待于進一步研究。
本實驗還存在一定的局限性。首先,可逆性氣流受限及氣道高反應是哮喘的一個重要病理特征,但由于實驗條件的限制,我們在評估蝦青素治療效果時無法對該參數進行評價。其次我們還需要使用分子特異性抑制劑來充分闡明其信號機制。其次,在分組方面我們可以再設立一組激素組,觀察蝦青素與激素聯合應用的治療效果與單用蝦青素的治療效果如何。最后,蝦青素作為治療劑的安全性需要進一步的測試。我們的研究為支氣管哮喘的發病機制帶來了新的視角,蝦青素在哮喘中的作用可能為今后哮喘的預防和治療提供新的靶點,為將來進一步的機制研究做一定基礎參考。
支氣管哮喘(簡稱哮喘)是一種常見的慢性呼吸系統疾病,其發病率呈逐年增高的趨勢,全世界3億多人患有哮喘,中國約有
AST即3,3’-二羥基-4,4’-二酮基-β,β’胡蘿卜素,是一種具有抗炎、抗氧化作用的脂溶性類胡蘿卜素,在神經系統疾病等多種疾病的發生和發展中發揮重要作用[4-7]。近年來,氧化應激在支氣管哮喘發生發展中的作用日益引起人們的重視。但到目前為止,AST對支氣管哮喘氣道炎癥和氣道重構的影響,國內外均少見報道。為此,我們用卵清蛋白(ovalbumin,OVA)致敏和激發建立大鼠支氣管哮喘模型,并給予蝦青素灌胃處理,觀察AST對大鼠氣道炎癥及氣道重構的影響。
1 材料和方法
1.1 材料
1.1.1 實驗動物
健康雄性Wistar大鼠50只(購自濟南朋悅實驗動物繁育有限公司),5~6周齡,平均體重140~180 g,清潔級,動物生產許可證號:SCXK(魯)
1.1.2 主要儀器及試劑
包埋機(武漢俊杰電子有限公司),顯微鏡(尼康儀器有限公司),病理切片機(德國Leica公司),高速冷凍離心機(美國ThermoFisher公司),酶標儀(南京德鐵實驗設備有限公司),PCR儀(美國BIORAD公司),OVA干粉(上海麥克林生化科技有限公司),氫氧化鋁(西隴科學股份有限公司),蝦青素(Solarbio),4%多聚甲醛(biosharp),RNA提取試劑TRIzol(VICMED),1-溴-3-氯丙烷(上海麥克林生化科技有限公司),小鼠抗大鼠MUC5AC單抗(美國Neomarker公司),大鼠IL-5、IL-13、總IgE、TGF-β、MDA、SOD ELISA測定試劑盒(上海酶聯生物),RT-PCR試劑盒(AG和TaKaRa),霧化器(boy037G6000型,德國Pari公司)。
1.2 方法
1.2.1 動物分組
50只雄性Wistar大鼠按隨機數字表法分為5組(n=10)。生理鹽水致敏+生理鹽水激發組(對照組):應用生理鹽水致敏大鼠,生理鹽水霧化吸入2周;支氣管哮喘組(哮喘組):OVA致敏大鼠和反復霧化吸入2周制備支氣管哮喘大鼠模型;為了探討蝦青素處理是否有劑量依賴性,又將蝦青素分為三組不同劑量組,支氣管哮喘+蝦青素5 mg/kg灌胃處理組(AST 5 mg/kg組)、支氣管哮喘+蝦青素10 mg/kg灌胃處理組(AST 10 mg/kg組)、支氣管哮喘+蝦青素50 mg/kg灌胃處理組(AST 50 mg/kg組):三組支氣管哮喘大鼠分別給予相應劑量的蝦青素灌胃處理10 d。各組大鼠于末次OVA或生理鹽水激發24 h后處死。
1.2.2 建立支氣管哮喘模型
參考Palmans等[8]的方法建立大鼠支氣管哮喘模型。于第1 d、第8 d用新鮮配置的OVA 1 mg+氫氧化鋁100 mg+生理鹽水1 ml混懸液,在大鼠兩側腹股溝、腹、前足趾,共4點做皮下注射,每點0.2 ml,腹腔注射0.2 ml。從第15 d至第29 d,連續2周,將大鼠放于自制有機玻璃箱(50 cm×27 cm×25 cm)內,連接霧化器,以1%OVA生理鹽水溶液(1g OVA溶于100 ml 0.9%氯化鈉)進行霧化吸入,每周3次,每次30 min。對照組以生理鹽水代替OVA致敏和激發。
1.2.3 蝦青素處理
按照Hwang等[9]的研究方法,在OVA激發前給予AST組每只大鼠2 ml蝦青素生理鹽水混懸液(含5 mg/kg、10 mg/kg、50 mg/kg蝦青素)灌胃,從第15 d至第24 d,連續10 d;對照組和哮喘組用2 ml生理鹽水進行灌胃處理。
1.2.4 肺組織的獲取
各組大鼠在末次OVA或生理鹽水激發24 h后,用5%水合氯醛將大鼠麻醉,剖開胸腔,心臟穿刺取血,
1.2.5 ELISA測定BALF IL-5、IL-13、IFN-γ、TGF-β、MDA、SOD及血清總IgE水平
–80 ℃冰箱取出BALF上清液,室溫孵育20 min,操作步驟按ELISA試劑盒說明書進行。用酶標儀在450nm波長測定各孔累積光密度(integrated optical density,IOD)值。
1.2.6 大鼠肺組織切片HE染色
取出用4%多聚甲醛浸泡的肺組織,置于室溫靜置10 min,石蠟包埋固定后,切取5μm厚切片,在HE染色切片上隨機選取直徑500~
1.2.7 肺組織PAS染色
石蠟包埋肺組織,切片機切取5 μm 厚的肺組織切片,按照PAS染色試劑盒說明進行染色。在 PAS染色切片上,測量氣道上皮表面與基底膜間區域的總面積及被PAS染成玫瑰紅色的面積,以PAS染色面積占該區域總面積的百分比表示杯狀細胞增生程度。
1.2.8 肺組織Masson染色
常規石蠟包埋、切片,按照Masson染色試劑盒說明進行染色。在Masson染色切片上,測量氣道上皮基底膜下20 μm區域內被染成藍色的非細胞部分的面積和該區域的總面積,以被染成藍色部分的面積占該區域總面積的百分比表示上皮下膠原纖維沉積的程度。
1.2.9 大鼠肺組織中MUC5AC mRNA檢測
–80 ℃冰箱取出肺組織,于液氮中研磨約30 mg,溶解到1 mL Trizol試劑中,依次加入1/5體積的1-溴-3-氯丙烷、異丙醇、80%乙醇(現用現配)后提取RNA,分別測定各組RNA 濃度,根據RNA 濃度加樣,利用試劑盒說明進行逆轉錄得到互補DNA(complementary deoxyribonucleic acid,cDNA)。MUC5AC mRNA上游引物:5’- GGGCAGCGCTACAGTTTCAG-3’,下游引物:5’-TCAGTGACAACACGAAAGGC-3’,擴增片段100堿基對(base pair,100bp);內參甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)mRNA上游引物:5’-TCCTGTGGCATCCATGAAACT-3’,下游引物:5’-GAAGCACTTGCGGTGCACGAT-3’,擴增片段185bp。根據RT-PCR試劑盒說明進行操作,10 μL體系進行定量 PCR,得到各組mRNA 表達水平及溶解曲線。將得到CT值,用2-ΔΔCT法求出數值,利用Prism 8軟件作圖并分析數據。
1.2.10 大鼠肺組織MUC5AC免疫組織化學染色
甲醛固定的右肺下葉石蠟包埋,制作5 μm組織切片,脫蠟入水,小鼠抗大鼠MUC5AC單抗,4 ℃孵育過夜,用PBS進行1∶200稀釋一抗,用PBS進行1∶2 000稀釋二抗,孵育1.5 h后,抗生物素蛋白鏈菌素-生物素復合物(strept avidin-biotin complex,SABC)法染色,蘇木精復染,以PBS代替一抗為陰性對照。每只大鼠直徑在500~
1.3 統計學處理
數據以均數±標準差(x± s)表示。多組間比較采用單因素方差分析(one-way ANOVA),單因素方差分析后組間兩兩比較采用Tukey-Kramer檢驗。P<0.05為差異有統計學意義。所有統計分析均使用GraphPad Prism 8.0進行。
2 結 果
2.1 各組大鼠BALF上清液細胞因子水平
哮喘組BALF上清液中IL-5、IL-13、TGF-β水平均高于對照組(P<0.01或P<0.001);灌胃5 mg/kg、10 mg/kg、50 mg/kg AST后,BALF上清液中IL-5、IL-13、TGF-β水平進行性降低,呈劑量依賴性(P<0.05或P<0.01);哮喘組IFN-γ水平低于對照組(P<0.001),AST灌胃處理后IFN-γ水平高于哮喘組(P<0.05或P<0.01),而AST灌胃處理的3組水平無差別(P>0.05)。結果見表1。
2.2 各組大鼠BALF中氧化/抗氧化細胞因子水平
與對照組比較,哮喘組大鼠BALF中MDA水平升高,SOD水平降低(P<0.001);與哮喘組比較,哮喘大鼠經5 mg/kg、10 mg/kg、50 mg/kg AST灌胃處理后,BALF中MDA水平降低,SOD水平升高(P<0.05或P<0.01)。結果見表2。
2.3 各組大鼠血清中總IgE水平
哮喘組大鼠血清總IgE水平高于對照組(P<0.001);哮喘大鼠經5 mg/kg、10 mg/kg、50 mg/kg AST灌胃處理后,血清總IgE水平降低(P<0.05或P<0.01),三組均低于哮喘組;而AST組之間無差別(P>0.05)。結果見表3。
2.4 各組大鼠氣道上皮炎癥細胞浸潤及上皮細胞脫落程度
與對照組比較,哮喘組大鼠氣道可見炎癥細胞浸潤和散在的上皮細胞損傷脫落(P<0.001);與哮喘組比較,AST灌胃處理后大鼠氣道炎癥細胞浸潤、上皮細胞脫落程度減輕(P<0.01或P<0.001);而AST不同劑量處理之間無差別(P>0.05)。結果見表4,圖1。
 圖1
各組大鼠的氣道炎癥浸潤和上皮細胞脫落病理學觀察(HE ×400)
圖1
各組大鼠的氣道炎癥浸潤和上皮細胞脫落病理學觀察(HE ×400)
2.5 各組大鼠氣道上皮杯狀細胞增生程度
哮喘組大鼠氣道上皮可見杯狀細胞增生,對照組大鼠無氣道上皮杯狀細胞增生(P<0.001);與哮喘組比較,AST灌胃處理組大鼠氣道上皮杯狀細胞數量減少(P<0.05或P<0.01或P<0.001);而AST 不同劑量之間無顯著差異(P>0.05)。結果見表5、圖2。
 圖2
各組大鼠氣道上皮杯狀細胞增生病理學觀察(PAS ×200 )
圖2
各組大鼠氣道上皮杯狀細胞增生病理學觀察(PAS ×200 )
2.6 各組大鼠氣道上皮下膠原纖維沉積程度
哮喘組大鼠氣道上皮下有膠原纖維沉積,對照組大鼠氣道上皮下未見有膠原纖維沉積(P<0.001);與哮喘組比較,AST灌胃處理后氣道上皮下膠原纖維沉積程度減輕(P<0.01或P<0.001);而AST 處理組之間氣道上皮下膠原纖維沉積程度無差異(P>0.05)。結果見表5、圖3。
 圖3
各組大鼠氣道上皮下膠原纖維沉積病理學觀察(Masson ×200)
圖3
各組大鼠氣道上皮下膠原纖維沉積病理學觀察(Masson ×200)
2.7 各組大鼠肺組織MUC5AC mRNA的表達
哮喘組大鼠肺組織中MUC5AC mRNA表達比對照組顯著升高(P<0.001);與哮喘組比較,AST灌胃處理組MUC5AC mRNA表達降低(P<0.01);而AST灌胃處理組之間MUC5AC mRNA表達差異無統計學意義(P>0.05)。結果圖4。
 圖4
各組大鼠肺組織的MUC5AC mRNA表達水平(n =10,x± s)
圖4
各組大鼠肺組織的MUC5AC mRNA表達水平(n =10,x± s)
注:與對照組比較,***
2.8 各組大鼠氣道上皮MUC5AC的表達
與對照組比較,哮喘組大鼠的氣道上皮MUC5AC蛋白表達水平升高(P<0.001);AST處理組與哮喘組比較,大鼠氣道周圍MUC5AC蛋白表達水平降低(P<0.01);不同劑量AST處理組MUC5AC表達無差異(P>0.05)結果見表6、圖5。
 圖5
各組大鼠氣道上皮細胞MUC5AC的表達(SABC ×200)
圖5
各組大鼠氣道上皮細胞MUC5AC的表達(SABC ×200)
3 討論
氧化應激是指活性氧產生能力與抗氧化防御能力之間的失衡,這種失衡與哮喘氣道慢性炎癥有關[10]。研究表明[11],哮喘患者血漿氧化應激標志物MDA、高級氧化蛋白產物(advanced oxidation protein products,AOPP)含量升高,SOD活性降低,抗氧化劑谷胱甘肽(glutathione,r-glutamyl cysteingl+glycine,GSH)水平降低,GSH的消耗可能與抑制輔助性T細胞1型(t-helper cell 1,Th1)相關細胞因子和促進輔助性T細胞2型(t-helper cell 2,Th2)相關細胞因子的產生有關,提示氧化應激在哮喘的發生和發展中具有重要作用。
AST是一種天然的抗氧化劑,其主要機制是通過抑制細胞因子和趨化因子活性調節免疫反應,大量證據支持AST對心血管疾病、糖尿病、神經退行性疾病、癌癥和肥胖引起的氧化損傷有一定保護作用[12]。盡管目前導致哮喘的分子機制尚不清楚,但氧化和炎癥介質被發現在這一過程中扮演了重要角色。為此,本研究通過分析蝦青素對哮喘大鼠的影響,初步闡明其發揮抗炎作用的潛在機制。
聚集在氣道上皮炎癥細胞會產生大量活性氧,而活性氧刺激組胺釋放,導致內皮細胞損傷脫落,破壞β-腎上腺素能受體的功能,從而加重氣道炎癥和重構。MDA的表達反映了全身脂質過氧化的程度,通常與SOD的測定相結合。SOD是一種重要的抗氧化酶和氧化應激標志物,在清除自由基、防止細胞損傷、促進氧化和抗氧化平衡等方面發揮著重要作用,SOD的活性可反應氧自由基對肺損傷的程度[13]。本研究表明蝦青素可以降低哮喘大鼠肺組織中MDA的含量,升高SOD的活性,說明蝦青素可以調節哮喘大鼠的氧化應激水平。
支氣管哮喘是由多種炎性細胞如T淋巴細胞、 巨噬細胞等和細胞組分共同參與介導的氣道慢性炎癥性疾病[14]。當外源性變應原進入機體后,被抗原提呈細胞內吞并將過敏原呈遞給Th2細胞,活化的Th2細胞產生IL-4、IL-5、 IL-13等細胞因子[15],這些細胞因子在哮喘氣道炎癥和重構中起重要的調控作用,而具有促纖維化活性的TGF-β與氣道重構密切相關[16]。其中,IL-4、 IL-13可激活B淋巴細胞合成特異性IgE,抗原與抗體結合后激活肥大細胞、嗜堿性粒細胞等炎癥細胞并使其釋放多種活性物質。IL-5誘導嗜酸性粒細胞在氣道上皮內聚集、活化和成熟,導致嗜酸性粒細胞炎癥[17],抗IL-5治療是治療高嗜酸性粒細胞綜合征患者的有效方法之一。IL-13主要是由CD4+Th2 細胞產生,活化的單核細胞、B細胞、CD8+細胞等在一定條件下也能分泌IL-13[18]。作為主要的Th2細胞因子之一,IL-13在哮喘等變應性疾病中發揮重要調控作用,IL-4和IL-13可以通過IL-4受體上調黏蛋白的表達,是促進杯狀細胞增生、組織重構和支氣管痙攣的主要細胞因子[19]。IL-13可促進哮喘氣道炎癥、黏液過度分泌、氣道高反應性(airway hyper reactivity,AHR)和IgE的合成[20]。Th1細胞分泌的IFN-γ在Th1分化中起重要作用,IFN-γ主要通過抑制CD4+ T細胞的浸潤、減少Th2細胞因子(IL-4和IL-5)的產生、抑制IgE的合成,減輕過敏性氣道炎癥抑制嗜酸性粒細胞的聚集[21-22]。本研究表明蝦青素可以降低哮喘大鼠肺組織中IL-5、IL-13和IgE水平,提高IFN-γ水平,說明蝦青素可以減輕哮喘大鼠的氣道炎癥。
氣道重構是哮喘的重要病理特征,包括上皮細胞脫落、杯狀細胞增生、上皮下膠原蛋白沉積和纖維化、新生血管生成、氣道平滑肌細胞肥大和增生等病理改變[23]。在呼吸道黏膜表面覆蓋著由杯狀細胞和黏膜下腺體分泌的黏液,其中杯狀細胞是主要的分泌細胞[24],其分泌的黏液是由水、離子、蛋白、糖蛋白及脂質等組成的混合物。黏液的主要成分是黏蛋白,對氣道的局部防御至關重要[25]。在哮喘患者和哮喘動物模型中氣道黏液的過度分泌是主要的病理學特征之一[26]。過度分泌的黏液可以阻塞氣道,使氣道阻力增加,加重氣道高反應性,是哮喘患者發病和死亡的主要原因之一[27]。哮喘患者氣道分泌的黏蛋白主要是MUC5AC,主要由氣道上皮杯狀細胞分泌。研究發現,IL-13可促進杯狀細胞增生,上調MUC5AC的表達[28]。Khalfaoui等[29]發現哮喘患者氣道上皮組織樣本中MUC5AC表達量顯著高于對照組。Siddiqui等發現[28],miR-141可調節IL-13,促進氣道上皮杯狀細胞增生,MUC5AC基因和蛋白表達,促進氣道重塑。而miR-145可抑制表皮生長因子受體(epidermal growth factor receptor,EGFR)的激活,下調MUC5AC表達,減輕氣道重構[30]。本實驗中,經過AST處理, IL-13水平降低,同時氣道MUC5AC表達降低,提示兩者有一定相關性,IL-13在上調MUC5AC中起一定作用,AST可下調哮喘大鼠肺中MUC5AC的表達,抑制杯狀細胞增生,減少氣道黏液分泌,降低氣道周圍膠原纖維的沉積,減輕氣道重構。
Hwang等[9]通過動物實驗證明,AST可抑制OVA誘導的哮喘小鼠肺部炎癥細胞的浸潤、黏液的過度分泌和肺纖維化。在本研究中,我們也得到了同樣的結果。綜合以上,我們初步判斷AST可通過緩解氧化應激水平,減輕OVA誘導的哮喘大鼠氣道炎癥,可能與抑制Th2細胞因子(IL-5和IL-13)的釋放,調節Th1/Th2失衡,降低血清IgE水平有關。AST還可下調MUC5AC表達,抑制杯狀細胞增生,減少氣道黏液高分泌,降低氣道周圍膠原纖維的沉積,減輕氣道重構。此外,為了探討三組不同劑量的AST處理組之間有無差異,經過研究發現,不同劑量AST處理對哮喘大鼠氣道炎癥及氣道重構無劑量依賴性,提示小劑量的AST對哮喘氣道炎癥和氣道重構起一定保護作用。因此,抗氧化治療可能是未來支氣管哮喘防治的有效靶點之一,其確切的機制還有待于進一步研究。
本實驗還存在一定的局限性。首先,可逆性氣流受限及氣道高反應是哮喘的一個重要病理特征,但由于實驗條件的限制,我們在評估蝦青素治療效果時無法對該參數進行評價。其次我們還需要使用分子特異性抑制劑來充分闡明其信號機制。其次,在分組方面我們可以再設立一組激素組,觀察蝦青素與激素聯合應用的治療效果與單用蝦青素的治療效果如何。最后,蝦青素作為治療劑的安全性需要進一步的測試。我們的研究為支氣管哮喘的發病機制帶來了新的視角,蝦青素在哮喘中的作用可能為今后哮喘的預防和治療提供新的靶點,為將來進一步的機制研究做一定基礎參考。