引用本文: 王麗雯, 柯華, 王可. 表皮生長因子受體突變合并程序性細胞死亡蛋白1配體高表達的晚期肺腺癌病例報告. 中國呼吸與危重監護雜志, 2024, 23(9): 651-654. doi: 10.7507/1671-6205.202309046 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
近年來,表皮生長因子受體酪氨酸激酶抑制劑(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)已經成為EGFR突變晚期非小細胞肺癌(non-small cell lung cancer,NSCLC)患者的標準治療方式。使用EGFR-TKI治療患者后的客觀緩解率(objective response rate,ORR)一般在60%~70%,但仍有30%~40%的患者出現原發耐藥的情況,從而導致患者的長期生存受限。明確EGFR-TKI的耐藥機制以及針對這類患者的治療措施,現已成為EGFR-TKI在臨床上進一步發揮作用,延長患者生存、提高患者生存質量的關鍵問題。本文就2例EGFR突變合并程序性細胞死亡蛋白1配體(programmed cell death protein 1 ligand,PD-L1)高表達的晚期肺腺癌患者EGFR-TKI原發耐藥報道如下。
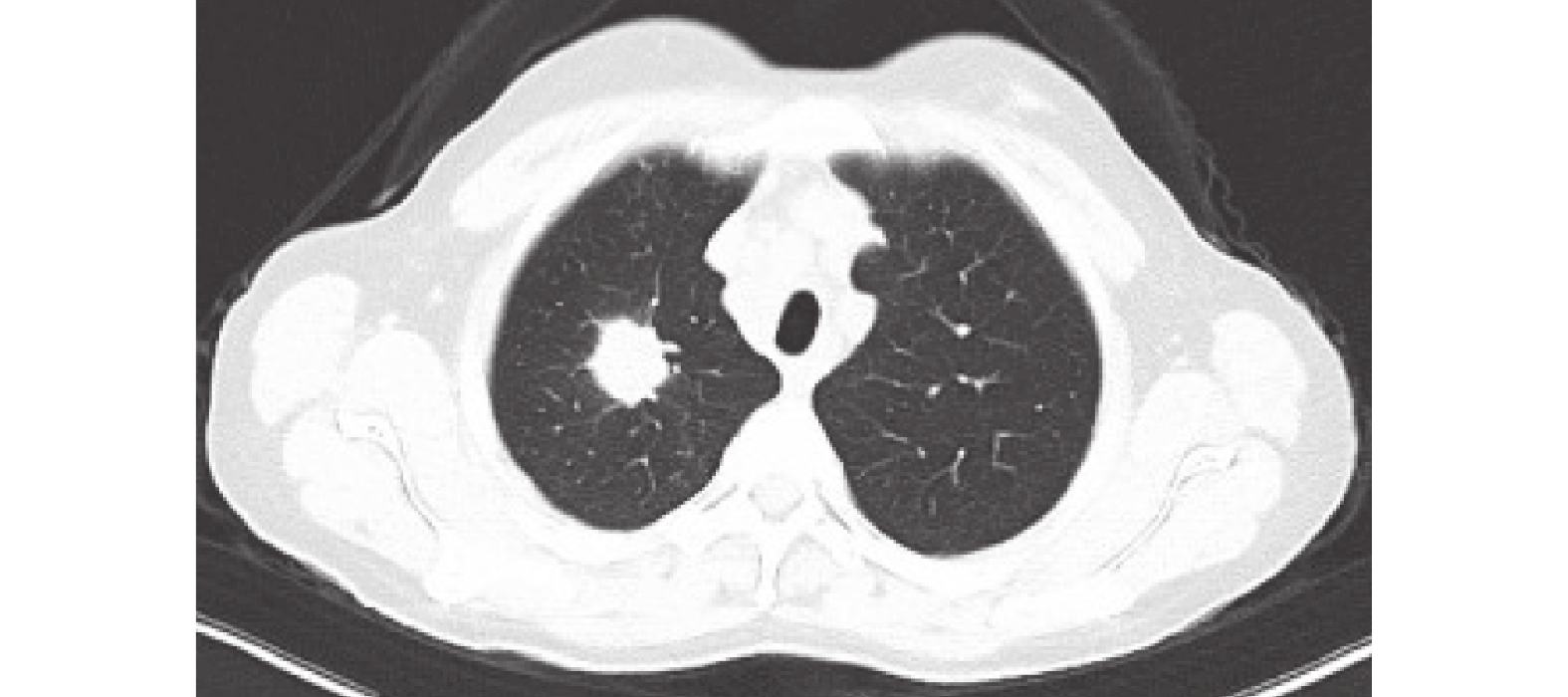
病例資料 患者1,女性,58歲,因“咳嗽咳痰伴氣緊4+月,確診肺腺癌2+月”于2023-07-10入院。免疫組化染色示:PCK(+)、TTF-1(+)、CK7(+)、NapsinA(+)、Ki-67(+,20%~30%),PD-L1(22C3)(TPS:70%)。胸部CT示:肺上葉尖段軟組織密度結節影,多系周圍型肺癌,伴右肺及縱隔淋巴結轉移(圖1)。骨顯像示:腰5椎體右側及右側膝關節骨代謝性稍增高灶,考慮退變。全身其余骨顯像未見確切異常征象。頭部MRI示:未見確切腫瘤轉移征象。同時行Next Generation Sequence檢測示:EGFR 19DEL+。
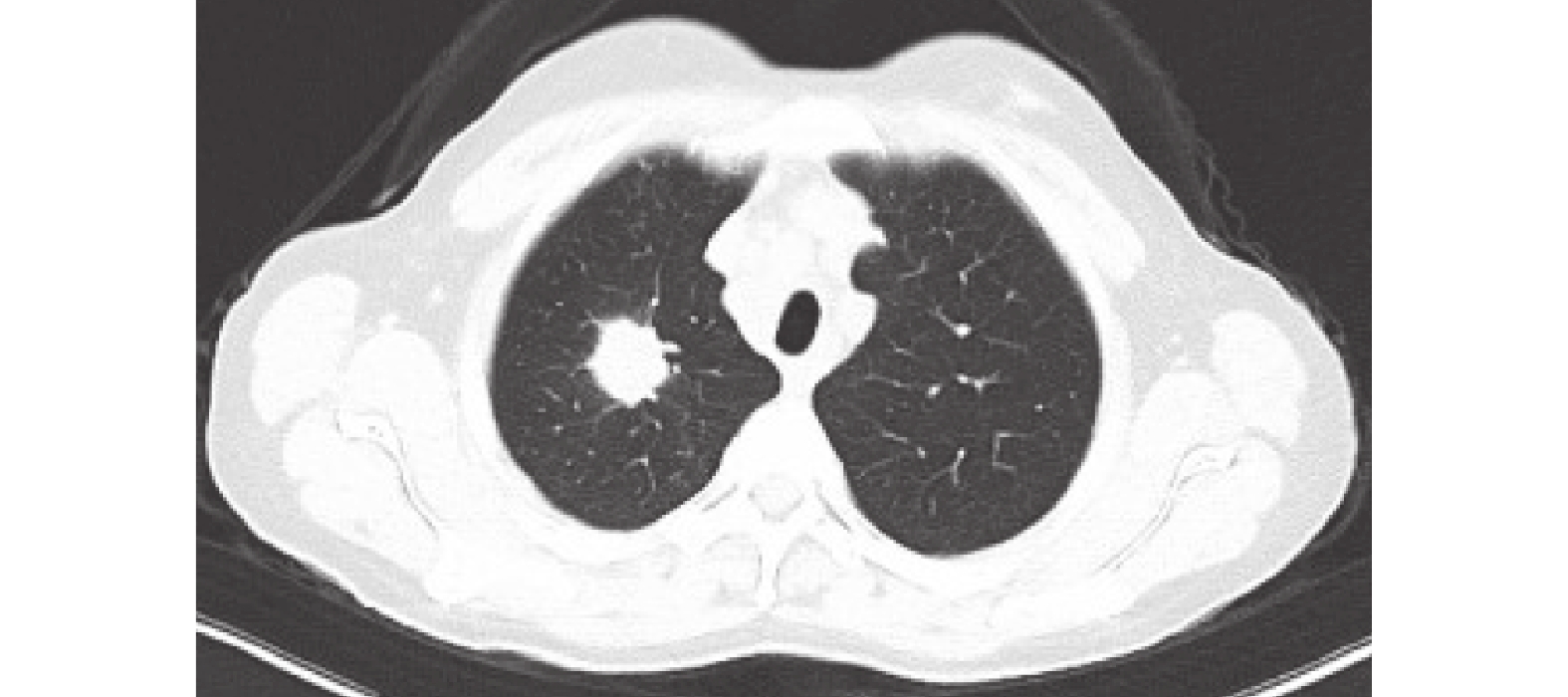 圖1
胸部CT:肺上葉尖段軟組織密度結節影,多系周圍型肺癌,伴右肺及縱隔淋巴結轉移。
圖1
胸部CT:肺上葉尖段軟組織密度結節影,多系周圍型肺癌,伴右肺及縱隔淋巴結轉移。
入院診斷:1.右上肺腺癌伴雙側頸根部、肺門、縱隔、肝胃韌帶淋巴結轉移,雙肺、骨、左側腎上腺轉移(T4N3M1c IVB期)。
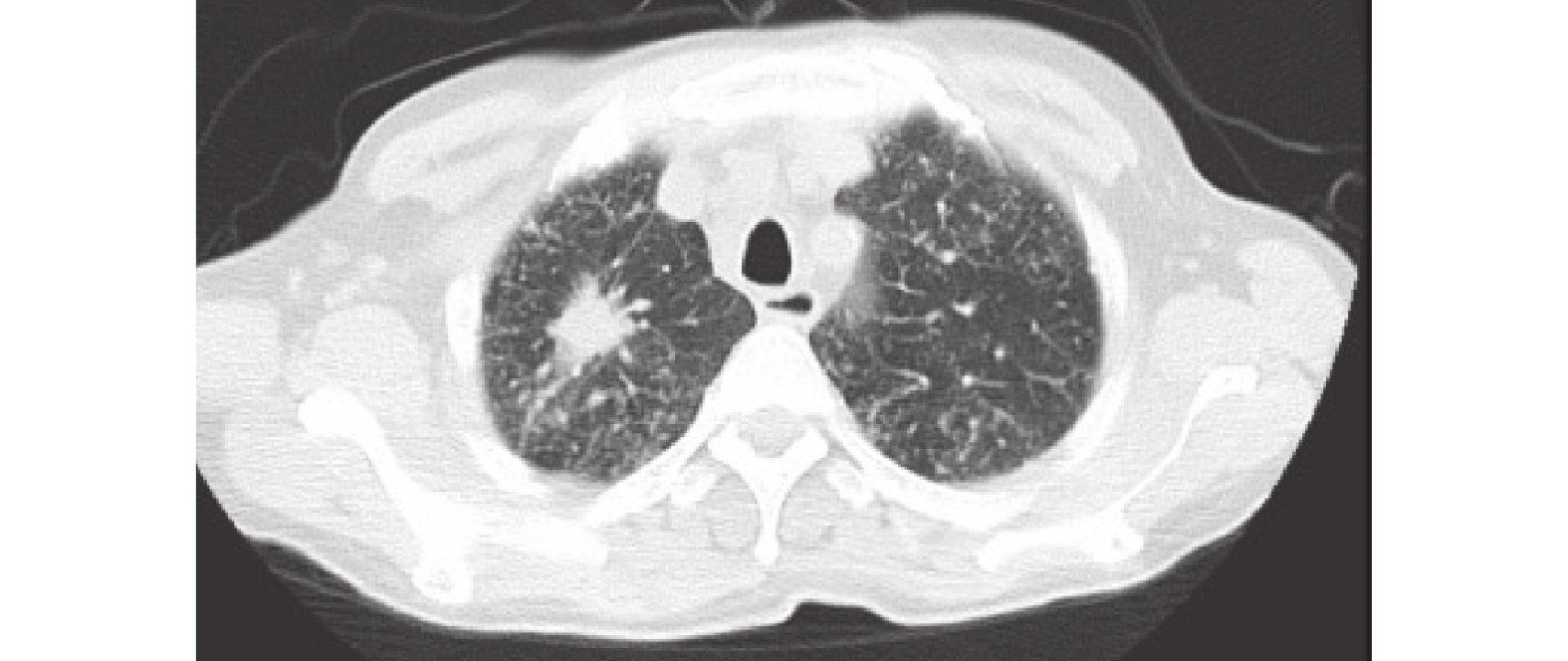
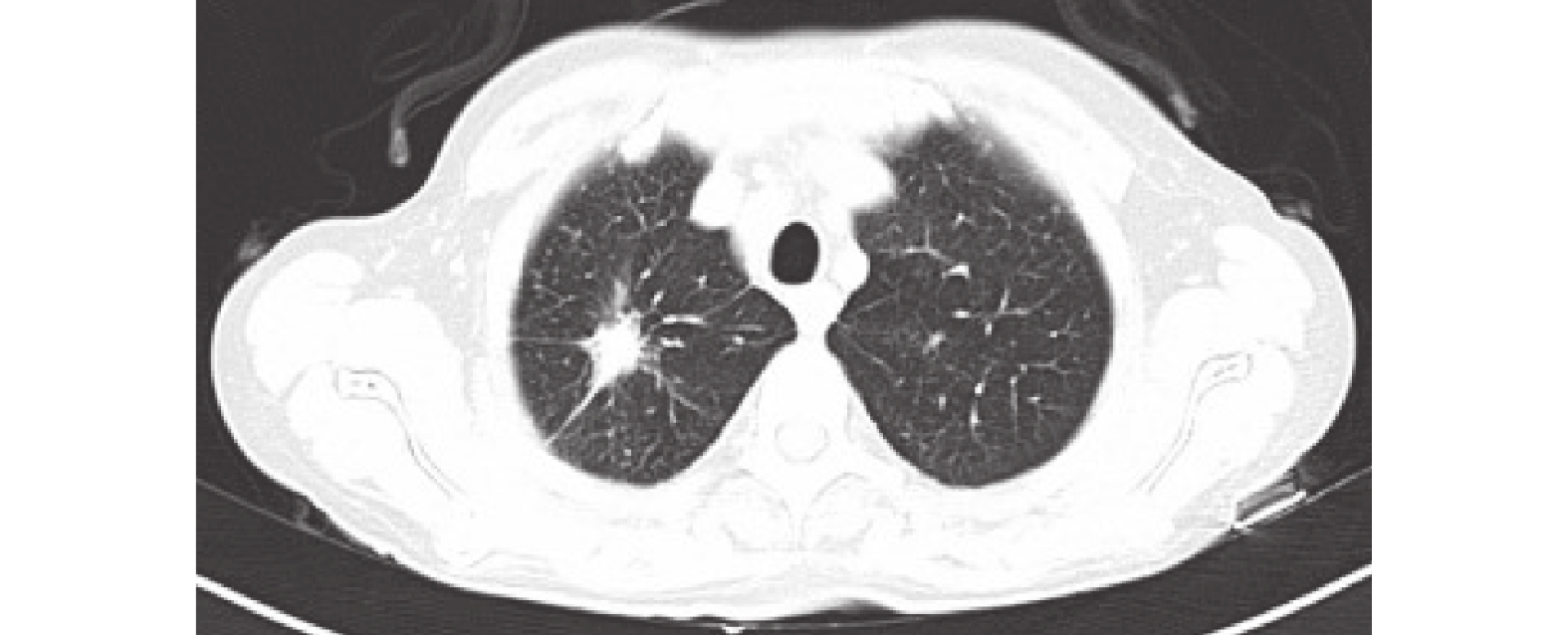
患者于2023-05-25開始口服奧希替尼靶向藥物,期間患者出現肩部小面積皮疹,AE I級,服藥一周后緩解。后于2023-06-19復查胸部CT示:右肺上葉尖段見大小約2.9×1.6cm的軟組織密度結節影,呈分葉狀,見毛刺征,增強后不均勻強化,鄰近胸膜增厚、粘連,雙肺見彌漫分布結節及腫塊影,雙側頸根部、縱隔及肺門淋巴結增多、增大,病灶包繞肺門血管及支氣管,右肺上葉尖段支氣管截斷,上述考慮肺癌伴雙肺多發轉移,縱隔及肺門淋巴結轉移(圖2)。綜合療效評估:疾病進展(progressive disease,PD)。于2023-06-29停止口服奧希替尼。因PD-L1高表達,于2023-07-13、2023-08-12行第1、2周期AP方案(培美曲塞,500 mg/m2+順鉑,75 mg/m2)化療聯合信迪利單抗(200 mg)免疫治療。兩周期后,復查胸部CT示: 1.右肺上葉尖段肺癌,伴雙肺多發轉移,縱隔及肺門淋巴結轉移,多發骨轉移,對比2023-06-19CT病灶縮小;2. 雙肺散在炎癥,較前明顯減少(圖3)。療效評估為部分緩解(partial response,PR)
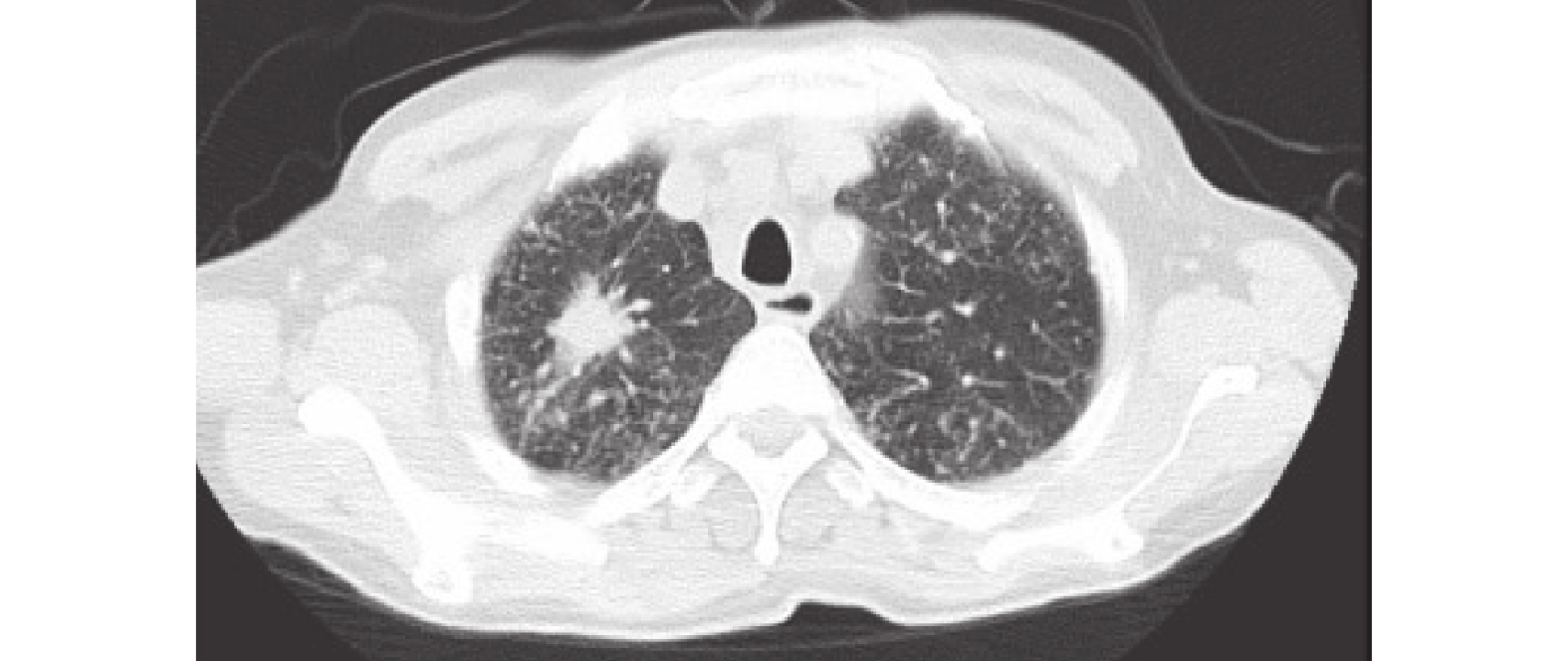 圖2
胸部CT:右肺上葉尖段見大小約2.9×1.6cm的軟組織密度結節影,呈分葉狀,見毛刺征,增強后不均勻強化,鄰近胸膜增厚、粘連,雙肺見彌漫分布結節及腫塊影,雙側頸根部、縱隔及肺門淋巴結增多、增大,病灶包繞肺門血管及支氣管,右肺上葉尖段支氣管截斷,上述考慮肺癌伴雙肺多發轉移,縱隔及肺門淋巴結轉移。
圖2
胸部CT:右肺上葉尖段見大小約2.9×1.6cm的軟組織密度結節影,呈分葉狀,見毛刺征,增強后不均勻強化,鄰近胸膜增厚、粘連,雙肺見彌漫分布結節及腫塊影,雙側頸根部、縱隔及肺門淋巴結增多、增大,病灶包繞肺門血管及支氣管,右肺上葉尖段支氣管截斷,上述考慮肺癌伴雙肺多發轉移,縱隔及肺門淋巴結轉移。
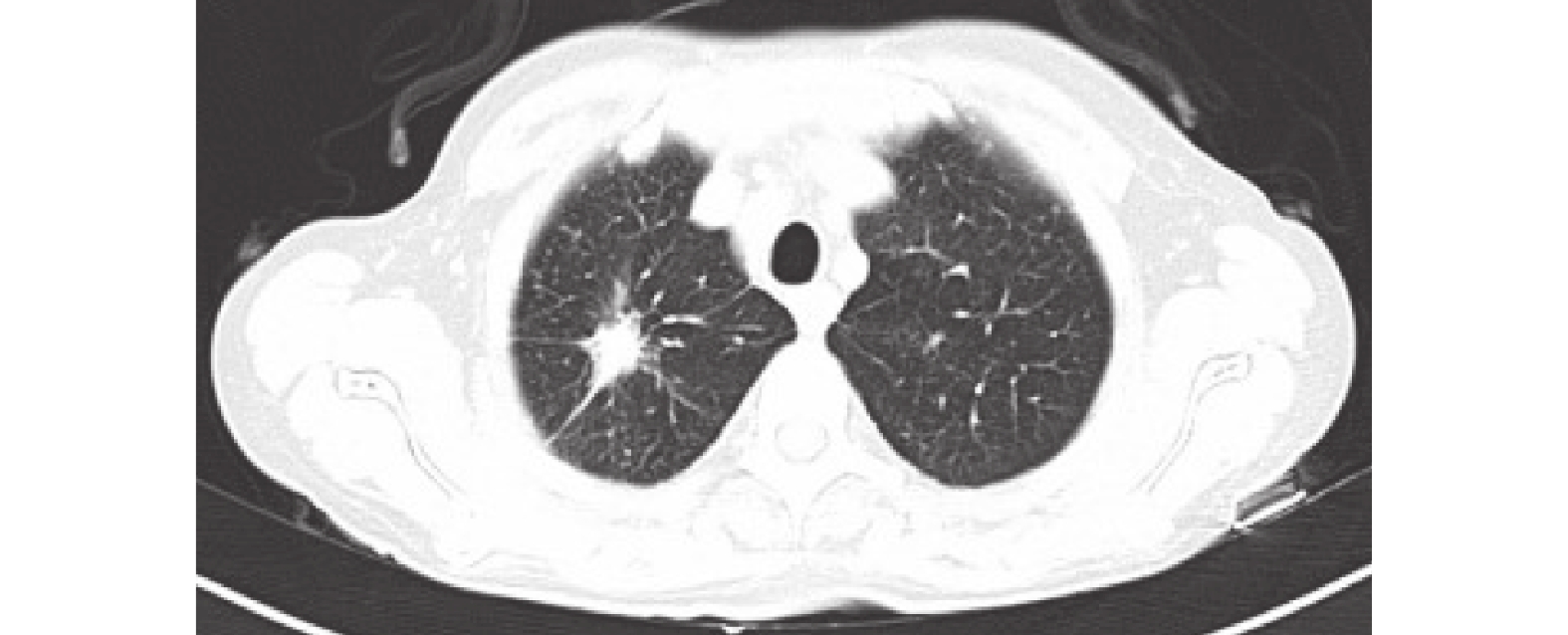 圖3
胸部CT: 1.右肺上葉尖段肺癌,伴雙肺多發轉移,縱隔及肺門淋巴結轉移,多發骨轉移,對比2023-06-19 CT舊片,病灶縮小;2. 雙肺散在炎癥,較前片明顯減少。
圖3
胸部CT: 1.右肺上葉尖段肺癌,伴雙肺多發轉移,縱隔及肺門淋巴結轉移,多發骨轉移,對比2023-06-19 CT舊片,病灶縮小;2. 雙肺散在炎癥,較前片明顯減少。
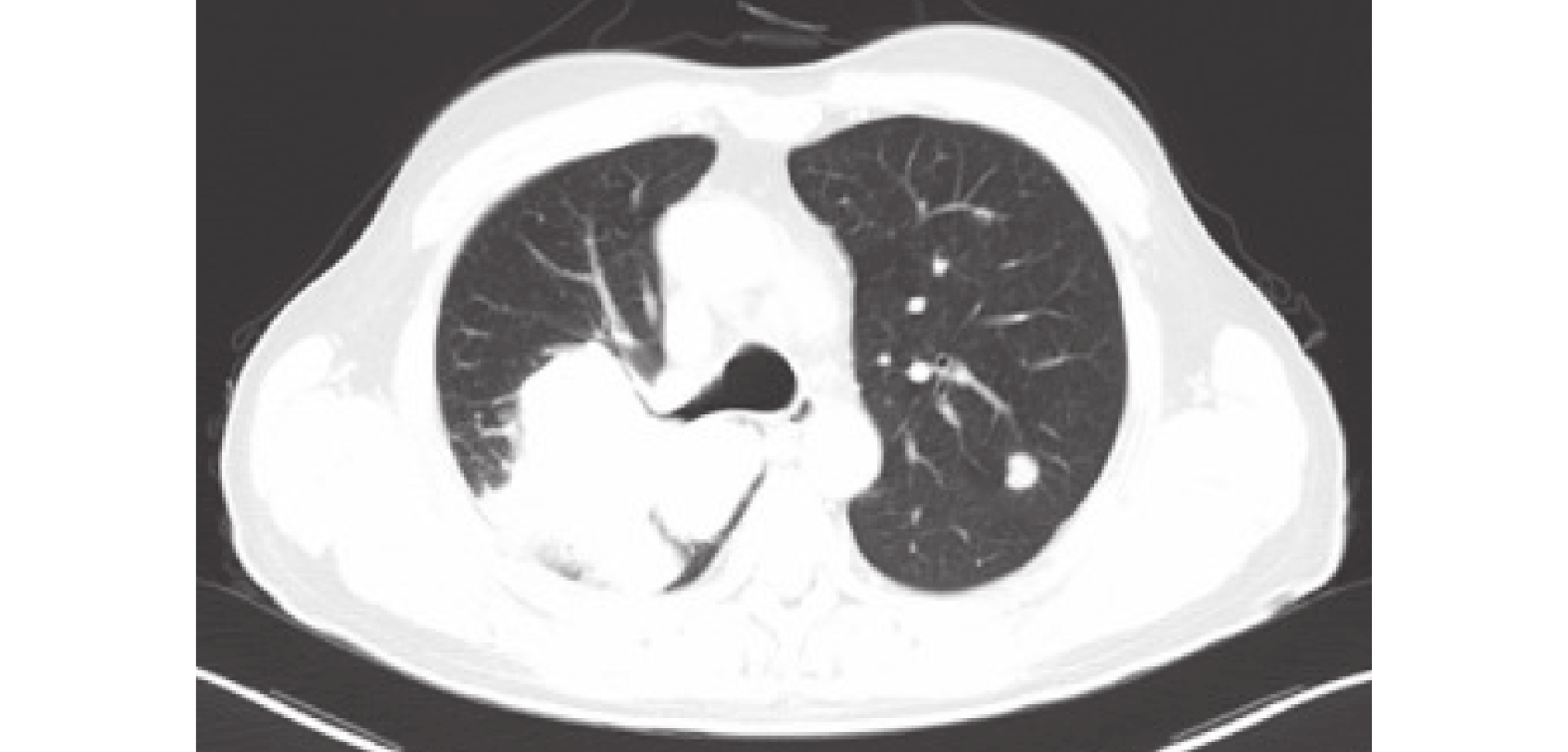
患者2,男性,57歲。因“確診右肺腺癌11+月”于2023-07-24入我院。11+月前(2022年8月)患者因反復咳嗽于外院就診,行胸部CT示:右肺上葉和下葉背段區占位(圖4)。頭部CT示:未見確切腫瘤轉移征象(圖5)。2022-09-14于我院天府院區行經肺穿刺活檢術,病理診斷:非小細胞癌,免疫組化示:CK7(+)、TTF-1(+)、CEA(+)、NapsinA(+),PD-L1(22C3)(TPS:50%)。同時行Next Generation Sequence檢測示:EGFR L858R+。
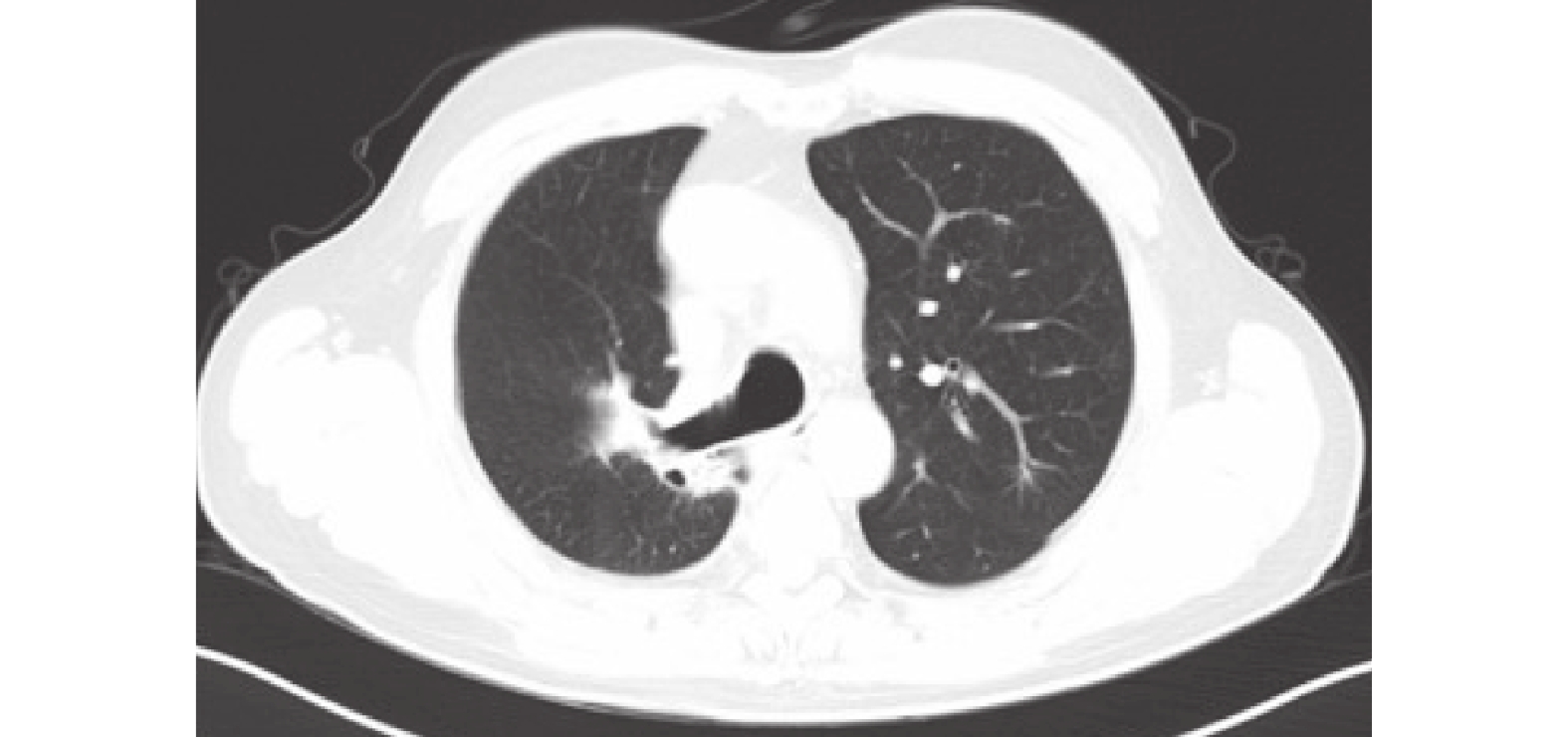
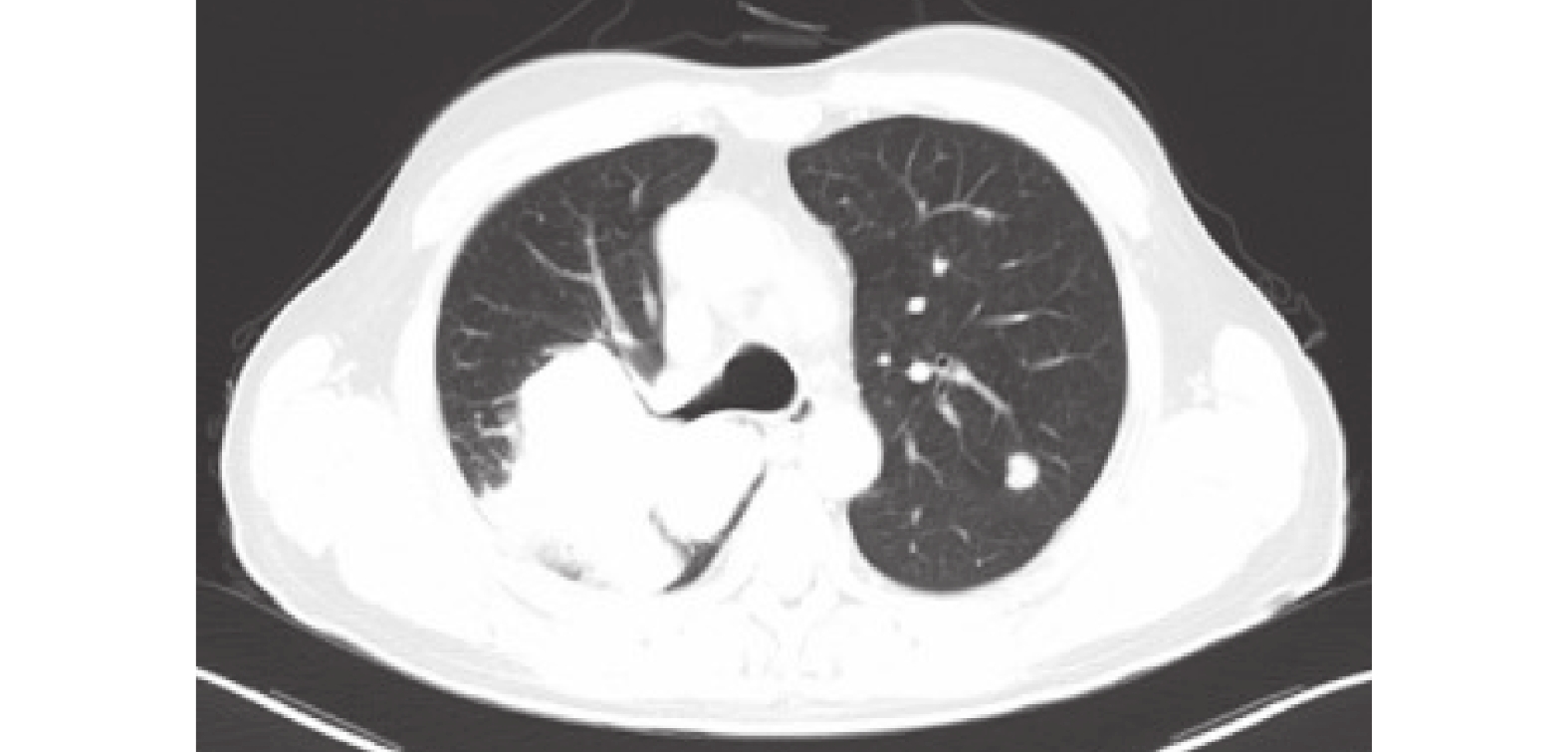 圖4
胸部CT:右肺上葉和下葉背段區占位
圖4
胸部CT:右肺上葉和下葉背段區占位
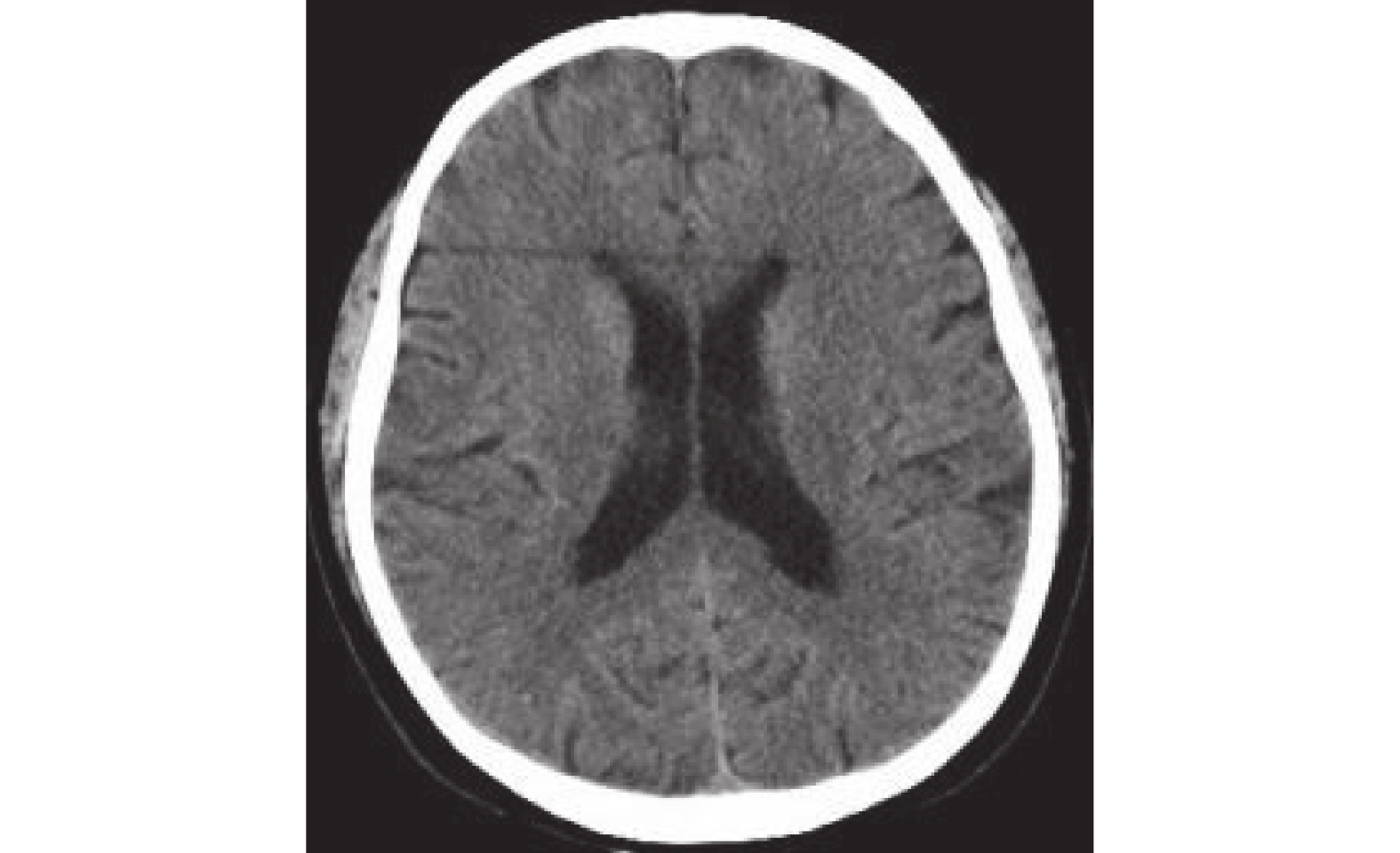
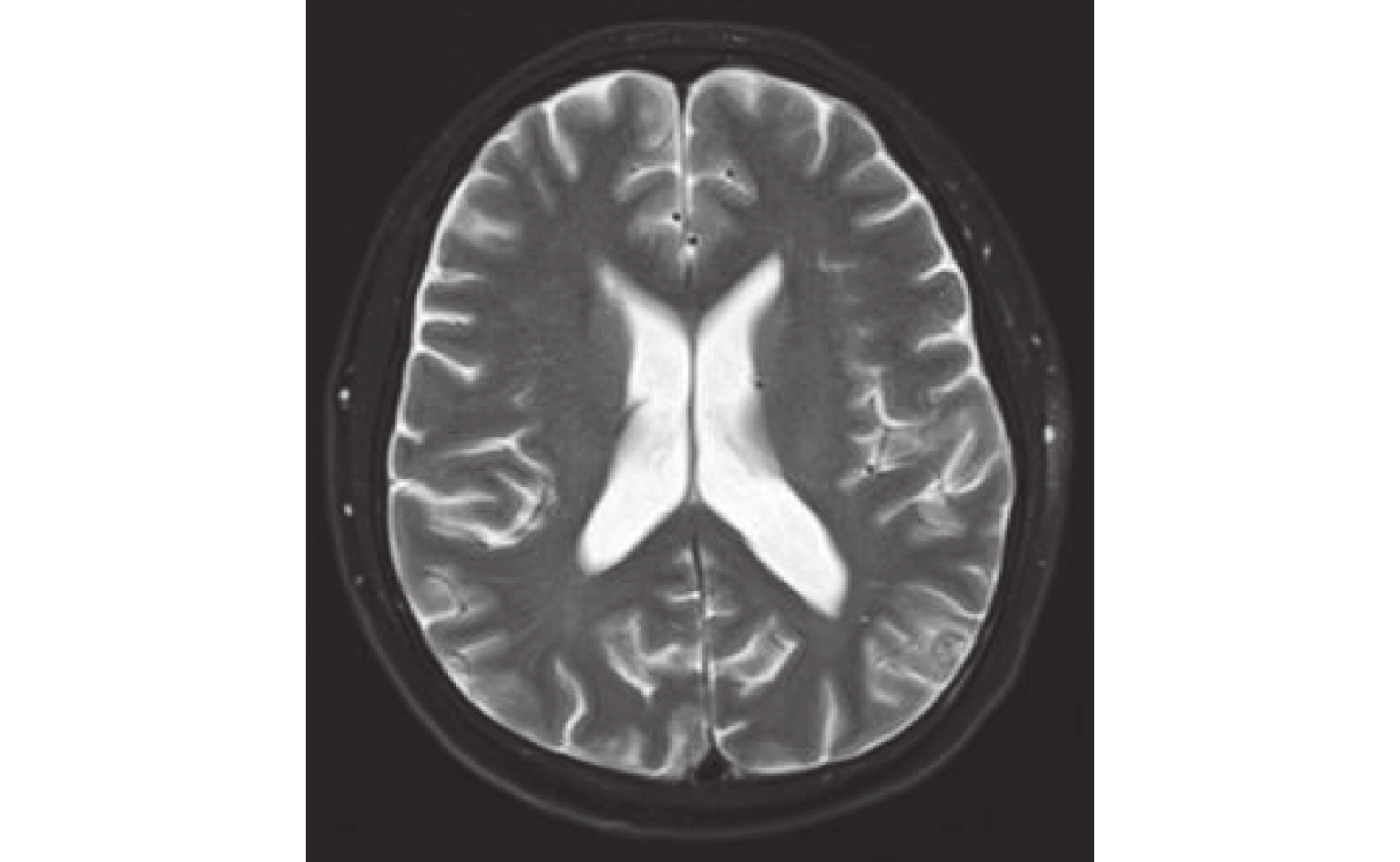
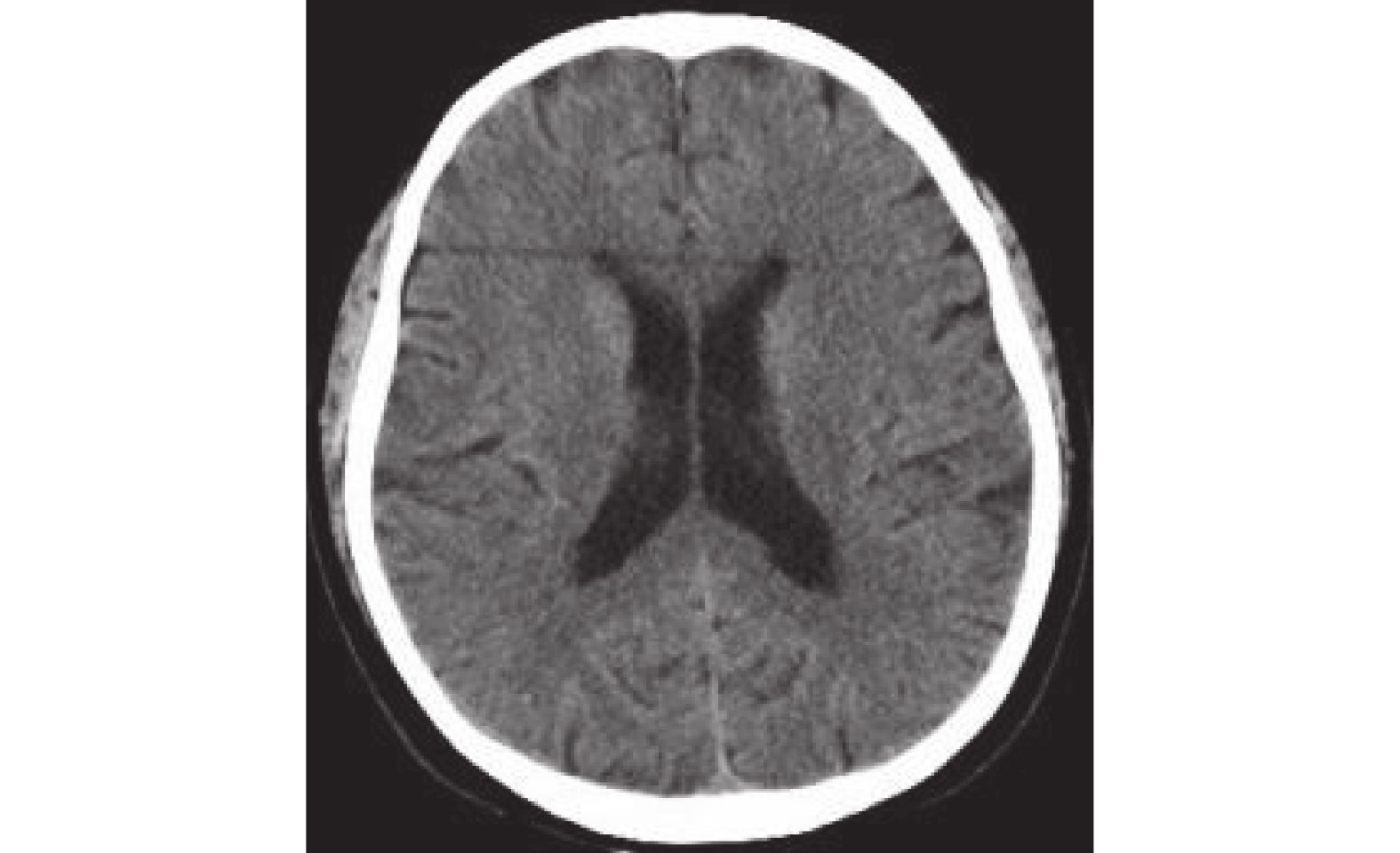 圖5
頭部CT:未見確切腫瘤轉移征象
圖5
頭部CT:未見確切腫瘤轉移征象
入院診斷:1.右肺腺癌伴雙肺內、肺門、斜裂、胸膜縱隔淋巴結及骨轉移(cT4N2M1a IVA期)。
因全身腫瘤負荷大,患者于2022-10-20、2022-11-15行第1、2周期AC方案(培美曲塞,500mg/m2+卡鉑,AUC=5)化療聯合阿美替尼(110mg)靶向治療。1周期后療效評估:病情穩定(stable disease,SD)。2周期后復查胸部CT較前未見明顯變化(圖6),頭部MRI示:左側頂枕葉結節,考慮轉移(圖7)。療效評估:PD。遂于2022-12-10、2023-01-07改行白蛋白紫杉醇(260 mg/m2)+卡鉑(AUC=5)化療聯合信迪利單抗(200 mg)+貝伐珠單抗(2.5 mg/kg)免疫治療。后復查胸部CT示:右肺上、下葉肺癌伴阻塞性肺炎,累及右側斜裂及胸膜,并右肺門及縱隔淋巴結轉移可能,與2022-12-08 CT比較,右肺腫塊稍縮小(圖8)。頭部MRI示:左側顳頂葉交界區結節,與2022-12-09MRI圖像相比,結節壞死縮小(圖9)。2周期后療效評估為PR。后繼續規律白蛋白紫杉醇+卡鉑化療聯合信迪利單抗+貝伐珠單抗免疫治療,2周期后予信迪利單抗(200 mg)+貝伐珠單抗(500 mg)抗免疫靶向治療。
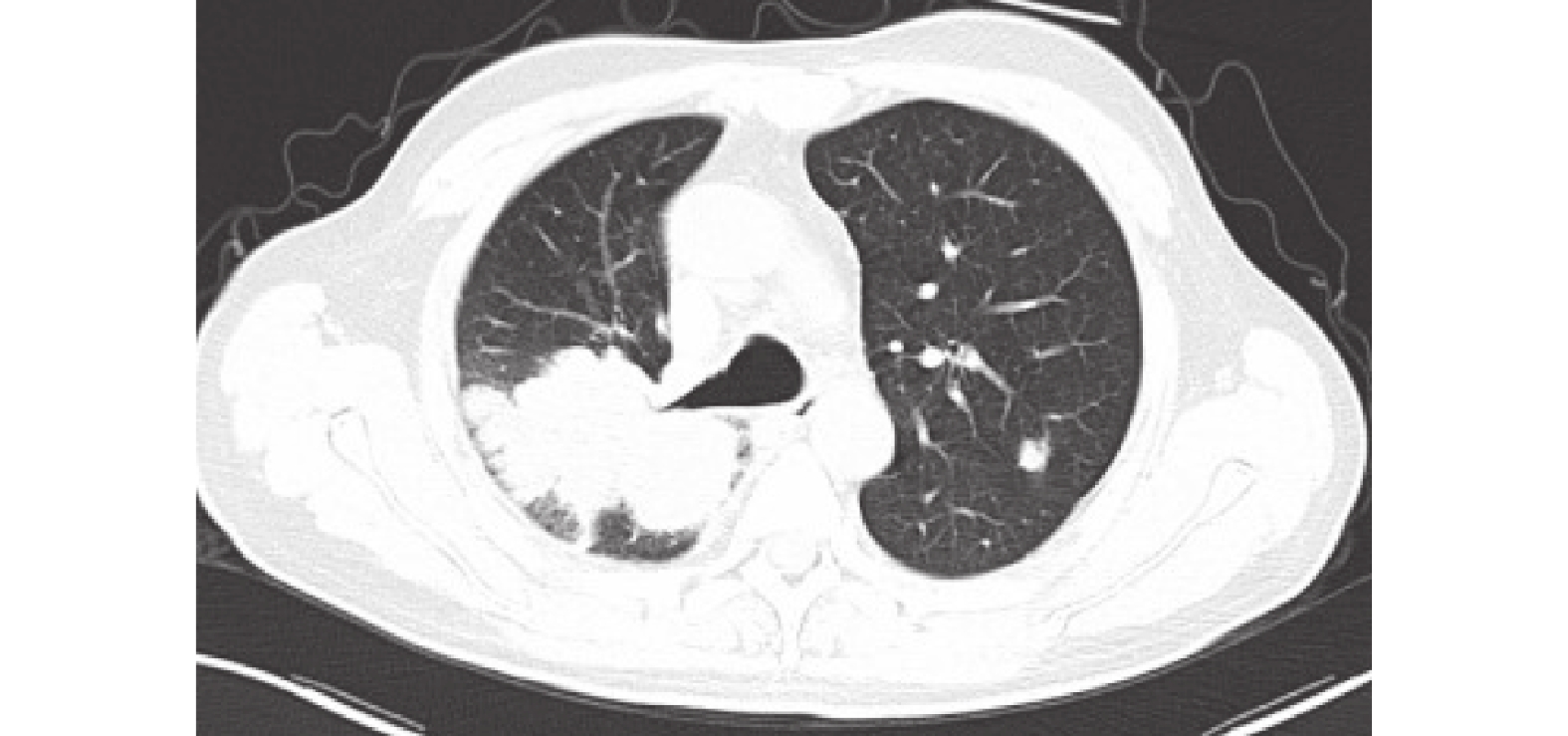 圖6
胸部CT:右肺癌伴阻塞性肺炎,累計右側斜裂及胸膜,并肺門及縱膈淋巴結增多,部分增大
圖6
胸部CT:右肺癌伴阻塞性肺炎,累計右側斜裂及胸膜,并肺門及縱膈淋巴結增多,部分增大
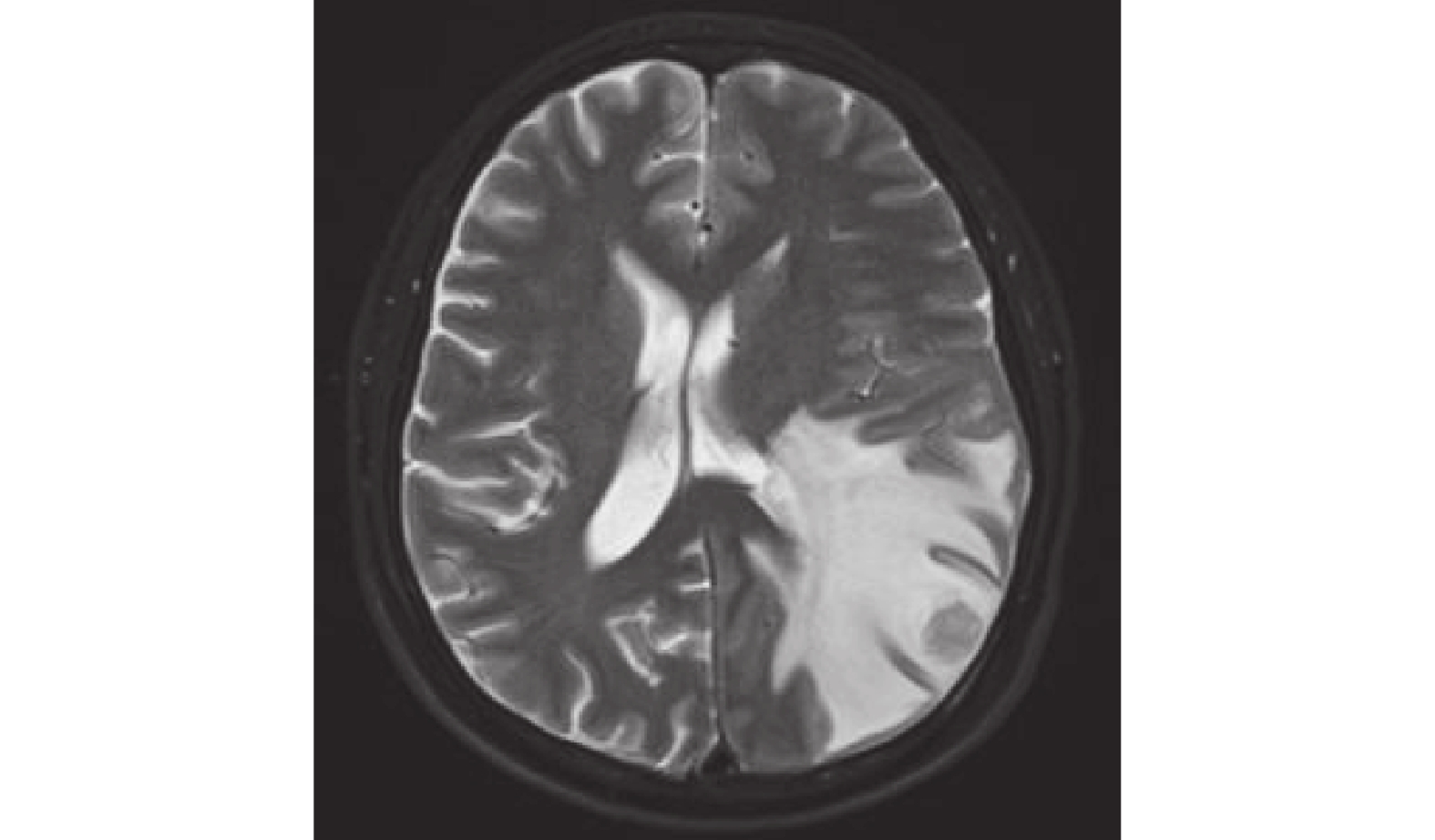 圖7
左側頂枕葉結節,考慮轉移。
圖7
左側頂枕葉結節,考慮轉移。
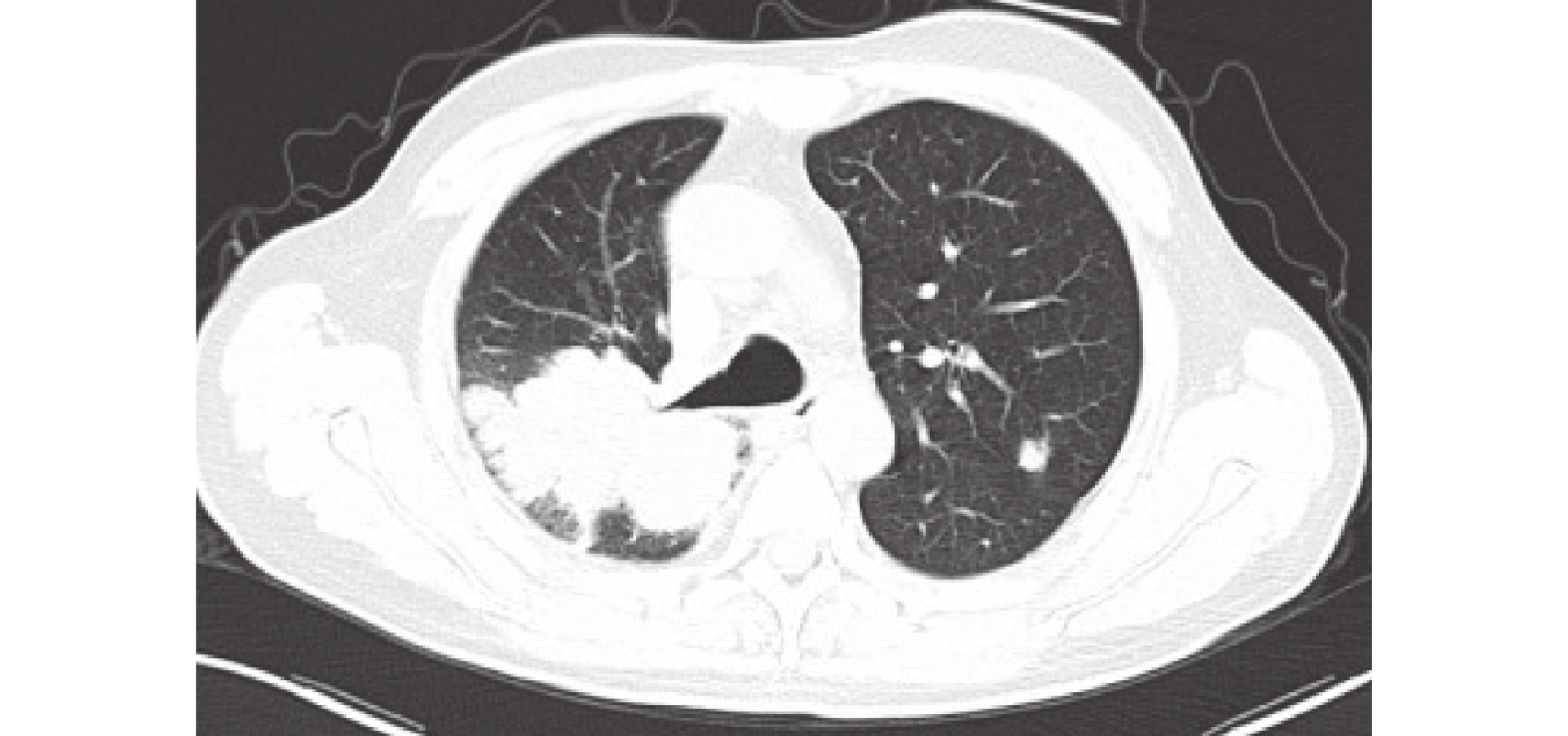
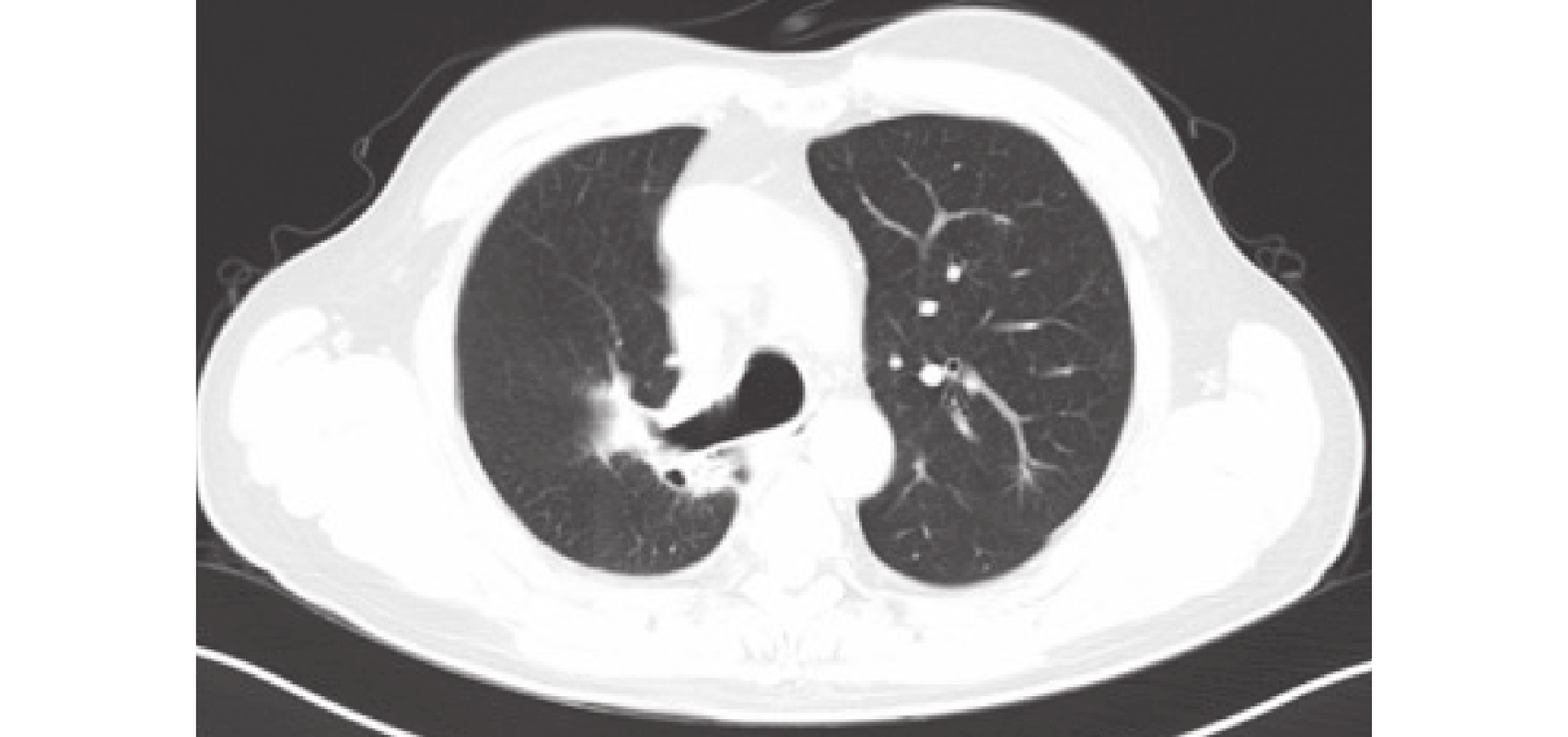 圖8
胸部CT:右肺上、下葉肺癌伴阻塞性肺炎,累及右側斜裂及胸膜,并右肺門及縱隔淋巴結轉移可能,與2022-12-08CT比較,右肺腫塊稍縮小。
圖8
胸部CT:右肺上、下葉肺癌伴阻塞性肺炎,累及右側斜裂及胸膜,并右肺門及縱隔淋巴結轉移可能,與2022-12-08CT比較,右肺腫塊稍縮小。
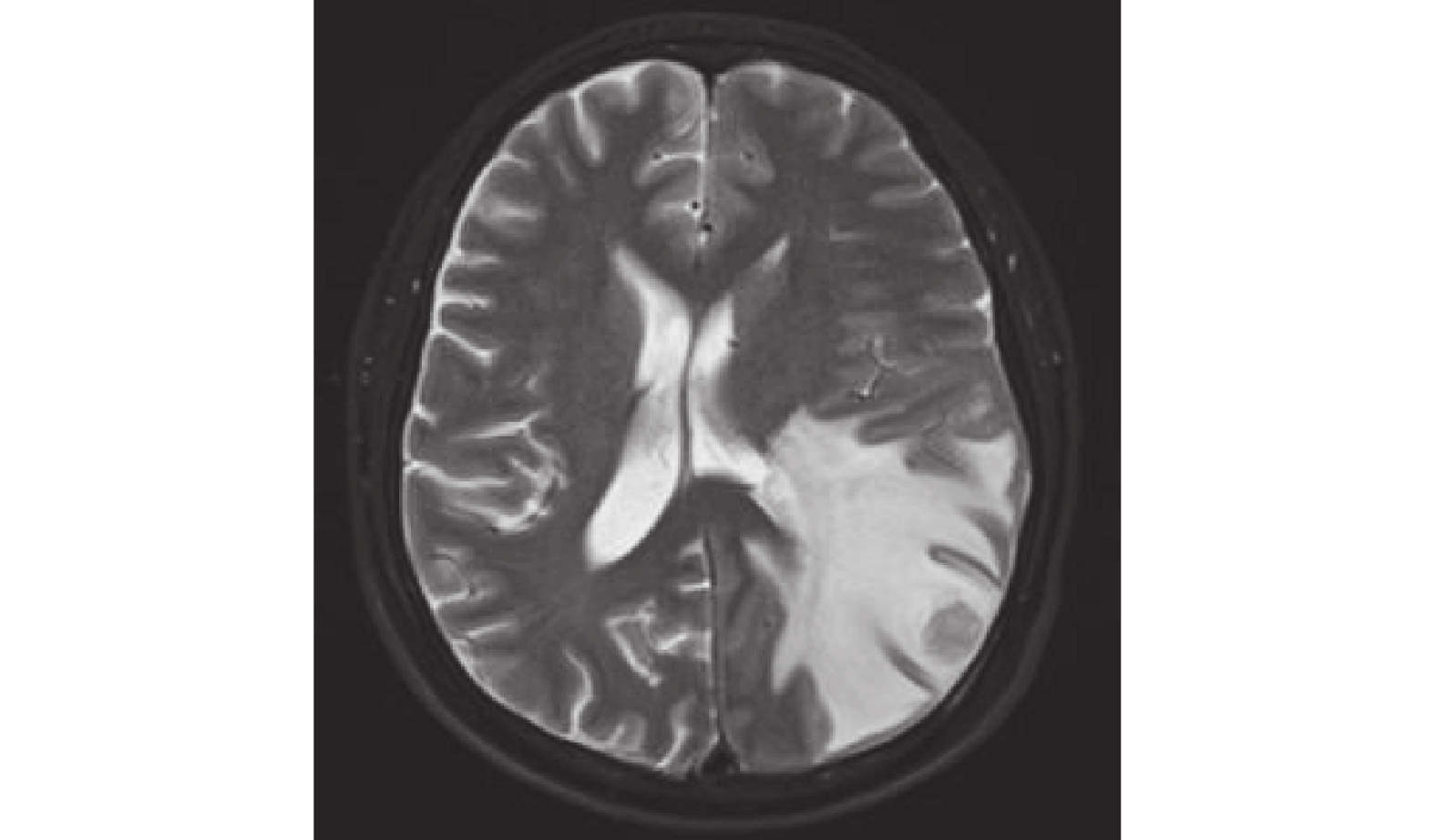
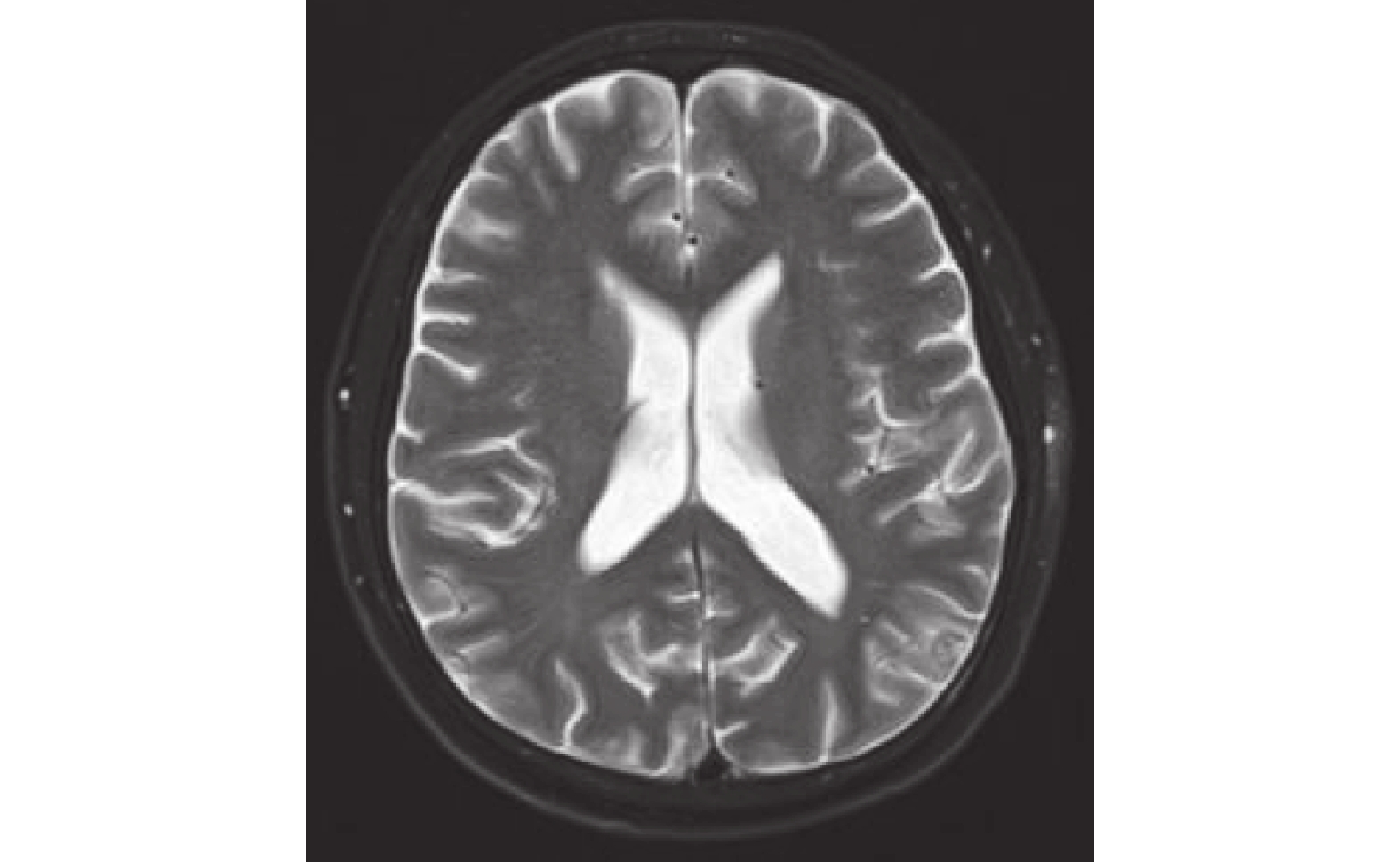 圖9
頭部MRI示:左側顳頂葉交界區結節,與2022-12-09MRI圖像相比,結節壞死縮小。
圖9
頭部MRI示:左側顳頂葉交界區結節,與2022-12-09MRI圖像相比,結節壞死縮小。
討論 現有充分的臨床證據證明,使用吉非替尼(IPASS研究)、奧希替尼(FLAURA研究)等EGFR-TKIs一線治療合并EGFR突變晚期NSCLC,患者能獲得更長的無進展生存期(progression free survival,PFS),生活質量也顯著提高[1-2]。隨著肺癌精準診療的快速發展,EGFR-TKI也已經成為EGFR突變晚期NSCLC患者的標準治療方式。
EGFR-TKI耐藥分為原發性耐藥和獲得性耐藥。目前,將原發性耐藥定義為,患者在接受EGFR-TKI治療3個月內不僅沒有證據顯示客觀緩解,還存在疾病的進展。將獲得性耐藥定義為,經初始治療后患者獲得緩解或持續臨床獲益≥6個月,而在后續繼續治療過程中出現的疾病進展[3]。
PD-L1是程序性細胞死亡蛋白1的配體,廣泛表達于健康組織細胞中。PD-1/PD-L1軸通過抑制T淋巴細胞增殖、細胞因子產生和細胞溶解活性等,來誘發腫瘤發展過程中的免疫抵抗。近年來,針對PD-1/PD-L1軸的免疫療法已在世界范圍內進行了臨床試驗,用于治療包括NSCLC在內的各種實體和血液惡性腫瘤,并對表達高PD-L1水平(TPS≥50%)的NSCLC表現出了優異的治療效果。與此同時,針對PD-L1低表達的EGFR突變晚期NSCLC患者目前仍然是采取EGFR-TKI的標準治療方式。
在既往研究中,不少學者探索分析了PD-L1的表達和EGFR-TKI耐藥之間的關系。有研究發現,NOX4升高通過增強IL-8/PD-L1信號傳導促進腫瘤發生和獲得EGFR-TKI耐藥性。最終明確了EGFR-TKI可以通過激活NOX4/YY1/IL-8/PD-L1信號通路,從而誘發TKI耐藥,為EGFR-TKI耐藥性和免疫逃逸提供了新的見解[4]。Peng等[5]研究發現,三種已知的EGFR-TKI耐藥機制(c-MET擴增、肝細胞生長因子(HGF)和EGFR-T790M)均通過上調NSCLC中PD-L1的表達,來促進腫瘤細胞的免疫逃逸。
Su等[6]回顧性地評估了101例符合條件的患者,與PD-L1低表達相比,PD-L1高表達顯著降低了ORR(35.7% vs. 67.3%,P=0.002),且縮短了PFS(3.8 vs. 9.5個月,P<0.001)。在Hsu等[7]的研究中,原發性耐藥組的TPS陽性率明顯高于疾病對照組(45.5% vs.12.3%,P=0.001)。且在原發性耐藥組中,有22.7%的患者PD-L1呈高表達(TPS≥50%),而在疾病對照組中只有1例患者出現這種情況。同時,使用EGFR-TKI治療的PD-L1高表達患者的PFS和總生存期((overall survival,OS)顯著短于PD-L1低表達患者(1.6月vs.4.9月;10.1 月vs.38.2月,P<
以上研究結果顯示,PD-L1與EGFR-TKI的敏感性相關,且PD-L1的高表達可能是導致EGFR-TKI原發耐藥的機制之一。而關于PD-L1的高表達與EGFR-TKI原發耐藥之間具體的機制還需要采用大樣本的調查以及標準化的方法進一步證實,以提高我們對EGFR-TKI原發耐藥的復雜信號通路的理解,并在指導下找到克服EGFR-TKI耐藥的最佳聯合治療方式,進而提高患者的生存質量。
在本院兩個病例中,患者免疫組化染色示PD-1 TPS≥50%,在分別經奧希替尼(一個月內)、阿美替尼(兩個月內)治療后,疾病出現進展。而在停止靶向藥物治療改為免疫治療聯合化療后,兩周期療效評估均為PR。
ORIENT-31 3期研究中發現,與單獨化療相比,信迪利單抗+IBI305的免疫治療聯合化療(培美曲塞+順鉑)可顯著改善患者的PFS(6.9 月vs. 4.3月,P<
在IMpower150 3期研究中顯示,在貝伐珠單抗聯合化療(卡鉑+紫杉醇)的基礎上,加用阿替利珠單抗可以顯著改善轉移性NSCLC初治患者的PFS(8.4 月vs. 6.8月,P<0.001)和OS(29.4月vs.18.1月,P=0.02)。首次證實了使用阿替利珠單抗+貝伐珠單抗的免疫治療聯合化療治療EGFR突變患者的可行性。并強調了該方案可以作為難以治療的預后不良患者的一種潛在新治療選擇,例如那些肝轉移或經TKIs治療失敗的致敏性EGFR突變患者[9]。
因此,針對本院這類EGFR突變合并PD-L1高表達的晚期肺腺癌患者,在經EGFR-TKI后疾病出現進展后,應盡早改用PD-1/PD-L1抑制劑的免疫治療聯合化療的治療方案,以此爭取更長的總生存期,提高患者的生存質量。
免疫治療聯合化療的治療模式,在目前也已經有部分研究顯示了其治療經EGFR-TKI后疾病出現進展的NSCLC患者的療效和生存益處,也希望在未來有能更多的大型Ⅲ期臨床試驗與分子生物學發現相結合,為患者選擇合適的治療方案帶來更多的啟示。
綜上,PD-L1的高表達可能是導致EGFR-TKI原發耐藥的機制之一,而針對這類EGFR突變合并PD-L1高表達的晚期肺腺癌患者,免疫治療(PD-1/PD-L1抑制劑)聯合化療是一種潛在的治療選擇,但是聯合治療方案的最佳模式、獲益人群的篩選以及用藥的安全性等還需要需進一步的探索,這也為以后的研究提出了更高的要求。
利益沖突:本研究不涉及任何利益沖突。
近年來,表皮生長因子受體酪氨酸激酶抑制劑(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)已經成為EGFR突變晚期非小細胞肺癌(non-small cell lung cancer,NSCLC)患者的標準治療方式。使用EGFR-TKI治療患者后的客觀緩解率(objective response rate,ORR)一般在60%~70%,但仍有30%~40%的患者出現原發耐藥的情況,從而導致患者的長期生存受限。明確EGFR-TKI的耐藥機制以及針對這類患者的治療措施,現已成為EGFR-TKI在臨床上進一步發揮作用,延長患者生存、提高患者生存質量的關鍵問題。本文就2例EGFR突變合并程序性細胞死亡蛋白1配體(programmed cell death protein 1 ligand,PD-L1)高表達的晚期肺腺癌患者EGFR-TKI原發耐藥報道如下。
病例資料 患者1,女性,58歲,因“咳嗽咳痰伴氣緊4+月,確診肺腺癌2+月”于2023-07-10入院。免疫組化染色示:PCK(+)、TTF-1(+)、CK7(+)、NapsinA(+)、Ki-67(+,20%~30%),PD-L1(22C3)(TPS:70%)。胸部CT示:肺上葉尖段軟組織密度結節影,多系周圍型肺癌,伴右肺及縱隔淋巴結轉移(圖1)。骨顯像示:腰5椎體右側及右側膝關節骨代謝性稍增高灶,考慮退變。全身其余骨顯像未見確切異常征象。頭部MRI示:未見確切腫瘤轉移征象。同時行Next Generation Sequence檢測示:EGFR 19DEL+。
 圖1
胸部CT:肺上葉尖段軟組織密度結節影,多系周圍型肺癌,伴右肺及縱隔淋巴結轉移。
圖1
胸部CT:肺上葉尖段軟組織密度結節影,多系周圍型肺癌,伴右肺及縱隔淋巴結轉移。
入院診斷:1.右上肺腺癌伴雙側頸根部、肺門、縱隔、肝胃韌帶淋巴結轉移,雙肺、骨、左側腎上腺轉移(T4N3M1c IVB期)。
患者于2023-05-25開始口服奧希替尼靶向藥物,期間患者出現肩部小面積皮疹,AE I級,服藥一周后緩解。后于2023-06-19復查胸部CT示:右肺上葉尖段見大小約2.9×1.6cm的軟組織密度結節影,呈分葉狀,見毛刺征,增強后不均勻強化,鄰近胸膜增厚、粘連,雙肺見彌漫分布結節及腫塊影,雙側頸根部、縱隔及肺門淋巴結增多、增大,病灶包繞肺門血管及支氣管,右肺上葉尖段支氣管截斷,上述考慮肺癌伴雙肺多發轉移,縱隔及肺門淋巴結轉移(圖2)。綜合療效評估:疾病進展(progressive disease,PD)。于2023-06-29停止口服奧希替尼。因PD-L1高表達,于2023-07-13、2023-08-12行第1、2周期AP方案(培美曲塞,500 mg/m2+順鉑,75 mg/m2)化療聯合信迪利單抗(200 mg)免疫治療。兩周期后,復查胸部CT示: 1.右肺上葉尖段肺癌,伴雙肺多發轉移,縱隔及肺門淋巴結轉移,多發骨轉移,對比2023-06-19CT病灶縮小;2. 雙肺散在炎癥,較前明顯減少(圖3)。療效評估為部分緩解(partial response,PR)
 圖2
胸部CT:右肺上葉尖段見大小約2.9×1.6cm的軟組織密度結節影,呈分葉狀,見毛刺征,增強后不均勻強化,鄰近胸膜增厚、粘連,雙肺見彌漫分布結節及腫塊影,雙側頸根部、縱隔及肺門淋巴結增多、增大,病灶包繞肺門血管及支氣管,右肺上葉尖段支氣管截斷,上述考慮肺癌伴雙肺多發轉移,縱隔及肺門淋巴結轉移。
圖2
胸部CT:右肺上葉尖段見大小約2.9×1.6cm的軟組織密度結節影,呈分葉狀,見毛刺征,增強后不均勻強化,鄰近胸膜增厚、粘連,雙肺見彌漫分布結節及腫塊影,雙側頸根部、縱隔及肺門淋巴結增多、增大,病灶包繞肺門血管及支氣管,右肺上葉尖段支氣管截斷,上述考慮肺癌伴雙肺多發轉移,縱隔及肺門淋巴結轉移。
 圖3
胸部CT: 1.右肺上葉尖段肺癌,伴雙肺多發轉移,縱隔及肺門淋巴結轉移,多發骨轉移,對比2023-06-19 CT舊片,病灶縮小;2. 雙肺散在炎癥,較前片明顯減少。
圖3
胸部CT: 1.右肺上葉尖段肺癌,伴雙肺多發轉移,縱隔及肺門淋巴結轉移,多發骨轉移,對比2023-06-19 CT舊片,病灶縮小;2. 雙肺散在炎癥,較前片明顯減少。
患者2,男性,57歲。因“確診右肺腺癌11+月”于2023-07-24入我院。11+月前(2022年8月)患者因反復咳嗽于外院就診,行胸部CT示:右肺上葉和下葉背段區占位(圖4)。頭部CT示:未見確切腫瘤轉移征象(圖5)。2022-09-14于我院天府院區行經肺穿刺活檢術,病理診斷:非小細胞癌,免疫組化示:CK7(+)、TTF-1(+)、CEA(+)、NapsinA(+),PD-L1(22C3)(TPS:50%)。同時行Next Generation Sequence檢測示:EGFR L858R+。
 圖4
胸部CT:右肺上葉和下葉背段區占位
圖4
胸部CT:右肺上葉和下葉背段區占位
 圖5
頭部CT:未見確切腫瘤轉移征象
圖5
頭部CT:未見確切腫瘤轉移征象
入院診斷:1.右肺腺癌伴雙肺內、肺門、斜裂、胸膜縱隔淋巴結及骨轉移(cT4N2M1a IVA期)。
因全身腫瘤負荷大,患者于2022-10-20、2022-11-15行第1、2周期AC方案(培美曲塞,500mg/m2+卡鉑,AUC=5)化療聯合阿美替尼(110mg)靶向治療。1周期后療效評估:病情穩定(stable disease,SD)。2周期后復查胸部CT較前未見明顯變化(圖6),頭部MRI示:左側頂枕葉結節,考慮轉移(圖7)。療效評估:PD。遂于2022-12-10、2023-01-07改行白蛋白紫杉醇(260 mg/m2)+卡鉑(AUC=5)化療聯合信迪利單抗(200 mg)+貝伐珠單抗(2.5 mg/kg)免疫治療。后復查胸部CT示:右肺上、下葉肺癌伴阻塞性肺炎,累及右側斜裂及胸膜,并右肺門及縱隔淋巴結轉移可能,與2022-12-08 CT比較,右肺腫塊稍縮小(圖8)。頭部MRI示:左側顳頂葉交界區結節,與2022-12-09MRI圖像相比,結節壞死縮小(圖9)。2周期后療效評估為PR。后繼續規律白蛋白紫杉醇+卡鉑化療聯合信迪利單抗+貝伐珠單抗免疫治療,2周期后予信迪利單抗(200 mg)+貝伐珠單抗(500 mg)抗免疫靶向治療。
 圖6
胸部CT:右肺癌伴阻塞性肺炎,累計右側斜裂及胸膜,并肺門及縱膈淋巴結增多,部分增大
圖6
胸部CT:右肺癌伴阻塞性肺炎,累計右側斜裂及胸膜,并肺門及縱膈淋巴結增多,部分增大
 圖7
左側頂枕葉結節,考慮轉移。
圖7
左側頂枕葉結節,考慮轉移。
 圖8
胸部CT:右肺上、下葉肺癌伴阻塞性肺炎,累及右側斜裂及胸膜,并右肺門及縱隔淋巴結轉移可能,與2022-12-08CT比較,右肺腫塊稍縮小。
圖8
胸部CT:右肺上、下葉肺癌伴阻塞性肺炎,累及右側斜裂及胸膜,并右肺門及縱隔淋巴結轉移可能,與2022-12-08CT比較,右肺腫塊稍縮小。
 圖9
頭部MRI示:左側顳頂葉交界區結節,與2022-12-09MRI圖像相比,結節壞死縮小。
圖9
頭部MRI示:左側顳頂葉交界區結節,與2022-12-09MRI圖像相比,結節壞死縮小。
討論 現有充分的臨床證據證明,使用吉非替尼(IPASS研究)、奧希替尼(FLAURA研究)等EGFR-TKIs一線治療合并EGFR突變晚期NSCLC,患者能獲得更長的無進展生存期(progression free survival,PFS),生活質量也顯著提高[1-2]。隨著肺癌精準診療的快速發展,EGFR-TKI也已經成為EGFR突變晚期NSCLC患者的標準治療方式。
EGFR-TKI耐藥分為原發性耐藥和獲得性耐藥。目前,將原發性耐藥定義為,患者在接受EGFR-TKI治療3個月內不僅沒有證據顯示客觀緩解,還存在疾病的進展。將獲得性耐藥定義為,經初始治療后患者獲得緩解或持續臨床獲益≥6個月,而在后續繼續治療過程中出現的疾病進展[3]。
PD-L1是程序性細胞死亡蛋白1的配體,廣泛表達于健康組織細胞中。PD-1/PD-L1軸通過抑制T淋巴細胞增殖、細胞因子產生和細胞溶解活性等,來誘發腫瘤發展過程中的免疫抵抗。近年來,針對PD-1/PD-L1軸的免疫療法已在世界范圍內進行了臨床試驗,用于治療包括NSCLC在內的各種實體和血液惡性腫瘤,并對表達高PD-L1水平(TPS≥50%)的NSCLC表現出了優異的治療效果。與此同時,針對PD-L1低表達的EGFR突變晚期NSCLC患者目前仍然是采取EGFR-TKI的標準治療方式。
在既往研究中,不少學者探索分析了PD-L1的表達和EGFR-TKI耐藥之間的關系。有研究發現,NOX4升高通過增強IL-8/PD-L1信號傳導促進腫瘤發生和獲得EGFR-TKI耐藥性。最終明確了EGFR-TKI可以通過激活NOX4/YY1/IL-8/PD-L1信號通路,從而誘發TKI耐藥,為EGFR-TKI耐藥性和免疫逃逸提供了新的見解[4]。Peng等[5]研究發現,三種已知的EGFR-TKI耐藥機制(c-MET擴增、肝細胞生長因子(HGF)和EGFR-T790M)均通過上調NSCLC中PD-L1的表達,來促進腫瘤細胞的免疫逃逸。
Su等[6]回顧性地評估了101例符合條件的患者,與PD-L1低表達相比,PD-L1高表達顯著降低了ORR(35.7% vs. 67.3%,P=0.002),且縮短了PFS(3.8 vs. 9.5個月,P<0.001)。在Hsu等[7]的研究中,原發性耐藥組的TPS陽性率明顯高于疾病對照組(45.5% vs.12.3%,P=0.001)。且在原發性耐藥組中,有22.7%的患者PD-L1呈高表達(TPS≥50%),而在疾病對照組中只有1例患者出現這種情況。同時,使用EGFR-TKI治療的PD-L1高表達患者的PFS和總生存期((overall survival,OS)顯著短于PD-L1低表達患者(1.6月vs.4.9月;10.1 月vs.38.2月,P<
以上研究結果顯示,PD-L1與EGFR-TKI的敏感性相關,且PD-L1的高表達可能是導致EGFR-TKI原發耐藥的機制之一。而關于PD-L1的高表達與EGFR-TKI原發耐藥之間具體的機制還需要采用大樣本的調查以及標準化的方法進一步證實,以提高我們對EGFR-TKI原發耐藥的復雜信號通路的理解,并在指導下找到克服EGFR-TKI耐藥的最佳聯合治療方式,進而提高患者的生存質量。
在本院兩個病例中,患者免疫組化染色示PD-1 TPS≥50%,在分別經奧希替尼(一個月內)、阿美替尼(兩個月內)治療后,疾病出現進展。而在停止靶向藥物治療改為免疫治療聯合化療后,兩周期療效評估均為PR。
ORIENT-31 3期研究中發現,與單獨化療相比,信迪利單抗+IBI305的免疫治療聯合化療(培美曲塞+順鉑)可顯著改善患者的PFS(6.9 月vs. 4.3月,P<
在IMpower150 3期研究中顯示,在貝伐珠單抗聯合化療(卡鉑+紫杉醇)的基礎上,加用阿替利珠單抗可以顯著改善轉移性NSCLC初治患者的PFS(8.4 月vs. 6.8月,P<0.001)和OS(29.4月vs.18.1月,P=0.02)。首次證實了使用阿替利珠單抗+貝伐珠單抗的免疫治療聯合化療治療EGFR突變患者的可行性。并強調了該方案可以作為難以治療的預后不良患者的一種潛在新治療選擇,例如那些肝轉移或經TKIs治療失敗的致敏性EGFR突變患者[9]。
因此,針對本院這類EGFR突變合并PD-L1高表達的晚期肺腺癌患者,在經EGFR-TKI后疾病出現進展后,應盡早改用PD-1/PD-L1抑制劑的免疫治療聯合化療的治療方案,以此爭取更長的總生存期,提高患者的生存質量。
免疫治療聯合化療的治療模式,在目前也已經有部分研究顯示了其治療經EGFR-TKI后疾病出現進展的NSCLC患者的療效和生存益處,也希望在未來有能更多的大型Ⅲ期臨床試驗與分子生物學發現相結合,為患者選擇合適的治療方案帶來更多的啟示。
綜上,PD-L1的高表達可能是導致EGFR-TKI原發耐藥的機制之一,而針對這類EGFR突變合并PD-L1高表達的晚期肺腺癌患者,免疫治療(PD-1/PD-L1抑制劑)聯合化療是一種潛在的治療選擇,但是聯合治療方案的最佳模式、獲益人群的篩選以及用藥的安全性等還需要需進一步的探索,這也為以后的研究提出了更高的要求。
利益沖突:本研究不涉及任何利益沖突。