引用本文: 厚雙龍, 魏嘉辛, 趙鑫, 王剛. 相位角與慢性阻塞性肺疾病的系統評價. 中國呼吸與危重監護雜志, 2024, 23(5): 312-320. doi: 10.7507/1671-6205.202312004 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
慢性阻塞性肺疾病(簡稱慢阻肺)是一種以進行性和不可逆性的氣流阻塞和呼吸道癥狀為特征的疾病[1]。世界衛生組織最新數據表明慢阻肺已成為世界第三大死亡原因,是全球性的健康危機[2]。在我國,由慢阻肺直接產生的人均醫療費用高達75~3 565美元,造成較重的疾病負擔[3]。慢阻肺的臨床和病理表現具有明顯的異質性和多組分特征。事實上,盡管臨床上強調對慢阻肺患者的肺功能管理,生存研究已經確定了部分肺外因素,如營養不良、骨骼肌功能障礙等[4]。流行病學調查顯示,營養不良在慢阻肺患者中的患病率高達30%[5]。慢阻肺患者合并營養不良通過炎癥因子、慢性缺氧、氧化應激和糖皮質激素過度使用等生理機制進而造成骨骼肌損耗,嚴重影響慢阻肺患者的臨床結局[5-6]。因此,營養和骨骼肌評估對于慢阻肺患者具有重要意義。然而,傳統人體測量學方法往往不能準確、敏感的監測其早期變化,無法為慢阻肺的臨床管理提供參考[7]。
相位角(phase angle,PhA)是生物電阻抗技術衍生的一項新型原始參數,它提供了人體細胞內外水分的分布信息,同時被認為是體細胞質量與細胞膜完整性的指標[8]。最近,PhA因其低成本、易獲取、可復現且不受生物電阻抗分析技術的固有模型影響等顯著優勢而受到關注。證據表明,相較于傳統人體測量學方法,PhA能夠更敏感地檢測與早期營養風險有關的死亡風險[9]。目前,PhA已被廣泛應用于營養不良和肌少癥的評估[10-11]。從臨床疾病看,PhA已經在心血管疾病、代謝性疾病、癌癥、老年性疾病中等疾病中建立應用,用于臨床疾病的功能評估和結局預測[12-15]。在慢阻肺方面,早期研究初步表明慢阻肺患者的PhA水平與其臨床結局密切相關[16]。隨著PhA的發展成熟,近年來有關PhA應用于慢阻肺的原始研究有所增加,然而對該領域證據的系統總結尚處空白[17-26]。本次系統評價旨在總結慢阻肺患者的PhA水平與其功能、嚴重程度以及預后的關聯,為慢阻肺的臨床綜合管理提供新的視角。
1 資料與方法
1.1 方法論與方案注冊
本研究根據系統評價和Meta分析的首選報告項目(PRISMA)指南進行[27],研究方案已在PROSPERO平臺登記注冊(注冊號:CRD42023450791)。
1.2 檢索策略
對PubMed、Embase、Web of Science、Scopus、CNKI和WanFang數據庫進行全面檢索,檢索時間從建庫至2023年8月1日。中文檢索詞:慢阻肺、慢性阻塞性肺疾病、COPD、相位角、PhA。英文檢索詞:Chronic Obstructive Lung Disease、Chronic Obstructive Pulmonary Disease、Chronic Obstructive Airway Disease、COPD、phase angle、PhA。具體檢索策略見表1。
1.3 納入與排除標準
1.3.1 納入標準
(1)P:以國際標準確診的慢性阻塞性肺疾病患者;(2)I:使用生物電阻抗分析儀測量患者的相位角;(3)C:不適用;(4)O:相位角與慢性阻塞性肺疾病功能、嚴重程度及預后的關聯。(5)S:未作限定。
1.3.2 排除標準
(1)未按國際標準診斷慢性阻塞性肺疾病的文獻;(2)會議論文集、碩博論文、綜述、Meta分析、動物實驗;(3)方法學不明確的文獻;(4)結局指標不明確或缺少必要數據的文獻。
1.4 文獻篩選與資料提取
文獻篩選與資料提取由第二作者和第三作者完成。將納入文獻導入文獻管理軟件進行去重后通過閱讀標題和摘要初步排除無關文獻,再經全文閱讀最終確定納入文獻。資料提取一般內容包括:作者及年份、國家、研究設計、研究對象、樣本量、性別、年齡、病程、體重指數(body mass index,BMI)、隨訪時間、納入對象PhA值和PhA參考值。此外,本研究還對文獻方法學特征和主要結果進行了提取和編碼。
1.5 文獻質量評價
考慮納入文獻存在不同研究設計,因此選擇混合方法評價工具(mixed methods appraisal tool,MMAT)進行質量評價[28]。該工具包括5類適用范圍:定性研究、定量隨機對照研究、定量非隨機研究、定量描述性分析研究和混合方法研究,被廣泛應用于混合方法研究的質量評價。根據納入研究類型,本研究選擇“定量非隨機研究”部分的清單條目展開評價。評價條目包括2條通用的篩選問題和5條針對問題,如果研究符合篩選問題的標準,表明可以使用MMAT進行評價。每條問題使用★表示符合標準、–表示不符合標準,/表示不清楚,并使用★和百分比描述文獻總體質量。質量評價過程由兩名研究人員獨立評價并交叉核對。
2 結果
2.1 文獻檢索結果
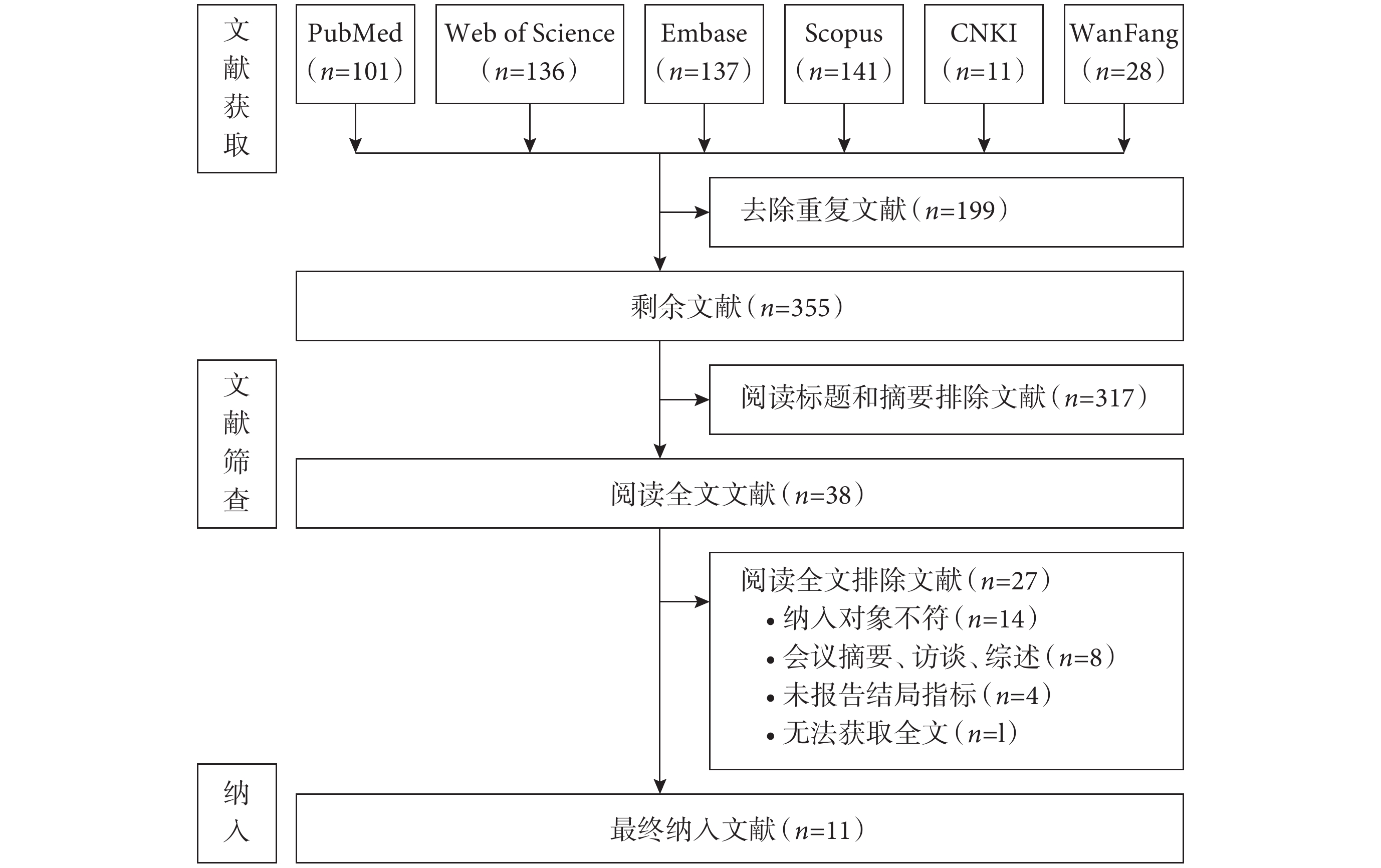
從數據庫初檢獲取554篇文獻。其中199篇經查重后剔除,317篇經閱讀標題摘要排除,38篇進行全文閱讀,因圖1所示原因排除27篇,最終剩余11篇文獻進入系統評價。文獻篩選流程見圖1。
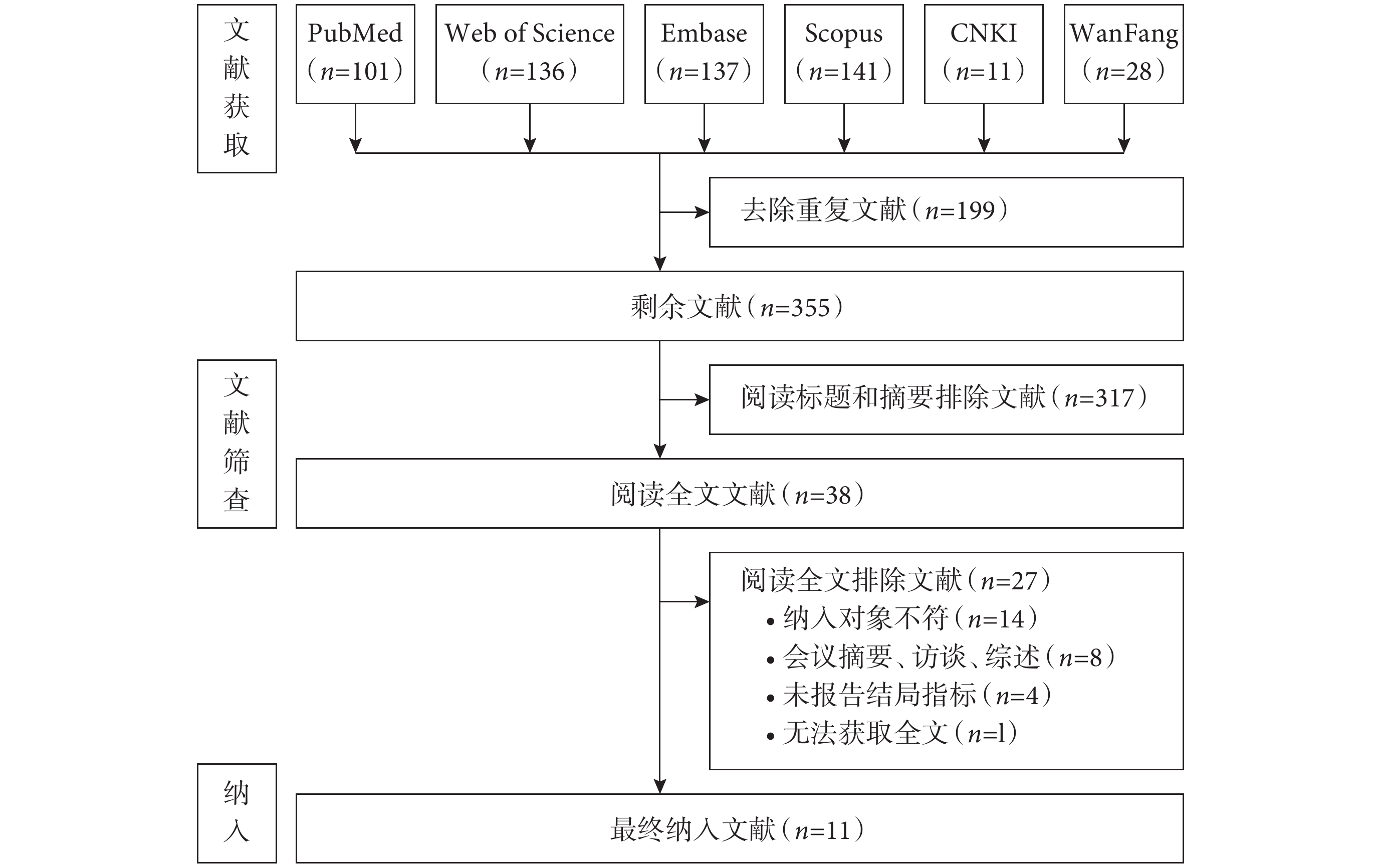 圖1
文獻篩選流程圖
圖1
文獻篩選流程圖
2.2 納入研究一般資料
共計11篇文獻進入系統評價[16-26],涉及2 189名受試者,其中2 163名慢阻肺患者,26名健康受試者。納入研究4篇為隊列研究[19,23-24,26],6篇為橫斷面研究[16-18,20-22],1篇為病例對照研究[25]。納入研究樣本量從51名至502名不等。患者平均年齡均較高,性別、病程和BMI未見明顯差異。4項隊列研究說明了隨訪時間[16,23-24,26],最長約78個月[24],最短3個月[26]。納入研究中受試者的PhA值分布在3.29°~5.83°范圍。3項研究以前瞻標準將受試者分為正常PhA組和低PhA組[20,23,26],參考標準為男性5.0°,女性4.6°,結果見表2。
2.3 文獻質量評價
納入研究質量評價見表3。所有研究的通用篩選問題均符合標準,可以使用MMAT進行質量評價。所有研究的受試者均可代表目標人群,干預和暴露恰當,結局數據完整,研究過程均符合預期方法論。在混雜因素方面,兩項研究在設計和數據分析過程中僅考慮雙變量,未控制其他可能的混雜變量[18,20]。總體而言,9項研究100%符合所有質量評價標準[16-17,19,21-26],2項研究80%符合所有質量評價標準[18,20],納入文獻整體質量較高,結果見表3。
2.4 相位角與慢阻肺患者嚴重程度
3項研究說明了PhA與慢阻肺患者嚴重程度的關系[16,23,26],主要包括病情等級[26],入住重癥監護病房(intensive care unit,ICU)情況[26],慢性阻塞性肺疾病全球倡議(Global Initiative for Chronic Obstructive Lung Disease,GOLD)分級[23,26],改良版的英國醫學研究委員會呼吸困難(modified British medical research council,mMRC)分級[16,23,26],慢阻肺評估測試(COPD assessment test,CAT)分數[26],BODE指數[16]和年齡呼吸困難障礙(Age dyspnea obstruction,ADO)分數[16],具體信息見表4。
在Maddocks等[16]的研究中,作者使用mMRC分級、CAT、BODE指數和ADO分數作為穩定期慢阻肺患者疾病嚴重程度的指標。分析結果表明,PhA與患者mMRC分級、ADO分數、BODE指數存在顯著負相關,提示PhA水平與慢阻肺疾病嚴重程度有關。張瑩[23]對比正常PhA和低PhA慢阻肺患者的臨床資料,發現兩組患者的GOLD分級存在顯著差異,相比于正常PhA的慢阻肺患者,低PhA患者的GOLD分級明顯較低,與周翠銀[26]的研究結果一致。此外,周翠銀等[26]還報道了正常和低PhA組慢阻肺患者病情嚴重等級以及入住ICU情況的顯著差異,低PhA患者往往病情嚴重等級較高,入住ICU風險更大。
2.5 相位角與慢阻肺患者功能
8項研究闡述了慢阻肺患者的PhA水平與其功能的關系[16-17,20-23,25-26],包括肺功能[16-17,20-23,26]和軀體功能[16-17,25],具體信息見表4。
2015年,Maddocks等[16]評估了502名穩定期慢阻肺患者。相關性分析顯示患者的PhA水平與其第1秒用力呼氣容積占預計值百分比(forced expiratory volume in the first second as a percentage of predicted value,FEV1%pred)呈中度負相關。同時,患者股四頭肌最大自主收縮力量、4米步行速度、椅子5次坐起時間和遞增穿梭步行測試結果與PhA表現出中度正相關。De Blasio等[17]研究發現慢阻肺患者的PhA水平與手握力、最大吸氣壓力和最大呼氣壓力存在中度正相關。此外,一項針對我國急性期慢阻肺患者的研究中[20],作者按照Kyle標準[29]將95名受試者分為正常PhA組和低PhA組,發現正常PhA組的肺功能分級顯著高于低PhA組患者。同樣,張瑩[23]報道稱正常PhA組慢阻肺患者的FEV1%pred顯著高于低PhA組,但兩組患者的第1秒用力呼氣容積與用力肺活量比值(forced expiratory volume in the first second/forced vital capacity,FEV1/FVC)未發現明顯差異,與周翠銀[26]的研究結果一致。
以上結果提示慢阻肺患者的PhA變化與其軀體功能和肺功能密切相關,PhA有可能作為慢阻肺患者肺功能和軀體功能的有效預測因子。Orea-Tejeda等[21]研究發現穩定期慢阻肺患者的PhA水平與肺功能顯著相關,在多變量回歸模型中,PhA是患者FEV1[β=7.76,95%置信區間(confidential interval,CI)4.174~11.384,P<0.001]和FVC(β=3.254,95%CI 0.555~5.954,P=0.018)的獨立預測因子。墨西哥的一項研究同樣顯示PhA可以作為慢阻肺患者肺功能的獨立預測因子(FEV1:β=5.745,95%CI 2.596~8.895,P<0.001;FVC:β=3.871,95%CI 1.077~6.665,P=0.008)[22]。此外,最新一項研究納入25名慢阻肺患者和26名匹配健康受試者,分析其身體成分和功能之間的關聯,結果顯示兩組受試者的PhA水平與6分鐘步行試驗結果存在顯著相關性[25]。在矯正了年齡、性別和FEV1%pred后,PhA仍然是6分鐘步行試驗的獨立預測因素(β=57,95%CI 27.5~87.2,P<0.001)。
2.6 相位角與慢阻肺患者預后
7項研究描述了慢阻肺患者的PhA與其預后的關聯[16,18-20,23-24,26],主要涉及營養風險[18,20]、住院時間[16,20]、急性加重[16,23,26]和死亡[19,23-24,26],具體信息見表4。
住院時間與疾病負擔直接相關,住院時間越長,疾病負擔越重。Maddocks等[16]研究顯示,在穩定期的慢阻肺住院患者中,低二分位數PhA患者的住院時長顯著大于高二分位數患者。程玉婷等[20]研究表明急性期慢阻肺患者的PhA水平與其住院時長呈顯著的負相關。
低PhA水平與較高的營養風險有關。一項研究根據歐洲臨床營養與代謝協會推薦標準,將263名慢阻肺患者分為無營養不良組、無炎癥營養不良組和營養不良伴炎癥組,發現三組患者的PhA水平存在顯著差異[18]。具體而言,隨著營養風險的增加,慢阻肺患者的PhA水平明顯降低,提示兩者相關聯。營養風險篩查2002(nutritional risk screening 2002,NRS2002)量表綜合了營養狀態受損評分、年齡調整分數和疾病嚴重程度評分,具有較好的信度和效度[30]。程玉婷等[20]研究表明正常PhA與低PhA水平慢阻肺患者之間的NRS2002得分具有顯著差異,低PhA組的營養風險更高。
隨訪期急性加重和死亡風險是慢阻肺患者最常用的不良預后指標。3項文獻說明了慢阻肺患者的PhA水平與急性加重的關聯[16,23,26]。其中1項研究報告了PhA低于中位數與高于中位數的慢阻肺患者急性加重次數的顯著差異[16],2項研究使用了生存分析和COX回歸分析[23,26]。結果表明,以隨訪期急性加重為終點事件,低PhA組患者與正常PhA組患者生存時間分布具有顯著差異。Kaplan-Meier繪制曲線顯示,正常PhA組出現急性加重的生存時間中位數明顯大于低PhA組。兩項研究中COX回歸分析結果均顯示慢阻肺患者的PhA水平是其急性加重的獨立預測因子,風險比(hazard ratio,HR)分別為2.744(95%CI 1.259~5.981,P=0.001)[23]和1.558(95%CI 1.133~2.186,P<0.001)[26]。就PhA與死亡風險而言,總共有4項研究進行報道[19,23-24,26],其中兩項研究[19,24]比較了隨訪期慢阻肺幸存者與非幸存者的PhA水平,發現非幸存者的PhA水平整體低于幸存者。3項研究使用了生存分析[19,23,26]。以隨訪期間死亡為終點事件的Log-Rank法分析結果表明,低PhA組慢阻肺患者的生存率顯著低于正常PhA組,差異有統計學意義。特別是在De Blasio等[19]的研究中,與最高五分位數PhA組患者相比,最低五分位數PhA組患者的病死率增加至9.00倍。最后,4項研究都使用COX回歸分析了慢阻肺患者死亡風險的預測因素,結果均證實PhA是死亡的獨立預測因子[19,23-24,26]。
3 討論
慢阻肺的發病機制尚不明確,目前流行病學已證實的危險因素包括遺傳因素、早期生活事件以及長期暴露于煙草環境和有毒氣體下[31]。此外,近年也有研究表明腸道菌群失衡和牙周疾病等作為慢阻肺的新型危險因素[32-33]。在臨床環境中,慢阻肺患者通常出現炎癥反應、蛋白水解失衡、體液異常分布、氧化應激等病理生理機制,導致慢阻肺患者的營養狀況和肌肉功能下降,進而造成肺功能和軀體功能流失[6,34]。另一方面,慢阻肺可能與多種合并癥共存,如高血壓、冠狀動脈疾病、慢性腎功能衰竭、心力衰竭和惡病質,嚴重影響患者的生存率和預后效果[35]。鑒于慢阻肺病理生理機制以及臨床轉歸的異質性,目前對慢阻肺患者的結局預測和臨床管理仍缺乏敏感的參考指標[36]。在這種情況下,重要的是要認識到慢阻肺患者的呼吸系統癥狀與全身表現之間的串擾因素,以確定可用作功能評估、病情嚴重程度以及生存指標的有效參數,這些因素可能會對慢阻肺患者的臨床管理和結局預測起到作用[14,21,36]。
近年來,學者們對生物電阻抗分析原始變量的應用逐漸廣泛[11-15]。生物電阻抗可以分為細胞內液、外液的阻抗成分以及細胞膜產生的容抗成分,而PhA描述了50 kHz電流穿過人體時阻抗與容抗之間的關系,計算公式為反正切(容抗/阻抗)×180°/π[8]。由于氧化應激、營養不良、促炎狀態、分解代謝狀態異常和糖皮質激素的過度使用,慢阻肺患者往往會出現細胞完整性降低、體細胞總量下降、細胞內和細胞外水分分布紊亂等特征,這種情況會導致PhA出現異常[16,20,23]。在臨床實踐中,PhA已被證實為各種疾病肌肉質量、營養狀況、運動耐受以及病死率的影響因素[12-15]。此外,現有證據充分支持PhA在慢阻肺合并癥管理方面的應用效果[12-15]。從綜合角度考慮,PhA有可能作為慢阻肺患者功能狀態、疾病嚴重程度和預后的潛在預測指標。
本研究共納入11項研究進行系統評價,共2 163名患者的PhA平均水平分布在3.29°~5.83°之間。盡管未使用標準化的PhA使得各個研究之間的異質性較高,但這組數值水平顯著低于正常人群的參考值[37]。從慢阻肺患者的PhA水平與疾病嚴重程度的關聯出發,本研究確定了3項研究[14,21,24]。總體結果表明,慢阻肺患者的PhA與疾病嚴重程度有關,疾病嚴重程度較高患者的PhA普遍較低。然而,尚無研究提供PhA作為疾病嚴重程度的預測因子的相關證據。慢阻肺患者的肺功能和軀體功能互相串擾,是慢阻肺患者疾病程度和預后效果的決定因素。本次所納入研究中,7項研究報告了PhA水平與肺功能的關聯[14-15,18-21,24],3項研究報告了PhA水平與軀體功能的關系[16,17,25]。結果提示慢阻肺患者的PhA水平與肺通氣、呼吸肌和軀體功能的變化一致。此外,PhA還可以作為慢阻肺患者FEV1[21-22]、FVC[21-22]和運動耐受性[24]的獨立預測因子。在運動耐受性方面,PhA的預測價值甚至要遠高于FEV1%pred[24]。關于慢阻肺患者的PhA水平與預后效果的關聯,本研究確定了住院時長、營養狀況、急性加重和死亡四個方面。其中2項研究說明了慢阻肺患者的PhA水平與其住院時長[16,20]和營養狀況[18,20]的雙變量相關性。換句話說,在不考慮其他混雜變量的情況下,相比于正常PhA的患者,低水平PhA患者的住院時間更長,出現營養不良的風險也更高。另外,慢阻肺患者的急性加重是患者肺功能、生活質量和生存率的決定因素,同時也是慢阻肺相關經濟負擔的主要來源[38]。有限的生存分析證據表明,正常PhA患者與低PhA患者的生存時間分布存在顯著差異。以男性>5.0°,女性>4.6°為低PhA標準,正常PhA患者出現急性加重的次數明顯少于低PhA患者,低PhA是慢阻肺患者急性加重的獨立危險因素[23,26]。在張瑩[23]的研究中獲取到的HR為2.744,相比之下周翠銀[26]的研究中HR較低,為1.558。最后,4項隊列研究均表明PhA可以作為慢阻肺患者全因死亡的有效預測因子[19,23-24,26]。在隨訪期最長的研究中,PhA對慢阻肺患者病死率的預測系數為–0.64,慢阻肺患者的PhA每增加1個標準單位,死亡風險就會下降0.64倍[24]。
本系統評價具有局限性。首先,受限于原始研究,本次系統評價納入的原始研究較少,且只有4項研究設計為隊列研究,提供的因果證據有限。其次,注意到納入研究中僅有1項研究使用了經年齡、性別和BMI調整的標準化PhA,其他研究均未使用,限制了各研究結果的可比性和推廣性。另外,納入研究具有明顯的方法學異質性,各研究對于PhA的測量技術,如儀器型號、測量時間、測量體位未做統一,可能會影響評價結果的客觀性。最后,各研究的研究設計和效應量指標異質性較高,使得無法對累積證據進行Meta分析,導致證據質量較低。
綜上所述,本次關于慢阻肺患者PhA水平與其臨床狀況的系統評價,表明目前有限的證據顯示低PhA水平與慢阻肺患者疾病嚴重程度、功能下降和不良預后有關,PhA是慢阻肺患者肺功能、軀體運動耐力、急性加重和死亡的潛在預測因子。作為限制,無法對現有研究進行定量的Meta分析,未來需要提供更多前瞻性、多中心的隊列研究,為PhA在慢阻肺患者中的臨床應用提供更高質量的證據支持。
利益沖突:本研究不涉及任何利益沖突。
慢性阻塞性肺疾病(簡稱慢阻肺)是一種以進行性和不可逆性的氣流阻塞和呼吸道癥狀為特征的疾病[1]。世界衛生組織最新數據表明慢阻肺已成為世界第三大死亡原因,是全球性的健康危機[2]。在我國,由慢阻肺直接產生的人均醫療費用高達75~3 565美元,造成較重的疾病負擔[3]。慢阻肺的臨床和病理表現具有明顯的異質性和多組分特征。事實上,盡管臨床上強調對慢阻肺患者的肺功能管理,生存研究已經確定了部分肺外因素,如營養不良、骨骼肌功能障礙等[4]。流行病學調查顯示,營養不良在慢阻肺患者中的患病率高達30%[5]。慢阻肺患者合并營養不良通過炎癥因子、慢性缺氧、氧化應激和糖皮質激素過度使用等生理機制進而造成骨骼肌損耗,嚴重影響慢阻肺患者的臨床結局[5-6]。因此,營養和骨骼肌評估對于慢阻肺患者具有重要意義。然而,傳統人體測量學方法往往不能準確、敏感的監測其早期變化,無法為慢阻肺的臨床管理提供參考[7]。
相位角(phase angle,PhA)是生物電阻抗技術衍生的一項新型原始參數,它提供了人體細胞內外水分的分布信息,同時被認為是體細胞質量與細胞膜完整性的指標[8]。最近,PhA因其低成本、易獲取、可復現且不受生物電阻抗分析技術的固有模型影響等顯著優勢而受到關注。證據表明,相較于傳統人體測量學方法,PhA能夠更敏感地檢測與早期營養風險有關的死亡風險[9]。目前,PhA已被廣泛應用于營養不良和肌少癥的評估[10-11]。從臨床疾病看,PhA已經在心血管疾病、代謝性疾病、癌癥、老年性疾病中等疾病中建立應用,用于臨床疾病的功能評估和結局預測[12-15]。在慢阻肺方面,早期研究初步表明慢阻肺患者的PhA水平與其臨床結局密切相關[16]。隨著PhA的發展成熟,近年來有關PhA應用于慢阻肺的原始研究有所增加,然而對該領域證據的系統總結尚處空白[17-26]。本次系統評價旨在總結慢阻肺患者的PhA水平與其功能、嚴重程度以及預后的關聯,為慢阻肺的臨床綜合管理提供新的視角。
1 資料與方法
1.1 方法論與方案注冊
本研究根據系統評價和Meta分析的首選報告項目(PRISMA)指南進行[27],研究方案已在PROSPERO平臺登記注冊(注冊號:CRD42023450791)。
1.2 檢索策略
對PubMed、Embase、Web of Science、Scopus、CNKI和WanFang數據庫進行全面檢索,檢索時間從建庫至2023年8月1日。中文檢索詞:慢阻肺、慢性阻塞性肺疾病、COPD、相位角、PhA。英文檢索詞:Chronic Obstructive Lung Disease、Chronic Obstructive Pulmonary Disease、Chronic Obstructive Airway Disease、COPD、phase angle、PhA。具體檢索策略見表1。
1.3 納入與排除標準
1.3.1 納入標準
(1)P:以國際標準確診的慢性阻塞性肺疾病患者;(2)I:使用生物電阻抗分析儀測量患者的相位角;(3)C:不適用;(4)O:相位角與慢性阻塞性肺疾病功能、嚴重程度及預后的關聯。(5)S:未作限定。
1.3.2 排除標準
(1)未按國際標準診斷慢性阻塞性肺疾病的文獻;(2)會議論文集、碩博論文、綜述、Meta分析、動物實驗;(3)方法學不明確的文獻;(4)結局指標不明確或缺少必要數據的文獻。
1.4 文獻篩選與資料提取
文獻篩選與資料提取由第二作者和第三作者完成。將納入文獻導入文獻管理軟件進行去重后通過閱讀標題和摘要初步排除無關文獻,再經全文閱讀最終確定納入文獻。資料提取一般內容包括:作者及年份、國家、研究設計、研究對象、樣本量、性別、年齡、病程、體重指數(body mass index,BMI)、隨訪時間、納入對象PhA值和PhA參考值。此外,本研究還對文獻方法學特征和主要結果進行了提取和編碼。
1.5 文獻質量評價
考慮納入文獻存在不同研究設計,因此選擇混合方法評價工具(mixed methods appraisal tool,MMAT)進行質量評價[28]。該工具包括5類適用范圍:定性研究、定量隨機對照研究、定量非隨機研究、定量描述性分析研究和混合方法研究,被廣泛應用于混合方法研究的質量評價。根據納入研究類型,本研究選擇“定量非隨機研究”部分的清單條目展開評價。評價條目包括2條通用的篩選問題和5條針對問題,如果研究符合篩選問題的標準,表明可以使用MMAT進行評價。每條問題使用★表示符合標準、–表示不符合標準,/表示不清楚,并使用★和百分比描述文獻總體質量。質量評價過程由兩名研究人員獨立評價并交叉核對。
2 結果
2.1 文獻檢索結果
從數據庫初檢獲取554篇文獻。其中199篇經查重后剔除,317篇經閱讀標題摘要排除,38篇進行全文閱讀,因圖1所示原因排除27篇,最終剩余11篇文獻進入系統評價。文獻篩選流程見圖1。
 圖1
文獻篩選流程圖
圖1
文獻篩選流程圖
2.2 納入研究一般資料
共計11篇文獻進入系統評價[16-26],涉及2 189名受試者,其中2 163名慢阻肺患者,26名健康受試者。納入研究4篇為隊列研究[19,23-24,26],6篇為橫斷面研究[16-18,20-22],1篇為病例對照研究[25]。納入研究樣本量從51名至502名不等。患者平均年齡均較高,性別、病程和BMI未見明顯差異。4項隊列研究說明了隨訪時間[16,23-24,26],最長約78個月[24],最短3個月[26]。納入研究中受試者的PhA值分布在3.29°~5.83°范圍。3項研究以前瞻標準將受試者分為正常PhA組和低PhA組[20,23,26],參考標準為男性5.0°,女性4.6°,結果見表2。
2.3 文獻質量評價
納入研究質量評價見表3。所有研究的通用篩選問題均符合標準,可以使用MMAT進行質量評價。所有研究的受試者均可代表目標人群,干預和暴露恰當,結局數據完整,研究過程均符合預期方法論。在混雜因素方面,兩項研究在設計和數據分析過程中僅考慮雙變量,未控制其他可能的混雜變量[18,20]。總體而言,9項研究100%符合所有質量評價標準[16-17,19,21-26],2項研究80%符合所有質量評價標準[18,20],納入文獻整體質量較高,結果見表3。
2.4 相位角與慢阻肺患者嚴重程度
3項研究說明了PhA與慢阻肺患者嚴重程度的關系[16,23,26],主要包括病情等級[26],入住重癥監護病房(intensive care unit,ICU)情況[26],慢性阻塞性肺疾病全球倡議(Global Initiative for Chronic Obstructive Lung Disease,GOLD)分級[23,26],改良版的英國醫學研究委員會呼吸困難(modified British medical research council,mMRC)分級[16,23,26],慢阻肺評估測試(COPD assessment test,CAT)分數[26],BODE指數[16]和年齡呼吸困難障礙(Age dyspnea obstruction,ADO)分數[16],具體信息見表4。
在Maddocks等[16]的研究中,作者使用mMRC分級、CAT、BODE指數和ADO分數作為穩定期慢阻肺患者疾病嚴重程度的指標。分析結果表明,PhA與患者mMRC分級、ADO分數、BODE指數存在顯著負相關,提示PhA水平與慢阻肺疾病嚴重程度有關。張瑩[23]對比正常PhA和低PhA慢阻肺患者的臨床資料,發現兩組患者的GOLD分級存在顯著差異,相比于正常PhA的慢阻肺患者,低PhA患者的GOLD分級明顯較低,與周翠銀[26]的研究結果一致。此外,周翠銀等[26]還報道了正常和低PhA組慢阻肺患者病情嚴重等級以及入住ICU情況的顯著差異,低PhA患者往往病情嚴重等級較高,入住ICU風險更大。
2.5 相位角與慢阻肺患者功能
8項研究闡述了慢阻肺患者的PhA水平與其功能的關系[16-17,20-23,25-26],包括肺功能[16-17,20-23,26]和軀體功能[16-17,25],具體信息見表4。
2015年,Maddocks等[16]評估了502名穩定期慢阻肺患者。相關性分析顯示患者的PhA水平與其第1秒用力呼氣容積占預計值百分比(forced expiratory volume in the first second as a percentage of predicted value,FEV1%pred)呈中度負相關。同時,患者股四頭肌最大自主收縮力量、4米步行速度、椅子5次坐起時間和遞增穿梭步行測試結果與PhA表現出中度正相關。De Blasio等[17]研究發現慢阻肺患者的PhA水平與手握力、最大吸氣壓力和最大呼氣壓力存在中度正相關。此外,一項針對我國急性期慢阻肺患者的研究中[20],作者按照Kyle標準[29]將95名受試者分為正常PhA組和低PhA組,發現正常PhA組的肺功能分級顯著高于低PhA組患者。同樣,張瑩[23]報道稱正常PhA組慢阻肺患者的FEV1%pred顯著高于低PhA組,但兩組患者的第1秒用力呼氣容積與用力肺活量比值(forced expiratory volume in the first second/forced vital capacity,FEV1/FVC)未發現明顯差異,與周翠銀[26]的研究結果一致。
以上結果提示慢阻肺患者的PhA變化與其軀體功能和肺功能密切相關,PhA有可能作為慢阻肺患者肺功能和軀體功能的有效預測因子。Orea-Tejeda等[21]研究發現穩定期慢阻肺患者的PhA水平與肺功能顯著相關,在多變量回歸模型中,PhA是患者FEV1[β=7.76,95%置信區間(confidential interval,CI)4.174~11.384,P<0.001]和FVC(β=3.254,95%CI 0.555~5.954,P=0.018)的獨立預測因子。墨西哥的一項研究同樣顯示PhA可以作為慢阻肺患者肺功能的獨立預測因子(FEV1:β=5.745,95%CI 2.596~8.895,P<0.001;FVC:β=3.871,95%CI 1.077~6.665,P=0.008)[22]。此外,最新一項研究納入25名慢阻肺患者和26名匹配健康受試者,分析其身體成分和功能之間的關聯,結果顯示兩組受試者的PhA水平與6分鐘步行試驗結果存在顯著相關性[25]。在矯正了年齡、性別和FEV1%pred后,PhA仍然是6分鐘步行試驗的獨立預測因素(β=57,95%CI 27.5~87.2,P<0.001)。
2.6 相位角與慢阻肺患者預后
7項研究描述了慢阻肺患者的PhA與其預后的關聯[16,18-20,23-24,26],主要涉及營養風險[18,20]、住院時間[16,20]、急性加重[16,23,26]和死亡[19,23-24,26],具體信息見表4。
住院時間與疾病負擔直接相關,住院時間越長,疾病負擔越重。Maddocks等[16]研究顯示,在穩定期的慢阻肺住院患者中,低二分位數PhA患者的住院時長顯著大于高二分位數患者。程玉婷等[20]研究表明急性期慢阻肺患者的PhA水平與其住院時長呈顯著的負相關。
低PhA水平與較高的營養風險有關。一項研究根據歐洲臨床營養與代謝協會推薦標準,將263名慢阻肺患者分為無營養不良組、無炎癥營養不良組和營養不良伴炎癥組,發現三組患者的PhA水平存在顯著差異[18]。具體而言,隨著營養風險的增加,慢阻肺患者的PhA水平明顯降低,提示兩者相關聯。營養風險篩查2002(nutritional risk screening 2002,NRS2002)量表綜合了營養狀態受損評分、年齡調整分數和疾病嚴重程度評分,具有較好的信度和效度[30]。程玉婷等[20]研究表明正常PhA與低PhA水平慢阻肺患者之間的NRS2002得分具有顯著差異,低PhA組的營養風險更高。
隨訪期急性加重和死亡風險是慢阻肺患者最常用的不良預后指標。3項文獻說明了慢阻肺患者的PhA水平與急性加重的關聯[16,23,26]。其中1項研究報告了PhA低于中位數與高于中位數的慢阻肺患者急性加重次數的顯著差異[16],2項研究使用了生存分析和COX回歸分析[23,26]。結果表明,以隨訪期急性加重為終點事件,低PhA組患者與正常PhA組患者生存時間分布具有顯著差異。Kaplan-Meier繪制曲線顯示,正常PhA組出現急性加重的生存時間中位數明顯大于低PhA組。兩項研究中COX回歸分析結果均顯示慢阻肺患者的PhA水平是其急性加重的獨立預測因子,風險比(hazard ratio,HR)分別為2.744(95%CI 1.259~5.981,P=0.001)[23]和1.558(95%CI 1.133~2.186,P<0.001)[26]。就PhA與死亡風險而言,總共有4項研究進行報道[19,23-24,26],其中兩項研究[19,24]比較了隨訪期慢阻肺幸存者與非幸存者的PhA水平,發現非幸存者的PhA水平整體低于幸存者。3項研究使用了生存分析[19,23,26]。以隨訪期間死亡為終點事件的Log-Rank法分析結果表明,低PhA組慢阻肺患者的生存率顯著低于正常PhA組,差異有統計學意義。特別是在De Blasio等[19]的研究中,與最高五分位數PhA組患者相比,最低五分位數PhA組患者的病死率增加至9.00倍。最后,4項研究都使用COX回歸分析了慢阻肺患者死亡風險的預測因素,結果均證實PhA是死亡的獨立預測因子[19,23-24,26]。
3 討論
慢阻肺的發病機制尚不明確,目前流行病學已證實的危險因素包括遺傳因素、早期生活事件以及長期暴露于煙草環境和有毒氣體下[31]。此外,近年也有研究表明腸道菌群失衡和牙周疾病等作為慢阻肺的新型危險因素[32-33]。在臨床環境中,慢阻肺患者通常出現炎癥反應、蛋白水解失衡、體液異常分布、氧化應激等病理生理機制,導致慢阻肺患者的營養狀況和肌肉功能下降,進而造成肺功能和軀體功能流失[6,34]。另一方面,慢阻肺可能與多種合并癥共存,如高血壓、冠狀動脈疾病、慢性腎功能衰竭、心力衰竭和惡病質,嚴重影響患者的生存率和預后效果[35]。鑒于慢阻肺病理生理機制以及臨床轉歸的異質性,目前對慢阻肺患者的結局預測和臨床管理仍缺乏敏感的參考指標[36]。在這種情況下,重要的是要認識到慢阻肺患者的呼吸系統癥狀與全身表現之間的串擾因素,以確定可用作功能評估、病情嚴重程度以及生存指標的有效參數,這些因素可能會對慢阻肺患者的臨床管理和結局預測起到作用[14,21,36]。
近年來,學者們對生物電阻抗分析原始變量的應用逐漸廣泛[11-15]。生物電阻抗可以分為細胞內液、外液的阻抗成分以及細胞膜產生的容抗成分,而PhA描述了50 kHz電流穿過人體時阻抗與容抗之間的關系,計算公式為反正切(容抗/阻抗)×180°/π[8]。由于氧化應激、營養不良、促炎狀態、分解代謝狀態異常和糖皮質激素的過度使用,慢阻肺患者往往會出現細胞完整性降低、體細胞總量下降、細胞內和細胞外水分分布紊亂等特征,這種情況會導致PhA出現異常[16,20,23]。在臨床實踐中,PhA已被證實為各種疾病肌肉質量、營養狀況、運動耐受以及病死率的影響因素[12-15]。此外,現有證據充分支持PhA在慢阻肺合并癥管理方面的應用效果[12-15]。從綜合角度考慮,PhA有可能作為慢阻肺患者功能狀態、疾病嚴重程度和預后的潛在預測指標。
本研究共納入11項研究進行系統評價,共2 163名患者的PhA平均水平分布在3.29°~5.83°之間。盡管未使用標準化的PhA使得各個研究之間的異質性較高,但這組數值水平顯著低于正常人群的參考值[37]。從慢阻肺患者的PhA水平與疾病嚴重程度的關聯出發,本研究確定了3項研究[14,21,24]。總體結果表明,慢阻肺患者的PhA與疾病嚴重程度有關,疾病嚴重程度較高患者的PhA普遍較低。然而,尚無研究提供PhA作為疾病嚴重程度的預測因子的相關證據。慢阻肺患者的肺功能和軀體功能互相串擾,是慢阻肺患者疾病程度和預后效果的決定因素。本次所納入研究中,7項研究報告了PhA水平與肺功能的關聯[14-15,18-21,24],3項研究報告了PhA水平與軀體功能的關系[16,17,25]。結果提示慢阻肺患者的PhA水平與肺通氣、呼吸肌和軀體功能的變化一致。此外,PhA還可以作為慢阻肺患者FEV1[21-22]、FVC[21-22]和運動耐受性[24]的獨立預測因子。在運動耐受性方面,PhA的預測價值甚至要遠高于FEV1%pred[24]。關于慢阻肺患者的PhA水平與預后效果的關聯,本研究確定了住院時長、營養狀況、急性加重和死亡四個方面。其中2項研究說明了慢阻肺患者的PhA水平與其住院時長[16,20]和營養狀況[18,20]的雙變量相關性。換句話說,在不考慮其他混雜變量的情況下,相比于正常PhA的患者,低水平PhA患者的住院時間更長,出現營養不良的風險也更高。另外,慢阻肺患者的急性加重是患者肺功能、生活質量和生存率的決定因素,同時也是慢阻肺相關經濟負擔的主要來源[38]。有限的生存分析證據表明,正常PhA患者與低PhA患者的生存時間分布存在顯著差異。以男性>5.0°,女性>4.6°為低PhA標準,正常PhA患者出現急性加重的次數明顯少于低PhA患者,低PhA是慢阻肺患者急性加重的獨立危險因素[23,26]。在張瑩[23]的研究中獲取到的HR為2.744,相比之下周翠銀[26]的研究中HR較低,為1.558。最后,4項隊列研究均表明PhA可以作為慢阻肺患者全因死亡的有效預測因子[19,23-24,26]。在隨訪期最長的研究中,PhA對慢阻肺患者病死率的預測系數為–0.64,慢阻肺患者的PhA每增加1個標準單位,死亡風險就會下降0.64倍[24]。
本系統評價具有局限性。首先,受限于原始研究,本次系統評價納入的原始研究較少,且只有4項研究設計為隊列研究,提供的因果證據有限。其次,注意到納入研究中僅有1項研究使用了經年齡、性別和BMI調整的標準化PhA,其他研究均未使用,限制了各研究結果的可比性和推廣性。另外,納入研究具有明顯的方法學異質性,各研究對于PhA的測量技術,如儀器型號、測量時間、測量體位未做統一,可能會影響評價結果的客觀性。最后,各研究的研究設計和效應量指標異質性較高,使得無法對累積證據進行Meta分析,導致證據質量較低。
綜上所述,本次關于慢阻肺患者PhA水平與其臨床狀況的系統評價,表明目前有限的證據顯示低PhA水平與慢阻肺患者疾病嚴重程度、功能下降和不良預后有關,PhA是慢阻肺患者肺功能、軀體運動耐力、急性加重和死亡的潛在預測因子。作為限制,無法對現有研究進行定量的Meta分析,未來需要提供更多前瞻性、多中心的隊列研究,為PhA在慢阻肺患者中的臨床應用提供更高質量的證據支持。
利益沖突:本研究不涉及任何利益沖突。