引用本文: 任潔, 湯榮, 楊鍇, 謝國鋼, 丁鳳鳴, 張旻. 新型冠狀病毒感染繼發諾卡菌病合并活動性肺結核一例并文獻復習. 中國呼吸與危重監護雜志, 2024, 23(7): 504-508. doi: 10.7507/1671-6205.202401060 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
在新型冠狀病毒大流行期間,新型冠狀病毒感染患者繼發活動性肺結核常見,但同時合并諾卡菌病罕見[1]。諾卡菌屬于革蘭陽性需氧放線菌,抗酸染色呈弱陽性,主要感染免疫功能低下人群,其臨床癥狀、體征和影像學缺乏特異性,病原學培養增殖速度慢,容易漏診[2]。此外,諾卡菌導致慢性化膿性炎癥可使宿主肺部CD4+ T細胞免疫反應低下,從而干擾活動性肺結核的免疫學診斷結果[3]。本文報告了1例72歲女性在新型冠狀病毒感染后出現長期反復發熱,通過肺泡灌洗液宏基因組學二代基因測序發現圣喬治教堂諾卡菌合并結核分枝桿菌感染病例,并總結相關文獻。希望臨床醫師對于新型冠狀病毒感染后反復發熱患者在鑒別診斷中需要考慮是否存在諾卡菌病合并結核分枝桿菌感染可能,避免漏診、誤診而延誤治療。
1 臨床資料
患者女,72歲,因“反復咳嗽、咳痰伴發熱10個月余”于2023年11月25日入院。患者2023年1月5日因“咳嗽乏力10天”入住當地醫院,測體溫37.7℃,血常規顯示白細胞13.5×109/L、中性粒細胞百分比74.3%,C反應蛋白(C-reactive protein,CRP)54.43 mg/L,新型冠狀病毒核酸陽性。胸部CT顯示兩肺多發滲出性改變,肺底散在磨玻璃影,兩肺部分支氣管輕度擴張,右肺中葉局部支氣管狹窄(圖1a、b)。隨后氣管鏡檢查顯示兩側支氣管炎性改變。診斷為“新型冠狀病毒重癥感染”,予奈瑪特韋/利托那韋抗病毒、地塞米松抗炎以及頭孢哌酮舒巴坦抗感染和化痰平喘等對癥處理,經治療后患者癥狀好轉出院。出院后患者反復出現發熱,發熱時體溫波動于38~39℃,在當地予靜脈頭孢類抗生素抗感染治療1周后體溫可降至正常,但2~3周后又出現發熱,伴有咳嗽膿痰,上述癥狀反復發作,持續10個月余。11月22日患者再次出現發熱,體溫最高39℃,在當地醫院查白細胞18.0×109/L、中性粒細胞百分比68.7%、CRP 77.3 mg/L,胸部CT提示兩肺多發感染伴部分實變,予頭孢曲松聯合左氧氟沙星抗感染后體溫較前下降。11月25日患者到我院門診就診,復查血常規白細胞21.2×109/L,中性粒細胞百分比83.1%,CRP 74.1 mg/L。為求進一步診治,擬“發熱原因待查”收住入院。病程中患者無明顯腹痛、腹瀉、嘔吐等消化道癥狀,無明顯頭痛、暈厥、抽搐等神經系統癥狀,無明顯皮疹、關節疼痛、口干等結締組織疾病表現。患者既往否認慢性基礎疾病,職業為農民,無煙酒嗜好。
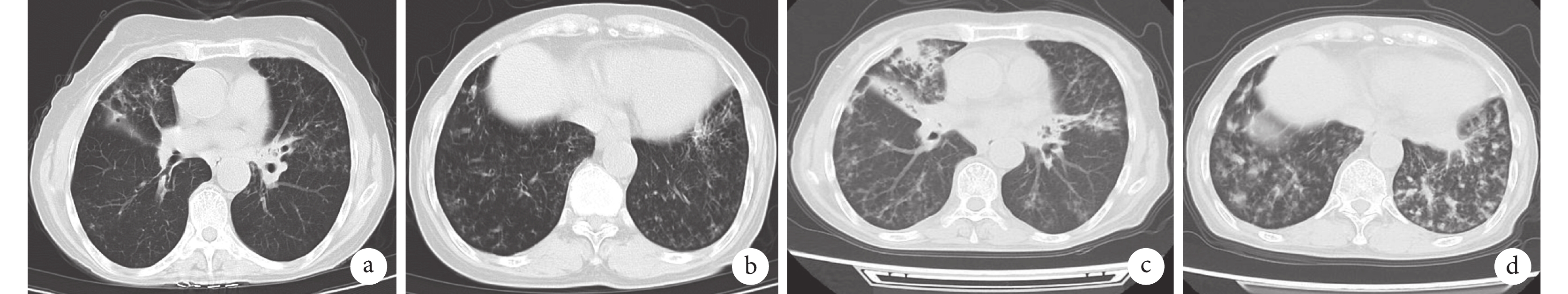 圖1
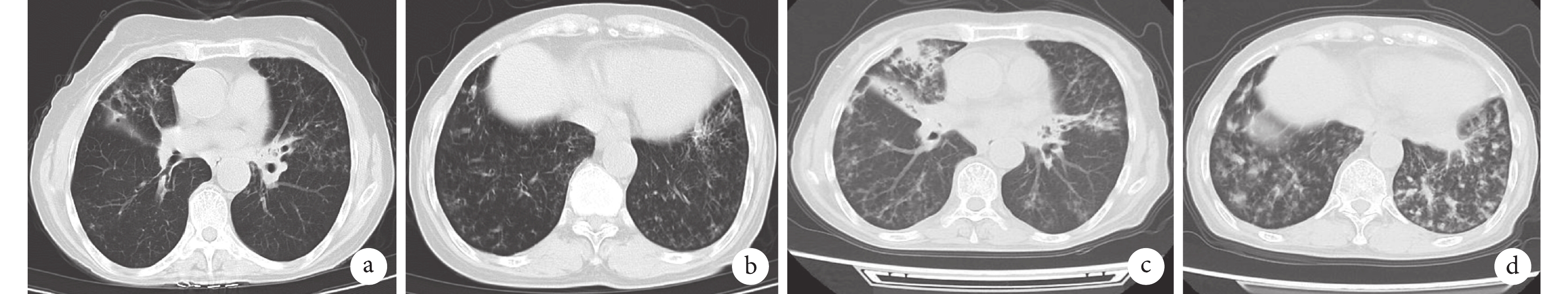
胸部CT檢查像
圖1
胸部CT檢查像
新型冠狀病毒感染時,患者胸部CT(2023年1月12日)顯示部分支氣管輕度擴張,右肺中葉局部支氣管狹窄(圖a);兩肺多發炎癥性改變,雙側肺底散在磨玻璃影(圖b);新型冠狀病毒感染后患者出現反復發熱10月余,此次入院后患者胸部CT(2023年11月28日)顯示雙肺部分支氣管擴張,可見“樹芽征”,右肺上葉可見實變影伴周圍滲出,右肺中葉不張(圖c),雙側肺底散在斑片滲出灶(圖d)。
入院查體:體溫37.3℃,脈搏98 次/min,呼吸18次/min,血壓120/85 mm Hg(1 mm Hg=0.133 kPa),神志清,精神萎,全身皮膚未見皮疹,雙側鎖骨上未觸及腫大淋巴結,肺部聽診雙側肺底可聞及少許濕啰音,心臟及腹部未見異常,雙下肢未見水腫。
入院診斷:發熱原因待查(特殊病原體肺部感染?)
入院診治經過:患者入院前長期反復發熱伴有中性粒細胞和CRP升高,胸部CT提示滲出性病變,β-內酰胺類抗生素無法有效控制病情,首先考慮肺部特殊病原體感染可能。入院后積極完善感染相關檢查,紅細胞沉降率100 mm/h;降鈣素原正常范圍(0.05 ng/mL);呼吸道流感病原體IgM膠體金檢測顯示呼吸道合胞病毒弱陽性,甲流、乙流、副流感、肺炎支原體、肺炎衣原體、腺病毒和柯薩奇病毒B組均為陰性;新型冠狀病毒核酸檢測陰性;血液T-SPOT.TB檢測陰性;HIV抗體陰性;血液T/B/NK淋巴細胞計數顯示CD3、CD4、CD8、CD19、NK細胞計數均正常;痰真菌涂片未見孢子和菌絲,真菌培養白色酵母菌生長;痰濃縮集菌未找到抗酸桿菌;痰細菌涂片未見可疑細菌,痰微生物培養48 h正常菌群生長;β-D-葡聚糖110 pg/mL。
入院后給予氨芐西林舒巴坦(3 g,1次/8 h)聯合莫西沙星(0.4 g,1次/d)經驗性抗感染治療以及化痰、營養支持。由于感染相關檢測未有診斷提示意義,故予以復查胸部CT,顯示雙肺部分支氣管擴張,可見“樹芽征”,右肺上葉可見實變影伴周圍滲出,右肺中葉不張,雙側肺底散在斑片滲出灶(圖1c、d),隨后行支氣管鏡檢查,取支氣管肺泡灌洗液送檢。鏡下發現支氣管黏膜充血水腫,右側支氣管中葉以及雙側支氣管下葉基底段開口可見膿性分泌物(圖2a),于右側中葉支氣管開口予20 mL生理鹽水灌洗6次,混合后送檢。肺泡灌洗液細胞學檢查:黃色,非常渾濁,有核細胞計數8 000×106/L,中性粒細胞85%,肺泡巨噬細胞12%,淋巴細胞2%,嗜酸性粒細胞1%,糖原染色陰性,鐵染色查含鐵血黃素細胞陰性,特殊染色查耶氏肺孢子菌陰性,真菌、隱球菌涂片檢查未查見。肺泡灌洗液細胞因子測定顯示白細胞介素(interleukin,IL)-6為26.05 pg/mL↑、IL-8為4 589.48 pg/mL↑、IL-1β 為116.83 pg/mL↑、干擾素γ為5.76 pg/mL;肺泡灌洗液T細胞免疫分型顯示CD3+CD4+ (輔助/誘導T細胞)0.39%↓、CD3+CD38+(T細胞活化亞群)3.09%↓、CD4+CD28+(輔助T細胞功能亞群)0.39%↓、CD4–CD8– 39.99%(雙陰性T細胞)↑。與微生物室溝通,延長痰微生物培養時間,72 h后血瓊脂平板上可見淡黃色菌落生長(圖2b),經質譜鑒定為圣喬治教堂諾卡菌(MALDI Biotyper微生物質譜快速鑒定系統,Score=1.73,圖2c)。灌洗液宏基因組學二代基因測序顯示圣喬治諾卡菌(序列數3 951,圖2d)和結核分枝桿菌復合群(序列數295,圖2e)。
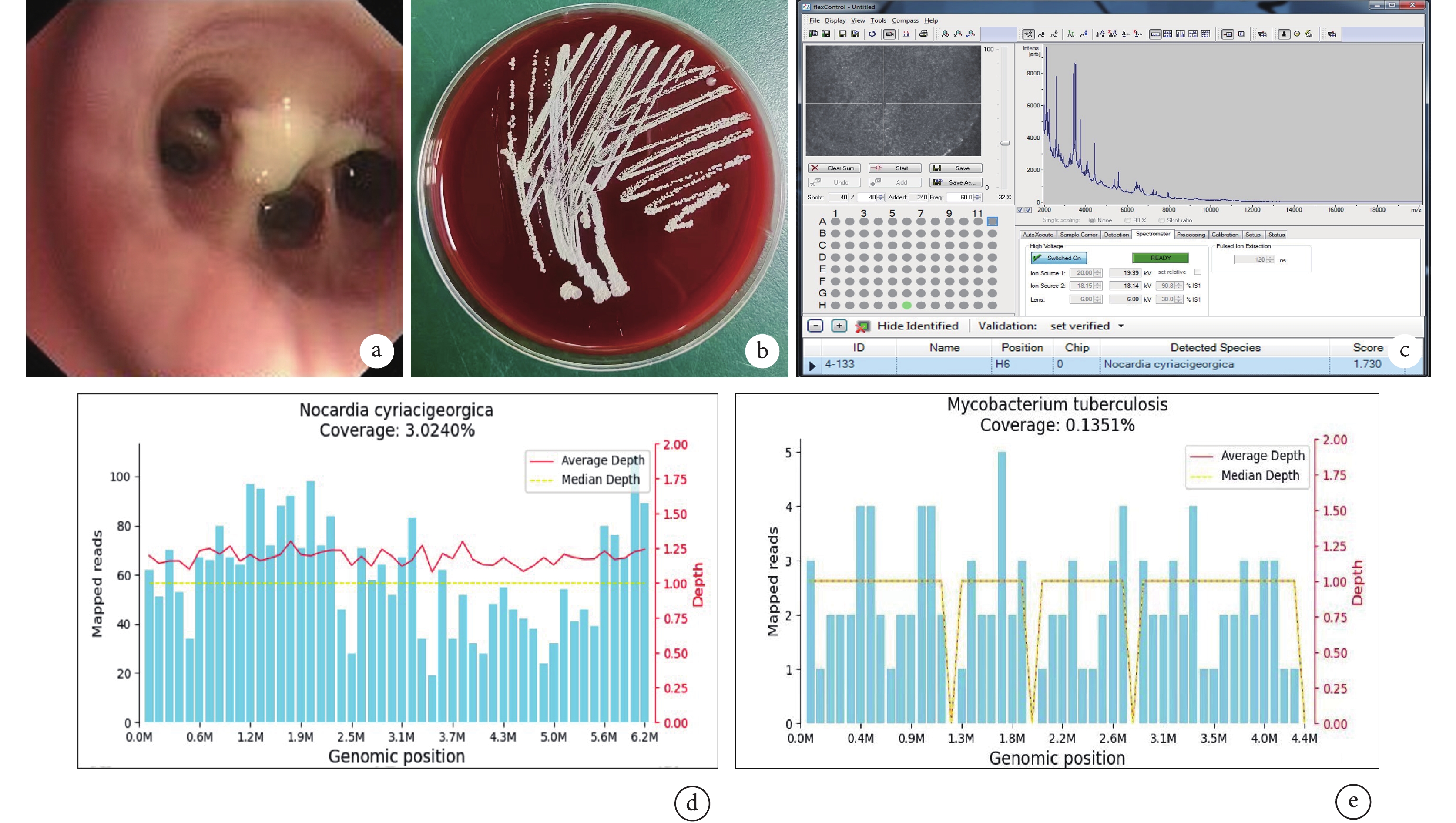 圖2
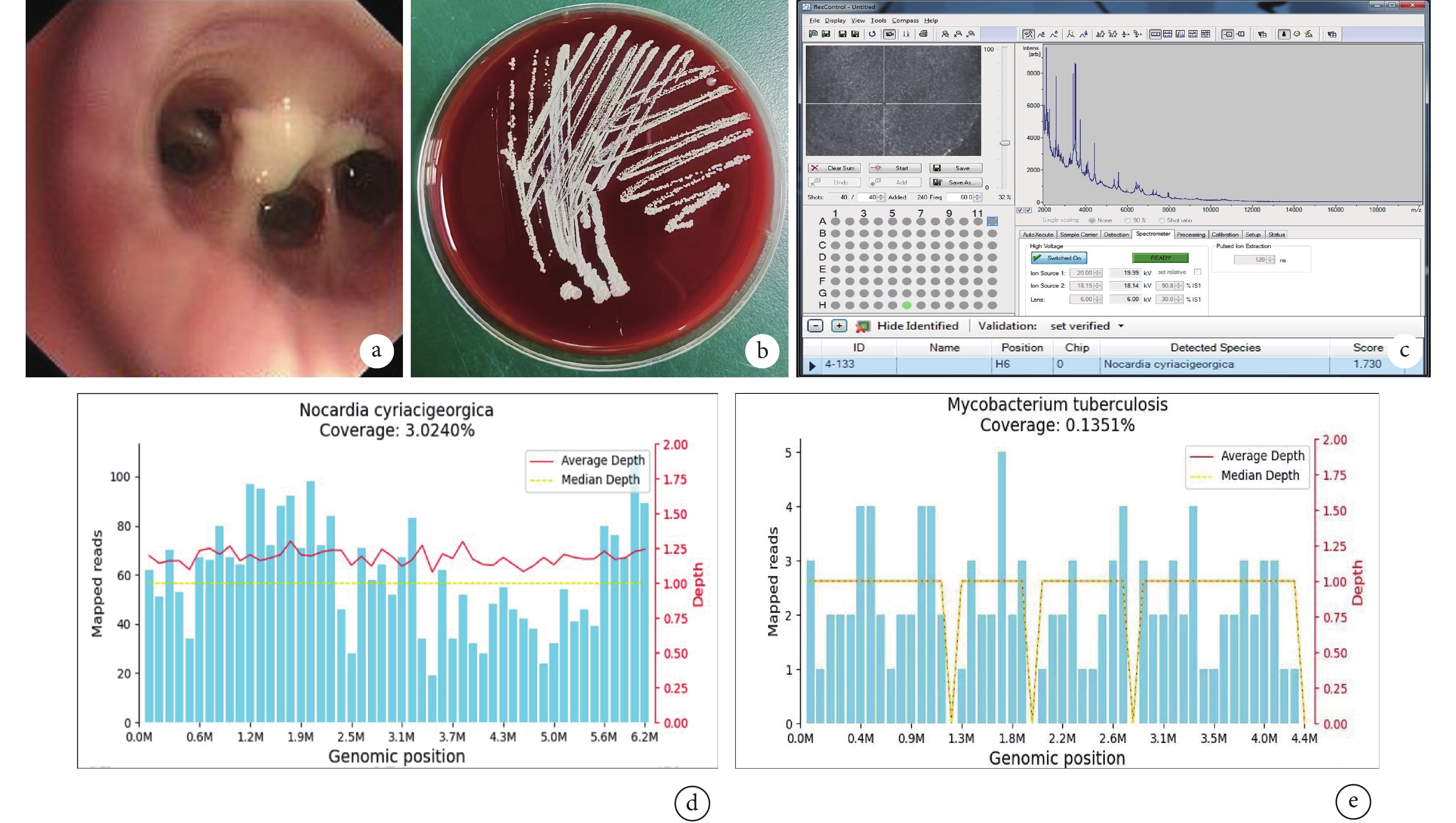
支氣管肺泡灌洗液病原微生物學檢查結果
圖2
支氣管肺泡灌洗液病原微生物學檢查結果
支氣管鏡檢查(2023年11月30日)顯示患者支氣管黏膜充血水腫,支氣管腔內可見膿性分泌物(圖a);肺泡灌洗液微生物培養1周后,血培養皿可見大量淡黃色菌落生長(圖b);質譜檢測(MALDI Biotyper微生物質譜快速鑒定系統),鑒定為圣喬治教堂諾卡菌(Score =1.73)(圖c);肺泡灌洗液宏基因組學二代測序檢測顯示圣喬治教堂諾卡菌序列數3 951(圖d),結核分枝桿菌復合群序列數295(圖e),鑒定置信度99%。
結合患者的臨床癥狀、影像學表現和微生物學檢測結果考慮患者為諾卡菌病合并活動性肺結核,給予出院帶藥復方磺胺甲惡唑片(0.96 g,4 次/d),同時給予異煙肼(0.3 g,1次/d)、利福平(0.45 g,1次/d)、吡嗪酰胺(0.5 g,3次/d)、乙胺丁醇(0.75 g,1次/d)抗癆治療。2周后門診隨訪,患者咳嗽、咳痰明顯減輕,無發熱,一般情況良好,復查白細胞7.6×109/L,中性粒細胞百分比62.6%,CRP 18.5 mg/L,肝腎功能在正常范圍,繼續目前抗感染治療。2個月后再次隨訪,患者無明顯咳嗽、咳痰,狀態良好,復查白細胞6.0×109/L,中性粒細胞百分比49.0%,CRP 4.45 mg/L;肝腎功能在正常范圍,丙氨酸氨基轉移酶17 U/L,天冬氨酸氨基轉移酶27 U/L,肌酐71 μmol/L,尿素6.5 mmol/L。
2 討論
諾卡菌分布廣泛,在水、土壤、衰敗的植被和動物群中廣泛傳播,可以附著于灰塵或生物氣溶膠而被吸入導致肺部感染,引起全身播散[4]。諾卡菌感染在免疫缺陷患者(包括實體器官和造血干細胞移植受體、實體腫瘤和血液系統惡性腫瘤患者以及HIV感染患者)中風險最高,其他風險因素包括全身/吸入皮質類固醇使用、糖尿病、慢性肺病(如慢性阻塞性肺病、支氣管擴張癥和囊性纖維化)等[2]。檢索國內外文獻發現,目前在新型冠狀病毒肺炎感染期間或感染后不久出現的諾卡菌病僅有少數病例報道。Stamos等[1]通過對已有的10例病例報告統計分析,發現這些患者都有易感染諾卡菌的風險因素,且在住院期間接受了糖皮質激素治療。本病例患者雖然為非免疫抑制宿主,但職業為農民,具有環境高危因素,并且在新型冠狀病毒感染患病期間曾使用全身激素治療,因此屬于諾卡菌感染的高危人群。此外,由于長期化膿性感染,肺泡灌洗液T細胞免疫分型顯示肺部CD4+輔助T細胞免疫功能低下,因此同時具有結核分枝桿菌感染的高危因素。
諾卡菌病患者的臨床表現通常非特異性,主要癥狀包括發燒、咳嗽、呼吸困難,有時還伴有胸痛;臨床征象包括白細胞增多和CRP升高[5-6]。在胸部高分辨CT中,肺諾卡菌病最常見的征象是肺結節或腫塊,此外胸腔積液、肺部滲出性病灶也可能存在。諾卡菌病診斷需要結合臨床和實驗室檢查[7]。對于不明原因慢性肺部感染患者,需要考慮諾卡菌感染可能性,在呼吸道標本(痰液或肺泡灌洗液)病原學檢測中應重點排查諾卡菌。諾卡菌的典型細菌涂片和革蘭染色表現為革蘭陽性桿菌,排列成細枝細絲狀,次級分枝可見菌絲呈90°分枝角,弱抗酸染色陽性。諾卡菌繁殖速度慢,一般需5~7天才可見白色或淡黃色菌落,菌落表面可出現皺褶。細菌培養耗時長,有時需要延長培養時間至2周,甚至需要先用氫氧化鈉殺死其他雜菌再進行培養,易延誤治療。PCR或宏基因測序等分子生物學技術可實現快速且高效的診斷效率[8]。諾卡菌物種鑒定的金標準是對16S rRNA,hsp65,secA1和sodA中的1個或2個基因進行擴增和測序。準確的物種鑒定有助于明確病原學診斷,提供精準抗感染治療的靶點[9]。
與諾卡菌病相似,結核分枝桿菌感染也常見于免疫損害患者。這兩種病原體的臨床癥狀無特異性差別,均可出現發熱、咳嗽、膿痰、體重減輕、乏力和盜汗等,因此在臨床實踐中經常被誤診[10]。影像學上兩者均可出現空洞,伴有壞死和組織破壞,也可伴有胸腔積液和肉芽腫,往往難以鑒別[11]。若既往肺結核治愈遺留肺部結構異常的患者感染諾卡菌,診斷則更加困難,常被誤認為結核病復發。諾卡菌采用結核分枝桿菌培養方法也可以生長,如果不仔細鑒定,耐藥性檢查結果和非結核分枝桿菌結果相似,又易誤診為非結核分枝桿菌感染。此外,結核合并諾卡菌感染時抗酸染色也可呈陽性,與單純結核感染時結果相似,易漏診諾卡菌感染[12]。共同感染的罕見性導致了一種病原體的發現可能會降低其他病原體存在的懷疑,明確診斷必須依靠病原學檢測結果。
本病例雖然通過肺泡灌洗液宏基因組測序發現大量結核分枝桿菌序列,但外周血T-SPOT.TB檢測結果卻為陰性,推測可能與患者肺泡灌洗液CD4+ T細胞比例明顯降低,影響肺組織感染部位淋巴細胞對結核分枝桿菌特異性免疫反應有關[3]。該患者新型冠狀病毒感染后呼吸屏障固有免疫反應功能障礙,隨后繼發諾卡菌慢性感染使肺組織長期處于化膿性炎癥狀態,上述感染引起的病理生理改變導致肺組織出現CD4+ T細胞耗竭。一方面使患者肺組織局部免疫功能低下,影響宿主控制潛在或新發結核分枝桿菌感染的能力,引起結核分枝桿菌從肉芽腫中逃逸并在肺內傳播,導致活動性肺結核[13];另一方面也干擾活動性肺結核免疫相關診斷結果,影響外周血釋放干擾素γ的結核特異性T淋巴細胞檢測,使T-SPOT.TB出現假陰性[14]。因此,對于諾卡菌病患者不應僅根據外周血免疫診斷結果排除結核分枝桿菌感染可能,而應重視肺部感染部位的病原學檢測結果。
目前諾卡菌感染在血清學方面尚沒有發現特異性指標。近年來多例病例報道諾卡菌病患者檢出β-D-葡聚糖血清水平升高[15]。雖然β-D-葡聚糖是真菌細胞壁的主要成份,但一些種類的諾卡菌(如星形諾卡菌、皮疽諾卡菌等)細胞壁也可能存在β-D-葡聚糖成份,從而引起交叉反應。此外,采用僅針對諾卡菌而對真菌無作用的抗生素(甲氧芐啶/磺胺甲惡唑)治療后,患者血清中的β-D-葡聚糖出現下降。本例患者β-D-葡聚糖也出現輕度升高(110 pg/mL),因此β-D-葡聚糖升高提示諾卡菌感染可能,但其臨床應用價值仍有待于相關臨床研究進一步證實。對于免疫功能受損人群,感染諾卡菌的主要危險因素是細胞免疫反應受損。人體免疫系統對諾卡菌的免疫反應始于單核巨噬細胞和中性粒細胞吞噬大部分細菌并抑制其生長,隨后需要活化T淋巴細胞直接接觸細菌導致其裂解,防止肺部或全身細菌播散,因此T細胞免疫功能受損患者更易感染諾卡菌。目前相關細胞免疫反應尚缺乏風險評估標準,建議在有條件的臨床實驗室進行淋巴細胞亞群檢測,包括總T細胞、CD4+ T細胞、CD8+ T細胞、NK細胞的比例及數量,開展相關風險評估研究。
磺胺類藥物是治療諾卡菌病的一線藥物,其中最常用復方磺胺甲噁唑(trimethoprim-sulfamethoxazole,TMP-SMX)[16]。TMP-SMX治療不良反應包括骨髓抑制,肝毒性和腎功能不全等[17]。對于抗結核治療臨床常用四聯療法:異煙肼、利福平、吡嗪酰胺和乙胺丁醇。這4種藥物通過不同作用機制發揮殺菌或抑菌作用[18]。藥物不良反應包括肝損害、高尿酸血癥、周圍神經病變等[19]。因此,對于多種病原體合并感染患者用藥時應更加謹慎,在聯合治療時注意監測患者血常規及肝腎功能,警惕不良反應發生。
以“新型冠狀病毒”“諾卡菌”及“結核”為檢索詞,通過中國知網和萬方數據庫進行中文文獻檢索;同時在PubMed數據庫以“COVID-19 AND (Nocardia OR Nocardiosis) AND (TB OR Mycobacterium tuberculosis)”為檢索詞進行英文文獻檢索,均暫時未檢索到類似本例新型冠狀病毒感染繼發諾卡菌合并結核分枝桿菌感染的病例報告。本例患者在新型冠狀病毒感染后出現長期反復發熱,通過肺泡灌洗液病原學檢測發現圣喬治教堂諾卡菌合并結核分枝桿菌感染。復習國內外相關文獻可知,諾卡菌臨床特征無特異性,影像學表現和肺結核相似,易出現誤診和漏診。因此,對于新型冠狀病毒感染后出現反復發熱患者,應注重基于分子生物學的病原微生物檢測,考慮是否存在諾卡菌合并結核分枝桿菌感染可能,避免漏診、誤診而延誤治療。
利益沖突:本研究不涉及任何利益沖突。
在新型冠狀病毒大流行期間,新型冠狀病毒感染患者繼發活動性肺結核常見,但同時合并諾卡菌病罕見[1]。諾卡菌屬于革蘭陽性需氧放線菌,抗酸染色呈弱陽性,主要感染免疫功能低下人群,其臨床癥狀、體征和影像學缺乏特異性,病原學培養增殖速度慢,容易漏診[2]。此外,諾卡菌導致慢性化膿性炎癥可使宿主肺部CD4+ T細胞免疫反應低下,從而干擾活動性肺結核的免疫學診斷結果[3]。本文報告了1例72歲女性在新型冠狀病毒感染后出現長期反復發熱,通過肺泡灌洗液宏基因組學二代基因測序發現圣喬治教堂諾卡菌合并結核分枝桿菌感染病例,并總結相關文獻。希望臨床醫師對于新型冠狀病毒感染后反復發熱患者在鑒別診斷中需要考慮是否存在諾卡菌病合并結核分枝桿菌感染可能,避免漏診、誤診而延誤治療。
1 臨床資料
患者女,72歲,因“反復咳嗽、咳痰伴發熱10個月余”于2023年11月25日入院。患者2023年1月5日因“咳嗽乏力10天”入住當地醫院,測體溫37.7℃,血常規顯示白細胞13.5×109/L、中性粒細胞百分比74.3%,C反應蛋白(C-reactive protein,CRP)54.43 mg/L,新型冠狀病毒核酸陽性。胸部CT顯示兩肺多發滲出性改變,肺底散在磨玻璃影,兩肺部分支氣管輕度擴張,右肺中葉局部支氣管狹窄(圖1a、b)。隨后氣管鏡檢查顯示兩側支氣管炎性改變。診斷為“新型冠狀病毒重癥感染”,予奈瑪特韋/利托那韋抗病毒、地塞米松抗炎以及頭孢哌酮舒巴坦抗感染和化痰平喘等對癥處理,經治療后患者癥狀好轉出院。出院后患者反復出現發熱,發熱時體溫波動于38~39℃,在當地予靜脈頭孢類抗生素抗感染治療1周后體溫可降至正常,但2~3周后又出現發熱,伴有咳嗽膿痰,上述癥狀反復發作,持續10個月余。11月22日患者再次出現發熱,體溫最高39℃,在當地醫院查白細胞18.0×109/L、中性粒細胞百分比68.7%、CRP 77.3 mg/L,胸部CT提示兩肺多發感染伴部分實變,予頭孢曲松聯合左氧氟沙星抗感染后體溫較前下降。11月25日患者到我院門診就診,復查血常規白細胞21.2×109/L,中性粒細胞百分比83.1%,CRP 74.1 mg/L。為求進一步診治,擬“發熱原因待查”收住入院。病程中患者無明顯腹痛、腹瀉、嘔吐等消化道癥狀,無明顯頭痛、暈厥、抽搐等神經系統癥狀,無明顯皮疹、關節疼痛、口干等結締組織疾病表現。患者既往否認慢性基礎疾病,職業為農民,無煙酒嗜好。
 圖1
胸部CT檢查像
圖1
胸部CT檢查像
新型冠狀病毒感染時,患者胸部CT(2023年1月12日)顯示部分支氣管輕度擴張,右肺中葉局部支氣管狹窄(圖a);兩肺多發炎癥性改變,雙側肺底散在磨玻璃影(圖b);新型冠狀病毒感染后患者出現反復發熱10月余,此次入院后患者胸部CT(2023年11月28日)顯示雙肺部分支氣管擴張,可見“樹芽征”,右肺上葉可見實變影伴周圍滲出,右肺中葉不張(圖c),雙側肺底散在斑片滲出灶(圖d)。
入院查體:體溫37.3℃,脈搏98 次/min,呼吸18次/min,血壓120/85 mm Hg(1 mm Hg=0.133 kPa),神志清,精神萎,全身皮膚未見皮疹,雙側鎖骨上未觸及腫大淋巴結,肺部聽診雙側肺底可聞及少許濕啰音,心臟及腹部未見異常,雙下肢未見水腫。
入院診斷:發熱原因待查(特殊病原體肺部感染?)
入院診治經過:患者入院前長期反復發熱伴有中性粒細胞和CRP升高,胸部CT提示滲出性病變,β-內酰胺類抗生素無法有效控制病情,首先考慮肺部特殊病原體感染可能。入院后積極完善感染相關檢查,紅細胞沉降率100 mm/h;降鈣素原正常范圍(0.05 ng/mL);呼吸道流感病原體IgM膠體金檢測顯示呼吸道合胞病毒弱陽性,甲流、乙流、副流感、肺炎支原體、肺炎衣原體、腺病毒和柯薩奇病毒B組均為陰性;新型冠狀病毒核酸檢測陰性;血液T-SPOT.TB檢測陰性;HIV抗體陰性;血液T/B/NK淋巴細胞計數顯示CD3、CD4、CD8、CD19、NK細胞計數均正常;痰真菌涂片未見孢子和菌絲,真菌培養白色酵母菌生長;痰濃縮集菌未找到抗酸桿菌;痰細菌涂片未見可疑細菌,痰微生物培養48 h正常菌群生長;β-D-葡聚糖110 pg/mL。
入院后給予氨芐西林舒巴坦(3 g,1次/8 h)聯合莫西沙星(0.4 g,1次/d)經驗性抗感染治療以及化痰、營養支持。由于感染相關檢測未有診斷提示意義,故予以復查胸部CT,顯示雙肺部分支氣管擴張,可見“樹芽征”,右肺上葉可見實變影伴周圍滲出,右肺中葉不張,雙側肺底散在斑片滲出灶(圖1c、d),隨后行支氣管鏡檢查,取支氣管肺泡灌洗液送檢。鏡下發現支氣管黏膜充血水腫,右側支氣管中葉以及雙側支氣管下葉基底段開口可見膿性分泌物(圖2a),于右側中葉支氣管開口予20 mL生理鹽水灌洗6次,混合后送檢。肺泡灌洗液細胞學檢查:黃色,非常渾濁,有核細胞計數8 000×106/L,中性粒細胞85%,肺泡巨噬細胞12%,淋巴細胞2%,嗜酸性粒細胞1%,糖原染色陰性,鐵染色查含鐵血黃素細胞陰性,特殊染色查耶氏肺孢子菌陰性,真菌、隱球菌涂片檢查未查見。肺泡灌洗液細胞因子測定顯示白細胞介素(interleukin,IL)-6為26.05 pg/mL↑、IL-8為4 589.48 pg/mL↑、IL-1β 為116.83 pg/mL↑、干擾素γ為5.76 pg/mL;肺泡灌洗液T細胞免疫分型顯示CD3+CD4+ (輔助/誘導T細胞)0.39%↓、CD3+CD38+(T細胞活化亞群)3.09%↓、CD4+CD28+(輔助T細胞功能亞群)0.39%↓、CD4–CD8– 39.99%(雙陰性T細胞)↑。與微生物室溝通,延長痰微生物培養時間,72 h后血瓊脂平板上可見淡黃色菌落生長(圖2b),經質譜鑒定為圣喬治教堂諾卡菌(MALDI Biotyper微生物質譜快速鑒定系統,Score=1.73,圖2c)。灌洗液宏基因組學二代基因測序顯示圣喬治諾卡菌(序列數3 951,圖2d)和結核分枝桿菌復合群(序列數295,圖2e)。
 圖2
支氣管肺泡灌洗液病原微生物學檢查結果
圖2
支氣管肺泡灌洗液病原微生物學檢查結果
支氣管鏡檢查(2023年11月30日)顯示患者支氣管黏膜充血水腫,支氣管腔內可見膿性分泌物(圖a);肺泡灌洗液微生物培養1周后,血培養皿可見大量淡黃色菌落生長(圖b);質譜檢測(MALDI Biotyper微生物質譜快速鑒定系統),鑒定為圣喬治教堂諾卡菌(Score =1.73)(圖c);肺泡灌洗液宏基因組學二代測序檢測顯示圣喬治教堂諾卡菌序列數3 951(圖d),結核分枝桿菌復合群序列數295(圖e),鑒定置信度99%。
結合患者的臨床癥狀、影像學表現和微生物學檢測結果考慮患者為諾卡菌病合并活動性肺結核,給予出院帶藥復方磺胺甲惡唑片(0.96 g,4 次/d),同時給予異煙肼(0.3 g,1次/d)、利福平(0.45 g,1次/d)、吡嗪酰胺(0.5 g,3次/d)、乙胺丁醇(0.75 g,1次/d)抗癆治療。2周后門診隨訪,患者咳嗽、咳痰明顯減輕,無發熱,一般情況良好,復查白細胞7.6×109/L,中性粒細胞百分比62.6%,CRP 18.5 mg/L,肝腎功能在正常范圍,繼續目前抗感染治療。2個月后再次隨訪,患者無明顯咳嗽、咳痰,狀態良好,復查白細胞6.0×109/L,中性粒細胞百分比49.0%,CRP 4.45 mg/L;肝腎功能在正常范圍,丙氨酸氨基轉移酶17 U/L,天冬氨酸氨基轉移酶27 U/L,肌酐71 μmol/L,尿素6.5 mmol/L。
2 討論
諾卡菌分布廣泛,在水、土壤、衰敗的植被和動物群中廣泛傳播,可以附著于灰塵或生物氣溶膠而被吸入導致肺部感染,引起全身播散[4]。諾卡菌感染在免疫缺陷患者(包括實體器官和造血干細胞移植受體、實體腫瘤和血液系統惡性腫瘤患者以及HIV感染患者)中風險最高,其他風險因素包括全身/吸入皮質類固醇使用、糖尿病、慢性肺病(如慢性阻塞性肺病、支氣管擴張癥和囊性纖維化)等[2]。檢索國內外文獻發現,目前在新型冠狀病毒肺炎感染期間或感染后不久出現的諾卡菌病僅有少數病例報道。Stamos等[1]通過對已有的10例病例報告統計分析,發現這些患者都有易感染諾卡菌的風險因素,且在住院期間接受了糖皮質激素治療。本病例患者雖然為非免疫抑制宿主,但職業為農民,具有環境高危因素,并且在新型冠狀病毒感染患病期間曾使用全身激素治療,因此屬于諾卡菌感染的高危人群。此外,由于長期化膿性感染,肺泡灌洗液T細胞免疫分型顯示肺部CD4+輔助T細胞免疫功能低下,因此同時具有結核分枝桿菌感染的高危因素。
諾卡菌病患者的臨床表現通常非特異性,主要癥狀包括發燒、咳嗽、呼吸困難,有時還伴有胸痛;臨床征象包括白細胞增多和CRP升高[5-6]。在胸部高分辨CT中,肺諾卡菌病最常見的征象是肺結節或腫塊,此外胸腔積液、肺部滲出性病灶也可能存在。諾卡菌病診斷需要結合臨床和實驗室檢查[7]。對于不明原因慢性肺部感染患者,需要考慮諾卡菌感染可能性,在呼吸道標本(痰液或肺泡灌洗液)病原學檢測中應重點排查諾卡菌。諾卡菌的典型細菌涂片和革蘭染色表現為革蘭陽性桿菌,排列成細枝細絲狀,次級分枝可見菌絲呈90°分枝角,弱抗酸染色陽性。諾卡菌繁殖速度慢,一般需5~7天才可見白色或淡黃色菌落,菌落表面可出現皺褶。細菌培養耗時長,有時需要延長培養時間至2周,甚至需要先用氫氧化鈉殺死其他雜菌再進行培養,易延誤治療。PCR或宏基因測序等分子生物學技術可實現快速且高效的診斷效率[8]。諾卡菌物種鑒定的金標準是對16S rRNA,hsp65,secA1和sodA中的1個或2個基因進行擴增和測序。準確的物種鑒定有助于明確病原學診斷,提供精準抗感染治療的靶點[9]。
與諾卡菌病相似,結核分枝桿菌感染也常見于免疫損害患者。這兩種病原體的臨床癥狀無特異性差別,均可出現發熱、咳嗽、膿痰、體重減輕、乏力和盜汗等,因此在臨床實踐中經常被誤診[10]。影像學上兩者均可出現空洞,伴有壞死和組織破壞,也可伴有胸腔積液和肉芽腫,往往難以鑒別[11]。若既往肺結核治愈遺留肺部結構異常的患者感染諾卡菌,診斷則更加困難,常被誤認為結核病復發。諾卡菌采用結核分枝桿菌培養方法也可以生長,如果不仔細鑒定,耐藥性檢查結果和非結核分枝桿菌結果相似,又易誤診為非結核分枝桿菌感染。此外,結核合并諾卡菌感染時抗酸染色也可呈陽性,與單純結核感染時結果相似,易漏診諾卡菌感染[12]。共同感染的罕見性導致了一種病原體的發現可能會降低其他病原體存在的懷疑,明確診斷必須依靠病原學檢測結果。
本病例雖然通過肺泡灌洗液宏基因組測序發現大量結核分枝桿菌序列,但外周血T-SPOT.TB檢測結果卻為陰性,推測可能與患者肺泡灌洗液CD4+ T細胞比例明顯降低,影響肺組織感染部位淋巴細胞對結核分枝桿菌特異性免疫反應有關[3]。該患者新型冠狀病毒感染后呼吸屏障固有免疫反應功能障礙,隨后繼發諾卡菌慢性感染使肺組織長期處于化膿性炎癥狀態,上述感染引起的病理生理改變導致肺組織出現CD4+ T細胞耗竭。一方面使患者肺組織局部免疫功能低下,影響宿主控制潛在或新發結核分枝桿菌感染的能力,引起結核分枝桿菌從肉芽腫中逃逸并在肺內傳播,導致活動性肺結核[13];另一方面也干擾活動性肺結核免疫相關診斷結果,影響外周血釋放干擾素γ的結核特異性T淋巴細胞檢測,使T-SPOT.TB出現假陰性[14]。因此,對于諾卡菌病患者不應僅根據外周血免疫診斷結果排除結核分枝桿菌感染可能,而應重視肺部感染部位的病原學檢測結果。
目前諾卡菌感染在血清學方面尚沒有發現特異性指標。近年來多例病例報道諾卡菌病患者檢出β-D-葡聚糖血清水平升高[15]。雖然β-D-葡聚糖是真菌細胞壁的主要成份,但一些種類的諾卡菌(如星形諾卡菌、皮疽諾卡菌等)細胞壁也可能存在β-D-葡聚糖成份,從而引起交叉反應。此外,采用僅針對諾卡菌而對真菌無作用的抗生素(甲氧芐啶/磺胺甲惡唑)治療后,患者血清中的β-D-葡聚糖出現下降。本例患者β-D-葡聚糖也出現輕度升高(110 pg/mL),因此β-D-葡聚糖升高提示諾卡菌感染可能,但其臨床應用價值仍有待于相關臨床研究進一步證實。對于免疫功能受損人群,感染諾卡菌的主要危險因素是細胞免疫反應受損。人體免疫系統對諾卡菌的免疫反應始于單核巨噬細胞和中性粒細胞吞噬大部分細菌并抑制其生長,隨后需要活化T淋巴細胞直接接觸細菌導致其裂解,防止肺部或全身細菌播散,因此T細胞免疫功能受損患者更易感染諾卡菌。目前相關細胞免疫反應尚缺乏風險評估標準,建議在有條件的臨床實驗室進行淋巴細胞亞群檢測,包括總T細胞、CD4+ T細胞、CD8+ T細胞、NK細胞的比例及數量,開展相關風險評估研究。
磺胺類藥物是治療諾卡菌病的一線藥物,其中最常用復方磺胺甲噁唑(trimethoprim-sulfamethoxazole,TMP-SMX)[16]。TMP-SMX治療不良反應包括骨髓抑制,肝毒性和腎功能不全等[17]。對于抗結核治療臨床常用四聯療法:異煙肼、利福平、吡嗪酰胺和乙胺丁醇。這4種藥物通過不同作用機制發揮殺菌或抑菌作用[18]。藥物不良反應包括肝損害、高尿酸血癥、周圍神經病變等[19]。因此,對于多種病原體合并感染患者用藥時應更加謹慎,在聯合治療時注意監測患者血常規及肝腎功能,警惕不良反應發生。
以“新型冠狀病毒”“諾卡菌”及“結核”為檢索詞,通過中國知網和萬方數據庫進行中文文獻檢索;同時在PubMed數據庫以“COVID-19 AND (Nocardia OR Nocardiosis) AND (TB OR Mycobacterium tuberculosis)”為檢索詞進行英文文獻檢索,均暫時未檢索到類似本例新型冠狀病毒感染繼發諾卡菌合并結核分枝桿菌感染的病例報告。本例患者在新型冠狀病毒感染后出現長期反復發熱,通過肺泡灌洗液病原學檢測發現圣喬治教堂諾卡菌合并結核分枝桿菌感染。復習國內外相關文獻可知,諾卡菌臨床特征無特異性,影像學表現和肺結核相似,易出現誤診和漏診。因此,對于新型冠狀病毒感染后出現反復發熱患者,應注重基于分子生物學的病原微生物檢測,考慮是否存在諾卡菌合并結核分枝桿菌感染可能,避免漏診、誤診而延誤治療。
利益沖突:本研究不涉及任何利益沖突。