引用本文: 陳旭, 陸光兵, 田良東. 胡黃連苷Ⅱ調節TXNIP/NLRP3信號通路對重癥肺炎大鼠肺泡上皮細胞焦亡的影響. 中國呼吸與危重監護雜志, 2024, 23(11): 791-796. doi: 10.7507/1671-6205.202403045 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
重癥肺炎是一種可由多種病原微生物引起的進展快、病情重、病死率高的肺部感染性疾病,發病時其肺組織產生大量的炎癥因子,炎癥因子過度激活從而引發全身炎癥反應,導致出現急性呼吸衰竭、低血壓甚至休克等癥狀,嚴重危及患者生命健康[1-2]。目前關于重癥肺炎的治療主要采用抗生素、祛痰、平喘止咳等藥物進行對癥治療,療效顯著性較差,且停用后易復發或病情加重,因此尋求新的重癥肺炎治療藥物迫在眉睫。胡黃連苷Ⅱ(picroside Ⅱ,PIC Ⅱ)是玄參科多年生草本植物胡黃連根莖的主要活性成分之一,具有抗炎、抗氧化、免疫調節、臟器保護等多種作用。研究顯示PIC Ⅱ可以通過減少炎癥因子的釋放,改善慢性阻塞性肺病患者炎癥癥狀[3]。硫氧還蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)/核苷酸結合寡聚化結構域樣受體蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)信號通路是參與炎癥及細胞焦亡的重要通路,抑制TXNIP/NLRP3通路可以減輕重癥肺炎大鼠肺損傷[4]。PIC Ⅱ能否通過調控TXNIP/NLRP3信號通路調控重癥肺炎尚不清楚。本研究主要探索PIC Ⅱ對重癥肺炎大鼠肺泡上皮細胞焦亡及TXNIP/NLRP3信號通路的影響,為重癥肺炎的治療提供理論依據。
1 材料與方法
1.1 材料
(200±20)g SPF級SD雄性大鼠購于中國醫學科學院醫學生物學研究所[生產許可證號SCXK(滇)K2022-0002],飼養在四川格林泰科生物科技有限公司實驗動物中心[SYXK(川)2023-0212]。本研究已獲得四川格林泰科生物科技有限公司動物倫理委員會的批準(審批號
PIC Ⅱ(大于98%,39012-20-9,購于上海博湖生物公司)。腫瘤壞死因子α(tumor necrosis factor α,TNF-α)(PT516)、白細胞介素-1β(interleukin-1β,IL-1β)(PI303)、白細胞介素-6(interleukin-6,IL-6)(PI328)ELISA試劑盒購于上海碧云天公司。蘇木精-伊紅染色(hematoxylin-eosin staining,HE)染色試劑盒(ZN1970-GFM)購于北京百奧萊博科技公司。半胱氨酸天冬氨酸蛋白酶1(cysteine aspartate protease 1,Caspase-1)(orb771336)抗體購于武漢博歐特生物公司。消皮素D(dermatin D,GSDMD)(36425)抗體購于美國Cell Signaling Technology公司。TXNIP(ab188865)、NLRP3(ab263899)、凋亡相關微粒蛋白(apoptosis-associated microprotein,ASC)(ab309497)抗體購于英國abcam公司。
1.2 方法
1.2.1 構建重癥肺炎大鼠模型
先將所有實驗大鼠適應性飼養1周,除對照組外所有大鼠經氣管穿刺注入0.3 mL肺炎克雷伯菌液,7 d后觀察大鼠若出現活動、進食明顯減少,口鼻分泌物增多,呼吸困難、肺部濕啰音等癥狀時,表示建模成功[5]。對照組注射等量的生理鹽水。
1.2.2 分組與處理
將所有實驗大鼠分為對照組,重癥肺炎組,PIC Ⅱ低、中、高劑量組(PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組)[6],以及PIC Ⅱ高劑量+TXNIP/NLRP3通路激活劑氧化三甲胺組(PIC Ⅱ-H+TMAO組)[4],每組30只大鼠。PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組:造模成功后,分別給予6.25、12.5、25 mg·kg–1·d–1 PIC Ⅱ灌胃處理;PIC Ⅱ-H+TMAO組:造模成功后,分別進行25 mg·kg–1·d–1 PIC Ⅱ及110 mg·kg–1·d–1氧化三甲胺灌胃處理;對照組與重癥肺炎組灌胃與PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組等量的生理鹽水;給藥持續8周。
1.2.3 炎癥水平檢測
各組隨機選擇10只大鼠麻醉處死,磷酸鹽緩沖液灌洗左肺,反復沖洗3次,混合溶液,2 500 r/min離心10 min,取上清,參照相應ELISA試劑盒說明書檢測TNF-α、IL-1β、IL-6水平。
1.2.4 炎癥細胞檢測
取上述肺泡灌洗液沉淀物,重懸,均勻涂抹在載玻片中央,干燥后瑞氏染色,干燥、封片,統計顯微鏡下選取200個細胞中嗜酸性粒細胞(eosinophil,EOS)、淋巴細胞(lymphocyte,LYM)、中性粒細胞(neutrophil,NEU)比例,檢測灌洗液中各細胞數。
1.2.5 肺組織病理檢查
從各組剩余大鼠隨機選擇10只麻醉處死,取出左肺組織清洗干凈,置于4%多聚甲醛中,常規石蠟包埋切片,再脫蠟水化,蘇木素染色,伊紅染色,二甲苯透明,樹脂封片,顯微鏡下觀察。
1.2.6 免疫組化
取1.2.5制作的大鼠肺組織石蠟切片,脫蠟復水,修復封閉,加入GSDMD、Caspase-1一抗孵育,再與二抗室溫共孵育,二氨基聯苯胺顯色,脫水透明封片后收集圖像并進行分析。
1.2.7 Western blot
將各組剩余10只大鼠麻醉處死,取出左肺組織,研碎加入裂解液裂解蛋白,提取總蛋白并檢測蛋白濃度。根據蛋白大小進行凝膠電泳、轉膜、封閉,先后分別與TXNIP(1∶1 000)、NLRP3(1∶1 000)、ASC(1∶1 000)、GADPH(1∶1 000)一抗及辣根過氧化物酶標記的二抗(1∶2 000)共孵育,電化學發光試劑顯影,熒光顯微鏡觀察拍照分析。
1.3 統計學方法
采用SPSS 25.0進行統計分析。呈正態分布的計量資料以均數±標準差(x±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 重癥肺炎大鼠模型的鑒定
穿刺氣管給予模型大鼠肺炎克雷伯菌溶液7 d后,可見模型大鼠精神萎靡,活動和進食明顯減少,口鼻分泌物增多,呼吸困難,肺部濕啰音。與對照組相比,模型組大鼠支氣管肺泡灌洗液中TNF-α[(402.39±45.27)pg/mL比(81.50±12.44)pg/mL]、IL-1β[(226.85±24.30)pg/mL比(40.72±7.31)pg/mL]、IL-6[(289.96±30.18)pg/mL比(57.25±8.60)pg/mL]和EOS[(4.80±0.52)×106/L比(0.26±0.04)×106/L]、LYM[(7.93±0.85)×106/L比(2.11±0.30)×106/L]、NEU[(6.07±0.63)×106/L比(1.30±0.21)×106/L]均升高(P<0.05)。HE染色結果顯示,與對照組相比,模型組大鼠肺組織肺泡壁增厚,肺泡內大量炎性細胞浸潤,結果見圖1。
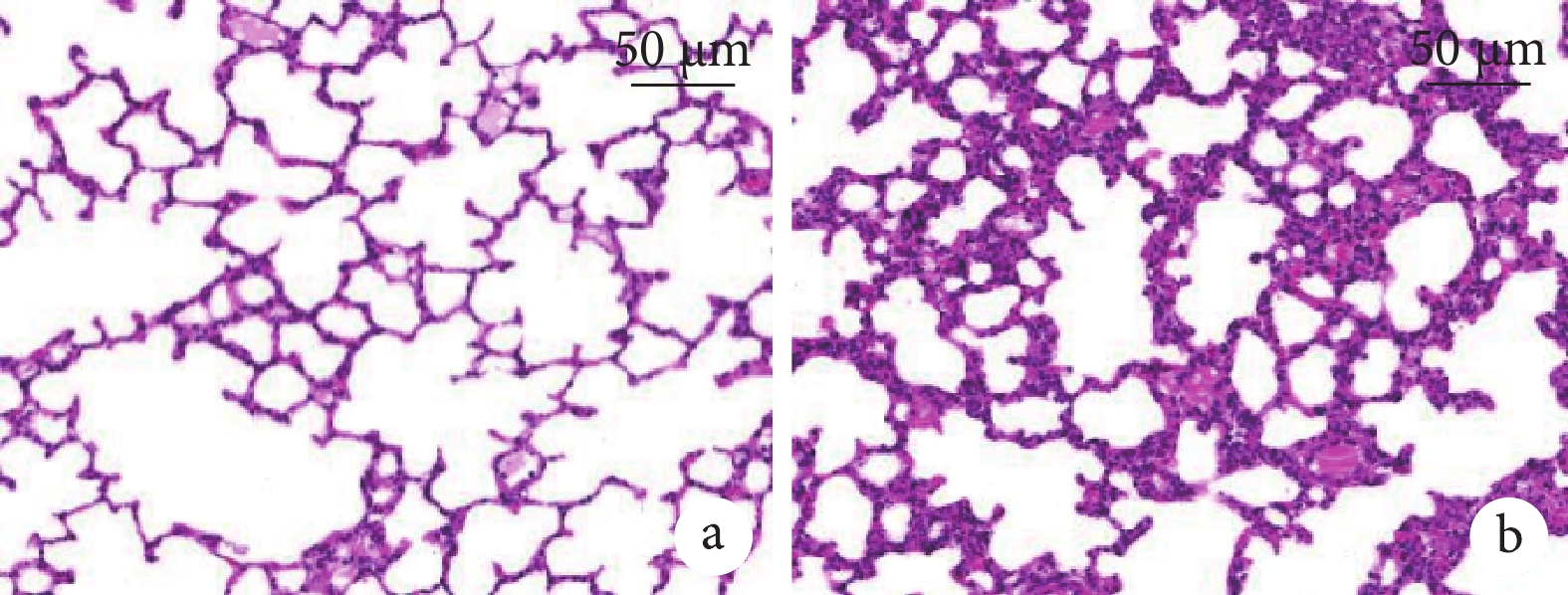 圖1
大鼠肺組織病理像(HE×200)
圖1
大鼠肺組織病理像(HE×200)
a. 對照組;b. 模型組:大鼠肺組織可見肺泡壁增厚,肺泡內大量炎性細胞浸潤。
2.2 PIC Ⅱ對重癥肺炎大鼠炎癥因子水平的影響
與對照組相比,重癥肺炎組大鼠TNF-α、IL-1β、IL-6水平升高(均P<0.05)。與重癥肺炎組相比,PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠TNF-α、IL-1β、IL-6水平依次降低(均P<0.05)。與PIC Ⅱ-H組相比,PIC Ⅱ-H+TMAO組大鼠TNF-α、IL-1β、IL-6水平升高(均P<0.05)。結果見表1。
2.3 PIC Ⅱ對重癥肺炎大鼠炎癥細胞數目的影響
與對照組相比,重癥肺炎組大鼠EOS、LYM、NEU細胞數目顯著升高(均P<0.05)。與重癥肺炎組相比,PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠EOS、LYM、NEU細胞數目依次顯著降低(均P<0.05)。與PIC Ⅱ-H組相比,PIC Ⅱ-H+TMAO組大鼠EOS、LYM、NEU細胞數目顯著升高(均P<0.05)。結果見表1。
2.4 PIC Ⅱ對重癥肺炎大鼠肺組織病理形態變化的影響
對照組大鼠肺組織正常,無炎性細胞浸潤。與對照組相比,重癥肺炎組大鼠肺組織損傷嚴重,有大量炎性細胞浸潤。與重癥肺炎組相比,PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠肺組織損傷依次顯著減輕,炎癥細胞浸潤逐漸減少。與PIC Ⅱ-H組相比,PIC Ⅱ-H+TMAO組大鼠肺組織損傷加重,炎性細胞浸潤顯著增加。結果見圖2。
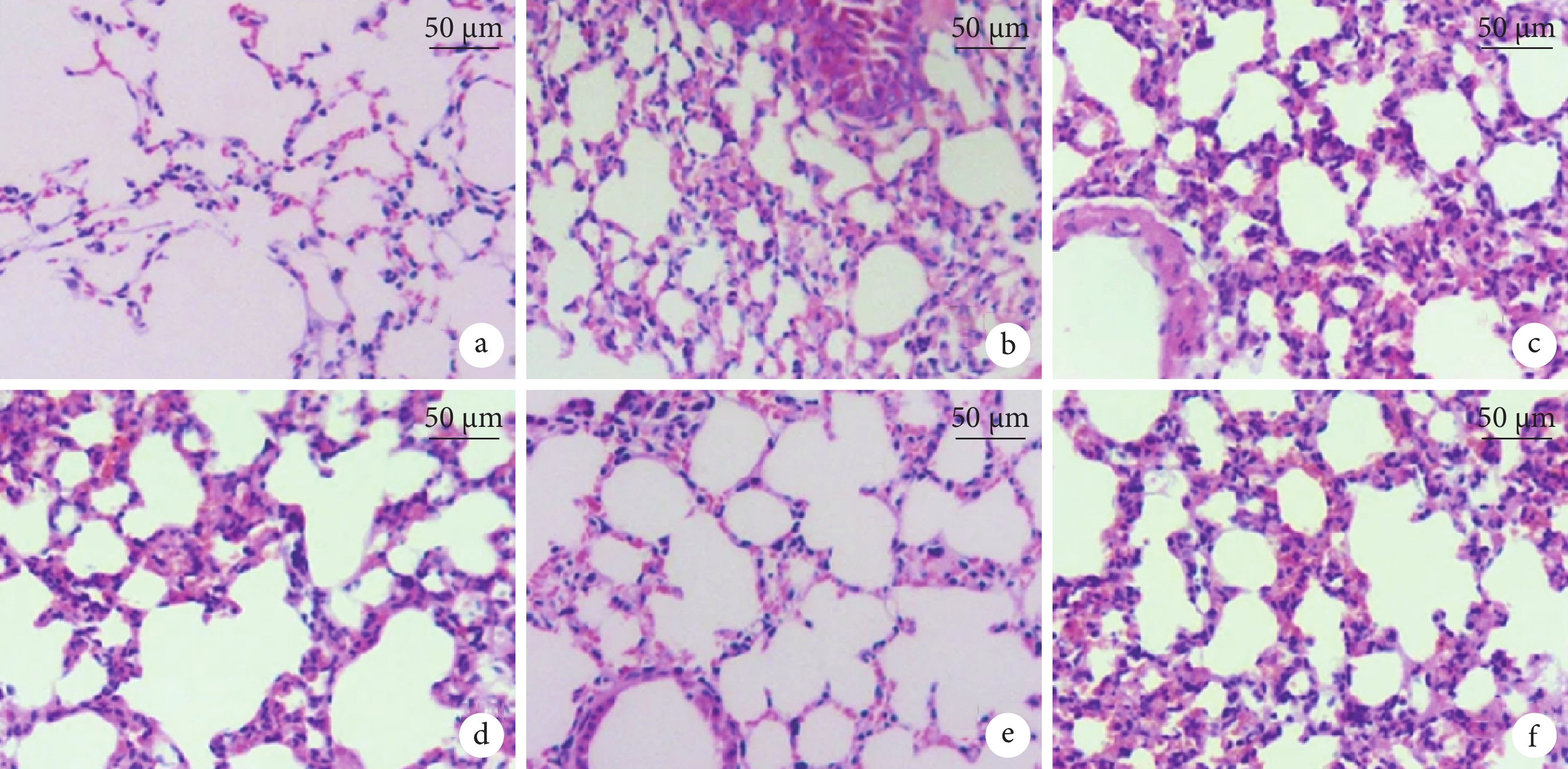 圖2
各組大鼠肺組織病理像(HE×200)
圖2
各組大鼠肺組織病理像(HE×200)
a. 對照組:肺組織正常,無炎性細胞浸潤;b. 重癥肺炎組:肺組織可見大量炎性細胞浸潤,肺組織損傷嚴重;c~e. PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠肺組織損傷減輕,炎癥細胞浸潤逐漸減少;f. PIC Ⅱ-H+TMAO組大鼠肺組織損傷加重,炎性細胞浸潤增加。
2.5 PIC Ⅱ對重癥肺炎大鼠焦亡相關蛋白水平的影響
與對照組相比,重癥肺炎組大鼠Caspase-1、GSDMD表達水平顯著升高(均P<0.05);與重癥肺炎組相比,PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠Caspase-1、GSDMD表達水平依次顯著降低(均P<0.05);與PIC Ⅱ-H組相比,PIC Ⅱ-H+TMAO組大鼠Caspase-1、GSDMD表達水平顯著升高(均P<0.05)。結果見圖3和表2。
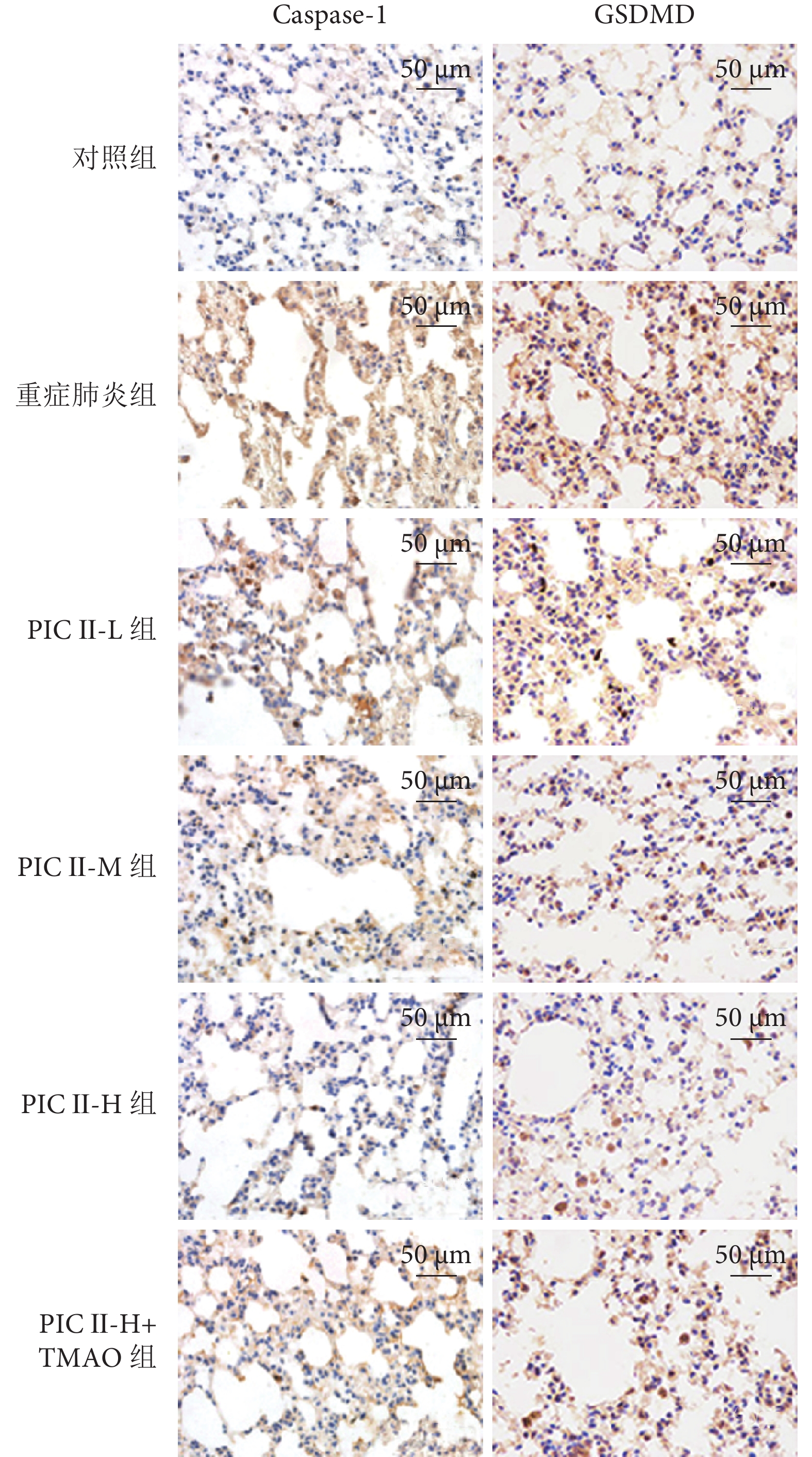 圖3
大鼠肺組織Caspase-1、GSDMD蛋白表達水平(免疫組化×200)
圖3
大鼠肺組織Caspase-1、GSDMD蛋白表達水平(免疫組化×200)
重癥肺炎組大鼠肺組織Caspase-1、GSDMD陽性表達較對照組增加;PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠肺組織Caspase-1、GSDMD陽性表達較重癥肺炎組減少;PIC Ⅱ-H+TMAO組大鼠肺組織Caspase-1、GSDMD陽性表達較PIC Ⅱ-H組增加。
2.6 PIC Ⅱ對TXNIP/NLRP3信號通路的影響
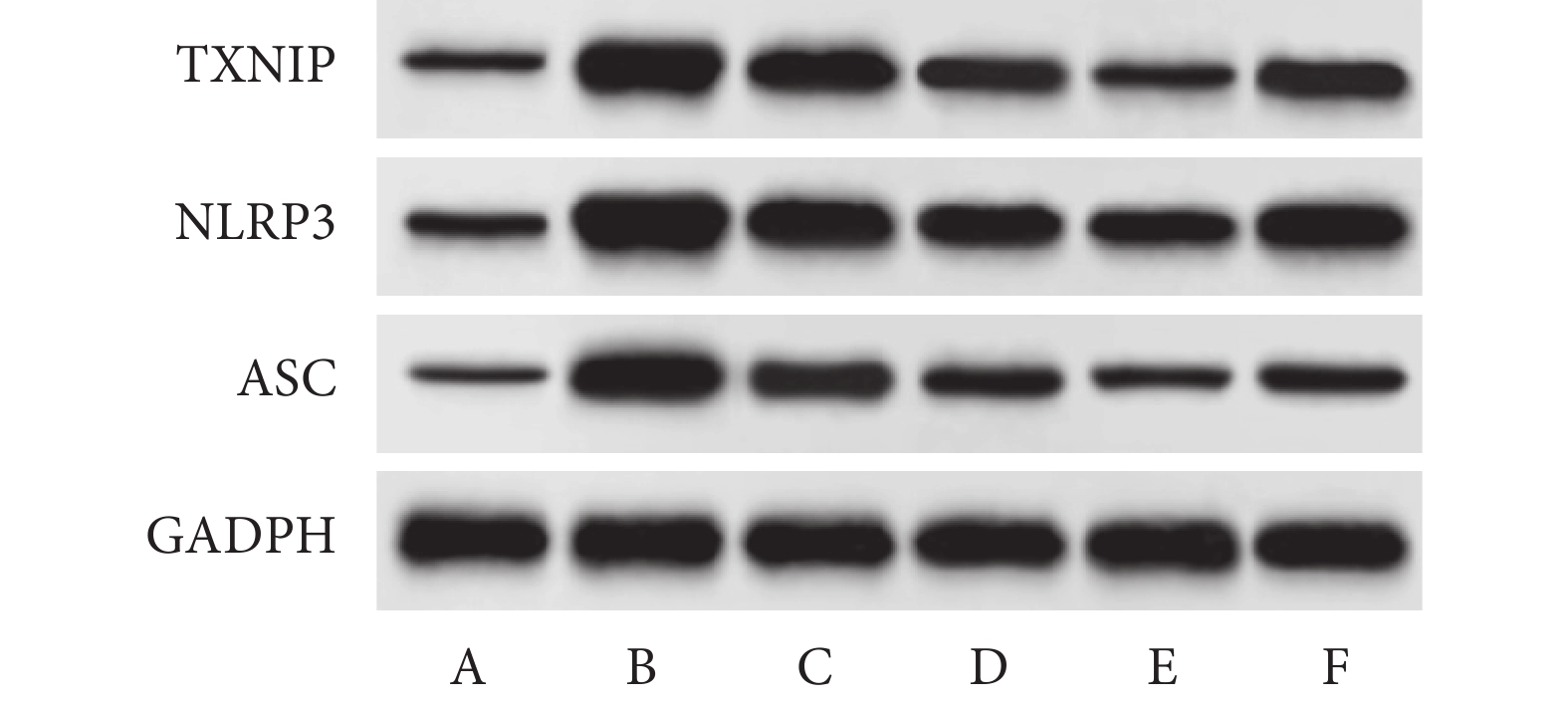
與對照組相比,重癥肺炎組大鼠TXNIP、NLRP3、ASC表達升高(均P<0.05)。與重癥肺炎組相比,PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠TXNIP、NLRP3、ASC表達依次降低(均P<0.05)。與PIC Ⅱ-H組相比,PIC Ⅱ-H+TMAO組大鼠TXNIP、NLRP3、ASC表達升高(均P<0.05)。結果見圖4和表3。
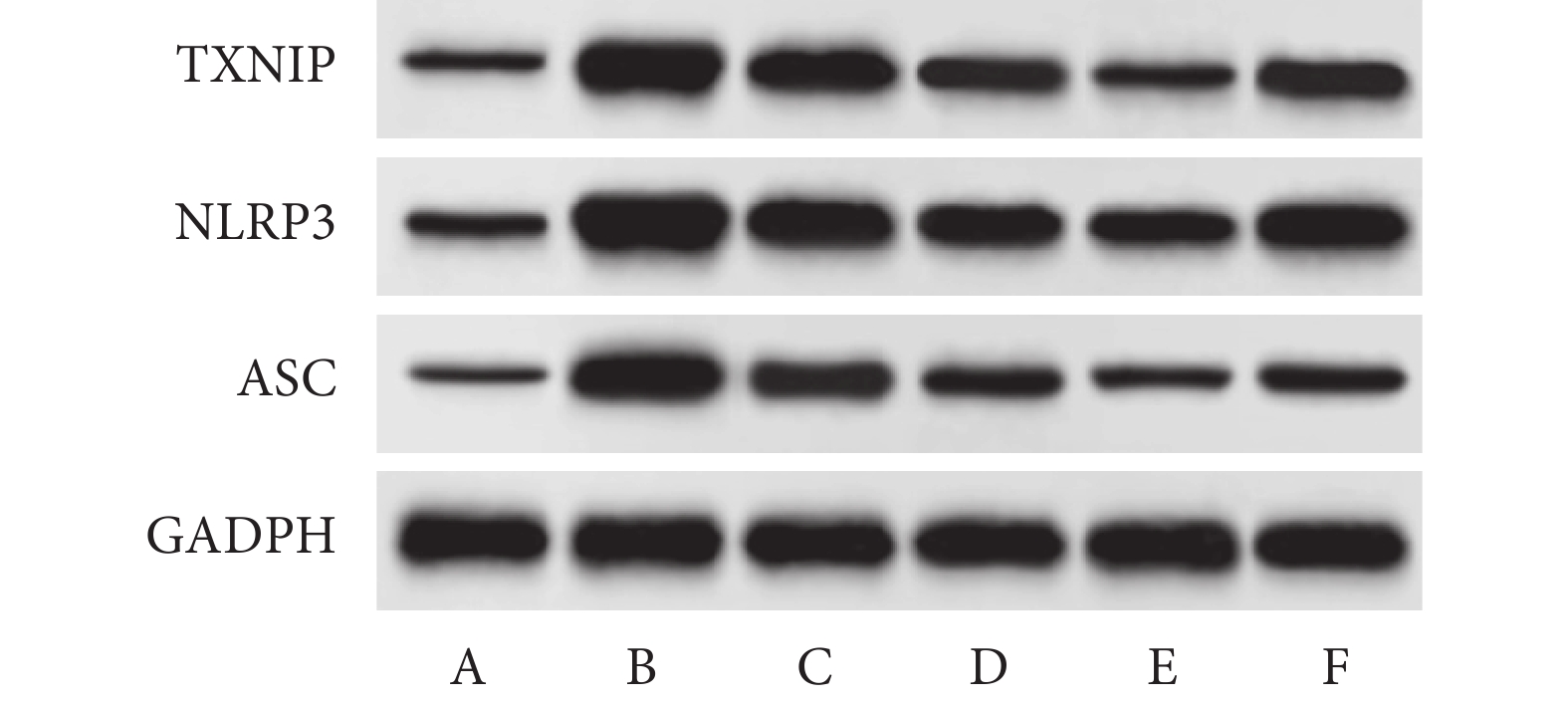 圖4
Western blot檢測TXNIP、NLRP3、ASC蛋白表達
圖4
Western blot檢測TXNIP、NLRP3、ASC蛋白表達
A. 對照組;B. 重癥肺炎組;C. PIC Ⅱ-L組;D. PIC Ⅱ-M組;E. PIC Ⅱ-H組;F. PIC Ⅱ-H+TMAO組。
3 討論
肺炎主要是由細菌、病毒等病原體感染肺部引起的肺泡、肺間質炎癥性疾病,其中肺部炎癥程度及其擴散程度等影響肺炎嚴重程度,癥狀有嚴重的低氧血癥、低血壓、急性呼吸衰竭等現象,嚴重威脅人類生命健康[7]。因此,抗炎治療成為治療重癥肺炎的關鍵。然而目前常用的抗菌藥物雖然可以減輕機體炎癥,緩解呼吸困難等癥狀,但因其易產生耐藥性,而導致治療效果不佳,所以尋求新的治療藥物至關重要。PIC Ⅱ是一種環烯醚萜苷類化合物,對于抗炎及臟器保護具有重要作用,其中包括肺臟[8]。研究顯示PIC Ⅱ可以通過抑制NLRP3炎癥小體的激活抑制炎癥反應發揮抗動脈粥硬化作用[9]。PIC Ⅱ還可以通過降低炎癥因子釋放及氧化應激水平,抑制腎缺血再灌注損傷引起的炎癥及氧化應激反應,減輕腎損傷[10]。本研究顯示,PIC Ⅱ可以減少重癥肺炎大鼠肺組織炎性細胞浸潤,改善肺損傷。
重癥肺炎的發展與肺組織炎性發展密不可分,其中炎癥細胞的聚集及炎癥因子釋放是其關鍵因素。當機體受到刺激,激活EOS、LYM、NEU等炎癥細胞在肺部大量聚集,并釋放大量的TNF?α、IL?1β、IL?6等炎性因子,加重炎癥反應。研究發現減少EOS、LYM、NEU等炎癥細胞數目,降低TNF?α、IL?1β、IL?6水平,可以減輕慢性阻塞性肺病大鼠的氣道炎性反應,從而減輕肺損傷[11]。本研究顯示PIC Ⅱ可以降低EOS、LYM、NEU細胞數目,降低TNF?α、IL?1β、IL?6水平,說明PIC Ⅱ可以通過降低炎癥反應,改善重癥肺炎大鼠肺損傷。
細胞焦亡是一種炎癥形式的程序性細胞死亡,在感染、炎癥及免疫性疾病中均發揮著重要作用。在細胞焦亡過程中,NLRP3炎癥小體通過激活Caspase-1,誘導GSDMD依賴性細胞焦亡,進而促進TNF?α、IL?1β、IL?6等炎性因子的釋放[12]。其中功能蛋白GSDMD是細胞焦亡及炎性小體活化的標志物,其水平升高可導致肺組織細胞焦亡,造成肺損傷[13]。研究發現抑制Caspase-1、GSDMD蛋白表達,可以抑制LPS誘導的小鼠肺組織細胞焦亡,改善急性肺損傷癥狀[14];下調Caspase-1、GSDMD蛋白表達水平,可以減輕膿毒癥大鼠肺組織炎癥,減輕肺組織細胞焦亡及肺損傷,保護肺功能[15]。本研究顯示PIC Ⅱ可以下調Caspase-1、GSDMD蛋白表達水平,說明PIC Ⅱ可以通過減輕肺組織細胞焦亡,減輕肺損傷。
TXNIP/NLRP3通路與炎癥及焦亡息息相關。當機體遭受病原菌感染,促使其釋放大量的活性氧,過度活性氧促進TXNIP的表達,進而誘發NLRP3炎癥小體的激活及后續相關炎癥因子的大量釋放,加重炎癥反應,引發細胞焦亡[16]。其中NLRP3炎癥小體是細胞焦亡啟動的關鍵環節,它是由傳感分子先天免疫受體蛋白NLRP3、接頭蛋白ASC和炎性蛋白酶Caspase-1組成,激活NLRP3通過ASC招募Caspase-1,使其活化,促進炎性因子釋放,加劇炎癥反應,引發細胞焦亡[17]。而抑制TXNIP/NLRP3通路,可以減少細胞內炎性因子的釋放,抑制炎癥反應及細胞焦亡,保護肺損傷[18-19]。本研究顯示PIC Ⅱ可以下調TXNIP、NLRP3、ASC表達水平,推測PIC Ⅱ可以通過抑制TXNIP/NLRP3通路抑制重癥肺炎大鼠肺泡上皮細胞焦亡。為證實這一猜測,我們對重癥肺炎大鼠進行PIC Ⅱ高劑量處理基礎上增加TMAO處理,TMAO可逆轉PIC Ⅱ對重癥肺炎大鼠肺損傷的保護作用,證實PIC Ⅱ可以通過抑制TXNIP/NLRP3通路抑制重癥肺炎大鼠肺泡上皮細胞焦亡。
綜上所述,PIC Ⅱ通過抑制TXNIP/NLRP3通路抑制重癥肺炎大鼠肺泡上皮細胞焦亡。本研究為PIC Ⅱ治療重癥肺炎提供了理論依據,對重癥肺炎新型治療藥物的開發和重癥肺炎的治療具有重要意義。然而PIC Ⅱ的作用機制復雜,是否調控其他通路發揮作用尚不清楚,仍需進一步研究。
利益沖突:本研究不涉及任何利益沖突。
重癥肺炎是一種可由多種病原微生物引起的進展快、病情重、病死率高的肺部感染性疾病,發病時其肺組織產生大量的炎癥因子,炎癥因子過度激活從而引發全身炎癥反應,導致出現急性呼吸衰竭、低血壓甚至休克等癥狀,嚴重危及患者生命健康[1-2]。目前關于重癥肺炎的治療主要采用抗生素、祛痰、平喘止咳等藥物進行對癥治療,療效顯著性較差,且停用后易復發或病情加重,因此尋求新的重癥肺炎治療藥物迫在眉睫。胡黃連苷Ⅱ(picroside Ⅱ,PIC Ⅱ)是玄參科多年生草本植物胡黃連根莖的主要活性成分之一,具有抗炎、抗氧化、免疫調節、臟器保護等多種作用。研究顯示PIC Ⅱ可以通過減少炎癥因子的釋放,改善慢性阻塞性肺病患者炎癥癥狀[3]。硫氧還蛋白相互作用蛋白(thioredoxin-interacting protein,TXNIP)/核苷酸結合寡聚化結構域樣受體蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)信號通路是參與炎癥及細胞焦亡的重要通路,抑制TXNIP/NLRP3通路可以減輕重癥肺炎大鼠肺損傷[4]。PIC Ⅱ能否通過調控TXNIP/NLRP3信號通路調控重癥肺炎尚不清楚。本研究主要探索PIC Ⅱ對重癥肺炎大鼠肺泡上皮細胞焦亡及TXNIP/NLRP3信號通路的影響,為重癥肺炎的治療提供理論依據。
1 材料與方法
1.1 材料
(200±20)g SPF級SD雄性大鼠購于中國醫學科學院醫學生物學研究所[生產許可證號SCXK(滇)K2022-0002],飼養在四川格林泰科生物科技有限公司實驗動物中心[SYXK(川)2023-0212]。本研究已獲得四川格林泰科生物科技有限公司動物倫理委員會的批準(審批號
PIC Ⅱ(大于98%,39012-20-9,購于上海博湖生物公司)。腫瘤壞死因子α(tumor necrosis factor α,TNF-α)(PT516)、白細胞介素-1β(interleukin-1β,IL-1β)(PI303)、白細胞介素-6(interleukin-6,IL-6)(PI328)ELISA試劑盒購于上海碧云天公司。蘇木精-伊紅染色(hematoxylin-eosin staining,HE)染色試劑盒(ZN1970-GFM)購于北京百奧萊博科技公司。半胱氨酸天冬氨酸蛋白酶1(cysteine aspartate protease 1,Caspase-1)(orb771336)抗體購于武漢博歐特生物公司。消皮素D(dermatin D,GSDMD)(36425)抗體購于美國Cell Signaling Technology公司。TXNIP(ab188865)、NLRP3(ab263899)、凋亡相關微粒蛋白(apoptosis-associated microprotein,ASC)(ab309497)抗體購于英國abcam公司。
1.2 方法
1.2.1 構建重癥肺炎大鼠模型
先將所有實驗大鼠適應性飼養1周,除對照組外所有大鼠經氣管穿刺注入0.3 mL肺炎克雷伯菌液,7 d后觀察大鼠若出現活動、進食明顯減少,口鼻分泌物增多,呼吸困難、肺部濕啰音等癥狀時,表示建模成功[5]。對照組注射等量的生理鹽水。
1.2.2 分組與處理
將所有實驗大鼠分為對照組,重癥肺炎組,PIC Ⅱ低、中、高劑量組(PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組)[6],以及PIC Ⅱ高劑量+TXNIP/NLRP3通路激活劑氧化三甲胺組(PIC Ⅱ-H+TMAO組)[4],每組30只大鼠。PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組:造模成功后,分別給予6.25、12.5、25 mg·kg–1·d–1 PIC Ⅱ灌胃處理;PIC Ⅱ-H+TMAO組:造模成功后,分別進行25 mg·kg–1·d–1 PIC Ⅱ及110 mg·kg–1·d–1氧化三甲胺灌胃處理;對照組與重癥肺炎組灌胃與PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組等量的生理鹽水;給藥持續8周。
1.2.3 炎癥水平檢測
各組隨機選擇10只大鼠麻醉處死,磷酸鹽緩沖液灌洗左肺,反復沖洗3次,混合溶液,2 500 r/min離心10 min,取上清,參照相應ELISA試劑盒說明書檢測TNF-α、IL-1β、IL-6水平。
1.2.4 炎癥細胞檢測
取上述肺泡灌洗液沉淀物,重懸,均勻涂抹在載玻片中央,干燥后瑞氏染色,干燥、封片,統計顯微鏡下選取200個細胞中嗜酸性粒細胞(eosinophil,EOS)、淋巴細胞(lymphocyte,LYM)、中性粒細胞(neutrophil,NEU)比例,檢測灌洗液中各細胞數。
1.2.5 肺組織病理檢查
從各組剩余大鼠隨機選擇10只麻醉處死,取出左肺組織清洗干凈,置于4%多聚甲醛中,常規石蠟包埋切片,再脫蠟水化,蘇木素染色,伊紅染色,二甲苯透明,樹脂封片,顯微鏡下觀察。
1.2.6 免疫組化
取1.2.5制作的大鼠肺組織石蠟切片,脫蠟復水,修復封閉,加入GSDMD、Caspase-1一抗孵育,再與二抗室溫共孵育,二氨基聯苯胺顯色,脫水透明封片后收集圖像并進行分析。
1.2.7 Western blot
將各組剩余10只大鼠麻醉處死,取出左肺組織,研碎加入裂解液裂解蛋白,提取總蛋白并檢測蛋白濃度。根據蛋白大小進行凝膠電泳、轉膜、封閉,先后分別與TXNIP(1∶1 000)、NLRP3(1∶1 000)、ASC(1∶1 000)、GADPH(1∶1 000)一抗及辣根過氧化物酶標記的二抗(1∶2 000)共孵育,電化學發光試劑顯影,熒光顯微鏡觀察拍照分析。
1.3 統計學方法
采用SPSS 25.0進行統計分析。呈正態分布的計量資料以均數±標準差(x±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 重癥肺炎大鼠模型的鑒定
穿刺氣管給予模型大鼠肺炎克雷伯菌溶液7 d后,可見模型大鼠精神萎靡,活動和進食明顯減少,口鼻分泌物增多,呼吸困難,肺部濕啰音。與對照組相比,模型組大鼠支氣管肺泡灌洗液中TNF-α[(402.39±45.27)pg/mL比(81.50±12.44)pg/mL]、IL-1β[(226.85±24.30)pg/mL比(40.72±7.31)pg/mL]、IL-6[(289.96±30.18)pg/mL比(57.25±8.60)pg/mL]和EOS[(4.80±0.52)×106/L比(0.26±0.04)×106/L]、LYM[(7.93±0.85)×106/L比(2.11±0.30)×106/L]、NEU[(6.07±0.63)×106/L比(1.30±0.21)×106/L]均升高(P<0.05)。HE染色結果顯示,與對照組相比,模型組大鼠肺組織肺泡壁增厚,肺泡內大量炎性細胞浸潤,結果見圖1。
 圖1
大鼠肺組織病理像(HE×200)
圖1
大鼠肺組織病理像(HE×200)
a. 對照組;b. 模型組:大鼠肺組織可見肺泡壁增厚,肺泡內大量炎性細胞浸潤。
2.2 PIC Ⅱ對重癥肺炎大鼠炎癥因子水平的影響
與對照組相比,重癥肺炎組大鼠TNF-α、IL-1β、IL-6水平升高(均P<0.05)。與重癥肺炎組相比,PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠TNF-α、IL-1β、IL-6水平依次降低(均P<0.05)。與PIC Ⅱ-H組相比,PIC Ⅱ-H+TMAO組大鼠TNF-α、IL-1β、IL-6水平升高(均P<0.05)。結果見表1。
2.3 PIC Ⅱ對重癥肺炎大鼠炎癥細胞數目的影響
與對照組相比,重癥肺炎組大鼠EOS、LYM、NEU細胞數目顯著升高(均P<0.05)。與重癥肺炎組相比,PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠EOS、LYM、NEU細胞數目依次顯著降低(均P<0.05)。與PIC Ⅱ-H組相比,PIC Ⅱ-H+TMAO組大鼠EOS、LYM、NEU細胞數目顯著升高(均P<0.05)。結果見表1。
2.4 PIC Ⅱ對重癥肺炎大鼠肺組織病理形態變化的影響
對照組大鼠肺組織正常,無炎性細胞浸潤。與對照組相比,重癥肺炎組大鼠肺組織損傷嚴重,有大量炎性細胞浸潤。與重癥肺炎組相比,PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠肺組織損傷依次顯著減輕,炎癥細胞浸潤逐漸減少。與PIC Ⅱ-H組相比,PIC Ⅱ-H+TMAO組大鼠肺組織損傷加重,炎性細胞浸潤顯著增加。結果見圖2。
 圖2
各組大鼠肺組織病理像(HE×200)
圖2
各組大鼠肺組織病理像(HE×200)
a. 對照組:肺組織正常,無炎性細胞浸潤;b. 重癥肺炎組:肺組織可見大量炎性細胞浸潤,肺組織損傷嚴重;c~e. PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠肺組織損傷減輕,炎癥細胞浸潤逐漸減少;f. PIC Ⅱ-H+TMAO組大鼠肺組織損傷加重,炎性細胞浸潤增加。
2.5 PIC Ⅱ對重癥肺炎大鼠焦亡相關蛋白水平的影響
與對照組相比,重癥肺炎組大鼠Caspase-1、GSDMD表達水平顯著升高(均P<0.05);與重癥肺炎組相比,PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠Caspase-1、GSDMD表達水平依次顯著降低(均P<0.05);與PIC Ⅱ-H組相比,PIC Ⅱ-H+TMAO組大鼠Caspase-1、GSDMD表達水平顯著升高(均P<0.05)。結果見圖3和表2。
 圖3
大鼠肺組織Caspase-1、GSDMD蛋白表達水平(免疫組化×200)
圖3
大鼠肺組織Caspase-1、GSDMD蛋白表達水平(免疫組化×200)
重癥肺炎組大鼠肺組織Caspase-1、GSDMD陽性表達較對照組增加;PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠肺組織Caspase-1、GSDMD陽性表達較重癥肺炎組減少;PIC Ⅱ-H+TMAO組大鼠肺組織Caspase-1、GSDMD陽性表達較PIC Ⅱ-H組增加。
2.6 PIC Ⅱ對TXNIP/NLRP3信號通路的影響
與對照組相比,重癥肺炎組大鼠TXNIP、NLRP3、ASC表達升高(均P<0.05)。與重癥肺炎組相比,PIC Ⅱ-L、PIC Ⅱ-M、PIC Ⅱ-H組大鼠TXNIP、NLRP3、ASC表達依次降低(均P<0.05)。與PIC Ⅱ-H組相比,PIC Ⅱ-H+TMAO組大鼠TXNIP、NLRP3、ASC表達升高(均P<0.05)。結果見圖4和表3。
 圖4
Western blot檢測TXNIP、NLRP3、ASC蛋白表達
圖4
Western blot檢測TXNIP、NLRP3、ASC蛋白表達
A. 對照組;B. 重癥肺炎組;C. PIC Ⅱ-L組;D. PIC Ⅱ-M組;E. PIC Ⅱ-H組;F. PIC Ⅱ-H+TMAO組。
3 討論
肺炎主要是由細菌、病毒等病原體感染肺部引起的肺泡、肺間質炎癥性疾病,其中肺部炎癥程度及其擴散程度等影響肺炎嚴重程度,癥狀有嚴重的低氧血癥、低血壓、急性呼吸衰竭等現象,嚴重威脅人類生命健康[7]。因此,抗炎治療成為治療重癥肺炎的關鍵。然而目前常用的抗菌藥物雖然可以減輕機體炎癥,緩解呼吸困難等癥狀,但因其易產生耐藥性,而導致治療效果不佳,所以尋求新的治療藥物至關重要。PIC Ⅱ是一種環烯醚萜苷類化合物,對于抗炎及臟器保護具有重要作用,其中包括肺臟[8]。研究顯示PIC Ⅱ可以通過抑制NLRP3炎癥小體的激活抑制炎癥反應發揮抗動脈粥硬化作用[9]。PIC Ⅱ還可以通過降低炎癥因子釋放及氧化應激水平,抑制腎缺血再灌注損傷引起的炎癥及氧化應激反應,減輕腎損傷[10]。本研究顯示,PIC Ⅱ可以減少重癥肺炎大鼠肺組織炎性細胞浸潤,改善肺損傷。
重癥肺炎的發展與肺組織炎性發展密不可分,其中炎癥細胞的聚集及炎癥因子釋放是其關鍵因素。當機體受到刺激,激活EOS、LYM、NEU等炎癥細胞在肺部大量聚集,并釋放大量的TNF?α、IL?1β、IL?6等炎性因子,加重炎癥反應。研究發現減少EOS、LYM、NEU等炎癥細胞數目,降低TNF?α、IL?1β、IL?6水平,可以減輕慢性阻塞性肺病大鼠的氣道炎性反應,從而減輕肺損傷[11]。本研究顯示PIC Ⅱ可以降低EOS、LYM、NEU細胞數目,降低TNF?α、IL?1β、IL?6水平,說明PIC Ⅱ可以通過降低炎癥反應,改善重癥肺炎大鼠肺損傷。
細胞焦亡是一種炎癥形式的程序性細胞死亡,在感染、炎癥及免疫性疾病中均發揮著重要作用。在細胞焦亡過程中,NLRP3炎癥小體通過激活Caspase-1,誘導GSDMD依賴性細胞焦亡,進而促進TNF?α、IL?1β、IL?6等炎性因子的釋放[12]。其中功能蛋白GSDMD是細胞焦亡及炎性小體活化的標志物,其水平升高可導致肺組織細胞焦亡,造成肺損傷[13]。研究發現抑制Caspase-1、GSDMD蛋白表達,可以抑制LPS誘導的小鼠肺組織細胞焦亡,改善急性肺損傷癥狀[14];下調Caspase-1、GSDMD蛋白表達水平,可以減輕膿毒癥大鼠肺組織炎癥,減輕肺組織細胞焦亡及肺損傷,保護肺功能[15]。本研究顯示PIC Ⅱ可以下調Caspase-1、GSDMD蛋白表達水平,說明PIC Ⅱ可以通過減輕肺組織細胞焦亡,減輕肺損傷。
TXNIP/NLRP3通路與炎癥及焦亡息息相關。當機體遭受病原菌感染,促使其釋放大量的活性氧,過度活性氧促進TXNIP的表達,進而誘發NLRP3炎癥小體的激活及后續相關炎癥因子的大量釋放,加重炎癥反應,引發細胞焦亡[16]。其中NLRP3炎癥小體是細胞焦亡啟動的關鍵環節,它是由傳感分子先天免疫受體蛋白NLRP3、接頭蛋白ASC和炎性蛋白酶Caspase-1組成,激活NLRP3通過ASC招募Caspase-1,使其活化,促進炎性因子釋放,加劇炎癥反應,引發細胞焦亡[17]。而抑制TXNIP/NLRP3通路,可以減少細胞內炎性因子的釋放,抑制炎癥反應及細胞焦亡,保護肺損傷[18-19]。本研究顯示PIC Ⅱ可以下調TXNIP、NLRP3、ASC表達水平,推測PIC Ⅱ可以通過抑制TXNIP/NLRP3通路抑制重癥肺炎大鼠肺泡上皮細胞焦亡。為證實這一猜測,我們對重癥肺炎大鼠進行PIC Ⅱ高劑量處理基礎上增加TMAO處理,TMAO可逆轉PIC Ⅱ對重癥肺炎大鼠肺損傷的保護作用,證實PIC Ⅱ可以通過抑制TXNIP/NLRP3通路抑制重癥肺炎大鼠肺泡上皮細胞焦亡。
綜上所述,PIC Ⅱ通過抑制TXNIP/NLRP3通路抑制重癥肺炎大鼠肺泡上皮細胞焦亡。本研究為PIC Ⅱ治療重癥肺炎提供了理論依據,對重癥肺炎新型治療藥物的開發和重癥肺炎的治療具有重要意義。然而PIC Ⅱ的作用機制復雜,是否調控其他通路發揮作用尚不清楚,仍需進一步研究。
利益沖突:本研究不涉及任何利益沖突。