引用本文: 齊凱, 鄭麗, 彭金華, 宋超, 陳向來, 徐建軍. LncRNA MIR223HG調控共濟失調毛細血管擴張突變的表達影響肺腺癌細胞的增殖、遷移和凋亡. 中國呼吸與危重監護雜志, 2025, 24(1): 42-50. doi: 10.7507/1671-6205.202403047 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
肺腺癌是一種病死率高、基因組全面不穩定的腫瘤。研究表明,過度吸煙、污染、輻射和潛在的DNA損傷可能導致基因組改變的高發[1]。與基因改變相關的長非編碼RNA(long non-coding RNA,lncRNA)具有促腫瘤生長和影響基因組穩定性的作用。研究發現一些體細胞拷貝數改變lncRNAs是致癌lncRNAs的候選者[2]。重新激活睪丸癌基因中的lncRNA可以促進基因組不穩定和惡性轉化[3]。相反,一些lncRNA,如CUPID1、CUPID2和DDSR1,則可促進DNA修復并促進基因組穩定性[4]。DNA損傷反應在維持基因組完整性方面發揮著重要作用[5]。DNA損傷誘導的長鏈非編碼RNA(DNA damage induced long non-coding RNA,DINO)和細胞周期蛋白激酶抑制蛋白1A(p21,由CDKN1A編碼)監測p53活性的誘導,并對于DNA損傷應答(DNA damage response,DDR)的激活至關重要[6-7]。DDR中感知DNA損傷的因子和誘導修復的因子之間存在著復雜的機制。在識別DNA損傷的同時,共濟失調毛細血管擴張突變(ataxia-telangiectasia mutated,ATM)、Rad3相關激酶(ataxia-telangiectasia mutated- and Rad3-related,ATR)和DNA依賴性蛋白激酶催化亞基(DNA-dependent protein kinase catalytic subunit,DNA-PKcs)等傳導蛋白會放大損傷信號,并將其傳遞給細胞周期檢查點激酶(checkpoint kinase,Chk)1和Chk2等效應蛋白[8-13]。ATM通常對DNA雙鏈斷裂作出反應,而ATR則特別介導DNA單鏈斷裂[14-15]。因此,DDR中的這些傳感器、換能器和效應蛋白受包括miRNA和lncRNA在內的DDR響應非蛋白質編碼RNA(non-coding RNA,ncRNA)的調控[16]。Lou等[17]發現大腦特異性DNA損傷相關的lncRNA BS-DRL1通過與神經元中的高遷移率族蛋白B1相互作用來調節DNA損傷反應和基因組穩定性。Wu等[18]報道ncRNA HITTERS在內質網應激誘導的DNA損傷中充當保護因子,保護口腔鱗狀細胞癌免受內質網應激的傷害。Chaudhary等[19]發現在人類結直腸癌中,lncRNA PINCR在DNA損傷后通過上調p53靶標的子集來調節細胞周期。最近一項研究從基因組和轉錄水平鑒定了一組與基因組不穩定性相關的lncRNA,并探討了它們對肺腺癌患者預后的意義。其中,MIR223HG被認為是肺腺癌患者預后的保護因素。然而,MIR223HG在肺腺癌中的作用機制還需要進一步研究。我們的研究擬探討MIR223HG作為基因組不穩定相關的lncRNA之一,是否與DNA損傷因子有關,以及調控肺癌細胞的增殖、遷移和凋亡的分子機制。
1 材料與方法
1.1 細胞和藥物
人胚肺細胞MRC-5和肺癌細胞A549和H1299購自ThermoFisher SCIENTIFIC,并用含有10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培養基(BI,以色列)培養。細胞在組織培養箱中于37℃、5% CO2氣氛中孵育。Zeocin(酷拉博,中國)和依托泊苷(Sigma,美國)將KU-55933(Solarbio,中國)和AZ31(Selleckchem,美國)溶解在二甲基亞砜(Sigma,美國)中并保存在–20℃下,將KU-55933(Solarbio,中國)溶解在水中并保存在–20℃下。
1.2 方法
1.2.1 實時定量聚合酶鏈式反應分析
總RNA分離后用Trizol試劑(Thermo Fisher,CA,美國)進行。根據方案,使用PrimeScript RT試劑盒(TIANGEN,China)將1 μg總RNA逆轉錄成cDNA。根據說明,使用RealUniversal Color PreMix(SYBR Green)(TIANGEN,China)進行實時定量聚合酶鏈式反應(quantitative real-time polymerase chain reaction,qRT-PCR)。使用引物設計軟件Oligo版本7(Molecular Biology Insights,Inc.)設計用于qPCR的引物。引物的詳細信息見表1。使用2–ΔΔCt方法以GAPDH作為內部對照分析產物的相對定量。所有測定一式三份,進行3次。
1.2.2 蛋白免疫印跡實驗(Western blot)
總蛋白通過裂解緩沖液(50 mmol/L Tris-HCl,pH7.5;5 mmol/L 乙二胺四乙酸,100 mmol/L 氯化鈉,1% 曲拉通X-100,0.1% 十二烷基硫酸鈉和10%甘油)和1 mmol/L 苯甲基磺酰氟(Beyotime,生物技術研究所)收獲。總蛋白通過離心收集。通過十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離變性蛋白(每泳道20 μg),然后轉移到0.22 μm聚偏二氟乙烯膜上。用5%脫脂牛奶室溫封閉1 h后,將膜與一抗(1∶2 000)孵育以識別γH2AX(Abcam,
1.2.3 質粒轉染
研究中使用的質粒:非靶向小干擾RNA(non-targeting small interfering RNA,NT siRNA)、靶向ATM、ATR、PRKDC(編碼DNA-PK)的siRNA、MIR223HG和特異性靶向Chk2的siRNA獲自Addgene。根據操作方案,使用Lipofectamine 3000(Thermo Fisher,美國)將1 μg質粒分別轉染至細胞中。siRNA序列見表2。
1.2.4 Transwell遷移實驗
Transwell遷移實驗用于評估細胞遷移能力。將總共5×104個細胞懸浮在100 μL無FBS的培養基中,并添加到頂室。底部室充滿標準培養基。將細胞在37℃下孵育24 h。通過擦拭將未能遷移的細胞從膜的頂表面去除。將膜底表面上的遷移細胞固定并用0.2%結晶紫(Sigma,美國)染色。使用光學顯微鏡(Olympus)對來自膜的5個隨機區域的遷移細胞進行計數。
1.2.5 集落形成測定
集落形成測定用于研究細胞增殖。將轉染的細胞接種于6孔組織板中并在DMEM (Sigma,美國)中在5% CO2下在35℃下于10% FBS中培養10 d,并使用0.1%結晶紫(Sigma,美國)固定和染色細胞。
1.2.6 細胞凋亡檢測
使用Annexin V-FITC/PI細胞凋亡檢測試劑盒(Sigma,美國)按照說明書檢測細胞凋亡率。將細胞接種到6孔組織培養板中(4×105個細胞/孔)。收集細胞,用磷酸鹽緩沖液洗滌,并重懸于500 μL結合緩沖液中。然后,將5 μL Annexin V-FITC和5 μL PI添加到緩沖液中,并在室溫下避光孵育15 min。在1 h內通過流式細胞術(BD FACSCanto)對細胞進行分析。
1.3 統計學方法
所有實驗至少進行3次。數據以均數±標準差(x±s)表示。統計分析和圖表由IBM SPSS Statistics 20.0和GraphPad Prism 8.0版進行處理。應用t檢驗或Fisher精確檢驗來比較兩組之間差異的統計學顯著性。Spearman等級相關系數用于確定兩個參數之間的相關性。P<0.05為差異有統計學意義。
2 結果
2.1 肺腺癌中MIR223HG的表達與DNA損傷有關
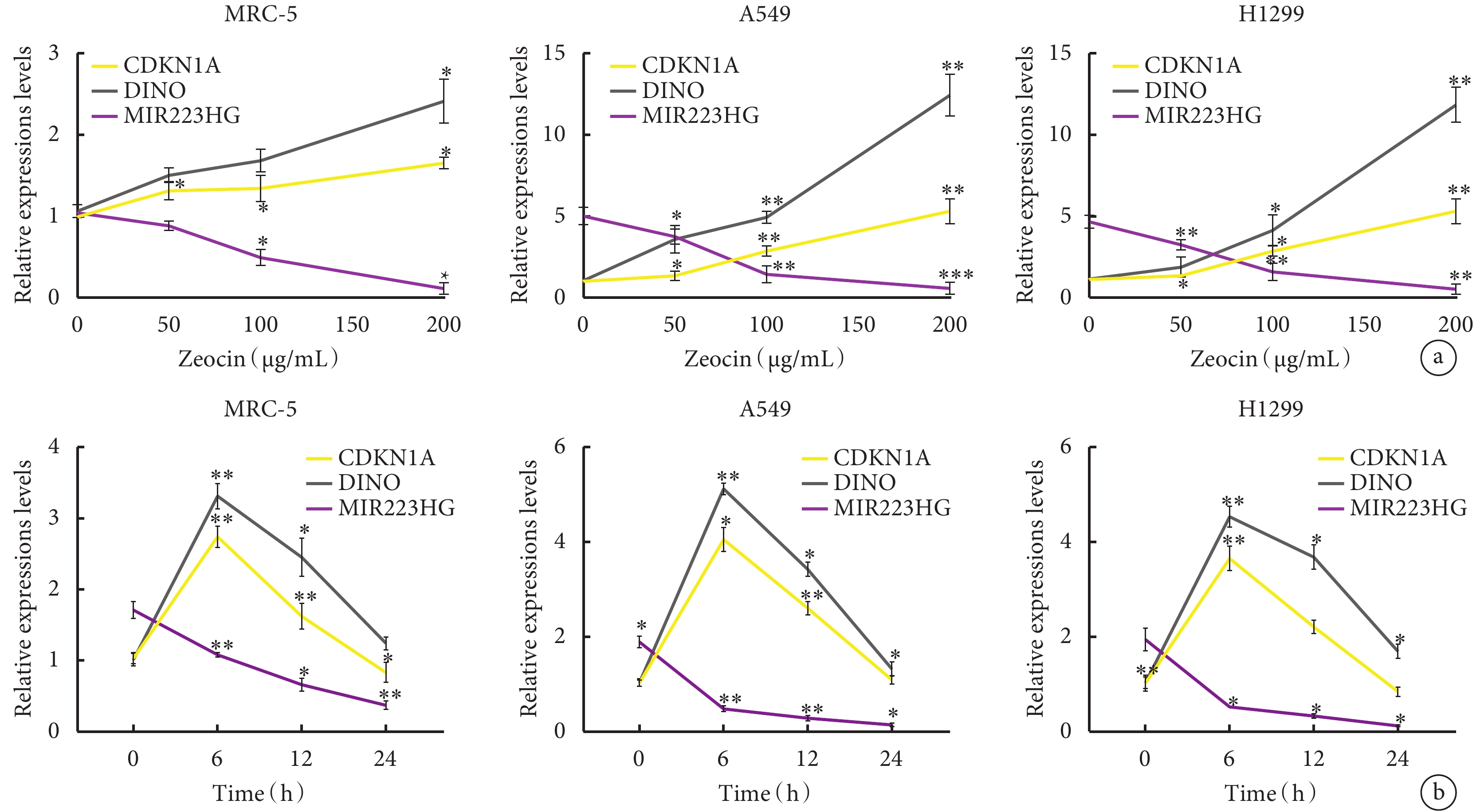
以不同濃度的Zeocin處理MRC-5、A549和H1299細胞24 h,隨Zeocin的濃度增加,MRC-5、A549和H1299細胞中MIR223HG的表達水平均呈下降趨勢。當細胞暴露于200 μg/mL的Zeocin時,肺癌細胞A549和H1299中MIR223HG的表達與未處理的細胞相比分別下降了1倍、6倍、4倍。與未處理的細胞相比,A549和H1299細胞中CDKN1A和DINO RNA的表達分別平均增加6倍和10倍(圖1a)。在不同治療時間點(0~24 h)測試MIR223HG、CDKN1A和DINO RNA的水平,在不同時間處理200 μg/mL Zeocin的MRC-5、A549和H1299細胞中,MIR223HG 表達降低。在24 h時,A549和H1299細胞中MIR223HG的表達水平僅為未處理細胞的10倍。然而,CDKN1A和DINO RNA在細胞中的表達量在0~6 h內增加,然后在6~24 h內減少。6 h時,CDKN1A和DINO RNA在A549和H1299細胞中的平均表達量分別達到4倍和5倍(圖1b)。
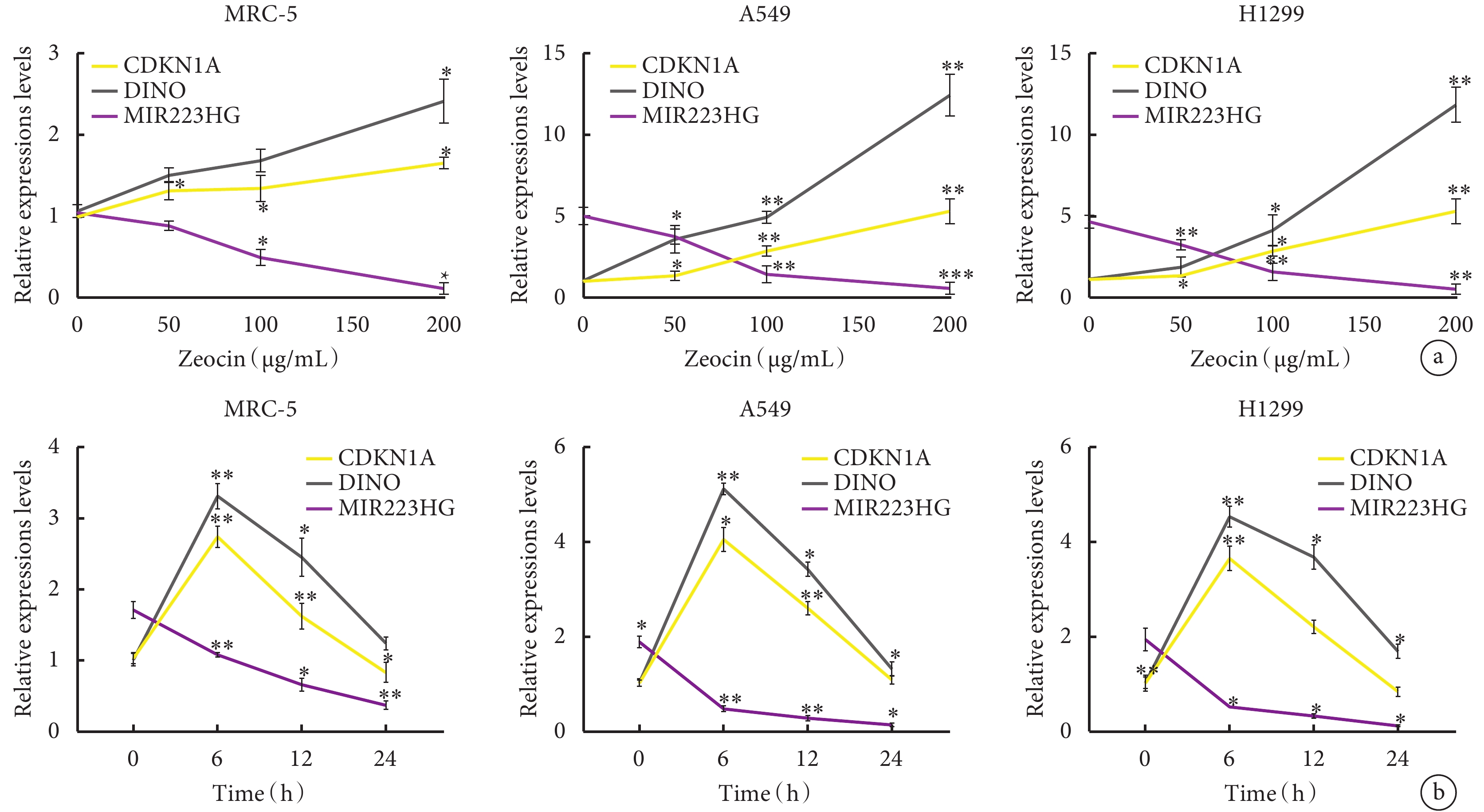 圖1
Zeocin處理的MRC-5、A549和H1299細胞中MIR223HG、CDKN1A和DINO的表達
圖1
Zeocin處理的MRC-5、A549和H1299細胞中MIR223HG、CDKN1A和DINO的表達
a. 不同濃度的Zeocin對MRC-5、A549、H1299細胞中MIR223HG、CDKN1A、DINO RNA表達水平的影響;b. 經200 μg/mL Zeocin處理不同時間后MRC-5、A549、H1299細胞中MIR223HG、CDKN1A、DINO RNA表達水平。
2.2 肺癌細胞中MIR223HG與DDR通路的關系
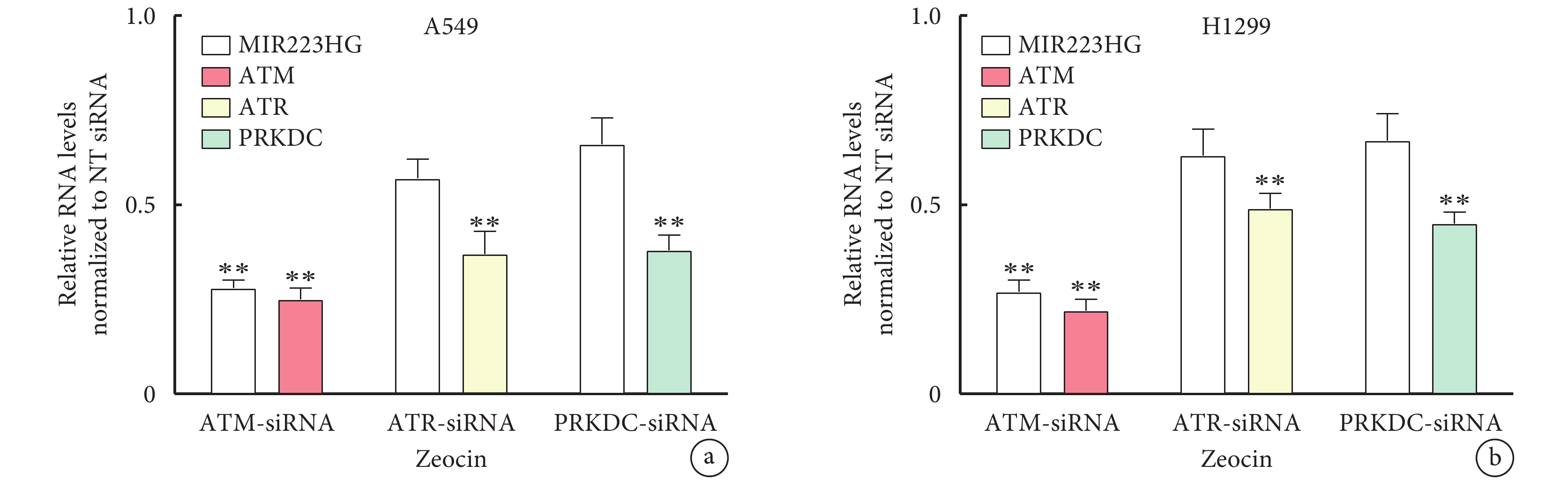
在Zeocin處理的A549細胞中,γH2AX信號增強,并且信號隨著處理時間延長而增強(S2)。檢測ATM、ATR和DNA-PKs在肺癌細胞A549中MIR223HG表達,發現將NT siRNA和靶向ATM、ATR或PRKDC(編碼DNA-PKs)的siRNA轉染到A549細胞中。48 h后,用200 μg/mL Zeocin處理細胞24h。然而,用ATR siRNA和PRKDC siRNA處理的A549細胞中,MIR223HG的表達水平與對照組相比沒有顯著差異(P>0.05,圖2)。
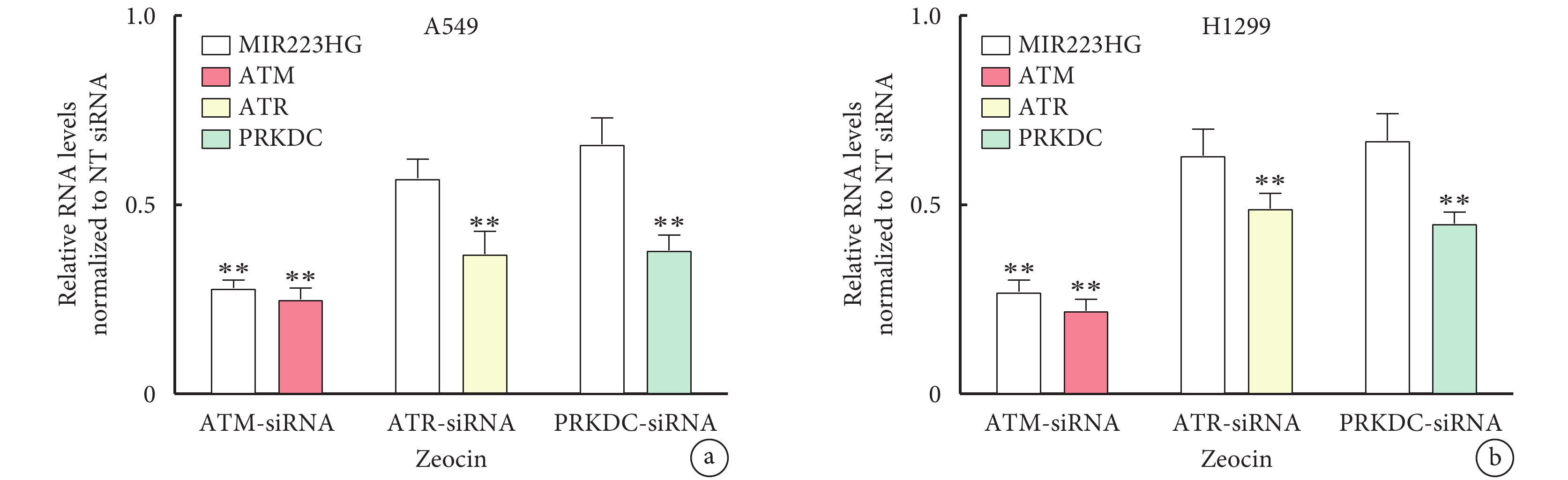 圖2
ATM通過Zeocin處理肺癌A549和H1299細胞來調節MIR223HG的表達
圖2
ATM通過Zeocin處理肺癌A549和H1299細胞來調節MIR223HG的表達
a. A549細胞;b. H1299細胞。
2.3 ATM對肺癌A549細胞中MIR223HG的表達的影響
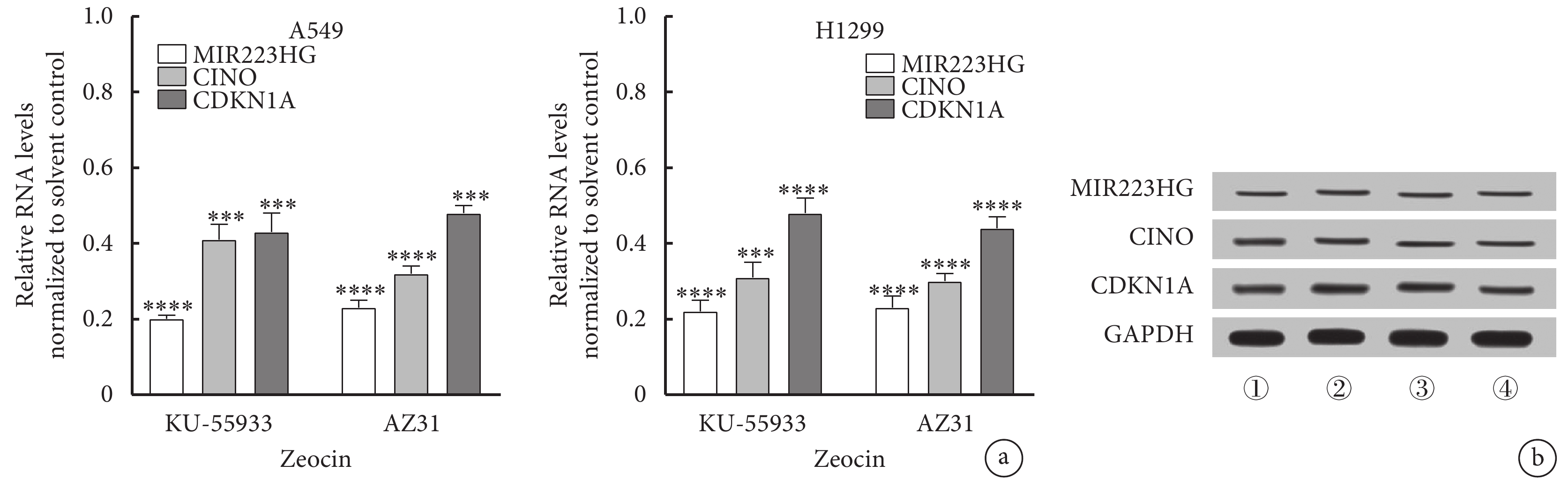
結果表明,A549細胞中MIR223HG的表達與ATM存在相關性。為評估ATM對A549細胞中MIR223HG轉錄水平的影響,應用20 μmol/L KU-55933或AZ31(ATM激酶抑制劑)處理A549細胞,然后用Zeocin(200 μg/mL)處理2 h。結果顯示,與對照相比,KU-55933或AZ31處理的A549細胞中MIR223HG、CINO、CDKN1A RNA及蛋白的表達降低(圖3)。
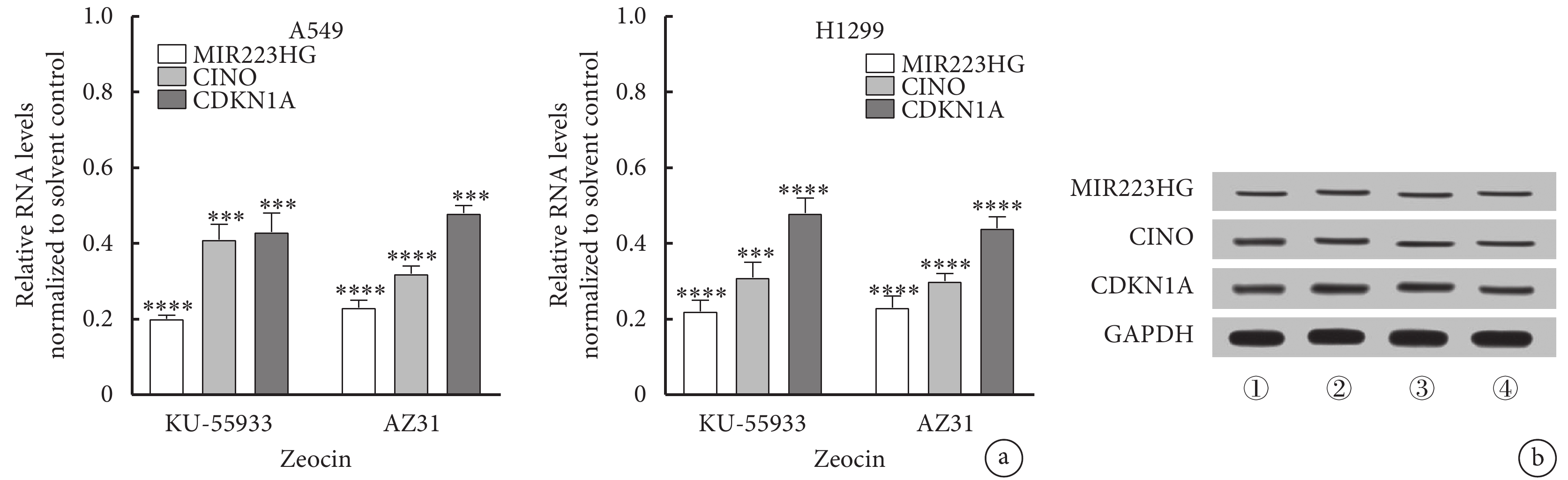 圖3
ATM對肺癌A549細胞中MIR223HG的表達的影響
圖3
ATM對肺癌A549細胞中MIR223HG的表達的影響
a. ATM激酶抑制劑促進Zeocin對肺癌A549、H1299細胞中MIR223HG的下調(
2.4 通過ATM/Chk2/p53通路調控肺癌細胞中MIR223HG的表達
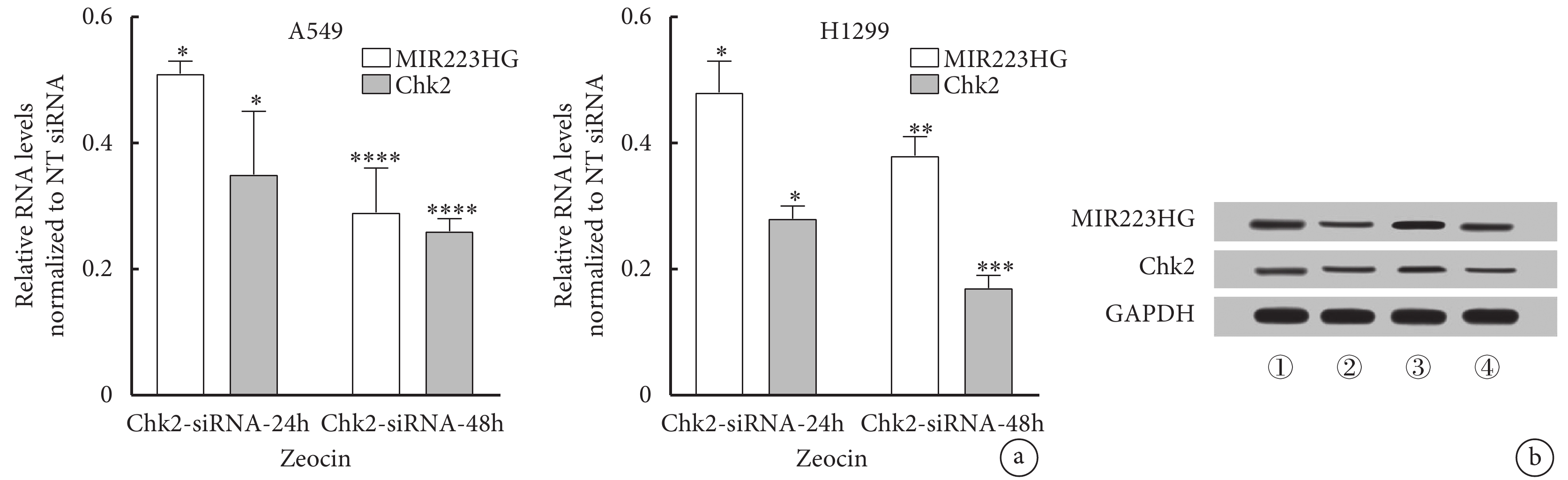
將NT siRNA或特異性靶向Chk2的siRNA轉染到A549細胞中48 h后,用200 μg/mL Zeocin處理細胞。結果顯示Chk2轉錄物在24h和48h時下降。而Zeocin處理Chk2-siRNA細胞48 h后,MIR223HG RNA及蛋白表達水平明顯升高,這與ATM激酶抑制劑的處理效果一致(圖4)。
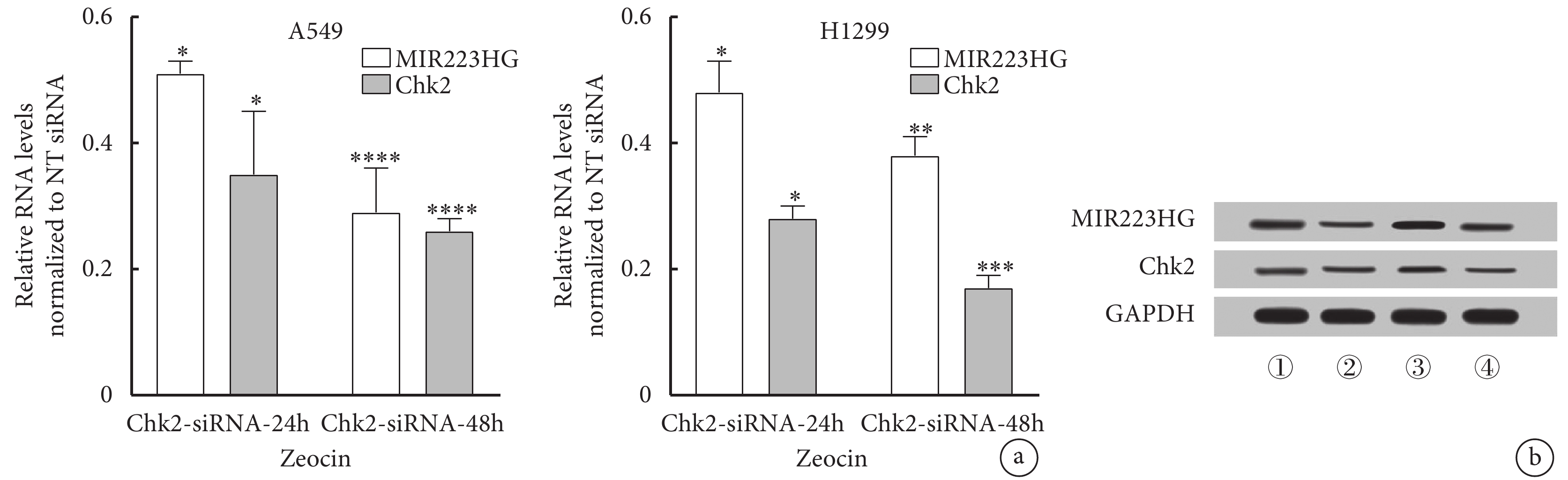 圖4
通過ATM/Chk2/p53通路調控肺癌細胞中MIR223HG的表達
圖4
通過ATM/Chk2/p53通路調控肺癌細胞中MIR223HG的表達
a. 在A549、H1299細胞中MIR223HG表達的調控依賴于ATM/Chk2/p53通路(
2.5 p53與 MIR223HG RNA誘導之間的關系
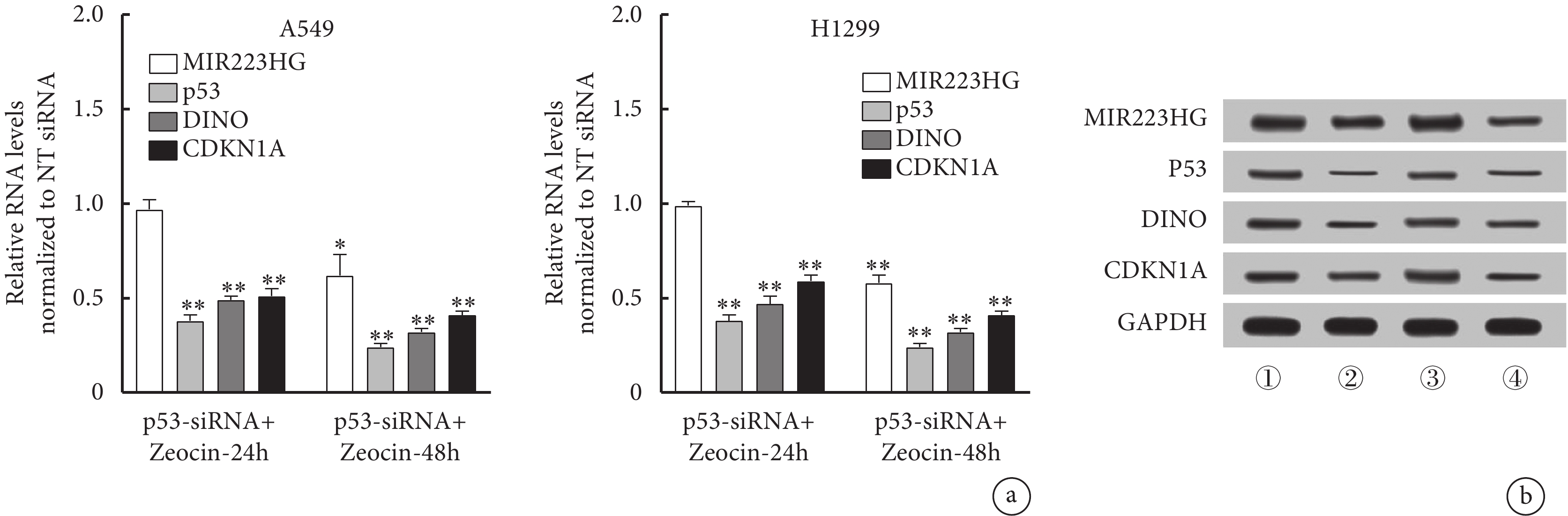
將NT siRNA或特異性靶向p53的siRNA轉染到A549和H1299細胞中,然后用200 μg/mL Zeocin處理這些細胞。在不同時間點檢測MIR223HG、CDKN1A和DINO RNA及蛋白表達。結果顯示,在Zeocin處理的A549和H1299細胞中,與對照細胞相比,p53-siRNA的MIR223HG RNA及蛋白表達在24 h和48 h時上調。相反,p53-siRNA轉染后CDKN1A、DINO RNA及蛋白的表達在Zeocin處理后的24 h和48 h均強烈下降(圖5)。
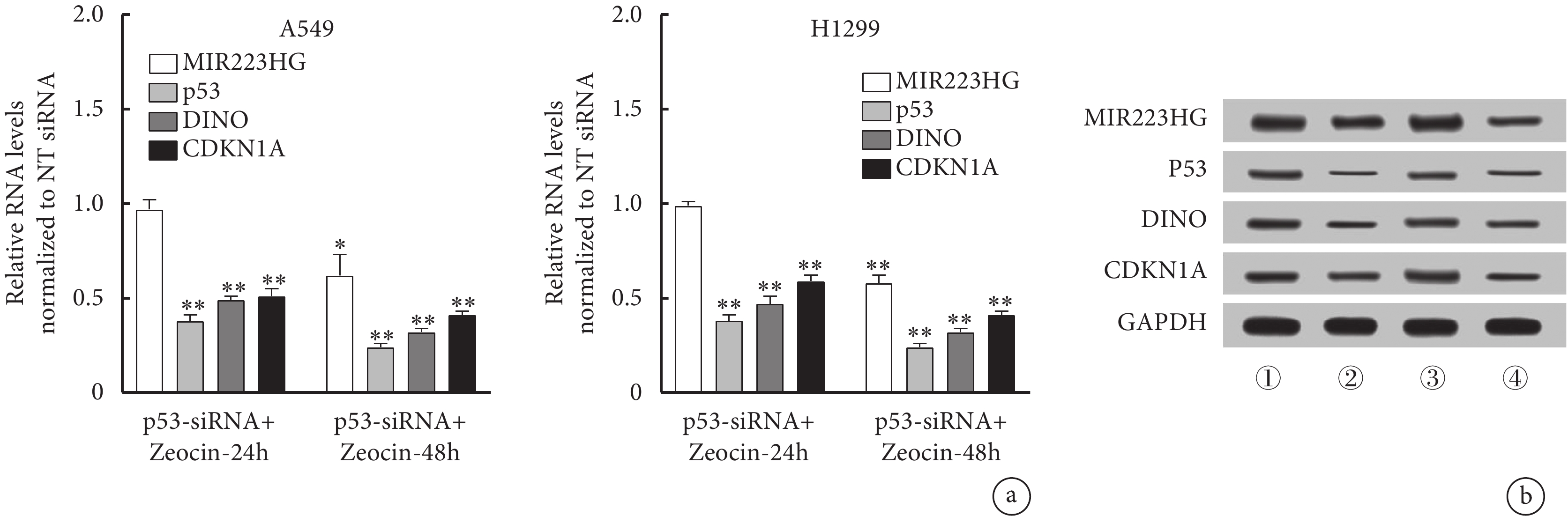 圖5
p53與 MIR223HG RNA誘導之間的關系
圖5
p53與 MIR223HG RNA誘導之間的關系
a. Zeocin 處理24 h和48 h后p53可調節MIR223HG RNA的表達。b. A549、H1299細胞中MIR223HG、Chk2的表達:① A549細胞經Zeocin處理24 h;② A549細胞經Zeocin處理48 h;③ H1299細胞經Zeocin處理24 h;④ H1299細胞經Zeocin處理48 h。
2.6 MIR223HG通過ATM影響肺癌細胞增殖、遷移和凋亡
用200 μg/mL Zeocin處理A549和H1299細胞,并 H2O作為溶劑對照,24 h后,使用相同數量的細胞進行Transwell遷移測定和平板克隆性測定。結果顯示,Zeocin處理減少了A549和H1299細胞的遷移(圖6),表明MIR223HG的下調表達抑制了肺癌細胞的遷移和增殖。將NT siRNA或ATM-si RNA、MIR223HG-si RNA轉染到A549和H1299細胞中以探索肺癌細胞遷移和擴散。結果顯示,si-MIR223HG RNA和si-ATM RNA在A549和H1299細胞中MIR223HG和ATM的表達分別下降40%和60%(圖6)。具有si-MIR223HG RNA的A549和H1299細胞減少了細胞遷移和增殖,而具有si-ATM RNA的細胞增加了細胞遷移和增殖。
 圖6
MIR223HG通過ATM調節肺癌細胞的增殖和遷移
圖6
MIR223HG通過ATM調節肺癌細胞的增殖和遷移
a. A549細胞中MIR223HG、ATM的表達;b. H1299細胞中MIR223HG、ATM的表達;c. Zeocin對A549、H1299細胞增殖的影響;d. A549、H1299細胞轉染NT siRNA、ATM-si RNA、MIR223HG-si RNA后的增殖情況;e. Zeocin對A549、H1299細胞遷移的影響;f. A549、H1299細胞轉染NT siRNA、ATM-si RNA、MIR223HG-si RNA后的遷移情況。
2.7 下調MIR223HG表達對肺癌細胞凋亡的影響
H2O和Zeocin處理細胞的凋亡率存在明顯差異。與對照組相比,經Zeocin處理 A549和H1299細胞的凋亡率更低。含有MIR223HG-si RNA的細胞凋亡率較高,含有ATM-si RNA的細胞凋亡率較低(圖7)。
 圖7
MIR223HG通過ATM促進肺癌細胞凋亡
圖7
MIR223HG通過ATM促進肺癌細胞凋亡
3 討論
越來越多的研究表明,LncRNA在腫瘤的某些生物學過程中發揮著重要作用[20]。重要的是,LncRNA參與調控DNA損傷反應和基因組穩定性[6]。研究表明MIR223HG預計會影響肺腺癌中的基因組不穩定性[21]。因此,我們推測MIR223HG可能與肺腺癌中的DNA損傷反應有關。為檢驗這一假設,我們使用濃度不斷增加的博萊霉素Zeocin處理人胚肺細胞MRC-5和肺癌細胞A549和H1299,并檢測MIR223HG、CDKN1A和CINO RNA的表達,Zeocin可作為放射模擬物來損傷DNA分子,qRT-PCR檢測不同處理濃度和時間點下基因的表達。結果顯示,肺癌細胞中LncRNA MIR223HG的表達受DNA損傷藥物Zeocin和依托泊苷的調控。而包括DDR信號級聯關鍵因素在內的一些基因子集也受Zeocin的調控而表達MIR223HG。這說明MIR223HG可能參與了DDR信號通路。DDR通路中斷是腫瘤的標志之一。DNA損傷劑可引起不同類型的DNA損傷,并對細胞產生一系列潛在的破壞性后果,包括遺傳不穩定和促進腫瘤形成的突變積累。在DDR中,ATM、ATR和DNA-PKcs負責協調細胞對雙鏈斷裂的反應,包括DNA修復、檢查點激活、細胞凋亡、衰老以及染色質結構、轉錄和mRNA剪接的改變[22]。值得注意的是,磷酸化的H2AX是參與DDR途徑的必要因子,而Zeocin可促進γH2AX的積累[23]。
為進一步探討肺癌細胞中MIR223HG與DDR通路的關系,我們首先檢測200 μg/mL Zeocin處理A549細胞在不同時間點γH2AX蛋白的積累情況。將細胞固定24 h,然后用特異性抗體進行識別。結果表明,在Zeocin處理的A549細胞中,γH2AX信號增強,且信號隨處理時間的延長而增強(S2)。結果顯示肺癌細胞中MIR223HG表達的降低僅受ATM調節,而不是ATR或DNA-PKcs。此外,ATM抑制劑KU-55933和AZ31也調節MIR223HG轉錄水平。結果表明,A549和H1299細胞中MIR223HG轉錄水平的變化依賴于ATM。Chk2和p53是ATM藥物DDR通路的下游,我們發現在A549和H1299細胞中Chk2和p53的敲低對Zeocin減少MIR223HG RNA具有負面影響。且與p53調控的DNA損傷途徑相關的CDKN1A和DINO RNA的變異是對應的。因此,我們的研究表明ATM蛋白和ATM-Chk2-p53信號通路參與調節肺癌細胞中MIR223HG RNA的表達。DNA損傷的治療方式可能會導致耐藥性[24-27],并帶來一些對腫瘤發展的擔憂[28]。這表明MIR223HG的下調可能與肺癌細胞的凋亡、增殖和遷移有關。本研究探討了肺癌中LncRNA MIR223HG與ATM的關系。細胞轉化實驗表明,MIR223HG siRNA通過ATM增強肺癌細胞的凋亡并減少其遷移和增殖。總之,本研究表明DNA損傷元件Zeocin通過DDR途徑影響肺癌細胞中需要ATM蛋白的MIR223HG RNA,闡明了RNA表達與腫瘤遷移和增殖之間的關系,為肺癌提供了潛在的治療靶點。
綜上所述,肺癌細胞中LncRNA MIR223HG的表達受DNA損傷劑調控,并與ATM/Chk2/p53通路有關。MIR223HG影響肺癌細胞的增殖、遷移和凋亡。因此,MIR223HG 可能是肺癌的有效治療靶點。
利益沖突:本研究不涉及任何利益沖突。
肺腺癌是一種病死率高、基因組全面不穩定的腫瘤。研究表明,過度吸煙、污染、輻射和潛在的DNA損傷可能導致基因組改變的高發[1]。與基因改變相關的長非編碼RNA(long non-coding RNA,lncRNA)具有促腫瘤生長和影響基因組穩定性的作用。研究發現一些體細胞拷貝數改變lncRNAs是致癌lncRNAs的候選者[2]。重新激活睪丸癌基因中的lncRNA可以促進基因組不穩定和惡性轉化[3]。相反,一些lncRNA,如CUPID1、CUPID2和DDSR1,則可促進DNA修復并促進基因組穩定性[4]。DNA損傷反應在維持基因組完整性方面發揮著重要作用[5]。DNA損傷誘導的長鏈非編碼RNA(DNA damage induced long non-coding RNA,DINO)和細胞周期蛋白激酶抑制蛋白1A(p21,由CDKN1A編碼)監測p53活性的誘導,并對于DNA損傷應答(DNA damage response,DDR)的激活至關重要[6-7]。DDR中感知DNA損傷的因子和誘導修復的因子之間存在著復雜的機制。在識別DNA損傷的同時,共濟失調毛細血管擴張突變(ataxia-telangiectasia mutated,ATM)、Rad3相關激酶(ataxia-telangiectasia mutated- and Rad3-related,ATR)和DNA依賴性蛋白激酶催化亞基(DNA-dependent protein kinase catalytic subunit,DNA-PKcs)等傳導蛋白會放大損傷信號,并將其傳遞給細胞周期檢查點激酶(checkpoint kinase,Chk)1和Chk2等效應蛋白[8-13]。ATM通常對DNA雙鏈斷裂作出反應,而ATR則特別介導DNA單鏈斷裂[14-15]。因此,DDR中的這些傳感器、換能器和效應蛋白受包括miRNA和lncRNA在內的DDR響應非蛋白質編碼RNA(non-coding RNA,ncRNA)的調控[16]。Lou等[17]發現大腦特異性DNA損傷相關的lncRNA BS-DRL1通過與神經元中的高遷移率族蛋白B1相互作用來調節DNA損傷反應和基因組穩定性。Wu等[18]報道ncRNA HITTERS在內質網應激誘導的DNA損傷中充當保護因子,保護口腔鱗狀細胞癌免受內質網應激的傷害。Chaudhary等[19]發現在人類結直腸癌中,lncRNA PINCR在DNA損傷后通過上調p53靶標的子集來調節細胞周期。最近一項研究從基因組和轉錄水平鑒定了一組與基因組不穩定性相關的lncRNA,并探討了它們對肺腺癌患者預后的意義。其中,MIR223HG被認為是肺腺癌患者預后的保護因素。然而,MIR223HG在肺腺癌中的作用機制還需要進一步研究。我們的研究擬探討MIR223HG作為基因組不穩定相關的lncRNA之一,是否與DNA損傷因子有關,以及調控肺癌細胞的增殖、遷移和凋亡的分子機制。
1 材料與方法
1.1 細胞和藥物
人胚肺細胞MRC-5和肺癌細胞A549和H1299購自ThermoFisher SCIENTIFIC,并用含有10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培養基(BI,以色列)培養。細胞在組織培養箱中于37℃、5% CO2氣氛中孵育。Zeocin(酷拉博,中國)和依托泊苷(Sigma,美國)將KU-55933(Solarbio,中國)和AZ31(Selleckchem,美國)溶解在二甲基亞砜(Sigma,美國)中并保存在–20℃下,將KU-55933(Solarbio,中國)溶解在水中并保存在–20℃下。
1.2 方法
1.2.1 實時定量聚合酶鏈式反應分析
總RNA分離后用Trizol試劑(Thermo Fisher,CA,美國)進行。根據方案,使用PrimeScript RT試劑盒(TIANGEN,China)將1 μg總RNA逆轉錄成cDNA。根據說明,使用RealUniversal Color PreMix(SYBR Green)(TIANGEN,China)進行實時定量聚合酶鏈式反應(quantitative real-time polymerase chain reaction,qRT-PCR)。使用引物設計軟件Oligo版本7(Molecular Biology Insights,Inc.)設計用于qPCR的引物。引物的詳細信息見表1。使用2–ΔΔCt方法以GAPDH作為內部對照分析產物的相對定量。所有測定一式三份,進行3次。
1.2.2 蛋白免疫印跡實驗(Western blot)
總蛋白通過裂解緩沖液(50 mmol/L Tris-HCl,pH7.5;5 mmol/L 乙二胺四乙酸,100 mmol/L 氯化鈉,1% 曲拉通X-100,0.1% 十二烷基硫酸鈉和10%甘油)和1 mmol/L 苯甲基磺酰氟(Beyotime,生物技術研究所)收獲。總蛋白通過離心收集。通過十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離變性蛋白(每泳道20 μg),然后轉移到0.22 μm聚偏二氟乙烯膜上。用5%脫脂牛奶室溫封閉1 h后,將膜與一抗(1∶2 000)孵育以識別γH2AX(Abcam,
1.2.3 質粒轉染
研究中使用的質粒:非靶向小干擾RNA(non-targeting small interfering RNA,NT siRNA)、靶向ATM、ATR、PRKDC(編碼DNA-PK)的siRNA、MIR223HG和特異性靶向Chk2的siRNA獲自Addgene。根據操作方案,使用Lipofectamine 3000(Thermo Fisher,美國)將1 μg質粒分別轉染至細胞中。siRNA序列見表2。
1.2.4 Transwell遷移實驗
Transwell遷移實驗用于評估細胞遷移能力。將總共5×104個細胞懸浮在100 μL無FBS的培養基中,并添加到頂室。底部室充滿標準培養基。將細胞在37℃下孵育24 h。通過擦拭將未能遷移的細胞從膜的頂表面去除。將膜底表面上的遷移細胞固定并用0.2%結晶紫(Sigma,美國)染色。使用光學顯微鏡(Olympus)對來自膜的5個隨機區域的遷移細胞進行計數。
1.2.5 集落形成測定
集落形成測定用于研究細胞增殖。將轉染的細胞接種于6孔組織板中并在DMEM (Sigma,美國)中在5% CO2下在35℃下于10% FBS中培養10 d,并使用0.1%結晶紫(Sigma,美國)固定和染色細胞。
1.2.6 細胞凋亡檢測
使用Annexin V-FITC/PI細胞凋亡檢測試劑盒(Sigma,美國)按照說明書檢測細胞凋亡率。將細胞接種到6孔組織培養板中(4×105個細胞/孔)。收集細胞,用磷酸鹽緩沖液洗滌,并重懸于500 μL結合緩沖液中。然后,將5 μL Annexin V-FITC和5 μL PI添加到緩沖液中,并在室溫下避光孵育15 min。在1 h內通過流式細胞術(BD FACSCanto)對細胞進行分析。
1.3 統計學方法
所有實驗至少進行3次。數據以均數±標準差(x±s)表示。統計分析和圖表由IBM SPSS Statistics 20.0和GraphPad Prism 8.0版進行處理。應用t檢驗或Fisher精確檢驗來比較兩組之間差異的統計學顯著性。Spearman等級相關系數用于確定兩個參數之間的相關性。P<0.05為差異有統計學意義。
2 結果
2.1 肺腺癌中MIR223HG的表達與DNA損傷有關
以不同濃度的Zeocin處理MRC-5、A549和H1299細胞24 h,隨Zeocin的濃度增加,MRC-5、A549和H1299細胞中MIR223HG的表達水平均呈下降趨勢。當細胞暴露于200 μg/mL的Zeocin時,肺癌細胞A549和H1299中MIR223HG的表達與未處理的細胞相比分別下降了1倍、6倍、4倍。與未處理的細胞相比,A549和H1299細胞中CDKN1A和DINO RNA的表達分別平均增加6倍和10倍(圖1a)。在不同治療時間點(0~24 h)測試MIR223HG、CDKN1A和DINO RNA的水平,在不同時間處理200 μg/mL Zeocin的MRC-5、A549和H1299細胞中,MIR223HG 表達降低。在24 h時,A549和H1299細胞中MIR223HG的表達水平僅為未處理細胞的10倍。然而,CDKN1A和DINO RNA在細胞中的表達量在0~6 h內增加,然后在6~24 h內減少。6 h時,CDKN1A和DINO RNA在A549和H1299細胞中的平均表達量分別達到4倍和5倍(圖1b)。
 圖1
Zeocin處理的MRC-5、A549和H1299細胞中MIR223HG、CDKN1A和DINO的表達
圖1
Zeocin處理的MRC-5、A549和H1299細胞中MIR223HG、CDKN1A和DINO的表達
a. 不同濃度的Zeocin對MRC-5、A549、H1299細胞中MIR223HG、CDKN1A、DINO RNA表達水平的影響;b. 經200 μg/mL Zeocin處理不同時間后MRC-5、A549、H1299細胞中MIR223HG、CDKN1A、DINO RNA表達水平。
2.2 肺癌細胞中MIR223HG與DDR通路的關系
在Zeocin處理的A549細胞中,γH2AX信號增強,并且信號隨著處理時間延長而增強(S2)。檢測ATM、ATR和DNA-PKs在肺癌細胞A549中MIR223HG表達,發現將NT siRNA和靶向ATM、ATR或PRKDC(編碼DNA-PKs)的siRNA轉染到A549細胞中。48 h后,用200 μg/mL Zeocin處理細胞24h。然而,用ATR siRNA和PRKDC siRNA處理的A549細胞中,MIR223HG的表達水平與對照組相比沒有顯著差異(P>0.05,圖2)。
 圖2
ATM通過Zeocin處理肺癌A549和H1299細胞來調節MIR223HG的表達
圖2
ATM通過Zeocin處理肺癌A549和H1299細胞來調節MIR223HG的表達
a. A549細胞;b. H1299細胞。
2.3 ATM對肺癌A549細胞中MIR223HG的表達的影響
結果表明,A549細胞中MIR223HG的表達與ATM存在相關性。為評估ATM對A549細胞中MIR223HG轉錄水平的影響,應用20 μmol/L KU-55933或AZ31(ATM激酶抑制劑)處理A549細胞,然后用Zeocin(200 μg/mL)處理2 h。結果顯示,與對照相比,KU-55933或AZ31處理的A549細胞中MIR223HG、CINO、CDKN1A RNA及蛋白的表達降低(圖3)。
 圖3
ATM對肺癌A549細胞中MIR223HG的表達的影響
圖3
ATM對肺癌A549細胞中MIR223HG的表達的影響
a. ATM激酶抑制劑促進Zeocin對肺癌A549、H1299細胞中MIR223HG的下調(
2.4 通過ATM/Chk2/p53通路調控肺癌細胞中MIR223HG的表達
將NT siRNA或特異性靶向Chk2的siRNA轉染到A549細胞中48 h后,用200 μg/mL Zeocin處理細胞。結果顯示Chk2轉錄物在24h和48h時下降。而Zeocin處理Chk2-siRNA細胞48 h后,MIR223HG RNA及蛋白表達水平明顯升高,這與ATM激酶抑制劑的處理效果一致(圖4)。
 圖4
通過ATM/Chk2/p53通路調控肺癌細胞中MIR223HG的表達
圖4
通過ATM/Chk2/p53通路調控肺癌細胞中MIR223HG的表達
a. 在A549、H1299細胞中MIR223HG表達的調控依賴于ATM/Chk2/p53通路(
2.5 p53與 MIR223HG RNA誘導之間的關系
將NT siRNA或特異性靶向p53的siRNA轉染到A549和H1299細胞中,然后用200 μg/mL Zeocin處理這些細胞。在不同時間點檢測MIR223HG、CDKN1A和DINO RNA及蛋白表達。結果顯示,在Zeocin處理的A549和H1299細胞中,與對照細胞相比,p53-siRNA的MIR223HG RNA及蛋白表達在24 h和48 h時上調。相反,p53-siRNA轉染后CDKN1A、DINO RNA及蛋白的表達在Zeocin處理后的24 h和48 h均強烈下降(圖5)。
 圖5
p53與 MIR223HG RNA誘導之間的關系
圖5
p53與 MIR223HG RNA誘導之間的關系
a. Zeocin 處理24 h和48 h后p53可調節MIR223HG RNA的表達。b. A549、H1299細胞中MIR223HG、Chk2的表達:① A549細胞經Zeocin處理24 h;② A549細胞經Zeocin處理48 h;③ H1299細胞經Zeocin處理24 h;④ H1299細胞經Zeocin處理48 h。
2.6 MIR223HG通過ATM影響肺癌細胞增殖、遷移和凋亡
用200 μg/mL Zeocin處理A549和H1299細胞,并 H2O作為溶劑對照,24 h后,使用相同數量的細胞進行Transwell遷移測定和平板克隆性測定。結果顯示,Zeocin處理減少了A549和H1299細胞的遷移(圖6),表明MIR223HG的下調表達抑制了肺癌細胞的遷移和增殖。將NT siRNA或ATM-si RNA、MIR223HG-si RNA轉染到A549和H1299細胞中以探索肺癌細胞遷移和擴散。結果顯示,si-MIR223HG RNA和si-ATM RNA在A549和H1299細胞中MIR223HG和ATM的表達分別下降40%和60%(圖6)。具有si-MIR223HG RNA的A549和H1299細胞減少了細胞遷移和增殖,而具有si-ATM RNA的細胞增加了細胞遷移和增殖。
 圖6
MIR223HG通過ATM調節肺癌細胞的增殖和遷移
圖6
MIR223HG通過ATM調節肺癌細胞的增殖和遷移
a. A549細胞中MIR223HG、ATM的表達;b. H1299細胞中MIR223HG、ATM的表達;c. Zeocin對A549、H1299細胞增殖的影響;d. A549、H1299細胞轉染NT siRNA、ATM-si RNA、MIR223HG-si RNA后的增殖情況;e. Zeocin對A549、H1299細胞遷移的影響;f. A549、H1299細胞轉染NT siRNA、ATM-si RNA、MIR223HG-si RNA后的遷移情況。
2.7 下調MIR223HG表達對肺癌細胞凋亡的影響
H2O和Zeocin處理細胞的凋亡率存在明顯差異。與對照組相比,經Zeocin處理 A549和H1299細胞的凋亡率更低。含有MIR223HG-si RNA的細胞凋亡率較高,含有ATM-si RNA的細胞凋亡率較低(圖7)。
 圖7
MIR223HG通過ATM促進肺癌細胞凋亡
圖7
MIR223HG通過ATM促進肺癌細胞凋亡
3 討論
越來越多的研究表明,LncRNA在腫瘤的某些生物學過程中發揮著重要作用[20]。重要的是,LncRNA參與調控DNA損傷反應和基因組穩定性[6]。研究表明MIR223HG預計會影響肺腺癌中的基因組不穩定性[21]。因此,我們推測MIR223HG可能與肺腺癌中的DNA損傷反應有關。為檢驗這一假設,我們使用濃度不斷增加的博萊霉素Zeocin處理人胚肺細胞MRC-5和肺癌細胞A549和H1299,并檢測MIR223HG、CDKN1A和CINO RNA的表達,Zeocin可作為放射模擬物來損傷DNA分子,qRT-PCR檢測不同處理濃度和時間點下基因的表達。結果顯示,肺癌細胞中LncRNA MIR223HG的表達受DNA損傷藥物Zeocin和依托泊苷的調控。而包括DDR信號級聯關鍵因素在內的一些基因子集也受Zeocin的調控而表達MIR223HG。這說明MIR223HG可能參與了DDR信號通路。DDR通路中斷是腫瘤的標志之一。DNA損傷劑可引起不同類型的DNA損傷,并對細胞產生一系列潛在的破壞性后果,包括遺傳不穩定和促進腫瘤形成的突變積累。在DDR中,ATM、ATR和DNA-PKcs負責協調細胞對雙鏈斷裂的反應,包括DNA修復、檢查點激活、細胞凋亡、衰老以及染色質結構、轉錄和mRNA剪接的改變[22]。值得注意的是,磷酸化的H2AX是參與DDR途徑的必要因子,而Zeocin可促進γH2AX的積累[23]。
為進一步探討肺癌細胞中MIR223HG與DDR通路的關系,我們首先檢測200 μg/mL Zeocin處理A549細胞在不同時間點γH2AX蛋白的積累情況。將細胞固定24 h,然后用特異性抗體進行識別。結果表明,在Zeocin處理的A549細胞中,γH2AX信號增強,且信號隨處理時間的延長而增強(S2)。結果顯示肺癌細胞中MIR223HG表達的降低僅受ATM調節,而不是ATR或DNA-PKcs。此外,ATM抑制劑KU-55933和AZ31也調節MIR223HG轉錄水平。結果表明,A549和H1299細胞中MIR223HG轉錄水平的變化依賴于ATM。Chk2和p53是ATM藥物DDR通路的下游,我們發現在A549和H1299細胞中Chk2和p53的敲低對Zeocin減少MIR223HG RNA具有負面影響。且與p53調控的DNA損傷途徑相關的CDKN1A和DINO RNA的變異是對應的。因此,我們的研究表明ATM蛋白和ATM-Chk2-p53信號通路參與調節肺癌細胞中MIR223HG RNA的表達。DNA損傷的治療方式可能會導致耐藥性[24-27],并帶來一些對腫瘤發展的擔憂[28]。這表明MIR223HG的下調可能與肺癌細胞的凋亡、增殖和遷移有關。本研究探討了肺癌中LncRNA MIR223HG與ATM的關系。細胞轉化實驗表明,MIR223HG siRNA通過ATM增強肺癌細胞的凋亡并減少其遷移和增殖。總之,本研究表明DNA損傷元件Zeocin通過DDR途徑影響肺癌細胞中需要ATM蛋白的MIR223HG RNA,闡明了RNA表達與腫瘤遷移和增殖之間的關系,為肺癌提供了潛在的治療靶點。
綜上所述,肺癌細胞中LncRNA MIR223HG的表達受DNA損傷劑調控,并與ATM/Chk2/p53通路有關。MIR223HG影響肺癌細胞的增殖、遷移和凋亡。因此,MIR223HG 可能是肺癌的有效治療靶點。
利益沖突:本研究不涉及任何利益沖突。