引用本文: 王夏燕, 凌繼祖, 葉新華. 重度間歇性低氧對大鼠認知功能及線粒體結構和功能的影響. 中國呼吸與危重監護雜志, 2024, 23(10): 727-733. doi: 10.7507/1671-6205.202405066 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
阻塞性睡眠呼吸暫停低通氣綜合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是指在睡眠期間上呼吸道完全或部分阻塞導致的間歇性低氧/復氧和睡眠片段化,OSAHS患病可用間歇性低氧大鼠模型來模擬[1]。間歇性低氧和復氧導致氧化應激狀態增強,促使全身炎癥反應,產生大量活性氧(reactive oxygen species,ROS),使超氧陰離子(O2–)和過氧化氫(H2O2)等氧自由基和代謝產物大量積聚,氧化損傷細胞脂質、蛋白質和DNA。細胞抗氧能力下降出現損傷[2],腦組織對這種損傷作用反應敏感,表現為海馬及海馬旁灰質萎縮,此區域功能與認知、學習、記憶相關,海馬區神經元受損導致認知障礙的發生[3]。神經元功能高度依賴線粒體,線粒體不僅能夠產生ATP維持神經元離子梯度和突觸活動[4-5],也是調節生理活動重要信號樞紐[6]。線粒體促進細胞內各項生理活動,也可產生病理狀態。低氧氧化應激產生大量ROS同時也會使線粒體正常代謝功能障礙,影響神經元的正常功能,發生認知障礙 [6-7]。也有研究發現線粒體內在功能障礙可導致神經退行性病變[8]。這表明間歇性低氧導致的氧化應激損傷是引起認知障礙的機制之一,其線粒體代謝功能障礙可能與此機制相關。本研究目的在于建立重度間歇性低氧大鼠模型,通過對海馬CA1區線粒體的提取和純化,探討重度間歇性低氧大鼠在認知障礙時的線粒體結構和功能變化,同時采用不同間歇性低氧條件模型探討間歇性低氧及其嚴重程度對認知功能的影響。
1 材料與方法
1.1 實驗動物、儀器與試劑
1.1.1 實驗動物
選取48只成年雄性Wistar大鼠(體重160~180 g,6周齡),實驗前置于安靜環境、自然光照、溫度16~21℃、日溫差≤8℃、濕度40%~55%條件下適應性喂養1周。動物許可證號:SYXK 2019-0022。實驗動物中心的資質號:SCXK 2019-0008。
1.1.2 實驗儀器
Morris水迷宮系統(廠家Noldus),透視電子顯微鏡(廠家JEOL),熒光酶標儀(廠家Molecular Devices),流式細胞儀(廠家Beckman),正置顯微鏡(廠家Leica),移液器(廠家Eppendorf),低溫高速離心機(廠家Eppenedorf)。
1.1.3 實驗試劑
磷酸鹽緩沖液(phosphate buffered saline,PBS)(廠家Beyotime),JC-1(廠家Beyotime),線粒體耗氧率檢測試劑盒(上海康朗生物),MMP試劑盒(廠家Beyotime)。
1.2 方法
1.2.1 動物造模
選取30只大鼠,隨機分為5組,每組6只:正常對照組(Control組)、間歇性空氣對照組(Sham組)、5%間歇性低氧組(IH-4 w組)、5%間歇性低氧組(IH-6 w組)和5%間歇性低氧組(IH-8 w組)。Control組置于普通飼養箱,自由攝食水,不給予任何處置;Sham組每天9點至17點置于間歇性低氧倉,但氣源僅是壓縮空氣,倉內氧濃度始終維持在21%左右;IH組每天9點至17點置于間歇性低氧倉行間歇性低氧處置,以2 min為一周期,其中氮氣30 s,間歇10 s,空氣、氧氣混合氣體20 s,單純空氣60 s,使最低氧濃度分別達5%,最高氧濃度小于等于21%,按照分組分別持續4、6、8周。
選取18只大鼠,構建重度間歇性低氧模型,分為正常對照組(Control組)、間歇性空氣對照組(Sham組)和5%間歇性低氧8周組(IH-8 w組),每組6只,三組大鼠用1%戊巴比妥鈉按照40 mg/kg體重腹腔內注射,麻醉后在枕骨大孔處剪下頭部,咬骨鉗打開顱骨暴露出腦組織,冰面上快速剝離雙側海馬,在體視顯微鏡下以最快的速度分離海馬CA1區,以上操作在1 min內完成。
1.2.2 Morris水迷宮實驗
Morries水迷宮實驗用來評估大鼠的認知功能,包括定位航行實驗和空間探索實驗。定位航行實驗:實驗開始先將大鼠放入水池中(不放平臺)自由游泳2 min使其熟悉水迷宮環境。每天固定時間段分別訓練4次,連續訓練5天,具體操作是開始將平臺放置在第三象限中央,大鼠頭朝池壁從任一起始點(象限池壁圓弧中點)放入水中,4次訓練分別從4個不同起始點開始,動物運動軌跡跟蹤系統記錄了大鼠找到平臺的時間(逃避潛伏期)和游泳路徑,大鼠找到平臺或在120 s內找不到平臺(潛伏期記為120 s),都將大鼠放入平臺休息15 s后進行下一次實驗,4次實驗訓練所得潛伏期取平均值記錄為學習成績。空間探索實驗:訓練第6天撤除平臺,所有大鼠從同一入水點入水,入水點可為4個中任意一個,記錄大鼠2 min內跨越原來平臺的次數。
1.2.3 標本采集
先取重度間歇性低氧模型各組大鼠海馬CA1區組織約1 mm×1 mm×1 mm大小固定,再脫水、浸透、包埋、切片、電子染色處理,片染后晾干待觀察。
1.2.4 線粒體呼吸功能檢測
線粒體提取:剪取一小塊新鮮組織至1.5 mL離心管,對組織進行稱重,用PBS洗滌組織1次。再將剪切的細小的組織碎片加入預冷的線粒體分離試劑,在冰浴上進行勻漿10次,離心2次處理后沉淀即為分離得到的線粒體。
呼吸功能檢測:用PBS洗滌線粒體。加入100 μL線粒體HBSS懸液至96孔板中。每孔加入10 μL BBoxiProbe⑧R02氧熒光探針,充分混勻。每孔加入100 μL氧氣封閉液,使用熒光酶標儀(激發波長468 nm,發射波長603 nm)檢測15 min內線粒體外O2消耗變化情況,每2 min讀取1次。線粒體耗氧率試劑盒檢測最終耗氧率,判斷呼吸功能。
1.2.5 線粒體通透性測定
在二甲基亞砜中制備1 mg/mL JC-1染色原液。在96孔板中,每孔加入90 μL的0.2 μg/mL JC-1溶液,每孔中加入50 μg線粒體蛋白當量。用JC-1溶液將最終體積調整至100 μL,并在37℃、5% CO2的培養箱中孵育10~15 min。用熒光酶標儀分別檢測525~590 nm和490~530 nm處的熒光強度,進行數據分析。聚集的JC-1在525~590 nm處測量的紅色熒光(aggregate)代表完整的線粒體膜,而在490~530 nm處測量的單體JC-1的綠色熒光(monomer)代表被破壞的線粒體膜。結果用aggregate/monomer比值(mMPT)表示,反映跨膜氫離子電位的狀態以及線粒體膜的完整性。
1.2.6 線粒體膜電位(mitochondrial membrane potential,MMP)檢測
分離各組大鼠的線粒體,將分離后的線粒體重新懸浮于0.5 mL緩沖液中。經加入JC-1染色工作液、孵育、JC-1染色緩沖液、冰浴、離心、JC-1染色緩沖液再次洗滌處理后,流式細胞儀上機檢測,CELL Quest軟件分析。流式細胞術檢測MMP變化:線粒體膜電位較高時,JC-1在線粒體的基質中形成聚合物,可以產生紅色熒光(PE,JC-1 red);線粒體膜電位較低時,JC-1以單體形式存在于線粒體的基質中,可以產生綠色熒光(FITC,JC-1 green)。紅色熒光百分比與綠色熒光的百分比反應膜電位的水平,比值越高表明線粒體膜電位越正常,比值越低表明線粒體膜電位受到破壞而降低。
1.3 統計學方法
呈正態分布的計量數據以均數±標準差(x±s)表示。采用單因素方差分析比較組間差異。所有統計分析在GraphPad 7.0軟件上完成,P<0.05為差異有統計學意義。
2 結果
2.1 Morris水迷宮實驗
2.1.1 Morris水迷宮游泳軌跡圖及游泳速度
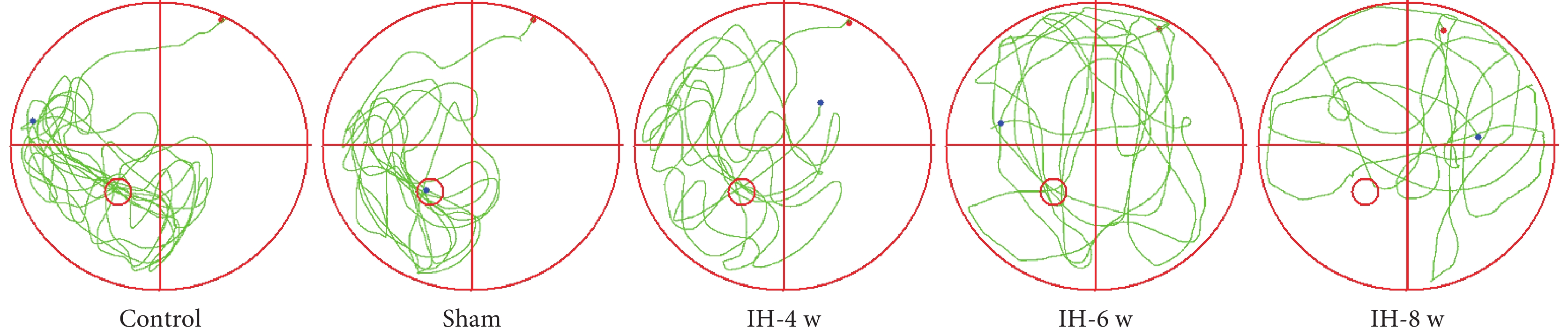
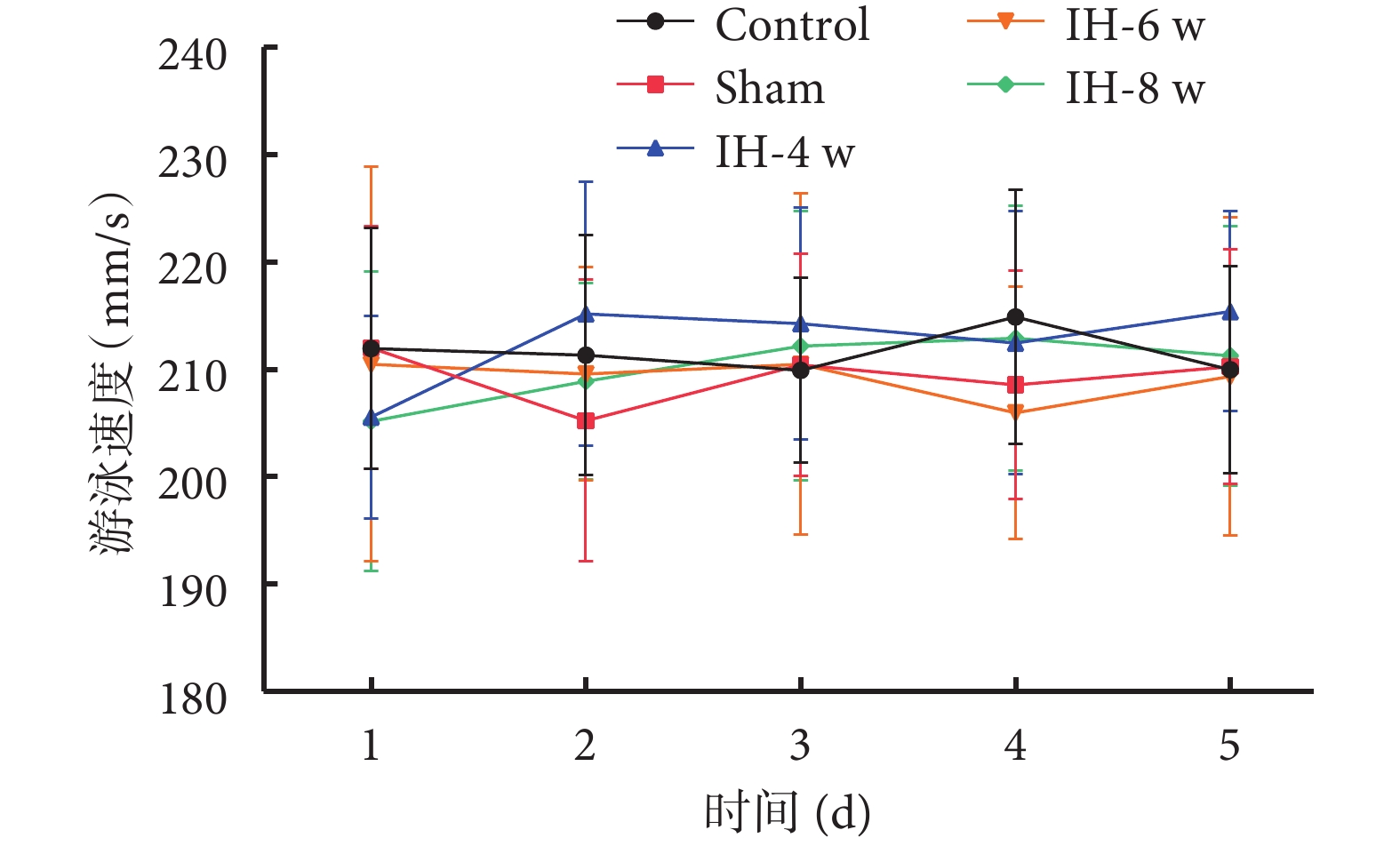
各組大鼠水迷宮游泳軌跡圖以及游泳速度結果見圖1和圖2。各組大鼠之間的游泳速度無明顯差異。
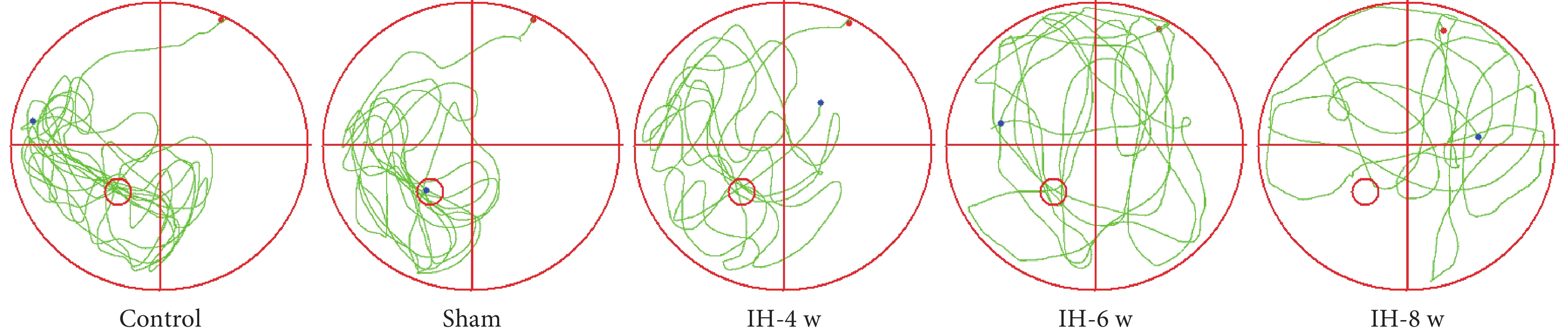 圖1
水迷宮游泳軌跡圖
圖1
水迷宮游泳軌跡圖
 圖2
水迷宮游泳速度
圖2
水迷宮游泳速度
2.1.2 找到隱藏平臺的時間(潛伏期)及目標象限停留時間
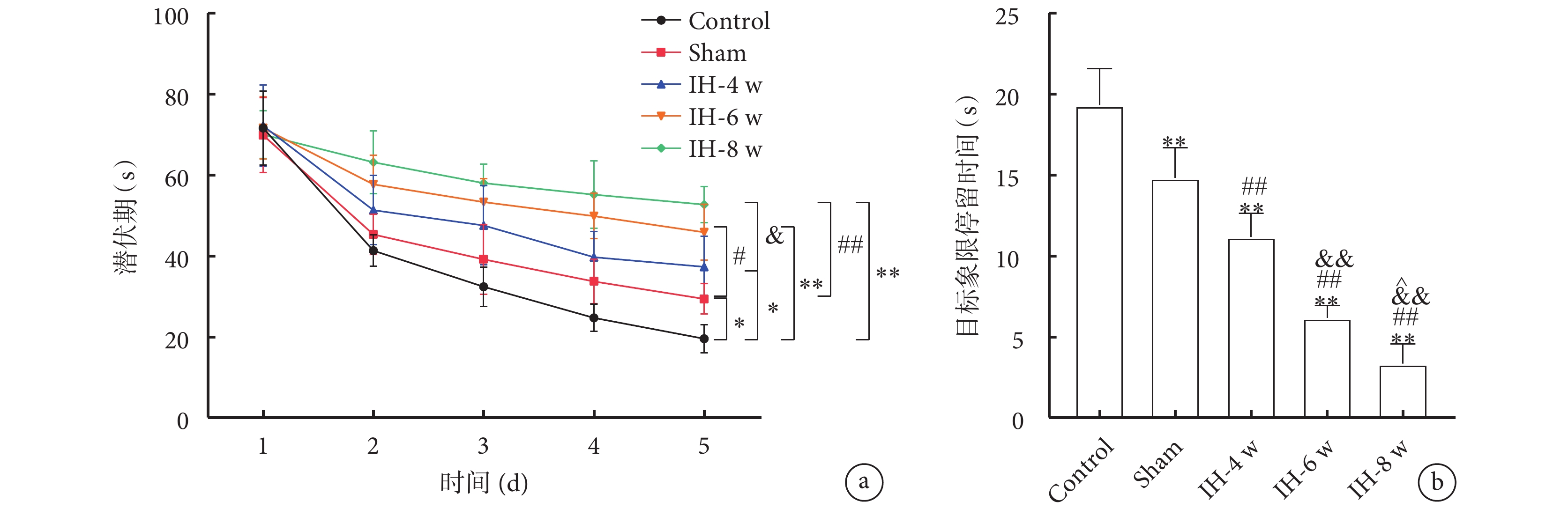
各組大鼠找到隱藏平臺的時間(潛伏期)以及目標象限停留時間的結果如圖3所示。與Control組大鼠相比,Sham組和IH各組大鼠的找到隱藏平臺的潛伏期明顯延長,目標象限停留時間明顯減少。隨著間歇性低氧時間的增加,大鼠找到隱藏平臺的潛伏期明顯增加,目標象限停留時間明顯縮短。
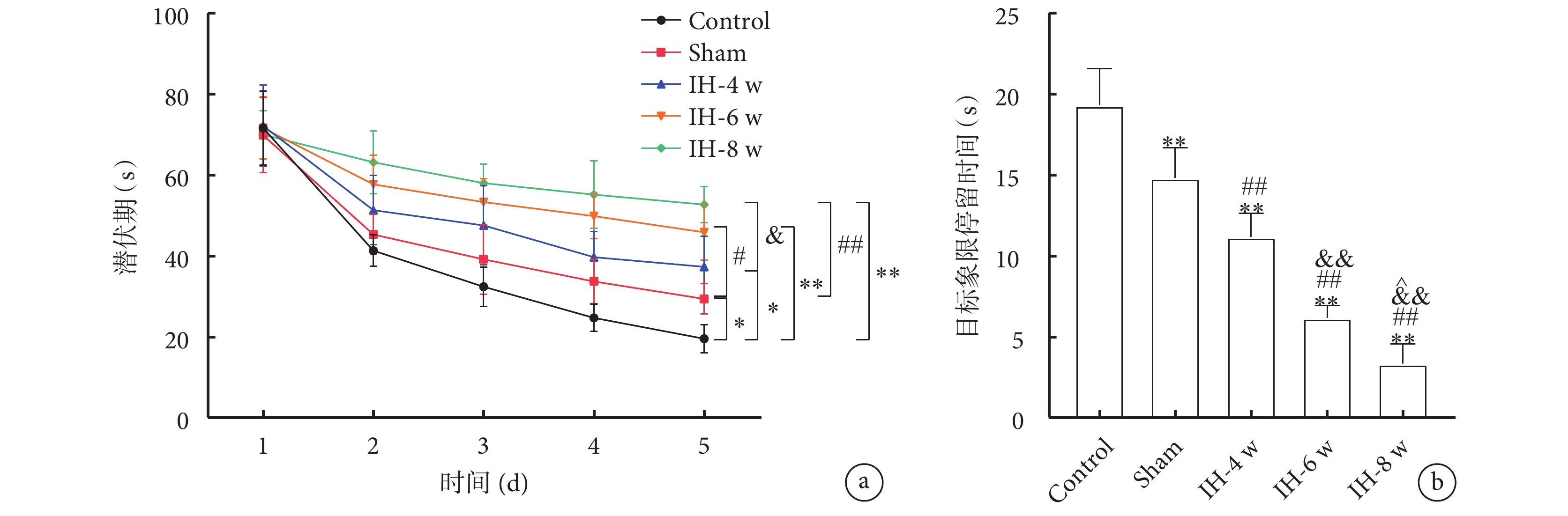 圖3
水迷宮游泳測試
圖3
水迷宮游泳測試
a. 找到隱藏平臺的時間(潛伏期);b. 目標象限停留時間。與Control組比較,*
總體趨勢:各組大鼠游泳速度無顯著差異;找到隱藏平臺的潛伏期:Control組<Sham組<IH-4 w組<IH-6 w組<IH-8 w組;目標象限停留時間:Control組>Sham組>IH-4 w組>IH-6 w組>IH-8 w組。
2.2 透視電子顯微鏡下線粒體表現
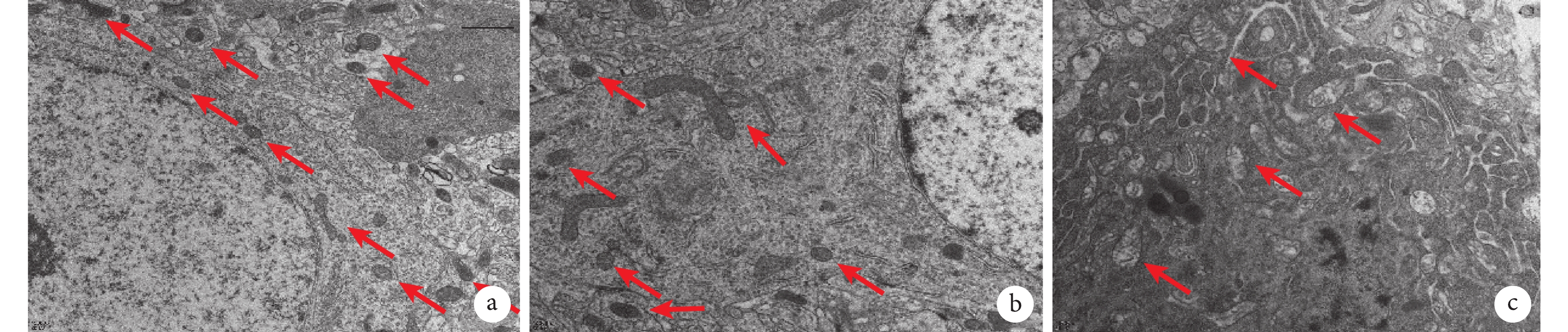
透視電子顯微鏡結果如圖4所示。Control組形態與正常線粒體一樣,呈現圓形或橢圓形,線粒體內外膜、嵴清晰顯示,未見斷裂,基質均勻,未見典型自噬體結構。Sham組和IH-8 w組線粒體可見雙層膜或多層膜,線粒體腫脹、嵴斷裂、空泡化。Control組、Sham組、IH-8 w組整體范圍所見線粒體數量依次減少,大小依次變大。
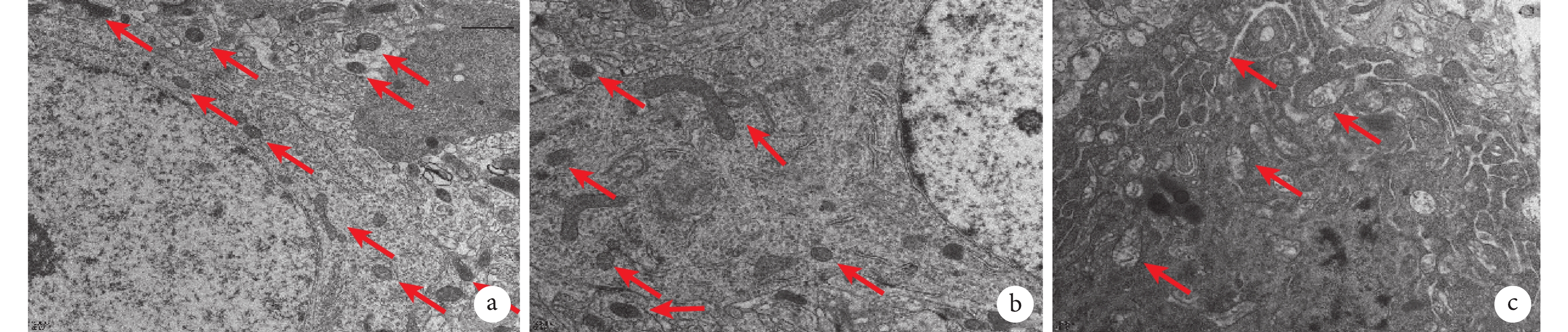 圖4
大鼠海馬CA1區線粒體透視電子顯微鏡像(×15 000)
圖4
大鼠海馬CA1區線粒體透視電子顯微鏡像(×15 000)
a. Control組:線粒體形態正常;b. Sham組:線粒體腫脹,內外膜破壞,嵴消失;c. IH-8 w組:線粒體腫脹、嵴斷裂、空泡化(紅色箭頭所指為線粒體)。
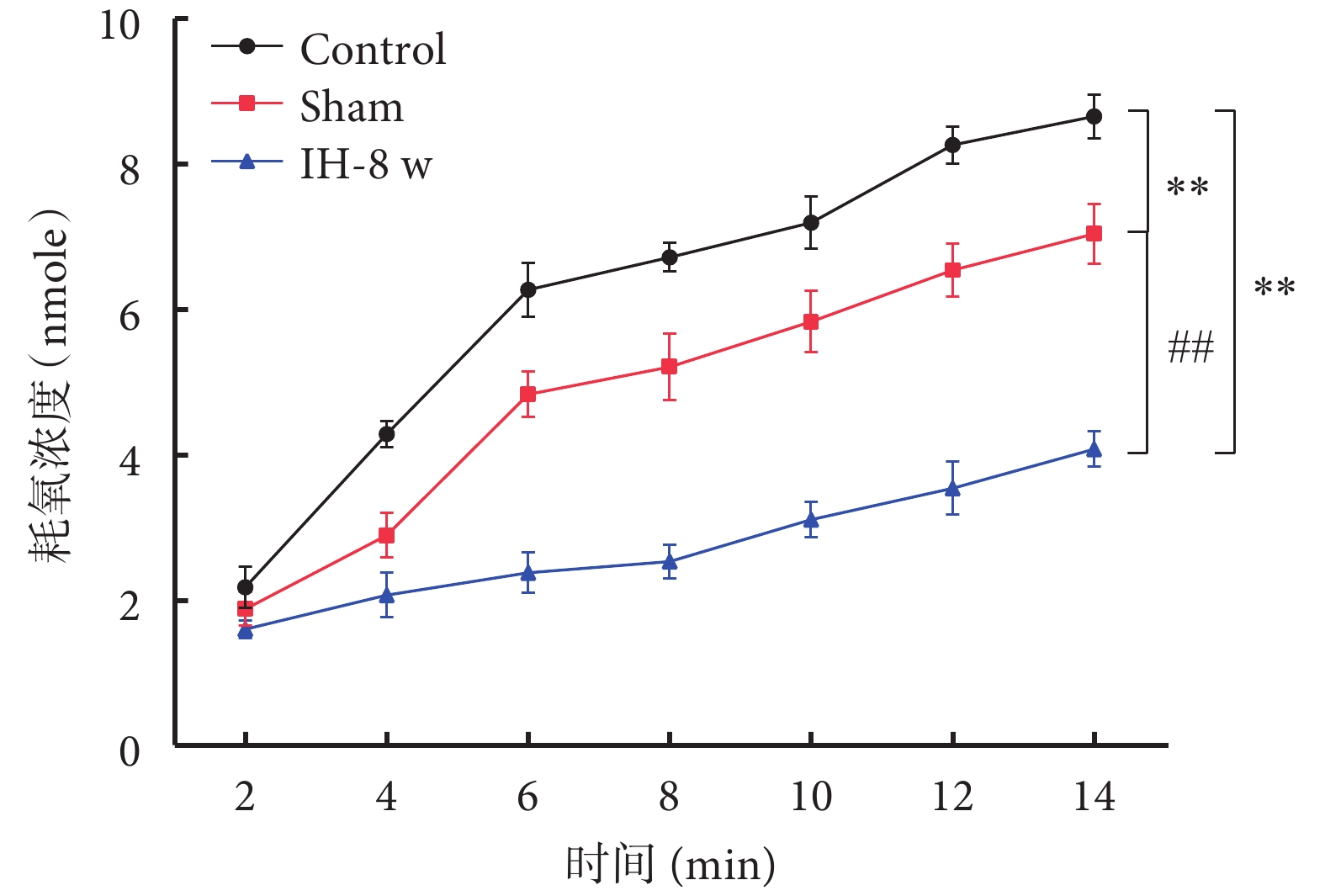
2.3 線粒體呼吸功能
線粒體呼吸功能檢測結果如圖5所示。與Control組相比,Sham組和IH-8 w組大鼠海馬CA1區線粒體呼吸功能明顯減弱;與Sham組相比,IH-8 w組大鼠海馬CA1區線粒體呼吸功能明顯減弱。線粒體呼吸功能的趨勢:Control組>Sham組>IH-8 w組。
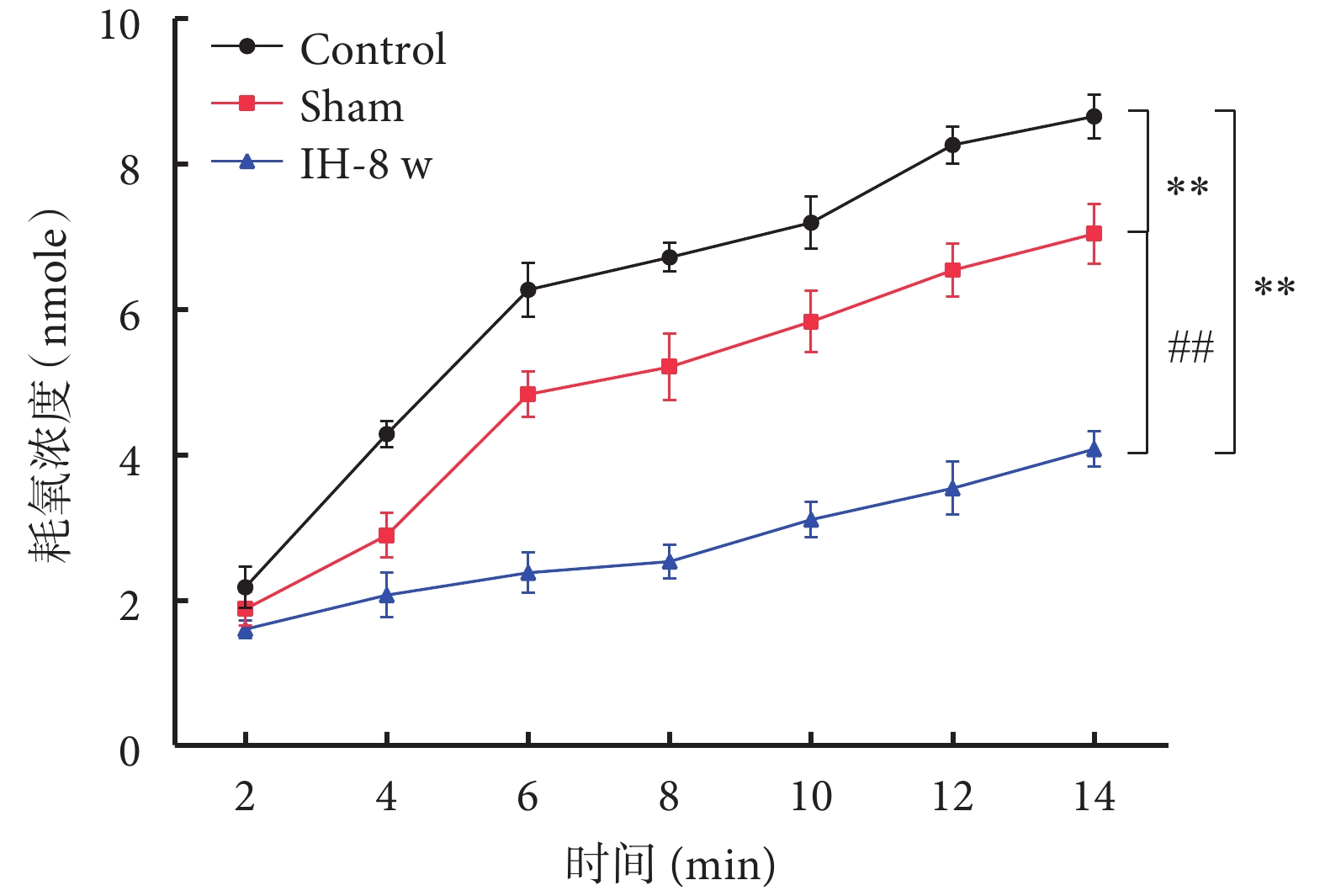 圖5
線粒體呼吸功能檢測
圖5
線粒體呼吸功能檢測
與Control組比較,*
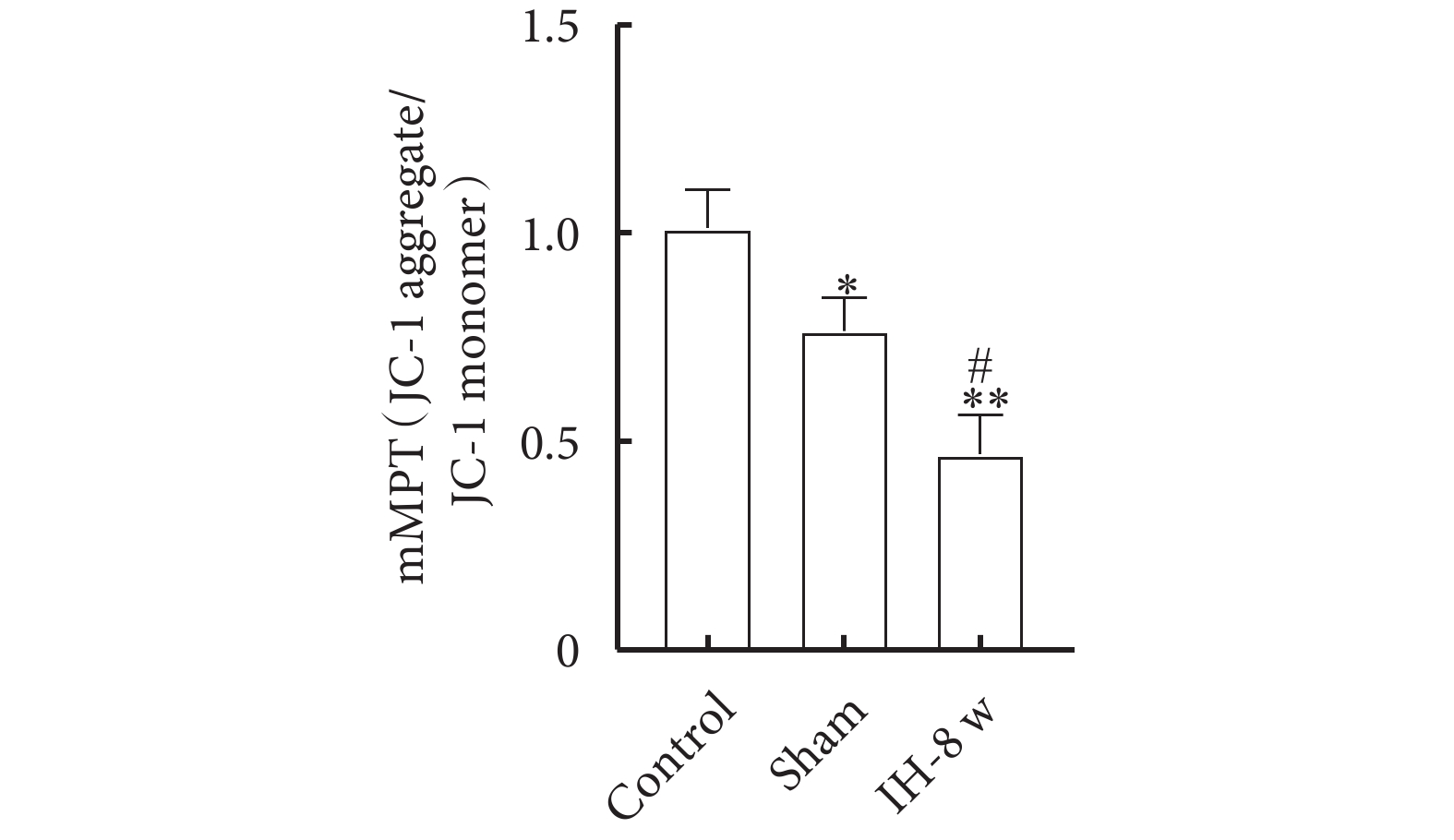
2.4 線粒體通透性
線粒體通透性測定結果如圖6所示。與Control組相比,Sham組和IH-8 w組大鼠海馬CA1區線粒體mMPT值明顯降低,表明線粒體通透性明顯增加;與Sham組相比,IH-8 w組大鼠海馬CA1區線粒體mMPT值明顯降低,表明線粒體通透性明顯增加。線粒體通透性的趨勢:Control組<Sham組<IH-8 w組。
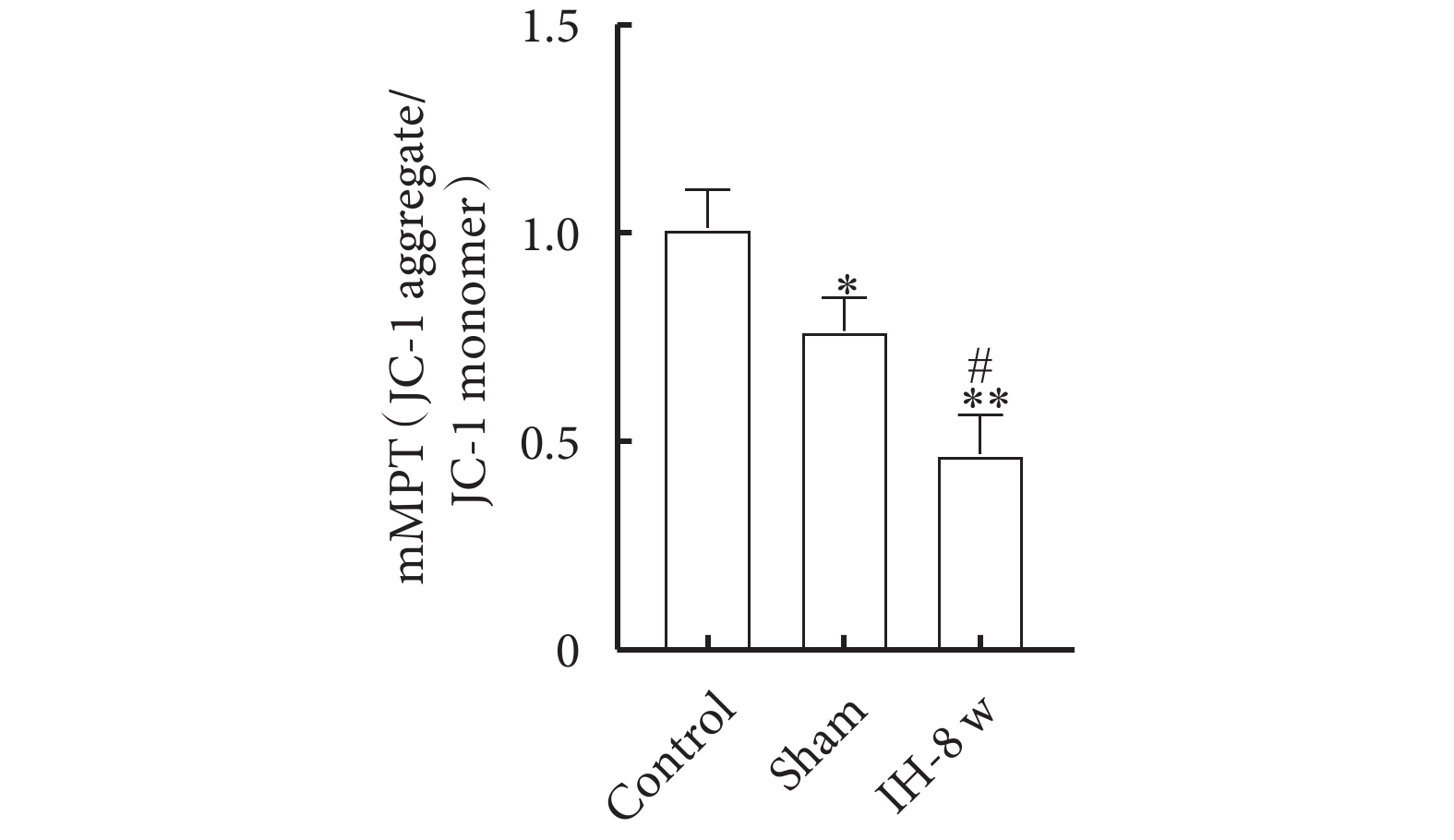 圖6
線粒體通透性測定
圖6
線粒體通透性測定
與Control組比較,*
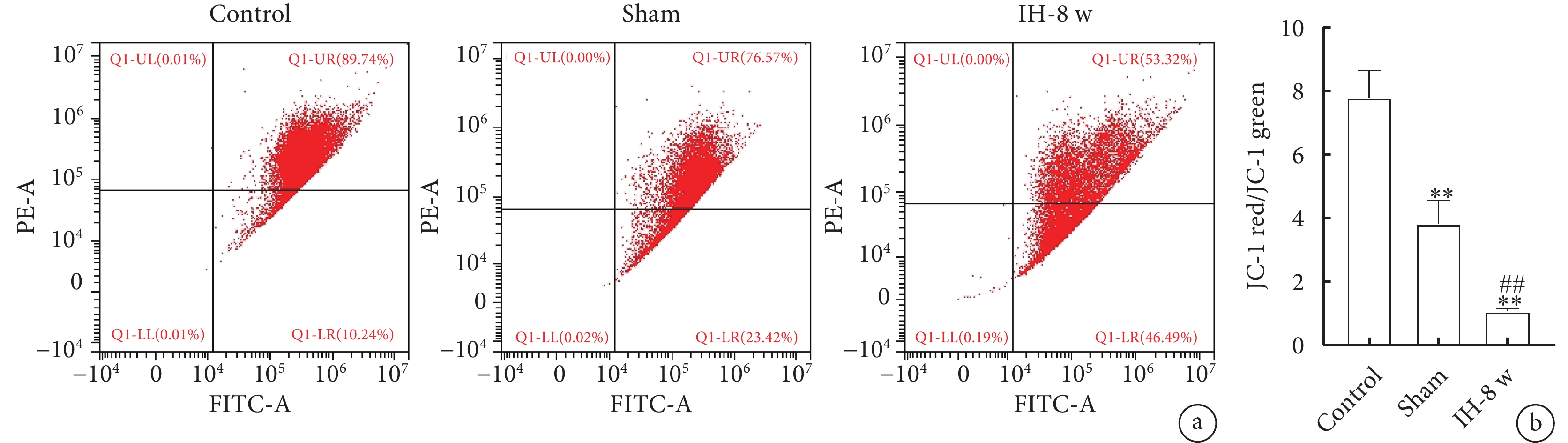
2.5 線粒體膜電位
線粒體膜電位檢測結果如圖7所示。與Control組相比,Sham組和IH-8 w組大鼠海馬CA1區線粒體膜電位明顯降低;與Sham組相比,IH-8 w組大鼠海馬CA1區線粒體膜電位明顯降低,表明間歇性低氧可以使線粒體膜電位降低。線粒體膜電位的趨勢:Control組>Sham組>IH-8 w組。
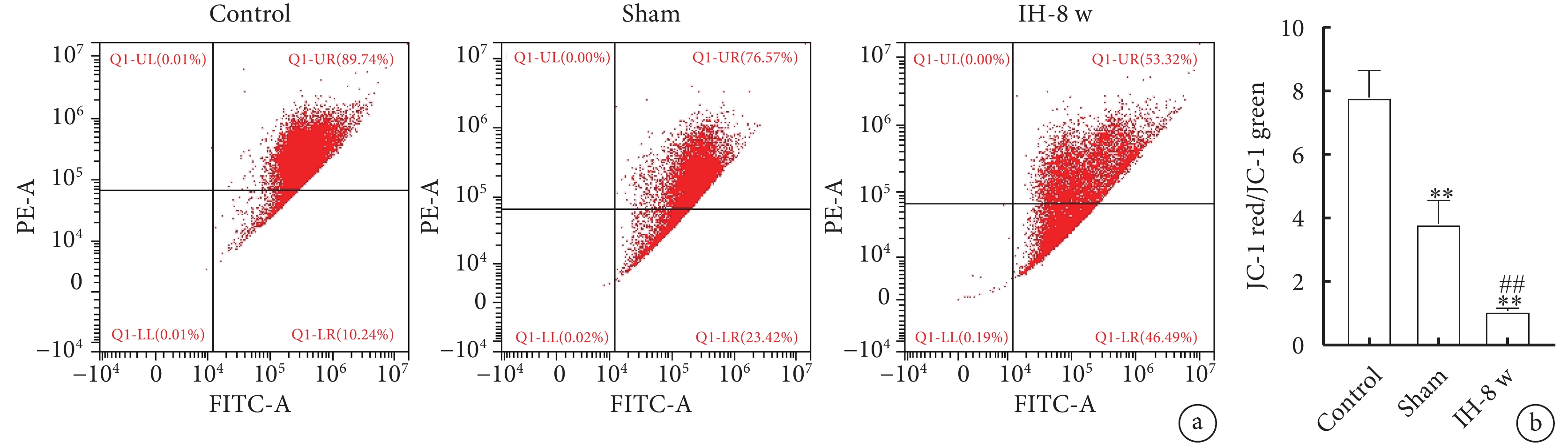 圖7
線粒體膜電位變化
圖7
線粒體膜電位變化
a. 線粒體膜電位流式分析圖;b. 線粒體膜電位。與Control組比較,*
3 討論
3.1 海馬區間歇性低氧對認知功能的影響
既往研究中,OSAHS患者大腦形態變化在海馬體,海馬體又是認知處理的關鍵區域[9-10]。海馬體根據細胞形態和皮質區發育不同分為CA1、CA2、CA3、CA4四個區域,其中CA1在記憶過程起重要作用。有關大鼠的實驗研究發現,間歇性缺氧引起的認知障礙與海馬體的變化有關[11]。同時也有研究闡述OSAHS可造成海馬損傷,出現認知缺陷,可能的原因是海馬區在間歇性低氧時的氧化應激損傷,包括導致的炎癥和細胞凋亡[12]。這說明了OSAHS發病時,缺氧造成的氧化應激損傷和腦區海馬微結構損傷與認知障礙存在相關性。
本研究中,Morris水迷宮實驗里各組大鼠的游泳速度無顯著差異,表明它們之間的神經運動能力無顯著差別,在Control組、Sham組、IH-4 w組、IH-6 w組、IH-8 w組的5組比較中,發現隱藏平臺的潛伏期依次增加,目標象限停留時間依次縮短。提示間歇性低氧對大鼠的空間記憶和空間探索能力的影響關系,隨著間歇性低氧時間延長,空間記憶和空間探索能力下降程度增加。說明OSAHS隨著缺氧時間增加,認知障礙的嚴重程度增加。
OSAHS的特征是間歇性缺氧,表現為短暫且高頻的血氧飽和度降低。間歇性缺氧為氧化應激和自由基的產生創造了條件,復氧可能導致再灌注損傷[13]。間歇性缺氧一方面可損害大鼠海馬體CA1區域突觸的可塑性,神經元突觸的長時程增強(long-term potentiation,LTP)受損,突觸前纖維受到高頻刺激后突觸傳遞強度減弱,而LTP與學習記憶相關[14]。另一方面缺氧時會導致皮質和海馬體發生失代償的內質網應激反應,CCAAT/增強子結合蛋白同源蛋白(C/EBP-homologous protein,CHOP)激活增加,CHOP激活導致缺氧誘導因子-1α(hypoxia inducible factor-1α,HIF-1α)表達增加和上調NADPH氧化酶-2,使得氧化應激增強,氧化應激反過來會促進內質網應激反應增強,進而增加CHOP和氧化應激,是氧化應激和神經元損傷的主要路徑[15]。同時上述路徑使ROS水平升高,ROS水平升高使GluN1[N-甲基-d-天冬氨酸受體(N-methyl-D-aspartate receptor,NMDAR)的必需亞基]水平下調,NMDAR在大腦功能方面發揮著重要作用[16]。缺氧時NMDAR依賴性LTP的喪失和海馬內核HIF-1α的增加,使得ROS的生成酶NADPH氧化酶-4表達增加了2倍,促進體內氧化狀態和GluN1的下調[17]。另外,缺氧誘導因子-2也會通過缺氧導致抗氧化酶活性降低,腦組織抗氧化能力降低導致損傷[18]。以上機制表明缺氧會對海馬神經元突觸和空間記憶產生損害。此外,體內促氧化劑/抗氧化劑的平衡狀態變化可使腦組織中脂質過氧化、蛋白質氧化、一氧化氮水平升高而損傷[2]。神經元對氧化應激高度敏感,氧化應激增強狀態下氧自由基和超氧化物增多,抗氧化酶缺乏,腦組織抗氧化能力就減弱引起損傷。
3.2 線粒體結構、功能與認知障礙
本研究發現間歇性低氧可以使線粒體形態發生改變,線粒體呼吸功能減弱,通透性降低,膜電位降低,表明間歇性低氧對于海馬CA1區線粒體形態、結構和功能產生負面影響,揭示了間歇性低氧的認知障礙與線粒體代謝之間的聯系。
哺乳動物90%的能量來自于線粒體,大腦神經元線粒體高度耗能,需要大量ATP維持離子穩態和調節局部鈣水平[19]。當病理狀態出現時,線粒體動力學失調和線粒體功能障礙是衰老、不同神經系統疾病和退行性疾病的關鍵所在[20]。二者之間存在聯系的原因可能通過以下機制解釋。有關實驗研究表明,間歇性缺氧所致的認知障礙是由線粒體功能障礙所致。因為缺氧導致細胞凋亡增加、細胞色素C從線粒體易位到胞質室,以及從腦中分離的線粒體產生的超氧化物增加。其中線粒體凋亡由ROS介導,線粒體內膜的通透性轉化孔開放,隨之線粒體膜電位破壞,重要線粒體蛋白前體的輸入中斷,使細胞器解體,細胞凋亡發生[21],這解釋了缺氧時線粒體膜電位破壞的現象及原因。另外,大腦中氧分壓和濃度很低且不均勻,大量的酶以氧氣作為底物,尤其是細胞色素C氧化酶,它是線粒體中ATP產生的關鍵所在,細胞色素C氧化酶對氧的親和力非常高,在正常條件下確保氧化磷酸化活性在非常低的PO2時不降低。大腦缺氧低于臨界水平后可以改變線粒體氧化磷酸化,減少ATP的產生,不足以維持離子泵的活性,進而導致神經元和星形膠質細胞快速且廣泛的膜去極化[22]。同時,氧化應激過強導致活性氧增加達到閾值水平,觸發線粒體通道其中之一的打開,這會導致線粒體膜電位同時崩潰,電子傳遞鏈產生的ROS瞬時增加,ROS的胞質釋放會觸發鄰近線粒體發生一系列變化,加重線粒體功能障礙從而形成正反饋[7,23]。這也解釋了低氧條件下線粒體膜電位水平發生變化的原因。此外,研究表明線粒體具有一種內置機制,可以對低水平的鈣做出反應,導致通透性增加、ATP酶誘導、氧化磷酸化解偶聯和呼吸功能喪失同時發生[24],而缺氧缺血時鈣離子從細胞外液易位到細胞中[25],線粒體感受到低鈣狀態做出反應,這解釋了線粒體通透性增加、呼吸及其他功能減弱的原因是缺氧時低鈣狀態所致。
ROS對神經元的有害作用也與其抗氧化活性密切相關[26],谷胱甘肽作為體內的抗氧化劑可以抵抗氧化應激,并且是中樞神經系統的調節劑。大腦本身由于谷胱甘肽過氧化物酶和過氧化氫酶含量低,易造成超氧化物歧化酶、超氧化物、羥自由基積聚,脂質過氧化損傷,超氧化物過多時和一氧化氮在體內結合可生成毒氧化劑過氧亞硝酸,此物質產生速度快,擴散距離遠,可以使脂質、蛋白質和DNA氧化,線粒體酶失活。谷胱甘肽在大腦本身含量比外周低,抗氧化能力弱而加劇了上述損傷[27]。以上研究均表明,線粒體功能代謝紊亂在低氧介導的認知障礙中的作用,對于相關領域疾病的治療具有潛在研究價值。例如,依達拉奉作為一種有效的自由基清除劑,可以顯著增強對羥自由基的抑制作用,阻擋腦組織脂質過氧化損傷,也可以上調海馬區超氧化物歧化酶、過氧化氫酶、腦源性神經營養因子和其他物質的表達,可減輕缺氧引起的認知障礙,增加線粒體數量[28]。明確這種影響關系有望進一步研究線粒體自噬在缺氧氧化應激時的保護作用,加深分子蛋白機制的研究,為相關藥物治療提供理論依據。
綜上所述,本研究通過建立重度間歇性低氧大鼠模型模擬OSAHS發病,發現重度間歇性缺氧時線粒體代謝功能紊亂,海馬區受損發生認知障礙,并且間歇性低氧損傷時間延長時的認知障礙程度加劇,為臨床早期診斷及其藥物治療提供理論依據。
利益沖突:本研究不涉及任何利益沖突。
阻塞性睡眠呼吸暫停低通氣綜合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是指在睡眠期間上呼吸道完全或部分阻塞導致的間歇性低氧/復氧和睡眠片段化,OSAHS患病可用間歇性低氧大鼠模型來模擬[1]。間歇性低氧和復氧導致氧化應激狀態增強,促使全身炎癥反應,產生大量活性氧(reactive oxygen species,ROS),使超氧陰離子(O2–)和過氧化氫(H2O2)等氧自由基和代謝產物大量積聚,氧化損傷細胞脂質、蛋白質和DNA。細胞抗氧能力下降出現損傷[2],腦組織對這種損傷作用反應敏感,表現為海馬及海馬旁灰質萎縮,此區域功能與認知、學習、記憶相關,海馬區神經元受損導致認知障礙的發生[3]。神經元功能高度依賴線粒體,線粒體不僅能夠產生ATP維持神經元離子梯度和突觸活動[4-5],也是調節生理活動重要信號樞紐[6]。線粒體促進細胞內各項生理活動,也可產生病理狀態。低氧氧化應激產生大量ROS同時也會使線粒體正常代謝功能障礙,影響神經元的正常功能,發生認知障礙 [6-7]。也有研究發現線粒體內在功能障礙可導致神經退行性病變[8]。這表明間歇性低氧導致的氧化應激損傷是引起認知障礙的機制之一,其線粒體代謝功能障礙可能與此機制相關。本研究目的在于建立重度間歇性低氧大鼠模型,通過對海馬CA1區線粒體的提取和純化,探討重度間歇性低氧大鼠在認知障礙時的線粒體結構和功能變化,同時采用不同間歇性低氧條件模型探討間歇性低氧及其嚴重程度對認知功能的影響。
1 材料與方法
1.1 實驗動物、儀器與試劑
1.1.1 實驗動物
選取48只成年雄性Wistar大鼠(體重160~180 g,6周齡),實驗前置于安靜環境、自然光照、溫度16~21℃、日溫差≤8℃、濕度40%~55%條件下適應性喂養1周。動物許可證號:SYXK 2019-0022。實驗動物中心的資質號:SCXK 2019-0008。
1.1.2 實驗儀器
Morris水迷宮系統(廠家Noldus),透視電子顯微鏡(廠家JEOL),熒光酶標儀(廠家Molecular Devices),流式細胞儀(廠家Beckman),正置顯微鏡(廠家Leica),移液器(廠家Eppendorf),低溫高速離心機(廠家Eppenedorf)。
1.1.3 實驗試劑
磷酸鹽緩沖液(phosphate buffered saline,PBS)(廠家Beyotime),JC-1(廠家Beyotime),線粒體耗氧率檢測試劑盒(上海康朗生物),MMP試劑盒(廠家Beyotime)。
1.2 方法
1.2.1 動物造模
選取30只大鼠,隨機分為5組,每組6只:正常對照組(Control組)、間歇性空氣對照組(Sham組)、5%間歇性低氧組(IH-4 w組)、5%間歇性低氧組(IH-6 w組)和5%間歇性低氧組(IH-8 w組)。Control組置于普通飼養箱,自由攝食水,不給予任何處置;Sham組每天9點至17點置于間歇性低氧倉,但氣源僅是壓縮空氣,倉內氧濃度始終維持在21%左右;IH組每天9點至17點置于間歇性低氧倉行間歇性低氧處置,以2 min為一周期,其中氮氣30 s,間歇10 s,空氣、氧氣混合氣體20 s,單純空氣60 s,使最低氧濃度分別達5%,最高氧濃度小于等于21%,按照分組分別持續4、6、8周。
選取18只大鼠,構建重度間歇性低氧模型,分為正常對照組(Control組)、間歇性空氣對照組(Sham組)和5%間歇性低氧8周組(IH-8 w組),每組6只,三組大鼠用1%戊巴比妥鈉按照40 mg/kg體重腹腔內注射,麻醉后在枕骨大孔處剪下頭部,咬骨鉗打開顱骨暴露出腦組織,冰面上快速剝離雙側海馬,在體視顯微鏡下以最快的速度分離海馬CA1區,以上操作在1 min內完成。
1.2.2 Morris水迷宮實驗
Morries水迷宮實驗用來評估大鼠的認知功能,包括定位航行實驗和空間探索實驗。定位航行實驗:實驗開始先將大鼠放入水池中(不放平臺)自由游泳2 min使其熟悉水迷宮環境。每天固定時間段分別訓練4次,連續訓練5天,具體操作是開始將平臺放置在第三象限中央,大鼠頭朝池壁從任一起始點(象限池壁圓弧中點)放入水中,4次訓練分別從4個不同起始點開始,動物運動軌跡跟蹤系統記錄了大鼠找到平臺的時間(逃避潛伏期)和游泳路徑,大鼠找到平臺或在120 s內找不到平臺(潛伏期記為120 s),都將大鼠放入平臺休息15 s后進行下一次實驗,4次實驗訓練所得潛伏期取平均值記錄為學習成績。空間探索實驗:訓練第6天撤除平臺,所有大鼠從同一入水點入水,入水點可為4個中任意一個,記錄大鼠2 min內跨越原來平臺的次數。
1.2.3 標本采集
先取重度間歇性低氧模型各組大鼠海馬CA1區組織約1 mm×1 mm×1 mm大小固定,再脫水、浸透、包埋、切片、電子染色處理,片染后晾干待觀察。
1.2.4 線粒體呼吸功能檢測
線粒體提取:剪取一小塊新鮮組織至1.5 mL離心管,對組織進行稱重,用PBS洗滌組織1次。再將剪切的細小的組織碎片加入預冷的線粒體分離試劑,在冰浴上進行勻漿10次,離心2次處理后沉淀即為分離得到的線粒體。
呼吸功能檢測:用PBS洗滌線粒體。加入100 μL線粒體HBSS懸液至96孔板中。每孔加入10 μL BBoxiProbe⑧R02氧熒光探針,充分混勻。每孔加入100 μL氧氣封閉液,使用熒光酶標儀(激發波長468 nm,發射波長603 nm)檢測15 min內線粒體外O2消耗變化情況,每2 min讀取1次。線粒體耗氧率試劑盒檢測最終耗氧率,判斷呼吸功能。
1.2.5 線粒體通透性測定
在二甲基亞砜中制備1 mg/mL JC-1染色原液。在96孔板中,每孔加入90 μL的0.2 μg/mL JC-1溶液,每孔中加入50 μg線粒體蛋白當量。用JC-1溶液將最終體積調整至100 μL,并在37℃、5% CO2的培養箱中孵育10~15 min。用熒光酶標儀分別檢測525~590 nm和490~530 nm處的熒光強度,進行數據分析。聚集的JC-1在525~590 nm處測量的紅色熒光(aggregate)代表完整的線粒體膜,而在490~530 nm處測量的單體JC-1的綠色熒光(monomer)代表被破壞的線粒體膜。結果用aggregate/monomer比值(mMPT)表示,反映跨膜氫離子電位的狀態以及線粒體膜的完整性。
1.2.6 線粒體膜電位(mitochondrial membrane potential,MMP)檢測
分離各組大鼠的線粒體,將分離后的線粒體重新懸浮于0.5 mL緩沖液中。經加入JC-1染色工作液、孵育、JC-1染色緩沖液、冰浴、離心、JC-1染色緩沖液再次洗滌處理后,流式細胞儀上機檢測,CELL Quest軟件分析。流式細胞術檢測MMP變化:線粒體膜電位較高時,JC-1在線粒體的基質中形成聚合物,可以產生紅色熒光(PE,JC-1 red);線粒體膜電位較低時,JC-1以單體形式存在于線粒體的基質中,可以產生綠色熒光(FITC,JC-1 green)。紅色熒光百分比與綠色熒光的百分比反應膜電位的水平,比值越高表明線粒體膜電位越正常,比值越低表明線粒體膜電位受到破壞而降低。
1.3 統計學方法
呈正態分布的計量數據以均數±標準差(x±s)表示。采用單因素方差分析比較組間差異。所有統計分析在GraphPad 7.0軟件上完成,P<0.05為差異有統計學意義。
2 結果
2.1 Morris水迷宮實驗
2.1.1 Morris水迷宮游泳軌跡圖及游泳速度
各組大鼠水迷宮游泳軌跡圖以及游泳速度結果見圖1和圖2。各組大鼠之間的游泳速度無明顯差異。
 圖1
水迷宮游泳軌跡圖
圖1
水迷宮游泳軌跡圖
 圖2
水迷宮游泳速度
圖2
水迷宮游泳速度
2.1.2 找到隱藏平臺的時間(潛伏期)及目標象限停留時間
各組大鼠找到隱藏平臺的時間(潛伏期)以及目標象限停留時間的結果如圖3所示。與Control組大鼠相比,Sham組和IH各組大鼠的找到隱藏平臺的潛伏期明顯延長,目標象限停留時間明顯減少。隨著間歇性低氧時間的增加,大鼠找到隱藏平臺的潛伏期明顯增加,目標象限停留時間明顯縮短。
 圖3
水迷宮游泳測試
圖3
水迷宮游泳測試
a. 找到隱藏平臺的時間(潛伏期);b. 目標象限停留時間。與Control組比較,*
總體趨勢:各組大鼠游泳速度無顯著差異;找到隱藏平臺的潛伏期:Control組<Sham組<IH-4 w組<IH-6 w組<IH-8 w組;目標象限停留時間:Control組>Sham組>IH-4 w組>IH-6 w組>IH-8 w組。
2.2 透視電子顯微鏡下線粒體表現
透視電子顯微鏡結果如圖4所示。Control組形態與正常線粒體一樣,呈現圓形或橢圓形,線粒體內外膜、嵴清晰顯示,未見斷裂,基質均勻,未見典型自噬體結構。Sham組和IH-8 w組線粒體可見雙層膜或多層膜,線粒體腫脹、嵴斷裂、空泡化。Control組、Sham組、IH-8 w組整體范圍所見線粒體數量依次減少,大小依次變大。
 圖4
大鼠海馬CA1區線粒體透視電子顯微鏡像(×15 000)
圖4
大鼠海馬CA1區線粒體透視電子顯微鏡像(×15 000)
a. Control組:線粒體形態正常;b. Sham組:線粒體腫脹,內外膜破壞,嵴消失;c. IH-8 w組:線粒體腫脹、嵴斷裂、空泡化(紅色箭頭所指為線粒體)。
2.3 線粒體呼吸功能
線粒體呼吸功能檢測結果如圖5所示。與Control組相比,Sham組和IH-8 w組大鼠海馬CA1區線粒體呼吸功能明顯減弱;與Sham組相比,IH-8 w組大鼠海馬CA1區線粒體呼吸功能明顯減弱。線粒體呼吸功能的趨勢:Control組>Sham組>IH-8 w組。
 圖5
線粒體呼吸功能檢測
圖5
線粒體呼吸功能檢測
與Control組比較,*
2.4 線粒體通透性
線粒體通透性測定結果如圖6所示。與Control組相比,Sham組和IH-8 w組大鼠海馬CA1區線粒體mMPT值明顯降低,表明線粒體通透性明顯增加;與Sham組相比,IH-8 w組大鼠海馬CA1區線粒體mMPT值明顯降低,表明線粒體通透性明顯增加。線粒體通透性的趨勢:Control組<Sham組<IH-8 w組。
 圖6
線粒體通透性測定
圖6
線粒體通透性測定
與Control組比較,*
2.5 線粒體膜電位
線粒體膜電位檢測結果如圖7所示。與Control組相比,Sham組和IH-8 w組大鼠海馬CA1區線粒體膜電位明顯降低;與Sham組相比,IH-8 w組大鼠海馬CA1區線粒體膜電位明顯降低,表明間歇性低氧可以使線粒體膜電位降低。線粒體膜電位的趨勢:Control組>Sham組>IH-8 w組。
 圖7
線粒體膜電位變化
圖7
線粒體膜電位變化
a. 線粒體膜電位流式分析圖;b. 線粒體膜電位。與Control組比較,*
3 討論
3.1 海馬區間歇性低氧對認知功能的影響
既往研究中,OSAHS患者大腦形態變化在海馬體,海馬體又是認知處理的關鍵區域[9-10]。海馬體根據細胞形態和皮質區發育不同分為CA1、CA2、CA3、CA4四個區域,其中CA1在記憶過程起重要作用。有關大鼠的實驗研究發現,間歇性缺氧引起的認知障礙與海馬體的變化有關[11]。同時也有研究闡述OSAHS可造成海馬損傷,出現認知缺陷,可能的原因是海馬區在間歇性低氧時的氧化應激損傷,包括導致的炎癥和細胞凋亡[12]。這說明了OSAHS發病時,缺氧造成的氧化應激損傷和腦區海馬微結構損傷與認知障礙存在相關性。
本研究中,Morris水迷宮實驗里各組大鼠的游泳速度無顯著差異,表明它們之間的神經運動能力無顯著差別,在Control組、Sham組、IH-4 w組、IH-6 w組、IH-8 w組的5組比較中,發現隱藏平臺的潛伏期依次增加,目標象限停留時間依次縮短。提示間歇性低氧對大鼠的空間記憶和空間探索能力的影響關系,隨著間歇性低氧時間延長,空間記憶和空間探索能力下降程度增加。說明OSAHS隨著缺氧時間增加,認知障礙的嚴重程度增加。
OSAHS的特征是間歇性缺氧,表現為短暫且高頻的血氧飽和度降低。間歇性缺氧為氧化應激和自由基的產生創造了條件,復氧可能導致再灌注損傷[13]。間歇性缺氧一方面可損害大鼠海馬體CA1區域突觸的可塑性,神經元突觸的長時程增強(long-term potentiation,LTP)受損,突觸前纖維受到高頻刺激后突觸傳遞強度減弱,而LTP與學習記憶相關[14]。另一方面缺氧時會導致皮質和海馬體發生失代償的內質網應激反應,CCAAT/增強子結合蛋白同源蛋白(C/EBP-homologous protein,CHOP)激活增加,CHOP激活導致缺氧誘導因子-1α(hypoxia inducible factor-1α,HIF-1α)表達增加和上調NADPH氧化酶-2,使得氧化應激增強,氧化應激反過來會促進內質網應激反應增強,進而增加CHOP和氧化應激,是氧化應激和神經元損傷的主要路徑[15]。同時上述路徑使ROS水平升高,ROS水平升高使GluN1[N-甲基-d-天冬氨酸受體(N-methyl-D-aspartate receptor,NMDAR)的必需亞基]水平下調,NMDAR在大腦功能方面發揮著重要作用[16]。缺氧時NMDAR依賴性LTP的喪失和海馬內核HIF-1α的增加,使得ROS的生成酶NADPH氧化酶-4表達增加了2倍,促進體內氧化狀態和GluN1的下調[17]。另外,缺氧誘導因子-2也會通過缺氧導致抗氧化酶活性降低,腦組織抗氧化能力降低導致損傷[18]。以上機制表明缺氧會對海馬神經元突觸和空間記憶產生損害。此外,體內促氧化劑/抗氧化劑的平衡狀態變化可使腦組織中脂質過氧化、蛋白質氧化、一氧化氮水平升高而損傷[2]。神經元對氧化應激高度敏感,氧化應激增強狀態下氧自由基和超氧化物增多,抗氧化酶缺乏,腦組織抗氧化能力就減弱引起損傷。
3.2 線粒體結構、功能與認知障礙
本研究發現間歇性低氧可以使線粒體形態發生改變,線粒體呼吸功能減弱,通透性降低,膜電位降低,表明間歇性低氧對于海馬CA1區線粒體形態、結構和功能產生負面影響,揭示了間歇性低氧的認知障礙與線粒體代謝之間的聯系。
哺乳動物90%的能量來自于線粒體,大腦神經元線粒體高度耗能,需要大量ATP維持離子穩態和調節局部鈣水平[19]。當病理狀態出現時,線粒體動力學失調和線粒體功能障礙是衰老、不同神經系統疾病和退行性疾病的關鍵所在[20]。二者之間存在聯系的原因可能通過以下機制解釋。有關實驗研究表明,間歇性缺氧所致的認知障礙是由線粒體功能障礙所致。因為缺氧導致細胞凋亡增加、細胞色素C從線粒體易位到胞質室,以及從腦中分離的線粒體產生的超氧化物增加。其中線粒體凋亡由ROS介導,線粒體內膜的通透性轉化孔開放,隨之線粒體膜電位破壞,重要線粒體蛋白前體的輸入中斷,使細胞器解體,細胞凋亡發生[21],這解釋了缺氧時線粒體膜電位破壞的現象及原因。另外,大腦中氧分壓和濃度很低且不均勻,大量的酶以氧氣作為底物,尤其是細胞色素C氧化酶,它是線粒體中ATP產生的關鍵所在,細胞色素C氧化酶對氧的親和力非常高,在正常條件下確保氧化磷酸化活性在非常低的PO2時不降低。大腦缺氧低于臨界水平后可以改變線粒體氧化磷酸化,減少ATP的產生,不足以維持離子泵的活性,進而導致神經元和星形膠質細胞快速且廣泛的膜去極化[22]。同時,氧化應激過強導致活性氧增加達到閾值水平,觸發線粒體通道其中之一的打開,這會導致線粒體膜電位同時崩潰,電子傳遞鏈產生的ROS瞬時增加,ROS的胞質釋放會觸發鄰近線粒體發生一系列變化,加重線粒體功能障礙從而形成正反饋[7,23]。這也解釋了低氧條件下線粒體膜電位水平發生變化的原因。此外,研究表明線粒體具有一種內置機制,可以對低水平的鈣做出反應,導致通透性增加、ATP酶誘導、氧化磷酸化解偶聯和呼吸功能喪失同時發生[24],而缺氧缺血時鈣離子從細胞外液易位到細胞中[25],線粒體感受到低鈣狀態做出反應,這解釋了線粒體通透性增加、呼吸及其他功能減弱的原因是缺氧時低鈣狀態所致。
ROS對神經元的有害作用也與其抗氧化活性密切相關[26],谷胱甘肽作為體內的抗氧化劑可以抵抗氧化應激,并且是中樞神經系統的調節劑。大腦本身由于谷胱甘肽過氧化物酶和過氧化氫酶含量低,易造成超氧化物歧化酶、超氧化物、羥自由基積聚,脂質過氧化損傷,超氧化物過多時和一氧化氮在體內結合可生成毒氧化劑過氧亞硝酸,此物質產生速度快,擴散距離遠,可以使脂質、蛋白質和DNA氧化,線粒體酶失活。谷胱甘肽在大腦本身含量比外周低,抗氧化能力弱而加劇了上述損傷[27]。以上研究均表明,線粒體功能代謝紊亂在低氧介導的認知障礙中的作用,對于相關領域疾病的治療具有潛在研究價值。例如,依達拉奉作為一種有效的自由基清除劑,可以顯著增強對羥自由基的抑制作用,阻擋腦組織脂質過氧化損傷,也可以上調海馬區超氧化物歧化酶、過氧化氫酶、腦源性神經營養因子和其他物質的表達,可減輕缺氧引起的認知障礙,增加線粒體數量[28]。明確這種影響關系有望進一步研究線粒體自噬在缺氧氧化應激時的保護作用,加深分子蛋白機制的研究,為相關藥物治療提供理論依據。
綜上所述,本研究通過建立重度間歇性低氧大鼠模型模擬OSAHS發病,發現重度間歇性缺氧時線粒體代謝功能紊亂,海馬區受損發生認知障礙,并且間歇性低氧損傷時間延長時的認知障礙程度加劇,為臨床早期診斷及其藥物治療提供理論依據。
利益沖突:本研究不涉及任何利益沖突。