引用本文: 譚玉芬, 熊國林, 葉園園, 黃翠碧, 韋鑫燕, 李杰, 黃麗華, 賓雁飛. 煙草煙霧暴露通過TNF-α/Caspase-3/GSDME通路介導細胞焦亡促進骨骼肌萎縮. 中國呼吸與危重監護雜志, 2024, 23(10): 710-718. doi: 10.7507/1671-6205.202408075 復制
版權信息: ?四川大學華西醫院華西期刊社《中國呼吸與危重監護雜志》版權所有,未經授權不得轉載、改編
煙草煙霧暴露引發的慢性肺部異常炎癥反應是慢性阻塞性肺疾病 (chronic obstructive pulmonary disease,COPD,簡稱慢阻肺) 發病的主要因素[1-2]。骨骼肌萎縮和功能障礙是慢阻肺最常見的肺外合并癥之一,高達34%的慢阻肺患者伴有骨骼肌萎縮和功能障礙[3],表現為顯著的肌肉萎縮、收縮能力下降和運動功能障礙,這些不僅影響患者的生活質量,還顯著增加了慢阻肺患者的死亡率和住院率,是預測慢阻肺 死亡的獨立危險因素[4-5]。但目前關于慢阻肺骨骼肌萎縮和功能障礙的分子機制仍未完全闡明。研究表明,細胞焦亡(pyroptosis)與骨骼肌萎縮和功能障礙有關[6–8]。細胞焦亡是由GSDM家族(GSDMs)介導的具有免疫原性的程序性細胞死亡方式,可被多個胞外信號分子如 TNF-α識別并激活,GSDMs被活化的Caspase裂解以釋放具有細胞膜成孔功能的N-末端結構域,導致細胞內容物的釋放,誘導炎癥反應[9]。研究顯示,GSDME被活化的caspase-3特異性切割,產生 GSDME-N 片段,該片段穿透細胞膜,從而誘導細胞焦亡[10]。 Caspase-3/GSDME信號介導的焦亡參與了骨骼肌萎縮的發生發展[11]。然而,長期的煙草煙霧暴露是否通過TNF-α激活Caspase-3/GSDME通路誘導骨骼肌細胞焦亡,從而促進骨骼肌萎縮,目前尚不清楚。本研究旨在探討煙草煙霧誘導骨骼肌萎縮的機制是否與Caspase-3/GSDME介導的焦亡有關,為慢阻肺相關骨骼肌萎縮的治療機制提供一種新的策略。
1 材料與方法
1.1 材料
實驗動物:C57BL/6小鼠(5~6周,18 ± 2 g)購自廣西醫科大學實驗動物中心。環境溫度、濕度適宜,光/暗周期為12 h/12 h,小鼠自由飲水和進食。本研究已通過廣西醫科大學實驗動物倫理委員會審批。
實驗材料:C2C12小鼠成肌細胞系(中國科學院上海細胞庫,SCSP-505),胎牛血清(Gibco,10099141C),馬血清(Vivacell,C2510-0500 ),DMEM 高糖培養基(Gibco,C11995500BT)。Caspase-3 抑制劑Z-DEVD-FMK (MedChemExpress,HY-
實驗儀器:細胞培養箱(Thermo Scientific
1.2 方法
1.2.1 組織學分析
新鮮組織用 4% 多聚甲醛固定,然后脫水、石蠟包埋、切片,脫蠟、脫水,進行 HE 染色分析肌纖維的橫截面積(CSA)和形態。進一步將腓腸肌切片進行免疫組織化學染色,切片經抗原修復、3%過氧化氫孵育、封閉后,與一抗4 °C孵育過夜。第2天用二抗孵育,DAB 顯色,蘇木精復染。用病理顯微鏡拍照,每個切片隨機選取5個視野進行圖像采集,使用 ImageJ 軟件進行分析。
1.2.2 CS提取物(CS extract,CSE)的制備
參考文獻[12],將3支無濾嘴的香煙依次連接到含有3 ml磷酸鹽緩沖液(PBS)的抽吸裝置上,點燃香煙,用50 ml注射器緩慢抽吸,煙霧被溶解在PBS中,pH調至7.4,然后經0.22 μm無菌過濾器過濾以制成CSE。測量CSE的光密度,并在1h內使用。
1.2.3 細胞模型建立與分組
將C2C12細胞培養在含10%胎牛血清的DMEM高糖培養基中,置于37 ℃、5%CO2的培養箱中培養。當細胞融合度達80%后更換含2%馬血清的分化培養基,誘導分化5天至肌管形成[13]。將C2C12肌管分為對照組(Control組)、CSE組、CSE+100 μmol/L DMF組(CSE+DMF組)、CSE+50 μmol/L Z-DEVD-FMK 組(CSE+Z-DEVD-FMK組)、80ng/ml TNF-α組(TNF-α組)。Control組不做任何處理,CSE組用0.2%CSE處理24 h; CSE+DMF組用100 μmol/L DMF預處理C2C12細胞1h,再與0.2%CSE共處理24 h; CSE+Z-DEVD-FMK 組用50 μmol/L Z-DEVD-FMK預處理C2C12細胞1h,再用0.2%CSE處理24 h;TNF-α組用80 ng/ml 重組TNF-α蛋白干預24 h。
1.2.4 Hoechst 33342 /碘化丙啶(propidium iodide,PI)染色
經過不同處理的細胞,用磷酸緩沖鹽水(PBS)洗滌,加入含Hoechst和PI的細胞染色緩沖液30min。用熒光顯微鏡捕獲細胞圖像。隨機選擇3個不同的視野,計算PI陽性細胞比例。
1.2.5 LDH釋放實驗
使用LDH檢測試劑盒檢測骨骼肌細胞LDH釋放率,根據說明書操作,取各孔細胞培養基與60μL LDH檢測工作液混合,避光孵育30 min。使用酶標儀測量各孔490 nm處光密度值。
1.2.6 Western blot法檢測 Caspase-3、GSDME蛋白表達
收集各組C2C12細胞經裂解后的蛋白,通過電泳分離,轉膜,封閉后。與一抗4 ℃孵育過夜,熒光二抗室溫孵育1 h。紅外熒光顯影儀觀察與分析蛋白條帶。
1.2.7 免疫熒光
4%多聚甲醛固定細胞20 min,置于0.25%Triton X-100通透15 min,3%BSA封閉1 h,隨后用MyHC抗體4?C孵育過夜。第2天用熒光二抗避光孵育1 h,DAPI染核5min,在熒光顯微鏡下觀察,MyHC表達陽性(紅色)表明該細胞是骨骼肌細胞。肌管直徑:使用 ImageJ 軟件,對每組中不少于100個肌管的直徑進行了測量,并取平均值[14]。
1.2.8 動物分組與造模
C57BL/6小鼠隨機分為2組:對照(Control)組、CS組。CS組小鼠放進熏煙箱,點燃5支香煙,每次1 h,熏煙間隔0.5 h以上,每日4次,5天/周;Control組小鼠正常飼養。 第24周實驗結束后取材,稱取小鼠腓腸肌(GM)重量,取右側腓腸肌用于組織學評估,左側腓腸肌組織用于進一步蛋白分析
1.3 統計學方法
數據用 Graph Prism 10.0 進行分析,以均數 ± 標準差(SD)表示。根據數據的分布情況,兩組比較時,采用學生 t 檢驗或 Mann-Whitney U 檢驗。多組間比較使用單因素方差分析或 Kruskal-Wallis 檢驗。P<0.05視為差異有統計學意義。
2 結果
2.1 慢性CS暴露對小鼠腓腸肌形態和焦亡相關蛋白cleaved-caspase-3、GSDME-N的影響
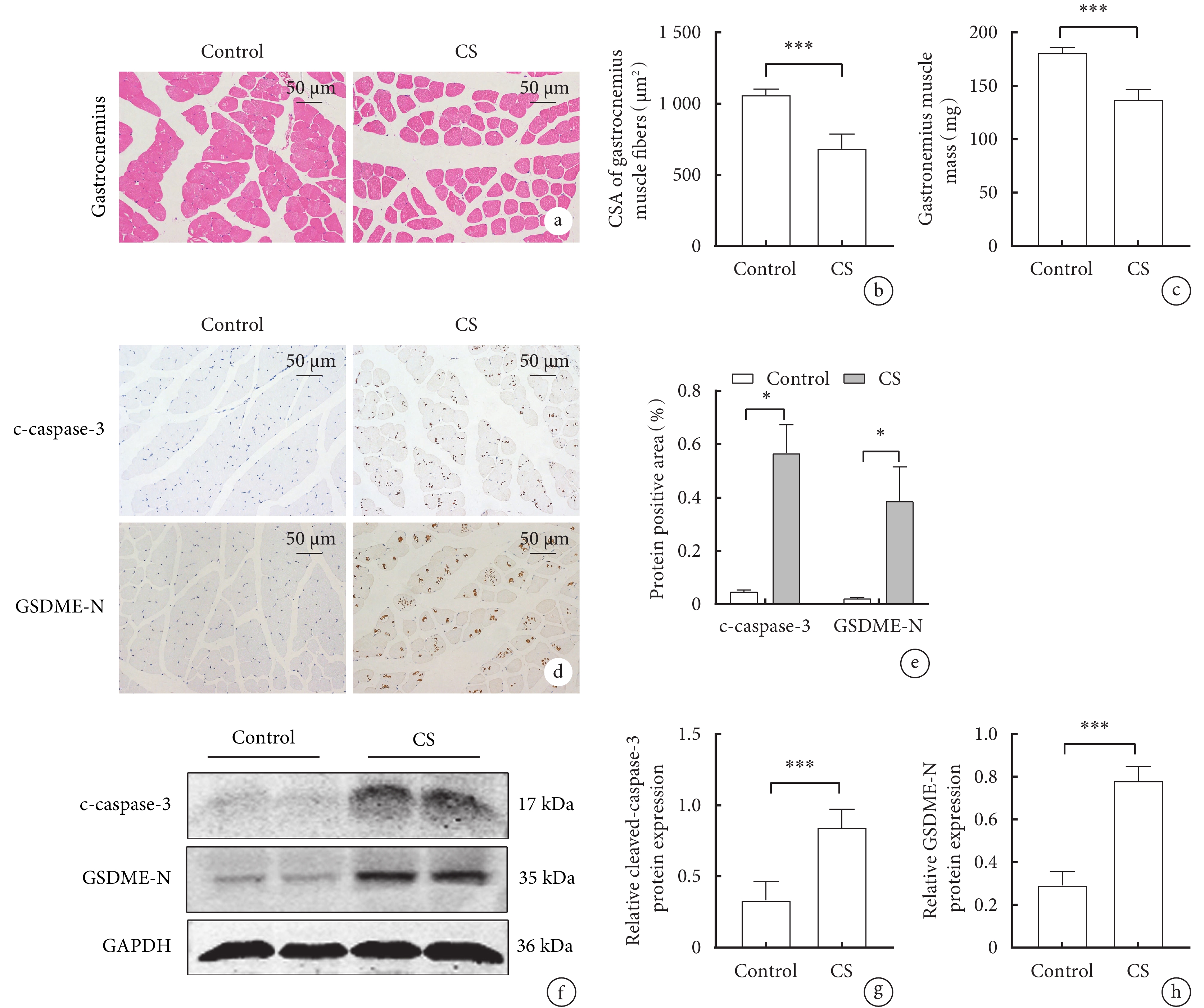
HE染色結果顯示,與對照組相比,CS組小鼠腓腸肌的肌纖維橫截面積(CSA)顯著降低(圖1a,b),CS組小鼠的腓腸肌重量明顯減輕,(180.83±5.31)mg vs(137±9.4) mg(P<0.05)(圖1c)。免疫組化結果顯示,CS組小鼠腓腸肌中Caspase-3和GSDME的陽性率較對照組顯著增加(P<0.05)(圖1d,e)。Western blot 結果顯示,與對照組相比, CS 組腓腸肌中 cleaved-caspase-3 及 GSDME-N 蛋白表達顯著升高(P<0.05)(圖1f,g,h)。表明慢性CS暴露誘導骨骼肌萎縮的同時伴隨著Caspase-3/GSDME介導的焦亡激活。
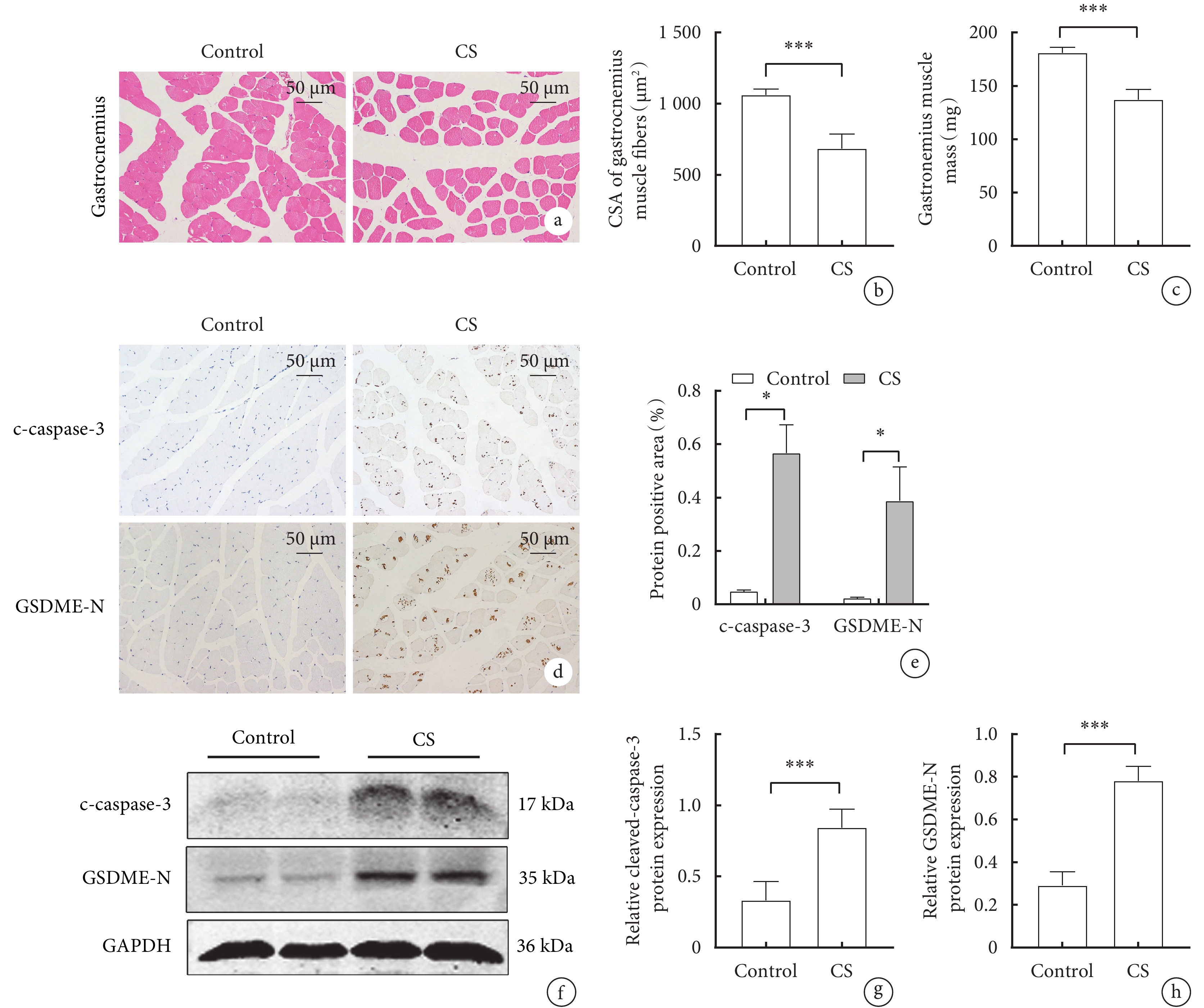 圖1
兩組小鼠腓腸肌的形態、重量和cleaved-caspase-3、GSDME-N蛋白表達比較
圖1
兩組小鼠腓腸肌的形態、重量和cleaved-caspase-3、GSDME-N蛋白表達比較
a. 腓腸肌的HE染色代表性圖像(x200); b. 腓腸肌肌纖維橫截面積;c. 腓腸肌的重量; d. 小鼠GM的c-caspase-3、GSDME-N免疫組織化學染色圖像,(X200);e. c-caspase-3和GSDME-N的免疫組織化學分析的定量; f. cleaved-caspase-3、GSDME-N蛋白表達的Western blot代表性圖像;g. cleaved-caspase-3的表達水平;h. GSDME-N的表達水平
2.2 CSE對骨骼肌細胞焦亡相關蛋白表達水平和肌管直徑的影響
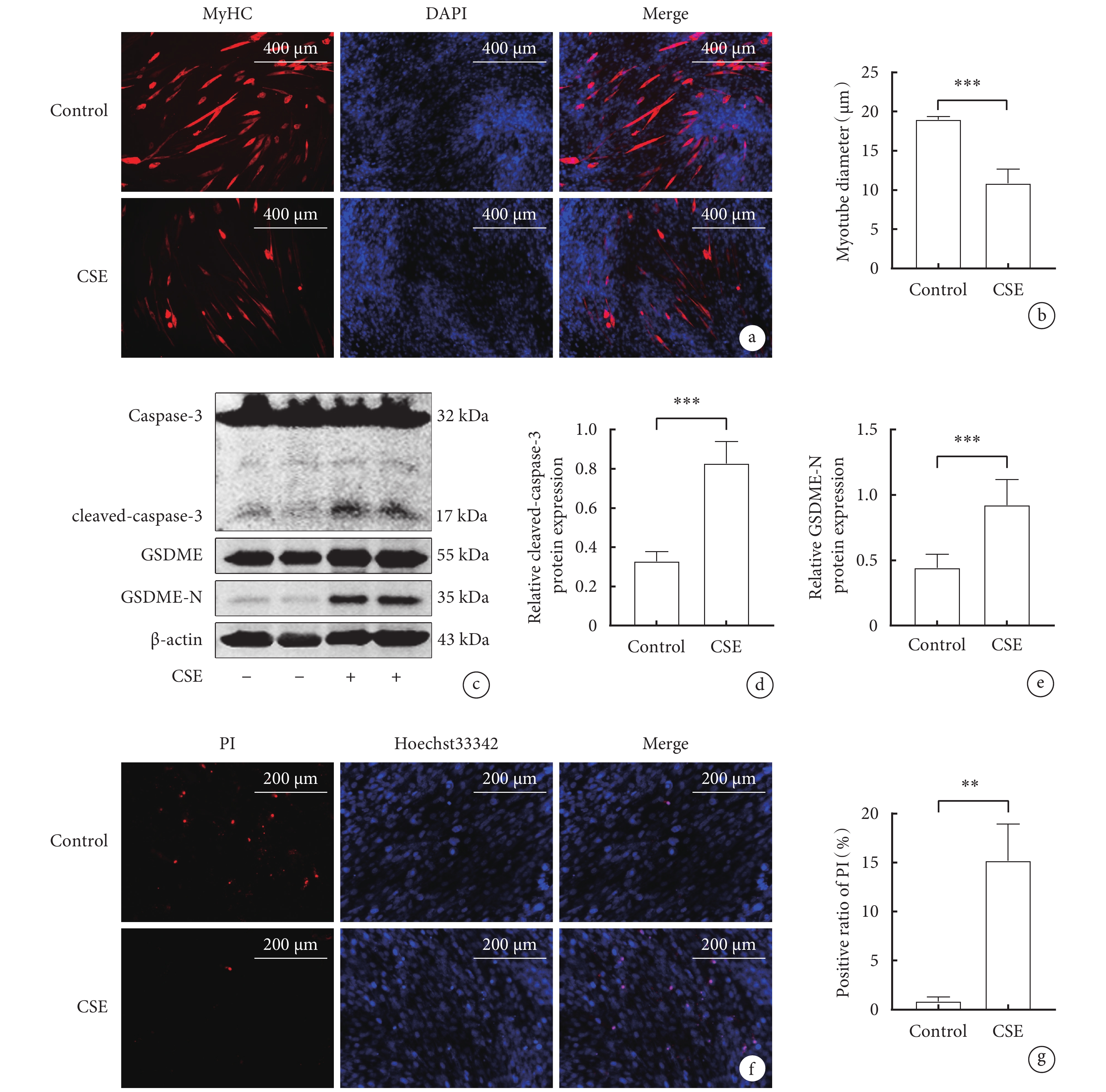
免疫熒光結果顯示,與對照組相比,CSE組肌管直徑明顯縮小(P<0.05)(圖2a,b)。與對照組相比,CSE組C2C12細胞中cleaved-caspase-3、GSDME-N蛋白的相對表達量顯著增加(P<0.05)(圖2c,d,e)。Hoechst
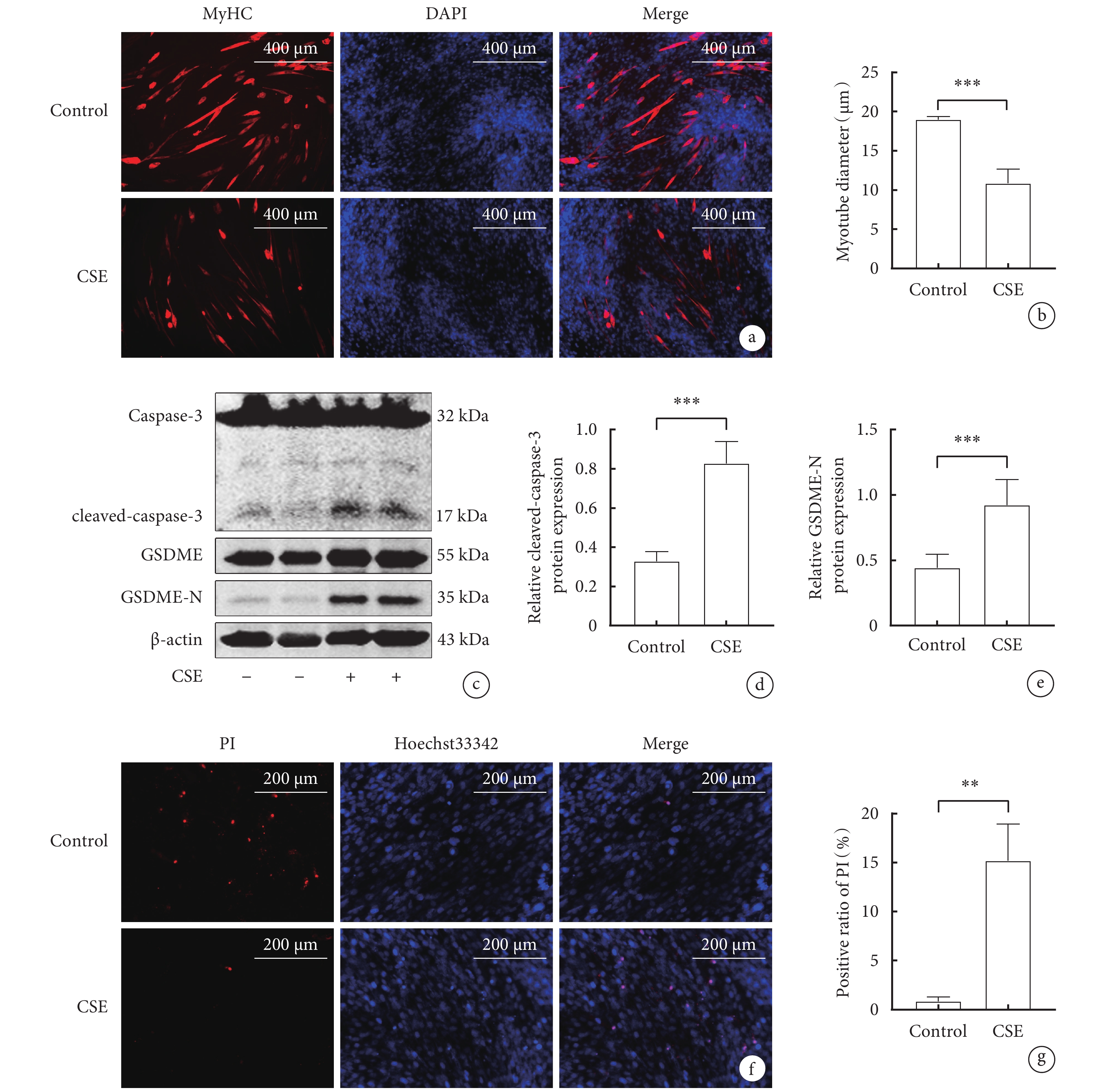 圖2
CSE對骨骼肌細胞焦亡相關指標和肌管直徑影響
圖2
CSE對骨骼肌細胞焦亡相關指標和肌管直徑影響
a. 骨骼肌細胞MyHC免疫熒光圖(x100);b. .兩組C2C12肌管直徑;c. cleaved-caspase-3、GSDME-N蛋白表達水平的Western blot代表性圖像; d. cleaved-caspase-3的蛋白表達水平;e. GSDME-N的蛋白表達水平;f. Hoechst 33342/ PI雙染色的代表性圖像(x200); g. 兩組骨骼肌細胞PI陽性率比較。
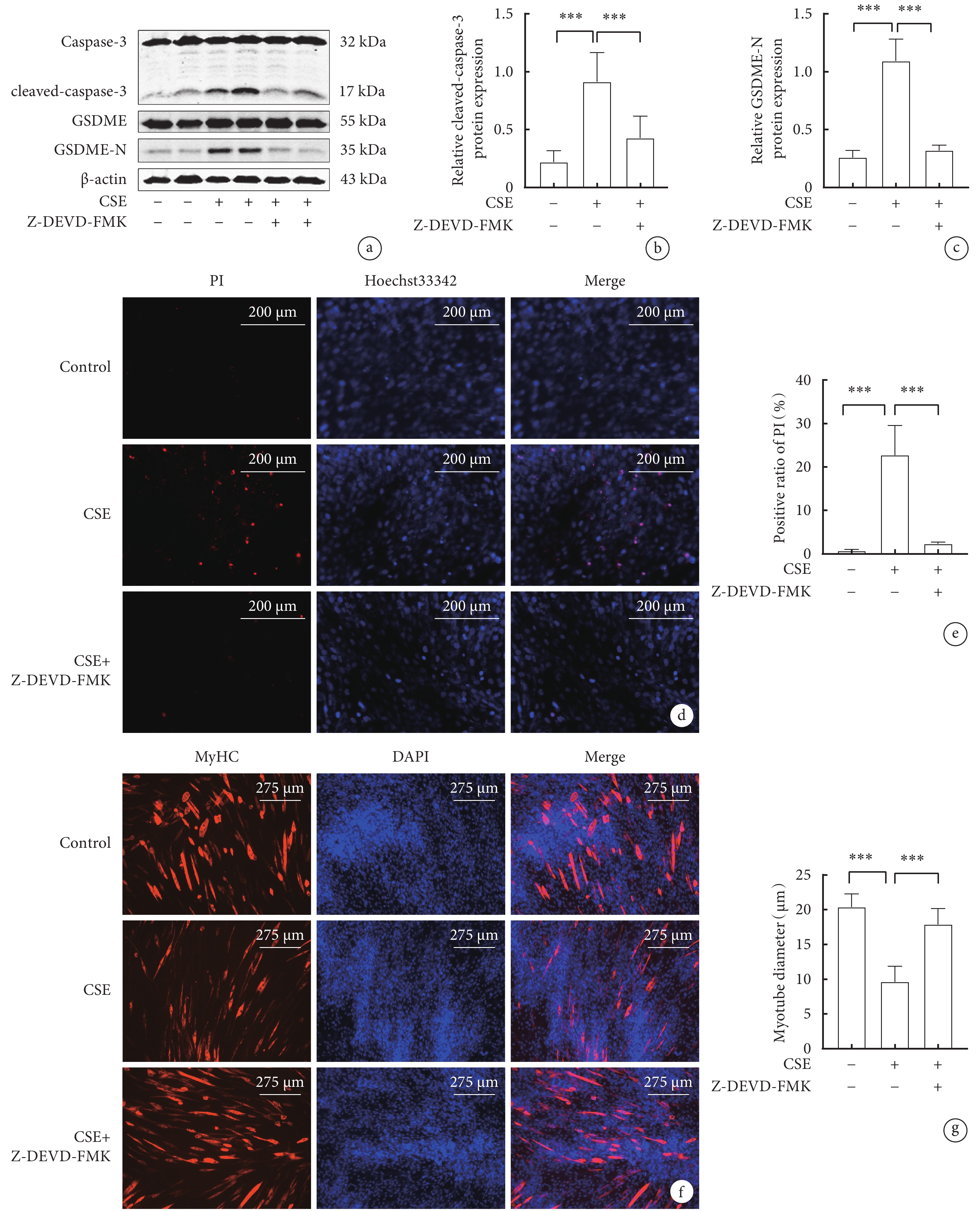
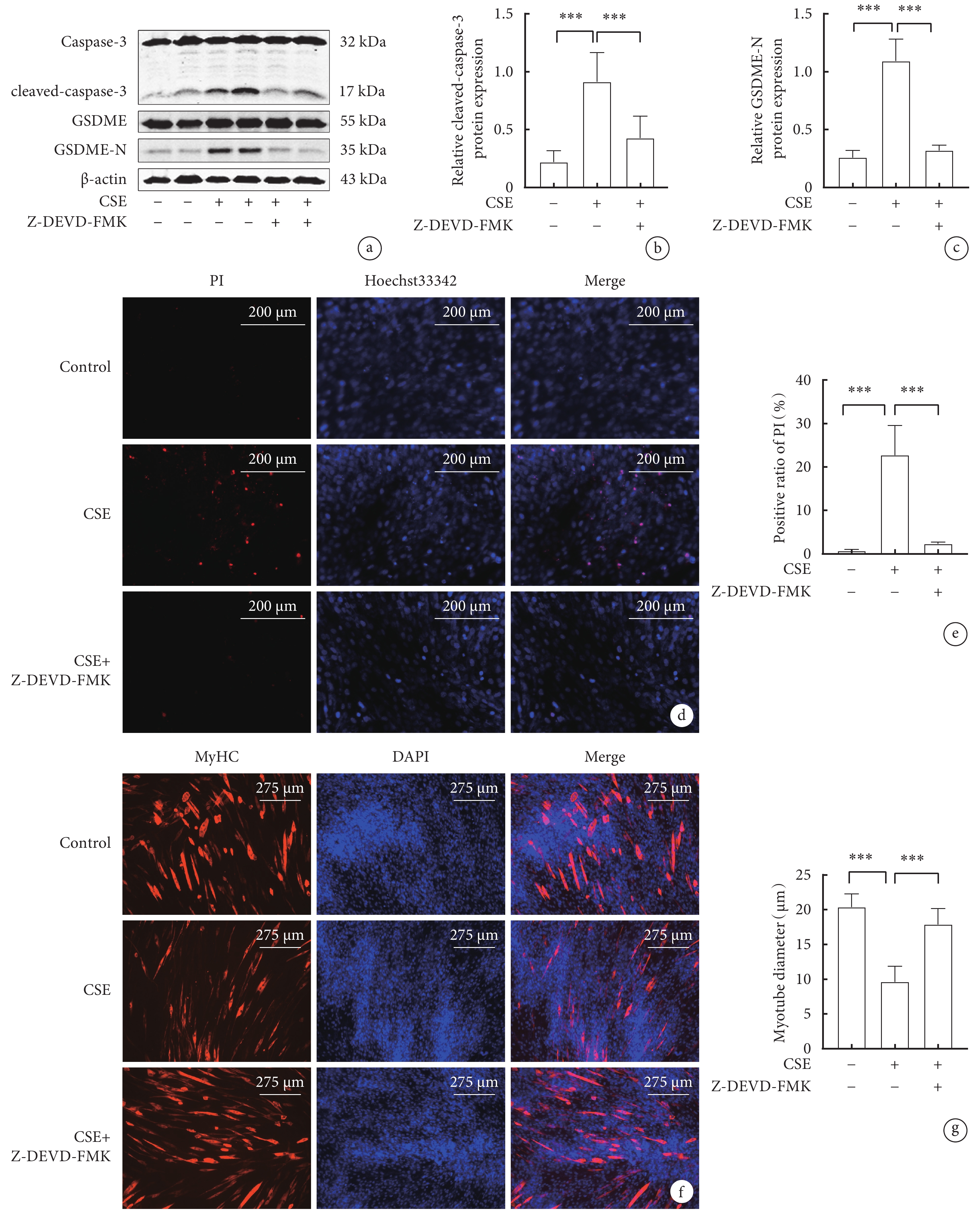 圖3
抑制Caspase-3對骨骼肌細胞焦亡相關指標和肌管直徑影響
圖3
抑制Caspase-3對骨骼肌細胞焦亡相關指標和肌管直徑影響
a. 各組骨骼肌細胞cleaved-caspase-3、GSDME-N蛋白表達水平的Western blot代表性圖像; b. cleaved-caspase-3的表達水平;c. GSDME-N的表達水平;d. Hoechst 33342/ PI雙染色的代表性圖像(x200);e. 各組骨骼肌細胞PI陽性率比較;f. 骨骼肌細胞MyHC免疫熒光圖(x100); g. 各組C2C12肌管直徑比較。
2.3 抑制Caspase-3對CSE誘導的C2C12細胞焦亡相關蛋白,PI陽性率和肌管直徑的影響
Caspase-3抑制劑Z-DEVD-FMK預處理C2C12細胞,再用CSE處理24 h。與對照組相比,CSE 組 cleaved-caspase-3、GSDME-N蛋白表達水平升高(P<0.05);與CSE 組相比,CSE+Z-DEVD-FMK組cleaved-caspase-3、GSDME-N蛋白表達下降(P<0.05)(圖3a,b,c)。與對照組相比,CSE組PI陽性比例升高(P<0.05);與CSE組相比,CSE+Z-DEVD-FMK組PI陽性比例顯著下降(P<0.05)(圖3d,e)。與對照組相比,CSE組肌管直徑顯著縮小(P<0.05);與CSE組相比,CSE+Z-DEVD-FMK組肌管直徑明顯增加(P<0.05)(圖3 f,g)。這些結果表明,CSE誘導骨骼肌細胞焦亡需要Caspase-3的激活,抑制Caspase-3的激活有效緩解CSE誘導的肌管萎縮。
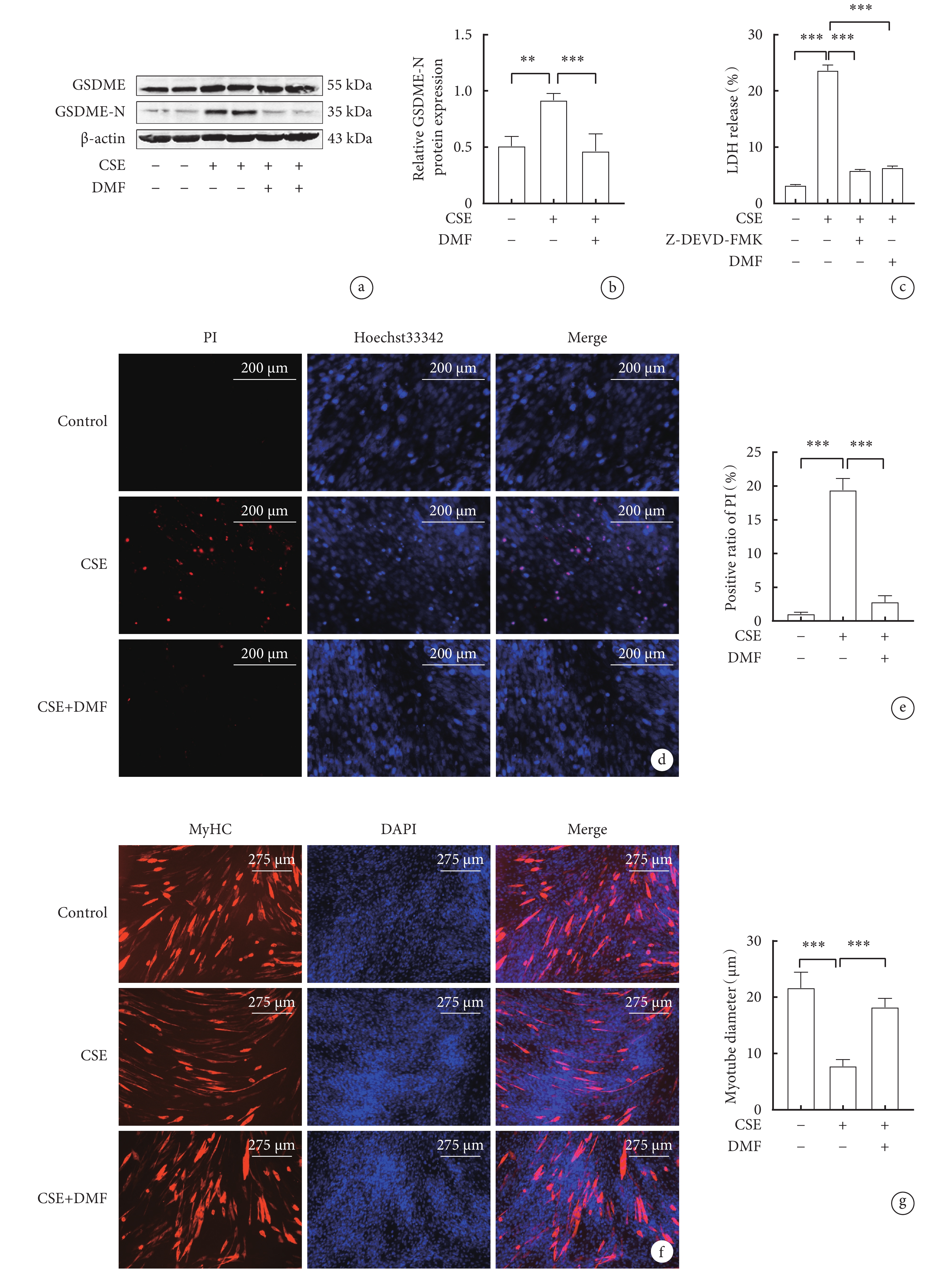
2.4 抑制GSDME對CSE誘導的C2C12細胞焦亡相關蛋白、PI陽性率和肌管直徑的影響
與對照組相比,CSE組C2C12細胞中GSDME-N蛋白表達水平顯著升高(P<0.05); CSE+DMF組C2C12細胞GSDME-N蛋白表達水平較CSE組明顯下降(P<0.05)(圖4a,b,c)。CSE組C2C12細胞PI陽性比例與對照組相比顯著升高(P<0.05);與CSE組相比,CSE+DMF組C2C12細胞PI陽性比例明顯下降(P<0.05)(圖4d,e)。CSE組C2C12肌管直徑與對照組相比顯著縮小(P<0.05);CSE+DMF組C2C12肌管直徑較CSE組增加(P<0.05)(圖4f,g)。結果表明,抑制GSDME減輕了CSE誘導的細胞焦亡,從而緩解了C2C12肌管萎縮。
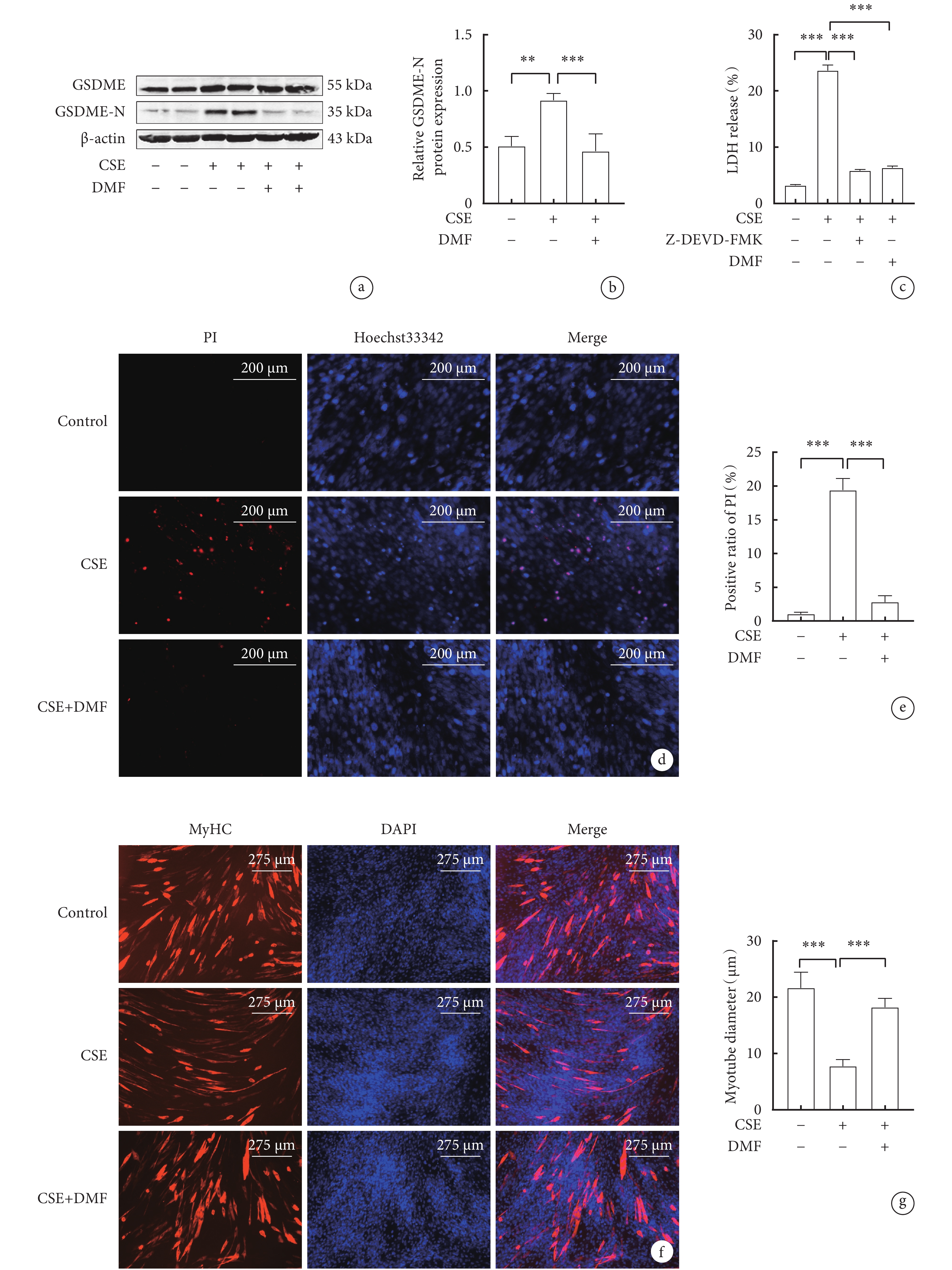 圖4
抑制GSDME對骨骼肌細胞焦亡相關指標和肌管直徑的影響
圖4
抑制GSDME對骨骼肌細胞焦亡相關指標和肌管直徑的影響
a. 各組骨骼肌細胞GSDME-N蛋白表達的代表性Western blot圖像;b. GSDME-N的表達水平; c. 各組骨骼肌細胞LDH釋放率的比較;d. Hoechst 33342/ PI雙染色的代表性圖像(x200); e. 各組骨骼肌細胞PI陽性率比較;f. 各組骨骼肌細胞MyHC蛋白的代表性免疫熒光圖像(x100);g. 各組C2C12肌管直徑變化。
2.5 抑制Caspase-3和GSDME對CSE誘導的C2C12細胞LDH釋放率的影響
與對照組相比,CSE組C2C12細胞的LDH釋放率明顯增加(P<0.05);與CSE組相比,CSE+Z-DEVD-FMK組和CSE+DMF組C2C12細胞的LDH釋放率均明顯降低(P<0.05)(圖4 c)。這些結果表明,CSE通過激活Caspase-3/GSDME途徑誘導C2C12細胞焦亡。
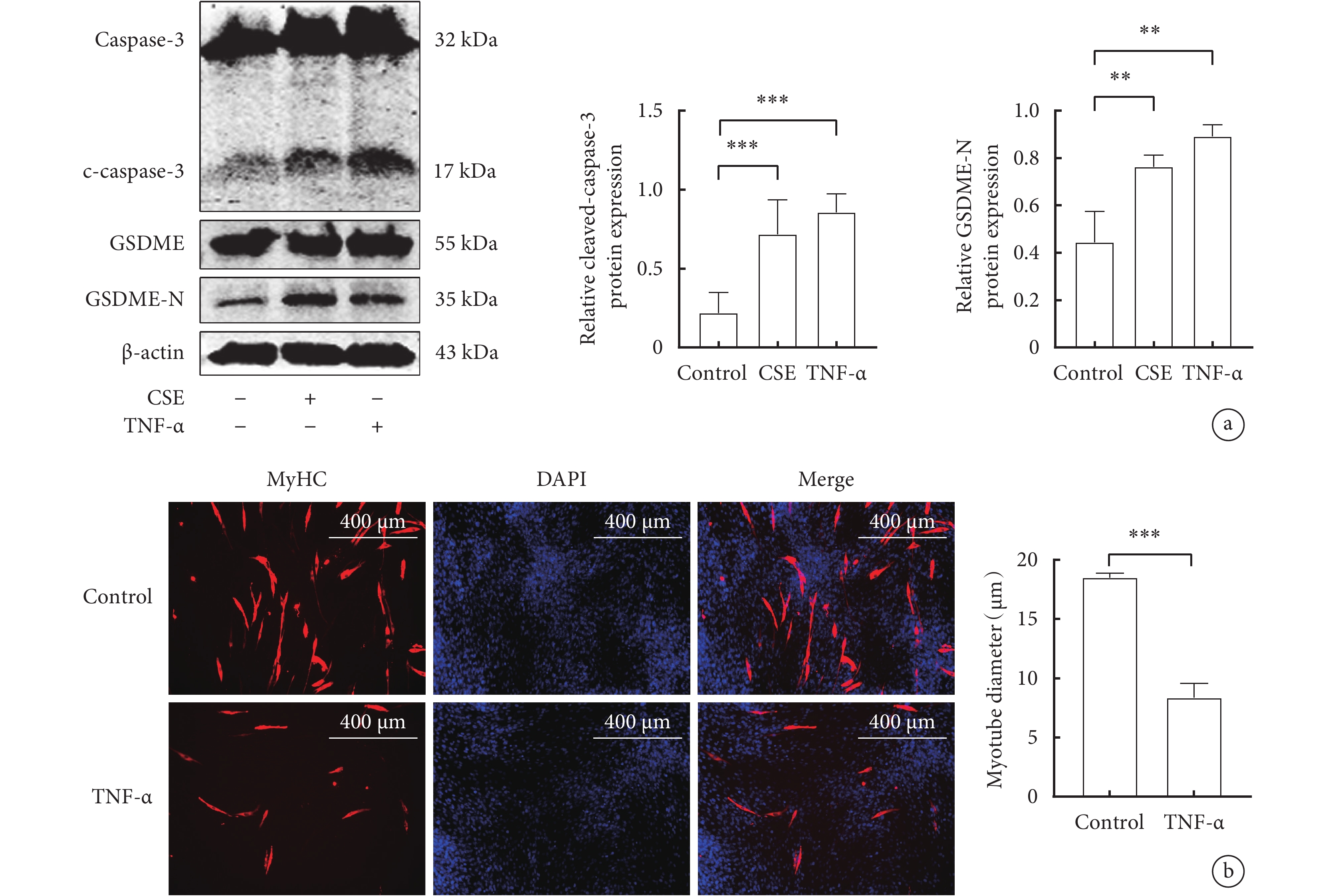
2.6 TNF-α對C2C12細胞焦亡相關蛋白和肌管直徑的影響
與對照組相比,TNF-α能顯著促進C2C12細胞中cleaved-caspase-3、GSDME-N蛋白的表達(P<0.05) (圖5 a)。TNF-α組C2C12肌管直徑較對照組明顯縮小(P<0.05)(圖5b)。
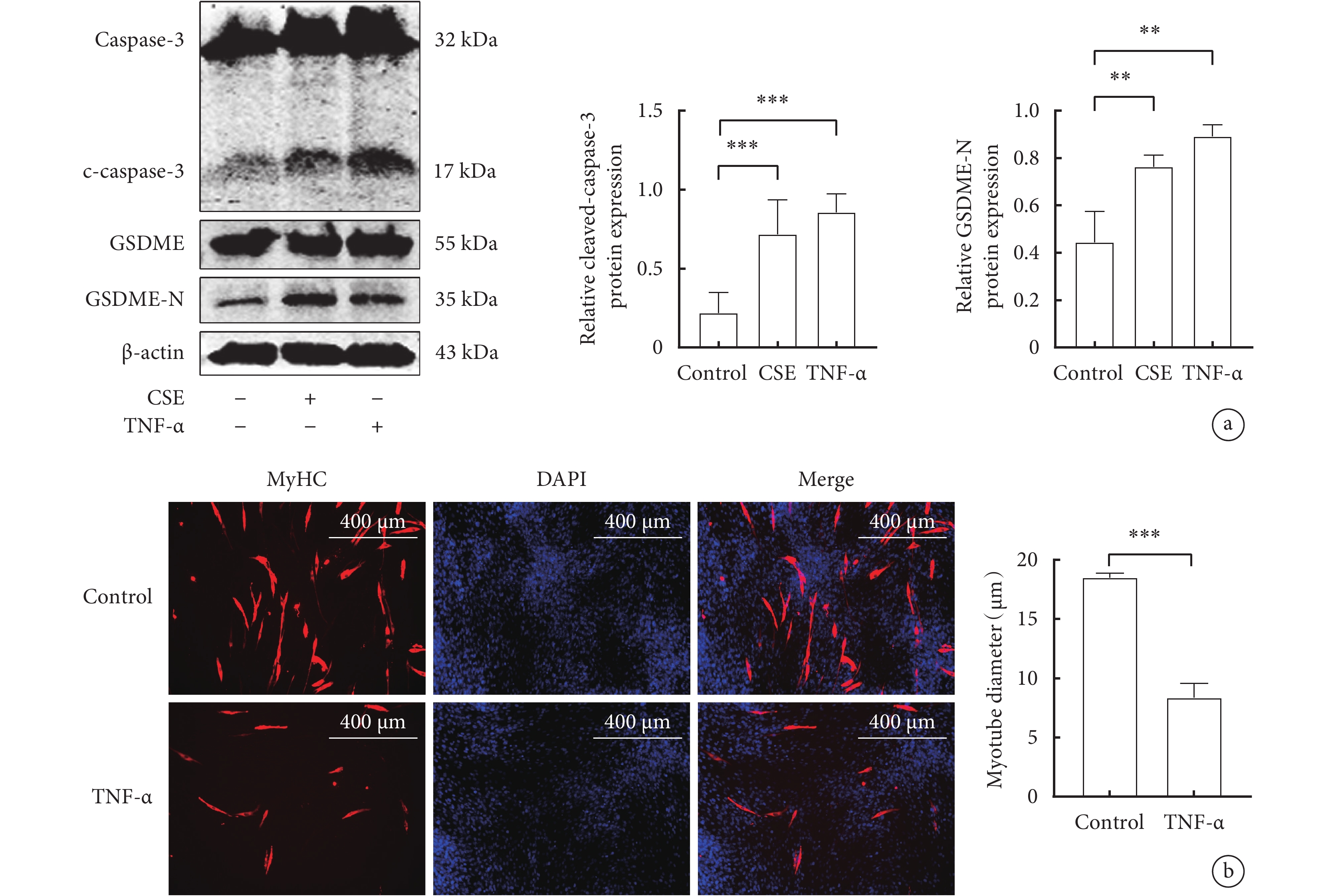 圖5
TNF-α對骨骼肌細胞焦亡相關指標和肌管直徑的影響
圖5
TNF-α對骨骼肌細胞焦亡相關指標和肌管直徑的影響
a. 骨骼肌細胞cleaved-caspase-3、GSDME-N蛋白的Western blot代表性圖像和表達水平;b. 兩組骨骼肌細胞MyHC蛋白的代表性免疫熒光圖像(x100)和肌管直徑變化。
3 討論
慢阻肺合并骨骼肌萎縮和功能障礙的發病機制已有大量的研究,目前認為主要由于煙草煙霧(CS)等氧化應激刺激下炎癥表達增加,造成骨骼肌蛋白合成功能障礙、蛋白降解增加是導致其萎縮的主要機制[15,16]。在本研究中,將小鼠暴露于CS 24周后,可引起小鼠腓腸肌萎縮、肌纖維橫截面積減少和重量減輕,與先前的研究成果一致[17]。
近年來陸續有研究報道了細胞焦亡參與了骨骼肌萎縮[7]。細胞焦亡是一種區別于細胞凋亡的程序性細胞死亡方式 [18],主要通過三種不同的途徑激活,一是通過caspase-1的經典炎癥小體途徑,二是通過脂多糖結合的caspase-4/5/11的直接激活,三是依賴于caspase-3和GSDME-N的途徑。研究表明,GSDME觸發的細胞焦亡過程主要受Caspase-3激活的調控 [10]。在Caspase-3的活化下,GSDME高表達的細胞發生焦亡[19,20]。在這項研究中,觀察了慢性CS暴露對小鼠腓腸肌焦亡相關蛋白caspase-3、GSDME表達水平的影響,發現CS暴露的小鼠腓腸肌中caspase-3蛋白被激活,GSDME蛋白的N端片段表達水平較對照組顯著增加,這些發現提示慢阻肺小鼠的骨骼肌經歷了GSDME介導的焦亡。CS導致小鼠腓腸肌萎縮的同時伴隨著GSDME介導的焦亡激活。有研究顯示,煙草煙霧誘導的小鼠肌肉萎縮模型中,腓腸肌存在焦亡激活[21]。因此,細胞焦亡可能是慢阻肺骨骼肌萎縮與功能障礙的關鍵因素,CS可能通過激活caspase-3/GSDME介導的細胞焦亡從而促進骨骼肌萎縮。
進一步在體外驗證細胞焦亡在骨骼肌萎縮中的作用,用CSE處理C2C12細胞,發現CSE促進肌管中cleaved-caspase-3、GSDME-N蛋白表達增加,這與體內實驗結果一致。先前的研究已經證明,細胞焦亡的特征是細胞膜破裂,這與細胞凋亡過程中細胞膜的完整性保持有著本質區別,PI染色陽性通常表示細胞膜的完整性喪失,這是評估細胞焦亡發生的一個指標。在這項研究中,CSE誘導了骨骼肌細胞LDH的釋放和PI陽性率增加,表明骨骼肌細胞死亡并伴隨著廣泛的裂解,與凋亡誘導的細胞死亡不同。這些數據表明,由于肌管中GSDME-N的高表達,CSE觸發了肌管中GSDME介導的焦亡。此外,CSE促進C2C12肌管萎縮。這一發現進一步支持CS通過激活caspase-3/GSDME介導的細胞焦亡促進骨骼肌萎縮的假設。
為了研究Caspase-3和GSDME在CSE誘導的骨骼肌細胞焦亡中的作用,使用Caspase-3抑制劑Z-DEVD-FMK和GSDME抑制劑DMF處理骨骼肌細胞。本研究發現,抑制Caspase-3后顯著降低了CSE誘導的焦亡相關蛋白cleaved-caspase-3、GSDME-N的表達和C2C12細胞PI陽性率,減少了LDH的釋放,并有效緩解CSE誘導的肌管直徑減小。提示“caspase-3的激活”是CSE誘導的骨骼肌細胞焦亡的調控靶點。抑制GSDME的結果與之一致,逆轉了CSE誘導的細胞焦亡,并有效緩解CSE誘導的肌管萎縮。這些數據表明Caspase-3/GSDME介導的非經典焦亡途徑可能在煙草煙霧暴露誘導的慢阻肺相關骨骼肌萎縮中發揮重要作用。
腫瘤壞死因子TNF-α是一種炎癥因子,由于其復雜的細胞死亡信號傳導,被認為在不同類型的程序性細胞死亡方式的相互聯系中起著重要作用[22]。TNF-α通過激活Caspase-3觸發細胞凋亡,或進一步促進Caspase-3激活GSDME,從而引發細胞焦亡。TNF-α由炎性細胞以及骨骼肌細胞釋放,是細胞焦亡的啟動因素之一[23]。有研究表明,TNF-α通過caspase-8/caspase-3/GSDME途徑介導的細胞焦亡促進了老年小鼠骨骼肌的萎縮[11]。課題組前期研究已證實,煙草煙霧暴露可促進骨骼肌細胞釋放大量TNF-α[17],提示在煙草煙霧暴露下,骨骼肌細胞釋放的TNF-α可能是Caspase-3/GSDME途徑引發細胞焦亡的關鍵啟動因素。在本實驗中,使用重組TNF-α蛋白刺激骨骼肌細胞,觀察到TNF-α誘導肌管萎縮,并伴隨著Cleaved-Caspase-3和GSDME-N蛋白表達的增加。這些發現支持了煙草煙霧(CS)通過激活TNF-α/Caspase-3/GSDME途徑增強細胞焦亡,從而促進骨骼肌萎縮的假設。
綜上所述,本研究通過慢阻肺相關骨骼肌萎縮小鼠模型及細胞體外實驗,闡明了CS通過激活TNF-α/Caspase-3/GSDME途徑誘導骨骼肌細胞焦亡,進而促進骨骼肌萎縮的分子機制。這一發現不僅促進了我們對骨骼肌萎縮分子機制的理解,也為慢阻肺相關骨骼肌萎縮的治療策略提供了一種科學依據。
利益沖突:本研究不涉及任何利益沖突。
煙草煙霧暴露引發的慢性肺部異常炎癥反應是慢性阻塞性肺疾病 (chronic obstructive pulmonary disease,COPD,簡稱慢阻肺) 發病的主要因素[1-2]。骨骼肌萎縮和功能障礙是慢阻肺最常見的肺外合并癥之一,高達34%的慢阻肺患者伴有骨骼肌萎縮和功能障礙[3],表現為顯著的肌肉萎縮、收縮能力下降和運動功能障礙,這些不僅影響患者的生活質量,還顯著增加了慢阻肺患者的死亡率和住院率,是預測慢阻肺 死亡的獨立危險因素[4-5]。但目前關于慢阻肺骨骼肌萎縮和功能障礙的分子機制仍未完全闡明。研究表明,細胞焦亡(pyroptosis)與骨骼肌萎縮和功能障礙有關[6–8]。細胞焦亡是由GSDM家族(GSDMs)介導的具有免疫原性的程序性細胞死亡方式,可被多個胞外信號分子如 TNF-α識別并激活,GSDMs被活化的Caspase裂解以釋放具有細胞膜成孔功能的N-末端結構域,導致細胞內容物的釋放,誘導炎癥反應[9]。研究顯示,GSDME被活化的caspase-3特異性切割,產生 GSDME-N 片段,該片段穿透細胞膜,從而誘導細胞焦亡[10]。 Caspase-3/GSDME信號介導的焦亡參與了骨骼肌萎縮的發生發展[11]。然而,長期的煙草煙霧暴露是否通過TNF-α激活Caspase-3/GSDME通路誘導骨骼肌細胞焦亡,從而促進骨骼肌萎縮,目前尚不清楚。本研究旨在探討煙草煙霧誘導骨骼肌萎縮的機制是否與Caspase-3/GSDME介導的焦亡有關,為慢阻肺相關骨骼肌萎縮的治療機制提供一種新的策略。
1 材料與方法
1.1 材料
實驗動物:C57BL/6小鼠(5~6周,18 ± 2 g)購自廣西醫科大學實驗動物中心。環境溫度、濕度適宜,光/暗周期為12 h/12 h,小鼠自由飲水和進食。本研究已通過廣西醫科大學實驗動物倫理委員會審批。
實驗材料:C2C12小鼠成肌細胞系(中國科學院上海細胞庫,SCSP-505),胎牛血清(Gibco,10099141C),馬血清(Vivacell,C2510-0500 ),DMEM 高糖培養基(Gibco,C11995500BT)。Caspase-3 抑制劑Z-DEVD-FMK (MedChemExpress,HY-
實驗儀器:細胞培養箱(Thermo Scientific
1.2 方法
1.2.1 組織學分析
新鮮組織用 4% 多聚甲醛固定,然后脫水、石蠟包埋、切片,脫蠟、脫水,進行 HE 染色分析肌纖維的橫截面積(CSA)和形態。進一步將腓腸肌切片進行免疫組織化學染色,切片經抗原修復、3%過氧化氫孵育、封閉后,與一抗4 °C孵育過夜。第2天用二抗孵育,DAB 顯色,蘇木精復染。用病理顯微鏡拍照,每個切片隨機選取5個視野進行圖像采集,使用 ImageJ 軟件進行分析。
1.2.2 CS提取物(CS extract,CSE)的制備
參考文獻[12],將3支無濾嘴的香煙依次連接到含有3 ml磷酸鹽緩沖液(PBS)的抽吸裝置上,點燃香煙,用50 ml注射器緩慢抽吸,煙霧被溶解在PBS中,pH調至7.4,然后經0.22 μm無菌過濾器過濾以制成CSE。測量CSE的光密度,并在1h內使用。
1.2.3 細胞模型建立與分組
將C2C12細胞培養在含10%胎牛血清的DMEM高糖培養基中,置于37 ℃、5%CO2的培養箱中培養。當細胞融合度達80%后更換含2%馬血清的分化培養基,誘導分化5天至肌管形成[13]。將C2C12肌管分為對照組(Control組)、CSE組、CSE+100 μmol/L DMF組(CSE+DMF組)、CSE+50 μmol/L Z-DEVD-FMK 組(CSE+Z-DEVD-FMK組)、80ng/ml TNF-α組(TNF-α組)。Control組不做任何處理,CSE組用0.2%CSE處理24 h; CSE+DMF組用100 μmol/L DMF預處理C2C12細胞1h,再與0.2%CSE共處理24 h; CSE+Z-DEVD-FMK 組用50 μmol/L Z-DEVD-FMK預處理C2C12細胞1h,再用0.2%CSE處理24 h;TNF-α組用80 ng/ml 重組TNF-α蛋白干預24 h。
1.2.4 Hoechst 33342 /碘化丙啶(propidium iodide,PI)染色
經過不同處理的細胞,用磷酸緩沖鹽水(PBS)洗滌,加入含Hoechst和PI的細胞染色緩沖液30min。用熒光顯微鏡捕獲細胞圖像。隨機選擇3個不同的視野,計算PI陽性細胞比例。
1.2.5 LDH釋放實驗
使用LDH檢測試劑盒檢測骨骼肌細胞LDH釋放率,根據說明書操作,取各孔細胞培養基與60μL LDH檢測工作液混合,避光孵育30 min。使用酶標儀測量各孔490 nm處光密度值。
1.2.6 Western blot法檢測 Caspase-3、GSDME蛋白表達
收集各組C2C12細胞經裂解后的蛋白,通過電泳分離,轉膜,封閉后。與一抗4 ℃孵育過夜,熒光二抗室溫孵育1 h。紅外熒光顯影儀觀察與分析蛋白條帶。
1.2.7 免疫熒光
4%多聚甲醛固定細胞20 min,置于0.25%Triton X-100通透15 min,3%BSA封閉1 h,隨后用MyHC抗體4?C孵育過夜。第2天用熒光二抗避光孵育1 h,DAPI染核5min,在熒光顯微鏡下觀察,MyHC表達陽性(紅色)表明該細胞是骨骼肌細胞。肌管直徑:使用 ImageJ 軟件,對每組中不少于100個肌管的直徑進行了測量,并取平均值[14]。
1.2.8 動物分組與造模
C57BL/6小鼠隨機分為2組:對照(Control)組、CS組。CS組小鼠放進熏煙箱,點燃5支香煙,每次1 h,熏煙間隔0.5 h以上,每日4次,5天/周;Control組小鼠正常飼養。 第24周實驗結束后取材,稱取小鼠腓腸肌(GM)重量,取右側腓腸肌用于組織學評估,左側腓腸肌組織用于進一步蛋白分析
1.3 統計學方法
數據用 Graph Prism 10.0 進行分析,以均數 ± 標準差(SD)表示。根據數據的分布情況,兩組比較時,采用學生 t 檢驗或 Mann-Whitney U 檢驗。多組間比較使用單因素方差分析或 Kruskal-Wallis 檢驗。P<0.05視為差異有統計學意義。
2 結果
2.1 慢性CS暴露對小鼠腓腸肌形態和焦亡相關蛋白cleaved-caspase-3、GSDME-N的影響
HE染色結果顯示,與對照組相比,CS組小鼠腓腸肌的肌纖維橫截面積(CSA)顯著降低(圖1a,b),CS組小鼠的腓腸肌重量明顯減輕,(180.83±5.31)mg vs(137±9.4) mg(P<0.05)(圖1c)。免疫組化結果顯示,CS組小鼠腓腸肌中Caspase-3和GSDME的陽性率較對照組顯著增加(P<0.05)(圖1d,e)。Western blot 結果顯示,與對照組相比, CS 組腓腸肌中 cleaved-caspase-3 及 GSDME-N 蛋白表達顯著升高(P<0.05)(圖1f,g,h)。表明慢性CS暴露誘導骨骼肌萎縮的同時伴隨著Caspase-3/GSDME介導的焦亡激活。
 圖1
兩組小鼠腓腸肌的形態、重量和cleaved-caspase-3、GSDME-N蛋白表達比較
圖1
兩組小鼠腓腸肌的形態、重量和cleaved-caspase-3、GSDME-N蛋白表達比較
a. 腓腸肌的HE染色代表性圖像(x200); b. 腓腸肌肌纖維橫截面積;c. 腓腸肌的重量; d. 小鼠GM的c-caspase-3、GSDME-N免疫組織化學染色圖像,(X200);e. c-caspase-3和GSDME-N的免疫組織化學分析的定量; f. cleaved-caspase-3、GSDME-N蛋白表達的Western blot代表性圖像;g. cleaved-caspase-3的表達水平;h. GSDME-N的表達水平
2.2 CSE對骨骼肌細胞焦亡相關蛋白表達水平和肌管直徑的影響
免疫熒光結果顯示,與對照組相比,CSE組肌管直徑明顯縮小(P<0.05)(圖2a,b)。與對照組相比,CSE組C2C12細胞中cleaved-caspase-3、GSDME-N蛋白的相對表達量顯著增加(P<0.05)(圖2c,d,e)。Hoechst
 圖2
CSE對骨骼肌細胞焦亡相關指標和肌管直徑影響
圖2
CSE對骨骼肌細胞焦亡相關指標和肌管直徑影響
a. 骨骼肌細胞MyHC免疫熒光圖(x100);b. .兩組C2C12肌管直徑;c. cleaved-caspase-3、GSDME-N蛋白表達水平的Western blot代表性圖像; d. cleaved-caspase-3的蛋白表達水平;e. GSDME-N的蛋白表達水平;f. Hoechst 33342/ PI雙染色的代表性圖像(x200); g. 兩組骨骼肌細胞PI陽性率比較。
 圖3
抑制Caspase-3對骨骼肌細胞焦亡相關指標和肌管直徑影響
圖3
抑制Caspase-3對骨骼肌細胞焦亡相關指標和肌管直徑影響
a. 各組骨骼肌細胞cleaved-caspase-3、GSDME-N蛋白表達水平的Western blot代表性圖像; b. cleaved-caspase-3的表達水平;c. GSDME-N的表達水平;d. Hoechst 33342/ PI雙染色的代表性圖像(x200);e. 各組骨骼肌細胞PI陽性率比較;f. 骨骼肌細胞MyHC免疫熒光圖(x100); g. 各組C2C12肌管直徑比較。
2.3 抑制Caspase-3對CSE誘導的C2C12細胞焦亡相關蛋白,PI陽性率和肌管直徑的影響
Caspase-3抑制劑Z-DEVD-FMK預處理C2C12細胞,再用CSE處理24 h。與對照組相比,CSE 組 cleaved-caspase-3、GSDME-N蛋白表達水平升高(P<0.05);與CSE 組相比,CSE+Z-DEVD-FMK組cleaved-caspase-3、GSDME-N蛋白表達下降(P<0.05)(圖3a,b,c)。與對照組相比,CSE組PI陽性比例升高(P<0.05);與CSE組相比,CSE+Z-DEVD-FMK組PI陽性比例顯著下降(P<0.05)(圖3d,e)。與對照組相比,CSE組肌管直徑顯著縮小(P<0.05);與CSE組相比,CSE+Z-DEVD-FMK組肌管直徑明顯增加(P<0.05)(圖3 f,g)。這些結果表明,CSE誘導骨骼肌細胞焦亡需要Caspase-3的激活,抑制Caspase-3的激活有效緩解CSE誘導的肌管萎縮。
2.4 抑制GSDME對CSE誘導的C2C12細胞焦亡相關蛋白、PI陽性率和肌管直徑的影響
與對照組相比,CSE組C2C12細胞中GSDME-N蛋白表達水平顯著升高(P<0.05); CSE+DMF組C2C12細胞GSDME-N蛋白表達水平較CSE組明顯下降(P<0.05)(圖4a,b,c)。CSE組C2C12細胞PI陽性比例與對照組相比顯著升高(P<0.05);與CSE組相比,CSE+DMF組C2C12細胞PI陽性比例明顯下降(P<0.05)(圖4d,e)。CSE組C2C12肌管直徑與對照組相比顯著縮小(P<0.05);CSE+DMF組C2C12肌管直徑較CSE組增加(P<0.05)(圖4f,g)。結果表明,抑制GSDME減輕了CSE誘導的細胞焦亡,從而緩解了C2C12肌管萎縮。
 圖4
抑制GSDME對骨骼肌細胞焦亡相關指標和肌管直徑的影響
圖4
抑制GSDME對骨骼肌細胞焦亡相關指標和肌管直徑的影響
a. 各組骨骼肌細胞GSDME-N蛋白表達的代表性Western blot圖像;b. GSDME-N的表達水平; c. 各組骨骼肌細胞LDH釋放率的比較;d. Hoechst 33342/ PI雙染色的代表性圖像(x200); e. 各組骨骼肌細胞PI陽性率比較;f. 各組骨骼肌細胞MyHC蛋白的代表性免疫熒光圖像(x100);g. 各組C2C12肌管直徑變化。
2.5 抑制Caspase-3和GSDME對CSE誘導的C2C12細胞LDH釋放率的影響
與對照組相比,CSE組C2C12細胞的LDH釋放率明顯增加(P<0.05);與CSE組相比,CSE+Z-DEVD-FMK組和CSE+DMF組C2C12細胞的LDH釋放率均明顯降低(P<0.05)(圖4 c)。這些結果表明,CSE通過激活Caspase-3/GSDME途徑誘導C2C12細胞焦亡。
2.6 TNF-α對C2C12細胞焦亡相關蛋白和肌管直徑的影響
與對照組相比,TNF-α能顯著促進C2C12細胞中cleaved-caspase-3、GSDME-N蛋白的表達(P<0.05) (圖5 a)。TNF-α組C2C12肌管直徑較對照組明顯縮小(P<0.05)(圖5b)。
 圖5
TNF-α對骨骼肌細胞焦亡相關指標和肌管直徑的影響
圖5
TNF-α對骨骼肌細胞焦亡相關指標和肌管直徑的影響
a. 骨骼肌細胞cleaved-caspase-3、GSDME-N蛋白的Western blot代表性圖像和表達水平;b. 兩組骨骼肌細胞MyHC蛋白的代表性免疫熒光圖像(x100)和肌管直徑變化。
3 討論
慢阻肺合并骨骼肌萎縮和功能障礙的發病機制已有大量的研究,目前認為主要由于煙草煙霧(CS)等氧化應激刺激下炎癥表達增加,造成骨骼肌蛋白合成功能障礙、蛋白降解增加是導致其萎縮的主要機制[15,16]。在本研究中,將小鼠暴露于CS 24周后,可引起小鼠腓腸肌萎縮、肌纖維橫截面積減少和重量減輕,與先前的研究成果一致[17]。
近年來陸續有研究報道了細胞焦亡參與了骨骼肌萎縮[7]。細胞焦亡是一種區別于細胞凋亡的程序性細胞死亡方式 [18],主要通過三種不同的途徑激活,一是通過caspase-1的經典炎癥小體途徑,二是通過脂多糖結合的caspase-4/5/11的直接激活,三是依賴于caspase-3和GSDME-N的途徑。研究表明,GSDME觸發的細胞焦亡過程主要受Caspase-3激活的調控 [10]。在Caspase-3的活化下,GSDME高表達的細胞發生焦亡[19,20]。在這項研究中,觀察了慢性CS暴露對小鼠腓腸肌焦亡相關蛋白caspase-3、GSDME表達水平的影響,發現CS暴露的小鼠腓腸肌中caspase-3蛋白被激活,GSDME蛋白的N端片段表達水平較對照組顯著增加,這些發現提示慢阻肺小鼠的骨骼肌經歷了GSDME介導的焦亡。CS導致小鼠腓腸肌萎縮的同時伴隨著GSDME介導的焦亡激活。有研究顯示,煙草煙霧誘導的小鼠肌肉萎縮模型中,腓腸肌存在焦亡激活[21]。因此,細胞焦亡可能是慢阻肺骨骼肌萎縮與功能障礙的關鍵因素,CS可能通過激活caspase-3/GSDME介導的細胞焦亡從而促進骨骼肌萎縮。
進一步在體外驗證細胞焦亡在骨骼肌萎縮中的作用,用CSE處理C2C12細胞,發現CSE促進肌管中cleaved-caspase-3、GSDME-N蛋白表達增加,這與體內實驗結果一致。先前的研究已經證明,細胞焦亡的特征是細胞膜破裂,這與細胞凋亡過程中細胞膜的完整性保持有著本質區別,PI染色陽性通常表示細胞膜的完整性喪失,這是評估細胞焦亡發生的一個指標。在這項研究中,CSE誘導了骨骼肌細胞LDH的釋放和PI陽性率增加,表明骨骼肌細胞死亡并伴隨著廣泛的裂解,與凋亡誘導的細胞死亡不同。這些數據表明,由于肌管中GSDME-N的高表達,CSE觸發了肌管中GSDME介導的焦亡。此外,CSE促進C2C12肌管萎縮。這一發現進一步支持CS通過激活caspase-3/GSDME介導的細胞焦亡促進骨骼肌萎縮的假設。
為了研究Caspase-3和GSDME在CSE誘導的骨骼肌細胞焦亡中的作用,使用Caspase-3抑制劑Z-DEVD-FMK和GSDME抑制劑DMF處理骨骼肌細胞。本研究發現,抑制Caspase-3后顯著降低了CSE誘導的焦亡相關蛋白cleaved-caspase-3、GSDME-N的表達和C2C12細胞PI陽性率,減少了LDH的釋放,并有效緩解CSE誘導的肌管直徑減小。提示“caspase-3的激活”是CSE誘導的骨骼肌細胞焦亡的調控靶點。抑制GSDME的結果與之一致,逆轉了CSE誘導的細胞焦亡,并有效緩解CSE誘導的肌管萎縮。這些數據表明Caspase-3/GSDME介導的非經典焦亡途徑可能在煙草煙霧暴露誘導的慢阻肺相關骨骼肌萎縮中發揮重要作用。
腫瘤壞死因子TNF-α是一種炎癥因子,由于其復雜的細胞死亡信號傳導,被認為在不同類型的程序性細胞死亡方式的相互聯系中起著重要作用[22]。TNF-α通過激活Caspase-3觸發細胞凋亡,或進一步促進Caspase-3激活GSDME,從而引發細胞焦亡。TNF-α由炎性細胞以及骨骼肌細胞釋放,是細胞焦亡的啟動因素之一[23]。有研究表明,TNF-α通過caspase-8/caspase-3/GSDME途徑介導的細胞焦亡促進了老年小鼠骨骼肌的萎縮[11]。課題組前期研究已證實,煙草煙霧暴露可促進骨骼肌細胞釋放大量TNF-α[17],提示在煙草煙霧暴露下,骨骼肌細胞釋放的TNF-α可能是Caspase-3/GSDME途徑引發細胞焦亡的關鍵啟動因素。在本實驗中,使用重組TNF-α蛋白刺激骨骼肌細胞,觀察到TNF-α誘導肌管萎縮,并伴隨著Cleaved-Caspase-3和GSDME-N蛋白表達的增加。這些發現支持了煙草煙霧(CS)通過激活TNF-α/Caspase-3/GSDME途徑增強細胞焦亡,從而促進骨骼肌萎縮的假設。
綜上所述,本研究通過慢阻肺相關骨骼肌萎縮小鼠模型及細胞體外實驗,闡明了CS通過激活TNF-α/Caspase-3/GSDME途徑誘導骨骼肌細胞焦亡,進而促進骨骼肌萎縮的分子機制。這一發現不僅促進了我們對骨骼肌萎縮分子機制的理解,也為慢阻肺相關骨骼肌萎縮的治療策略提供了一種科學依據。
利益沖突:本研究不涉及任何利益沖突。