中藥注射劑上市后臨床安全性再評價研究分別獲取了主動監測、被動監測及文獻研究等多種研究類型的安全性證據。但缺乏可有效整合上述研究類型數據的綜合評價方法,至今無法進一步產出更全面、更客觀的高級別循證醫學研究證據,嚴重影響了中藥注射劑的監督管理和臨床合理使用。而建立綜合評價方法的關鍵是先建立綜合評價核心指標的優選方法,形成可賦權量化評分的模型應用于綜合評價方法中。混合方法研究通過對數據反復進行定量與定性研究,可實現有效、深入整合不同研究類型數據并科學、規范地完成評價模型中指標的篩選;其次,對于模型構建研究中最關鍵的指標賦權與權重調節,筆者創新性地將層次分析法與不變權重次約束法相結合,引入混合方法研究設計的定量研究部分,保證模型構建過程中指標的準確賦權。故本文在參考針對有效性試驗核心結局指標提出的核心指標集的研究基礎上,提出運用混合方法開展基于多源復雜數據的指標篩選與權重調節研究,構建融合不同研究類型數據的中藥注射劑上市后臨床安全性綜合評價模型,為中藥注射劑上市后臨床安全性綜合評價提供測量工具和新方法。
引用本文: 李春曉, 楊玉晴, 凌霄, 程子豪, 宋學坤, 郭靜, 李學林. 基于混合方法的中藥注射劑上市后臨床安全性綜合評價模型構建研究思路探討. 中國循證醫學雜志, 2024, 24(4): 484-489. doi: 10.7507/1672-2531.202307168 復制
版權信息: ?四川大學華西醫院華西期刊社《中國循證醫學雜志》版權所有,未經授權不得轉載、改編
中藥注射劑上市后臨床安全性再評價研究是再評價的首要核心內容[1]。我國自2009年專門對中藥注射劑啟動上市后安全性再評價至今,逐漸形成了以醫院集中監測為主的主動監測、自發呈報系統報告的被動監測及安全性文獻研究等多種研究類型[2],并分別獲取了其單一研究類型的安全性證據。而藥品安全性評價證據應該從多源頭考慮,需要納入不同類型的研究證據[3],獲得其安全性綜合評價結果。基于此,考慮到單一研究類型評價結果存在一定的局限性(表1),獲得的證據很大程度上不能客觀、全面地代表中藥注射劑的臨床安全性[4],也不足以達到公認的證據強度和推薦力度,故筆者提出將上述研究類型數據整合進行綜合評價,以獲取更高質量的安全性證據[5]。
1 中藥注射劑上市后臨床安全性綜合評價研究現狀分析
2021年,中華人民共和國國家衛生健康委員會發布了《關于規范開展藥品臨床綜合評價工作的通知》,強調要不斷深化對藥品臨床綜合評價重要性的認識[6]。國內學者也開始了不斷探索,如謝雁鳴教授團隊采用多維準則決策模型對部分中成藥探索開展了包含安全性、有效性、經濟等方面的綜合評價,并提出安全性證據評價應融合多種研究類型進行綜合評價以構建中藥上市后安全性證據體[7,8]。劉建平教授也同樣提出,應該構建由多種研究方法、不同設計類型、多種來源的證據組成的“證據體”[9]。但國內符合藥品安全性特點的、能夠同時兼顧不同研究類型評價結果的、臨床安全性綜合評價具體技術方法尚未見報道,關于中藥注射劑臨床安全性綜合評價方法更無從談起。此外,國外藥品上市后安全性再評價以藥品不良反應(adverse drug reaction,ADR)監測研究的結果為絕對主導,并未完全達到綜合評價的目的和要求[10-12],也無法提供相應的參考。
2 構建中藥注射劑臨床安全性綜合評價模型的意義
中藥注射劑是中醫藥現代化的代表產物,因其具有起效迅速、生物利用度高等特點,在各種急危重癥的治療中發揮了重要作用。但近十余年頻發的中藥注射劑安全性事件[13],觸發了業界重新審視中藥注射劑療效與風險的證據嚴重不足的問題,亟需開展中藥注射劑上市后臨床安全性綜合評價研究獲取更高質量的循證醫學方法獲得的證據。綜合評價研究是指依據不同的評價目的和對象,選擇相應的評價指標,通過賦予指標不同權重,按照一定的評價方法將評價指標轉化為能反映評價對象某方面特征的信息(即綜合評價結果)[14]。因此,開展中藥注射劑上市后臨床安全性綜合評價研究的關鍵,是先建立中藥注射劑上市后臨床安全性綜合評價核心指標的優選方法,形成可賦權量化評分的模型應用于綜合評價。
構建中藥注射劑上市后臨床安全性綜合評價模型可有效解決綜合評價研究中核心指標篩選與研究質量測量中實際存在的難題。具體表現在:① 可以有效降低不同研究類型收集或報告數據類型的差異,解決不同研究類型間由于方法、群體等因素造成的差異性結果難以整合的問題,使更多研究納入綜合評價;② 可以提前規范設計不同研究類型應收集的數據條目和核心指標條目,有利于及時發現并減少不良反應漏報的情況;③ 通過對不同研究類型發現的不良反應進行多角度、多指標相關暴露因素的數據收集,提高不良反應因果關聯性評價的客觀性、合理性和科學性;④ 通過規范設計研究中應收集的核心指標條目,有效減少由于收集信息繁冗造成的研究對象依從性差的問題;⑤ 構建的量化評價模型,可實現對不同品種的中藥注射劑上市后臨床安全性各類型研究質量進行綜合測量,評估其完成的優劣,為將來借助人工智能技術實現動態、實時評價奠定基礎。所以,建立中藥注射劑上市后臨床安全性綜合評價模型具有十分重要的現實意義。
3 構建綜合評價模型尚需解決的關鍵問題
3.1 多維評價指標篩選問題
中藥注射劑上市后臨床安全性不同研究類型收集的數據信息既包含諸如人口學信息、個人過敏史、藥品實際使用相關信息、藥品發生不良反應情況信息(包括ADR臨床表現、發生時間、累及的器官/系統損害、轉歸時間及預后)等十分廣泛、復雜的非量化數據,也包含ADR發生率,不同ADR臨床表現的例次等可量化數據構成的客觀指標,同時還包含著不良反應因果關聯性評價及影響因素等主觀指標。而評價指標的篩選會直接影響后續研究的系統評價與整合[15,16],所以不僅是對各研究類型數據指標進行簡單的匯總,還需多角度、多維度的綜合考量。綜合評價模型的基礎是,篩選出各研究類型中所涉及安全性評價指標中必須且重點報告的核心指標[17],此研究過程可借鑒核心指標集(core outcome set,COS)的研制思路。
COS自2013年引進中國并被引入中醫藥領域以來,在有效性評價指標的篩選上得到了廣泛地應用并取得了不小的成績[18-20]。但COS研究目前也主要應用于有效性評價指標的研究中,在安全性評價指標中很少體現[21]。盡管邱瑞瑾等[17]提出采用COS研究模式,構建中成藥上市后臨床安全性評價核心數據集,但相關研究結果并未發表;且COS研究模式在方法學上還處于探索階段,仍需不斷完善[22]。目前許多COS研究采用德爾菲調查和共識會議相結合的方法形成COS,此研究過程中不同利益相關群體達成共識比較困難,存在重要但非核心指標被排除在外的可能[23]。因此,核心指標的確定需要探索更加豐富的定量、定性研究方法,以規避COS研究中定量定性研究方法相對單一,導致指標被過度排除的風險。混合方法研究(mixed methods research,MMR)結合了定量研究和定性研究的優勢[24],讓研究者從不同的角度去分析研究問題,經過反復多次的定性與定量研究,獲得更加深入全面的結果[25]。適合使用MMR的研究具有以下特征:① 使用單一類型的證據不足以回答研究問題;② 一種研究方法的結果,需要用第二種研究方法的結果來補充解釋;③ 在耗時較長,且包含多個階段的項目中,研究者需要聯結多個研究來達到總體目標;④ 獲得比單純采用定量或者定性研究更多的數據[26,27]。以上特征與醫療健康領域的諸多研究的特點和需求契合,符合藥品臨床安全性綜合評價方法學技術要求[28-30]。采用MMR有望為各研究類型篩選出符合本研究特點的評價指標,實現不同來源數據的有效融合,解決多維評價指標篩選問題。
3.2 多維指標賦權問題
中藥注射劑上市后安全性再評價研究過程實質上是由多指標影響的綜合評估,并非各評價要素的簡單融合,而是要求各指標間具有一定的相關性。并且指標在評價模型中的效力根據其重要程度需要各有側重,因此可體現在指標的準確賦權上。權重能夠反映各指標對整體模型的貢獻度,對提高指標的信度、效度、反應度,以及進行準確、合理、科學的臨床評價起著至關重要的作用[31]。
綜合評價模型構建研究設計中,筆者創新性地提出將層次分析法(analytic hierarchy process,AHP)與不變權重次約束(invariant weight sub-constraint,IWSC)相結合(AHP-IWSCM)并引入混合方法的定量研究部分。此法有望實現對復雜數據指標的準確賦權與優劣勢指標的篩選,保證綜合評價模型的效度。AHP通過矩陣標準化特征向量,由上至下逐層計算最低層因素相對最高層因素的相隨重要性權值構建指標權重,可以在一定程度上減少主觀性,以得到科學、嚴謹、標準的指標層次模型[32,33]。然而采用此方法只解決了不同評價指標的排序問題,無法具體給出哪些因素才是影響具體評價對象特定評價結果的關鍵因素。為解決上述問題,筆者提出引入廣泛應用于管理學、經濟學等領域的、用于篩選某一研究問題中關鍵影響因素的IWSC。IWSC通過采用保持有n個指標的完整指標體系與n?1個指標的指標體系前后兩次評價中指標權重不變,通過比較去掉1個指標貢獻前、后的指標體系得分排序的變化大小,來篩選優勢指標和劣勢指標,通過對整體指標影響程度的大小完成關鍵因素的篩選[34,35]。因此,兩種研究方法結合形成的AHP-IWSCM模型,可實現對各層次或各維度指標進行權重賦予與調節,使綜合評價模型更加符合實際研究情況,保證模型的科學性與適用性。
4 構建中藥注射劑臨床安全性綜合評價模型的思路
4.1 指標要素池的建立
綜合評價模型構建過程中,筆者擬以包括醫院集中監測為主的主動監測、自發呈報系統的被動監測和安全性文獻報道3種主要研究類型中所涉及的安全性評價指標為研究對象構建指標要素池。該過程是形成整個綜合評價模型研究的第一步,既要全面包括中藥注射劑上市后臨床安全性研究中涉及的所有完整指標,同時也要最大程度體現各研究類型中難以用定量指標體現的特點。因此,該部分研究不僅僅涉及定量指標的收集,還需要補充以訪談方式為主的定性研究收集正高級職稱醫師、藥師、臨床試驗者、企業、醫療專業技術人員等與COS利益相關群體對各類研究類型特點的經驗和對問題的認識[36,37],通過訪談最大程度挖掘體現各研究類型的個性化優勢的安全性評價指標。MMR中聚斂式平行設計可實現同時收集和分析定量數據和定性數據,比較兩種結果或相互驗證兩種結果,最適合用于指標要素池的構建。
4.2 評價指標的篩選
在MMR中,根據具體情況的需要,對于定量、定性研究各有側重,在先后順序上也略有不同。區別于聚斂式平行設計的定量定性研究并重且同時開展,解釋性序列設計和探索性序列設計根據研究目的的不同,也會各有側重。如在形成指標要素池后,筆者擬進行以定性研究為先、定量研究為主的探索性序列設計,同時穿插定量研究為先、定性研究為主的解釋性序列設計,進行不同交互程度、反復定量定性結合研究,以整合不同研究類型的多源復雜數據指標。在此部分研究中,筆者擬以名義群體法、小組討論法為主等定性方法,圍繞指標要素池進行討論,對指標要素池中各指標要素進行重要性評價,預篩選臨床安全性評價的重要指標要素和一般指標要素。再采用以上述定性研究結果為依據,設計咨詢問卷通過2~3輪的德爾菲法收集行業權威專家(正高級職稱)[38]對各指標納入與否及重要程度的評分,通過評分進一步明確重要/一般指標,而后再采用回訪訪談、焦點小組等定性方法,對上述德爾菲法形成的量化指標結果進行科學性、合理性的評價,保證最終篩選的指標能夠全面涵蓋上市后研究和上市后再評價所需的指標。
4.3 各研究類型評價模型的構建
4.3.1 指標分層與判斷矩陣的構建
以醫院集中監測為主的主動監測研究類型中篩選出的指標為例,將指標分為目標層、準則層、指標層,構建指標層次結構。然后,利用9級標度法,通過比較每層不同元素建立判斷矩陣。
 |
其中,醫院集中監測研究類型的臨床安全性評價指標集記為A1,指標集中各指標記為Vi,共包含指標n個;Vi指標相對于Vj指標的相對重要性的比值為vij。
4.3.2 利用IWSC法對判斷矩陣進行調整
① 指標標準化處理:針對臨床安全性評價指標vij的標準化處理公式為:
 |
② 指標的賦權:選取“坎蒂雷賦權法”的客觀賦權法進行指標的賦權。先確定指標的相關系數矩陣 ,再通過標準差計算公式完成標準差對角矩陣
,再通過標準差計算公式完成標準差對角矩陣 的構建。通過計算矩陣
的構建。通過計算矩陣 后,確定特征值和數值最大特征值的特征向量特征值與特征向量的計算公式為
后,確定特征值和數值最大特征值的特征向量特征值與特征向量的計算公式為 ,其中
,其中 是特征向量,即可得權重值
是特征向量,即可得權重值 。
。
 |
③ 權優異度和權次異度:引入優隸屬度變量 表示
表示 與
與 距離
距離 大小的評價得分,次隸屬度變量
大小的評價得分,次隸屬度變量 表示
表示 與
與 距離
距離 大小的評價得分,則有
大小的評價得分,則有 且滿足
且滿足 ,其中
,其中 為歐氏距離。
為歐氏距離。
通過定義“權優異度” 為
為 與評價對象接近理想值的分數
與評價對象接近理想值的分數 的乘積,即
的乘積,即
 |
同理,“權次優異度”則為
 |
④ 萃取優勢指標、劣勢指標、關鍵指標:由于模型的目的是為了求出得分 ,故構建
,故構建 的函數表達式為
的函數表達式為 ,得到:
,得到: ;代入權優異度以及權次異度可得:
;代入權優異度以及權次異度可得: 。
。
根據 ,可得
,可得
 |
設 為去掉
為去掉 指標前、后兩次評價的得分,
指標前、后兩次評價的得分, 。通過比較
。通過比較 的大小,確定關鍵指標、優勢指標和劣勢指標,對矩陣進行調整與優化。
的大小,確定關鍵指標、優勢指標和劣勢指標,對矩陣進行調整與優化。
4.3.3 求矩陣的最大特征根值
求判斷矩陣的最大特征根值,原矩陣 與相對權重向量
與相對權重向量 的乘積獲得新向量
的乘積獲得新向量 ,即
,即 。
。
4.3.4 完成矩陣的一致性檢驗
構造判斷矩陣之后,需要對所有判斷矩陣實施一致性檢驗。筆者擬采用專家評分機制,收集專家對同層因素比較量化結果,然后取均值確定判斷矩陣。
4.3.5 單一研究類型AHP-IWSC評價模型
對各層級指標進行賦權,得到準則層指標 的歸一化權重值
的歸一化權重值 (
( ),指標層指標
),指標層指標 的歸一化權重值
的歸一化權重值 (
( ),應用乘積法逐層計算指標層指標
),應用乘積法逐層計算指標層指標 的組合權重向量
的組合權重向量 ,則有
,則有 ,完成各層級指標賦權后,最終形成醫院集中監測研究類型的AHP-IWSC評價模型。
,完成各層級指標賦權后,最終形成醫院集中監測研究類型的AHP-IWSC評價模型。
4.4 建立AHP-IWSC綜合評價模型
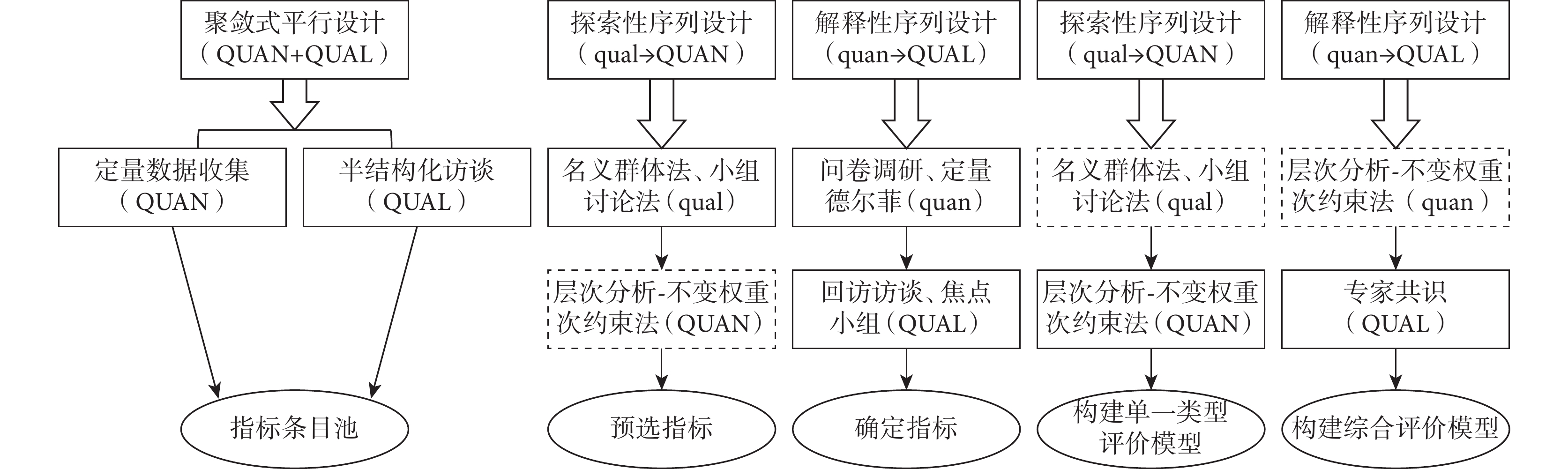
自發呈報系統、文獻研究類型的AHP-IWSC評價模型構建過程同醫院集中監測研究類型AHP-IWSC評價模型的構建過程。完成3種各研究類型的AHP-IWSC評價模型構建后,基于解釋性序列MMR,通過AHP-IWSC對各評價模型進行賦權,最后通過專家共識最終整合多種研究類型的綜合評價AHP-IWSC整體模型,研究思路見圖1。
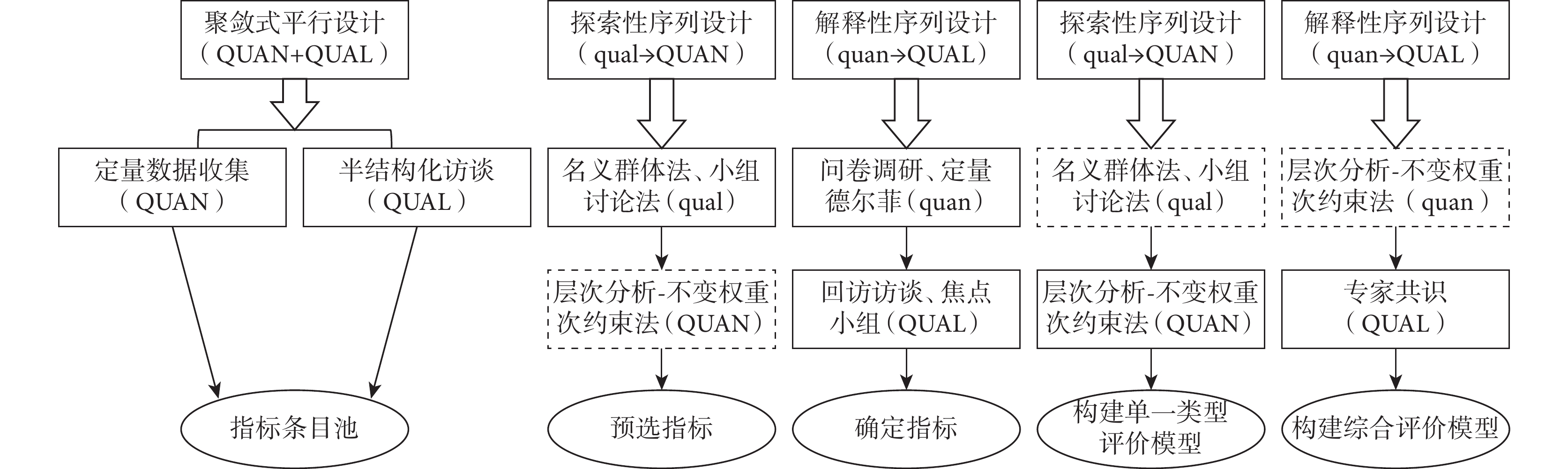 圖1
混合方法設計模式研究思路
圖1
混合方法設計模式研究思路
實線框表示在當前設計模式下完成,虛線框表示未在當前設計模式下完成;QUAN:定量方法;QUAL:定性方法;大寫字母表示優先重要,小寫字母表示較之次要,箭頭表示按照順序使用該方法。
5 小結
現今循證醫學發展迅速,證據體、證據分級等理念逐漸成熟,標志著一個以證據為基礎的新醫學時代的到來[39]。中藥注射劑上市后臨床安全性再評價工作開展十余年來,形成了多種臨床安全性再評價研究類型并分別獲取了單一研究證據,目前正面臨結果的驗收與評價。新醫學時代下,單一研究類型的臨床安全性再評價證據略顯單薄,綜合評價研究才是獲得更高質量證據、構建安全性證據體的必經之路。基于此,筆者創新性地提出并運用MMR多階段設計模式,構建兼具定量和定性兩種范式研究視角的臨床安全性綜合評價指標模型。該方法將有望解決中藥注射劑難以利用現有不同研究類型數據進行融合,獲取更高級別安全性評價證據的現實問題。同時,構建的綜合評價模型為中藥注射劑上市后臨床安全性綜合評價提供測量工具和新方法,為將來借助人工智能技術實現動態、實時評價奠定基礎。此方法有望推廣應用于各類中藥注射劑乃至其他藥品,具有十分重要的應用價值。
中藥注射劑上市后臨床安全性再評價研究是再評價的首要核心內容[1]。我國自2009年專門對中藥注射劑啟動上市后安全性再評價至今,逐漸形成了以醫院集中監測為主的主動監測、自發呈報系統報告的被動監測及安全性文獻研究等多種研究類型[2],并分別獲取了其單一研究類型的安全性證據。而藥品安全性評價證據應該從多源頭考慮,需要納入不同類型的研究證據[3],獲得其安全性綜合評價結果。基于此,考慮到單一研究類型評價結果存在一定的局限性(表1),獲得的證據很大程度上不能客觀、全面地代表中藥注射劑的臨床安全性[4],也不足以達到公認的證據強度和推薦力度,故筆者提出將上述研究類型數據整合進行綜合評價,以獲取更高質量的安全性證據[5]。
1 中藥注射劑上市后臨床安全性綜合評價研究現狀分析
2021年,中華人民共和國國家衛生健康委員會發布了《關于規范開展藥品臨床綜合評價工作的通知》,強調要不斷深化對藥品臨床綜合評價重要性的認識[6]。國內學者也開始了不斷探索,如謝雁鳴教授團隊采用多維準則決策模型對部分中成藥探索開展了包含安全性、有效性、經濟等方面的綜合評價,并提出安全性證據評價應融合多種研究類型進行綜合評價以構建中藥上市后安全性證據體[7,8]。劉建平教授也同樣提出,應該構建由多種研究方法、不同設計類型、多種來源的證據組成的“證據體”[9]。但國內符合藥品安全性特點的、能夠同時兼顧不同研究類型評價結果的、臨床安全性綜合評價具體技術方法尚未見報道,關于中藥注射劑臨床安全性綜合評價方法更無從談起。此外,國外藥品上市后安全性再評價以藥品不良反應(adverse drug reaction,ADR)監測研究的結果為絕對主導,并未完全達到綜合評價的目的和要求[10-12],也無法提供相應的參考。
2 構建中藥注射劑臨床安全性綜合評價模型的意義
中藥注射劑是中醫藥現代化的代表產物,因其具有起效迅速、生物利用度高等特點,在各種急危重癥的治療中發揮了重要作用。但近十余年頻發的中藥注射劑安全性事件[13],觸發了業界重新審視中藥注射劑療效與風險的證據嚴重不足的問題,亟需開展中藥注射劑上市后臨床安全性綜合評價研究獲取更高質量的循證醫學方法獲得的證據。綜合評價研究是指依據不同的評價目的和對象,選擇相應的評價指標,通過賦予指標不同權重,按照一定的評價方法將評價指標轉化為能反映評價對象某方面特征的信息(即綜合評價結果)[14]。因此,開展中藥注射劑上市后臨床安全性綜合評價研究的關鍵,是先建立中藥注射劑上市后臨床安全性綜合評價核心指標的優選方法,形成可賦權量化評分的模型應用于綜合評價。
構建中藥注射劑上市后臨床安全性綜合評價模型可有效解決綜合評價研究中核心指標篩選與研究質量測量中實際存在的難題。具體表現在:① 可以有效降低不同研究類型收集或報告數據類型的差異,解決不同研究類型間由于方法、群體等因素造成的差異性結果難以整合的問題,使更多研究納入綜合評價;② 可以提前規范設計不同研究類型應收集的數據條目和核心指標條目,有利于及時發現并減少不良反應漏報的情況;③ 通過對不同研究類型發現的不良反應進行多角度、多指標相關暴露因素的數據收集,提高不良反應因果關聯性評價的客觀性、合理性和科學性;④ 通過規范設計研究中應收集的核心指標條目,有效減少由于收集信息繁冗造成的研究對象依從性差的問題;⑤ 構建的量化評價模型,可實現對不同品種的中藥注射劑上市后臨床安全性各類型研究質量進行綜合測量,評估其完成的優劣,為將來借助人工智能技術實現動態、實時評價奠定基礎。所以,建立中藥注射劑上市后臨床安全性綜合評價模型具有十分重要的現實意義。
3 構建綜合評價模型尚需解決的關鍵問題
3.1 多維評價指標篩選問題
中藥注射劑上市后臨床安全性不同研究類型收集的數據信息既包含諸如人口學信息、個人過敏史、藥品實際使用相關信息、藥品發生不良反應情況信息(包括ADR臨床表現、發生時間、累及的器官/系統損害、轉歸時間及預后)等十分廣泛、復雜的非量化數據,也包含ADR發生率,不同ADR臨床表現的例次等可量化數據構成的客觀指標,同時還包含著不良反應因果關聯性評價及影響因素等主觀指標。而評價指標的篩選會直接影響后續研究的系統評價與整合[15,16],所以不僅是對各研究類型數據指標進行簡單的匯總,還需多角度、多維度的綜合考量。綜合評價模型的基礎是,篩選出各研究類型中所涉及安全性評價指標中必須且重點報告的核心指標[17],此研究過程可借鑒核心指標集(core outcome set,COS)的研制思路。
COS自2013年引進中國并被引入中醫藥領域以來,在有效性評價指標的篩選上得到了廣泛地應用并取得了不小的成績[18-20]。但COS研究目前也主要應用于有效性評價指標的研究中,在安全性評價指標中很少體現[21]。盡管邱瑞瑾等[17]提出采用COS研究模式,構建中成藥上市后臨床安全性評價核心數據集,但相關研究結果并未發表;且COS研究模式在方法學上還處于探索階段,仍需不斷完善[22]。目前許多COS研究采用德爾菲調查和共識會議相結合的方法形成COS,此研究過程中不同利益相關群體達成共識比較困難,存在重要但非核心指標被排除在外的可能[23]。因此,核心指標的確定需要探索更加豐富的定量、定性研究方法,以規避COS研究中定量定性研究方法相對單一,導致指標被過度排除的風險。混合方法研究(mixed methods research,MMR)結合了定量研究和定性研究的優勢[24],讓研究者從不同的角度去分析研究問題,經過反復多次的定性與定量研究,獲得更加深入全面的結果[25]。適合使用MMR的研究具有以下特征:① 使用單一類型的證據不足以回答研究問題;② 一種研究方法的結果,需要用第二種研究方法的結果來補充解釋;③ 在耗時較長,且包含多個階段的項目中,研究者需要聯結多個研究來達到總體目標;④ 獲得比單純采用定量或者定性研究更多的數據[26,27]。以上特征與醫療健康領域的諸多研究的特點和需求契合,符合藥品臨床安全性綜合評價方法學技術要求[28-30]。采用MMR有望為各研究類型篩選出符合本研究特點的評價指標,實現不同來源數據的有效融合,解決多維評價指標篩選問題。
3.2 多維指標賦權問題
中藥注射劑上市后安全性再評價研究過程實質上是由多指標影響的綜合評估,并非各評價要素的簡單融合,而是要求各指標間具有一定的相關性。并且指標在評價模型中的效力根據其重要程度需要各有側重,因此可體現在指標的準確賦權上。權重能夠反映各指標對整體模型的貢獻度,對提高指標的信度、效度、反應度,以及進行準確、合理、科學的臨床評價起著至關重要的作用[31]。
綜合評價模型構建研究設計中,筆者創新性地提出將層次分析法(analytic hierarchy process,AHP)與不變權重次約束(invariant weight sub-constraint,IWSC)相結合(AHP-IWSCM)并引入混合方法的定量研究部分。此法有望實現對復雜數據指標的準確賦權與優劣勢指標的篩選,保證綜合評價模型的效度。AHP通過矩陣標準化特征向量,由上至下逐層計算最低層因素相對最高層因素的相隨重要性權值構建指標權重,可以在一定程度上減少主觀性,以得到科學、嚴謹、標準的指標層次模型[32,33]。然而采用此方法只解決了不同評價指標的排序問題,無法具體給出哪些因素才是影響具體評價對象特定評價結果的關鍵因素。為解決上述問題,筆者提出引入廣泛應用于管理學、經濟學等領域的、用于篩選某一研究問題中關鍵影響因素的IWSC。IWSC通過采用保持有n個指標的完整指標體系與n?1個指標的指標體系前后兩次評價中指標權重不變,通過比較去掉1個指標貢獻前、后的指標體系得分排序的變化大小,來篩選優勢指標和劣勢指標,通過對整體指標影響程度的大小完成關鍵因素的篩選[34,35]。因此,兩種研究方法結合形成的AHP-IWSCM模型,可實現對各層次或各維度指標進行權重賦予與調節,使綜合評價模型更加符合實際研究情況,保證模型的科學性與適用性。
4 構建中藥注射劑臨床安全性綜合評價模型的思路
4.1 指標要素池的建立
綜合評價模型構建過程中,筆者擬以包括醫院集中監測為主的主動監測、自發呈報系統的被動監測和安全性文獻報道3種主要研究類型中所涉及的安全性評價指標為研究對象構建指標要素池。該過程是形成整個綜合評價模型研究的第一步,既要全面包括中藥注射劑上市后臨床安全性研究中涉及的所有完整指標,同時也要最大程度體現各研究類型中難以用定量指標體現的特點。因此,該部分研究不僅僅涉及定量指標的收集,還需要補充以訪談方式為主的定性研究收集正高級職稱醫師、藥師、臨床試驗者、企業、醫療專業技術人員等與COS利益相關群體對各類研究類型特點的經驗和對問題的認識[36,37],通過訪談最大程度挖掘體現各研究類型的個性化優勢的安全性評價指標。MMR中聚斂式平行設計可實現同時收集和分析定量數據和定性數據,比較兩種結果或相互驗證兩種結果,最適合用于指標要素池的構建。
4.2 評價指標的篩選
在MMR中,根據具體情況的需要,對于定量、定性研究各有側重,在先后順序上也略有不同。區別于聚斂式平行設計的定量定性研究并重且同時開展,解釋性序列設計和探索性序列設計根據研究目的的不同,也會各有側重。如在形成指標要素池后,筆者擬進行以定性研究為先、定量研究為主的探索性序列設計,同時穿插定量研究為先、定性研究為主的解釋性序列設計,進行不同交互程度、反復定量定性結合研究,以整合不同研究類型的多源復雜數據指標。在此部分研究中,筆者擬以名義群體法、小組討論法為主等定性方法,圍繞指標要素池進行討論,對指標要素池中各指標要素進行重要性評價,預篩選臨床安全性評價的重要指標要素和一般指標要素。再采用以上述定性研究結果為依據,設計咨詢問卷通過2~3輪的德爾菲法收集行業權威專家(正高級職稱)[38]對各指標納入與否及重要程度的評分,通過評分進一步明確重要/一般指標,而后再采用回訪訪談、焦點小組等定性方法,對上述德爾菲法形成的量化指標結果進行科學性、合理性的評價,保證最終篩選的指標能夠全面涵蓋上市后研究和上市后再評價所需的指標。
4.3 各研究類型評價模型的構建
4.3.1 指標分層與判斷矩陣的構建
以醫院集中監測為主的主動監測研究類型中篩選出的指標為例,將指標分為目標層、準則層、指標層,構建指標層次結構。然后,利用9級標度法,通過比較每層不同元素建立判斷矩陣。
 |
其中,醫院集中監測研究類型的臨床安全性評價指標集記為A1,指標集中各指標記為Vi,共包含指標n個;Vi指標相對于Vj指標的相對重要性的比值為vij。
4.3.2 利用IWSC法對判斷矩陣進行調整
① 指標標準化處理:針對臨床安全性評價指標vij的標準化處理公式為:
 |
② 指標的賦權:選取“坎蒂雷賦權法”的客觀賦權法進行指標的賦權。先確定指標的相關系數矩陣 ,再通過標準差計算公式完成標準差對角矩陣
,再通過標準差計算公式完成標準差對角矩陣 的構建。通過計算矩陣
的構建。通過計算矩陣 后,確定特征值和數值最大特征值的特征向量特征值與特征向量的計算公式為
后,確定特征值和數值最大特征值的特征向量特征值與特征向量的計算公式為 ,其中
,其中 是特征向量,即可得權重值
是特征向量,即可得權重值 。
。
 |
③ 權優異度和權次異度:引入優隸屬度變量 表示
表示 與
與 距離
距離 大小的評價得分,次隸屬度變量
大小的評價得分,次隸屬度變量 表示
表示 與
與 距離
距離 大小的評價得分,則有
大小的評價得分,則有 且滿足
且滿足 ,其中
,其中 為歐氏距離。
為歐氏距離。
通過定義“權優異度” 為
為 與評價對象接近理想值的分數
與評價對象接近理想值的分數 的乘積,即
的乘積,即
 |
同理,“權次優異度”則為
 |
④ 萃取優勢指標、劣勢指標、關鍵指標:由于模型的目的是為了求出得分 ,故構建
,故構建 的函數表達式為
的函數表達式為 ,得到:
,得到: ;代入權優異度以及權次異度可得:
;代入權優異度以及權次異度可得: 。
。
根據 ,可得
,可得
 |
設 為去掉
為去掉 指標前、后兩次評價的得分,
指標前、后兩次評價的得分, 。通過比較
。通過比較 的大小,確定關鍵指標、優勢指標和劣勢指標,對矩陣進行調整與優化。
的大小,確定關鍵指標、優勢指標和劣勢指標,對矩陣進行調整與優化。
4.3.3 求矩陣的最大特征根值
求判斷矩陣的最大特征根值,原矩陣 與相對權重向量
與相對權重向量 的乘積獲得新向量
的乘積獲得新向量 ,即
,即 。
。
4.3.4 完成矩陣的一致性檢驗
構造判斷矩陣之后,需要對所有判斷矩陣實施一致性檢驗。筆者擬采用專家評分機制,收集專家對同層因素比較量化結果,然后取均值確定判斷矩陣。
4.3.5 單一研究類型AHP-IWSC評價模型
對各層級指標進行賦權,得到準則層指標 的歸一化權重值
的歸一化權重值 (
( ),指標層指標
),指標層指標 的歸一化權重值
的歸一化權重值 (
( ),應用乘積法逐層計算指標層指標
),應用乘積法逐層計算指標層指標 的組合權重向量
的組合權重向量 ,則有
,則有 ,完成各層級指標賦權后,最終形成醫院集中監測研究類型的AHP-IWSC評價模型。
,完成各層級指標賦權后,最終形成醫院集中監測研究類型的AHP-IWSC評價模型。
4.4 建立AHP-IWSC綜合評價模型
自發呈報系統、文獻研究類型的AHP-IWSC評價模型構建過程同醫院集中監測研究類型AHP-IWSC評價模型的構建過程。完成3種各研究類型的AHP-IWSC評價模型構建后,基于解釋性序列MMR,通過AHP-IWSC對各評價模型進行賦權,最后通過專家共識最終整合多種研究類型的綜合評價AHP-IWSC整體模型,研究思路見圖1。
 圖1
混合方法設計模式研究思路
圖1
混合方法設計模式研究思路
實線框表示在當前設計模式下完成,虛線框表示未在當前設計模式下完成;QUAN:定量方法;QUAL:定性方法;大寫字母表示優先重要,小寫字母表示較之次要,箭頭表示按照順序使用該方法。
5 小結
現今循證醫學發展迅速,證據體、證據分級等理念逐漸成熟,標志著一個以證據為基礎的新醫學時代的到來[39]。中藥注射劑上市后臨床安全性再評價工作開展十余年來,形成了多種臨床安全性再評價研究類型并分別獲取了單一研究證據,目前正面臨結果的驗收與評價。新醫學時代下,單一研究類型的臨床安全性再評價證據略顯單薄,綜合評價研究才是獲得更高質量證據、構建安全性證據體的必經之路。基于此,筆者創新性地提出并運用MMR多階段設計模式,構建兼具定量和定性兩種范式研究視角的臨床安全性綜合評價指標模型。該方法將有望解決中藥注射劑難以利用現有不同研究類型數據進行融合,獲取更高級別安全性評價證據的現實問題。同時,構建的綜合評價模型為中藥注射劑上市后臨床安全性綜合評價提供測量工具和新方法,為將來借助人工智能技術實現動態、實時評價奠定基礎。此方法有望推廣應用于各類中藥注射劑乃至其他藥品,具有十分重要的應用價值。