臨床循證決策過程中需要基于最佳證據,綜合考慮干預措施利弊大小、證據確信度、成本與可行性等因素。通過制定患者健康結局指標效應量決策閾值(decision threshold of effect size,DTES),能夠幫助利益相關者理解干預措施利弊大小、評估證據確信度和解讀研究結果。MERGE工作組充分借鑒國際經驗,通過小組討論、半結構化訪談、專家共識和試點應用,開發了一套包括8個步驟的健康結局指標DTES制定方法指南,包括:必要性評估、組建工作組、遴選患者重要結局、基于最佳證據制作情景示例、設計專家函詢問卷、分析專家涵詢結果、面對面專家共識以及推廣應用與后效評價。DTES指南的開發,以期為利益相關者制定不同領域健康結局指標的DTES提供方法指導。
引用本文: 劉雅菲, 朱鴻飛, 李穎, 賴鴻皓, 周奇, 羅旭飛, 陳耀龍, 鄧宏勇, 杜亮, 靳英輝, 孔德昭, 黎國威, 李江, 李玲, 廖星, 劉杰, 史楠楠, 商洪才, 田金徽, 王曉輝, 吳大嶸, 楊豐文, 楊克虎, 于長禾, 張家興, 趙晨, 葛龍. 健康結局指標效應量決策閾值制定方法指南. 中國循證醫學雜志, 2024, 24(4): 405-413. doi: 10.7507/1672-2531.202308133 復制
版權信息: ?四川大學華西醫院華西期刊社《中國循證醫學雜志》版權所有,未經授權不得轉載、改編
臨床循證決策過程中應基于最佳證據,綜合考慮干預措施利弊大小、證據確信度、成本與可行性等因素后做出決策[1,2],推薦分級的評估、制定與評價(grading of recommendations assessment,development and evaluation,GRADE)工作組建議將干預措施利弊大小劃分為無意義(trivial or small, unimportant or no effect)、較小、中等或較大效應四類,對應的3個閾值分別為較小效應閾值(small effect threshold=T1)、中等效應閾值(moderate effect threshold=T2)和大效應閾值(large effect threshold=T3)。通過制定患者健康結局指標效應量決策閾值(decision threshold of effect size,DTES),能夠幫助利益相關者理解干預措施利弊大小、評估證據確信度和解讀研究結果。
目前,DTES多被用于進行結果解讀或證據質量評價相關的方法學指導,或基于具體適用范圍研究DTES的制定。然而,這些研究主要關注DTES的應用,并未詳細描述DTES的制定過程和步驟結果,因而國內外尚無能夠指導制定DTES的方法標準[3]。為此,MERGE工作組—一個專注于循證醫學方法學創新并在多學科交叉、融合和應用的團隊,在充分借鑒國際經驗基礎上,組織多學科領域的專家開發了針對患者健康結局指標效應量決策閾值制定的方法學指南,以期為利益相關者制定不同領域健康結局指標的DTES提供方法指導。
1 方法
本研究通過以下3個步驟構建方法指南:① 通過系統評價與方法學核心小組討論形成DTES制定方法指南初稿;② 以藥物治療新型冠狀病毒感染(coronavirus disease 2019,COVID-19)動態快速循證實踐要覽[4]的制訂為例,對方法指南初稿進行試點應用,確認各步驟的規范性與可操作性;③ 基于半結構化深入訪談與德爾菲共識收集多學科領域專家意見,修改完善方法規程并擬定終稿。
1.1 形成方法指南初稿
計算機檢索CNKI、WanFang Data、CBM、VIP、PubMed、Web of Science和Embase數據庫,補充檢索谷歌網站,中文檢索詞包括:閾值、指南、Meta分析、系統評價、衛生技術評估等;英文檢索詞包括:threshold*、guideline*、meta analys*、systematic review、health technology assessment*等。2名研究者獨立篩選文獻以獲取國內外已發表的DTES制定相關研究,提取納入研究中DTES制定的整體思路及相關步驟,進行描述性分析。
1.2 方法指南初稿的試點應用
以制訂“藥物治療新型冠狀病毒感染快速動態循證要覽”[4]為背景,應用DTES指南初稿制定COVID-19患者重要結局指標的DTES。通過預檢索COVID-19結局指標DTES總結現有研究基礎,進而判斷針對國內感染者與可及治療方案制定DTES的必要性。組建工作組并邀請共識專家,在檢索核心結局指標集(core outcome sets,COS)以遴選重要結局指標、基于系統評價(systematic review,SR)構建情景示例、設計調查DTES的專家函詢問卷后,通過一輪德爾菲專家函詢和一輪面對面專家共識會議,針對目標人群分組確定了COVID-19重要結局指標的T1、T2與T3,該DTES已在“藥物治療新型冠狀病毒感染快速動態循證要覽”[4]中報告。
在應用方法規程初稿的同時,細化步驟的操作要點,及時發現并解決使用該方法時可能出現的問題。基于試點應用DTES工作組成員的討論,采納有關專業術語解釋、專家函詢前培訓及情景示例證據遴選的主要修改意見。
1.3 形成方法指南終稿
采用目的抽樣,遵循信息飽和原則[5],邀請資深衛生研究方法學專家,就如何優化方法規程進行半結構化深入訪談。根據扎根理論對訪談材料進行編碼分析,通過開放式編碼、主軸編碼與核心編碼3個步驟概括整理專家的修改意見得到主范疇,并進一步完善各步驟形成修改稿。綜合考慮專業領域、地域分布及性別等因素組建共識專家組,使用德爾菲法達成共識,使用專家積極系數與權威系數(Cr)反映專家可靠性和權威性,最終根據共識建議修改框架,經專家審議擬定終稿。
2 結果
2.1 構建方法指南結果
經檢索后共獲得7項研究,根據研究目的,3項研究[6-8]針對具體目標人群與結局指標展開DTES制定,4項研究[9-12]涉及DTES制定的思路與需要考慮的因素。以SR結果為基礎,起草方法規程初稿。邀請5名工作年限在5~15年、博士學歷且具有副高級及以上職稱的方法學家組成核心小組,通過多輪討論、修改形成初稿。
同時,基于“藥物治療新型冠狀病毒感染快速動態循證要覽”[4]中試點應用工作組的討論結果,采納了3條有關專業術語解釋、專家函詢前培訓及情景示例證據遴選的主要修改意見。邀請6名資深衛生研究方法學專家進行半結構化深入訪談,通過三級編碼概括得到共識專家組組建、DTES調查表設計、調查形式選擇、資料整理分析、專家共識會議召開、方法指南整體建議6個主范疇,進一步完善形成修改稿。
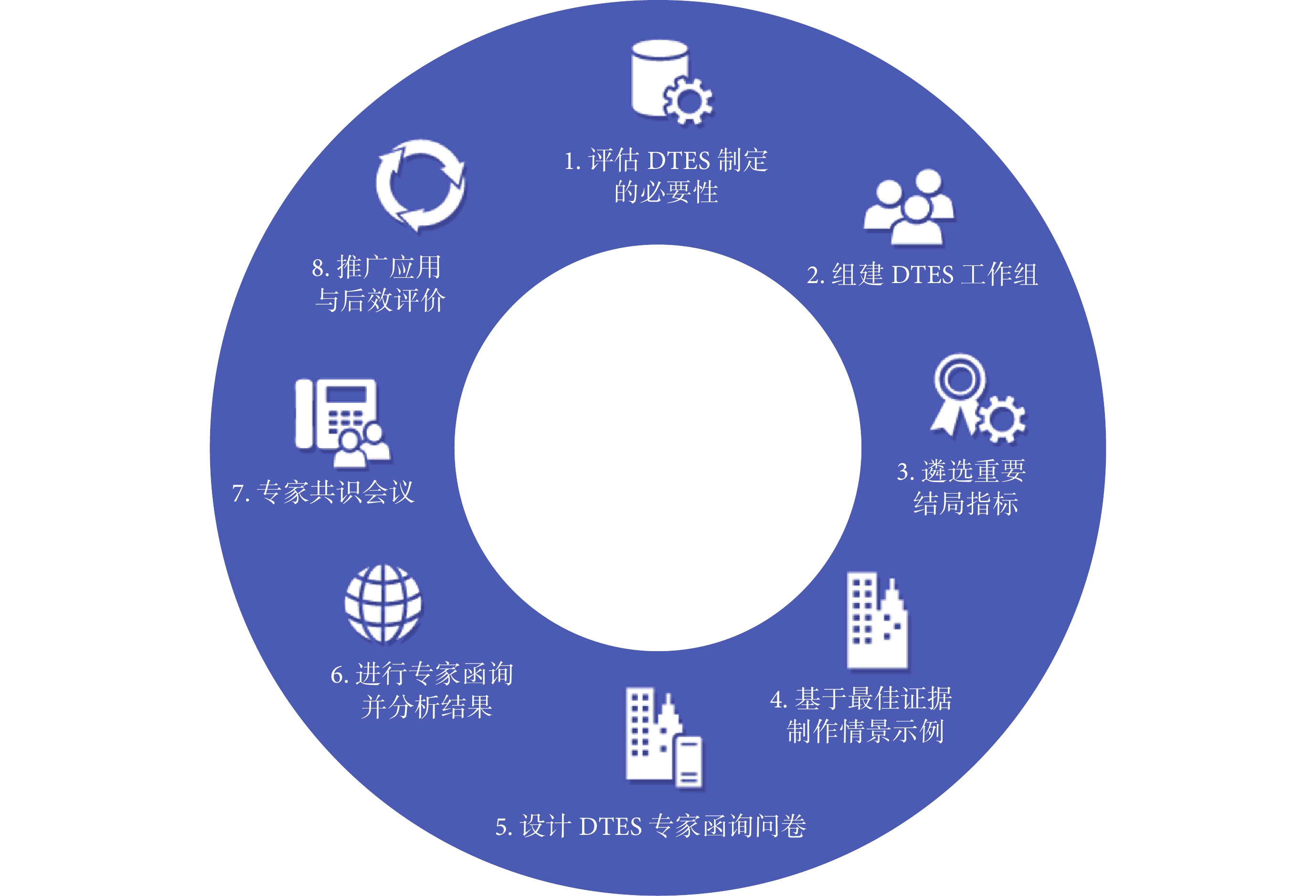
綜合考慮專業領域、地域分布及性別等因素,邀請來自北京、廣東、甘肅、貴州、四川、湖北、遼寧7個省(市)數十家科研院所的14名專家組建共識專家組。專家的專業方向覆蓋臨床醫學、臨床藥學、公共衛生、衛生政策與衛生研究方法學。工作組向專家發放函詢問卷,經過第一輪德爾菲調查后,專家積極系數(問卷回收率)為100%,Cr為0.874,共識條目同意率在78.57%~100%之間,收到30條開放式專家意見。本輪所有共識條目同意率均大于70%,無需進行第二輪德爾菲調查,繼而修改步驟及操作要點,對操作要點進一步解釋形成方法指南終稿并發給專家核查確認,經專家審議最終擬定8個步驟的方法指南:① 評估DTES制定的必要性;② 組建DTES工作組;③ 遴選重要結局指標;④ 基于最佳證據構建情景示例;⑤ 設計DTES專家函詢問卷;⑥ 進行專家函詢并分析結果;⑦ 面對面專家共識會議;⑧ 推廣與后效評價。
2.2 健康結局指標DTES制定方法指南
健康結局指標DTES制定方法指南包含8個步驟(圖1),各步驟操作要點及舉例說明如下:
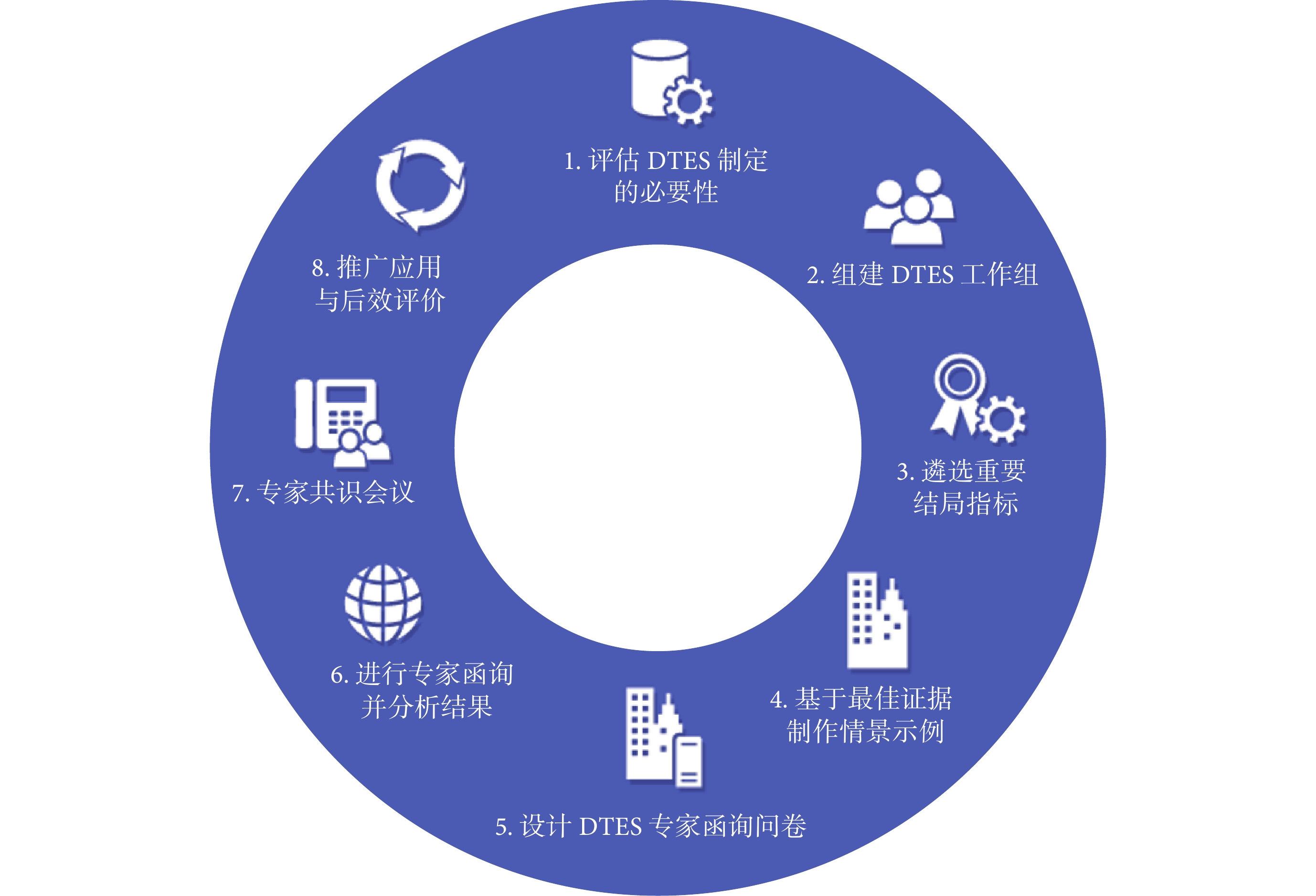 圖1
DTES制定步驟
圖1
DTES制定步驟
2.2.1 步驟1:評估DTES制定的必要性
在后續步驟開始前,應先判斷是否需要開展結局指標DTES的制定工作。首先系統檢索目標主題是否已有研究報告相關結局指標DTES,若不存在此類研究,可按本指南開展DTES的制定工作。
當存在已發布的DTES時,首先應評估當前發布的DTES是否符合目標主題要求,通常需判斷其使用范圍如人群分組、臨床分型等是否與本研究目標一致。其次應評估T1、T2和T3是否均已制定,且已有DTES的結局指標是否已涵蓋本研究關注的全部結局。需注意,T1與最小臨床意義差值(minimal clinically important difference,MCID)的含義一致[10,13]。如果經評估認為已發布的DTES適用范圍符合要求,T1、T2和T3均已制定,且可使用已發布的DTES。當已有的DTES不齊全、部分結局指標還需要確定DTES或適用范圍的差異不可接受時,仍可遵循本指南開展制定工作。
2.2.2 步驟2:組建DTES工作組
DTES工作組應至少包含指導委員會、秘書組、證據評價組和共識專家組4個部分,成員的相關要求與主要職能見表1。成員可根據目標主題擬解決的問題(臨床或公共衛生問題)進行調整,一般情況下應包括相關領域專家及衛生主管部門或衛生保健服務提供者等利益相關者,理想情況下還應包含患者、高危人群與公眾[7,14,15]。其中,共識專家組成員應以具備目標主題相關研究經驗,并對衛生研究方法學有一定了解的臨床專家或公共衛生專家為主。此外,研究者還應邀請熟悉關注目標干預措施有效性相關證據的衛生研究方法學家參與共識。在條件允許的情況下建議訪談公眾或患者代表等目標受眾,邀請具備足以理解訪談內容的文化水平的利益相關者,調查其對結局指標重要性的評價及干預措施有效性的體驗。由于公眾或患者代表的觀點基于個體而非群體視角,因此并不直接參與DTES的制定,可將公眾或患者代表的觀點作為專家討論時的參考資料呈現。
在確定工作組成員后,所有成員需填寫利益沖突聲明表并交由秘書組備案,各類利益沖突的聲明應在制定過程中基于實際情況動態更新。由指導委員會負責審核成員的利益沖突聲明,存在直接或間接經濟利益沖突的成員應予以排除,若存在其他類型利益沖突如專業或知識產權沖突,應予以公開。
2.2.3 步驟3:遴選患者重要結局指標
研究者應基于專家、決策實施者與目標受眾的意見[16],采用文獻研究、定性訪談、面對面專家共識會議、德爾菲法中的一種或多種方法遴選需要制定DTES的患者重要結局指標[3,17]。
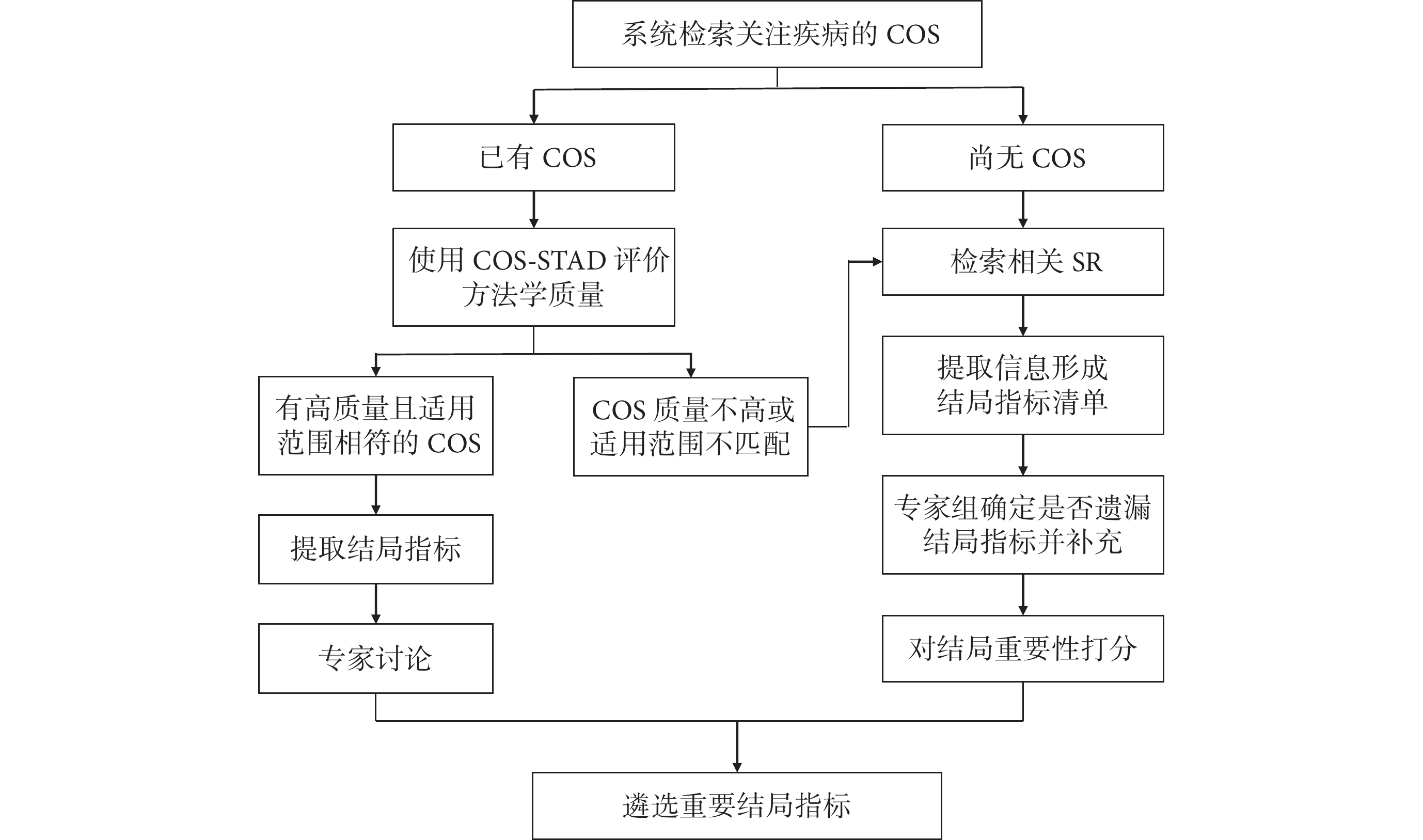
首先系統檢索并篩選關注疾病的COS[18],遴選流程如圖2所示。如果存在COS,可以使用COMET工作組提出的COS-STAD[19]進行方法學質量評價,以判斷該COS是否可作為參考依據。COS-STAD包含11個條目,各條目最終評價結果為“是”(1分)或“不是”(0分)。針對高質量且符合研究范圍的COS,提取COS的結局指標,通過專家組對重要性打分排序并形成共識以確定重要結局指標。若無高質量COS,或COS適用范圍不足以涵蓋DTES應用范圍(例如COS僅關注目標疾病的某一分型,或COS僅關注中老年人而DTES目標人群還包括青少年與成人等),則參考WHO指南制定手冊與GRADE工作組建議的結局指標遴選與重要性排序方法[16,17,20-22],基于人群、干預措施與對照措施系統檢索并篩選已發表的SR,提取多個SR所關注的結局指標以形成結局指標清單。由專家組確定是否有遺漏的相關結局并進行補充,可要求專家組成員使用9分Likert評分系統對結局指標的重要性進行打分,7~9分代表“至關重要”,4~6分代表“重要”,1~3分代表“相對次要”。基于評分情況對結局指標進行重要性排序,遴選“至關重要”與“重要”的結局指標。
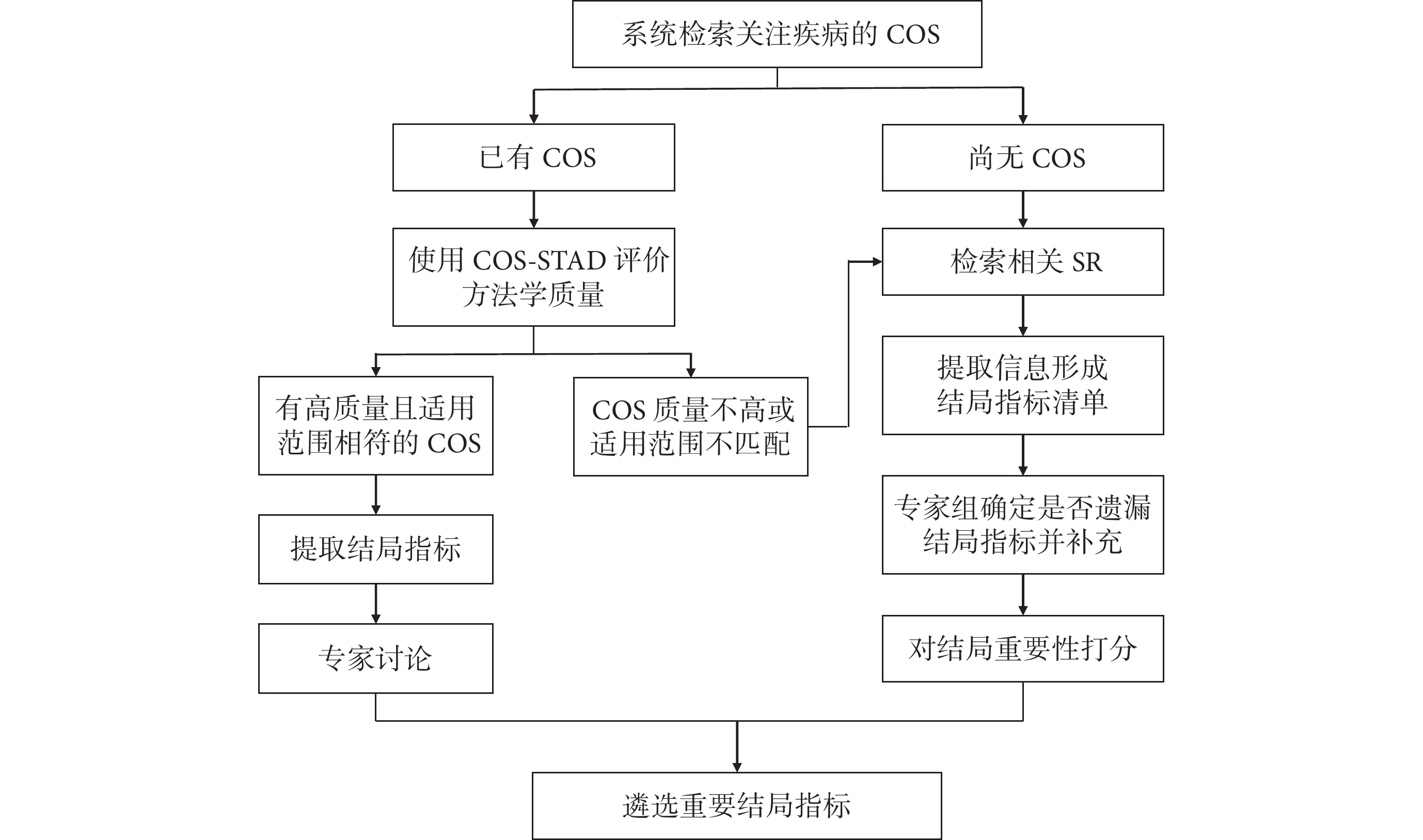 圖2
重要結局指標遴選流程
圖2
重要結局指標遴選流程
2.2.4 步驟4:基于最佳證據制作情景示例
為便于專家理解調查目的,直觀呈現擬關注結局接受干預措施后與基線風險的差異,在DTES調查表中應針對各個結局構建相應的情景示例。基于確定的研究對象、干預措施、對照措施與結局指標制定檢索策略與證據的納入與排除標準。盡管基于隨機對照試驗的SR或Meta分析(systematic review/meta-analysis,SR/MA)被視為最佳證據主要來源[23],但最佳證據需同時考慮SR/MA質量和時效性兩個因素,若存在已發表的SR/MA,可使用AMSTAR 2工具(a measurement tool to assess systematic reviews)[24,25]對其進行方法學質量評價。AMSTAR 2工具包含16個條目,關注SR/MA從選題設計、注冊、數據提取、偏倚風險評估、統計分析、結果的解釋與討論到利益沖突報告的全過程,7個條目被視為關鍵條目。各條目的評價結果為“是”(回答正確且依據充分)、“部分是”(回答正確但依據不足)和“否”(無相關評價內容或評價不當),SR/MA的整體方法學質量可被評為“高”(無或僅1個非關鍵條目存在缺陷)、“中等”(>1個非關鍵條目存在缺陷)、“低”(1個關鍵條目存在缺陷)以及“極低”(>1個關鍵條目存在缺陷)。
參考Cochrane系統評價手冊[26],當存在近兩年內發布的高質量SR/MA時,可將該SR/MA作為情景示例的證據基礎;若SR/MA為高質量但發布時間較早,應考慮更新該SR/MA;如果不存在相關SR/MA或存在低質量SR/MA,則檢索原始研究證據制作新的SR/MA。當存在多篇符合要求的SR/MA時,由指導委員會綜合考慮各研究中臨床分型、人群及地區等亞組分析的詳細程度確定最終的證據基礎。
為避免干預措施的具體名稱對專家判斷造成影響,情景示例中不報告具體的干預措施。由于結局指標DTES為效應點估計值的閾值,為避免呈現信息造成判斷干擾,不顯示該估計值的置信區間。情景示例的呈現方式參考SoF表[27],應報告結局指標、人群或患者、對照措施、證據的樣本量和研究數量、GRADE證據質量。除上述信息外,對于分類變量,呈現相對效應、常規對照的基線風險、干預組風險、干預與基線風險差;對于連續型變量,呈現常規對照的基線值、干預組效應、干預與基線值的差值。參考BMJ發表的題為“Drug treatments for COVID-19: living systematic review and network meta-analysis”的研究[28],表2與表3為示例。
2.2.5 步驟5:設計DTES專家函詢問卷
設計DTES專家函詢問卷,通過德爾菲法調查DTES。問卷由前言、填寫說明和DTES調查表及專家基本信息4個部分組成。在前言部分詳細說明研究目的、意義和調查內容。填寫說明應對DTES調查表中出現的專業術語均給予詳盡的解釋。
針對每個重要結局指標,DTES調查表根據目標人群分組或疾病臨床分型構建一個或多個情景示例,每個情景示例下包含兩個問題(框1)。若存在可用不同量表測量效應的結局指標,應針對COS指定的測量工具或SR/MA報告較為廣泛使用的量表構建情景示例;若暫無相關COS或無法確定最為常用的量表,建議考慮每個量表均構建相應情景示例。為便于專家理解問題,貼合決策實際,明確要求專家基于群體效應視角對干預組絕對風險或效應做出判斷。
2.2.6 步驟6:進行專家函詢并分析結果
考慮到DTES專家函詢問卷的專業性較強,為使專家能夠充分理解調查內容,可在問卷發放前召開會議或制作教學視頻對專家進行培訓。
預先針對專家意見的集中程度與協調程度設定達成共識的標準,未達成共識的DTES應在反饋分析結果后再次共識。核對收集到的資料,進行雙人雙錄。需注意問題2所得各組數據為干預組效應閾值,而研究目的為制定重要結局指標干預與基線差值DTES。因此,在計算DTES前應將收集數據轉化為干預與基線差值的閾值,即將基線風險或基線值減去專家所填寫較小、中等或較大改變的數值。對轉換后各組數值進行正態性檢驗,服從正態分布采用均數和標準差描述,否則采用中位數和四分位間距描述,所得均數或中位數即為各結局指標的DTES。
2.2.7 步驟7:面對面專家共識會議
當專家函詢的分析結果存在未達成共識的結局指標時,向參與函詢專家發出會議邀請,在會議中介紹會議議題并分別呈現達成共識及未達成共識的調查結果。專家在會議中針對未達成共識的DTES展開討論,通過投票等方式確定該結局指標最終的DTES。無論是否召開面對面專家共識,所有結局指標DTES都應由專家組最終確認通過。
2.2.8 步驟8:推廣應用與后效評價
DTES可通過同行評審期刊、媒體等途徑傳播,可同時發布教學視頻或培訓手冊等DTES的應用輔助材料。其主要應用方式包括輔助指南、SR或衛生技術評估等研究背景下的數據分析結果解讀,評價效應估計值的不精確性,以及作為推薦意見更新的先驗閾值。
監測評估應用情況,并建立合理的反饋機制。根據應用反饋與相關研究證據的動態監測情況(例如定期檢查DTES研究發表后的被引情況)判斷是否更新DTES,主要包括完善已制定的DTES和新增某個重要結局指標DTES。
3 討論
本研究在方法指南構建初期系統檢索DTES制定相關研究,在對此進行歸納總結的基礎上撰寫初稿,同時充分參考權威機構制訂且經過多個研究驗證的相關方法工具與流程,經方法學家多輪討論一致通過初稿并進行試點應用;為優化完善方法學框架,根據試點應用多學科DTES工作組反饋、資深衛生研究方法學家訪談結果及一輪德爾菲函詢收集的多學科專家組正式意見最終擬定方法指南終稿,構建了首個系統可操作的核心結局指標DTES制定方法指南。
該DTES制定方法指南的優點在于:① 各步驟及操作要點清晰明確,可操作性強,解釋舉例部分列出具體方法流程的參考來源,便于使用者理解;② 明確的DTES可評估干預措施利弊、評價證據質量,從而決定推薦意見方向與強度、判斷推薦意見是否更新。基于國際GRADE標準[29],決定推薦強度的關鍵因素包括干預措施利弊平衡、證據質量、價值觀和偏好以及成本大小。當確定結局指標的DTES后,可明確干預措施的效應量大小與利弊方向,評價證據質量的不精確性,若干預利弊間差距越大、證據質量越高,越適合作出強推薦,反之適合作出弱推薦。同樣,當新證據出現時,可通過DTES評估是否更新推薦意見,確保指南的時效性和準確性。
鑒于時間與成本的限制,本指南尚存在以下不足:① 試點應用的范圍不夠廣泛,未來還應在SR、衛生技術評估和指南等研究背景下應用,進一步驗證方法指南;② DTES制定領域研究的數量較少,潛在的定量方法均未得到研究的應用與驗證[30,31],如考慮單一獲益結局與單一危害結局的方法包括計算增量凈健康效益(incremental net health benefit,INHB)、凈臨床效益(net clinical benefit,NCB)和需治療人數(number needed to treat,NNT)等,同時考慮多個獲益或危害結局的方法主要有多準則決策分析(multicriteria decision analysis,MCDA),限制了DTES制定方法的多樣性;③ 臨床決策注重患者的偏好與價值觀,主要通過調查或系統檢索目標受眾的偏好與價值觀研究收集觀點,但將調查或SR結果融入決策形成過程的具體方法步驟少有報告[3,32],考慮到DTES專家函詢問卷的專業性較強,邀請目標受眾直接參與DTES制定難度較大,方法指南提出通過訪談或問卷調查的方式收集受眾對干預措施及結局指標效應量大小的觀點,未來研究還需對科學系統方法展開進一步探索。
隨著指南、SR和衛生技術評估等研究對制定并應用DTES以輔助解釋數據分析結果、評價證據質量、制訂推薦意見或形成結論的需求增加,今后有必要采取具體措施以推動框架的推廣、應用與完善。其次,有必要針對DTES的有效性評價展開研究,以降低決策帶來的風險,提高決策的可信度與穩定性。
4 小結
健康結局指標DTES制定方法指南可為臨床決策的利益相關者衡量干預措施效應量大小提供可靠方法,促進研究者合理解讀多種干預措施產生的健康影響、判斷影響大小并評估證據精確性,對決策過程的科學化、規范化與透明化有著積極作用。
專家組成員(按姓氏首字母排序)
陳耀龍(蘭州大學基礎醫學院循證醫學中心)、鄧宏勇(上海中醫藥大學中醫健康協同創新中心)、杜亮(四川大學華西醫院中國循證醫學中心)、靳英輝(武漢大學中南醫院循證與轉化醫學中心)、孔德昭(遼寧中醫藥大學附屬醫院)、黎國威(暨南大學附屬廣東省第二人民醫院)、李江(中國醫學科學院腫瘤醫院)、李玲(四川大學華西醫院中國循證醫學中心)、廖星(中國中醫科學院臨床與基礎醫學研究所)、劉杰(中國中醫科學院廣安門醫院)、商洪才(北京中醫藥大學東直門醫院)、史楠楠(中國中醫科學院中醫臨床基礎醫學研究所)、田金徽(蘭州大學基礎醫學院循證醫學中心)、王曉輝(蘭州大學公共衛生學院)、吳大嶸(廣州中醫藥大學第二附屬醫院)、楊豐文(天津中醫藥大學循證醫學中心)、楊克虎(蘭州大學基礎醫學院循證醫學中心)、于長禾(北京中醫藥大學東直門醫院)、張家興(貴州省人民醫院藥劑科)、趙晨(中國中醫科學院中醫臨床基礎醫學研究所)
臨床循證決策過程中應基于最佳證據,綜合考慮干預措施利弊大小、證據確信度、成本與可行性等因素后做出決策[1,2],推薦分級的評估、制定與評價(grading of recommendations assessment,development and evaluation,GRADE)工作組建議將干預措施利弊大小劃分為無意義(trivial or small, unimportant or no effect)、較小、中等或較大效應四類,對應的3個閾值分別為較小效應閾值(small effect threshold=T1)、中等效應閾值(moderate effect threshold=T2)和大效應閾值(large effect threshold=T3)。通過制定患者健康結局指標效應量決策閾值(decision threshold of effect size,DTES),能夠幫助利益相關者理解干預措施利弊大小、評估證據確信度和解讀研究結果。
目前,DTES多被用于進行結果解讀或證據質量評價相關的方法學指導,或基于具體適用范圍研究DTES的制定。然而,這些研究主要關注DTES的應用,并未詳細描述DTES的制定過程和步驟結果,因而國內外尚無能夠指導制定DTES的方法標準[3]。為此,MERGE工作組—一個專注于循證醫學方法學創新并在多學科交叉、融合和應用的團隊,在充分借鑒國際經驗基礎上,組織多學科領域的專家開發了針對患者健康結局指標效應量決策閾值制定的方法學指南,以期為利益相關者制定不同領域健康結局指標的DTES提供方法指導。
1 方法
本研究通過以下3個步驟構建方法指南:① 通過系統評價與方法學核心小組討論形成DTES制定方法指南初稿;② 以藥物治療新型冠狀病毒感染(coronavirus disease 2019,COVID-19)動態快速循證實踐要覽[4]的制訂為例,對方法指南初稿進行試點應用,確認各步驟的規范性與可操作性;③ 基于半結構化深入訪談與德爾菲共識收集多學科領域專家意見,修改完善方法規程并擬定終稿。
1.1 形成方法指南初稿
計算機檢索CNKI、WanFang Data、CBM、VIP、PubMed、Web of Science和Embase數據庫,補充檢索谷歌網站,中文檢索詞包括:閾值、指南、Meta分析、系統評價、衛生技術評估等;英文檢索詞包括:threshold*、guideline*、meta analys*、systematic review、health technology assessment*等。2名研究者獨立篩選文獻以獲取國內外已發表的DTES制定相關研究,提取納入研究中DTES制定的整體思路及相關步驟,進行描述性分析。
1.2 方法指南初稿的試點應用
以制訂“藥物治療新型冠狀病毒感染快速動態循證要覽”[4]為背景,應用DTES指南初稿制定COVID-19患者重要結局指標的DTES。通過預檢索COVID-19結局指標DTES總結現有研究基礎,進而判斷針對國內感染者與可及治療方案制定DTES的必要性。組建工作組并邀請共識專家,在檢索核心結局指標集(core outcome sets,COS)以遴選重要結局指標、基于系統評價(systematic review,SR)構建情景示例、設計調查DTES的專家函詢問卷后,通過一輪德爾菲專家函詢和一輪面對面專家共識會議,針對目標人群分組確定了COVID-19重要結局指標的T1、T2與T3,該DTES已在“藥物治療新型冠狀病毒感染快速動態循證要覽”[4]中報告。
在應用方法規程初稿的同時,細化步驟的操作要點,及時發現并解決使用該方法時可能出現的問題。基于試點應用DTES工作組成員的討論,采納有關專業術語解釋、專家函詢前培訓及情景示例證據遴選的主要修改意見。
1.3 形成方法指南終稿
采用目的抽樣,遵循信息飽和原則[5],邀請資深衛生研究方法學專家,就如何優化方法規程進行半結構化深入訪談。根據扎根理論對訪談材料進行編碼分析,通過開放式編碼、主軸編碼與核心編碼3個步驟概括整理專家的修改意見得到主范疇,并進一步完善各步驟形成修改稿。綜合考慮專業領域、地域分布及性別等因素組建共識專家組,使用德爾菲法達成共識,使用專家積極系數與權威系數(Cr)反映專家可靠性和權威性,最終根據共識建議修改框架,經專家審議擬定終稿。
2 結果
2.1 構建方法指南結果
經檢索后共獲得7項研究,根據研究目的,3項研究[6-8]針對具體目標人群與結局指標展開DTES制定,4項研究[9-12]涉及DTES制定的思路與需要考慮的因素。以SR結果為基礎,起草方法規程初稿。邀請5名工作年限在5~15年、博士學歷且具有副高級及以上職稱的方法學家組成核心小組,通過多輪討論、修改形成初稿。
同時,基于“藥物治療新型冠狀病毒感染快速動態循證要覽”[4]中試點應用工作組的討論結果,采納了3條有關專業術語解釋、專家函詢前培訓及情景示例證據遴選的主要修改意見。邀請6名資深衛生研究方法學專家進行半結構化深入訪談,通過三級編碼概括得到共識專家組組建、DTES調查表設計、調查形式選擇、資料整理分析、專家共識會議召開、方法指南整體建議6個主范疇,進一步完善形成修改稿。
綜合考慮專業領域、地域分布及性別等因素,邀請來自北京、廣東、甘肅、貴州、四川、湖北、遼寧7個省(市)數十家科研院所的14名專家組建共識專家組。專家的專業方向覆蓋臨床醫學、臨床藥學、公共衛生、衛生政策與衛生研究方法學。工作組向專家發放函詢問卷,經過第一輪德爾菲調查后,專家積極系數(問卷回收率)為100%,Cr為0.874,共識條目同意率在78.57%~100%之間,收到30條開放式專家意見。本輪所有共識條目同意率均大于70%,無需進行第二輪德爾菲調查,繼而修改步驟及操作要點,對操作要點進一步解釋形成方法指南終稿并發給專家核查確認,經專家審議最終擬定8個步驟的方法指南:① 評估DTES制定的必要性;② 組建DTES工作組;③ 遴選重要結局指標;④ 基于最佳證據構建情景示例;⑤ 設計DTES專家函詢問卷;⑥ 進行專家函詢并分析結果;⑦ 面對面專家共識會議;⑧ 推廣與后效評價。
2.2 健康結局指標DTES制定方法指南
健康結局指標DTES制定方法指南包含8個步驟(圖1),各步驟操作要點及舉例說明如下:
 圖1
DTES制定步驟
圖1
DTES制定步驟
2.2.1 步驟1:評估DTES制定的必要性
在后續步驟開始前,應先判斷是否需要開展結局指標DTES的制定工作。首先系統檢索目標主題是否已有研究報告相關結局指標DTES,若不存在此類研究,可按本指南開展DTES的制定工作。
當存在已發布的DTES時,首先應評估當前發布的DTES是否符合目標主題要求,通常需判斷其使用范圍如人群分組、臨床分型等是否與本研究目標一致。其次應評估T1、T2和T3是否均已制定,且已有DTES的結局指標是否已涵蓋本研究關注的全部結局。需注意,T1與最小臨床意義差值(minimal clinically important difference,MCID)的含義一致[10,13]。如果經評估認為已發布的DTES適用范圍符合要求,T1、T2和T3均已制定,且可使用已發布的DTES。當已有的DTES不齊全、部分結局指標還需要確定DTES或適用范圍的差異不可接受時,仍可遵循本指南開展制定工作。
2.2.2 步驟2:組建DTES工作組
DTES工作組應至少包含指導委員會、秘書組、證據評價組和共識專家組4個部分,成員的相關要求與主要職能見表1。成員可根據目標主題擬解決的問題(臨床或公共衛生問題)進行調整,一般情況下應包括相關領域專家及衛生主管部門或衛生保健服務提供者等利益相關者,理想情況下還應包含患者、高危人群與公眾[7,14,15]。其中,共識專家組成員應以具備目標主題相關研究經驗,并對衛生研究方法學有一定了解的臨床專家或公共衛生專家為主。此外,研究者還應邀請熟悉關注目標干預措施有效性相關證據的衛生研究方法學家參與共識。在條件允許的情況下建議訪談公眾或患者代表等目標受眾,邀請具備足以理解訪談內容的文化水平的利益相關者,調查其對結局指標重要性的評價及干預措施有效性的體驗。由于公眾或患者代表的觀點基于個體而非群體視角,因此并不直接參與DTES的制定,可將公眾或患者代表的觀點作為專家討論時的參考資料呈現。
在確定工作組成員后,所有成員需填寫利益沖突聲明表并交由秘書組備案,各類利益沖突的聲明應在制定過程中基于實際情況動態更新。由指導委員會負責審核成員的利益沖突聲明,存在直接或間接經濟利益沖突的成員應予以排除,若存在其他類型利益沖突如專業或知識產權沖突,應予以公開。
2.2.3 步驟3:遴選患者重要結局指標
研究者應基于專家、決策實施者與目標受眾的意見[16],采用文獻研究、定性訪談、面對面專家共識會議、德爾菲法中的一種或多種方法遴選需要制定DTES的患者重要結局指標[3,17]。
首先系統檢索并篩選關注疾病的COS[18],遴選流程如圖2所示。如果存在COS,可以使用COMET工作組提出的COS-STAD[19]進行方法學質量評價,以判斷該COS是否可作為參考依據。COS-STAD包含11個條目,各條目最終評價結果為“是”(1分)或“不是”(0分)。針對高質量且符合研究范圍的COS,提取COS的結局指標,通過專家組對重要性打分排序并形成共識以確定重要結局指標。若無高質量COS,或COS適用范圍不足以涵蓋DTES應用范圍(例如COS僅關注目標疾病的某一分型,或COS僅關注中老年人而DTES目標人群還包括青少年與成人等),則參考WHO指南制定手冊與GRADE工作組建議的結局指標遴選與重要性排序方法[16,17,20-22],基于人群、干預措施與對照措施系統檢索并篩選已發表的SR,提取多個SR所關注的結局指標以形成結局指標清單。由專家組確定是否有遺漏的相關結局并進行補充,可要求專家組成員使用9分Likert評分系統對結局指標的重要性進行打分,7~9分代表“至關重要”,4~6分代表“重要”,1~3分代表“相對次要”。基于評分情況對結局指標進行重要性排序,遴選“至關重要”與“重要”的結局指標。
 圖2
重要結局指標遴選流程
圖2
重要結局指標遴選流程
2.2.4 步驟4:基于最佳證據制作情景示例
為便于專家理解調查目的,直觀呈現擬關注結局接受干預措施后與基線風險的差異,在DTES調查表中應針對各個結局構建相應的情景示例。基于確定的研究對象、干預措施、對照措施與結局指標制定檢索策略與證據的納入與排除標準。盡管基于隨機對照試驗的SR或Meta分析(systematic review/meta-analysis,SR/MA)被視為最佳證據主要來源[23],但最佳證據需同時考慮SR/MA質量和時效性兩個因素,若存在已發表的SR/MA,可使用AMSTAR 2工具(a measurement tool to assess systematic reviews)[24,25]對其進行方法學質量評價。AMSTAR 2工具包含16個條目,關注SR/MA從選題設計、注冊、數據提取、偏倚風險評估、統計分析、結果的解釋與討論到利益沖突報告的全過程,7個條目被視為關鍵條目。各條目的評價結果為“是”(回答正確且依據充分)、“部分是”(回答正確但依據不足)和“否”(無相關評價內容或評價不當),SR/MA的整體方法學質量可被評為“高”(無或僅1個非關鍵條目存在缺陷)、“中等”(>1個非關鍵條目存在缺陷)、“低”(1個關鍵條目存在缺陷)以及“極低”(>1個關鍵條目存在缺陷)。
參考Cochrane系統評價手冊[26],當存在近兩年內發布的高質量SR/MA時,可將該SR/MA作為情景示例的證據基礎;若SR/MA為高質量但發布時間較早,應考慮更新該SR/MA;如果不存在相關SR/MA或存在低質量SR/MA,則檢索原始研究證據制作新的SR/MA。當存在多篇符合要求的SR/MA時,由指導委員會綜合考慮各研究中臨床分型、人群及地區等亞組分析的詳細程度確定最終的證據基礎。
為避免干預措施的具體名稱對專家判斷造成影響,情景示例中不報告具體的干預措施。由于結局指標DTES為效應點估計值的閾值,為避免呈現信息造成判斷干擾,不顯示該估計值的置信區間。情景示例的呈現方式參考SoF表[27],應報告結局指標、人群或患者、對照措施、證據的樣本量和研究數量、GRADE證據質量。除上述信息外,對于分類變量,呈現相對效應、常規對照的基線風險、干預組風險、干預與基線風險差;對于連續型變量,呈現常規對照的基線值、干預組效應、干預與基線值的差值。參考BMJ發表的題為“Drug treatments for COVID-19: living systematic review and network meta-analysis”的研究[28],表2與表3為示例。
2.2.5 步驟5:設計DTES專家函詢問卷
設計DTES專家函詢問卷,通過德爾菲法調查DTES。問卷由前言、填寫說明和DTES調查表及專家基本信息4個部分組成。在前言部分詳細說明研究目的、意義和調查內容。填寫說明應對DTES調查表中出現的專業術語均給予詳盡的解釋。
針對每個重要結局指標,DTES調查表根據目標人群分組或疾病臨床分型構建一個或多個情景示例,每個情景示例下包含兩個問題(框1)。若存在可用不同量表測量效應的結局指標,應針對COS指定的測量工具或SR/MA報告較為廣泛使用的量表構建情景示例;若暫無相關COS或無法確定最為常用的量表,建議考慮每個量表均構建相應情景示例。為便于專家理解問題,貼合決策實際,明確要求專家基于群體效應視角對干預組絕對風險或效應做出判斷。
2.2.6 步驟6:進行專家函詢并分析結果
考慮到DTES專家函詢問卷的專業性較強,為使專家能夠充分理解調查內容,可在問卷發放前召開會議或制作教學視頻對專家進行培訓。
預先針對專家意見的集中程度與協調程度設定達成共識的標準,未達成共識的DTES應在反饋分析結果后再次共識。核對收集到的資料,進行雙人雙錄。需注意問題2所得各組數據為干預組效應閾值,而研究目的為制定重要結局指標干預與基線差值DTES。因此,在計算DTES前應將收集數據轉化為干預與基線差值的閾值,即將基線風險或基線值減去專家所填寫較小、中等或較大改變的數值。對轉換后各組數值進行正態性檢驗,服從正態分布采用均數和標準差描述,否則采用中位數和四分位間距描述,所得均數或中位數即為各結局指標的DTES。
2.2.7 步驟7:面對面專家共識會議
當專家函詢的分析結果存在未達成共識的結局指標時,向參與函詢專家發出會議邀請,在會議中介紹會議議題并分別呈現達成共識及未達成共識的調查結果。專家在會議中針對未達成共識的DTES展開討論,通過投票等方式確定該結局指標最終的DTES。無論是否召開面對面專家共識,所有結局指標DTES都應由專家組最終確認通過。
2.2.8 步驟8:推廣應用與后效評價
DTES可通過同行評審期刊、媒體等途徑傳播,可同時發布教學視頻或培訓手冊等DTES的應用輔助材料。其主要應用方式包括輔助指南、SR或衛生技術評估等研究背景下的數據分析結果解讀,評價效應估計值的不精確性,以及作為推薦意見更新的先驗閾值。
監測評估應用情況,并建立合理的反饋機制。根據應用反饋與相關研究證據的動態監測情況(例如定期檢查DTES研究發表后的被引情況)判斷是否更新DTES,主要包括完善已制定的DTES和新增某個重要結局指標DTES。
3 討論
本研究在方法指南構建初期系統檢索DTES制定相關研究,在對此進行歸納總結的基礎上撰寫初稿,同時充分參考權威機構制訂且經過多個研究驗證的相關方法工具與流程,經方法學家多輪討論一致通過初稿并進行試點應用;為優化完善方法學框架,根據試點應用多學科DTES工作組反饋、資深衛生研究方法學家訪談結果及一輪德爾菲函詢收集的多學科專家組正式意見最終擬定方法指南終稿,構建了首個系統可操作的核心結局指標DTES制定方法指南。
該DTES制定方法指南的優點在于:① 各步驟及操作要點清晰明確,可操作性強,解釋舉例部分列出具體方法流程的參考來源,便于使用者理解;② 明確的DTES可評估干預措施利弊、評價證據質量,從而決定推薦意見方向與強度、判斷推薦意見是否更新。基于國際GRADE標準[29],決定推薦強度的關鍵因素包括干預措施利弊平衡、證據質量、價值觀和偏好以及成本大小。當確定結局指標的DTES后,可明確干預措施的效應量大小與利弊方向,評價證據質量的不精確性,若干預利弊間差距越大、證據質量越高,越適合作出強推薦,反之適合作出弱推薦。同樣,當新證據出現時,可通過DTES評估是否更新推薦意見,確保指南的時效性和準確性。
鑒于時間與成本的限制,本指南尚存在以下不足:① 試點應用的范圍不夠廣泛,未來還應在SR、衛生技術評估和指南等研究背景下應用,進一步驗證方法指南;② DTES制定領域研究的數量較少,潛在的定量方法均未得到研究的應用與驗證[30,31],如考慮單一獲益結局與單一危害結局的方法包括計算增量凈健康效益(incremental net health benefit,INHB)、凈臨床效益(net clinical benefit,NCB)和需治療人數(number needed to treat,NNT)等,同時考慮多個獲益或危害結局的方法主要有多準則決策分析(multicriteria decision analysis,MCDA),限制了DTES制定方法的多樣性;③ 臨床決策注重患者的偏好與價值觀,主要通過調查或系統檢索目標受眾的偏好與價值觀研究收集觀點,但將調查或SR結果融入決策形成過程的具體方法步驟少有報告[3,32],考慮到DTES專家函詢問卷的專業性較強,邀請目標受眾直接參與DTES制定難度較大,方法指南提出通過訪談或問卷調查的方式收集受眾對干預措施及結局指標效應量大小的觀點,未來研究還需對科學系統方法展開進一步探索。
隨著指南、SR和衛生技術評估等研究對制定并應用DTES以輔助解釋數據分析結果、評價證據質量、制訂推薦意見或形成結論的需求增加,今后有必要采取具體措施以推動框架的推廣、應用與完善。其次,有必要針對DTES的有效性評價展開研究,以降低決策帶來的風險,提高決策的可信度與穩定性。
4 小結
健康結局指標DTES制定方法指南可為臨床決策的利益相關者衡量干預措施效應量大小提供可靠方法,促進研究者合理解讀多種干預措施產生的健康影響、判斷影響大小并評估證據精確性,對決策過程的科學化、規范化與透明化有著積極作用。
專家組成員(按姓氏首字母排序)
陳耀龍(蘭州大學基礎醫學院循證醫學中心)、鄧宏勇(上海中醫藥大學中醫健康協同創新中心)、杜亮(四川大學華西醫院中國循證醫學中心)、靳英輝(武漢大學中南醫院循證與轉化醫學中心)、孔德昭(遼寧中醫藥大學附屬醫院)、黎國威(暨南大學附屬廣東省第二人民醫院)、李江(中國醫學科學院腫瘤醫院)、李玲(四川大學華西醫院中國循證醫學中心)、廖星(中國中醫科學院臨床與基礎醫學研究所)、劉杰(中國中醫科學院廣安門醫院)、商洪才(北京中醫藥大學東直門醫院)、史楠楠(中國中醫科學院中醫臨床基礎醫學研究所)、田金徽(蘭州大學基礎醫學院循證醫學中心)、王曉輝(蘭州大學公共衛生學院)、吳大嶸(廣州中醫藥大學第二附屬醫院)、楊豐文(天津中醫藥大學循證醫學中心)、楊克虎(蘭州大學基礎醫學院循證醫學中心)、于長禾(北京中醫藥大學東直門醫院)、張家興(貴州省人民醫院藥劑科)、趙晨(中國中醫科學院中醫臨床基礎醫學研究所)