臨床價值評價是藥品臨床綜合評價的核心,是支持藥品供應保障決策的重要環節。真實世界數據能反映實際診療過程,是評估藥品實際臨床需求、評價藥品有效性和安全性證據的重要數據來源。本技術規范明確了真實世界數據用于藥品臨床價值評價的適用范圍,以及開展價值評價研究的關鍵考量:包括適用于真實世界數據研究的藥品臨床價值評價維度,和如何有效利用真實世界數據進行評價,并針對研究設計和統計分析提出了基于真實世界數據的藥品臨床價值評價的研究實施要點,以幫助研究者正確認識和規范使用真實世界研究開展藥品臨床價值評價。
引用本文: 徐嘉悅, 何俏, 劉艷梅, 劉佳利, 姚明宏, 趙楊, 黎國威, 黃麗紅, 舒嘯塵, 李玲, 王雯, 孫鑫. 真實世界數據用于藥品臨床價值評價的關鍵技術考量. 中國循證醫學雜志, 2024, 24(5): 523-528. doi: 10.7507/1672-2531.202401084 復制
版權信息: ?四川大學華西醫院華西期刊社《中國循證醫學雜志》版權所有,未經授權不得轉載、改編
臨床價值評價是藥品臨床綜合評價的核心,是支持藥品供應保障決策的重要環節。但我國藥品臨床價值評價面臨巨大挑戰。目前多數藥品主要依賴于傳統隨機對照試驗(randomized clinical trial,RCT)獲批上市,存在研究人群高度選擇、方案設計相對固定、樣本量小以及隨訪時間短等局限,難以獲得臨床實際用藥效果以及長期、罕見安全性證據。其次,對于孤兒藥或某些臨床急需創新藥,通常是基于國外人群的單臂試驗以快速審批途徑上市,其有效性和安全性證據尚不充分[1]。
真實世界數據(real world data,RWD)是指來自真實醫療環境,反映實際診療中患者健康狀況和醫療服務過程的數據,具有涵蓋人群廣泛、樣本量大、隨訪時間長等優勢。隨著藥品上市后不斷累積的用藥信息和結局信息,充分利用已有國家、區域等藥品臨床應用相關的RWD資源,開展RWD研究,可評估藥品臨床需求并提供真實臨床環境下藥品有效性和安全性證據,從多個維度支持醫保臨床價值評價[2-4]。
為進一步規范和合理引導RWD在藥品臨床價值評價中的應用,制定本技術規范。本技術規范通過明確RWD在支持藥品臨床價值評價的適用范圍、總體考慮,并建立研究設計和統計分析關鍵技術、決策原則,以期促進RWD合理、規范用于醫保藥品臨床價值評價。
1 RWD用于藥品臨床價值評價的適用范圍
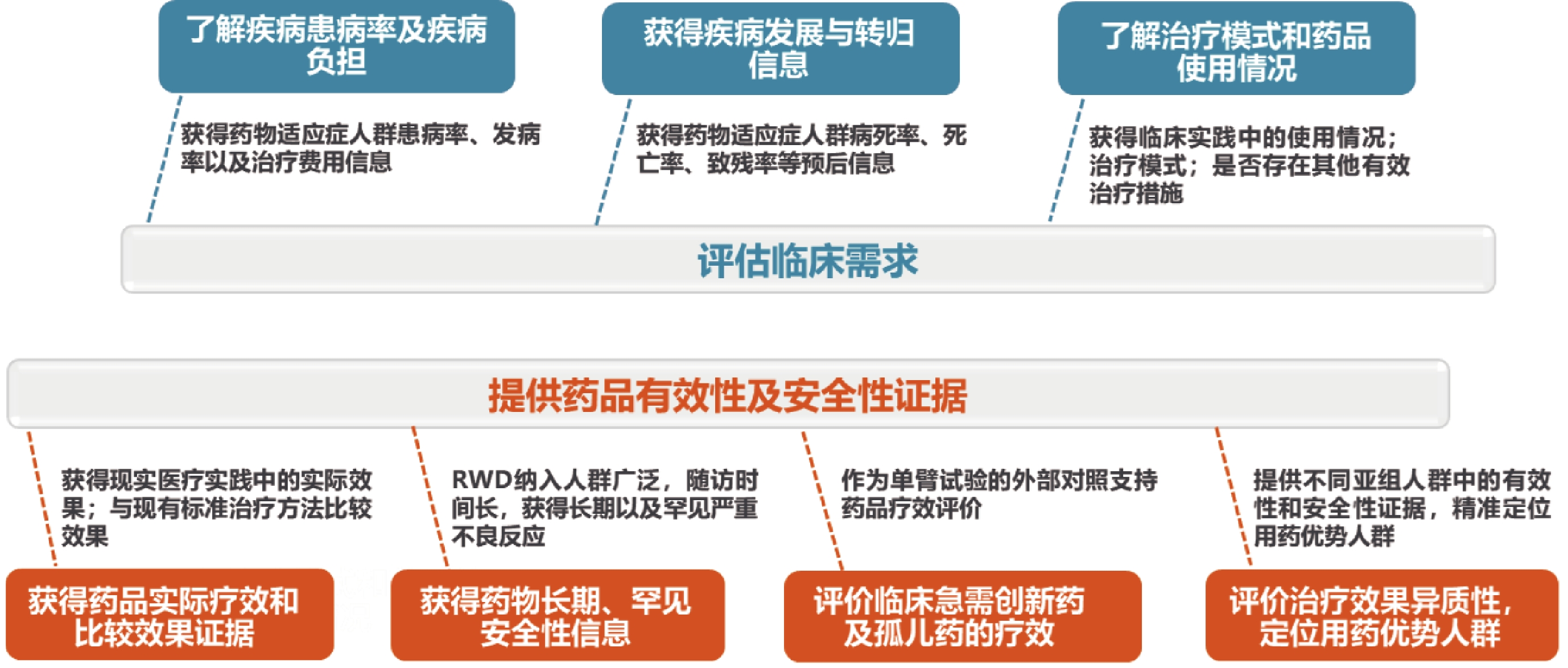
RWD在臨床價值評價中的適用范圍主要包括兩個方面,即臨床需求評估和療效評價,如圖1所示。
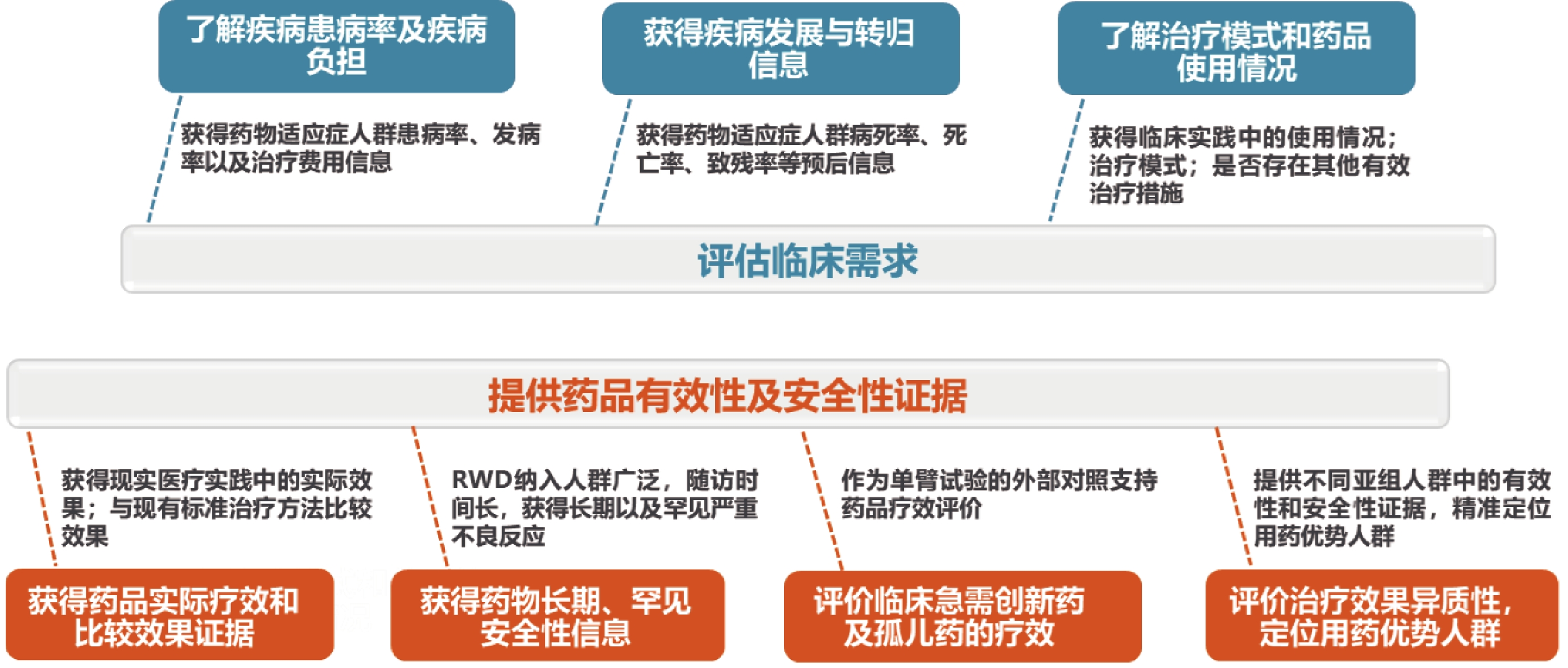 圖1
真實世界數據(RWD)在藥品臨床價值評價中的適用范圍
圖1
真實世界數據(RWD)在藥品臨床價值評價中的適用范圍
1.1 評估臨床需求
1.1.1 疾病患病率和疾病負擔
可獲得特定藥品適應癥人群發病率、患病率等數據,以及患者治療費用信息,評估疾病對社會和家庭等帶來的疾病負擔。
1.1.2 疾病發展與轉歸
獲得疾病病死率、死亡率、致殘率等臨床轉歸和疾病嚴重程度信息,評估疾病預后,結合疾病發病率綜合評估藥品臨床價值。一般來說,疾病患病率越高、預后越差,更應關注和評估其對應適應癥藥品的臨床價值;某些疾病患病率雖然不高,但嚴重威脅生命健康,致死致殘率高,該適應癥治療藥品的臨床價值仍應特別關注[5]。
1.1.3 用藥模式
基于RWD的藥品臨床診療使用情況,分析適應癥人群在臨床實踐中的治療模式,評估特定藥品是否存在其他有效的替代治療措施、是否存在尚未被滿足的臨床需求。
1.2 藥品有效性及安全性評價
1.2.1 藥品實際療效和比較效果
真實世界研究,特別是采用實效性臨床試驗設計的研究,可獲得臨床實踐中的藥品實際療效以及與現有標準治療方法的比較療效,以評價該藥品的臨床治療優勢。
1.2.2 藥品長期、罕見安全性
安全性是影響藥品臨床價值評估的重要因素。上市前藥品臨床研究由于病例數較少、隨訪時間較短等原因,難以發現藥品長期、罕見不良反應;RWD納入人群廣泛、隨訪時間長,是藥品長期以及罕見嚴重不良反應的重要證據來源。
1.2.3 臨床急需創新藥及孤兒藥的療效
孤兒藥以及缺乏有效治療的重大疾病的臨床急需創新藥,通常是基于單臂臨床試驗結果獲批上市。RWD一方面可作為外部對照支持藥品療效評價;另一方面,藥品上市后,在實際診療中的廣泛應用,積累了豐富的RWD,包括用藥及對照信息,可為進一步評價臨床急需創新藥及孤兒藥的療效提供數據支持。
1.2.4 療效異質性及用藥優勢人群
藥品上市后,應用人群更為廣泛,通過分析不同人群的治療效應異質性,可提供藥品在不同亞組人群中的有效性和安全性證據,精準定位用藥優勢人群。
2 RWD用于藥品臨床價值評價的關鍵考量
RWD用于藥品臨床價值評價主要涵蓋兩個維度的考慮:首先,藥品價值評價的研究問題是否需要RWD支持;其次,如何使用這些RWD。
2.1 臨床價值評價維度的考量
第一個考量主要對于臨床價值評價維度的考慮。總體而言,在臨床需求評估方面,RWD可提供患病率/發病率、疾病轉歸、疾病負擔、用藥模式等信息,為評估藥品需求、醫保基金風險和開展經濟學評價提供重要參數;在療效評價方面,是否需要RWD,不同藥品的考慮不同[6]:① 通常,大部分藥品是基于傳統RCT獲批上市,已有較明確的有效性證據。對于此類藥品,RWD可提供藥品與同類藥品的比較有效性證據;同時可提供藥品長期、罕見不良反應證據。② 對于孤兒藥或臨床急需創新藥械,多基于單臂臨床試驗結果通過快速通道上市,缺乏基于中國人群的臨床試驗證據,有效性證據尚不充分[7]。在上市早期,RWD可為這些產品有效性評價提供外部對照數據;在長期上市應用后,大量RWD的積累可支持進一步的藥品療效評價。
2.2 RWD來源和研究設計的考量
第二個考量是如何科學有效地利用RWD開展藥品臨床價值評價研究,主要包括對數據來源和研究設計的選擇。
2.2.1 數據來源
在開始進行藥品臨床價值評價時,需根據不同的臨床價值評價問題,選擇合適的數據來源。RWD來源主要分為常規收集醫療數據(routinely collected health data,RCD),包括醫院電子病歷數據(electronic medical record,EMR)、醫保數據、居民電子健康檔案、區域健康醫療數據和可穿戴設備數據等,以及基于一定研究目的主動收集的醫療數據[8]。對于評估臨床需求,獲取疾病頻率、疾病轉歸、疾病負擔、用藥模式等信息,通常可考慮采用RCD;對于評估藥品安全性,RCD覆蓋大量用藥人群,隨訪時間長,在評價長期特別是罕見不良反應方面有一定優勢[9];對于評價藥品的有效性,RCD質量可能無法完全滿足研究需求,通常至少部分數據需采用主動收集的方式,尤其是采用實效性隨機對照試驗評價藥品的實際療效或比較效果時,通常需要事先考慮哪些數據可從醫院電子病歷系統收集、哪些應通過前瞻性訪視主動收集[10]。
2.2.2 研究設計
在確定數據來源后,需根據具體的場景,選擇不同的研究設計類型。主要的研究設計類型包括實效性臨床試驗(pragmatic clinical trial,PCT)、觀察性研究以及單臂外對照設計。設計類型的選擇需要考慮多方面的因素,包括:① 擬解決的問題是安全性問題或有效性問題;② 結局事件發生率和預期觀察時長;③ 是否為創新藥、孤兒藥等特殊藥品等。
一般來說,對于評價藥品有效性,首選PCT,尤其是實效性隨機對照試驗(pragmatic randomized controlled trial,pRCT)。pRCT是在真實或接近真實醫療環境下,采用隨機、對照的設計比較臨床實踐中不同干預措施的治療結果,可以更好地控制混雜,因此有效性評價效能更優[11]。
在某些特殊情景下,例如孤兒藥和創新藥,患者樣本量小,且出于倫理考慮,開展pRCT可行性差,此時可根據實際研究情況,考慮使用觀察性研究或單臂外對照設計。單臂外對照是指將所有研究對象均納入試驗組,并從其他研究或數據源中找一組特征相似的研究對象作為對照組,即為外部對照。RWD可作為單臂研究的外部對照數據,按照與試驗/暴露組重疊時間可分為歷史外對照、同期外對照和雙向外對照,優先推薦同期外對照[12]。
對于上市后藥品安全性的監測評價,特別是針對聯合用藥相關,或長期、罕見的不良反應,以及藥物療效異質性評價和優勢人群定位,由于需要較長觀察期和/或較大的樣本人群,因此觀察性研究更為常用。但觀察性研究由于缺乏隨機化,其藥品療效評價受到多種混雜、偏倚因素的干擾,影響研究結果的可信度。因此在進行觀察性研究設計和分析的過程中,核心是控制觀察性研究中偏倚和混雜[13]。
3 RWD用于臨床價值評價研究的設計和分析要點
嚴謹科學的研究設計和統計分析是RWD產生的證據能否支持藥品臨床價值評價的關鍵。在基于RWD的臨床價值評價實施中,研究設計及分析需要重點考慮以下方面。
3.1 研究設計要點
在數據源質量可靠的前提下,總體研究設計的合理性決定了基于RWD的藥品臨床價值證據質量。研究者應首先根據研究問題,選擇試驗性研究設計(干預性研究設計)、觀察性研究設計(非干預性研究設計),或設置單臂外對照。外對照是一種特殊的設計類型,其研究組可以是干預性也可以是非干預性[14]。在確定研究設計后,進一步考慮具體研究設計中的關鍵要素設置。
3.1.1 試驗性研究設計
相對于理想條件下嚴格受控的RCT,pRCT設計主要評估的關鍵要素包括:研究對象、干預措施、對照措施、結局指標、隨訪等(表1)[15,16]。
① 研究對象:研究對象是藥品的臨床實際應用人群,通常為藥品說明書中列出的適應癥患者。納入標準通常較寬泛,可能包含研究疾病的不同階段、分期、類型等,也可能涵蓋不同年齡層、各種生理病理狀態等。
② 干預措施:干預措施應與常規臨床實踐保持較好一致,可根據患者實際情況靈活調整用藥劑量、療程以及合并用藥情況,需對研究中允許的合并用藥等做出必要的限定。
③ 對照措施:對照的選擇要考慮現實臨床實際情況,選用常規治療、標準治療或公認有效的治療措施作為對照,可考慮疊加設計,一般不推薦安慰劑和空白對照。同時對照選擇需根據具體決策需求,例如:若研究目的是將新的藥品納入醫保目錄,則優先選擇醫保目錄中已有的同類常規治療藥品作為對照。
④ 結局指標:結局指標通常選擇對患者具有重要臨床意義的指標,強調以病人為導向的臨床獲益終點結局,如疾病轉歸、功能變化、健康相關生命質量等。
⑤ 隨訪:隨訪時間應根據研究目的及擬評價的結局指標來確定,如評價藥品的遠期臨床價值,隨訪時間應相對較長,且應多時點測量。研究方案中應明確指出試驗中隨訪次數和周期安排,隨訪頻率通常與常規臨床隨訪一致。
3.1.2 觀察性研究設計
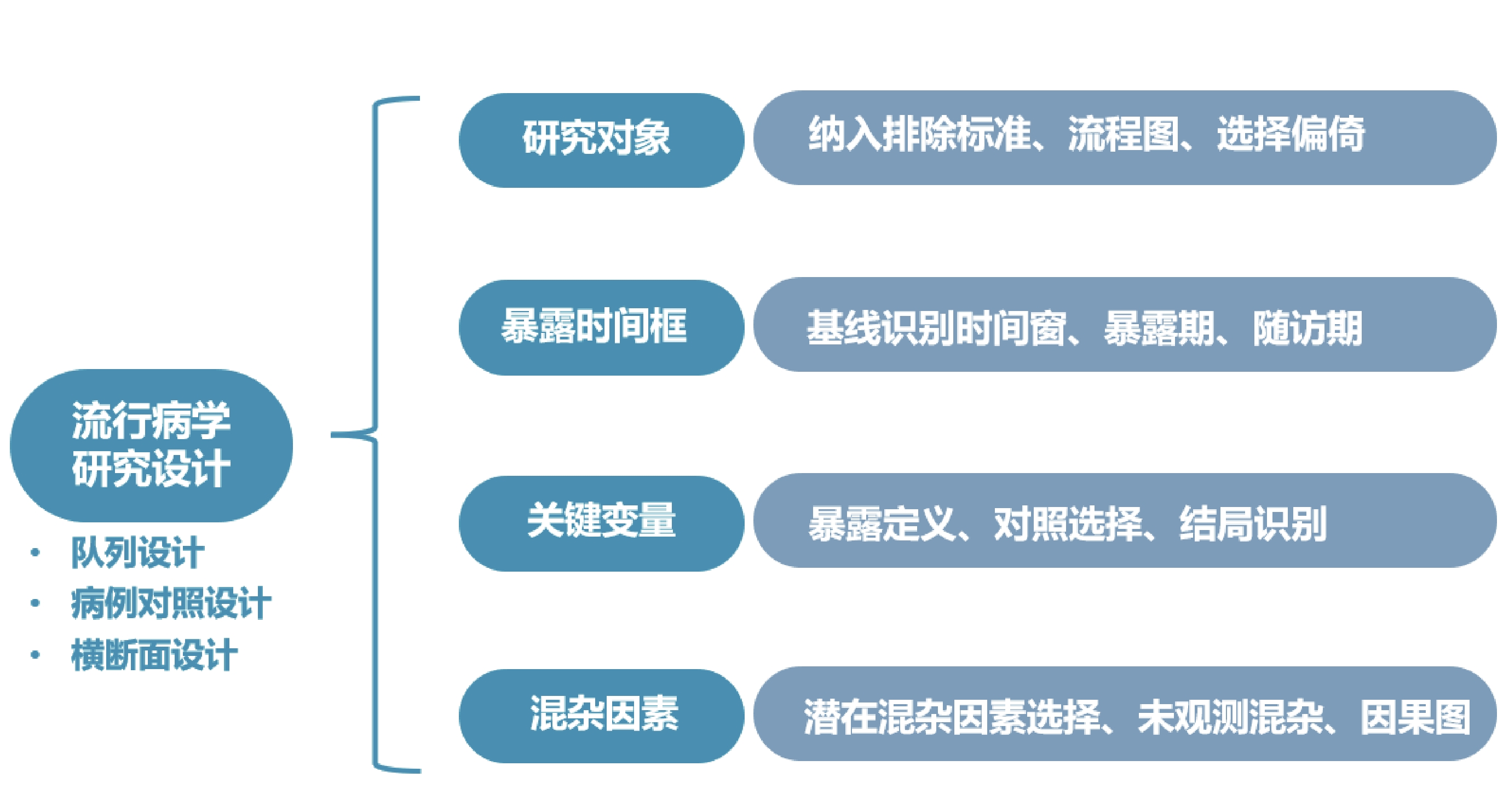
觀察性研究設計缺乏隨機化過程,受到真實世界診療環境的高維因素影響,應特別關注藥品臨床價值評價的因果推斷強度,避免虛假關聯。有研究探索將隨機試驗的設計原則應用于觀察性研究,構建基于觀察性數據的目標仿真試驗(target trial emulation,TTE),以提高觀察性研究的因果推薦強度[17]。觀察性研究設計應至少考慮流行病學設計、研究人群的選擇、暴露和對照的選擇、結局的設定及測量、隨訪時間/時間窗的設定和混雜因素選擇等[18,19]。如圖2。
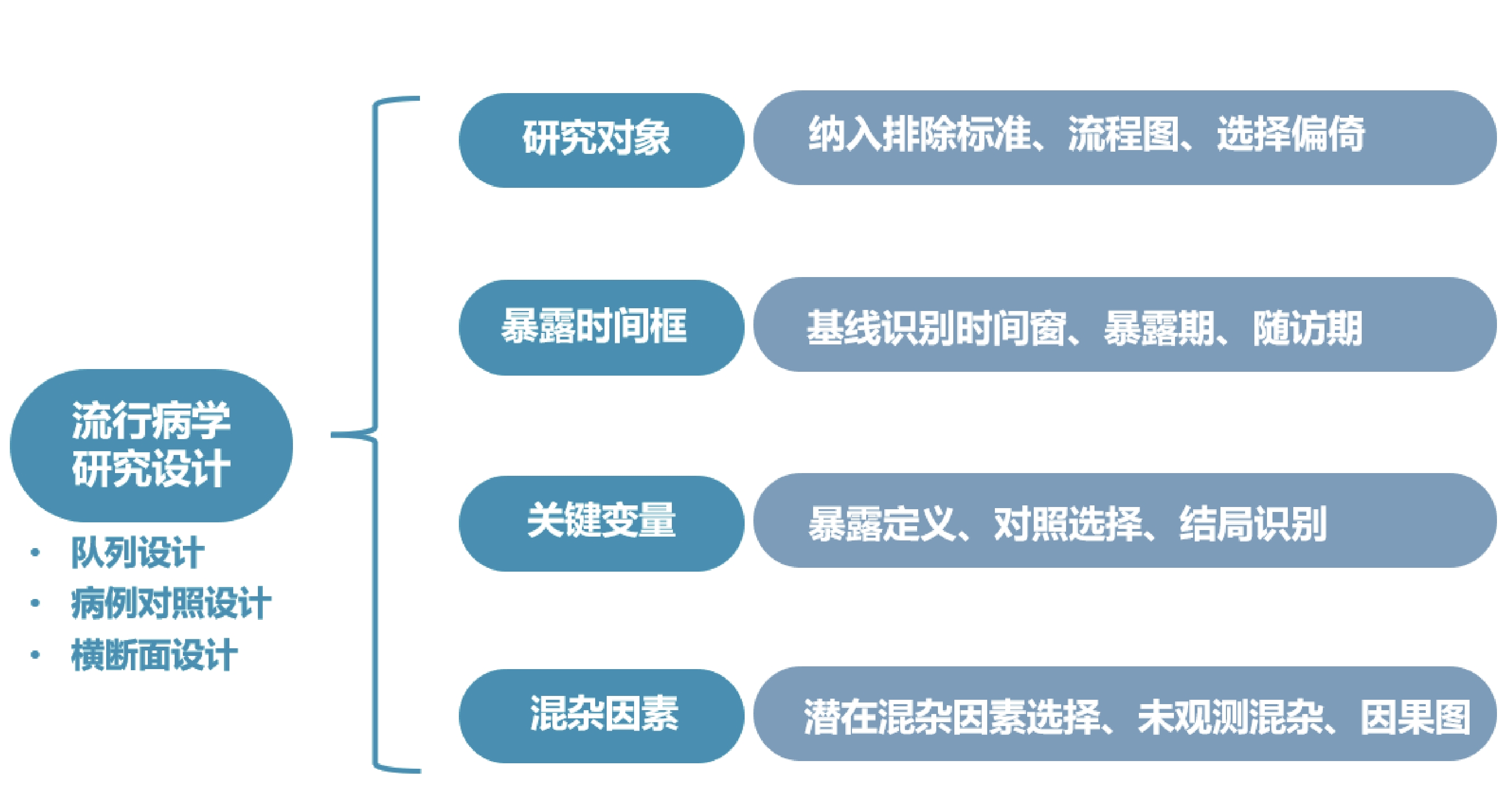 圖2
真實世界藥品臨床價值評價的觀察性研究設計要點
圖2
真實世界藥品臨床價值評價的觀察性研究設計要點
① 流行病學設計類型:常用于藥品療效評價的觀察性研究設計主要包括隊列研究、病例-對照研究、以及相關衍生設計類型(如巢式病例-對照研究、病例隊列研究、病例交叉研究等研究設計)。不同的研究設計適用場景、優勢和局限不同,研究設計需適配研究問題和數據情況。
② 研究對象確定:應根據研究問題,制定清晰可行的納入排除標準并說明理由,避免選擇性偏倚。推薦使用流程圖或其他方式詳細說明研究對象的納入排除情況。
③ 暴露/對照的選擇:明確定義暴露并選擇合適的對照,是觀察性研究藥品治療效應評價的關鍵環節。在研究條件可行的情況下,可考慮采用首次用藥設計(new user design),即選擇首次使用目標藥物的病例納入研究,并設置陽性對照(active comparison)[20],以更好地控制基線混雜,減少幸存者偏倚和適應癥偏倚[21]。
④ 隨訪時間定義:基于RCD的觀察性研究,研究者通常需要在數據庫中進行回溯,以確定藥品暴露前的患者基線時間,并追溯暴露后的隨訪期結束時間。在定義暴露時間框時應結合藥品藥代動力學特點,充分考慮基線協變量識別時間窗、暴露期(研究對象藥品暴露到引起暴露效應的時間跨度)、誘導期(出現暴露效應至疾病發生的時間跨度)、滯后期(結局事件發生到出現可檢測癥狀或體征的時間間隔)、隨訪期(研究對象因暴露而存在結局事件風險的時間范圍)等關鍵時間點,避免出現因時序誤判引起的因果倒置以及不死時間偏倚等時間相關混雜[18,22]。
⑤ 結局變量的定義和識別:結局指標的定義首先應考慮臨床價值維度,主要包括有效性、安全性、經濟性指標;其次評估數據源中指標的可及性、準確性和完整性,并對變量的準確性進行驗證。應盡可能選擇具有客觀評價標準的指標,盡量避免變量錯分。
⑥ 混雜因素的選擇:觀察性研究的藥品療效評價時,混雜因素的合理選擇是確定藥品暴露和結局間的因果關系的關鍵步驟,應評估所納入協變量是否符合混雜因素標準、納入混雜因素是否全面、測量是否準確等。
3.1.3 外對照設置
在藥品臨床價值評價研究中,RWD可以作為單臂研究外部對照的重要數據來源。基于RWD的外對照設置原則主要包括[23,24]:① 對照藥品建議選擇質優價廉的陽性對照藥品;② 外部對照人群納入排除標準應與試驗/暴露組一致;③ 應明確外部對照組的干預方式、劑量、時長;④ 保證外部對照組研究結局的定義、隨訪時間、測量方法與試驗/暴露組一致,避免信息偏倚;⑤ 作為外部對照的RWD需具備盡可能詳細、量化的協變量信息,應明確可能對對照藥品或結局產生重要影響的因素及其測量方法;⑥ 外對照人群的選擇不應發生明顯的時間偏倚。
3.2 統計分析要點
基于RWD的藥品臨床價值評價,特別是療效評價,往往需制定明確的統計分析計劃,并考慮研究的樣本量是否充分,控制混雜偏倚的方法是否恰當,缺失數據處理及潛在偏倚分析情況等。
3.2.1 統計分析計劃
首先需要事先制定并詳細報告統計分析計劃,統計分析計劃應至少包含研究方案概要、分析原則與策略、樣本量估計、缺失數據處理、主要指標和次要指標的定義與分析方法、亞組或分層分析、敏感性分析等;其次實際分析流程和方法選擇應嚴格遵循統計分析計劃,無論是試驗性研究還是觀察性研究,都應避免以結果為導向的事后分析。
3.2.2 樣本量計算
選擇恰當方法計算研究的樣本量,報告樣本量的計算方法、參數設定和來源,并考慮失訪率和最終納入研究的樣本數量是否達到預設要求。在基于已有數據庫的真實世界研究中,研究可納入多少例樣本量往往取決于數據庫中有多少對象滿足納入排除標準,同時也應考慮可能獲得的陽性事件數,特別是針對長期、罕見的安全性結局。研究者應在研究結束時評估研究的統計效能,特別是在出現陰性結果的情況下。
3.2.3 混雜的控制
在pRCT中,應合理選擇隨機化方法,嚴格執行并全程質控;其次應考慮是否引入隨機后混雜(如合并用藥、不依從等)及相應的處理方法是否合理。
在觀察性研究中,混雜因素可能存在高維、時序的復雜特點,選擇控制混雜因素的統計方法時應首先評估:① 潛在的混雜因素間是否存在共線、交互等作用關系;② 是否存在隨時間變化的時間依賴性混雜;③ 是否存在未觀測混雜,及其對主分析結果的影響。基于不同混雜因素的情況,選擇恰當的統計分析方法。
3.2.4 缺失數據處理
對于缺失數據處理,主要涉及以下步驟[25,26];① 評估缺失情況,包括存在缺失的變量、缺失比例以及缺失機制;② 根據變量的缺失機制(完全隨機、隨機、非隨機)選擇合適的填補方式;③ 評估缺失影響,例如采用不同的缺失處理方法進行敏感性分析,評估結果可靠性。
3.2.5 潛在偏倚分析
研究者應全面分析整個研究過程中可能引入的潛在偏倚,并通過多種敏感性分析或定量偏倚等方式探查偏倚對結果的影響。當敏感性分析結果不穩健時,需合理解釋原因。
綜上所述,利用RWD能較好提供在實際臨床環境下藥品使用人群的臨床需求、有效性以及安全性證據,是支持藥品臨床價值多個維度評價的重要數據來源。然而,采用RWD支持藥品臨床價值評價仍處于探索階段。本技術規范探討了RWD用于藥品臨床價值評價的適用范圍和關鍵考慮,RWD研究的設計和分析方法原則,以期促進RWD合理、規范用于藥品多維臨床價值評價。
致謝 本研究得到醫保部門、國內外學術專家的大力支持,特此致謝(按姓氏筆畫排序):丁錦希、王麗、毛振賓、朱永峰、劉夢娜、孫強、李順平、楊莉、吳久鴻、應亞珍、張弛、陳昊、胡明、袁妮、賈寧、董恒進、蔣亞文、蔣杰、曾渝、謝鋒、瞿佳
臨床價值評價是藥品臨床綜合評價的核心,是支持藥品供應保障決策的重要環節。但我國藥品臨床價值評價面臨巨大挑戰。目前多數藥品主要依賴于傳統隨機對照試驗(randomized clinical trial,RCT)獲批上市,存在研究人群高度選擇、方案設計相對固定、樣本量小以及隨訪時間短等局限,難以獲得臨床實際用藥效果以及長期、罕見安全性證據。其次,對于孤兒藥或某些臨床急需創新藥,通常是基于國外人群的單臂試驗以快速審批途徑上市,其有效性和安全性證據尚不充分[1]。
真實世界數據(real world data,RWD)是指來自真實醫療環境,反映實際診療中患者健康狀況和醫療服務過程的數據,具有涵蓋人群廣泛、樣本量大、隨訪時間長等優勢。隨著藥品上市后不斷累積的用藥信息和結局信息,充分利用已有國家、區域等藥品臨床應用相關的RWD資源,開展RWD研究,可評估藥品臨床需求并提供真實臨床環境下藥品有效性和安全性證據,從多個維度支持醫保臨床價值評價[2-4]。
為進一步規范和合理引導RWD在藥品臨床價值評價中的應用,制定本技術規范。本技術規范通過明確RWD在支持藥品臨床價值評價的適用范圍、總體考慮,并建立研究設計和統計分析關鍵技術、決策原則,以期促進RWD合理、規范用于醫保藥品臨床價值評價。
1 RWD用于藥品臨床價值評價的適用范圍
RWD在臨床價值評價中的適用范圍主要包括兩個方面,即臨床需求評估和療效評價,如圖1所示。
 圖1
真實世界數據(RWD)在藥品臨床價值評價中的適用范圍
圖1
真實世界數據(RWD)在藥品臨床價值評價中的適用范圍
1.1 評估臨床需求
1.1.1 疾病患病率和疾病負擔
可獲得特定藥品適應癥人群發病率、患病率等數據,以及患者治療費用信息,評估疾病對社會和家庭等帶來的疾病負擔。
1.1.2 疾病發展與轉歸
獲得疾病病死率、死亡率、致殘率等臨床轉歸和疾病嚴重程度信息,評估疾病預后,結合疾病發病率綜合評估藥品臨床價值。一般來說,疾病患病率越高、預后越差,更應關注和評估其對應適應癥藥品的臨床價值;某些疾病患病率雖然不高,但嚴重威脅生命健康,致死致殘率高,該適應癥治療藥品的臨床價值仍應特別關注[5]。
1.1.3 用藥模式
基于RWD的藥品臨床診療使用情況,分析適應癥人群在臨床實踐中的治療模式,評估特定藥品是否存在其他有效的替代治療措施、是否存在尚未被滿足的臨床需求。
1.2 藥品有效性及安全性評價
1.2.1 藥品實際療效和比較效果
真實世界研究,特別是采用實效性臨床試驗設計的研究,可獲得臨床實踐中的藥品實際療效以及與現有標準治療方法的比較療效,以評價該藥品的臨床治療優勢。
1.2.2 藥品長期、罕見安全性
安全性是影響藥品臨床價值評估的重要因素。上市前藥品臨床研究由于病例數較少、隨訪時間較短等原因,難以發現藥品長期、罕見不良反應;RWD納入人群廣泛、隨訪時間長,是藥品長期以及罕見嚴重不良反應的重要證據來源。
1.2.3 臨床急需創新藥及孤兒藥的療效
孤兒藥以及缺乏有效治療的重大疾病的臨床急需創新藥,通常是基于單臂臨床試驗結果獲批上市。RWD一方面可作為外部對照支持藥品療效評價;另一方面,藥品上市后,在實際診療中的廣泛應用,積累了豐富的RWD,包括用藥及對照信息,可為進一步評價臨床急需創新藥及孤兒藥的療效提供數據支持。
1.2.4 療效異質性及用藥優勢人群
藥品上市后,應用人群更為廣泛,通過分析不同人群的治療效應異質性,可提供藥品在不同亞組人群中的有效性和安全性證據,精準定位用藥優勢人群。
2 RWD用于藥品臨床價值評價的關鍵考量
RWD用于藥品臨床價值評價主要涵蓋兩個維度的考慮:首先,藥品價值評價的研究問題是否需要RWD支持;其次,如何使用這些RWD。
2.1 臨床價值評價維度的考量
第一個考量主要對于臨床價值評價維度的考慮。總體而言,在臨床需求評估方面,RWD可提供患病率/發病率、疾病轉歸、疾病負擔、用藥模式等信息,為評估藥品需求、醫保基金風險和開展經濟學評價提供重要參數;在療效評價方面,是否需要RWD,不同藥品的考慮不同[6]:① 通常,大部分藥品是基于傳統RCT獲批上市,已有較明確的有效性證據。對于此類藥品,RWD可提供藥品與同類藥品的比較有效性證據;同時可提供藥品長期、罕見不良反應證據。② 對于孤兒藥或臨床急需創新藥械,多基于單臂臨床試驗結果通過快速通道上市,缺乏基于中國人群的臨床試驗證據,有效性證據尚不充分[7]。在上市早期,RWD可為這些產品有效性評價提供外部對照數據;在長期上市應用后,大量RWD的積累可支持進一步的藥品療效評價。
2.2 RWD來源和研究設計的考量
第二個考量是如何科學有效地利用RWD開展藥品臨床價值評價研究,主要包括對數據來源和研究設計的選擇。
2.2.1 數據來源
在開始進行藥品臨床價值評價時,需根據不同的臨床價值評價問題,選擇合適的數據來源。RWD來源主要分為常規收集醫療數據(routinely collected health data,RCD),包括醫院電子病歷數據(electronic medical record,EMR)、醫保數據、居民電子健康檔案、區域健康醫療數據和可穿戴設備數據等,以及基于一定研究目的主動收集的醫療數據[8]。對于評估臨床需求,獲取疾病頻率、疾病轉歸、疾病負擔、用藥模式等信息,通常可考慮采用RCD;對于評估藥品安全性,RCD覆蓋大量用藥人群,隨訪時間長,在評價長期特別是罕見不良反應方面有一定優勢[9];對于評價藥品的有效性,RCD質量可能無法完全滿足研究需求,通常至少部分數據需采用主動收集的方式,尤其是采用實效性隨機對照試驗評價藥品的實際療效或比較效果時,通常需要事先考慮哪些數據可從醫院電子病歷系統收集、哪些應通過前瞻性訪視主動收集[10]。
2.2.2 研究設計
在確定數據來源后,需根據具體的場景,選擇不同的研究設計類型。主要的研究設計類型包括實效性臨床試驗(pragmatic clinical trial,PCT)、觀察性研究以及單臂外對照設計。設計類型的選擇需要考慮多方面的因素,包括:① 擬解決的問題是安全性問題或有效性問題;② 結局事件發生率和預期觀察時長;③ 是否為創新藥、孤兒藥等特殊藥品等。
一般來說,對于評價藥品有效性,首選PCT,尤其是實效性隨機對照試驗(pragmatic randomized controlled trial,pRCT)。pRCT是在真實或接近真實醫療環境下,采用隨機、對照的設計比較臨床實踐中不同干預措施的治療結果,可以更好地控制混雜,因此有效性評價效能更優[11]。
在某些特殊情景下,例如孤兒藥和創新藥,患者樣本量小,且出于倫理考慮,開展pRCT可行性差,此時可根據實際研究情況,考慮使用觀察性研究或單臂外對照設計。單臂外對照是指將所有研究對象均納入試驗組,并從其他研究或數據源中找一組特征相似的研究對象作為對照組,即為外部對照。RWD可作為單臂研究的外部對照數據,按照與試驗/暴露組重疊時間可分為歷史外對照、同期外對照和雙向外對照,優先推薦同期外對照[12]。
對于上市后藥品安全性的監測評價,特別是針對聯合用藥相關,或長期、罕見的不良反應,以及藥物療效異質性評價和優勢人群定位,由于需要較長觀察期和/或較大的樣本人群,因此觀察性研究更為常用。但觀察性研究由于缺乏隨機化,其藥品療效評價受到多種混雜、偏倚因素的干擾,影響研究結果的可信度。因此在進行觀察性研究設計和分析的過程中,核心是控制觀察性研究中偏倚和混雜[13]。
3 RWD用于臨床價值評價研究的設計和分析要點
嚴謹科學的研究設計和統計分析是RWD產生的證據能否支持藥品臨床價值評價的關鍵。在基于RWD的臨床價值評價實施中,研究設計及分析需要重點考慮以下方面。
3.1 研究設計要點
在數據源質量可靠的前提下,總體研究設計的合理性決定了基于RWD的藥品臨床價值證據質量。研究者應首先根據研究問題,選擇試驗性研究設計(干預性研究設計)、觀察性研究設計(非干預性研究設計),或設置單臂外對照。外對照是一種特殊的設計類型,其研究組可以是干預性也可以是非干預性[14]。在確定研究設計后,進一步考慮具體研究設計中的關鍵要素設置。
3.1.1 試驗性研究設計
相對于理想條件下嚴格受控的RCT,pRCT設計主要評估的關鍵要素包括:研究對象、干預措施、對照措施、結局指標、隨訪等(表1)[15,16]。
① 研究對象:研究對象是藥品的臨床實際應用人群,通常為藥品說明書中列出的適應癥患者。納入標準通常較寬泛,可能包含研究疾病的不同階段、分期、類型等,也可能涵蓋不同年齡層、各種生理病理狀態等。
② 干預措施:干預措施應與常規臨床實踐保持較好一致,可根據患者實際情況靈活調整用藥劑量、療程以及合并用藥情況,需對研究中允許的合并用藥等做出必要的限定。
③ 對照措施:對照的選擇要考慮現實臨床實際情況,選用常規治療、標準治療或公認有效的治療措施作為對照,可考慮疊加設計,一般不推薦安慰劑和空白對照。同時對照選擇需根據具體決策需求,例如:若研究目的是將新的藥品納入醫保目錄,則優先選擇醫保目錄中已有的同類常規治療藥品作為對照。
④ 結局指標:結局指標通常選擇對患者具有重要臨床意義的指標,強調以病人為導向的臨床獲益終點結局,如疾病轉歸、功能變化、健康相關生命質量等。
⑤ 隨訪:隨訪時間應根據研究目的及擬評價的結局指標來確定,如評價藥品的遠期臨床價值,隨訪時間應相對較長,且應多時點測量。研究方案中應明確指出試驗中隨訪次數和周期安排,隨訪頻率通常與常規臨床隨訪一致。
3.1.2 觀察性研究設計
觀察性研究設計缺乏隨機化過程,受到真實世界診療環境的高維因素影響,應特別關注藥品臨床價值評價的因果推斷強度,避免虛假關聯。有研究探索將隨機試驗的設計原則應用于觀察性研究,構建基于觀察性數據的目標仿真試驗(target trial emulation,TTE),以提高觀察性研究的因果推薦強度[17]。觀察性研究設計應至少考慮流行病學設計、研究人群的選擇、暴露和對照的選擇、結局的設定及測量、隨訪時間/時間窗的設定和混雜因素選擇等[18,19]。如圖2。
 圖2
真實世界藥品臨床價值評價的觀察性研究設計要點
圖2
真實世界藥品臨床價值評價的觀察性研究設計要點
① 流行病學設計類型:常用于藥品療效評價的觀察性研究設計主要包括隊列研究、病例-對照研究、以及相關衍生設計類型(如巢式病例-對照研究、病例隊列研究、病例交叉研究等研究設計)。不同的研究設計適用場景、優勢和局限不同,研究設計需適配研究問題和數據情況。
② 研究對象確定:應根據研究問題,制定清晰可行的納入排除標準并說明理由,避免選擇性偏倚。推薦使用流程圖或其他方式詳細說明研究對象的納入排除情況。
③ 暴露/對照的選擇:明確定義暴露并選擇合適的對照,是觀察性研究藥品治療效應評價的關鍵環節。在研究條件可行的情況下,可考慮采用首次用藥設計(new user design),即選擇首次使用目標藥物的病例納入研究,并設置陽性對照(active comparison)[20],以更好地控制基線混雜,減少幸存者偏倚和適應癥偏倚[21]。
④ 隨訪時間定義:基于RCD的觀察性研究,研究者通常需要在數據庫中進行回溯,以確定藥品暴露前的患者基線時間,并追溯暴露后的隨訪期結束時間。在定義暴露時間框時應結合藥品藥代動力學特點,充分考慮基線協變量識別時間窗、暴露期(研究對象藥品暴露到引起暴露效應的時間跨度)、誘導期(出現暴露效應至疾病發生的時間跨度)、滯后期(結局事件發生到出現可檢測癥狀或體征的時間間隔)、隨訪期(研究對象因暴露而存在結局事件風險的時間范圍)等關鍵時間點,避免出現因時序誤判引起的因果倒置以及不死時間偏倚等時間相關混雜[18,22]。
⑤ 結局變量的定義和識別:結局指標的定義首先應考慮臨床價值維度,主要包括有效性、安全性、經濟性指標;其次評估數據源中指標的可及性、準確性和完整性,并對變量的準確性進行驗證。應盡可能選擇具有客觀評價標準的指標,盡量避免變量錯分。
⑥ 混雜因素的選擇:觀察性研究的藥品療效評價時,混雜因素的合理選擇是確定藥品暴露和結局間的因果關系的關鍵步驟,應評估所納入協變量是否符合混雜因素標準、納入混雜因素是否全面、測量是否準確等。
3.1.3 外對照設置
在藥品臨床價值評價研究中,RWD可以作為單臂研究外部對照的重要數據來源。基于RWD的外對照設置原則主要包括[23,24]:① 對照藥品建議選擇質優價廉的陽性對照藥品;② 外部對照人群納入排除標準應與試驗/暴露組一致;③ 應明確外部對照組的干預方式、劑量、時長;④ 保證外部對照組研究結局的定義、隨訪時間、測量方法與試驗/暴露組一致,避免信息偏倚;⑤ 作為外部對照的RWD需具備盡可能詳細、量化的協變量信息,應明確可能對對照藥品或結局產生重要影響的因素及其測量方法;⑥ 外對照人群的選擇不應發生明顯的時間偏倚。
3.2 統計分析要點
基于RWD的藥品臨床價值評價,特別是療效評價,往往需制定明確的統計分析計劃,并考慮研究的樣本量是否充分,控制混雜偏倚的方法是否恰當,缺失數據處理及潛在偏倚分析情況等。
3.2.1 統計分析計劃
首先需要事先制定并詳細報告統計分析計劃,統計分析計劃應至少包含研究方案概要、分析原則與策略、樣本量估計、缺失數據處理、主要指標和次要指標的定義與分析方法、亞組或分層分析、敏感性分析等;其次實際分析流程和方法選擇應嚴格遵循統計分析計劃,無論是試驗性研究還是觀察性研究,都應避免以結果為導向的事后分析。
3.2.2 樣本量計算
選擇恰當方法計算研究的樣本量,報告樣本量的計算方法、參數設定和來源,并考慮失訪率和最終納入研究的樣本數量是否達到預設要求。在基于已有數據庫的真實世界研究中,研究可納入多少例樣本量往往取決于數據庫中有多少對象滿足納入排除標準,同時也應考慮可能獲得的陽性事件數,特別是針對長期、罕見的安全性結局。研究者應在研究結束時評估研究的統計效能,特別是在出現陰性結果的情況下。
3.2.3 混雜的控制
在pRCT中,應合理選擇隨機化方法,嚴格執行并全程質控;其次應考慮是否引入隨機后混雜(如合并用藥、不依從等)及相應的處理方法是否合理。
在觀察性研究中,混雜因素可能存在高維、時序的復雜特點,選擇控制混雜因素的統計方法時應首先評估:① 潛在的混雜因素間是否存在共線、交互等作用關系;② 是否存在隨時間變化的時間依賴性混雜;③ 是否存在未觀測混雜,及其對主分析結果的影響。基于不同混雜因素的情況,選擇恰當的統計分析方法。
3.2.4 缺失數據處理
對于缺失數據處理,主要涉及以下步驟[25,26];① 評估缺失情況,包括存在缺失的變量、缺失比例以及缺失機制;② 根據變量的缺失機制(完全隨機、隨機、非隨機)選擇合適的填補方式;③ 評估缺失影響,例如采用不同的缺失處理方法進行敏感性分析,評估結果可靠性。
3.2.5 潛在偏倚分析
研究者應全面分析整個研究過程中可能引入的潛在偏倚,并通過多種敏感性分析或定量偏倚等方式探查偏倚對結果的影響。當敏感性分析結果不穩健時,需合理解釋原因。
綜上所述,利用RWD能較好提供在實際臨床環境下藥品使用人群的臨床需求、有效性以及安全性證據,是支持藥品臨床價值多個維度評價的重要數據來源。然而,采用RWD支持藥品臨床價值評價仍處于探索階段。本技術規范探討了RWD用于藥品臨床價值評價的適用范圍和關鍵考慮,RWD研究的設計和分析方法原則,以期促進RWD合理、規范用于藥品多維臨床價值評價。
致謝 本研究得到醫保部門、國內外學術專家的大力支持,特此致謝(按姓氏筆畫排序):丁錦希、王麗、毛振賓、朱永峰、劉夢娜、孫強、李順平、楊莉、吳久鴻、應亞珍、張弛、陳昊、胡明、袁妮、賈寧、董恒進、蔣亞文、蔣杰、曾渝、謝鋒、瞿佳