引用本文: 黃濤, 李燦, 黃先琴, 李黃倩玉, 吳晶, 毛宗福, 史錄文, 管曉東. 真實世界數據用于藥品醫保決策的國內外政策分析. 中國循證醫學雜志, 2024, 24(5): 510-515. doi: 10.7507/1672-2531.202401104 復制
版權信息: ?四川大學華西醫院華西期刊社《中國循證醫學雜志》版權所有,未經授權不得轉載、改編
真實世界數據(real-world data,RWD)指來源于日常所收集的各種與患者健康狀況和診療有關的數據,真實世界證據(real-world evidence,RWE)指通過對適用的RWD進行恰當和充分的分析所獲得的關于藥物的使用情況和潛在獲益風險的臨床證據,包括通過觀察性研究或實效性隨機對照試驗(pragmatic randomized controlled trial,PCT)獲得的證據[1,2]。作為傳統隨機對照試驗(randomized controlled trial,RCT)的有效補充,RWE被廣泛用于衛生技術評估(health technology assessment,HTA)等領域[3,4],逐漸成為藥品監管決策證據體系的組成部分[5]。
相比于傳統RCT,RWE在研究人群、診療過程、給藥方式等方面更具有代表性和接近臨床實踐[1],在評估藥品經濟性和預算影響分析方面有著不可或缺的作用。隨著經單臂臨床試驗和替代終點加速審批的藥品逐漸增加[6]、國家醫保目錄調整和醫保談判逐步常規化[7],RWE在醫保準入領域的重要性愈發凸顯。然而,目前我國將RWD/RWE用于醫保準入領域的政策指引和指南仍然空缺,如何將RWE用于醫保準入等問題尚未確定。
為此,本研究擬通過分析國內外主要藥品監管機構已發布的有關RWD/RWE用于醫保準入的政策法規、指導原則及文獻綜述,梳理RWD/RWE用于醫保準入的適用條件及流程,為我國開展支持藥品醫保準入的真實世界研究(real-world study,RWS),完善相關數據及標準體系建設提供參考與借鑒。
1 方法
計算機檢索英國國家衛生與臨床優化研究所(National Institute for Health and Care Excellence,NICE)、美國臨床和經濟評論研究所(Institute for Clinical & Economic Review,ICER)等國內外主要藥品監管機構和HTA機構網站(表1),以及CNKI、VIP、WangFang Data和PubMed數據庫,搜集有關RWE用于醫保準入的文獻資料,系統梳理國內外監管機構RWD/RWE用于醫保準入的適用條件、應用范圍、框架指南和報銷模式。中文檢索詞包括:真實世界數據、真實世界證據、醫保準入、風險分擔、按效果付費等;英文檢索詞包括:real-world、risk sharing、reimburse*、cover*、insurance、outcome based等。
2 結果
2.1 RWE在醫保準入中的使用現狀
Makady等[4]研究顯示,2011—2016年英國、法國、德國、荷蘭4個國家HTA機構的52份報告中,所有報告均涉及相對有效性評價(relative effectiveness assessment,REA),25份報告涉及成本-效果評價(cost-effectiveness assessment,CEA)。REA報告中接受RWD的比例為54%;CEA報告中接受RWD的比例為88%。Bullement等[8]分析英國NICE的113個癌癥藥物審評報告后發現,108個藥物在CEA中使用了RWE。已使用的RWD中,71%為健康效用相關數據,46%為成本數據,40%為醫療服務利用數據。
通過對22個國家和地區的HTA機構有關RWD使用的相關政策進行梳理發現,RWD和RWE已經被廣泛應用于HTA的藥品有效性和安全性評估中[3,4,9,10]。蘇格蘭(SMC)、澳大利亞(PBAC)、澳大利亞(TGA)和加拿大(CADTH)等國家設置了RWD使用相關條件,要求在RCT不適宜或不符合倫理要求、缺少陽性對照RCT、無法從RCT獲得直接或間接證據等情況下才接受非隨機試驗作為證據[3,11-13]。此外,多數國家都將觀察性研究和上市后藥物安全性監測數據作為評價藥品安全性的補充證據(表2)。亞洲的11個國家和地區中有7個接受和鼓勵開展PCT[9]。
2.2 開展用于醫保準入的RWS的指南和框架
包括英國、加拿大、德國、法國、美國在內的國家HTA機構,已經發布了RWS指南和框架(表3)[14-18],明確了RWS適用藥物種類、如何開展用于醫保決策的RWS和使用RWD的流程。如英國NICE制定了RWE框架用以明確RWE應在何時使用和如何被使用,以及規范RWS的計劃、開展和報告[14]。
此外,由于RWD的質量參差不齊,能夠用于監管決策的RWE較少,限制了其應用和發展[19]。為規范RWD治理、提升RWE質量,國內外藥品監管機構近年來陸續發布RWS指南或指導原則。美國食品藥品監督管理局(Food and Drug Administration,FDA)在2017—2019年先后發布《使用RWE支持醫療器械監管決策》[20]《臨床研究中使用電子健康檔案數據指南》[21]《RWE計劃框架》[22]和《使用RWD和RWE向FDA遞交藥物和生物制品資料》[23]等多部指南。2020年3月,歐洲藥品管理局(European Medicines Agency,EMA)發起“科學監管策略2025”計劃,將高質量RWD作為首要任務之一[24],并于2021年10月發布《將注冊登記研究用于監管決策的指南》[25]。日本藥品和醫療器械管理局(Pharmaceuticals and Medical Devices Agency,PMDA)于2021年發布《應用注冊登記數據的基本原則》[26]和《確保應用注冊登記數據可靠性需要考慮的要點》[27]。中國藥品監督管理局則自2020年開始,相繼發布《真實世界證據支持藥物研發與審評的指導原則》[28]和《真實世界數據用于醫療器械臨床評價技術指導原則》[29]。
2.3 RWE用于醫保準入的模式
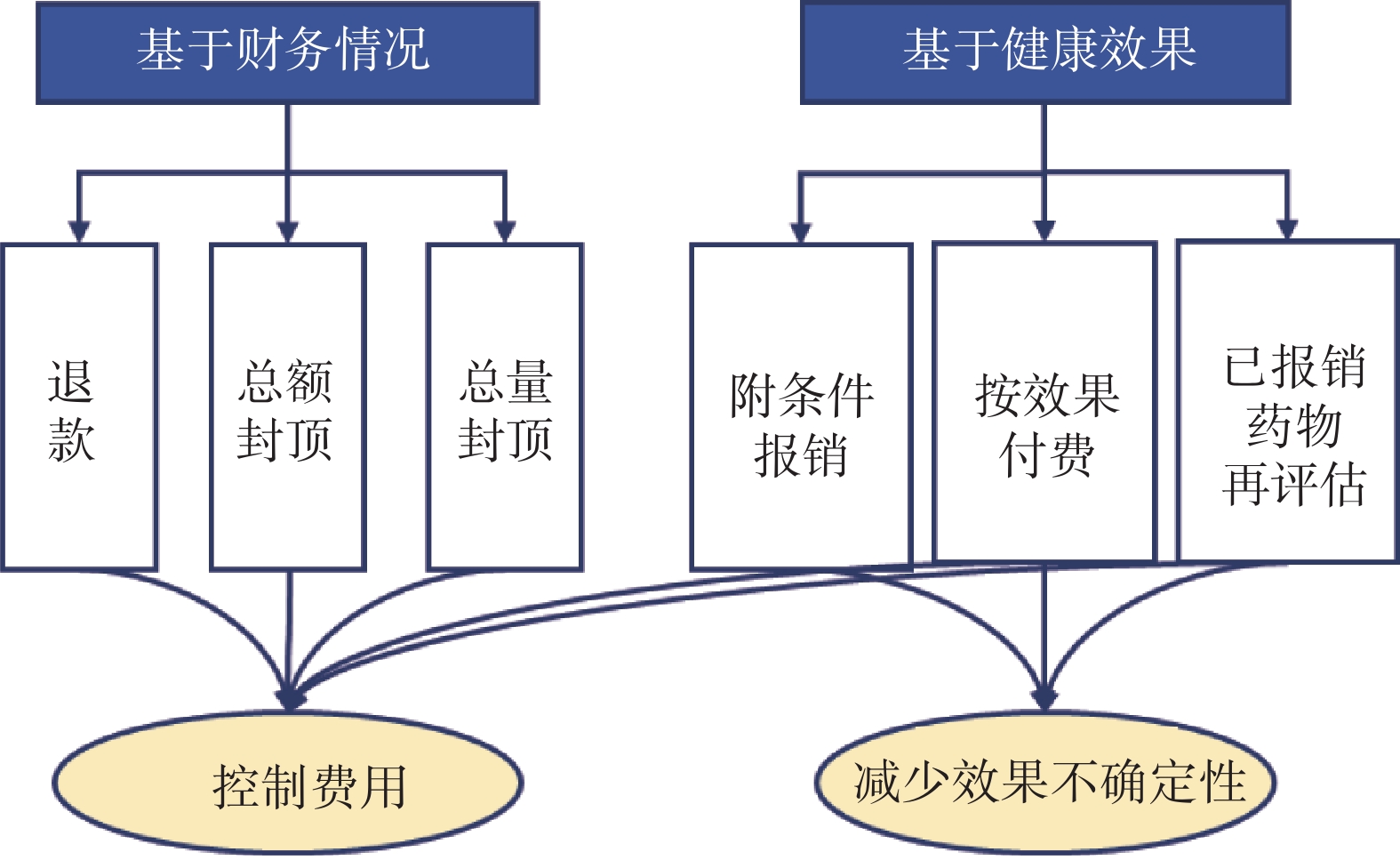
目前RWE用于醫保準入的模式主要分為兩大類(圖1)。第一大類為基于健康效果的醫保準入協議,包括附條件報銷、按效果付費和已報銷藥物的再評估,其目的主要是為了減少藥品臨床效果的不確定性。第二大類為基于財務情況的醫保準入協議,主要方式包括退款、總額封頂和總量封頂,其目的是為了控制醫保花費。
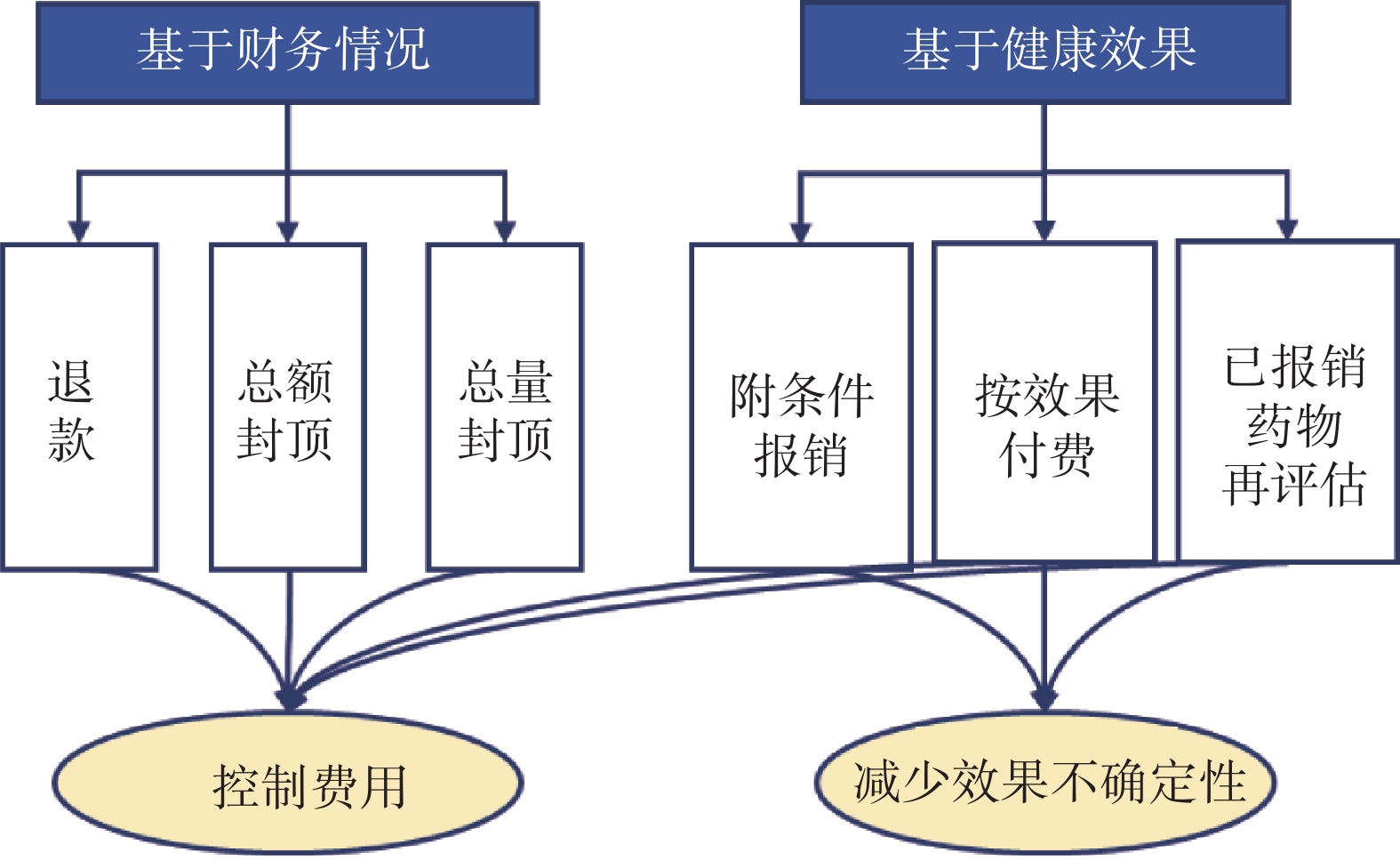 圖1
真實世界證據用于醫保準入的兩類模式
圖1
真實世界證據用于醫保準入的兩類模式
將基于健康效果的醫保準入協議按RWE的使用模式可以分為三類模式:① 附條件報銷:主要流程為基于初步得到的尚不成熟的藥品療效安全或經濟性結果,將藥品納入醫保報銷范圍,在一定時間內進一步收集RWD和RWE后,對藥品療效安全和經濟性進行重新評估,并最終決定是否將藥品納入醫保。目的在于促進可能具有重要臨床價值的藥品快速可及的同時,減少藥品療效安全的不確定性。該模式在英國、法國、美國等國家已廣泛開展[30-32],如英國的癌癥藥物基金計劃(cancer drug fund,CDF)、法國的早期使用授權計劃(early access authorization,AAP)和美國基于證據發展的報銷計劃(coverage with evidence development,CED)。② 按效果付費(outcome-based contract):根據使用藥品的患者臨床結局進行報銷或支付,其主要在美國等國家應用[33],如2016年美國醫保公司Harvard Pilgrim和藥企諾華就沙庫巴曲纈沙坦達成協議,如果患者住院減少率不能達到RCT的結果,諾華需接受較低的藥品凈價[33]。該模式的主要目的是在減少藥品療效不確定性的同時,對醫保費用進行控制。③ 已報銷藥品的再評價(re-assessment):其對已經正式納入醫保的藥品的臨床效果和成本進行再評估,以進一步減少藥品不確定性和控制醫保費用。加拿大CADTH等機構于2017年成立了加拿大癌癥藥物價值的真實證據合作計劃(Canadian real-world evidence for value in cancer drugs collaboration,CanREValue)[34],旨在開發癌癥藥物醫保基金決策中RWE的生成和使用框架,促進癌癥藥物的再評估與藥品資助決策的完善(重新談判藥品價格或剔除醫保)。RWE用于醫保準入的三類模式見表4。
3 我國RWD用于醫保準入的建議
3.1 對于醫保談判藥品,開展基于RWD的療效安全研究作為再準入決策工具
隨著經單臂臨床試驗和替代終點加速審批的藥品逐漸增加、國家醫保目錄調整和醫保談判逐步常規化,RWE在醫保準入領域的重要性愈發凸顯。自2018年以來,國家醫保藥品目錄調整周期從原來的最長八年縮短至每年一次,部分藥品甚至上市當年就被納入醫保目錄。然而,新藥由于上市時間短、經單臂臨床試驗和替代終點加速上市審批等原因,其有效性和安全性尚未完全得以驗證,有必要在其準入后對用藥安全性、有效性開展RWS,以確保醫保支付的經濟性。為實現上述目的,可以借鑒加拿大CanREValue[15],成立規劃和藥物選擇、數據收集、方法開發、藥物再評估、參與方協調等工作組,探索建立適用于我國醫藥體系的醫保藥品RWS數據標準規范、方法指南、路徑流程和工作機制。
3.2 療效不確切但臨床急需、具有重大創新性的藥品,通過風險分擔協議進入醫保
基于單臂臨床試驗證據進行附條件批準上市,無法在上市前完整收集與參照藥品頭對頭的系統性臨床研究數據,導致療效和安全性的對比數據不足,使得藥品在準入醫保目錄時存在不確定性[35]。然而此類藥品通常為臨床急需、具有重大創新性的藥品,如罕見病藥物、兒童藥品等。為降低醫保決策風險,建議參考英國CDF和法國AAP[30,31],構建附條件報銷的醫保準入模式。對于擬納入醫保但現有數據仍存在不確定性的臨床急需藥物,采取臨時納入醫保,于規定時間內收集RWD后再評估的方式進行報銷。藥企需承諾在規定期限內按照要求完成相關研究以降低藥品初始準入時的不確定性,否則需返還醫保已支付的花費。
3.3 完善數據收集標準和體系,提高RWE質量
當前國內外醫保監管部門和HTA機構都支持在藥品醫保準入過程中應用RWD和RDE。然而,從RWD到RWE,需要更為完善科學的數據收集標準和體系、嚴格的研究設計和方法。否則,由于樣本人群納排存在偏倚、數據缺失和未能控制混雜等問題,基于真實臨床診療實踐所收集到的數據并不能作評價藥品經濟性的可靠證據[1]。中國現有臨床診療數據、醫保數據、死亡登記數據和慢病監測數據等并不互通,并不利于開展大樣本、長期隨訪的RWS[36]。為提高RWS的質量,應盡力連通各種臨床數據資源,開展數據有效性驗證,統一數據規范和標準。參考英國NICE等出臺相應的指導原則和指南[13,14,17,37],在構建RWD標準和體系時,考慮數據質量和有效性、可靠性、適宜性、完整性、透明度、推廣能力、及時性和可擴展性等方面。
4 結論
當前國內外RWD用于醫保準入的經驗已較為豐富,相比于傳統的RCT,RWD在描述診療過程、測算疾病負擔、評估藥物真實臨床中的安全有效性等方面有著不可或缺的作用。同時,隨著經單臂臨床試驗和替代終點加速審批的藥品逐漸增加、國家醫保目錄調整和醫保談判逐步常規化,RWE在醫保準入領域的重要性愈發凸顯。相比于英美等國家,我國仍需要進一步完善RWD標準和體系,制定RWD和RWE用于藥物醫保準入流程和規范,以適應更快更高質量的醫藥產業發展和滿足臨床患者需求。
致謝 本研究得到醫保部門、國內外學術專家的大力支持,特此致謝(按姓氏筆畫排序):丁錦希、王麗、毛振賓、朱永峰、劉夢娜、孫強、李順平、楊莉、吳久鴻、應亞珍、張弛、陳昊、胡明、袁妮、賈寧、董恒進、蔣亞文、蔣杰、曾渝、謝鋒、瞿佳。
真實世界數據(real-world data,RWD)指來源于日常所收集的各種與患者健康狀況和診療有關的數據,真實世界證據(real-world evidence,RWE)指通過對適用的RWD進行恰當和充分的分析所獲得的關于藥物的使用情況和潛在獲益風險的臨床證據,包括通過觀察性研究或實效性隨機對照試驗(pragmatic randomized controlled trial,PCT)獲得的證據[1,2]。作為傳統隨機對照試驗(randomized controlled trial,RCT)的有效補充,RWE被廣泛用于衛生技術評估(health technology assessment,HTA)等領域[3,4],逐漸成為藥品監管決策證據體系的組成部分[5]。
相比于傳統RCT,RWE在研究人群、診療過程、給藥方式等方面更具有代表性和接近臨床實踐[1],在評估藥品經濟性和預算影響分析方面有著不可或缺的作用。隨著經單臂臨床試驗和替代終點加速審批的藥品逐漸增加[6]、國家醫保目錄調整和醫保談判逐步常規化[7],RWE在醫保準入領域的重要性愈發凸顯。然而,目前我國將RWD/RWE用于醫保準入領域的政策指引和指南仍然空缺,如何將RWE用于醫保準入等問題尚未確定。
為此,本研究擬通過分析國內外主要藥品監管機構已發布的有關RWD/RWE用于醫保準入的政策法規、指導原則及文獻綜述,梳理RWD/RWE用于醫保準入的適用條件及流程,為我國開展支持藥品醫保準入的真實世界研究(real-world study,RWS),完善相關數據及標準體系建設提供參考與借鑒。
1 方法
計算機檢索英國國家衛生與臨床優化研究所(National Institute for Health and Care Excellence,NICE)、美國臨床和經濟評論研究所(Institute for Clinical & Economic Review,ICER)等國內外主要藥品監管機構和HTA機構網站(表1),以及CNKI、VIP、WangFang Data和PubMed數據庫,搜集有關RWE用于醫保準入的文獻資料,系統梳理國內外監管機構RWD/RWE用于醫保準入的適用條件、應用范圍、框架指南和報銷模式。中文檢索詞包括:真實世界數據、真實世界證據、醫保準入、風險分擔、按效果付費等;英文檢索詞包括:real-world、risk sharing、reimburse*、cover*、insurance、outcome based等。
2 結果
2.1 RWE在醫保準入中的使用現狀
Makady等[4]研究顯示,2011—2016年英國、法國、德國、荷蘭4個國家HTA機構的52份報告中,所有報告均涉及相對有效性評價(relative effectiveness assessment,REA),25份報告涉及成本-效果評價(cost-effectiveness assessment,CEA)。REA報告中接受RWD的比例為54%;CEA報告中接受RWD的比例為88%。Bullement等[8]分析英國NICE的113個癌癥藥物審評報告后發現,108個藥物在CEA中使用了RWE。已使用的RWD中,71%為健康效用相關數據,46%為成本數據,40%為醫療服務利用數據。
通過對22個國家和地區的HTA機構有關RWD使用的相關政策進行梳理發現,RWD和RWE已經被廣泛應用于HTA的藥品有效性和安全性評估中[3,4,9,10]。蘇格蘭(SMC)、澳大利亞(PBAC)、澳大利亞(TGA)和加拿大(CADTH)等國家設置了RWD使用相關條件,要求在RCT不適宜或不符合倫理要求、缺少陽性對照RCT、無法從RCT獲得直接或間接證據等情況下才接受非隨機試驗作為證據[3,11-13]。此外,多數國家都將觀察性研究和上市后藥物安全性監測數據作為評價藥品安全性的補充證據(表2)。亞洲的11個國家和地區中有7個接受和鼓勵開展PCT[9]。
2.2 開展用于醫保準入的RWS的指南和框架
包括英國、加拿大、德國、法國、美國在內的國家HTA機構,已經發布了RWS指南和框架(表3)[14-18],明確了RWS適用藥物種類、如何開展用于醫保決策的RWS和使用RWD的流程。如英國NICE制定了RWE框架用以明確RWE應在何時使用和如何被使用,以及規范RWS的計劃、開展和報告[14]。
此外,由于RWD的質量參差不齊,能夠用于監管決策的RWE較少,限制了其應用和發展[19]。為規范RWD治理、提升RWE質量,國內外藥品監管機構近年來陸續發布RWS指南或指導原則。美國食品藥品監督管理局(Food and Drug Administration,FDA)在2017—2019年先后發布《使用RWE支持醫療器械監管決策》[20]《臨床研究中使用電子健康檔案數據指南》[21]《RWE計劃框架》[22]和《使用RWD和RWE向FDA遞交藥物和生物制品資料》[23]等多部指南。2020年3月,歐洲藥品管理局(European Medicines Agency,EMA)發起“科學監管策略2025”計劃,將高質量RWD作為首要任務之一[24],并于2021年10月發布《將注冊登記研究用于監管決策的指南》[25]。日本藥品和醫療器械管理局(Pharmaceuticals and Medical Devices Agency,PMDA)于2021年發布《應用注冊登記數據的基本原則》[26]和《確保應用注冊登記數據可靠性需要考慮的要點》[27]。中國藥品監督管理局則自2020年開始,相繼發布《真實世界證據支持藥物研發與審評的指導原則》[28]和《真實世界數據用于醫療器械臨床評價技術指導原則》[29]。
2.3 RWE用于醫保準入的模式
目前RWE用于醫保準入的模式主要分為兩大類(圖1)。第一大類為基于健康效果的醫保準入協議,包括附條件報銷、按效果付費和已報銷藥物的再評估,其目的主要是為了減少藥品臨床效果的不確定性。第二大類為基于財務情況的醫保準入協議,主要方式包括退款、總額封頂和總量封頂,其目的是為了控制醫保花費。
 圖1
真實世界證據用于醫保準入的兩類模式
圖1
真實世界證據用于醫保準入的兩類模式
將基于健康效果的醫保準入協議按RWE的使用模式可以分為三類模式:① 附條件報銷:主要流程為基于初步得到的尚不成熟的藥品療效安全或經濟性結果,將藥品納入醫保報銷范圍,在一定時間內進一步收集RWD和RWE后,對藥品療效安全和經濟性進行重新評估,并最終決定是否將藥品納入醫保。目的在于促進可能具有重要臨床價值的藥品快速可及的同時,減少藥品療效安全的不確定性。該模式在英國、法國、美國等國家已廣泛開展[30-32],如英國的癌癥藥物基金計劃(cancer drug fund,CDF)、法國的早期使用授權計劃(early access authorization,AAP)和美國基于證據發展的報銷計劃(coverage with evidence development,CED)。② 按效果付費(outcome-based contract):根據使用藥品的患者臨床結局進行報銷或支付,其主要在美國等國家應用[33],如2016年美國醫保公司Harvard Pilgrim和藥企諾華就沙庫巴曲纈沙坦達成協議,如果患者住院減少率不能達到RCT的結果,諾華需接受較低的藥品凈價[33]。該模式的主要目的是在減少藥品療效不確定性的同時,對醫保費用進行控制。③ 已報銷藥品的再評價(re-assessment):其對已經正式納入醫保的藥品的臨床效果和成本進行再評估,以進一步減少藥品不確定性和控制醫保費用。加拿大CADTH等機構于2017年成立了加拿大癌癥藥物價值的真實證據合作計劃(Canadian real-world evidence for value in cancer drugs collaboration,CanREValue)[34],旨在開發癌癥藥物醫保基金決策中RWE的生成和使用框架,促進癌癥藥物的再評估與藥品資助決策的完善(重新談判藥品價格或剔除醫保)。RWE用于醫保準入的三類模式見表4。
3 我國RWD用于醫保準入的建議
3.1 對于醫保談判藥品,開展基于RWD的療效安全研究作為再準入決策工具
隨著經單臂臨床試驗和替代終點加速審批的藥品逐漸增加、國家醫保目錄調整和醫保談判逐步常規化,RWE在醫保準入領域的重要性愈發凸顯。自2018年以來,國家醫保藥品目錄調整周期從原來的最長八年縮短至每年一次,部分藥品甚至上市當年就被納入醫保目錄。然而,新藥由于上市時間短、經單臂臨床試驗和替代終點加速上市審批等原因,其有效性和安全性尚未完全得以驗證,有必要在其準入后對用藥安全性、有效性開展RWS,以確保醫保支付的經濟性。為實現上述目的,可以借鑒加拿大CanREValue[15],成立規劃和藥物選擇、數據收集、方法開發、藥物再評估、參與方協調等工作組,探索建立適用于我國醫藥體系的醫保藥品RWS數據標準規范、方法指南、路徑流程和工作機制。
3.2 療效不確切但臨床急需、具有重大創新性的藥品,通過風險分擔協議進入醫保
基于單臂臨床試驗證據進行附條件批準上市,無法在上市前完整收集與參照藥品頭對頭的系統性臨床研究數據,導致療效和安全性的對比數據不足,使得藥品在準入醫保目錄時存在不確定性[35]。然而此類藥品通常為臨床急需、具有重大創新性的藥品,如罕見病藥物、兒童藥品等。為降低醫保決策風險,建議參考英國CDF和法國AAP[30,31],構建附條件報銷的醫保準入模式。對于擬納入醫保但現有數據仍存在不確定性的臨床急需藥物,采取臨時納入醫保,于規定時間內收集RWD后再評估的方式進行報銷。藥企需承諾在規定期限內按照要求完成相關研究以降低藥品初始準入時的不確定性,否則需返還醫保已支付的花費。
3.3 完善數據收集標準和體系,提高RWE質量
當前國內外醫保監管部門和HTA機構都支持在藥品醫保準入過程中應用RWD和RDE。然而,從RWD到RWE,需要更為完善科學的數據收集標準和體系、嚴格的研究設計和方法。否則,由于樣本人群納排存在偏倚、數據缺失和未能控制混雜等問題,基于真實臨床診療實踐所收集到的數據并不能作評價藥品經濟性的可靠證據[1]。中國現有臨床診療數據、醫保數據、死亡登記數據和慢病監測數據等并不互通,并不利于開展大樣本、長期隨訪的RWS[36]。為提高RWS的質量,應盡力連通各種臨床數據資源,開展數據有效性驗證,統一數據規范和標準。參考英國NICE等出臺相應的指導原則和指南[13,14,17,37],在構建RWD標準和體系時,考慮數據質量和有效性、可靠性、適宜性、完整性、透明度、推廣能力、及時性和可擴展性等方面。
4 結論
當前國內外RWD用于醫保準入的經驗已較為豐富,相比于傳統的RCT,RWD在描述診療過程、測算疾病負擔、評估藥物真實臨床中的安全有效性等方面有著不可或缺的作用。同時,隨著經單臂臨床試驗和替代終點加速審批的藥品逐漸增加、國家醫保目錄調整和醫保談判逐步常規化,RWE在醫保準入領域的重要性愈發凸顯。相比于英美等國家,我國仍需要進一步完善RWD標準和體系,制定RWD和RWE用于藥物醫保準入流程和規范,以適應更快更高質量的醫藥產業發展和滿足臨床患者需求。
致謝 本研究得到醫保部門、國內外學術專家的大力支持,特此致謝(按姓氏筆畫排序):丁錦希、王麗、毛振賓、朱永峰、劉夢娜、孫強、李順平、楊莉、吳久鴻、應亞珍、張弛、陳昊、胡明、袁妮、賈寧、董恒進、蔣亞文、蔣杰、曾渝、謝鋒、瞿佳。